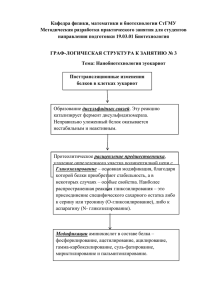
1. Диссертация Родионова М. В. - Российский онкологический
реклама

Федеральное государственное бюджетное учреждение «Российский онкологический научный центр имени Н.Н. Блохина» Министерства здравоохранения Российской Федерации На правах рукописи РОДИОНОВА МАРИЯ ВАЛЕРЬЕВНА ЭКСПРЕССИЯ И КОЭКСПРЕССИЯ ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ α И β В ТКАНИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И ЭФФЕКТИВНОСТЬ ЭНДОКРИНОТЕРАПИИ 14.01.12 онкология Диссертация на соискание учёной степени кандидата медицинских наук Научные руководители: Доктор медицинских наук, профессор Игорь Константинович Воротников Доктор биологических наук, профессор Татьяна Анатольевна Богуш Москва — 2015 1 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ............................................................................................................. 4 ГЛАВА 1. Обзор литературы ............................................................................ 10 1.1. Сравнительная характеристика эстрогеновых рецепторов: строение, функциональная активность ............................................................................. 10 1.2. Эстрогеновые рецепторы β и их корреляция с клиникоморфологическими параметрами ..................................................................... 13 1.3. Эстрогеновые рецепторы β и их предиктивная роль в терапии больных раком молочной железы .................................................................................... 14 1.4. Роль неоадъювантных клинических исследований в оценке чувствительности опухоли к системной терапии ........................................... 19 1.5. Предиктивная и прогностическая роль динамического мониторинга биологических маркеров в оценке гормоночувствительности опухоли ...... 21 1.6. Ki67 как маркер первичной и приобретенной резистентности .............. 27 ГЛАВА 2 ................................................................................................................ 32 2.1. Материал исследования .............................................................................. 32 2.2. Методы исследования................................................................................. 45 2.2.1. Морфологическое исследование опухолевой ткани молочной железы .............................................................................................................. 45 2.2.2. Иммуногистохимическое исследование рецепторов ........................ 47 2.2.3. Определение уровня экспрессии ЭРα и ЭРβ методом проточной цитофлоурометрии .......................................................................................... 51 2.2.4. Статистическая обработка полученных данных ................................ 54 ГЛАВА 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ............ 56 3.1. Экспрессия ЭРα и ЭРβ в ткани рака молочной железы и взаимосвязь их экспрессии с клиническими параметрами и морфологическими характеристиками опухоли ............................................................................... 56 3.2. Оценка предикивной значимости экспрессии рецепторов стероидных гормонов в модели двухнедельного теста на гормоночувствительность .... 71 3.2.1.Динамика изменения индекса пролиферации Ki67 относительно исходного уровня в предоперационной тестовой модели по определению чувствительности опухоли к гормонотерапии ................................................ 72 2 3.2.2. Динамика изменения индекса пролиферации Ki67 в группах различного биологического подтипа ............................................................... 82 3.2.3. Степень лечебного патоморфоза в предоперационной тестовой модели по определению чувствительности опухоли к гормонотерапии ..... 86 3.2.4. Динамика изменения уровня экспрессии рецепторов эстрогена и прогестерона в процессе гормонотерапии ...................................................... 92 3.2.4.1 Динамика изменения уровней экспрессии ЭРα и ЭРβ, определяемых методом ПЦФ ........................................................................ 92 3.2.4.2 Динамика изменения уровней экспрессии ЭР и ПР, определяемых методом ИГХ ................................................................................................... 95 3.2.5. Прогностическая номограмма PEPI SCORE в группах люминального А и люминального В Her2-негативного подтипов предоперационной тестовой модели ............................................................................................... 103 3.3. Конкордантность количественных показателей экспрессии ЭРα, полученных при количественной иммунофлуоресцентной оценке методом ПЦФ, с данными ИГХ исследования ............................................................. 106 ГЛАВА 4 .............................................................................................................. 110 ВЫВОДЫ ............................................................................................................ 121 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ........................................................ 122 СПИСОК СОКРАЩЕНИЙ ............................................................................. 123 СПИСОК ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА ................................... 125 СПИСОК ЛИТЕРАТУРЫ ............................................................................... 130 3 ВВЕДЕНИЕ Актуальность проблемы Рак молочной железы (РМЖ) занимает первое место среди всех злокачественных заболеваний у женщин. Прирост стандартизованного показателя заболеваемости РМЖ в России за последние 10 лет составил 19,94% (Давыдов М.И., Аксель Е.М., 2014). В динамике с 2009 по 2012 гг. абсолютное число умерших от РМЖ снизилось на 2,5% с 23517 до 22936. С одной стороны, это связано с ранней диагностикой, с другой – с улучшением качества лечения. Речь в первую очередь идет о системных методах лечения, ведущим среди которых является гормонотерапия. Эстрогеновые рецепторы (ЭР) являются важнейшей клеточной мишенью, воздействуя на которую, можно подавлять рост опухолевых клеток. Эстрогены реализует свое биологическое действие путем присоединения к рецепторам эстрогеновых рецепторов (α и β). Долгие годы экспрессия опухолевыми клетками ЭРα (изолированно, или в сочетании с рецепторами прогестерона (ПР)), определяемая иммуногистохимическим методом (ИГХ), использовалась как критерий для назначения гормонотерапии. В ткани РМЖ ЭР выявляются у 70-80% больных, однако только у 40-80% пациенток гормонотерапия обеспечивает длительный контроль над заболеванием, в случае же распространенных стадий опухолевого процесса, первичная резистентность диагностируется в 50% случаев уже на первой линии гормонотерапии (Garcia-Becerra и соавт., 2013). Следовательно, требуются дополнительные предиктивные маркеры клинического ответа на гормонотерапию. С другой стороны, около 10% пациенток больных рецептор-негативным раком молочной железы отвечают на гормонотерапию (Osborne и соавт., 1998). Было высказано предположение, что ответ на гормонотерапию у данных пациенток может быть обусловлен технической ошибкой и ложноотрицательным ответом или возможным ЭРнезависимым действием тамоксифена (Clarke и соавт., 2001). 4 Однако с открытием селективных эстрогеновых рецепторов было показано, что более 50% опухолей, ранее классифицируемых как рецепторнегативные, экспрессируют ЭРβ (Murphy и соавт., 2003). Было высказано предположение, что именно изолированная экспрессия ЭРβ может обусловливать гормоночувствительность опухолей с условно отрицательным статусом ЭР. В настоящее время не вызывает сомнения, что важнейшим моментом при оценке прогностической и предиктивной роли любого опухолевого маркёра и мишени таргетных препаратов является их количественная характеристика, а не констатация наличия в клетке. Это в полной мере относится и к ЭР. Для определения уровня экспрессии ЭР традиционно применяется полуколичественный метод ИГХ. Использование селективных моноклональных антител позволяет с высокой точностью установить наличие ЭР в исследуемой ткани. Однако, осуществляемая визуально оценка доли клеток, содержащих рецепторы, а тем более интенсивности их экспрессии в клетке, является полуколичественной. Безусловным шагом вперёд явился разработанный в ФГБНУ «РОНЦ им. Н.Н. Блохина» и запатентованный метод иммунофлуоресцентного анализа с привлечением проточной цитофлуориметрии количественно оценивать (ПЦФ). уровень Метод экспрессии позволяет разных строго типов ЭР, минимизируя субъективный фактор оценки. Двухнедельный предоперационный тест на гормоночувствительность позволяет быстро и достоверно выявлять первичные гормон-резистентные опухоли, а также механизмы, обуславливающие гормоночувствительность. Таким образом, представляется актуальным изучение уровня экспрессии ЭРα и ЭРβ количественным методом и оценка предиктивной значимости этих рецепторов в предоперационной тестовой модели. 5 Цель исследования: Количественно определить уровень экспрессии и коэкспрессии эстрогеновых рецепторов α и β в ткани рака молочной железы для оптимизации методов их оценки и уточнения предиктивной значимости при гормонотерапии рака молочной железы в модели двухнедельного теста на гормоночувствительность. Задачи исследования: 1. Количественно охарактеризовать частоту и уровень экспрессии и коэкспрессии ЭРα и ЭРβ в опухолевой ткани в популяции больных раком молочной железы. 2. Провести анализ корреляции уровней экспрессии ЭРα и ЭРβ с клиническими параметрами и морфологическими характеристиками опухоли. 3. Оценить конкордантность показателей экспрессии ЭРα, полученных при количественной иммунофлуоресцентной оценке с привлечением проточной цитофлуорметрии, с данными иммуногистохимического исследования. 4. Оценить предиктивную значимость экспрессии рецепторов стероидных гормонов и динамики их изменения в модели двухнедельной предоперационной гормонотерапии. Основные положения, выносимые на защиту 1. Иммунофлуоресцентный цитофлуориметрией, анализ, является ассоциированный с высокоинформативным проточной методом количественной молекулярной диагностики статуса рака молочной железы по экспрессии и коэкспрессии ЭРα и ЭРβ. 2. Уровень экспрессии ЭРα статистически значимо коррелирует с возрастом пациенток, уровнем Ki-67 и с гистологическим вариантом 6 опухоли. Корреляции экспрессии ЭРβ с клинико-морфологическими параметрами заболевания не выявлено. 3. Методы ПЦФ и ИГХ в целом обладают удовлетворительной конкордатностью в определении статуса ЭР. 4. Показателями, с высокой степенью достоверности предсказывающими гормоночувствительность опухоли являются: высокая экспрессия ЭРα по данным ПЦФ и ИГХ; исходно низкий уровень Ki67; низкая степень злокачественности; повышение уровня экспрессии ЭРα (ПЦФ) в процессе гормонотерапии; снижение интенсивности экспрессии ЭРα (ИГХ) в процессе гормонотерапии. 5. ЭРα, в отличие от ЭРβ, обладают наибольшей предиктивной значимостью в опухолевом ответе на предоперационную гормонотерапию. Научная новизна Впервые на статистически репрезентативном материале (113 биоптатов опухолевой ткани больных РМЖ), используя новый иммунофлуоресцентный метод с привлечением проточной цитофлуориметрии, проведена строго количественная оценка частоты и уровня экспрессии эстрогеновых рецепторов разных типов – α и β. Сформулированы рекомендации для проведения, наряду количественной, с иммуногистохимическим дифференцированной исследованием, иммунофлуоресцентной оценки статуса ЭРα и ЭРβ методом ПЦФ. Впервые показана конкордантность количественных показателей экспрессии ЭРα, полученных при количественной иммунофлуоресцентной оценке, с данными ИГХ исследования. Проведен анализ корреляции уровня экспрессии и коэкспрессии ЭРα и ЭРβ с клиническими, морфологическими и биологическими характеристиками опухолевого процесса (возраст пациентов и стадия 7 заболевания, гистологический вариант и степень злокачественности опухоли, уровень экспрессии Her-2 и Ki67 в опухоли). Впервые в рамках двухнедельной предоперационной гормональной терапии показана высокая предиктивная значимость количественных показателей экспрессии ЭРα и ЭРβ, превышающая предиктивную значимость полуколичественной оценки ЭР методом ИГХ. На основании проведенного исследования обоснована необходимость рутинного проведения теста на гормоночувствительность в группах люминального А и люминального В Her2-негативного подтипов с целью проведения персонифицированной адъювантной системной терапии. Практическая и теоретическая значимость работы Результаты проведенного исследования позволяют оптимизировать персонифицированный подход к гормонотерапии рака молочной железы. Полученные данные доказывают необходимость дальнейшего совершенствования методов оценки рецепторного статуса опухоли, сдвигая приоритеты в сторону строгой количественной оценки статуса рецепторов стероидных гормонов. Использованная автором предоперационная тестовая модель для определения гормоночувствительности опухоли, c привлечением проточной цитофлуориметрии для количественной оценки рецепторного статуса больных РМЖ, может гормоночувствительности быть рекомендована рецептор-позитивных для определения опухолей больных первично-операбельным РМЖ. Внедрение результатов исследования Результаты исследования внедрены в работу ФГБНУ "Российский онкологический научный центр им. Н.Н. Блохина", ГУЗ Областной клинический онкологический диспансер г. Ульяновска, в учебный процесс кафедры онкологии и лучевой диагностики ФГБОУ ВПО «Ульяновский государственный университет» Минобрнауки РФ. 8 Апробация работы Предварительные результаты исследования были представлены, доложены и обсуждены на конференции IMPACT Breast Cancer Conference (Брюссель, 7-9 мая 2015), 37th Annual SABCS (Сан-Антонио, 9-13 декабря 2014). Личный вклад автора Личный вклад автора состоит в непосредственном участии на всех этaпах исследования: формулирование цели и задач иcследования, разработка плана и дизайна исследования, набор исследуемого материала (отбор пациентов раком молочной железы согласно критериям включения и невключения, выполнение core-биопсий, забор операционного материала), обработка результатов исследования и подготовка публикаций по материалам работы. Публикации по теме диссертации По результатам диссертационного исследования опубликованы 3 статьи в журналах из перечня изданий, а также представлены тезисы на международных конференциях. Структура и объем диссертации Диссертация изложена на 144 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, результатов собственных исследований, обсуждения результатов исследований, выводов, практических рекомендаций и списка литературы, состоящего из 121 источника, в том числе –20 отечественных и 101 зарубежных авторов. Работа иллюстрирована 29 таблицами и 61 рисунком. 9 ГЛАВА 1. Обзор литературы 1.1. Сравнительная характеристика эстрогеновых рецепторов: строение, функциональная активность Рак молочной железы занимает первое место в структуре онкологической заболеваемости женского населения [14]. Этиология РМЖ до сих пор не известна, но многочисленные исследования показали, что именно эстрогены играют ведущую роль в возникновении этого заболевания, реализуя свое действие через лиганд-зависимые транскрипционные факторы, называемые эстрогеновыми рецепторами. В 1962 году Jensen E. и Jacobsen H., обнаружив специфическое взаимодействие 17-β эстрадиола с белками в ткани матки, пришли к заключению, что биологическое действие эстрогенов реализуется при участии рецепторного белка [67]. В дальнейшем этот белок изучался в различных лабораториях, и в 1986 году две исследовательские группы сделали заявление о том, что ЭР клонирован [54, 55]. До 1995 года считалось, что существует только один тип ЭР, и что именно он ответственен за реализацию всех физиологических и фармакологических эффектов естественных и синтетических эстрогенов и антиэстрогенов. Однако, в 1995 году был клонирован второй эстрогеновый рецептор из библиотеки к-ДНК простаты крысы [72]. Уже известный эстрогеновый рецептор был назван ЭРα, а новый рецептор – ЭРβ. Этот тип рецепторов экспрессируется в опухолях разных локализаций [1], а в ткани первичного и метастатического рака легкого, в отличие от ЭРα, является главной клеточной мишенью эстрогенов [2, 3, 19]. ЭРα и ЭРβ принадлежат к суперсемейству стероидных ядерных рецепторов и имеют сходную структурную архитектуру [46, 50, 56, 68, 81, 117]. Ген ЭРα находится в длинном плече хромосомы 6 (локус q24—27), тогда как ген ЭРβ расположен в локусе q21—22 хромосомы 14. Оба рецептора состоят из трех основных доменов, выполняющих специфические 10 функции: N-концевой (А/B), ДНК-связывающий (C) и лиганд-связывающий домены (E) [89]. На N-концевом участке рецептора находится домен транскрипционной активаторной функции AF1 – участок рецептора, ответственный за белокбелковые взаимодействия и транскрипционную активацию гена-мишени независимо от связывания с лигандом [24, 69, 85]. Сравнительный анализ AF1 доменов эстрогеновых рецепторов в различных клеточных линиях показал, что в ЭРα этот домен высоко эффективен в стимуляции репортерных генов различных эстроген-чувствительных элементов (ERE), в то время как подобная активность AF1 ЭРβ низкая [32]. ДНК связывающий домен (DBD), как следует из названия, отвечает за присоединение к специфическим последовательностям ДНК [107]. Гомологичность DBD ЭРα и ЭРβ высокая и составляет около 96% [60]. Лиганд-связывающий домен (LBD) ответственен за связывание лиганда с рецептором, димеризацию рецептора, ядерную транслокацию и трансактивацию экспрессии генов-мишеней. Этот домен содержит участок с активационной функцией (AF-2), ответственный за конформационные изменения ЭР в присутствии лигандов и последующее связывание димеров ЭР с коактиваторами и корепрессорами [46, 50, 117]. Лиганд-связывающие LBD домены ЭРα и ЭРβ обладают высокой гомологичностью и имеют сходную третичную структуру аминокислотной последовательности [50, 75]. Поэтому не удивительно, что ЭРα и ЭРβ имеют сходную афинность к эстрогенам и антиэстрогенам [73]. Присоединение лиганда к ЭР через цепь последующих событий приводит к изменению уровня транскрипции эстроген-регуляторных генов. Эти события и порядок, в котором они происходят, до конца не понятны, но известно, что они включают в себя димеризацию рецептора, взаимодействие рецептора с ДНК, транскрипционными коактиваторами, факторами, и корепрессорами формирование или другими преинициаторного комплекса [22, 23, 68, 69, 70, 109]. 11 Накапливаются данные о негеномных эффектах эстрогенов, которые происходят слишком быстро, чтобы быть обусловленными активацией синтеза РНК и белка. Негеномные эффекты являются общим свойством стероидных гормонов и часто связаны с активацией различных протеинкиназных каскадов [78]. Описанные негеномные эффекты 17βэстрадиола включают мобилизацию внутриклеточного кальция, стимулирование активности аденилатциклазы, и синтез цАМФ [21, 66, 102]. В культуре клеток РМЖ была отмечена способность 17β-эстрадиола активировать МАРК и PI3K сигнальные пути [28, 86]. На сегодняшний день изучено 5 изоформ ЭРβ [88]. Ген ESR2, с которого происходит трансляция ЭРβ, имеет 8 экзонов. В процессе альтернативного сплайсинга мРНК последнего экзона образуются белковые продукты с различной функциональной активностью – изоформы ЭРβ1 – ЭРβ5. Все изоформы отличаются по длине С-концевых последовательностей, и имеют различную молекулярную массу. При этом ЭРβ1 является единственным полноразмерным белком, способным связываться с лигандом. Функциональные исследования показали, что гиперэкспрессия ЭРβ1имеет проапоптотический и антипролиферативные эффекты [76, 96]. Активность изоформ ЭРβ2 – ЭРβ5 изучена недостаточно. ЭРβ3 специфично экспрессируется преимущественно в ткани яичка [88], а ЭРβ4 в ткани молочной железы найден не был [100]. Несмотря на то, что ЭРβ2 и ЭРβ5 не связываются с лигандом, исследования транзиторной трансфекции показали, что ЭРβ2 и ЭРβ5 могут выступать как антагонисты ЭРα, путем образования гетеродимеров [99, 121]. Имеются сообщения, что высокий уровень экспрессии ЭРβ2 ассоциирован с резистентностью к тамоксифену и более агрессивным течением РМЖ [61, 119]. Рассмотренные в следующих разделах данные касаются предиктивной роли в терапии больных РМЖ только полноразмерной изоформы эстрогеновых рецепторов. 12 Для определения уровня экспрессии ЭР наиболее часто применяется полуколичественный метод иммуногистохимии [10]. Использование селективных моноклональных антител позволяет с высокой точностью установить наличие ЭР в исследуемой ткани. Однако, осуществляемая визуально оценка доли клеток, содержащих рецепторы, а тем более интенсивности их экспрессии в клетке, является субъективной и полуколичественной. В отдельных работах в качестве альтернативы иммуногистохимии для определения ЭР применяют метод полимеразной цепной реакции [17]. Но уровень мРНК, обнаруживаемый таким способом, не всегда соответствует уровню рецептора в клетке, так как на формирование белка из мРНК оказывают влияние различные трансляционные факторы, постсинтетическая модификация и белковая деградация. Недостаточно информативными являются радиолигандный метод и вестерн-блоттинг [5]. Первый сводится к определению уровня ЭР в неочищенном цитозоле гомогената клеток на основании связывания рецепторов и продуктов их деградации с лигандом, а второй – к детекции ЭР по связыванию со специфическими антителами в тотальной белковой фракции, полученной из анализируемых клеток. Безусловным шагом вперёд явился разработанный в ФГБНУ «РОНЦ им.Н.Н. Блохина» и запатентованный метод иммунофлуоресцентного анализа с привлечением проточной цитофлуориметрии. Метод позволяет строго количественно оценивать не только уровень экспрессии разных типов ЭР, то есть количество клеток, экспрессирующих маркер в исследуемой опухоли, но и интенсивность экспрессии ЭР в каждой клетке [4]. 1.2. Эстрогеновые рецепторы β и их корреляция с клиникоморфологическими параметрами По данным литературы экспрессия ЭРβ коррелирует с экспрессией ЭРα, небольшим размером опухолевого узла, низкой степенью злокачественности, отсутствием поражения регионарных лимфоузлов [62, 82, 13 92, 115] и отсутствием экспрессии Her2 [82, 91, 92]. Самым крупным явилось ретроспективное исследование, включавшее 2170 больных РМЖ, проведенное Marotti J. и соавт. (2010) [82]. ЭРβ+ положительные опухоли были представлены в 68% случаев всех инвазивных карцином. Экспрессия ЭРβ коррелировала с экспрессией ЭРα (р<0,0001), рецепторов прогестерона (р <0,0001), Her2-отрицательным статусом опухоли (р=0,004). ЭРβ+/- статус опухоли значимо отличается в различных молекулярно-генетических подтипах РМЖ (р<0,0001), встречаясь более чем в 72% случаев люминального А подтипа, 68% - люминального В подтипа. Интересным является тот факт, что 55% опухолей Her2+подтипа и 60% случаев триждынегативного подтипа, являющихся ЭРα-отрицательными, экспрессируют ЭРβ. Экспрессия ЭРβ была представлена в опухолях всех гистологических вариантов РМЖ: в 63% случаях инвазивных протоковых карцином, 87% инвазивных дольковых карцином, 83% - муцинозных карцином, 100% тубулярных карцином. Отсутствие экспрессии ЭРβ1 ассоциировалось с большим размером опухоли высокой (р=0,0008), степенью злокачественности (р<0,0001), метастатическим поражением регионарных лимфоузлов (р=0,06) [82]. Однако имеются и результаты другого исследования, не показавшего взаимосвязи экспрессии ЭРβ и клиникопатологических параметров [108]. Такие различия в полученных результатах могут быть обусловлены различной концентрацией используемых антител, а так же отсутствием единой шкалы определения уровня экспрессии. Однако, исходя из частой комбинации изучаемого рецептора с благоприятными клинико-морфологическими параметрами, ЭРβ+ опухоли представляются группой хорошего прогноза. 1.3. Эстрогеновые рецепторы β и их предиктивная роль в терапии больных раком молочной железы После открытия ЭРβ представления о сигнальных путях эстрогенов значительно изменились. Теперь известно, что 17β-эстрадиол, главный 14 эндогенный активатор ЭР, неселективен по отношению к разным типам рецепторов – α и β. ЭРα присутствуют в 80% случаев РМЖ и являются основным иммуногистохимическим параметром для назначения антиэстрогенотерапии. Поскольку большинство пациенток, получающих тамоксифен, имеют ЭРα-позитивные опухоли, затруднительно определить прогностическую и предиктивную значимость экспрессии ЭРβ, несмотря на тот факт, что 5-10% ЭРα-отрицательных опухолей чувствительны к терапии тамоксифеном [114, 118]. Анализ, проведенный the Early Breast Cancer Trialists Collaborative Group (EBCTCG 1998), показал незначительное снижение смертности (6%) в группе пациентов с низкой экспрессией ЭРα (02 балла по системе Allred Scoring Guidline), получавших тамоксифен [31]. Однако эти данные не подтвердились в последующем метаанализе, включавшем бóльшее количество исследований [34]. Имеются данные 9 ретроспективных исследований, в которых сравнивался уровень экспрессии ЭРβ (изолированно и в сочетании с экспрессией ЭРα) в первичной опухоли c показателями выживаемости больных первично-операбельным РМЖ [63,64, 91, 92, 93, 108, 114]. Данные исследования отличаются по количеству включенных больных, виду адъювантной терапии, пороговому значению в оценке ЭРβ и медиане наблюдения. В шести исследованиях с общим количеством 1227 пациенток получена достоверная взаимосвязь высокого уровня экспрессии ЭРβ и безрецидивной выживаемости, как в группе пациенток, получавших комбинированное лечение, так и антиэстрогенотерапию в монорежиме. Также достоверно значимое увеличение общей выживаемости в случае высокой экспрессии ЭРβ было показано в работах Sugiura и соавт. (2007), Nakopoulou и соавт. (2004), Honma и соавт. (2008), Mann и соавт (2001). В трех других исследованиях статистически достоверной корреляции уровня экспрессии ЭРβ и показателей выживаемости получено не было [93, 94, 108]. Говоря об экспрессии ЭРβ в ткани РМЖ, можно выделить две группы случаев – когда ЭРβ ко-экспрессируются с ЭРα (ЭРβ+/ЭРα+) и 15 экспрессируются изолированно (ЭРβ+/ЭРα−). Первая группа (ЭРβ+/ЭРα+) составляет более половины случаев первичного РМЖ, в то время как изолированная экспрессия ЭРβ (ЭРβ+/ЭРα−) встречается менее чем в 20% случаев [90, 105]. Опухоли, которые традиционно на основании иммуногистохимического анализа классифицируются как ЭР-отрицательные и характеризуется более агрессивным течением и низкой частотой ответа на гормонотерапию [9, 95], включают вторую группу ЭРβ-экспрессирующих новообразований. Эта группа опухолей составляет 50-80% ЭР-отрицательных опухолей (фенотип ЭРβ+/ЭРα−) [62, 97]. До открытия в 1996 году ЭРβ предполагалось, что часть пациентов так называемой «классической» ЭРотрицательной группы отвечают на гормонотерапию в силу методических погрешностей и неправильного определения статуса ЭР в опухоли (ложноотрицательные иммуногистохимические результаты), а также в случае реализации эффектов антиэстрогенов, не ассоциированных с эстрогеновыми рецепторами [25]. До настоящего времени ЭРβ+/ЭРα– группа опухолей, изучена недостаточно, однако в свете современных знаний о существовании разных типов эстрогеновых рецепторов, которые являются мишенью для эстрогенов и антиэстрогенов, противоопухолевый эффект последних в опухолях с фенотипом ЭРβ+/ЭРα− кажется очевидным. Особый интерес представляет исследование Honma N. и соавт. (2008), в которое вошли 442 пациентки с первично-операбельным инвазивным РМЖ, получившие хирургическое лечение с последующей адъювантной терапией тамоксифеном вне зависимости от рецепторного статуса опухоли [62]. Медиана наблюдения составила 11,1 лет. Оказалось, что высокая экспрессия опухолевыми клетками ЭРβ (в данном исследовании пороговое значение принималось как наличие 10% и более интенсивно окрашенных клеток) является благоприятным прогностическим маркером, вне зависимости от уровня экспрессии ЭРα (р<0,001). Из 442 пациенток, включенных в исследование, 60 имели ЭРα-/ПРстатус опухоли, однако у 50 пациенток (83%) данной группы определялась 16 экспрессия ЭРβ. Разница безрецидивной выживаемости ЭРα-/ЭРβ- и ЭРα/ЭРβ+ пациенток оказалась разительной. Только у 11 (22%) из 50 ЭРβ+ пациенток развился рецидив заболевания за весь период наблюдения, в то время как у 8 (80%) из 10 ЭРβ- пациенток развился рецидив в течение 5 лет. Проведенный многофакторный анализ показал, что низкий уровень экспрессии ЭРβ является независимым показателем повышенной смертности (р=0,021) и рецидивирования (р=0,004) у больных РМЖ, получающих адъювантную гормонтерапию тамоксифеном. В группе пациенток с триждынегативным фенотипом, общая и безрецидивная выживаемость также отличалась в зависимости от экспрессии ЭРβ (p<0,001). Учеными была предпринята попытка оценить предиктивную роль экспрессии ЭРβ на модели неоадъювантной гормонотерапии. В исследование Miller W. и соавт. (2006) вошли 33 пациентки в постменопаузе с морфологически верифицированным диагнозом РМЖ, с размером опухолевого узла >3см и высокой экспрессией ЭРα (Allred > 5), ежедневно получавших тамоксифен 20 мг в сутки в течение 3 месяцев до операции [87]. Опухоли всех пациенток были высоко положительными по экспрессии ЭРβ (Allred 5-8). Клинический ответ был зарегистрирован у 70% пациенток, патоморфологический – у 48%. Однако статистических достоверных различий уровней экспрессии эстрогеновых рецепторов в группах ответивших и не ответивших на гормонотерапию получено не было. На фоне трехмесячного приема тамоксифена отмечалось снижение экспрессии ЭРα (у 81% больных) и повышение экспрессии ЭРβ (в 51% случаев) по сравнению с исходными показателями. В 2013 году в Annals of Clinical Oncology опубликованы результаты проспективного анализа экспрессии ЭРβ-1 и его регулятора SRAP (Steroid Receptor RNA Activator Protein) в рамках исследования NCIC-CTG-MA12 (рандомизированное плацебо-контролируемое исследование тамоксифена после адъювантной химиотерапии у пременопаузальных больных ранним РМЖ) [120]. В исследование вошли 672 пациентки; период наблюдения 17 составил 9,7 года. ЭРβ-1 и SRAP были оценены у 457 из 462 больных, соответственно, в связи с отсутствием материала или невозможностью интерпретации иммуногистохимических результатов. Медиана уровня экспрессии ЭРβ составила 5,0 баллов (0-205); 54,9% пациенток были отнесены в группу высокой ЭРβ экспрессии, а 45,1% - низкой. Поскольку в исследование были включены пациентки как с положительным, так и с отрицательным ЭРα статусом опухоли, был выполнен анализ внутри группы в соответствии с стратификацией ЭРα+/-. В группе ЭРα-положительных опухолей высокие уровни экспрессии ЭРβ-1 и SRAP, как изолированно, так и в сочетании, не показали преимущества терапии тамоксифеном. В то время как в группе ЭРα-отрицательных опухолей с высокой экспрессией ЭРβ при назначении тамоксифена отмечалось увеличение общей (р=0,007) и безрецидивной выживаемости (р=0,0009) по сравнению с группой плацебо. При низкой экспрессии ЭРβ и SRAP не было получено статистических различий в показателях выживаемости между группами тамоксифена и плацебо. Авторами сделан вывод о возможной предиктивной роли ЭРβ-1 в группе пациенток с ЭРα-отрицательным РМЖ. Иными словами, в работе получено реальное доказательство того, что, по крайней мере, в половине случаев, позитивный эффект тамоксифена при лечении РМЖ с отрицательным статусом ЭРα связан с экспрессией в опухолевых клетках другой мишени – эстрогеновых рецепторов β. Важным параметром, определяющим биологические особенности опухоли, является уровень каждого из маркеров при их коэкспрессии. В некоторых случаях высокий уровень экспрессии в опухоли ЭРβ может влиять на эффекты, опосредуемые ЭРα. Например, пролиферативный ответ при воздействии на культуру клеток РМЖ человека эстрогенов в случае коэкспрессии рецепторов наблюдается только при низком уровне экспрессии ЭРβ [113]. Полученные на культурах клеток данные о влиянии соотношения разных типов рецепторов на пролиферативное действие эстрогенов ещё не подтверждены в клинических условиях при изучении действия блокаторов 18 рецепторов. Поэтому информация о количественном соотношении экспрессии ЭРα и ЭРβ может быть очень важной при оценке предиктивной значимости каждого из типов рецепторов при их коэкспрессии. 1.4. Роль неоадъювантных клинических исследований в оценке чувствительности опухоли к системной терапии Использование адъювантной терапии рака молочной железы (РМЖ) привело к существенному снижению смертности от этой опухоли [15, 39]. Выбор метода адъювантной терапии, в соответствии с современными стандартами, основывается на знании молекулярно-биологического портрета опухоли [11]. Последние исследования, использовавшие методику микрочипов и кластерного анализа, позволили по-новому взглянуть на классификацию инвазивного РМЖ [26, 98, 111, 112]. В настоящее время выделяют несколько подтипов РМЖ, имеющих различный профиль экспрессии генов, клиническое течение и мишень для проведения персонализированной системной терапии. Молекулярно-биологические подтипы, включают в себя люминальные А и В (гормон-рецептор позитивные) подтипы, Her2+ подтип, и группу базалоидного рака [7]. Однако исследование профиля экспрессии с помощью микрочипов, является дорогостоящим и трудоемким. Для широкого практического использования традиционно применяется метод иммуногистохимического исследования опухолевой ткани. Эстрогеновые рецепторы, рецепторы прогестерона, рецептор эпидермального фактора роста (Her2) в настоящее время являются общепризнанными прогностическими факторами риска развития отрицательного события (рецидив заболевания, смерть) и маркерами, предсказывающими чувствительность или резистентность опухоли к конкретной терапии [13]. Одновременно ведется поиск новых прогностических и предиктивных маркёров. В частности, отличительной чертой опухолевых клеток является их способность к постоянному делению [59]. Наиболее распространенным 19 способом измерения степени пролиферации является иммуногистохимическое определения негистонного нуклеопротеина Ki67 [16]. Его точная функция в настоящее время достоверно не определена, хотя считается, что он связан с синтезом рибосомальной РНК [27, 101]. Наблюдение, что Ki67 присутствует только в пролиферирующих клетках, привело к тому, что данный маркер был одобрен для оценки доли пролиферирующих клеток в опухоли. В 2013 году панелью экспертов St. Gallen International Breast Cancer Conference было рекомендовано к использованию в клинической практике порогового значения Ki67 – 20% для разграничения опухолей с высокой и низкой пролиферативной активностью. Одновременно было предложено деление гормон-рецептор позитивных люминальных опухолей на два подтипа: подтип А (Ki67<20%) и подтип В (Ki67≥20%) [52]. Проведение неоадъювантной системной терапии не только делает возможным выполнение операции в случае местно-распространенного РМЖ и уменьшение объема хирургического вмешательства в случае первичнооперабельного РМЖ, но и позволяет in vivo оценить чувствительность опухоли к проводимой системной терапии [18]. Отсутствие опухолевых клеток в гистологических препаратах у пациенток, получивших неоадъювантную системную терапию, описывается как полный лечебный патоморфоз и является независимым маркером благоприятного прогноза [12, 57, 71]. Дизайн клинических исследований по изучению эффективности лекарственных средств в неоадьювантном режиме, основанный на анализе частоты полного лечебного патоморфоза, был одобрен как метод, требующий меньшего количества пациентов и более коротких сроков наблюдения, по сравнению с адъювантным. Однако достичь полного лечебного патоморфоза в результате проводимой неоадъювантной химиотерапии, особенно в группе с высокой экспрессией ЭР, удается достаточно редко, что приводит к затруднению интерпретации полученных результатов. Полный лечебный патоморфоз является редким явлением и в случае неоадъювантной 20 эндокринотерапии РМЖ, несмотря на доказанную прогностическую и предиктивную значимость высокого уровня экспрессии ЭР и ПР в опухоли. В литературе описаны редкие случаи полного лечебного патоморфоза ЭРпозитивного РМЖ на фоне предоперационной эндокринотерапии: 0-2% – после приема тамоксифена в течение 4-х месяцев, 2% – после 3-х месячного приема летрозола, 3% – после 3-х месячного приема анастрозола и 5-7% – после 3-6 месяцев терапии экземестаном [41,42, 51, 104, 106]. Результаты рандомизированного исследования Семиглазова В.Ф. и соавт., включавшего 121 пациентку местно-распространенным ЭР- позитивным РМЖ в постменопаузе, показали сопоставимую частоту полного лечебного патоморфоза в группах неоадъювантной химиотерапии (4 курса АТ) и гормонотерапии (3месяца приёма анастрозола или экземестана) – 7% и 5%, соответственно [106]. В настоящее время ведется активный поиск новых биологических маркёров в первичной и резидуальной опухолях, способных не только прогнозировать отдаленные результаты лечения, но также ускорить разработку и внедрение новых лекарственных средств в группе пациенток высокого риска. 1.5. Предиктивная и прогностическая роль динамического мониторинга биологических маркеров в оценке гормоночувствительности опухоли Впервые попытка оценить чувствительность опухоли к неоадъювантной гормонотерапии с использованием индекса пролиферации Ki67 была предпринята Dowsett М. и соавт. в 1998 году [80]. В пилотное исследование были включены пациентки (21) первично-операбельным РМЖ, у которых иммуноцитохимически в материале аспирационной биопсии определяли исходные показатели экспрессии ЭР, ПР и Ki67, а также методом проточной цитофлуориметрии – плоидность и фракцию клеток в S-фазе (SPF). Повторное аналогичное исследование проводилось через 14 дней и 8 недель после ежедневного приема тамоксифена в дозе 20 мг/сутки. 21 Объективный ответ оценивался клинически с использованием критериев UICC. Двенадцать пациенток ответили на лечение (в 2 случаях был зарегистрирован полный ответ, в 10 – частичный), у 7 больных наблюдалось прогрессирование заболевания. Клинический ответ был зарегистрирован преимущественно у пациенток с положительным статусом ЭР (р=0,002), ПР (р=0,006) и низкой фракцией SPF (р=0,06). После 14 дней приема тамоксифена в группе пациенток, ответивших на терапию, показатель Ki67 (процент окрашенных клеток) снизился в среднем в 4,8 раза, а в группе не ответивших на терапию средний показатель остался практически без изменения (р=0,005). В то же время статистически достоверного изменения SPF зарегистрировано не было. Снижение уровня ЭР относительно исходного значения было отмечено у 3 из 15 пациенток, причем все они ответили на лечение. Повышение экспрессии ПР наблюдалось у 7 из 17 пациенток, у 6 из которых наблюдался объективный ответ. Похожие изменения уровней экспрессии ЭР и ПР были получены и через 8 недель приема тамоксифена, однако снижение Ki67 и SPF в этом временном интервале не коррелировало с клиническим ответом. Авторами был сделан вывод, что снижение Ki67 и уровня экспрессии ЭР, а также повышение экспрессии ПР на фоне краткосрочного приема тамоксифена, могут прогнозировать терапевтический ответ на гормонотерапию. В 2000 году опубликованы результаты исследования аналогичного дизайна, в котором у 54 пациенток РМЖ изменение маркеров оценивалось на 14-ый день, 60-ый день, или на 14-ый и 60-ый дни [29]. Результаты однофакторного анализа показали, что исходные уровни ЭР и ПР являются достоверными предиктивными факторами ответа на гормонотерапию (р<0,0001 и р<0,003, соответственно). Повышение уровня экспрессия ПР и снижение Ki67 через две недели приема тамоксифена достоверно свидетельствовало о чувствительности опухоли к гормонотерапии (р<0,03 и р<0,04, соответственно). Напротив, отсутствие эстрогеновых рецепторов, наличие метастатических лимфоузлов и отсутствие снижения Ki67 после 14 22 дней приёма тамоксифена достоверно коррелировало с повышенным риском рецидивирования (р<0,05). В данном исследовании хирургическое лечение пациенткам не проводилось из-за наличия сопутствующей патологии или преклонного возраста, а безрецидивный период оценивался от начала лечения до появления отдаленных метастазов. Попытка оценить информативность динамики изменения Ki67, относительно исходного уровня, в прогнозировании клинического ответа и в оценке эффективности гормональных препаратов была предпринята в крупном мультицентровом двойном слепом рандомизированном исследовании IMPACT [36]. В исследование вошло 330 постменопаузальных пациенток первично-операбельным или местнораспространенным условнооперабельным ЭР-положительным РМЖ. Пациентки были рандомизированы в группы терапии тамоксифеном 20мг/сутки, аримидексом 1мг/сутки и комбинации этих препаратов в равной пропорции. Иммуногистохимическое определение ЭР, ПР, Her2 и Ki67 проводилось в материале кор-биопсии до начала лечения и через 2 недели, а также в операционном материале через 12 недель терапии. Окончательно в анализируемую группу были включены 259 пациентки. Во всех группах показано статистически достоверное снижение среднего геометрического показателя Ki67 после 2 и 12 недель лечения. Причем снижение было достоверно выше в группе анастрозола, в сравнении с группой тамоксифена (р=0,004, р=0,001, соответственно). В то время как между группами тамоксифена и комбинации тамоксифена и анастрозола достоверных различий получено не было (р=0,6, р=0,9). Авторами была предпринята попытка оценить чувствительность опухолей различных люминальных подтипов к проводимой гормонотерапии. За исключением группы комбинированного приема препаратов, снижение Ki67 на 2 и 12 неделе наблюдения было достоверно бóльшим в случае ПР-положительного статуса опухоли. После 2 недели терапии уровень Ki67 был статистически значимо ниже в ткани Her-2 положительных опухолей по сравнению с Her2негативными только в группе пациенток, получавших тамоксифен. В 23 процессе гормонотерапии изменялся и рецепторный статус опухолей. На 12ой неделе отмечалось снижение уровня экспрессии ЭР как в группе тамоксифена, так и анастрозола (р<0,05). В группе анастрозола также было отмечено значительное снижение экспрессии ПР на 2 и на 12-ой неделях наблюдения – на 41% и 82% соответственно. В то же время в группе тамоксифена уровень экспрессии ПР повышался на 48% на 2 неделе лечения, а к 12 неделе практически возвращался к исходным значениям. И наконец, в работе была выявлена статистически значимая корреляция между снижением уровня Ki67 и увеличением экспрессии ПР в группе тамоксифена, однако в группе анастрозола достоверной взаимосвязи получено не было. Отмеченное повышение уровня ПР в группе тамоксифена контрастирует со значительным подавлением экспрессии данных рецепторов в группе анастрозола. Однако разнонаправленное изменение уровня ПР в обеих группах прямо и статистически значимо коррелирует с подавлением пролиферативной активности опухоли. Снижение уровня экспрессии ПР на фоне приема анастрозола говорит об эффективности депривации эстрогенов вследствие зависимости ПР от эстрогенов. А повышение уровня ПР в группе тамоксифена является индикатором агонистического эффекта на его ген, что также является индикатором биологической чувствительности опухоли. Феномен раннего повышения уровня экспрессии ПР и повышенной чувствительности данных опухолевых клеток к гормонотерапии был описан Howel А. и соавт. еще в 1987 году [64]. Снижение среднего геометрического показателя Ki67 относительно исходного уровня отмечено на 2-ой (75,3% vs 61,7%) и на 12 неделе (73,2% vs 67,3%) терапии. Обращает на себя внимание тот факт, что эти изменения были более выражены в группе пациенток, у которых регистрировался объективный ответ. Вместе с тем, только в группе тамоксифена снижение Ki67 в группе пациенток с объективным ответом было статистически значимо (р=0,013). 24 При сравнительном анализе результатов неоадъювантной гормональной терапии РМЖ в исследовании IMPACT с данными по эффективности адъювантной гормональной терапии в исследовании АТАС выявляются следующие закономерности. В первом случае критерием эффективности терапии были объективный ответ и динамика изменения молекулярных маркёров, во втором – показатель безрецидивной выживаемости. При медиане наблюдения 100 месяцев, в исследовании АТАС, включавшем 9366 ЭР-позитивных пациенток в постменопаузе, показано увеличение безрецидивной выживаемости на 27% в группе анастрозола, по сравнению с группой тамоксифена [48]. Характер изменения уровня Ki67 в исследовании IMPACT как через 2 недели, так и через 12 недель приема препаратов гормонотерапии зеркально полностью коррелировал с показателями безрецидивной выживаемости в исследовании АТАС. Таким образом, краткосрочные пилотные проекты с оценкой молекулярных опухолевых маркеров в динамике могут быть рекомендованы для обоснования проведения в дальнейшем крупномасштабных дорогостоящих исследований. Существует ряд других исследований по неоадьювантной гормонотерапии РМЖ, в которых Ki67 интенсивно изучался как предиктор терапевтической эффективности различных препаратов. Оценка уровня Ki67 в процессе лечения позволяет получить оперативную информацию о биологии опухоли, ее чувствительности к проводимой терапии, и обладает большой прогностической значимостью в оценке отдаленных результатов лечения [37, 38, 40, 42, 44, 74, 84]. Впоследствии данные результаты неоадъювантных исследований по изучению эффективности гормональной терапии были подтверждены данными адъювантного исследования BIG-98, при медиане наблюдения 8,7 лет, показавшего достоверное повышение показателей общей и безрецидивной выживаемости в группе летрозола, по сравнению с группами тамоксифена и последовательного приема препаратов [103]. А результаты 25 финального анализа адъювантного исследования МА.27 по сравнению эффективности экземестана и анастрозола при медиане наблюдения 4,1 лет не показали преимущества назначения какого-либо из препаратов, тем самым подтвердив результаты неоадъювантного исследования Ellis и соавт., 2011 [44, 53]. Открытие в 90-х годах ЭРβ расширило понимание механизмов эстроген-опосредованного сигнального пути и межрецепторных взаимодействий. Madeira M. и соавт. (2013) впервые была предпринята попытка выявить предиктивную роль экспрессии в ткани РМЖ ЭРβ и соотношения ЭРα/ЭРβ в прогнозе гормоночувствительности опухоли, ориентируясь на динамику изменения показателей Ki67 и экспрессии рецепторов после проведения неоадъювантной гормональной терапии [79]. В анализ двойного слепого проспективного рандомизированного исследования вошли 75 пациенток первично-операбельным РМЖ в постменопаузе, получавших анастрозол 1мг/сут, тамоксифен 20мг/сут или плацебо в течение 26 дней до операции. В группе пациенток с ЭРβ-негативным РМЖ статистически значимого изменения показателей Ki67 получено не было. Однако в случае ЭРβ-позитивного РМЖ, в группах анастрозола и тамоксифена снижение Ki67 через 26 дней терапии было статистически достоверным (р=0,01 и р=0,04, соответственно). Авторы проанализировали также три подгруппы пациенток с разными вариантами соотношения уровней экспрессии ЭРα и ЭРβ: <1 (ЭРα < ЭРβ), 1-1,5 (ЭРα ~ЭРβ), и >1,5 (ЭРα > ЭРβ). Только в группе пациенток с соотношением ЭРα/Эрβ 1-1,5 было получено статистически значимое снижение уровня Ki67 в группах терапии тамоксифеном (р=0,026) и анастрозолом (р=0,005). Авторами сделан вывод в поддержку гипотезы о том, что сочетанное определение ЭРα и Эрβ обладает большей предиктивной информативностью в отношении гормоночувствительности опухоли, по сравнению с изолированной оценкой уровня экспрессии ЭРα. 26 Ряд изложенных выше данных в настоящее время детально изучается в уникальном неоадъювантном исследовании POETIC (PeriOperative Endocrine Therapy for Individualizing Care). Главной целью исследования является оценка давней гипотезы: «Может ли неоадъювантная гормонотерапия улучшить исход пациенток РМЖ» [35]. Эта гипотеза была сформулирована еще Fisher В. и соавт. в 1989 г., которые заметили, что проводимая до операции химио- и гормонотерапия увеличивает выживаемость у крыс [47]. В исследование POETIC предполагается включить 4000 пациенток ЭР-позитивным первично-операбельным РМЖ с рандомизацией 2:1 в группы неоадъювантного приема ингибиторов ароматазы (летрозол или анастрозол) в течение двух недель до операции и плацебо. Результаты данного исследования помогут оценить предиктивную роль динамики изменения Ki67 и профилей экспрессии генов (Oncotype DX, MammaPrint) в оценке безрецидивной выживаемости. 1.6. Ki67 как маркер первичной и приобретенной резистентности В отличие от стандартных адъювантных исследований, оценивающих отдаленные показатели выживаемости, неоадъювантная модель, с оценкой молекулярных опухолевых маркеров в качестве предиктивных факторов, позволяет выявить резистентность опухоли к гормонотерапии уже на ранних этапах лечения. В рассмотренном выше исследовании IMPACT, в группе анастрозола у 52/56 пациенток с ЭР-положительным РМЖ после двухнедельного приема препарата отмечалось снижение пролиферации опухолевых клеток, что свидетельствовало о том, что терапия ингибиторами ароматазы в подавляющем числе случаев оказалась эффективной. Однако характер динамических изменений показателей Ki67 в период от 2 до 12 недель терапии существенно различался внутри этой группы пациенток (рис.1а). У большинства из них (85%) снижение показателя Ki67, отмеченное спустя 2 недели от начала терапии, нарастало вплоть до 12 недель на фоне продолжившейся неоадъювантной терапии. У 15% больных, напротив, к 12 27 неделе от начала лечения снижение Ki67 останавливалось, а в некоторых случаях был отмечен рост маркёра, что может являться биологическим свидетельством ранней приобретенной резистентности к проводимой терапии. Это клиническими теоретическое данными: предположение безрецидивная было выживаемость подтверждено пациенток с приобретенной резистентностью не отличалась от таковой у пациенток с резистентностью de novo, и была достоверно ниже по сравнению с группой больных, у которых наблюдалось длительное стойкое снижение Ki67 (рис.1б) [45]. Это дает возможность использовать биомаркеры в исследованиях таргетных препаратов гормонорезистентности по опухоли, преодолению поскольку операция приобретенной традиционно проводится раньше появления клинических признаков резистентности опухоли. 28 Рис. 1. а. Изменение маркера пролиферации Ki67 на фоне 12-недельной терапии анастрозолом. б. Безрецидивная выживаемость пациенток ЭРположительным раком молочной железы, получавших анастрозол, тамоксифен или их комбинацию в течение 12 недель (резистентность de novo – снижение Ki67<50% за две недели терапии; приобретенная резистентность – снижение Ki67>50% за две недели терапии, и ≤50% снижение со 2-ой по 12-ую неделю терапии; продолженный ответ – снижение Ki67>50% за две недели терапии и >50% со 2-ой по 12-ую неделю терапии). Модифицировано из статьи Mitch Dowsett и соавт., 2011 [35]. Ниже приведены только несколько из подобных исследований. Добавление ингибитора тирозинкиназы гефитиниба к анастрозолу в течение 14 и 16 дней перед операцией не показало дополнительного снижения пролиферации опухоли, что опровергло теорию о возможности двойной 29 блокады рецепторов эпидермального фактора роста EGFR и ЭР в повышении чувствительности опухоли к гормонотерапии [110]. В совокупности с другими данными об ограниченной эффективности гефитиниба у больных ЭР-позитивным РМЖ, было принято решение не проводить исследования III фазы данного препарата. Ингибитор циклооксигеназы-2, целекоксиб, показал незначительное снижение Ki67 в течение 2-х недельного периода терапии ЭР-позитивного РМЖ, доказав свою ограниченную эффективность в ингибировании ароматазы [83]. В настоящее время неоадъювантная модель с изучением динамики уровня Ki67 используется в оценке эффективности ингибитора тирозинкиназы, лапатиниба, в популяции Her-2-негативного РМЖ [35]. Ki67 в составе прогностических моделей. Номограмма представляет собой прогностический алгоритм, позволяющий оценить вероятность определенного исхода индивидуально для каждого конкретного пациента, используя набор определенных «входных» данных (например, размер узла, гормональный статус опухоли и т.п.). На сегодняшний день не вызывает сомнений тот факт, что прогнозирование на основе сочетания нескольких прогностических параметров дает более точный результат, нежели прогнозирование, использующее только 1 маркер. Точное получающих определение гормонотерапию, риска рецидивирования позволяет обоснованно у пациенток, отказаться от проведения токсичной химиотерапии в группе пациенток низкого риска. Разработано несколько прогностических мультигенных сигнатур, показывающих преимущество дополнительного проведения химиотерапии у больных ЭР-позитивным РМЖ групп низкого и среднего риска (Oncotype DX, Mammaprint). Однако это дорогостоящие методики, применение которых не всегда обосновано. Традиционные иммуногистохимические маркеры часто обладают достаточно высокой прогностической и предиктивной информативностью. Номограмма IHC4 объединила иммуногистохимические параметры (ЭР, ПР, Ki67 и Her2) и клинико-морфологические параметры 30 (размер опухолевого узла, количество пораженных лимфоузлов, степень злокачественности, возраст пациентки) в математический индекс, позволяющий прогнозировать агрессивность заболевания у ЭР-позитивных пациенток, получающих эндокринотерапию. Данная номограмма была валидирована в исследовании TransАТАС в когорте 1125 пациенток, и ее прогностическая информативность не отличалась от таковой для Oncotype DX [33]. Предоперационный прогностический индекс PEPI был предложен в качестве номограммы, позволяющей оценить отдаленные результаты лечения больных РМЖ, в рамках исследования IMPACT. Индекс PEPI включает морфологические и молекулярные характеристики опухоли: статус ЭР, размер опухолевого узла, статус регионарных лимфоузлов, уровень Ki67 [43]. Авторами было показано, что после проведения в течение 12 недель неоадъювантной эндокринотерапии, можно выделить группу пациенток чрезвычайно низкого риска рецидива (PEPI SCORE 0 баллов), для которой является достаточным проведение только гормонотерапии, а также группу пациенток с высоким индексом PEPI (≥4 баллов), в которой необходимо дополнительно провести адъювантную химиотерапию. Таким образом, показатели Ki67 и динамика их изменения в ходе неоадъювантной гормональной терапии является важным ориентиром в выборе тактики дальнейшего лекарственного лечения РМЖ. Таким образом, изменение уровня гормональных рецепторов (ЭР, ПР) и маркера пролиферативной активности (Ki67) в предоперационной тестовой модели могут быть рекомендованы для индивидуализации лечения больных раком молочной железы. 31 ГЛАВА 2 2.1 Материал исследования Настоящее исследование выполнено на базе хирургического отделения №5, лаборатории медицинской химии ФГБНУ «РОНЦ им. Н. Н. Блохина», хирургического отделения №2 ГУЗ Областной клинический онкологический диспансер (ОКОД) г. Ульяновска в период 2012-2015 гг. Данное мультицентровое проспективное исследование представлено двумя группами пациенток получавших (II группа) и не получавших (I группа) предоперационный двухнедельный курс гормонотерапии (тест на гормоночувствительность) (рис. 2). Для оценки взаимосвязи экспрессии и ко-экспрессии ЭРα и ЭРβ с клинико-морфологическими характеристиками использовались: 1. данные анализа биоптатов операционного материала и клинические данные пациенток I группы; 2. данные анализа нативного материала core-биопсий и клинические данные пациенток II группы. Для анализа динамического изменения экспрессии рецепторов стероидных гормонов в процессе гормонотерапии использовались данные анализа материала core-биопсий и операционного материала пациенток II группы. 32 113 больных РМЖ I группа (n=67) II группа (n=46) Операция Core-биопсия Операционный материал: 1. Гистологическое исследование 2. ИГХ (ЭРα, ПР, Her2, Ki67) 3. ПЦФ (ЭРα, ЭРβ) Core-биопсия: 1. Гистологическое исследование 2. ИГХ (ЭРα, ПР, Her2, Ki67) 3. ПЦФ (ЭРα, ЭРβ) Двухнедельный тест на гормоночувствительность Экземестан 25 мг ежедневно n=4 Тамоксифен 20мг ежедневно n=42 Операция Операционный материал 1. Гистологическое исследование 2. ИГХ (ЭРα, ПР, Her2, Ki67) 3. ПЦФ (ЭРα, ЭРβ) Рис. 2. Дизайн исследования. В I группе проанализированы 67 биоптатов опухолевой ткани больных РМЖ, находившихся на лечении в ФГБНУ «РОНЦ им. Н. Н. Блохина» с 2012 по 2014 гг. 33 Во II группе исследованы 46 биоптатов опухолевой ткани больных РМЖ, которым был проведен двухнедельный тест на гормоночувствительность с применением тамоксифена или экземестана в ФГБНУ «РОНЦ им. Н. Н. Блохина» (n=30) и ГУЗ ОКОД (n=16) в период с 2014 по 2015гг. Кроме биоптатов в анализ были включены анамнестические и клинические данные, результаты диагностических методов обследования и другие материалы медицинских карт указанных выше больных. На все исследование было получено одобрение локального этического комитета ФГБНУ «РОНЦ им. Н. Н. Блохина». Работа проводилась с соблюдением законодательства РФ, этических норм и принципов Декларации Хельсинки (1964) со всеми последующими дополнениями и изменениями, регламентирующими научные исследования на биоматериалах, полученных от людей, а также международным руководством для биомедицинских исследований с вовлечением человека (International ethical guidelines for biomedical research involving human subjects) Совета международных организаций медицинских наук (CIOMS). Все первичные данные пациенток были обезличены в соответствии с требования п. 3 ст. 6 действующего Федерального закона РФ 152-ФЗ «О персональных данных». Критерии включения пациенток в I группу: 1. возраст старше 18 лет; 2. морфологически верифицированный диагноз рака молочной железы; 3. выполнение на первом этапе хирургического лечения; 4. размеры опухолевого узла достаточные для проведения планового гистологического, иммуногистохимического исследования и анализа проточной цитофлуометрии операционного материала. Критерии включения пациенток во II группу: 1. возраст старше 18 лет; 2. морфологически верифицированный диагноз РМЖ; 34 размеры опухолевого узла достаточные для выполнения core- 3. биопсии и последующего гистологического, иммуногистохимического исследования и анализа проточной цитофлуометрии биоптатов; отсутствие противопоказаний к терапии тамоксифеном или 4. экземестаном; наличие подписанного добровольного информированного 5. согласия на все процедуры исследования и проведение 2-х недельного теста на гормоночувствительность. Критерии невключения: проведение на первом этапе системной или лучевой терапии. 1. Средний возраст пациенток РМЖ составил 56,9±11,1 лет. Наибольшее число наблюдений (31,9%) находились в возрастной группе от 50 до 60 лет (рис. 3). K-S d=,05616, p> .20; Lilliefors p> .20 Expected Normal 45 40 35 Частота, абс. 30 25 20 15 10 5 0 20 30 40 50 60 70 80 Возраст, лет Рис. 3. Распределение наблюдений по возрастам. Распространенность процесса оценивалась у всех больных в соответствии с классификацией злокачественных опухолей UICC (7 издание TNM, 2009г.) на основании данных осмотра пациенток и инструментального обследования, включавшего в себя: маммографическое исследование и ультразвуковое исследование молочных желез и регионарных лимфоузлов, или магнитно-резонансную томографию молочных желез для пациенток 35 моложе 40 лет, рентгенографию органов грудной клетки, ультразвуковое исследование органов брюшной полости и малого таза, остеосцинтиграфию. Верификация диагноза осуществлялась при помощи цитологического метода исследования материала тонкоигольной аспирационной биопсии или гистологического метода исследования материала core-биопсии на амбулаторном этапе. Рак правой молочной железы был зарегистрирован у 65 пациенток (57%), рак левой молочной железы – у 48 (43%). Наиболее часто опухолевый узел локализовался в верхне-наружном квадранте молочной железы (44%), наиболее редко – в хвостовой доле (1%) (табл. 1). Таблица 1 Локализация опухолевого очага молочной железы Локализация Количество больных абс. % Верхне-наружный квадрант 50 44 Верхне-внутренний квадрант 8 7 Нижне-внутренний квадрант 9 8 Нижне-наружный квадрант 4 4 Центральная часть 7 6 Граница верхних квадрантов 8 7 Граница внутренних квадрантов 7 6 Граница нижних квадрантов 9 8 Граница наружных квадрантов 10 9 Хвостовая доля 1 1 113 100 Всего: Пациенткам II группы на амбулаторном или госпитальном этапе после полного обследования согласно государственным стандартам выполнялась core-биопсия опухолевого узла одноразовой автоматической иглой HTR 36 (HUNTER, размер 14 G, длина 15 см); в 43% случаев под контролем УЗИ. Материал фиксировался в 10% растворе забуференного нейтрального формалина в двух пробирках и направлялся в лабораторию патоморфологической диагностики для проведения гистологического и иммуногистохимического исследований и лабораторию медицинской химии для проведения молекулярного анализа. После выполнения core-биопсии, вне зависимости от рецепторного статуса опухоли, пациенткам назначался Тамоксифен Hexal (Германия) 20мг внутрь ежедневно (42 пациентки) или Аромазин Pfizer H.C.P. Corporation (США) 25мг внутрь ежедневно (4 пациентки), в случае наличия противопоказаний к терапии тамоксифеном, за 2 недели до оперативного вмешательства. Пациенткам выдавалось 14 таблеток, давались рекомендации по приему, фиксировалась даты госпитализации и операции. Хирургическое лечение выполнялось в объеме радикальной мастэктомии с сохранением грудных мышц или радикальной резекции. Вид операции определялся в зависимости от размера опухолевого узла, локализации, наличия или отсутствия микрокальцинатов, предпочтений пациентки, возможности проведения адъювантной лучевой терапии. Хирургическое лечение проводилось в среднем через 2-3 недели после первичного обращения больных в поликлинику ФГБНУ «РОНЦ им. Н. Н. Блохина» пациенткам I группы; и через 2 недели после выполнения coreбиопсия пациенткам II группы. Радикальная мастэктомия была выполнена 87 пациенткам (77%), из них 22 при I стадии, 37 − при IIA стадии; 16 – при IIB стадии, 4 – при IIIA стадии, 6 – при IIIB стадии, 2 – при IIIC стадии; из них санационная мастэктомия (распад опухолевого узла и угроза кровотечения) была проведена 4 пациенткам. Радикальная резекция со срочным гистологическим исследованием была выполнена 26 пациенткам (23%), из них 9 − при I стадии, 11 − при IIA стадии, 4 − при IIB стадии, 2 − при IIIA стадии (рис. 4). 37 80% 70% 60% 50% 40% 30% 20% 10% 0% Радикальная резекция Радикальная мастэктомия I IIA IIB IIIA Стадия Рис. 4. Структура оперативных вмешательств первично-операбельного РМЖ. Полученный в ходе операции биоматериал доставлялся в гистологическую лабораторию в нефиксированном виде для проведения стандартного гистологического исследования и ИГХ. Также во время вырезки фрагмент опухоли 0,2-0,5 см фиксировался в 4% растворе формальдегида и доставлялся в лабораторию медицинской химии для проведения ПЦФ анализа. С операционного материала проводились: 1. Плановое гистологическое исследование с обязательной оценкой степени лечебного патоморфоза во II группе; 2. Иммуногистохимическое исследование для оценки рецепторного статуса опухоли в I группе, определения возможных изменений рецепторного статуса и динамики изменения маркера пролиферации Ki67 относительно исходного уровня во II группе. В случае лечебного патоморфоза III-IV степени повторное иммуногистохимическое исследование не проводилось; 3. Исследование ЭРα, ЭРβ статуса опухоли методом ПЦФ. Наибольшее число больных в соответствии с данными планового гистологического и инструментального исследований относилось к IIA стадии (40,2% и 45,7% в I и II группах, соответственно), на 2-м месте по 38 частоте были больные I стадией (26,9% и 28,3%); IIB стадия установлена в 14,9% и 21,7% случаев, IIIA – в 6% и 4,3%, IIIB и IIIC стадии встречались только в I группе – 9% и 3%, соответственно (рис. 5): A. 9,0% 3,0% 6,0% 40,3% 40,2% IIA IIB IIIA IIIB IIIC Б. 21,7% I 4,3% 28,3% 45,7% IIA IIB IIIA Рис. 5. А. Распределение больных по стадиям в I группе. Б. Распределение больных по стадиям во II группе. Средний размер опухоли молочной железы составил 2,5см±1,2см, 2,73±1,4см в I и 2,31±0,8см в II группах. Наиболее часто размер опухолевого узла был в диапазоне от 2 до 3 см - 43,4% (рис. 6). 39 : размер узла (см) гистологически в общей группе больных РМЖ K-S d=,19232, p<,01 ; Lilliefors p<,01 Expected Normal 55 50 45 Частота, абс. 40 35 30 25 20 15 10 5 0 -1 0 1 2 3 4 5 6 7 8 9 Размер опухоли, см Рис. 6. Распределение наблюдений по размеру опухолевого узла. Совпадение размеров опухолевого узла по данным маммографического и гистологического исследований в I группе было низким. Расхождение в размерах опухолевого узла с использованием этих методов исследования менее чем на 0,5см было зарегистрировано у 38 (62%) из 61 больных. Изменение размеров опухолевого узла на фоне двухнедельного теста на чувствительность опухоли к гормонотерапии не оценивалось в связи с высоким процентом расхождений данных маммографии и гистологических заключений в I группе. Согласно результатам планового инвазивный рак был зарегистрирован гистологического заключения у 100% пациенток, из них внутрипротоковый рак с микроинвазией – у двух пациенток I группы. Наиболее частым гистологическим вариантом был инвазивный неспецифический рак (протоковый вариант) (84% и 74% случаев в I и II группах, соответственно). Реже встречались инвазивный дольковый рак (12% и 18%, соответственно) и особые формы РМЖ (медуллярный - 1% и 2%, тубулярный – 3% в I группе). Неспецифический смешанный рак описан в 4% случаев во II группе пациенток. У одной пациентки II группы описан случай миоэпителиальной карциномы. Распределение случаев РМЖ по 40 гистологическому варианту опухоли в I и II группах представлено в таблице 2. Таблица 2 Распределение больных в зависимости от гистотипа I группа Гистологический вариант опухоли II группа Количество биоптатов абс. % абс. % 56 84 34 74 Инвазивный дольковый рак 8 12 8 18 Медуллярный рак 1 1 1 2 Тубулярный 2 3 0 0 Миоэпителиальная карцинома 0 0 1 2 0 0 2 4 67 100 46 100 Инвазивный рак неспецифического типа (протоковый рак) Инвазивный смешанный рак неспецифического типа Всего Степень злокачественности опухоли была определена в 96% случаев РМЖ. В большинстве наблюдений (79% и 83% в I и II группах, соответственно) обнаружена II степень злокачественности, реже наблюдалась III степень злокачественности – 13% и 8% случаев, I степень злокачественности отмечена лишь в 3 и 7% случаев инвазивного РМЖ (табл. 3). Таблица 3 Распределение больных с инвазивным РМЖ по степени злокачественности I группа Степень злокачественности опухоли I II группа Количество наблюдений абс. % абс. % 2 3 3 7 41 II 53 79 38 83 III 9 13 4 8 Нет данных 3 4 1 2 Всего 67 100 46 100 Биологический подтип опухоли определялся на основании суррогатных иммуногистохимических маркеров в соответствии с рекомендациями St Gallen International Breast Cancer Conference, 2013, в I группе – с операционного материала, во II группе – с материала core-биопсии: 1. Люминальный А подтип: ЭР+, ПР+, Her2 - , Ki67 <20%; 2. Люминальный В Her2-негативный подтип: ЭР+, ПР+, Her2 – , Ki67 ≥20% и ЭР+, ПР–, Her2 – , Ki67 <20%; 3. Люминальный В Her2-позитивный подтип: ЭР+, ПР+, Her2 + , Ki67 любой; 4. Her2-позитивный подтип: ЭР –, ПР –, Her2 + , Ki67 любой; 5. Трижды-негативный подтип: ЭР –, ПР – , Her2 – , Ki67 любой. Наиболее часто опухоли принадлежали к люминальному А подтипу (51% и 44% случаев в I и II группах, соответственно), на 2-ом месте – к люминальному В Her2-негативному подтипу (22% и 26%); люминальный В Her2 – позитивный подтип был представлен в 11% случаев в обеих группах, Her2 – позитивный подтип - в 7% и 2% случаев, трижды-негативный – в 9% и 17% в I и II группах, соответственно (табл. 4). Таблица 4 Распределение злокачественных опухолей молочной железы по биологическим подтипам (n=113) Биологический подтип Люминальный А Всего II I группа группа Количество больных абс. % абс. % абс. % 34 51 20 44 54 48 42 Люминальный В Her2-негативный 15 22 12 26 27 24 Люминальный В Her2-позитивный 7 11 5 11 12 11 Her2-позитивный 5 7 1 2 6 5 Трижды-негативный 6 9 8 17 14 12 Всего: 67 100 46 100 113 100 В целом в исследуемой популяции в зависимости от рецепторного статуса опухоли распределились следующим образом: 83% гормон-рецептор позитивных опухолей, 16% Her2-позитивных опухолей, 12% триждынегативных опухолей. У двух пациенток II группы рецепторный статус кардинально отличался в материале core-биопсии и операционном материале и был подтвержден в пересмотре: люминальный В подтип → трижды негативный подтип и трижды-негативный подтип → люминальный В подтип. Адъювантная терапия этим пациентка назначалась соответственно рецепторному статусу, полученному с операционного материала. Комплексы опухолевых клеток в лимфатических и кровеносных сосудах были обнаружены в 49 из 113 наблюдений (43%), встречаясь в 30% (16/54) случаев люминального А подтипа, в 48% (13/27) случаев люминального В Her2-негативного подтипа, в 92%(11/12) случаев люминального В Her2позитивного подтипа, 83% (5/6) случаев Her2-позитивного подтипа, 36% (5/14) случаев трижды-негативного подтипа. Вопрос о проведении адъювантной системной и лучевой терапии решался мультидисциплинарно совместно с химио- и лучевыми терапевтами «РОНЦ им.Н.Н.Блохина» и ГУЗ ОКОД г. Ульяновска на основании возраста, стадии, биологического подтипа, сопутствующей патологии, статуса ECOG. Лучевая терапия на молочную железу, грудную стенку и регионарные лимфоузлы проводилась в случае выполнения пациентке органосохранной операции, размерах опухолевого узла ≥5см, метастатического поражения ≥4 регионарных лимфоузлов. Наиболее часто больным I группы проводилось 43 адьювантная химиотерапия и гормонотерапии (25% случаев), пациентам II группы чаще всего проводилась только гормонотерапия (30% случаев), предположительно в связи с тем, что результаты двухнедельного теста на гормоночувствительность учитывались химиотерапевтом при выборе тактики адъювантной терапии (табл. 5). Таблица 5 Варианты адъювантной терапии, проводимой больным РМЖ I группа Варианты терапии II группа Количество больных абс. % абс. 5 7,5 1 2,2 15 22,4 5 10,9 3 4,5 0 0 3 4,5 1 2,2 1 1,5 4 8,7 Химиотерапия + таргетная терапия 1 1,5 1 2,2 Химиотерапия + гормонотерапия 17 25,4 8 17,4 Лучевая терапия + гормонотерапия 4 6 5 10,9 Химиотерапия 3 4,5 6 13 Гормонотерапия 14 20,9 14 30,4 Лучевая терапия 0 0 0 0 1 1,5 1 2,2 67 100 46 100 Химиотерапия +таргетная терапия+ гормонотерапия + лучевая терапия Химиотерапия + лучевая терапия + гормонотерапия Химиотерапия +таргетная терапия+ лучевая терапия Химиотерапия + лучевая терапия Химиотерапия + таргетная терапия+ гормонотерапия Адьювантная терапия не проводилась Всего: % 44 Определяющим фактором в выборе системной адъювантной терапии являлся биологический подтип. 2.2. Методы исследования 2.2.1. Морфологическое исследование опухолевой ткани молочной железы Биопсийный и операционный материал доставлялся в патоморфологическую лабораторию. Обработка операционного материала производилась в максимально короткие сроки от получения материала, время от момента его получения до момента фиксации не превышало 3 часов. Использовали стандартную гистологическую окраску (гематоксилином и эозином). Макроскопически проводилась оценка следующих параметров опухоли: локализация по квадрантам молочной железы, границы опухолевого узла (длина и ширина узла в мм) (рис. 7). А. Б. Рис. 7. Макрофото опухолевого узла (А) и core-биоптата (Б) РМЖ. Измерение длины узла и столбика опухолевой ткани с помощью линейки с точностью до миллиметра. С помощью стандартного инструментария из опухолевого узла и из лимфатических узлов подмышечной и подключичной жировой клетчатки вырезались кусочки площадью 1 – 1,5 см2 и толщиной 0,5–1 см. Далее кусочки помещали в банки с 10% раствором нейтрального забуференного формалина для фиксации в течение 24-48 часов. Кусочки промывали в 45 течение 2-4 часов в проточной воде и проводили обезвоживание в спиртах в автоматах для гистологической обработки МС-2. При этом кусочки помещались в специальную корзину прибора, которая последовательно проходила батарею спиртов повышающейся концентрации: 70° этилового спирта в течение 5 часов; 95° в течение 4 часов; 95° в течение 3 часов; 95° в течение 2 часов; 95° в течение 1 часа. Далее кусочки в корзине автомата перемещались в раствор спирта-бензола в соотношении 1:1 на 1-2 часа; в бензол I – на 2 часа и в бензол II – на 2 часа. Для пропитки парафином кусочки перемещались в раствор бензол-парафина в соотношении 1:1 в термостат на 1 час, затем последовательно в чистый парафин (на 1,5 часа и дважды на 1 час). На полуавтоматическом микротоме получали срезы толщиной 5-7 мк. Полученные срезы окрашивались гематоксилин-эозином. Микроскопические препараты исследовали методом обзорной микроскопии, которая осуществлялась на световых микроскопах Carl Zeiss (Германия) и Leica DME (Германия). При обзорной микроскопии оценивались следующие качественные патоморфологические параметры опухолевой ткани: гистологический вариант рака в соответствии с международной гистологической классификацией опухолей 2012 г., степень злокачественности, определение наличия инвазии в кровеносные и лимфатические сосуды стромы, определение наличия опухолевых эмболов в лимфатических сосудах, степень лечебного патоморфоза по Лавниковой во II группе [8]. Степень патоморфоза I констатировали в случае, если в паренхиме опухоли определяли несвойственный данному новообразованию полиморфизм и дистрофию опухолевых клеток, подавление митозов при отсутствии изменений в общей структуре опухоли. Ко II степени относили опухоли, в которых, несмотря на сохранение основной массы паренхимы, отчётливо видны очаги регрессивных изменений различного характера при наличии выраженных дистрофических изменений в клетках. При III степени лечебного патоморфоза отмечалось резкое нарушение структуры опухоли за 46 счёт фиброзного замещения, обширного некроза или круглоклеточной инфильтрации с сохранением остатков опухоли в виде единичных групп раковых клеток, обычно с выраженным дистрофическим полиморфизмом. IV степень патоморфоза диагностировали при полном отсутствии паренхиматозных раковых клеток (pCR). 2.2.2. Иммуногистохимическое исследование рецепторов Определение экспрессии ЭРα, ПР, HER2 и Ki67 в образцах злокачественных опухолей молочной железы проводилось по стандартной методике с использованием полуколичественного иммуногистохимического метода. Исследования выполнялись с помощью метода пероксидазной техники на парафиновых срезах толщиной 3-4 мкм. Срезы депарафинировали и проводили по спиртам нисходящей концентрации. Демаскировку осуществляли в растворе цитратного буфера 0,01 М рН 6,0 для рецепторов прогестерона и белка c-erb-B2/HER2/neu и в растворе ЭДТА 0,001 М рН 9,0 для рецепторов эстрогена и белка Ki-67 на водяной бане в течение 40 минут. Были использованы следующие моноклональные мышиные антитела: 1. «DAKO»: к рецепторам эстрогена (клон 1D5), прогестерона (клон PgR 636), белку Ki- 67 (клон MIB-1); поликлональные кроличьи антитела Her2 в разведении 1:700; 2. «CellMarque»: к рецепторам эстрогена (клон SP1), прогестерона (клон PgR SP42); Готовые препараты изучали на световых микроскопах Carl Zeiss (Германия) и Leica DME (Германия). Вид применяемых в исследовании антител в I и II группах представлен в таблице 6. 47 Таблица 6 Применяемые антитела для определения стероидных рецепторов Исследовательский Группа центр исследования ФГНУ «РОНЦ им.Н.Н. Производитель применяемых антител, (абс., %) DAKO Cell Marque II группа 0 30 (100) Блохина» I группа 1 (1) 66 (99) ГУЗ ОКОД II группа 16 (100) 0 Для определения уровня экспрессии ЭР и ПР использовалась полуколичественная система «Allred Scoring Guidline» оценки процента окрашенных клеток (proportion score, PS) и интенсивности окраски клеток (intensity score, IS), которые затем суммировались: TS (total score) = PS + IS. Процент окрашенных клеток оценивался в баллах: 0 – 0% клеток, 1 – 0,1-1% клеток, 2 – 2-10% клеток, 3 – 11-33% клеток, 4 – 34-66% клеток, 5 – 67-100% клеток. Интенсивность окрашивания оценивалась в баллах: 0 – отсутствие окрашивания, 1 – слабое окрашивание, 2 – умеренное, 3 – выраженное окрашивание. Возможные варианты Allred score: 0 (ЭР/ПР – негативная опухоль), 2 – 4 (умеренно и высоко ЭР/ПР – позитивная опухоль), 5 – 8 (высоко ЭР/ПР – позитивная опухоль) [20]. На рис. 8 представлена типичная картина высоко – ЭР – позитивного рака молочной железы. 48 Рис. 8. Экспрессия эстроген-рецептора в опухолевой ткани трепан-биоптата РМЖ, х200. ЭР= 7 баллов (85%). Для оценки уровня экспрессии HER-2 рецепторов оценивалось наличие мембранного окрашивания (полное, неполное), интенсивность окрашивания. Оценка производилась в баллах в соответствии с правилами HercepTest [77]. Оценка результатов реакции проводилась с помощью балльной шкалы оценки – 0, 1+, 2+, 3+, разработанной производителем теста и одобренной FDA: 0 – при полном отсутствии продукта реакции или выявлении его на мембранах менее чем 10% клеток опухоли; 1+ – при незначительном количестве продукта реакции на части мембраны более чем 10% клеток опухоли; 2+ – при умеренном количестве продукта реакции на мембранах более чем 10% клеток опухоли; 3+ – при наличии ярко выраженного продукта реакции на протяжении всей мембраны клетки при окрашивании более чем 10% клеток опухоли. При значении 2+ результат расценивался как сомнительный и проводилась FISH- реакция. Индекс пролиферации Ki-67 (%) вычислялся двумя методиками: 1. Визуально (ФГБНУ «РОНЦ им. Н.Н. Блохина») путем подсчета количества иммунопозитивных ядер к общему количеству ядер. Пролиферативную активность клеток определяли по пролиферативному показателю Ki-67 по формуле: I Ki67% = ( ( ) ) 49 Подсчет производился не менее чем в 10 полях зрения. С помощью компьютерного анализатора изображения 2. "ImmunoRatio" (ГУЗ ОКОД) был произведен автоматический подсчёт индекса Ki-67 как соотношение площади окрашенных ядер к площади всех ядер, выраженное в процентах. Пороговым значением было принято значение Ki67 равное 20%. При значении менее 20% опухоль обладает низкой пролиферативной активностью, ≥20% - высокой. На рис. 9 представлена картина экспрессии Ki-67 в активно пролиферирующей опухоли молочной железы. Рис 9. Экспрессия индекса пролиферативной активности в трепан-биоптате РМЖ, х200. Ki-67= 45%. Для минимизации фактора субъективной оценки был выполнен пересмотр ряда препаратов патоморфологической ФГНУ лаборатории «РОНЦ ГУЗ им. ОКОД Н.Н. с Блохина» в использованием компьютерной программы "ImmunoRatio" (табл. 7). 50 Таблица 7 Повторное определение значения Ki67 c использованием компьютерной программы "ImmunoRatio" I группа Показатель Ki67 II группа Количество пациентов абс. % абс. % 17 25 15/30 core-биопсий 50 18/30 – операционный материал 60 Пересмотр Ki67 с использованием методики " ImmunoRatio" позволил выявить расхождение уровня экспрессии боле, чем на 5% в 31/50 (62%) случаях. Клинически значимое расхождение было зарегистрировано в 3/17 (18%) случаев в I группе и 3/15 (20%) наблюдений II группы. Данные опухоли были переклассифицированы из люминального А в люминальный В подтип, однако с учетом того, что пересмотр был произведен спустя 6 мес. после хирургического лечения, на терапевтическую тактику полученные результаты не повлияли. В анализ результатов исследования принимаются результаты Ki67, полученные с использованием автоматической методики подсчёта с помощью программы “ImmunoRatio”. 2.2.3. Определение уровня экспрессии ЭРα и ЭРβ методом проточной цитофлоурометрии После получения одноклеточных суспензий из опухолевых образцов, фиксированных в 4% растворе формальдегида, и пермеабилизации клеток в течение 20 мин. в 0,1% растворе Triton X-100 ("Sigma-Aldrich", США), клетки инкубировали в течение ночи (около 15 час.) с первичными моноклональными антителами к ЭРα (клон SP1, "Abcam", Великобритания) и 51 затем – в течение 1,5 час с вторичными антителами, конъюгированными с флуоресцентным красителем DyLight 650 (Великобритания). В качестве контроля использовали клетки после инкубации в течение 1,5 час. только с вторичными антителами. Для удаления из анализа дебриса и эритроцитов клетки инкубировали в течение 15 мин со специфическим красителем ДНК Hoechst 33258 ("Sigma-Aldrich", США) в концентрации 1,2 мкг/мл. В анализ включали только клетки с окрашенными ядрами, исключая клеточные конгломераты, которые выводились из анализа путём дополнительного гейтирования. Измерение флуоресценции проводили на проточном цитофлуориметре FACSCanto II ("Becton Dickinson", США) с применением программного обеспечения FACSDiva 6.0. Регистрацию сигнала флуоресценции красителей DyLight 650 и Hoechst 33258 проводили по параметру APC-A и Pacific Blue соответственно. Значение порога по параметру FSC-A составляло 12,5 тыс., показатель "количество событий/сек" – средний, число анализируемых событий – 5000. Интенсивность флуоресценции клеток рассчитывали с помощью программы WinMDI 2.9, количество специфически флуоресцирующих клеток – с помощью теста Колмогорова-Смирнова, включённого в программу FlowJo 7.6 ("TreeStar", США). Для контроля активности антител (рефересный положительный контроль) при исследовании каждого образца опухоли использовали клетки монослойной культуры рака молочной железы человека линии MCF7. В работе определены следующие показатели экспрессии ЭРα. Уровень экспрессии – количество клеток (%), специфическая флуоресценция которых после инкубации с моноклональными антителами к ЭРα превышает показатель контроля (вторичные антитела). Интенсивность экспрессии (усл.ед.) – отношение средней интенсивности клеток после инкубации с моноклональными антителами к флуоресценции клеток после инкубации только с вторичными антителами. Схематически алгоритм 52 иммунофлуоресцентного анализа статуса ЭРα с привлечением проточной цитофлуориметрии представлен на рис. 10. Уровень экспрессии Эрα (%) Специфическая флуоресценция клеток относительно контроля Контроль (вторичные антитела) Количество клеток Доля клеток, экспрессирующих ЭРα Специфическая флуоресценция Интенсивность флуоресценции, усл. ед. Интенсивность экспрессии ЭРα: Низкая – ≤ 2 Высокая – > 2 Высокая Параметры экспрессии ЭРα оцениваются с помощью статистического критерия Колмогорова-Смирнова, встроенного в программу FlowJo Рис. 10. Параметры иммунофлуоресцентной оценки статуса ЭРα с привлечением проточной цитофлуориметрии Определение экспрессии ЭРβ проводилось по аналогичной методике, с использованием следующих антител: мышиные моноклональные антитела IgG клона 14C8 (ab288, Abcam, Великобритания), вторичные – антитела, конъюгированные с флуоресцентным красителем DyLight 650 (ab98729, "Abcam", Великобритания). Суммарное количество исследованных препаратов первичной опухоли у больных РМЖ различными методами представлено в таблице 8. Таблица 8 Суммарное количество исследованных образцов рака молочной железы Группа Медицинское Метод исследования вмешательство исследования I Количество больных абс. % Оперативное Гистологический 67 100 вмешательство ИГХ 67 100 53 (радикальная ПЦФ селективные мастэктомия/ ЭР 67 100 Гистологический 46 100 ИГХ 46 100 ПЦФ селективные 35 76 радикальная резекция) II Core-биопсия ЭР Оперативное Гистологический 46 100 вмешательство ИГХ 46 100 (радикальная ПЦФ селективные 29 63 мастэктомия/ ЭР радикальная резекция) 2.2.4 Статистическая обработка полученных данных Для признаков нормального, с распределением, рассчитывали медиану, значимо квартили отличающимся и от применяли непараметрические методы сравнения несвязанных признаков (Kruskal-Wallis Anova & Median test при количестве сравниваемых групп более двух и MannWhitney при сопоставлении двух групп). Для связанных значений применяли критерий Wilcoxon matched pairs test. При сравнении частот строили таблицы сопряженности признаков. Для расчета р использовали точный критерий Фишера (при небольших объемах групп) и непараметрический критерий 2. Для частот, характеризующих чувствительность и специфичность, рассчитывали 95% доверительные интервалы. Различия считали статистически значимыми при р<0,05. 54 Проводили корреляционный анализ Pearson (Spearman для непараметрических данных) с расчетом коэффициента корреляции и уровня его значимости. Рассчитывали коэффициент конкордации для параметров, оцененных различными методами. При выборе статистических процедур учитывались методологические требования Международного конгресса по гармонизации GGP “Статистические принципы для клинических исследований” [65]. Все вычисления проводили на персональном компьютере с помощью математических пакетов «STATISTICA» и SPSS в отделе информационных технологий ФГБНУ «РОНЦ им. Н. Н. Блохина». 55 ГЛАВА 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ 3.1. Экспрессия ЭРα и ЭРβ в ткани рака молочной железы и взаимосвязь их экспрессии с клиническими параметрами и морфологическими характеристиками опухоли Для оценки взаимосвязи экспрессии и ко-экспрессии ЭРα и ЭРβ с клинико-морфологическими характеристиками использовались: 3. данные анализа биоптатов операционного материала и клинические данные пациенток I группы (без предоперационного курса гормонотерапии) (n=67); 4. данные анализа нативного материала core-биопсий и клинические данные пациенток II группы (с предоперационным курсом гормонотерапии) (n=46). Экспрессия ЭРα и ЭРβ была изучена у 102 имеющихся из 113 опухолевых образцов данных групп. Экспрессия ЭРα была выявлена в 78 (76,5%) опухолевых образцах. Практически у каждой четвертой пациентки (23,5%) экспрессия ЭРα отсутствовала (табл. 9). Таблица 9 Отсутствие экспрессии ЭРα и ЭРβ в опухолевой ткани исследуемой группы Экспрессия (%) Показатель Количество Частота больных отсутствия экспрессии Медиана; квартили Пределы M± ЭРα 102 24 (23,5%) 37,5; 27-47 16-66 37,8±13,4 ЭРβ 102 2 (2,0%) 39,5; 29-52 15-74 40,6±13,4 Медиана уровня экспрессии в группе ЭРα+ опухолей составила 37,5%. В 50% случаев экспрессия ЭРα была представлена в диапазоне 20-40% (рис. 11). 56 ЭР альфа K-S d=,10174, p> .20; Lilliefors p<,05 Expected Normal 30 25 Частота, абс. 20 15 10 5 0 10 20 30 40 50 60 70 единицы измерения Рис. 11. Распределение наблюдений по уровню экспрессии ЭРα. Экспрессия ЭРβ была выявлена в 100 (98%) опухолевых образцах, медиана уровня экспрессии составила 39,5%. В 48% случаев экспрессия ЭРβ находилась в диапазоне 20-40% (рис. 12). Histogram: ЭР бета K-S d=,05607, p> .20; Lilliefors p> .20 Expected Normal 35 30 No. of obs. 25 20 15 10 5 0 -10 0 10 20 30 40 50 60 70 80 X <= Category Boundary Рис. 12. Распределение наблюдений по уровню экспрессии ЭРβ. Экспрессия ЭРα и ЭРβ отсутствовала (ЭРα-/ЭРβ-) в опухолевой ткани только одной пациентки (1%), ко-экспрессия ЭРα и ЭРβ (ЭРα+/ЭРβ+) была описана у 77 пациенток (75%), изолированная экспрессия ЭРβ (ЭРα-/ЭРβ+) – у 23 (23%), изолированная экспрессия ЭРα (ЭРα+/ЭРβ-) – у 1 пациентки (1%) (рис. 13). 57 1% 1% 23% 75% ЭРα-/ЭРβЭРα-/ЭРβ+ ЭРα+/ЭРβ+ ЭРα+/ЭРβ- Рис. 13. Изолированная экспрессия и ко-экспрессия ЭРα и ЭРβ в ткани РМЖ. В соответствии с рассчитанными медианами по позитивным случаям экспрессии выделены два уровня экспрессии маркёров: 1. низкий уровень экспрессии: ЭРα и ЭРβ выявлены в <40% опухолевых клеток; 2. высокий уровень экспрессии: ЭРα и ЭРβ выявлены в ≥40% опухолевых клеток. При анализе положительных случаев экспрессии ЭРα низкий уровень экспрессии ЭРα был зарегистрирован у 43 пациенток (55%), высокий – у 35 (45%) из 78 случаев. Низкий уровень экспрессии ЭРβ был зарегистрирован у 50 пациенток (49%), высокий – у 50 (49%). В группе ЭРα+ опухолей не установлено корреляционной зависимости с экспрессией ЭРβ (rs=0,1; р=0,3) (рис. 14). 58 Больные РМЖ r = 0,12 80 70 ЭР бета + (баллы) 60 50 40 30 20 10 10 20 30 40 50 60 95% confidence 70 ЭР альфа + (баллы) Рис. 14. Распределение ЭРα+ случаев по уровню экспрессии ЭРβ. Однако частотный анализ показал, что в группе ЭРα- опухолей высокие значения ЭРβ (40%) встречаются более чем в 2 раза реже по сравнению с группой ЭРα+ опухолей (р=0,025). Так, из 24 пациенток с ЭРα- статусом опухоли высокие значения ЭРβ (≥40%) выявлены только в 20,8% случаев (табл. 10), причем экспрессия ЭРβ≥50% в данной группе была выявлена только в 4,17% случаев, а у 50% обнаружены минимальные значения позитивных ЭРβ (менее 30 %) (рис. 15). В группе ЭРα+ опухолей высокая и низкая экспрессия ЭРβ встречалась в 57,7% и 42,3% случаев, соответственно. Таблица 10 Экспрессия ЭРβ при различном статусе ЭРα Группы (n) Уровень экспрессии ЭРβ <40% 40% ЭРα- (24) 19 (78,2%) 5 (20,8%) ЭРα+ (78) 33 (42,3%) 45 (57,7%) 52 50 Всего р* р=0,025 * достоверность различия между частотой встречаемости 59 4,17% 4,17% 16,67% 50% 25% ЭРβ 0 ЭРβ 0-29 ЭРβ 30-39 ЭРβ 40-49 ЭРβ >50 Рис. 15. Экспрессия ЭРβ в группе ЭРα- опухолей. Результаты частотного теста были подтверждены дисперсионном анализом: медиана экспрессии ЭРβ составила 43% в группе ЭРα+ опухолей и 28,5% − в группе ЭРα- (р<0,0001) (рис. 16). Больные РМЖ 80 70 60 ЭР бета 50 40 30 20 10 РЭ+ РЭ- ЭР альфа позитивные негативные медиана 25%-75% пределы Рис. 16. Статистические оценки экспрессии ЭРβ в группах ЭРα+ и ЭРαопухолей РМЖ. С помощью критерия хи-квадрат была доказана связь уровня экспрессии ЭРα и возраста (р=0,03). При увеличении возраста увеличивалась доля случаев с высокой экспрессией ЭРα (≥40%) в опухолевом узле, достигая максимума в возрастной группе 60-69 лет, в которой высокий уровень 60 экспрессии ЭРα наблюдался в половине случаев (табл. 11). Исключением являлась возрастная группа 70 лет и старше, где доля высоких уровней ЭРα составила всего 35,7%, что, вероятнее всего, объяснимо малой выборкой (n=14). Связи возраста с уровнем экспрессии ЭРβ получено не было (р>0,05). Таблица 11 Экспрессия ЭРα и возраст Фактор Градация N Возраст, лет <40 40-49 50-59 60-69 70 3 27 34 24 14 Частота, абс. (%) ЭРαЭРα<40 ЭРα≥40 1 (33,33) 1 (33,3) 1 (33,3) 4 (14,81) 19 (70,37) 4 (14,81) 12 (35,29) 9 (26,47) 13 (38,24) 5 (20,83) 9 (29,17) 12 (50) 2 (14,29) 7 (50) 5 (35,71) р* 0,03 * достоверность различия между частотой встречаемости Не установлено корреляционной зависимости между экспрессией ЭРα, ЭРβ и размером опухолевого узла в сантиметрах (р=0,7 и р=0,08, соответственно). При использовании частотного теста также не было обнаружено взаимосвязи между размером опухолевого узла по системе TNM с наличием и уровнем экспрессии ЭРα и ЭРβ (р>0,05). В наиболее многочисленных группах Т1 и Т2 (36/102 – 35% и 57/102 – 56%) ЭРα+ опухоли зарегистрированы в 78% и 75% случаев, соответственно. Из них ЭРα<40% – в 44% и 38%, ЭРα ≥40% – в 33% и 36%. ЭРα- опухоли были зарегистрированы в 22% и 25% при Т1 и Т2. Низкая экспрессия ЭРβ<40% - в 47% и 47%; экспрессия ЭРβ≥40% - в 47% и 53% случаев при Т1 и Т2, соответственно (рис. 17). 61 ЭРβ+≥40% 47,22 ЭРβ+<40% 47,37 47,22 62,63 36,84 33,33 ЭРα+≥40% 38,6 44,44 ЭРα+<40% T2 T1 24,56 22,22 ЭРα- 75,44 77,78 ЭРα+ 0 20 40 60 % случаев 80 Рис. 17. Экспрессия ЭРα, ЭРβ и их уровень при Т1 и Т2. Медианы ЭРα в группах Т1ЭРα+ и Т2ЭРα+ составили 37 и 38%, медианы ЭРβ в группах Т1ЭРβ+ и Т2ЭРβ+ – 39% и 41% (р>0,05). Не выявлено корреляционной зависимости между количеством пораженных лимфоузлов и наличием экспрессии ЭРα (р=0,09), ее уровнем (р=0,2), уровнем экспрессии ЭРβ (р=0,07). Достоверной корреляционной зависимости между наличием экспрессии ЭРα и ЭРβ и стадией по TNM получено не было (р=0,16 и р=0,18, соответственно). Частотный и дисперсионный анализы также не показали связи уровня экспрессии ЭРα и ЭРβ со стадией (p>0,005). Лифоваскулярная инвазия была обнаружена в препаратах 49 из 102 пациенток (48%). Методом частотного анализа достоверной взаимосвязи между определением опухолевых эмболов в лимфатических и кровеносных сосудах и наличием экспрессии ЭРα (р=0,2), уровнями экспрессии ЭРα (р=0,19) и ЭРβ (р=0,27) выявлено не было. Отсутствие связи было подтверждено медианным тестом: р=0,3 и р=0,8, соответственно. Мультицентрическая форма роста была зарегистрирована у 45 из 102 пациенток (44%); достоверной корреляционной зависимости с уровнями экспрессии ЭРα и ЭРβ также получено не было (р>0,05). 62 Индекс пролиферации Ki67 был оценен у 113 пациенток, из них у 59% (67/113) Ki67 был менее 20%, медиана составила 18% (рис. 18). Histogram: Ki-67 (%) K-S d=,22442, p<,01 ; Lilliefors p<,01 Expected Normal 80 70 60 No. of obs. 50 40 30 20 10 0 -20 0 20 40 60 80 100 X <= Category Boundary Рис. 18. Распределение наблюдение по индексу пролиферации Ki67. Методом частотного анализа показана достоверная связь между наличием экспрессии ЭРα и пролиферативной активностью опухоли (р=0,001). Из 67 проанализированных образцов с низким уровнем Ki67 (<20%) экспрессия ЭРα была выявлена в 90% случаев, а при высоких значениях Ki67 частота ЭРα+ случаев снижалась до 57,1%. А в группе ЭРαопухолей высокие уровни Ki67 встречались в 4 раза чаще по сравнению с группой ЭРα+ (рис. 19). 63 90 100 % случаев 80 57,14 60 ЭРα+ 42,86 ЭРα- 40 10 20 0 Ki67<20% Ki67≥20% Рис. 19. Экспрессия ЭРα при различной пролиферативной активности опухоли. Произведен анализ не только наличия экспрессии ЭРα, но и ее уровня. Достоверной связи уровня экспрессии ЭРα с Ki67 частотным анализом показано не было, однако при высоких уровнях Ki67 только 23,8% опухолей имели высокий уровень экспрессии ЭРα (≥40%), в то время как в группе с низким Ki67 высокий уровень ЭРα был зарегистрирован в 41,6% случаев. Достоверной зависимости между уровнем экспрессии ЭРβ и пролиферативной активностью опухоли показано не было (р=0,26) (рис. 20). 50% 50% Ki67≥20% 23,81% 76,19% ЭРβ<40% 48,33% 51,67% 41,67% 58,33% Ki67<20% 0 20 40 % случаев 60 ЭРβ≥40% ЭРα≥40% ЭРα<40% 80 Рис. 20. Уровни экспрессии ЭРα и ЭРβ при различной пролиферативной активности РМЖ. 64 Выявлена достоверная корреляционная зависимость Ki67 с возрастом (р=0,03). Дисперсионный анализ также выявил тенденцию снижения медианы Ki67 по мере увеличения возраста (р=0,2) (рис. 21). Больные РМЖ 100 90 80 70 Ki-67 (%) 60 50 40 30 20 10 0 -10 3 4 5 6 7 медиана 25%-75% пределы десятилетие жизни в момент выявления РМЖ Рис. 21. Статистические оценки Ki67 в различных возрастных группах. Выявлена прямая корреляционная зависимость между размером опухолевого узла и уровнем Ki67 (p=0,04). Дисперсионный анализ показал, что медиана Ki67 недостоверно увеличивается при увеличении размера узла (p>0,05), увеличении количества пораженных лимфоузлов (p>0,05) и достоверно увеличивается при распространенных стадиях (р=0,02) с 14% при I стадии до 39% при IIIС стадии (табл. 17). При IIIB стадии медиана Ki67 17% не соответствует установленной тенденции, вероятно в связи с малочисленностью представленной группы. Было выявлено достоверное увеличение медианы Ki67 c 16% до 27% в группе опухолей с наличием лимфоваскулярной инвазии (р=0,03, MannWhitney U Test). Выявлены высокозначимые различия медианы Ki67 при различной степени злокачественности опухоли: медиана Ki67 в группе G1 составила 8%, G2 – 17%, G3 – 50% (p<0,0001) (рис. 22). 65 Больные РМЖ 100 90 80 70 Ki-67 (%) 60 50 40 30 20 10 0 медиана 25%-75% пределы -10 1 2 3 G Рис. 22. Статистические злокачественности РМЖ. оценки Ki67 при различной степени При использовании частотного анализа не было показано связи гистологического варианта опухоли с Ki67 (р>0,05). Выявлено достоверное увеличение медианы Ki67 при наличии гиперэкспрессии Her2 в опухоли: с 15% при Her2-0 до 40% при Her2-3+ (р=0,02) (рис. 23). Больные РМЖ 100 90 80 70 Ki-67 (%) 60 50 40 30 20 10 0 -10 0 1+ 2+ 3+ медиана 25%-75% пределы Her2-neu (баллы) Рис. 23. Статистические оценки Ki67 при различном Her2-статусе опухоли. Получено высокодостоверное различие медианы Ki67 в группах различного биологического подтипа: минимальная медиана Ki67 13% была зарегистрирована в группе люминального А подтипа, максимальная - 50%, в группе трижды-негативного подтипа (р<0,0001) (рис. 24). 66 Больные РМЖ 100 90 80 70 Ki-67 (%) 60 50 40 30 20 10 0 -10 Lum A Trip-neg LumB LumBHer2+ Her2+ медиана 25%-75% пределы Подтип Рис. 24. Статистические оценки Ki67 в группах различного биологического подтипа опухоли. Результаты дисперсионного анализа по оценке связи уровня Ki67 c клинико-морфологическими параметрами приведены в сводной таблице 12. Таблица 12 Результаты дисперсионного анализа по оценке связи Ki67 с клиникоморфологическими параметрами Фактор Градац ия Стадия по TNM I IIA Лимфоваскулярная инвазия Степень злокачественности Her2 N 31 48 IIB IIIA IIIB IIIC есть нет 20 6 6 2 49 63 G1 G2 G3 0 1+ 5 90 13 29 43 Медиана; квартили 14; 12-19 18; 12,547,5 27; 17-36 28,5; 16-40 17; 5-18 39; 18-60 27; 16-40 16; 12-30 8; 6-8 17; 13-30 50; 36-70 15; 12-30 16; 12-30 Ki67 (%) Пределы M± 2-80 6-90 20,8±20,5 30,8±23,5 7-70 12-65 3-70 18-60 3-85 2-90 27,6±15,2 31,7±19,2 21,7±24,6 39±29,7 31,1±22 24,3±20,7 6-28 2-80 18-90 6-90 2-80 11,2±9,4 24,9±19,1 53±24 23,5±21,3 23,3±19,2 р 0,02 0,03 <0,0001 0,02 67 2+ 29 18; 16-45 6-85 31,6±23,6 3+ 12 40; 21-54 17-70 39,4±19,4 Биологический Lum A 54 13; 8-16 2-19 13,4±6 <0,0001 подтип Lum В 27 13-85 40,3±20,4 35; 26-58 Her2Lum В 13 10-70 31,2±21,8 19; 16-40 Her2+ Her2+ 6 35; 22-40 20-48 33,3±11,1 Triple13 12-90 50,1±25 50; 30-70 neg Lum A – люминальный А подтип; Lum B – люминальный В подтип; Triple-neg – трижды-негативный подтип Корреляционной зависимости экспрессии ЭРα со степенью злокачественности получено не было (р=0,23). Частотный анализ не показал значимой связи уровней экспрессии ЭРα и ЭРβ и степени злокачественности (р>0,05), однако отмечена тенденция увеличения числа случаев ЭРαопухолей по мере нарастания степени злокачественности: с 0% при G1 до 38% при G3. Частота G3 в группах высокой и низкой экспрессии ЭРβ составила 38% и 62%, соответственно, G1 – 67% и 33% , G2 – 50% и 50%. Также можно отметить снижение частоты очень высоких уровней ЭРβ (≥52%) при увеличении степени злокачественности: при G3 данная Степень злокачественности экспрессия составила только 15,3% (рис. 25). 15,38% 23,08% 23,08% 3 0,00% 25,61% 23,17% 21,95% 26,83% 2 2,44% 1 38,46% 33,3% 33,3% 33,3% 0% 0,0% 0% 10% 52 и более 20% 40-51 30-39 30% <30 40% нет Рис. 25. Уровень экспрессии ЭРβ при различной степени злокачественности. 68 Отсутствие экспрессии ЭРα было зарегистрировано достоверно чаще при инвазивном раке неспецифического типа (25%), чем при дольковом (0%) (р=0,03). При дольковом раке высокая экспрессия ЭРα встречалась в 62%, в то время как при инвазивном раке неспецифического типа – только в 32% случаев (р=0,08). Медианы уровней экспрессии ЭРα отличались в группах инвазивного неспецифического и долькового рака – 37% и 47%, соответственно, однако полученные различия, также как и предыдущие, не достигли статистической значимости (р=0,14) (рис. 26). Больные РМЖ 70 60 ЭР альфа+ (баллы) 50 40 30 20 10 дольковый неспец типа гистологический вариант строения опухоли медиана 25%-75% пределы Рис. 26. Статистические оценки экспрессии ЭРα в группах инвазивного неспецифического и долькового рака. Медианы уровней экспрессии ЭРβ в группах инвазивного неспецифического и долькового рака практически не отличались и составили 38% и 40%, соответственно. Высокий уровень экспрессии ЭРβ был определен в 48% случаев люминального А (25/52) и люминального В Her2-негативного подтипов (12/25), 82% - люминального В Her2-позитивного подтипа (2/6), 25% трижды-негативного (2/8), 33% - Her2-позитивного рака (2/6). Различия частоты встречаемости различных уровней экспрессии между указанными подтипами оказались статистически не достоверными (р=0,4). Значимых 69 различий в медианах уровней экспрессии ЭРβ также получено не было (р>0,05). Не выявлено корреляционной зависимости гиперэкспрессии Her2 с экспрессией ЭРα (р=0,1), ЭРβ (р=0,97), ЭР по ИГХ (р=0,48). Однако частотный анализ показал, что в группе Her2-3+ наибольшая частота ЭРαслучаев - 45,45% и наименьшая частота случаев высокой экспрессии ЭРα≥40% − 9,09% (табл. 13). Таблица 13 Экспрессия ЭРα и Her2-статус Фактор Градация N Her2 0 1+ 2+ 3+ 24 40 27 11 Частота, абс. (%) ЭРαЭРα<40 ЭРα≥40 6 (25) 11 (45,83) 7 (29,17) 8 (20) 12 (30) 20 (50) 5 (18,52) 15 (55,56) 7 (25,93) 5 (45,45) 5 (45,45) 1 (9,09) р* 0,09 * достоверность различия между частотой встречаемости Эти данные подтверждаются результатами дисперсионного анализа. Выявлена тенденция к различию медианы ЭРα в группе Her2-3+ (22%) по сравнению с группами Her2-0 и Her2-1+ (33% и 43%, соответственно), р=0,1 (рис. 27). Больные РМЖ 70 60 ЭР альфа (%%) 50 40 30 20 10 0 1+ 2+ 3+ медиана 25%-75% пределы Her2 Рис. 27. Статистические оценки экспрессии ЭРα при различном статусе Her2. 70 Таким образом, не выявлено статистически значимой связи между уровнем экспрессии ЭРβ и всеми стандартными факторами прогноза. Тем не менее, выявлен ряд тенденций, свидетельствующих в пользу благоприятного прогностического значения экспрессии данного рецептора: низкая встречаемость высоких уровней ЭРβ (≥40%) в группе ЭРα- опухолей (20,8%) и при III степени злокачественности (38%). Наличие экспрессии ЭРα статистически значимо прямо коррелирует с дольковым гистологическим вариантом опухоли (р=0,03), низким Ki67 (р=0,001). Высокий уровень экспрессии ЭРα достоверно чаще выявляется у пациенток возрастной группы 60-69 лет (р=0,003). Также выявлена тенденция уменьшения числа случаев высокой экспрессии ЭРα (≥40%) по мере нарастания степени злокачественности опухоли, увеличения пролиферативной активности по показателю Ki67, при гиперэкспрессии Her2. Высокой прогностической информативностью обладает индекс пролиферативной активности Ki67, прямо коррелирующий с такими неблагоприятными характеристиками, как молодой возраст (р=0,03), бóльший размер опухолевого узла (р=0,04), распространенная стадия по системе TNM (р=0,02), высокая степень злокачественности (р<0,0001), наличие лимфоваскулярной инвазии (р=0,03) и агрессивные биологические подтипы (р<0,0001). 3.2. Оценка предикивной значимости экспрессии рецепторов стероидных гормонов в модели двухнедельного теста на гормоночувствительность В рамках чувствительности предоперационной опухоли к тестовой модели по определению гормонотерапии проводилась оценка следующих показателей: 1. Динамика изменения индекса пролиферации Ki67 относительно исходного уровня в опухолевом узле и метастатических лимфоузлах; 71 2. Динамика изменения индекса пролиферации Ki67 в группах различного биологического подтипа РМЖ; 3. Степень лечебного патоморфоза в опухолевом узле и метастатических лимфоузлах; 4. Динамика изменения уровней экспрессии ЭРα, ЭРβ, ЭРα и ПР по результатам ИГХ исследования. ЭРα, определяемый методом ИГХ далее обозначается как ЭР; 5. Прогностическая номограмма PEPI SCORE. 3.2.1.Динамика изменения индекса пролиферации Ki67 относительно исходного уровня в предоперационной тестовой модели по определению чувствительности опухоли к гормонотерапии Методом Wilcoxon Matched Pairs Test выявлено достоверное снижение Ki67 (↓Ki67) после 2-х недельного курса гормонотерапии (р=0,0003). У 3 пациенток с высокой степенью лечебного патоморфоза в опухолевом узле повторное ИГХ исследование не проводилось, и значение Ki67 после гормонотерапии было принято за 0. Снижение Ki67 в опухолевом узле относительного исходного уровня было зарегистрировано у 35 пациенток из 46 (76,1%), у 6 пациенток отмечено повышение Ki67 (16%) (↑Ki67), у 5 - Ki67 остался на прежнем уровне (10,9%) (рис. 28). 13,0% 10,9% 76,1% Cнижение Отсутствует Повышение Рис. 28. Общая динамика изменения Ki67 в исследуемой группе. 72 В процессе гормонотерапии медиана Ki67 снизилась с 17,5% до 9%(рис. 29). Больные РМЖ ДинамикаKi-67 (% ) Данные биопсии vs Оперативный материал 90 80 70 60 50 40 30 20 10 медиана 25%-75% пределы 0 -10 Ki- 6 7 ( % и ) Ki- 6 7 %о п е р Рис. 29. Динамика изменения Ki67 в процессе двухнедельного курса гормонотерапии. У 6 пациенток, не ответивших на гормонотерапию, повышение Ki67 по медиане составило 10%, тогда как снижение в группе 35 пациенток, ответивших на лечение, составило – 12,5%, пределы динамики сопоставимы, (р=0,3). Частота случаев снижения Ki67 относительно исходного уровня достоверно отличалась в различных возрастных группах (р=0,02). Наибольшее количество случаев снижения Ki67 было зарегистрировано в возрастных группах 60-69 лет – 88,27% (15/17) и >70лет - 100% (7/7). Не выявлено достоверной связи снижения Ki67 с размером опухолевого узла, метастатическом поражении регионарных лимфоузлов и наличием лимфоваскулярной инвазии (р>0,05). Можно предположить ассоциацию гистологического варианта с гормоночувствительностью опухоли: снижение Ki67 было зарегистрировано в 100% (3/3) случаев долькового рака, в то время как при инвазивном раке неспецифического типа только в 70,5% (24/34) (р=0,09). Гиперэкспрессия Her2 существенно снижает вероятность снижения Ki67, однако статистически значимого различия не достигнуто в связи с 73 малым количеством наблюдений (р=0,096). Процент снижения Ki67 был наименьшим (33,3%, 1/3) в случае наличия гиперэкспрессии Her2 (рис. 30). 100% % случаев 80% 80% 75% 83% 60% 33% 40% 20% 0% Her2 0 Her2 1+ Her2 2+ Her2 3+ Статус Her2 Рис. 30. Снижение Ki67 при различном Her2 статусе. Группами с высокой вероятностью снижения следует считать люминальный А и люминальный В Her2-негативный подтипы (р=0,003). Группами с наименьшей вероятностью снижения Ki67 следует считать трижды-негативный вариант и все группы с гиперэкспрессией Her2 (вероятность отсутствия снижения Ki67 в них составляет 71% и 43%, соответственно) (рис. 31). 74 95% Люминальный А 5% 67% Люминальный В Her2- 33% 57% Люминальный В Her2+ и Her2+ 43% 29% Трижды-негативный 71% 0% ↓Ki67 20% 40% 60% 80% 100% отсутствие ↓Ki67 Рис. 31. Динамика изменения Ki67 в группах различного биологического подтипа. Статус ЭРα был определен на 35 образцах материала core-биопсии, из них статус ЭРα был положительным в 74,3% случаев (26/35), экспрессия отсутствовала в 25,7% случаев (9/35). При использовании частотного анализа была показана достоверная взаимосвязь между экспрессией ЭРα в опухолевых клетках и снижением Ki67 (р=0,0003) (табл. 14). Таблица 14 Динамика изменения уровня Ki67 в зависимости от наличия или отсутствия экспрессии ЭРα Динамика изменения Ki67 Статус ЭРα Повышение Без Снижение динамики Количество пациентов, абс. (%) ЭРα+ 0 2 (7,7) 24 (92,3) ЭРα- 4 (44,44) 2 (22,22) 3 (33,33) Всего 4 (11,4) 4 (11,4) 27 (77,2) 75 При положительном статусе ЭРα снижение Ki67 было достигнуто в 92,3% случаев (24/26), Ki67 не изменялся у 2 пациенток (7,7%), повышения Ki67 не наблюдалось. При отсутствии экспрессии ЭРα снижение Ki67 наблюдалось только в 33,3% случаев (3/9), Ki67 не изменялся – у двух пациенток (22,2%), повышался в процессе гормонотерапии – у 4 (44,4%) (рис. 32). 92,3% ЭРα+ 7,7% 0,0% 33,3% ЭРα- 22,2% 44,4% 0% ↓Ki67 20% 40% 60% 80% отсутствие измений Ki67 100% ↑Ki67 Рис. 32. Динамика изменений Ki67 в зависимости от статуса ЭРα. Вероятность ответа на гормонотерапию определяется не только наличием экспрессии ЭРα в опухолевых клетках, но и ее уровнем. Выявлена достоверная зависимость снижения Ki67 от уровня экспрессии ЭРα (р=0,004). При высокой экспрессии ЭРα≥40% в 100% случаев (10/10) наблюдается снижение Ki67 (рис. 33), при значениях ЭРα<40% снижение Ki67 регистрируется в 87,5% случаев (14/16). 76 100% ЭРα≥40% 0 0 87,50% ЭРα<40% 12,50% 0 0% ↓Ki67 50% отсутствие измения Ki67 100% ↑Ki67 Рис. 33. Динамика изменения Ki67 в зависимости от уровня экспрессии ЭРα. Достоверной взаимосвязи между уровнем экспрессии ЭРβ и динамикой изменения Ki67 получено не было (р>0,005). Отмечено снижение Ki67 в группах как высокой, так и низкой экспрессии ЭРβ – в 75% (9/12) и 81% случаев (17/21), соответственно, в то время как повышение Ki67 в данных группах было зарегистрировано в 9,5% и 8% случаев, соответственно (табл. 15). Таблица 15 Динамика изменения уровня Ki67 в зависимости от уровня экспрессии ЭРβ Статус ЭРβ Динамика изменения Ki67 Повышение Без Снижение динамики Количество пациентов абс. (%) ЭРβ- 1 (50) 0 1 (50) ЭРβ <40% 2 (9,5) 2 (9,5) 17 (81) ЭРβ ≥40% 1 (8) 2 (17) 9 (75) 4 (11,5) 4 (11,5) 27 (77) Общее количество случаев Динамика изменения Ki67 в процессе гормонотерапии в зависимости от наличия и уровня экспрессии ЭР и ПР, определяемых иммуногистохимически, была оценена у 43 пациенток. 77 Стандартное иммуногистохимическое исследование также оказалось высоко предиктивным в оценке гормоночувствительности опухоли. Число случаев снижения Ki67 достоверно увеличивалось по мере увеличения суммарного балла по Allred (р=0,0005). При уровне экспрессии 8 баллов вероятность снижения Ki67 была максимальной и составила 95,24%, однако снижение Ki67 наблюдалось и при 0 баллах – в 22,22% случаев (рис. 34). ↓Ki67 22,22 4,76 12,50 16,67 отсутствие снижения или ↑Ki67 0 Баллы по Allred 8 20 7 6 95,24 87,50 83,33 50,00 50,00 40 60 77,78 80 100 % случаев 5 0 Рис. 34. Динамика изменения Ki67 в зависимости от уровня экспрессии ЭР в суммарных баллах по Allred. Тем не менее, следует считать, что метод ПЦФ обладает большей информативностью по сравнению со стандартным ИГХ исследованием, поскольку частота снижения Ki67 при высоком уровне ЭРα (≥40%), определяемым методом ПЦФ, составила 100%, в то время как при высоком уровне ЭР по Allred 6-8 баллов – 83-95%. Достоверной зависимости частоты снижения Ki67 от уровня экспрессии ПР показано не было (р=0,09), тем не менее, наибольшее количество случаев снижения Ki67 было зафиксировано при уровне экспрессии ПР 6-8 баллов по Allred (рис. 35). 78 83,33 100,00 87,50 ↓Ki67 50,00 46,15 16,67 0,00 отсутствие снижения или ↑Ki67 12,50 50,00 53,85 0 20 40 60 80 100 % случаев Баллы по Allred 8 7 6 5 0 Рис. 35. Динамика изменения Ki67 в зависимости от уровня экспрессии ПР по Allred. Одним из ключевых параметров, предопределяющих гормоночувствительность опухоли, является исходный уровень Ki67: при исходно низком уровне Ki67 (<20%) его снижение в процессе гормонотерапии наблюдалось в 88,46% случаев (23/26), при высоком – в 60% (12/20) (р=0,025). Динамика изменения Ki67 также определяется степенью злокачественности опухоли (р=0,034): при G1 снижение Ki67 было описано в 100% случаев (3/3), при G2 – в 79% (30/38), при G3 – только в 25% (1/4) (рис. 36). 79 100% 100% 88,46% 78,95% % случаев 80% 75% 60% 60% 40% 40% 25% 21,05% 20% 11,54% 0 0% Исходный Исходный уровень уровень Ki67 <20% Ki67 ≥20% G1 G2 ↑Ki67 или без динамики G3 ↓Ki67 Рис. 36. Динамика изменения Ki67 в зависимости от его исходного уровня и степени злокачественности. Таким образом, мы отобрали 4 ключевых фактора, определяющих гормоночувствительность опухоли: исходный уровень Ki67, рецепторный статус по данным ИГХ исследования, степень злокачественности и определяющий – уровень ЭРα по данным ПЦФ. При расслоении можно сделать вывод, что при исходно малых Ki67 и ЭРα+ статусе опухоли частота снижения Ki67 наибольшая и составляет 94,12%. При ЭРα+ статусе опухоли и исходно высоких значениях Ki67 гормоночувствительность опухоли несколько хуже – частота снижения Ki67 составила 85,71%. Большинство ЭР+ опухолей имело II степень злокачественности; в 95,5% случаев данной группы в случае наличия экспрессии ЭРα наблюдалось снижение Ki67(табл. 16). 80 Таблица 16 Динамика изменения Ki67 в зависимости от сочетания нескольких предиктивных признаков ЭРα статус Показатель ЭРα+ Ki67<20% Отсутствие снижения Ki67 (абс./%) 1 5,88% 1 14,29% 0 0% 1 4,5% 1 50% Ki67≥20% G1 G2 G3 Снижение Ki67 (абс./%) 18 94,12% 6 85,71% 1 100% 22 95,5% 1 50% Таким образом, все факторы влияют на гормоночувствительность опухоли, однако экспрессия ЭРα является определяющей. Индекс пролиферации Ki67 в метастатических лимфоузлах был оценен в 13 из 17 случаев (76,5%). В 10 случаях из 13 (77%) Ki67 в метастатических лимфоузлах не превышал Ki67 в первичной опухоли. Случаи, когда Ki67был выше в лимфоузле, чем в опухоли, - у пациентки люминального А подтипа с III степенью лечебного патоморфоза в опухолевом узле и I степенью лечебного патоморфоза в метастатическом лимфоузле, у пациентки Her2позитивного подтипа без лечебного патоморфоза в опухолевом узле и 2-х лимфоузлах, и пациентки люминальным В Her2-негативным подтипом с отсутствием экспрессии ПР, I степенью лечебного патоморфоза в опухолевом узле и лимфоузлах. Таким образом, ответ на терапию и биология первичного очага не всегда отражают биологию и ответ на терапию метастатического процесса и требуют дальнейшего изучения. 81 3.2.2. Динамика изменения индекса пролиферации Ki67 в группах различного биологического подтипа Клинически значимое снижение Ki67 на 50% и больше относительного исходного уровня было зарегистрировано у 23 пациенток из 46 (50%). Наибольшее количество случаев снижения Ki67≥50% было зарегистрировано в группе люминального А подтипа – 15 случаев из 20 (75%) (рис. 37). Ki67, % Люминальный А подтип 20 18 16 14 12 10 8 6 4 2 0 0 2 Время (недели) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Рис. 37. Динамика изменения Ki67 в группе люминального А подтипа ( - снижение Ki67 ≥ 50%; - снижение Ki67 < 50%; стабилизация или увеличение Ki67). В группе люминального В Her-2 негативного подтипа уменьшение пролиферативной активности опухоли в 2 раза и более было отмечено в 67% (8/12) случаев (рис. 38). 82 Люминальный В Her2-негативный подтип 80 70 Ki67, % 60 50 40 30 20 10 0 0 1 7 2 8 2 Время (недели) 3 4 9 10 5 11 6 12 Рис. 38. Динамика изменения Ki67 в группе люминального В Her2негативного подтипа ( - снижение Ki67 ≥ 50%; - снижение Ki67 < 50%; - стабилизация или увеличение Ki67). В обоих случаях увеличения Ki67 в группах люминального А и люминального В Her2-негативного подтипов (отмечены на рис. 37 и 38 красным), экспрессия ЭРα, определяемая методом ПЦФ, отсутствовала. В группах трижды-негативного подтипа, Her2-позитивного подтипа и в группе люминального В Her2-позитивного подтипа, несмотря на высокие уровни экспрессии ЭР и ПР, клинически значимого снижения Ki67 через 2 недели гормонотерапии не наблюдалось (рис. 39, 40). 83 Люминальный В Her2-позитивный и Her2-позитивный подтипы Ki67, % 80 60 40 20 0 0 2 Время (недели) 1 2 3 4 5 6 Рис. 39. Динамика изменения Ki67 в группах люминального В Her2позитивного и Her2-позитивного подтипов ( - снижение Ki67 < 50%; стабилизация или увеличение Ki67). - Трижды-негативный подтип Ki67, % 100 50 0 0 2 Время (недели) 1 2 3 4 5 6 7 8 Рис. 40. Динамика изменения Ki67 в группе трижды-негативного подтипа ( - снижение Ki67 < 50%; - стабилизация или увеличение Ki67). На рисунке 41 приведены фотографии опухолевого узла люминального В Her2-негативного подтипа пациентки С., 76 лет, отражающие снижение Ki67 на фоне двухнедельного приема тамоксифена. Ki67 снизился с 35% до 4-5%. 84 А. Б. Рис. 41. Пациентка С., 76 лет. А. Экспрессия индекса пролиферативной активности в опухолевой ткани core-биопсии РМЖ. Ki-67=35%. Б. Экспрессия индекса пролиферативной активности в опухолевой ткани в центральных отделах узла РМЖ после радикальной мастэктомии. Ki-67= 45%. На рисунке 42 приведены фотографии опухолевого узла люминального А подтипа пациентки И., 67, отражающие снижение Ki67 с 16-18% до 4-5%. А. Б. Рис. 42. Пациентка И., 67 лет. А. Экспрессия индекса пролиферативной активности в опухолевой ткани core-биопсии РМЖ. Ki-67= 16-18%. Б. Экспрессия индекса пролиферативной активности в опухолевой ткани в центральных отделах узла РМЖ после радикальной мастэктомии. Ki-67= 45%. 85 3.2.3 Степень лечебного патоморфоза в предоперационной тестовой модели по определению чувствительности опухоли к гормонотерапии Лечебный патоморфоз был описан в 43 опухолевых образцах из 46 (93%). Согласно результатам планового гистологического исследования, лечебный патоморфоз отсутствовал в 12 случаях (28%), I степень лечебного патоморфоза была описана в 18 случаях (42%), II – 8 (19%), III – 2 (5%), IV – 3 (7%) (рис. 43). Степень лечебного патоморфоза 5% 7% 28% 19% 42% 0 I II III IV Рис. 43. Степень лечебного патоморфоза в опухолевом узле после 2-х недельного предоперационного курса гормонотерапии, согласно результатам планового гистологического исследования. Был выполнен пересмотр 9 гистологических препаратов1: из них были пересмотрены два из трех случаев полного лечебного патоморфоза и случаи трижды-негативного рака с наличием признаков лечебного патоморфоза. 1 При тщательном пересмотре одного из случаев полного лечебного патоморфоза были выявлены единичные атипичные клетки и комплексы рака in situ, поэтому данные опухоли были переклассифицированы в группу лечебного патоморфоза III степени. В препаратах опухоли с IV степенью лечебного патоморфоза третьей пациентки элементов опухоли и признаков патоморфоза найдено не было. Однако в анализ включены результаты, зарегистрированные документально в плановых гистологических заключениях. 86 Высокая степень патоморфоза (III и IV) была зарегистрирована только в группе люминального А подтипа – в 26,2% случаев. При экспрессии ЭР 8 баллов по Allred лечебный патоморфоз отсутствовал только в 15% случаев (3/20). Наибольшее количество случаев без лечебного патоморфоза приходится на группу Her2+ опухолей (66,7%), несмотря на наличие экспрессии ЭР и ПР в группе люминального В Her2-позитивного подтипа (табл. 17). Патоморфоз I и II степени в группе трижды-негативных опухолей встречался в 62,5% случаев (5/8). ЭРβ был определен только в 3 из 8 образцов трижды-негативного рака. Во всех трех случаях экспрессия ЭРβ в материале core-биопсии была низкой (32-36%), повышалась в процессе гормонотерапии до 46-65%, снижения Ki67 зарегистрировано не было, в 1 опухолевом образце описаны признаки лечебного патоморфоза I степени. Таблица 17 Степень лечебного патоморфоза в группах различного биологического подтипа Биологический подтип Степень лечебного патоморфоза 0 I II III абс. % абс. % абс. % абс. % 4 21,1 6 31,6 4 21,1 2 10,5 3 Люминальный А подтип Люминальный В 1 9 9 82 1 9 IV 15,7 0 0 0 0 Her2Люминальный В 4 66,7 1 16,7 1 16,7 0 0 0 0 3 37,5 4 50 1 20 0 0 0 0 12 28 42 8 19 2 5 3 7 Her2+ и Her2+ Триждынегативный Всего 18 Выявлена прямая взаимосвязь степени лечебного патоморфоза в опухолевом узле и лимфатических узлах с динамикой изменений Ki67, 87 однако полученные различия не достигли статистической значимости (р=0,11) (табл. 18). При высокой степени лечебного патоморфоза (III, IV) снижение Ki67 было зарегистрировано в 80% случаев (4/5). Таблица 18 Динамика Ki67 при различной степени лечебного патоморфоза Степень лечебного Отсутствие патоморфоза снижения абс. (%) В опухолевом узле 0 5 (41,67) 1 4 (21,05) 2 0 3 1 (50) 4 0 Всего 10 В лимфоузлах 0 3 (72,86) 1 0 2 0 Всего 3 ↓Ki67, Ki67, абс. (%) Всего р* 0,11 7 (58,33) 15 (78,95) 7 (100) 1 (50) 3 (100) 33 12 19 7 2 3 43 4 (57,14) 6 (100) 2 (100) 12 7 6 2 15 * достоверность различия между частотой встречаемости ↓ - снижение На рисунках 44 и 45 представлены иллюстрации I степени лечебного патоморфоза люминального В рака молочной железы. 88 Рис. 44. Пациентка С., 76 лет. Фотография среза ткани опухолевого узла, окрашенного гематоксилин-эозином, после радикальной мастэктомии. Синяя стрелка – паренхима опухолевой ткани окрашена в фиолетовый цвет, сохранено около 50% опухолевой паренхимы. Красная стрелка – очаг склероза опухолевой ткани, как лечебный патоморфоз 1 степени. Рис. 45. Пациентка С., 76 лет. Инвазивный рак неспецифического типа с лечебным патоморфозом I степени (сохранено 50% опухолевой паренхимы), х50. На рисунках 46 - 48 представлены фотографии опухолевого узла с III степенью лечебного патоморфоза. На макропрепарате отмечается 89 характерная для склероза белесоватость, на микропрепаратах - выраженный склероз стромы, сохранено менее 10% опухолевой паренхимы. Рис. 46. Опухолевого узел РМЖ пациентки Б., 63 лет, после радикальной мастэктомии. Рис. 47. Инвазивный РМЖ после радикальной мастэктомии пациентки Б., 63 лет. Лечебный патоморфоз III степени (выраженный склероз стромы, сохранено менее 10% опухолевой паренхимы), х50. 90 Рис. 48. Пациентка Б., 63 лет. Инвазивный РМЖ, лечебный патоморфоз III степени (выраженный дистрофический полиморфизм опухолевых клеток в склерозированной строме), х200. На рисунках 49 и 50 представлены фотографии материала core-биопсии и операционного материала случая лечебного патоморфоза 4 степени пациентки инвазивным РМЖ на фоне двухнедельного приема тамоксифена. А. Б. Рис. 49. А. и Б. (два поля зрения). Пациентка Д., 62 лет. Инвазивный РМЖ неспецифического типа, G 2. Материал core-биопсии, х200. 91 А. Б. Рис. 50. А. и Б. (два поля зрения). Пациентка Д., 62 лет. Инвазивный РМЖ после радикальной мастэктомии. Очаги атипичного протокового фиброаденоматоза на фоне выраженного склероза (синяя стрелка) ткани молочной железы (лечебный патоморфоз 4 степени). 3.2.4 Динамика изменения уровня экспрессии рецепторов эстрогена и прогестерона в процессе гормонотерапии 3.2.4.1 Динамика изменения уровней экспрессии ЭРα и ЭРβ, определяемых методом ПЦФ Анализ динамики изменения уровня экспрессии ЭРα и ЭРβ проводился на имеющихся данных 29 парных образцов опухолевой ткани (core-биопсия и операционный материал). Анализ показал, что все позитивные случаи ЭРα остались позитивными после лечения, а из 9 первоначально негативных 5 (56%) поменяли свой статус на позитивный (табл. 19). Таблица 19 Core-биопсия ЭРα+ ЭРαВсего Динамика экспрессии ЭРα Операционный материал ЭРαЭРα+ абс., % абс., % 0 20 (100) 4 (44,44) 5 (55,56) 4 25 Всего р* 0,001 абс. 20 9 29 * достоверность различия между частотой встречаемости 92 Снижение уровня экспрессии ЭРα в группе исходно ЭРα+ опухолей было зарегистрировано в 10 случаях (34%), отсутствие динамики – в 4 (14%), повышение – в 15 (52%). Повышение уровня экспрессии в группе исходно ЭРα+ опухолей составило 7,5% по медиане. Проведенный анализ связи частоты различной динамики ЭРα (снижение/повышение/без динамики) не выявил ее зависимости с возрастом, размером опухолевого узла, статусом регионарных лимфоузлов, стадией, гистологическим вариантом, наличием лимфоваскулярной инвазии, Her2статусом, биологическим подтипом (р>0,05). Поэтому эти данные не требуют детального рассмотрения. Однако положительная динамика ЭРα наблюдалась достоверно чаще при снижении Ki67 (р=0,0012), что говорит о высокой предиктивной значимости динамики изменения данного маркера в процессе гормонотерапии (табл. 20). Таблица 20 Динамика изменения экспрессии ЭРα и Ki67 Динамика Ki67 ↓ ЭРα Отсутствие ↓Ki 67 ↓Ki 67 Всего абс., % 1 (14,29) 7 (35) 8 Динамика ЭРα ЭРα без ↑ЭРα динамики абс., % абс., % 4 (57,14) 2 (28,57) 0 13 (65) 4 15 р* Всего абс. 0,0012 7 20 27 * достоверность различия между частотой встречаемости ↓ - снижение; ↑ - повышение Wilcoxon Matched Pairs test выявил достоверное увеличение экспрессии ЭРβ в процессе двухнедельного курса гормонотерапии (р=0,0004). При этом медиана экспрессии ЭРβ увеличилась с 44% до 59% (рис. 51). 93 Больные РМЖ ЭР бета (%) Биопсия vs Оперативный метериал 80 70 60 50 40 30 20 10 медиана 25%-75% мин-макс 0 -10 ЭРб е т а биоп ЭРб е т а опер Рис. 51. Динамика изменения уровня экспрессии ЭРβ до и после лечения. Было отмечено достоверное увеличение уровня экспрессии ЭРβ: 1 случай нулевой экспрессии остался нулевым, 72% случаев низкой экспрессии (ЭРβ<40%) перешли в диапазон экспрессии ЭРβ≥40%, а 80% случаев высокой экспрессии остались в прежнем диапазоне (р=0,00001) (табл. 21). Таблица 21 Динамика изменения уровня экспрессии ЭРβ Core-биопсия ЭРβ 0 ЭРβ <40% ЭРβ≥40% Всего Операционный материал ЭРβ 0 ЭРβ <40% ЭРβ≥40% 1 (100) 0 0 0 5 (27,78) 13 (72,22) 0 2 (20) 8 (80) 1 7 21 Всего р* 1 18 10 29 0,00001 * достоверность различия между частотой встречаемости Снижение уровня экспрессии ЭРβ в процессе гормонотерапии было зарегистрировано в 4 случаях (14%), динамика отсутствовала – в 3 (10%), повышение ЭРβ было отмечено в опухолевой ткани 22 пациенток (76%). Не выявлено зависимости динамики изменения уровня экспрессии ЭРβ от возраста, размера опухолевого узла, статуса регионарных лимфоузлов, стадии, наличия лимфоваскулярной инвазии, гистологического варианта, степени злокачественности, Her2-статуса, биологического подтипа, исходного уровня ЭРβ, динамики изменения Ki67 (р>0,05). 94 Выявлена прямая корреляционная зависимость между изменениями уровней экспрессии ЭРα и ЭРβ (р=0,001) (рис. 52): при большем изменении ЭРα наблюдается и большее изменение ЭРβ, однако найденная закономерность применима только для исходно ЭРα+ опухолей. Больные РМЖ r =0,57; p=0,001 60 50 дельта ЭРбета 40 30 20 10 0 -10 -20 -40 -20 0 20 40 60 95% confidence 80 дельта альфа Рис. 52. Распределение случаев по уровню экспрессии ЭРα и ЭРβ. 3.2.4.2 Динамика изменения уровней экспрессии ЭР и ПР, определяемых методом ИГХ Динамика изменения уровня экспрессии ЭР оценена на имеющихся данных анализа 43 парных образцов опухолей ткани (core-биопсия и операционный материал). Повторное ИГХ исследование трех опухолевых образов с IV степенью лечебного патоморфоза не проводилось. Были рассмотрены динамические тенденции следующих параметров: суммарный бал по Allred, процент окрашенных клеток и интенсивность окрашивания ядер. В 53,5% случаев (23/43) наблюдалось снижение суммарного балла по Allred, в 9,3% случаев (4/43) – повышение, в 37,2% случаев (16/43) значение суммарного балла не изменялось. Наибольшее снижение достигало 6 баллов, а повышение – 3 балла. Абсолютная частота случаев с экспрессией ЭР 8 баллов по Allred в процессе гормонотерапии снизилась в 5 раз (рис. 53). 95 25 20 Частота, абс. 20 15 15 10 биопсия 9 9 9 операционный материал 7 5 5 3 0 0 0 0 1 4 2 2 3 4 5 6 7 8 ЭР (суммарный балл по Allred) Рис. 53. Динамика гормонотерапии. изменения уровня экспрессии ЭР в процессе В группе больных со снижением Ki67 снижение суммарного балла по Allred было зарегистрировано в 62,5% случаев, отсутствие изменения экспрессии ЭР – в 31,25%, повышение – в 6,25% (табл. 22). Однако все различия динамики изменения экспрессии ЭР в зависимости от динамики изменения Ki67 не были статистически значимыми (р=0,11). Таблица 22 Динамика изменения экспрессии ЭР и Ki67 Динамика Ki67 Отсутствие ↓Ki 67 ↓Ki 67 Всего Динамика ЭР, суммарный балл по Allred ↓ ЭР ЭР без ↑ЭР Всего динамики абс., % абс., % абс., % абс. 3 (27,27) 6 (54,55) 2 (18,18) 11 20 (62,5) 10 (31,25) 2 (6,25) 32 23 16 4 43 р* 0,11 * достоверность различия между частотой встречаемости ↓ - снижение; ↑ - повышение В процессе окрашенных гормонотерапии клеток (уровень наблюдалось экспрессии изменение ЭР): процента снижение было зарегистрировано в 39,5% случаев, повышение – в 21%, динамика 96 отсутствовала – в 39,5% случаев. Снижение процента окрашенных клеток также не обладало предиктивной информативностью в опухолевом ответе на гормонотерапию: в группе опухолей со снижением Ki67 снижение процента окрашенных клеток было зарегистрировано в 31,25% случаев (табл. 23). Таблица 23 Динамика изменения экспрессии ЭР и Ki67 Динамика Ki67 Отсутствие ↓Ki 67 ↓Ki 67 Всего Динамика ЭР, % окрашенных клеток ↓ ЭР (%) ЭР (%) без ↑ЭР (%) Всего динамики абс., % абс., % абс., % абс. 7 (63,64) 1 (9,09) 3 (27,27) 11 10 (31,25) 16 (50) 6 (18,75) 32 17 17 9 43 р* 0,052 * достоверность различия между частотой встречаемости ↓ - снижение; ↑ - повышение Проведено изучение изменения интенсивности окрашивания ядер опухолевых клеток в процессе гормонотерапии. Повышение интенсивности окрашивания было зарегистрировано в 2 случаях (4,65%), интенсивность окрашивания не менялась – в 18 случаях (41,86%), снижение интенсивности окрашивания на 1 балл – в 17 случаях (39,53%), снижение интенсивности окрашивания на 2 балла – в 6 случаях (13,95%). В группе опухолей со снижением Ki67 в 3,6 раза чаще выявляется снижение интенсивности окрашивания клеток – в 65,7% случаев (табл. 24). 97 Таблица 24 Динамика изменения экспрессии ЭР (интенсивность окрашивания ядер) и Ki67 Динамика Ki67 Отсутствие ↓Ki 67 ↓Ki 67 Всего, абс. Динамика ЭР, интенсивность окрашивания Всего ↓ на 2 ↓ на 1 Без ↑ балла балл динамики абс., % абс., % абс., % абс., % абс. 0 2 (18,18) 8 (72,73) 1 (9,09) 11 6 (18,75) 15 (46,88) 6 17 10 (31,25) 1 (3,13) 18 2 р* <0,05 32 * достоверность различия между частотой встречаемости ↓ - снижение; ↑ - повышение Таким образом, предиктивной значимостью обладает не уровень изменения экспрессии ЭР, а интенсивность окрашивания ядер. При исследовании препаратов с низкой интенсивностью окрашивания процент окрашенных клеток может субъективно занижаться из-за низкой интенсивности окрашивания. На рисунке 54 приведены фотографии опухолевого узла люминального В Her2-негативного подтипа пациентки С., 76 лет, иллюстрирующие снижение суммарного балла по Allred с 7 до 6 на фоне двухнедельного приема тамоксифена, причем уровень экспрессии повысился с 85% до 95%, а интенсивность окрашивания снизалась на 1 балл. 98 А. Б. Рис. 54. Пациентка С., 76 лет. А. Экспрессия ЭР в опухолевой ткани трепанбиоптата РМЖ, х200. ЭР = 7 баллов (85% (5) +2). Б. Экспрессия ЭР в опухолевой ткани узла РМЖ после радикальной мастэктомии, х200. ЭР = 6 баллов (95% (5) + 1). Динамика экспрессии ПР была оценена на материале опухолевых образцов 43 пациенток. Была отмечена тенденция снижения случаев отсутствия экспрессии ПР с 32,6% до 23,2% и повышение частоты случаев максимальной экспрессии (8 баллов по Allred) с 25,6% до 30,2% (р=0,01) (рис. 55). А. Б. ПР баллы (оперативный материал) 16 14 14 12 12 10 10 Частота, абс. Частота , абс. ПР баллы данные биопсии 16 8 8 6 6 4 4 2 2 0 0 2 4 5 ПР баллы 6 7 8 0 0 2 3 4 5 6 7 8 ПР (Баллы) Рис. 55. Распределение наблюдений по уровню экспрессии ПР в баллах по Allred. А. Материал core-биопсии. Б. Операционный материал. 99 Повышение суммарного балла по Allred после лечения было зарегистрировано в 15 (34,9%) наблюдениях, снижение - в 9 (20,9%) и в 19 случаях (44,1%) выявлено отсутствие изменение суммарного балла РП относительно данных биопсии (рис. 56). При этом величина наибольшего снижения равнялась 2-м баллам, наибольшего повышения – 5-ти баллам. 34,9% 20,9% 44,2% снижение нет динамики повышение Рис. 56. Динамика изменения экспрессии ПР в процессе гормонотерапии (изменения суммарного балла по Allred). Установлена выраженная тенденция к увеличению процента окрашенных клеток: медиана составила 50% в материале core-биопсии и 60% - в операционном материале (р=0,09) (рис. 57). Динамика ПР окрашенность ядер (%) Данные биопсии vs Оперативный материал 120 100 80 60 40 20 0 медиана 25%-75% пределы -20 РП % и РП%опер Рис. 57. Динамика изменения процента окрашенных клеток ПР до и после лечения. Не установлено значимого изменения интенсивности окрашенности ядер в процессе гормонотерапии (р=0,47 Wilcoxon Matched Pairs Test). 100 Проведенный анализ показал, что более чем в 2 раза чаще повышение уровня экспрессии ПР выявлено в группе больных с лимфоваскулярной инвазией (тенденция к различию частот), на 10% чаще - в группе больных со снижением Ki-67, почти в 2 раза реже при статусе Her2 2+/3+ (41,4%) против 21,4% в группе с Her2 0/1. Значимо различалась частота повышения уровня экспрессии ПР после проведенного лечения в группе с ЭР+ статусом опухоли, независимо от уровня экспрессии, оцененных в баллах (р=0,009) (табл. 25). Остальные факторы (стадия, гистологический вариант, степень злокачественности, размер первичного очага, возраст, исходные уровни ЭР альфа и бета, не были связаны с динамикой изменения экспрессии ПР. Таблица 25 Анализ частоты различной динамики уровня экспрессии ПР N Признак Градация нет Лимфоваскуляресть ная инвазия Подтип Снижение Ki-67 Her2-neu 25 17 Lum A** 17 Lum B 13 Triple-neg 7 Her2+ Lum В Her2+ нет 1 5 11 есть 32 0 1+ 15 14 2+ 11 3+ 3 Динамика ПР после лечения (баллы) р* Нет ↓ ↑ динамики 7 (28%) 12 (48%) 6 (24%) 0,079 9 1 (5,9%) 7 (41,2%) (52,9%) 6 5 6 (35,3%) (35,3%) (29,4%) 2 7 4 (30,8%) (15,4%) (53,9%) 0,23 1 6 (85.7%) (14,3%) 1 1 (20%) 2 (40%) 2 (40%) 3 1 (9,1%) 7 (63,6%) (27,3%) 0,29 12 12 8 (25%) (37,5%) (37,5%) 3 (20%) 6 (40%) 6 (40%) 2 6 6 (42,9%) (14,3%) (42,9%) 0,2 3 3 5 (45,5%) (27,3%) (27,3%) 1 2 (66,7%) 0 101 (33,3%) ЭР до лечения по данным ИГХ - 9 + 34 0 9 ЭР 1 интенсивность окрашивания до 2 лечения (баллы) по данным ИГХ 3 9 (26,5%) - 1 12 21 1 3 (25%) 5 (23,8%) 1 (11,1%) 0,009 11 14 (32,4%) (41,2%) 1 8 (88,9%) (11,1%) 0,047 5 4 (33,3%) (41,7%) 9 7 (33,3%) (42,9%) 8 (88,9%) * достоверность различия между частотой встречаемости ↓ - снижение; ↑ - повышение ** Lum A – люминальный А подтип; Lum B – люминальный В подтип; Triple-neg – трижынегативный подтип На рисунке 58 представлен клинический случай повышения уровня экспрессии ПР в процессе двухнедельного курса тамоксифена. А. Б. Рис. 58. Пациентка С., 76 лет. А. Экспрессия ПР в опухолевой ткани трепанбиоптата РМЖ, х200. ПР = 6 баллов (50%). Б. Экспрессия ПР в опухолевой ткани узла РМЖ после радикальной мастэктомии, х200. ПР = 8 баллов (100%). Таким образом, прямыми признаками, указывающими на гормоночувствительность опухоли согласно результатам двухнедельного теста на гормоночувствительность, можно считать: Статические показатели: 1. Экспрессия ЭРα (любая, но особенно высокая) (р=0,0003); 102 2. Высокая экспрессия ЭР (6-8 баллов по Allred), определяемая иммуногистохимически (р=0,0005); 3. Исходно низкий уровень Ki67< 20% (р=0,025); 4. Низкая степень злокачественности G1 (0,034); 5. Люминальный А и люминальный В Her2-негативный подтипы (р=0,003) Динамические показатели: 1. Повышение уровня экспрессии ЭРα (ПЦФ) в процессе гормонотерапии (р=0,0012); 2. Снижение интенсивности окрашивания ЭР опухолевых клеток в процессе гормонотерапии при иммуногистохимическом исследовании (р<0,05); 3. Высокая степень лечебного патоморфоза. Косвенные признаки: 1. Исходно высокий уровень экспрессии ПР 7-8 баллов по Allred (р=0,09); 2. Дольковый гистологический вариант (р=0,09); 3. Отсутствие гиперэкспрессии Her2 (р=0,096). В связи с ограниченным количеством наблюдений, умеренное снижение значения Ki67 и лечебный патоморфоз 1-2 степени в группе триждынегативного рака на данный момент не возможно объяснить ЭРβ опосредованным сигнальным путем. Однако данное явление может быть объяснимо как ЭР независимым действием тамоксифена, так и естественной гибелью клеток в высокопролиферирующих опухолях. 3.2.5 Прогностическая номограмма PEPI SCORE в группах люминального А и люминального В Her2-негативного подтипов предоперационной тестовой модели Прогностический индекс PEPI SCORE рассчитывается на основании морфологических характеристик опухоли после двухнедельного курса предоперационной гормонотерапии и направлен на выделение группы 103 пациенток благоприятного прогноза с минимальным риском возврата заболевания, проведение адъювантной химиотерапии в которой обоснованно не показано. PEPI SCORE определялся как суммарный балл при оценке следующих параметров (табл. 26). Таблица 26 Определение суммарного балла PEPI SCORE* Параметр Балл Размер опухолевого узла Т1/Т2 0 Т3/Т4 3 Статус регионарных лимфоузлов N0 0 N+ 3 Натуральный логарифм Ki67 (операционный материал, после терапии) 0-2,7% 0 >2,7-7,3% 1 >7,3-19,7% 2 >19,7% 3 Суммарный балл по Allred 3-8 0 0-2 3 *Суммарный балл PEPI SCORE 0 – низкий риск рецидива, 1-3 – промежуточный, >4 – высокий. В нашем исследовании PEPI SCORE был рассчитан для групп люминального А и люминального В Her2-негативного подтипов. PEPI SCORE 0 был зарегистрирован у 16 пациенток (50%), 1 – у 2 (6,25%), 3 – у 10 (31,25%), 4 – у 4 (12,5%). Низкий риск рецидива (PEPI SCORE 0) был зарегистрирован достоверно чаще в группе люминального А подтипа (табл. 27). 104 Таблица 27 PEPI SCORE и биологический подтип Биологический подтип PEPI SCORE, суммарный балл PEPI SCORE 0 PEPI SCORE 1 PEPI SCORE 3 абс. (%) 15 (75) абс. (%) 0 абс. (%) 5 (25) PEPI SCORE 4 Всего абс. (%) абс. 0 20 12 2 (16,66) 5 (41,66) 4 (33,33) Люминальный А Люминальный В 1 (8,33) Her2Всего 16 2 10 * достоверность различия между частотой встречаемости 4 р* 0,0006 32 Выявлена высокодостоверная прямая корреляционная зависимость прогностического индекса PEPI SCORE с исходным значением Ki67 (р=0,000003). Результаты частотного анализа показали, что предполагаемый низкий риск рецидива наблюдается в 76,19% случаев при исходных значениях Ki67<20% (табл. 28). Таблица 28 PEPI SCORE и исходный уровень Ki67 Исходный уровень Ki67 PEPI SCORE, суммарный балл PEPI PEPI PEPI PEPI SCORE 0 SCORE 1 SCORE 3 SCORE 4 абс. (%) абс. (%) абс. (%) абс. (%) 16 (76,19) 0 5 (23,81) 0 0 2 (18,18) 5 (45,45) 4 (36,36) 16 2 10 4 <20% ≥20% Всего * достоверность различия между частотой встречаемости Полученные анализом: медиана результаты были подтверждены р* Всего абс. 21 11 32 0,0006 дисперсионным Ki67 достоверно увеличивалась при увеличении суммарного балла PEPI SCORE (р<0,0001) (рис. 59). 105 Больные РМЖ 70 60 Ki-67 (%) по данным биопсии 50 40 30 20 10 0 -10 0 3 4 медиана 25%-75% пределы РЕР Рис. 59. Статистические оценки медианы Ki67 при различном суммарном балле PEPI SCORE. Таким образом, влияние исходного значения Ki67 на гормоночувствительность опухоли, описанное в предыдущем разделе, было подтверждено в прогностической номограмме PEPI SCORE. Несмотря на сопоставимую частоту случаев клинически значимого снижения Ki67 в группах люминального А и люминального В Her2негативного подтипов (раздел 3.2.1), обосновано использование существующих прогностических моделей для оценки риска рецидива, а также раз работка новых, с учетом полученных предиктивных факторов. 3.3. Конкордантность количественных показателей экспрессии ЭРα, полученных при количественной иммунофлуоресцентной оценке методом ПЦФ, с данными ИГХ исследования Во всей популяции исследования степень конкордации определялась на основании коэффициента конкордации W [77]. Коэффициент конкордации изменяется в диапазоне 0 W 1. Причем 0 соответствует несогласованности, а 1 соответствует полной согласованности. Если значение коэффициента конкордации превышает 0,40 – 0,50, то качество оценки считается удовлетворительным, если коэффициент W находится в диапазоне 0,70 – 0,80 - высоким. В нашем случае рассчитанный 106 коэффициент конкордации составил 0,49, что говорит об удовлетворительной конкордации методов ПЦФ и ИГХ в определении статуса ЭРα. Для окончательного вывода о качестве результатов коэффициент конкордации, в свою очередь, подвергся проверке по критерию Пирсона (р=0,00009), и мы может сделать окончательный вывод об удовлетворительной конкордации двух методов. В дальнейшем был проведен детальный анализ уровня экспрессии ЭРα, определенный методами ПЦФ и ИГХ на материале 67 опухолевых образцов. Результаты сравнительной оценки экспрессии ЭР в ткани рака молочной железы методами ИГХ и ПЦФ представлены в таблице 29. В обоих случаях показатели частоты встречаемости опухолей с наличием и отсутствием ЭР совпадают: 27% ЭР- и, соответственно, 73% – ЭР-положительных опухолей. Таблица 29 Сравнительный анализ экспрессии ЭРα в ткани рака молочной железы методами ИГХ и ПЦФ Статус ЭРα в ткани рака молочной железы (% больных) положительный ИГХ 27% отрицательный ИГХ ПЦФ 27% ПЦФ суммарно по группе 73% низкий* высокий** 20% 80% низкий* 48% 73% высокий** 52% * Низкий уровень экспрессии ЭРα – количество опухолевых клеток, экспрессирующих ЭРα >40%. ** Высокий уровень экспрессии ЭРα – количество опухолевых клеток, экспрессирующих ЭРα ≤40%. Однако при делении ЭР-положительных опухолей по уровню экспрессии маркёра видны значительные различия между данными, полученными с использованием разных методов. В случае ИГХ определения, только в 20% ЭР-положительных опухолей выявляется низкий уровень маркёра. При анализе методом ПЦФ количество опухолей с низким уровнем экспрессии ЭР было более чем в 2 раза выше – 48% случаев. Напротив, 107 частота встречаемости опухолей с высоким уровнем экспрессии ЭР была более чем в 1,5 раза выше при ИГХ исследовании по сравнению с ПЦФ – 80 и 52% соответственно. Более того, сравнение данных, полученных при ИГХ и ПЦФ исследовании индивидуально по каждому больному в группе пациентов с высоким уровнем экспрессии ЭР, выявило различие в информативности методов. При ИГХ исследовании опухоли отмечается выраженная "однородность" показателей ЭР по проценту окрашенных клеток (уровень экспрессии ЭР). В 89% случаев диагностирован уровень экспрессии ЭР "более 70%". Иная картина получена при оценке статуса ЭР методом ПЦФ (рис. 60). По уровню экспрессии ЭР опухоли с положительным статусом маркёра значительно отличались друг от друга. Показатель колебался от 27 до 65%. Уровень экспрессии ЭРα 100 90 80 70 60 50 40 30 20 10 0 ИГХ ПЦФ 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Рис. 60. Показатели экспрессии ЭРα в ткани рака молочной железы при исследовании методом ПЦФ в группе опухолей с высоким уровнем маркёра по данным ИГХ. По оси абсцисс – номера исследованных образцов опухолей, расположенных по мере возрастания уровня экспрессии ЭРα при оценке методом ПЦФ; по оси ординат – уровень экспрессии ЭРα (%). Горизонтальные и вертикальные линии на рис. делят опухоли в соответствии с данными ПЦФ анализа на группы с низкими (левый нижний квадрат) и высокими (верхний правый квадрат) показателями экспрессии ЭРα. Дифференцированное сравнение экспрессии ЭР по каждому из исследованных образцов опухоли внутри групп с положительным и отрицательным статусом ЭР позволило выявить следующие факты 108 (рис. 61). ИГХ + ПЦФ ЭР 12,5% ЭР ИГХ – ЭР ПЦФ ЭР – 73% 27% + 33% Рис. 61. Дискордантность результатов оценки ЭР в ткани рака молочной железы методом ИГХ и ПЦФ. Закрашенные сегменты – опухоли с положительной экспрессией ЭР, незакрашенные – с отрицательной. Цифрами на рис. указано число случаев (%) ЭР-положительных и ЭР-отрицательных опухолей, выявленных при исследовании методом ИГХ или ПЦФ. Среди опухолей, отнесённых при ИГХ исследовании в группу ЭРотрицательных, методом ПЦФ в 33% выявлены ЭР с уровнем экспрессии от 23 до 60% (средний показатель – 43,4±18,3%). Напротив, среди опухолей, отнесённых по результатам ИГХ оценки к ЭР-положительным, при исследовании методом ПЦФ в 12,5% случаев экспрессия ЭР не выявлена. Таким образом, ИГХ анализ экспрессии ЭР в опухоли может дать ложноотрицательный ответ у каждого третьего больного (в 33% случаев), а ложноположительный – минимум у каждого десятого пациента (в 12,5% случаев). 109 ГЛАВА 4 ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ Рак молочной железы является основной причиной смерти среди женского населения в большинстве стран мира. В последние 20 лет наметилось некоторое улучшение выживаемости этих пациенток. Приблизительно ¾ всех инвазивных опухолей молочной железы являются эстроген-рецептор - и/или прогестерон-рецептор – позитивными, включая как минимум половину всех случаев рака у женщин в пременопаузе. Эндокринная терапия представляет гормонозависимого РМЖ. собой основной вид лечения Естественная история рецептор-позитивного РМЖ отличается от таковой рецептор-негативного рака по времени до прогрессирования, локализации метастазов и, в целом, по агрессивности заболевания. В отличие от пациенток с ЭР-негативными опухолями у больных с ЭР-позитивными сохраняется постоянный риск рецидива заболевания с течением времени. У пациенток, которые получали в адьювантном режиме тамоксифен в течение 5 лет, более чем половина всех рецидивов случается через 6-15 лет после постановки диагноза [39]. Не смотря на то, что тамоксифен и ингибиторы ароматазы снижают риск прогрессирования заболевания в течение нескольких лет после того, как был прекращён их приём, поздние рецидивы и летальные исходы остаются главной клинической проблемой в группе рецептор-позитивных больных. В случае метастатического РМЖ, есть группа пациенток с рецепторпозитивными опухолями, у которых наблюдается длительный клинический эффект на антиэстрогеновую терапию, хотя большинство больных погибает в течение первых трёх лет. Таким образом, мы можем говорить о первичной и приобретенной продолжает резистентности оставаться к гормонотерапии, актуальной задачей изучение которой экспериментальной и клинической онкологии. Открытие в 90-х годах ЭРβ дало надежду появления новой мишени в терапии РМЖ. Однако результаты проведенных в дальнейшем исследований 110 оказались не однозначными в отношении прогностической и предиктивной значимости этой группы эстрогеновых рецепторов [92]. Одновременно ведется поиск новых, более объективных методов определения стероидных гормонов в опухолях молочной железы. В связи с этим, особый интерес вызвал разработанный в ФГБНУ «РОНЦ им. Н.Н. Блохина» метод иммунофлуоресцентного анализа с привлечением проточной цитофлуориметрии, минимизирующий субъективный фактор в оценке статуса ЭР и исключающий фактор гетерогенности опухоли за счет одномоментного анализа более 5000 клеток [3]. Метод позволяет строго количественно оценивать не только уровень экспрессии разных типов ЭР, то есть количество клеток, экспрессирующих маркер в исследуемой опухоли, но и интенсивность экспрессии ЭР в каждой клетке. Одним из наиболее перспективных клинических методов, предсказывающих эффективность гормонотерапии, является разработанный в 1998 г. Michel и Dowsett соавт. предоперационный тест на гормоночувствительность. Данный тест позволяет выявить случаи первичной резистентности опухоли еще на этапе составления плана адъювантной терапии, оценить патогенетическую значимость экспрессируемых рецепторов в сигнальных каскадах клетки и изучить эффективность новых препаратов системной терапии еще до этапа крупномасштабных рандомизированных исследований [80]. Совмещенный дизайн предоперационной тестовой модели с использованием проточной цитофлуориметрии для оценки ЭР статуса позволил охарактеризовать репрезентативную по отношению к общей популяции группу больных первично-операбельным РМЖ по уровню экспрессии ЭРα и ЭРβ в опухоли, выявить корреляцию их экспрессии с клиническими параметрами и морфологическими характеристиками, определить предиктивную значимость рецепторов, а также дополнительно выделить прямые и косвенные признаки гормоночувствительности опухоли. 111 Материалом мультицентрового проспективного исследования послужили 113 биоптатов опухолевой ткани больных РМЖ, получавших лечение в ФГБНУ «РОНЦ им. Н.Н. Блохина» и ГУЗ Областной клинический онкологический диспансер г. Ульяновска с 2012 по 2015 гг. Из них 67 пациенток вошли в I группу (без гормонотерапии), а 46 пациенток получали предоперационную гормонотерапию в рамках двухнедельной тестовой модели (II группа). Средний возраст пациенток РМЖ составил 56,9±11,1 лет. Наибольшее число больных, получавших предоперационную гормонотерапию, в соответствии с данными планового гистологического и инструментального методов исследования, относилось к IIA стадии (45,7%), на 2-м месте по частоте были больные с I стадией заболевания (28,3%). Все биоптаты были получены в ходе оперативного лечения и с помощью coreбиопсии опухоли молочной железы. Оценка рецепторного статуса проводилась как при помощи стандартного ИГХ-метода, так и методом ПЦФ. Биологический суррогатных подтип опухоли иммуногистохимических определялся маркеров в на основании соответствии с рекомендациями St Gallen International Breast Cancer Conference, 2013, в I группе – с операционного материала, во II группе – с материала coreбиопсии. Экспрессия ЭРα была выявлена в 78 (76,5%) опухолевых образцах. Практически у каждой четвертой пациентки (23,5%) экспрессия ЭРα отсутствовала. Экспрессия ЭРβ была выявлена в 100 (98%) опухолевых образцах. Ко-экспрессия ЭРα и ЭРβ (ЭРα+/ЭРβ+) была описана в 75% случаев. В соответствии с рассчитанными медианами было определено пороговое значение равное 40% для выделения высокого и низкого уровней экспрессии рецепторов. Высокий уровень экспрессии ЭРβ был определен в 48% случаев люминального А и люминального В Her2-негативного подтипов, 82% − люминального В Her2-позитивного подтипа, 25% − триждынегативного, 33%−Her2-позитивного РМЖ. Таким образом, была показана 112 экспрессия ЭРβ в исходно имуногистохимически ЭР-негативных случаях трижды-негативного и Her2-позитивного РМЖ. Статистически значимой взаимосвязи уровня экспрессии ЭРβ со стандартными факторами прогноза (размер опухолевого узла, статус регионарных лимфоузлов, стадия по TNM, наличие лимфоваскулярной инвазии) продемонстрировано не было. Полученные результаты противоречат исследованиям Vinayagam и соавт., 2007, не и Shaaban A. и соавт., 2008, не показавшим на материале 171 и 757 опухолевых образцов, соответственно, корреляции экспрессии ЭРβ с клинико-морфологическими параметрами [108]. Тем не менее, выявлены ряд тенденций, свидетельствующих в пользу благоприятного прогностического значения экспрессии ЭРβ: низкая встречаемость высоких уровней ЭРβ (≥40%) в группе ЭРα- опухолей (20,8%) и при III степени злокачественности. Частота G3 в группах высокой и низкой экспрессии ЭРβ составила 38% и 62%, соответственно, G1 – 67% и 33% , G2 – 50% и 50%. Исследованиями SugiuraT. и соавт., 2007, Marotti J. и соавт., 2010, Honma N. и соавт., 2008, также была получена прямая корреляция экспрессии ЭРβ с низкой степенью злокачественности опухоли [62, 82, 115]. В настоящей работе показана статистически значимая ассоциация экспрессии ЭРα, гистологическим определяемой вариантом методом опухоли ПЦФ, (р=0,03), с дольковым низким уровнемKi67 (р=0,001). Высокий уровень экспрессии ЭРα достоверно чаще встречался у пациенток возрастной группы 60-69 лет (р=0,003). Также выявлена тенденция уменьшения числа случаев высокой экспрессии ЭРα (≥40%) по мере нарастания степени злокачественности опухоли, увеличения пролиферативной активности и при гиперэкспрессии Her2. Полученные результаты соответствуют общепринятому понимаю благоприятного прогностического значения экспрессии ЭР, определяемой стандартным иммуногистохимическим методом. 113 Высокая пролиферативная активность опухоли прямо коррелировала с такими прогностически неблагоприятными характеристиками, как молодой возраст (р=0,03), бóльший размер опухолевого узла (р=0,04), распространенная стадия по системе TNM (р=0,02), высокая степень злокачественности (р<0,0001), наличие лимфоваскулярной инвазии (р=0,03) и агрессивные биологические подтипы (р<0,0001). В группе пациенток, получавших двухнедельный курс предоперационной гормонотерапии, было выявлено достоверное снижение уровня Ki67 относительно исходного значения (Wilcoxon Matched Pairs Test, р=0,0003). Однако снижение Ki67 было зарегистрировано только у 76,1% больных, в 16% случаев отмечено повышение Ki67, в 10,9% случаев значение Ki67 не изменялось. Наибольшей предиктивной значимостью в оценке гормоночувствительности опухоли, на основании динамики изменения уровня Ki67, обладала экспрессия ЭРα, определяемая методом ПЦФ (р=0,0003). Причем при высокой экспрессии ЭРα≥40% в 100% случаев наблюдалось снижение неинформативным в Ki67. Уровень предиктивной экспрессии оценке ЭРβ оказался гормоночувствительности опухоли. В единственном проспективном исследовании по оценке влияния экспрессии ЭРβ на динамику изменения Ki67, изучалось только наличие экспрессии, а не ее уровень [79]. В нашей работе экспрессия ЭРβ отсутствовала в опухолевой ткани только двух пациенток, потому сопоставление результатов не возможно. Стандартное оказалось высоко иммуногистохимическое предиктивным в оценке исследование ЭР также гормоночувствительности опухоли. Число случаев снижения Ki67 достоверно увеличивалось по мере увеличения суммарного балла по Allred (р=0,0005). Тем не менее, метод ПЦФ показал большую предиктивную информативность по сравнению со стандартным ИГХ исследованием. Частота снижения Ki67 при высоком уровне ЭРα (≥40%), определяемом методом ПЦФ, составила 100%, в то время как при высоком уровне ЭР по Allred 6-8 баллов – 83-95%. 114 Достоверной зависимости частоты снижения Ki67 от уровня экспрессии ПР показано не было (р=0,09), тем не менее, наибольшее количество случаев снижения Ki67 было зафиксировано при уровне экспрессии ПР 6-8 баллов по Allred. Группами с высокой вероятностью снижения Ki67следует считать люминальный А и люминальный В Her2-негативный подтипы (р=0,003). Клинически значимое снижение Ki67 (в два и более раза) было зарегистрировано в группе люминального А подтипа в 15 случаев из 20 (75%) и в группе люминального В Her-2 негативного подтипа – в 67% (8/12) случаев. В данных группах увеличение Ki67 было зарегистрировано только у двух пациенток, причем в обоих случаях экспрессия ЭРα, определяемая методом ПЦФ, отсутствовала. Высокая гормоночувствительность групп люминального А и люминального В Her2-негативного подтипов также подтверждается зарегистрированными случаями лечебного патоморфоза высокой (III и IV) степени (26,2% случаев). Прогностическая номограмма PEPISCORE показала, что низкий риск рецидива (0 баллов) достоверно чаще выявляется в группе люминального А подтипа, по сравнению с люминальным В Her2-негативным (р=0,0006), несмотря на то, что частота клинически значимого снижения Ki67 в данных группах сопоставима. Поэтому обоснованным является использование существующих прогностических моделей для оценки риска рецидива, а перспективным – разработка новых, с учетом полученных предиктивных факторов. Многофакторный анализ, проведенный в рамках исследования ACOSOG Z1031, также показал, что люминальный А подтип является доминирующим предиктором минимального риска рецидива в прогностической номограммеPEPISCORE [44]. Клинически значимого снижения Ki67 в группах трижды-негативного и Her2-позитивного РМЖ описано не было. Лечебный патоморфоз I и II степени в группе трижды-негативных опухолей встречался в 5 из 8 случаев. В связи с ограниченным количеством наблюдений, умеренное снижение 115 значения Ki67 и лечебный патоморфоз I-II степени в группе триждынегативного рака на данный момент не возможно объяснить ЭРβ опосредованным сигнальным путем. Однако подобное явление может быть объяснимо как ЭР независимым действием тамоксифена, так и естественной гибелью клеток в высокопролиферирующих опухолях. Наибольшее количество случаев без лечебного патоморфоза приходится на группу Her2+ опухолей (66,7%), несмотря на наличие экспрессии ЭР и ПР в группе люминального В Her2-позитивного подтипа. Об ограниченной гормоночувствительности Her2-3+ опухолей также свидетельствует низкая частота случаев высокой экспрессии ЭРα≥40% − 9,09%.Таким образом, в группе Her-2 позитивных опухолей, даже при наличии высокого уровня экспрессии рецепторов эстрогенов и прогестерона, невозможно отказаться от дополнительной системной терапии в связи с ограниченной чувствительностью данной группы опухолей к гормонотерапии. Одним из ключевых параметров, предопределяющих гормоночувствительность опухоли, является исходный уровень Ki67: при уровне Ki67 <20% его снижение в процессе гормонотерапии наблюдалось в 88,46% случаев, при высоком – в 60% (р=0,025). О связи исходного значения Ki67и гормоночувствительности опухоли также говорит тот факт, что при низком уровне Ki67 экспрессия ЭРα выявляется в 90% случаев, а при использовании пациенток прогностической регистрируется модели PEPISCORE в этой минимальный риск группе рецидива заболевания(76,19%). Динамика изменения Ki67 зависит и от степени злокачественности опухоли: при G1 снижение Ki67 было описано в 100% случаев, при G2 – в 79%, при G3 – только в 25% (р=0,034). Можно предположить о влиянии гистологического варианта на гормоночувствительностью опухоли: снижение Ki67 было зарегистрировано в 100% (3/3) случаев долькового рака, в то время как при инвазивном раке неспецифического типа только в 70,5% (24/34) (р=0,09). Одновременно было 116 замечено, что во всех случаях, при наличии долькового гистологического варианта присутствовала экспрессия ЭРα.Полученные в нашей работе результаты аналогичны данным, приведенным в работеTruinW. и соавт. (2012). На материале 3685 наблюдений авторами было показано, что 10летняя общая выживаемость в группе больных инвазивным дольковым раком составила 68% в группе гормонотерапии и 65% в группе комбинированной терапии (р=0,45), что косвенным образом свидетельствовало о высокой гормоночувствительности долькового РМЖ [116]. В процессе гормонотерапии может изменяться как рецепторный статус, так и уровень экспрессии рецепторов. Анализ показал, что все позитивные случаи ЭРα остались позитивными после лечения, а из 9 первоначально негативных 5 (56%) поменяли свой статус на позитивный. Снижение уровня экспрессии ЭРα в группе исходно ЭРα+ опухолей было зарегистрировано в 34% случаев, отсутствие динамики – в 14%, повышение – в 52% случаев. Повышение уровня экспрессии ЭРα является дополнительным предиктором гормоночувствительности опухоли, так как напрямую коррелируетсо снижением уровня Ki67 в процессе предоперационной гормонотерапии (р=0,0012). При ИГХ-исследовании отмечена тенденция к снижению суммарного балла экспрессии ЭР по Allred в 53,3% случаев. Однако данное снижение не коррелировало со снижением Ki67. Детальный анализ показал, что снижение суммарного балла по Allred достигается в основном за счет уменьшения интенсивности окрашивания ядер опухолевых клеток, которое было зарегистрировано в 53,5% случаев. Именно снижение интенсивности, а не уменьшение процента окрашенных клеток показало предиктивную значимость в опухолевом ответе на гормонотерапию. В группе опухолей со снижением Ki67 в 3,6 раза чаще выявлялось снижение интенсивности окрашивания ядер (р<0,05). Полученное нами повышение уровня экспрессии ЭРα методом ПЦФ не согласуется с результатами многочисленных работ Mitchel Dowsett, в 117 которых было описано снижение уровня экспрессии ЭР, определяемых ИГХметодом. Повышение уровня экспрессии ЭРα может быть объяснено механизмом действия тамоксифена. Тамоксифен конкурентно связывается с ЭР, подобно эстрогенам транслоцируется вместе с рецептором в ядро опухолевой клетки, тем самым действие эстрогенов не реализуется и клетка остается в G0 и G1 фазах цикла. При этом прогностически благоприятное повышение уровня экспрессии ЭРα может быть объяснено механизмом обратной связи: чем эффективнее тамоксифен связывается с ЭР, тем менее интенсивно эстрогены связываются с ЭР и происходит компенсаторный синтез ЭР. Одновременно уменьшение интенсивности окрашивания опухолевых клеток при ИГХ исследовании может быть обусловлено сниженной функциональной активностью вновь образованных рецепторов, а также образованием тамоксифен-ЭР комплексов. Процент окрашенных клеток может также субъективно занижаться из-за низкой интенсивности окрашивания опухолевых клеток. В нашем исследовании было отмечено достоверное увеличение уровня экспрессии ЭРβ: 1 случай нулевой экспрессии остался нулевым, 72% случаев низкой экспрессии (ЭРβ<40%) перешли в диапазон экспрессии ЭРβ≥40%, а 80% случаев высокой экспрессии остались в прежнем диапазоне (р=0,00001). Описанное повышение экспрессии ЭРβ в исследовании MillerW. и соавт., 2006, было зарегистрировано в 51% случаев [71]. Однако результаты нашей работы показали, что повышение уровня экспрессии ЭРβ не является предиктивным в отношении снижения уровня Ki67 (р>0,05). При ИГХ-исследовании повышение суммарного балла по Allred после лечения было зарегистрировано в 34,9% наблюдений, снижение − в 20,9% и в 44,1% случаев выявлено отсутствие изменение суммарного балла РП относительно данных биопсии. Установлена выраженная тенденция к увеличению процента окрашенных клеток: медиана составила 50% в материале core-биопсии и 60% − в операционном материале (р=0,09), при этом не выявлено значимого изменения интенсивности окрашивания ядер в 118 процессе гормонотерапии (р=0,47 Wilcoxon Matched Pairs Test). Проведенный анализ показал, что повышение уровня экспрессии ПР регистрировалось на 10% чаще в группе больных со снижением Ki67, почти в 2 раза реже − при статусе Her2 2+/3+. Значимо различалась частота повышения уровня экспрессии ПР после проведенного лечения в группе с ЭР+ статусом опухоли, независимо от уровня экспрессии рецепторов (р=0,009). В исследовании IMPACT также было показано повышение уровня экспрессии ПР в 48% случаев в группе тамоксифена через две недели терапии [36]. Таким образом, в нашей работе удалось выделить прямые признаки, указывающие на гормоночувствительность опухоли. Статические показатели: 6. Экспрессия ЭРα (любая, но особенно высокая); 7. Высокая экспрессия ЭР (6-8 баллов по Allred), определяемая иммуногистохимическим методом; 8. Исходно низкий уровень Ki67; 9. Низкая степень злокачественности; 10.Люминальный А и люминальный В Her2-негативный подтипы. Динамические показатели: 4. Повышение уровня экспрессии ЭРα, определяемая ПЦФ в процессе гормонотерапии; 5. Снижение интенсивности окрашивания ЭР опухолевых клеток в процессе гормонотерапии при иммуногистохимическом исследовании; 6. Высокая степень лечебного патоморфоза. Косвенными признаками являются: исходно высокий уровень экспрессии ПР (7-8 баллов по Allred), дольковый гистологический вариант, отсутствие гиперэкспрессии Her2, повышение уровня экспрессии ПР в процессе гормонотерапии относительно исходного при ИГХ исследовании (преимущественно за счет увеличения процента окрашенных клеток). Проведенный анализ всей группы исследовании показал удовлетворительную конкордантность методов ИГХ и ПЦФ (W=0,49). 119 Однако при детальном исследовании 60 случаев было показано, что среди опухолей, отнесённых при ИГХ исследовании в группу ЭР-отрицательных, методом ПЦФ в 33% выявлены ЭР с уровнем экспрессии от 23 до 60% (средний показатель – 43,4±18,3%). Напротив, среди опухолей, отнесённых по результатам ИГХ оценки к ЭР-положительным, при исследовании методом ПЦФ в 12,5% случаев экспрессия ЭР не выявлена. В соответствии с рекомендациями Американского общества патологов по определению рецепторного статуса РМЖ 2010 года, ложноположительные/отрицательные случаи могут выявляются в 20% ИГХисследований [58].Метод ПЦФ лишен субъективизма, позволяет одномоментно, строго количественно анализировать 5–10 тыс. клеток из клеточных суспензий, которые получают из хирургических образцов опухолей большого размера (до 2 см и более в диаметре). Показатель экспрессии маркёра при этом становится интегральным по большому объёму опухоли, а не по локальному участку как при иммуногистохимическом анализе, что в значительной степени нивелирует внутриопухолевую гетерогенность. С учетом высокого процента ложных результатов ИГХ исследований (20%) и установленной дискордантности методов ИГХ и ПЦФ в определении ЭР-негативных опухолей (33,3%), рекомендуется дублирование двух методов или проведение повторного ИГХ анализа при первом отрицательном результате ИГХ до 3-х отрицательных или первого положительного результата. Таким образом, настоящее пилотное исследование позволило выделить высокодостоверные предиктивные маркеры гормоночувствительности опухоли. Однако для определения их прогностической значимости требуется динамическое наблюдение пациенток исследуемой группы. Уровень ЭРα, показавший наибольшую предиктивную значимость, является перспективным параметром при составлении прогностических номограмм. 120 ВЫВОДЫ 1. Иммунофлуоресцентный анализ, ассоциированный с проточной цитофлуориметрией, является высокоинформативным количественным методом, который позволяет определить экспрессию ЭРα в 76,5% случаев, экспрессию ЭРβ - в 98% случаев, коэкспрессию – в 75% случаев рака молочной железы. 2. Уровень экспрессии ЭРα напрямую коррелирует с возрастом пациенток (р=0,03), ассоциирован с уровнем Ki-67 (р=0,0001) и дольковым гистологическим вариантом опухоли (р=0,03). Корреляции экспрессии ЭРβ с клинико-морфологическими параметрами заболевания не выявлено (р>0,05). 3. Методы ПЦФ и ИГХ обладают удовлетворительной конкордатностью (W=0,49) при определении статуса эстрогеновых рецепторов. 4. В результате двухнедельного предоперационного теста выявлены следующие высокодостоверные предиктивные признаки гормоночувствительности опухоли: высокая экспрессия ЭРα по данным ПЦФ (р=0,0003) и ИГХ (р=0,0005); исходно низкий уровень Ki67 (р=0,025); низкая степень злокачественности (0,034); повышение уровня экспрессии ЭРα (ПЦФ) в процессе гормонотерапии (р=0,0012); снижение интенсивности экспрессии ЭРα (ИГХ) в процессе гормонотерапии (р<0,05). 121 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ 1. Определение статуса ЭРα методом ПЦФ может быть рекомендовано для максимально достоверной верификации молекулярного диагноза и для его четкой количественной градации. 2. В группе Her-2 позитивных опухолей, даже при наличии высокого уровня экспрессии рецепторов эстрогенов и прогестерона, невозможно отказаться от ограниченной дополнительной системной чувствительностью данной терапии группы в связи с опухолей к гормонотерапии по результатам двухнедельного предоперационного теста. 3. Учитывая выявленные расхождения в постановке ЭР-отрицательного статуса РМЖ методами ПЦФ и ИГХ и гетерогенность опухоли, рекомендуется дублирование двух методов или проведение повторного ИГХ анализа при первом отрицательном результате ИГХ до 3-х отрицательных или первого положительного результата. 4. В рутинной клинической гормоночувствительность практике следует двухнедельный проводить тест на пациенткам с люминальным А и люминальным В Her2-негативным подтипами опухоли, которым можно воздержаться от проведения адъювантной химиотерапии. 5. Динамика изменения уровня экспрессии эстрогеновых рецепторов и рецепторов прогестерона в процессе двухнедельного предоперационного курса гормонотерапии может использоваться как дополнительный критерий гормоночувствительности опухоли. 122 СПИСОК СОКРАЩЕНИЙ AF – активирующий фактор EGFR – рецептор эпидермального фактора роста Her2 – рецептор эпидермального фактора роста IS – intensity score Ki67 – индекс пролиферативной активности M – наличие отдаленных метастазов m - ошибка репрезентативности N - поражение регионарных лимфатических узлов n - число больных р - вероятность ошибки pCR – полный лечебный патоморфоз PEPI – предоперационный прогностический индекс PS – proportion score SPF - S-phase fraction Т – размер первичной опухоли TS – total score UICC - Union for International Cancer Control ВОЗ – всемирная организация здравоохранения ГУЗ ОКОД- государственное учреждение здравоохранения Областной клинический онкологический диспансер, г. Ульяновск ДНК – дезоксирибонуклеиновая кислота ИГХ – иммуногистохимическое исследование к-ДНК – комплементарная дезоксирибонуклеиновая кислота М - среднее значение МРТ - магнитно-резонансная томография ПР – рецептор прогестерона ПЦФ – проточная цитофлуориметрия РМЖ - рак молочной железы РНК – рибонуклеиновая кислота 123 РОНЦ - Российский онкологический научный центр УЗИ – ультразвуковое исследование ФГБНУ - Федеральное государственное бюджетное научное учреждение ЭР – рецепторы эстрогенов ЭРα – эстрогеновый рецептор α ЭРβ – эстрогеновый рецептор β 124 СПИСОК ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА Рис. 1. А. Изменение маркера пролиферации Ki67 на фоне 12-недельной терапии анастрозолом. Б. Безрецидивная выживаемость пациенток ЭРположительным раком молочной железы, получавших анастрозол, тамоксифен или их комбинацию в течение 12 недель. Рис. 2. Дизайн исследования. Рис. 3. Распределение наблюдений по возрастам. Рис. 4. Структура оперативных вмешательств первично-операбельного РМЖ. Рис. 5. А. Распределение больных по стадиям в I группе. Б. Распределение больных по стадиям во II группе. Рис. 6. Распределение наблюдений по размеру опухолевого узла. Рис. 7. Макрофото опухолевого узла (А) и core-биоптата (Б) РМЖ. Измерение длины узла и столбика опухолевой ткани с помощью линейки с точностью до миллиметра. Рис. 8. Экспрессия эстроген-рецептора в опухолевой ткани трепан-биоптата РМЖ, х200. ЭР= 7 баллов (85%). Рис 9. Экспрессия индекса пролиферативной активности в трепан-биоптате РМЖ, х200. Ki-67= 45%. Рис. 10. Параметры иммунофлуоресцентной оценки статуса ЭРα с привлечением проточной цитофлуориметрии Рис. 11. Распределение наблюдений по уровню экспрессии ЭРα. Рис. 12. Распределение наблюдений по уровню экспрессии ЭРβ. Рис. 13. Изолированная экспрессия и ко-экспрессия ЭРα и ЭРβ в ткани РМЖ. Рис. 14. Распределение ЭРα+ случаев по уровню экспрессии ЭРβ. Рис. 15. Экспрессия ЭРβ в группе ЭРα- опухолей. Рис. 16. Статистические оценки экспрессии ЭРβ в группах ЭРα+ и ЭРαопухолей РМЖ. Рис. 17. Экспрессия ЭРα, ЭРβ и их уровень при Т1 и Т2. Рис. 18. Распределение наблюдение по индексу пролиферации Ki67. 125 Рис. 19. Экспрессия ЭРα при различной пролиферативной активности опухоли. Рис. 20. Уровни экспрессии ЭРα и ЭРβ при различной пролиферативной активности РМЖ. Рис. 21. Статистические оценки Ki67 в различных возрастных группах. Рис. 22. Статистические оценки Ki67 при различной степени злокачественности РМЖ. Рис. 23. Статистические оценки Ki67 при различном Her2-статусе опухоли. Рис. 24. Статистические оценки Ki67 в группах различного биологического подтипа опухоли. Рис. 25. Уровень экспрессии ЭРβ при различной степени злокачественности. Рис. 26. Статистические оценки экспрессии ЭРα в группах инвазивного неспецифического и долькового рака. Рис. 27. Статистические оценки экспрессии ЭРα при различном статусе Her2. Рис. 28. Общая динамика изменения Ki67 в исследуемой группе. Рис. 29. Динамика изменения Ki67 в процессе двухнедельного курса гормонотерапии. Рис. 30. Снижение Ki67 при различном Her2 статусе. Рис. 31. Динамика изменения Ki67 в группах различного биологического подтипа. Рис. 32. Динамика изменений Ki67 в зависимости от статуса ЭРα. Рис. 33. Динамика изменения Ki67 в зависимости от уровня экспрессии ЭРα. Рис. 34. Динамика изменения Ki67 в зависимости от уровня экспрессии ЭР в суммарных баллах по Allred. Рис. 35. Динамика изменения Ki67 в зависимости от уровня экспрессии ПР по Allred. Рис. 36. Динамика изменения Ki67 в зависимости от его исходного уровня и степени злокачественности. Рис. 37. Динамика изменения Ki67 в группе люминального А подтипа 126 Рис. 38. Динамика изменения Ki67 в группе люминального В Her2негативного подтипа. Рис. 39. Динамика изменения Ki67 в группах люминального В Her2позитивного и Her2-позитивного подтипов. Рис. 40. Динамика изменения Ki67 в группе трижды-негативного подтипа Рис. 41. Пациентка С., 76 лет. А. Экспрессия индекса пролиферативной активности в опухолевой ткани core-биопсии РМЖ. Ki-67=35%. Б. Экспрессия индекса пролиферативной активности в опухолевой ткани в центральных отделах узла РМЖ после радикальной мастэктомии. Ki-67= 45%. Рис. 42. Пациентка И., 67 лет. А. Экспрессия индекса пролиферативной активности в опухолевой ткани core-биопсии РМЖ. Ki-67= 16-18%. яБ. Экспрессия индекса пролиферативной активности в опухолевой ткани в центральных отделах узла РМЖ после радикальной мастэктомии. Ki-67= 45%. Рис. 43. Степень лечебного патоморфоза в опухолевом узле после 2-х недельного предоперационного курса гормонотерапии, согласно результатам планового гистологического исследования. Рис. 44. Пациентка С., 76 лет. Фотография среза ткани опухолевого узла, окрашенного гематоксилин-эозином, после радикальной мастэктомии. Синяя стрелка – паренхима опухолевой ткани окрашена в фиолетовый цвет, сохранено около 50% опухолевой паренхимы. Красная стрелка – очаг склероза опухолевой ткани, как лечебный патоморфоз 1 степени. Рис. 45. Пациентка С., 76 лет. Инвазивный рак неспецифического типа с лечебным патоморфозом I степени (сохранено 50% опухолевой паренхимы), х50. Рис. 46. Опухолевого узел РМЖ пациентки Б., 63 лет, после радикальной мастэктомии. 127 Рис. 47. Инвазивный РМЖ после радикальной мастэктомии пациентки Б., 63 лет. Лечебный патоморфоз III степени (выраженный склероз стромы, сохранено менее 10% опухолевой паренхимы), х50. Рис. 48. Пациентка Б., 63 лет. Инвазивный РМЖ, лечебный патоморфоз III степени (выраженный дистрофический полиморфизм опухолевых клеток в склерозированной строме), х200. Рис. 49. А. и Б. (два поля зрения). Пациентка Д., 62 лет. Инвазивный РМЖ неспецифического типа, G 2. Материал core-биопсии, х200. Рис. 50. А. и Б. (два поля зрения). Пациентка Д., 62 лет. Инвазивный РМЖ после радикальной мастэктомии. Очаги атипичного протокового фиброаденоматоза на фоне выраженного склероза (синяя стрелка) ткани молочной железы (лечебный патоморфоз 4 степени). Рис. 51. Динамика изменения уровня экспрессии ЭРβ до и после лечения. Рис. 52. Распределение случаев по уровню экспрессии ЭРα и ЭРβ. Рис. 53. Динамика изменения уровня экспрессии ЭР в процессе гормонотерапии. Рис. 54. Пациентка С., 76 лет. А. Экспрессия ЭР в опухолевой ткани трепанбиоптата РМЖ, х200. ЭР = 7 баллов (85% (5) +2). Б. Экспрессия ЭР в опухолевой ткани узла РМЖ после радикальной мастэктомии, х200. ЭР = 6 баллов (95% (5) + 1). Рис. 55. Распределение наблюдений по уровню экспрессии ПР в баллах по Allred. А. Материал core-биопсии. Б. Операционный материал. Рис. 56. Динамика изменения экспрессии ПР в процессе гормонотерапии (изменения суммарного балла по Allred). Рис. 57. Динамика изменения процента окрашенных клеток ПР до и после лечения. Рис. 58. Пациентка С., 76 лет. А. Экспрессия ПР в опухолевой ткани трепанбиоптата РМЖ, х200. ПР = 6 баллов (50%). Б. Экспрессия ПР в опухолевой ткани узла РМЖ после радикальной мастэктомии, х200. ПР = 8 баллов (100%). 128 Рис. 59. Статистические оценки медианы Ki67 при различном суммарном балле PEPI SCORE. Рис. 60. Показатели экспрессии ЭРα в ткани рака молочной железы при исследовании методом ПЦФ в группе опухолей с высоким уровнем маркёра по данным ИГХ. Рис. 61. Дискордантность результатов оценки ЭР в ткани рака молочной железы методом ИГХ и ПЦФ. 129 СПИСОК ЛИТЕРАТУРЫ 1. Богуш Т.А. Экспрессия эстрогеновых рецепторов в опухолях, отличных от рака молочной железы / Богуш Т.А., Дудко Е.А., Бёме A.A. [и др.] //Антибиотики и химиотер. – 2009. – Т.54. - №7-8. – C. 4149. 2. Богуш Т.А. / Богуш Т.А., Дудко Е.А., Бёме A.A. [и др.] Эстрогеновые рецепторы, антиэстрогены и немелкоклеточный рак лёгкого // Биохимия. – 2010. – Т.75. – 12. – C. 1633-1641. 3. Богуш Т.А. Сравнительная оценка экспрессии эстрогеновых рецепторов бета в ткани немелкоклеточного рака легкого и метастазов в легком опухолей других первичных локализаций / Богуш Т.А., Шатурова А.С., Дудко Е.А. [и др.] // ДАН. – 2014. – Т.454. - №6. – C. 720-724. 4. Богуш Т.А. Количественная использованием проточной иммунофлуоресцентная цитофлуориметрии оценка с экспрессии эстрогеновых рецепторов β в солидных опухолях человека / Богуш Т.А., Шатурова А.С., Дудко Е.А. [и др.] // Вестн. Моск. ун-та Сер. 2, Химия. – 2011. – Т. 52. - №4. – C. 305-312. 5. Герштейн Е.С. Тканевые маркеры как факторы прогноза при раке молочной железы / Герштейн Е.С., Кушлинский Н.Е. // Практическая онкология. – 2002. – Т. 3. - №1. – С. 38-44. 6. Давыдов М.И. Статистика злокачественных новообразований в России и странах СНГ в 2012 году / Давыдов М.И., Аксель Е.М. // Издательская группа РОНЦ. - 2014. – 46 с. 7. Кулигина Е. Ш. Эпидемиологические и молекулярные аспекты рака молочной железы / Кулигина Е. Ш. // Практическая онкология. – 2010. – Т.11, № 4. – С. 203-216. 130 8. Лавникова Г. А. Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование // Вестн. АМН СССР. — 1976. — № 6. — С. 13—19. 9. Общие стандарты лечения рака молочной железы, основанные на определении биологических подтипов: руководство для врачей / Под ред. В. Ф. Семиглазова, В. Г. А. Дашян. – М.: Медиа Медика. - 2011. 82 с. 10. Руководство по иммуногистохимической диагностике опухолей человека / под ред. С.В. Петрова, Н. Т. Райхлина. - Казань: Титул, 2004. 11. Семиглазов В.Ф. Рак молочной железы: мультидисциплинарный подход к лечению / Семиглазов В.Ф. // Практическая онкология. – 2015. – 16 (2). – С. 49-54. 12. Снегирев А.А. Лечебный патоморфоз как показатель эффективности лечения и пргноза рака молочной железы / Снегирев А.А., Григоренко А.А. // Дальневост. мед. журн. - 2013. – Т.1.- С. 134-137. 13. Снеговой А.В. Значение биомаркеров для определения тактики лечения злокачественных опухолей / Снеговой А.В., Манзюк Л.В. // Практическая онкология. – 2011. – Т. 12. – № 4. – С. 166-170. 14. Состояние онкологической помощи населению России в 2013 году / под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой.- М. ФГБУ «МНИОИ им. П.А.Герцена» Минздрава России, 2014. - 235 с. 15. Стенина М.Б. Адъювантная системная терапия рака молочной железы / Стенина М.Б. // Практическая онкология. – 2007. – 8 (3). – С. 118126. 16. Стенина М.Б. Рак молочной железы: наиболее важные научные события и выводы последних лет / Стенина М.Б., Фролова М.А. // Практическая онкология. – 2011. – 12(1). – С. 6-11. 17. Троценко И.Д. Оценка связи экспрессии рецепторов стероидных гормонов методом ОТ-ПЦР с уровнем пролиферации и апоптоза в 131 ткани рака молочной железы / Троценко И.Д , Рожкова Н.В., Харченко Н.В. [и др.] // Вестник РНЦРР Минздрава России. – 2012. – Т.12. - №2. 18. Тюляндин С.А. Системная терапия операбельного рака молочной железы / Тюляндин С.А. // Практическая онкология. – 2002. – Т.3. №1. – С. 29-37. 19. Шатурова А.С. Экспрессия эстрогеновых рецепторов β и β1 в ткани немелкоклеточного рака легкого человека / Шатурова А.С., Богуш Т.А., Дудко Е.А. [и др.] // Антибиотики и химиотер. – 2012. Т.57. №5-6. – С. 11-17. 20. Allred D. C.et al. Prognostic and predictive factors in breast cancer by immuno-histochemical analysis text. // Mod. Pathol. - 1998. – Vol.11. P.55-168. 21. Aronica S.M. Estrogen action via the cAMP signaling pathway: stimulation of adenylate cyclase and cAMP-regulated gene transcription / Aronica S.M., Kraus W.L., Katzenellenbogen B.S. // Proc Natl Acad Sci USA. 1994 . – Vol.91. – P. 8517–8521. 22. Beato M. Gene regulation by steroid hormones / Beato M. // Cell, 1989. – Vol.56. – P. 335–344. 23. Beekman J.M., Allan G.F., Tsai S.Y. et al. Transcriptional activation by the estrogen receptor requires a conformational change in the ligand binding domain // Mol Endocrinol. – 1993. – 7. – P. 1266–1274. 24. Berry M. Role of the two activating domains of the oestrogen receptor in the cell-type and promotercontext dependent agonistic activity of the antioestrogen 4-hydroxytamoxifen / Berry M., Metzger D., Chambon P. // EMBO J. – 1990. – Vol. 9. – P. 2811–2818. 25. Bogush T. Tamoxifen non-estrogen receptor mediated molecular targets / Bogush T., Dudko E., Bogush E. [et al.] // Oncology reviews. – 2012. – Vol.6. – №15. – P. 122-129. 132 26. Brenton J.D. Molecular classification and molecular forecasting of breast cancer: ready for clinical application? / Brenton J.D., Carey L.A., Ahmed A.A. [et al.] // J Clin Oncol. – 2005. – Vol.23. – P. 7350–7360. 27. Bullwinkel J. Ki-67 protein is associated with ribosomal RNA transcription in quiescent and proliferating cells / Bullwinkel J., BaronLuhr B., Ludemann A. [et al.] // J Cell Physiol. – 2006. – Vol.206. – P. 624-635. 28. Castoria G. PI3-kinase in concert with Src promotes the S-phase entry of oestradiol-stimulated MCF-7 cells / Castoria G., Migliaccio A., Bilancio A. [et al.] // EMBO J. – 2001. – Vol.20. – P. 6050–6059. 29. Chang J. Prediction of clinical outcome from primary tamoxifen by expression of biologic markers in breast cancer patients /Chang J, Powles TJ, Allred D.C. [et al.] //Clin Cancer Res. – 2000. – Vo.6. – P. 616-621. 30. Clarke R. Molecular and pharmacological aspects of antiestrogen resistance / Clarke R., Skaar T., Bouker K. [et al.] // Steroid Biochem. Mol. Biol. – 2001. – Vol.76. – P. 71-84. 31. Collins R. Early Breast Cancer Trialists’ Collaborative Group. Tamoxifen for early breast cancer: an overview of the randomised trials / Collins R., Davies C. [et al.] // Lancet. – 1998. – 351. – P. 1451-1467. 32. Cowley S.M. A comparison of transcriptional activation by ER alpha and ER beta / Cowley S.M. and Parker M.G // J Steroid Biochem Mol Biol. – 1999. – Vol.69. – P. 165–175. 33. Cuzick J. Prognostic value of a combined estrogen receptor, progesterone receptor, Ki-67, and human epidermal growth factor receptor 2 immunohistochemical score and comparison with the Genomic Health recurrence score in early breast cancer / Dowsett M., Pineda S. [et al.] // J Clin Oncol. – 2011. – Vol.29. – P. 4273-4278. 34. Davies C. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of 133 randomised trials / Davies C., Godwin J., Gray R. [et al.] // Lancet. -2011. –Vol. 378. – P. 771-784. 35. Dowsett M. Endocrine Therapy, New Biologicals, and New Study Designs for Presurgical Studies in Breast Cancer / Dowsett M. // J. Natl Cancer Inst. Monogr. – 2011. – P. 120–123. 36. Dowsett M. Short term changes in Ki67 during neoadjuvant treatment of primary breast cancer with anastrozole or tamoxifen alone or combined correlate with recurrence-free survival / Dowsett M., Smith I.E., Ebbs S.R. [et al.] // Clin Cancer Res. – 2005. – Vol.11. – P. 951s-958s. 37. Dowsett M. Effect of raloxifene on breast cancer cell Ki67 and apoptosis: a double-blind, placebo-controlled, randomized clinical trial in postmenopausal patients / Dowsett M., Bundred N.J., Decensi A. [et al.] // Cancer Epidemiol Biomarkers Prev. – 2001. – Vol.10. – P. 961-966. 38. Dowsett M. Antiproliferative effects of idoxifene in a placebo-controlled trial in primary human breast cancer / Dowsett M., Dixon J.M., Horgan K. [et al.] //Clin Cancer Res. – 2000. – Vol.6. – P. 2260-2267. 39. Early Breast Cancer Trialists' Collaborative Group. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials // Lancet. 2005. – Vol.365. – P. 1687-1717. 40. Eiermann W. Preoperative treatment of postmenopausal breast cancer patients with letrozole: a randomized double-blind multicenter study / Eiermann W., Paepke S., Appfelstaedt J., [et al.] // Ann Oncol. – 2001. – Vol.12. – P. 1527-1532. 41. Ellis M.J. Letrozole is more effective neoadjuvant endocrine chemotherapy than tamoxifen for erbB-1- and/or erbB-2-positive, estrogen receptorpositive primary breast cancer: evidence from a phase III randomized trial. / Ellis M.J., Coop A., Singh B. [et al.] // J Clin Oncol. - 2001. – Vol.19. – P. 3808–3816. 134 42. Ellis M.J. Letrozole inhibits tumor proliferation more effectively than tamoxifen independent of HER1/2 expression status / Ellis M.J., Coop A., Singh B. [et al.] // Cancer Res. – 2003. – Vol.63. – P. 6523-6531. 43. Ellis M.J. Randomized phase II neoadjuvant comparison between letrozole, anastrozole, and exemestane for postmenopausal women with estrogen receptor-rich stage 2 to 3 breast cancer: clinical and biomarker outcomes and predictive value of the baseline PaM50-based intrinsic subtype– ACOSOG Z1031 / Ellis M.J., Suman V.J., Hoog J. [et al.] // J Clin Oncol. 2011. – Vol.29. – P. 2342-2349. 44. Ellis M.J. Randomized phase II neoadjuvant comparison between letrozole, anastrozole, and exemestane for postmenopausal women with estrogen receptor-rich stage 2 to 3 breast cancer: clinical and biomarker outcomes and predictive value of the baseline PaM50-based intrinsic subtype– ACOSOG Z1031 / Ellis M.J., Suman V.J., Hoog J. [et al.] // J Clin Oncol. 2011. – Vol.29. – P. 2342-2349. 45. Ellis M.J. Outcome prediction for estrogen receptor-positive breast cancer based on postneoadjuvant endocrine therapy tumor characteristics / Ellis M.J., Tao Y., Luo J. [et al.] // J Natl Cancer Inst. – 2008. – Vol.100. – P. 1380-1388. 46. Evans R.M. The steroid and thyroid hormone superfamily / Evans R.M. // Science. – 1988. –Vol. 240. – P. 889–895. 47. Fisher B. Effect of local or systemic treatment prior to primary tumor removal on the production and response to a serum growth-stimulating factor in mice / Fisher B., Saffer E., Rudock C. [et al.] // Cancer Res. 1989. –Vol.49. - №8. – P. 2002–2004. 48. Forbes J.F. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 100-month analysis of the ATAC trial /Forbes J.F. // Lancet Oncol. – 2008. – Vol.9. - №1. – P. 45-53. 135 49. Garcia-Becerra R. Mechanisms of Resistance to Endocrine Therapy in Breast Cancer: Focus on Signaling Pathways, miRNAs and Genetically Based Resistance / Garcia-Becerra R., Santos N., Diaz L. et al. GarciaBecerra R., Santos N., Diaz L. [et al.] // Int J Mol Sci. – 2013. – Vol.14. №1. - P. 108–145. 50. Giguere V. Identification of a new class of steroid hormone receptors / Giguere V., Yang N., Segui P., Evans R.M. // Nature. – 1988. – Vol.331. – P. 91–94. 51. Gil M.J. Primary hormonal therapy with exemestane in patients with breast tumors >3 cm in diameter: Results of a Spanish multicenter phase II trial / Gil M.J., Barnadas A., Cirera L. [et al.] // Proc Am Soc Clin Oncol. -2004. – Vol. 23. – P. 603. 52. Goldhirsch A. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013 /Goldhirsch A., Winer E.P., Coates A.S. [et al.] // Ann Oncol. - 2013. – Vol.24. - №9. – P. 2206– 2223. 53. Goss P. Exemestane versus anastrozole in postmenopausal women with early breast cancer: NCIC CTG MA.27—a randomized controlled phase III trial / Goss P. // J Clin Oncol. – 2013. – Vol.11. – P. 1398-1404. 54. Green G.L. Sequence and expression of human estrogen receptor complementary DNA / Green G.L., Gilna P., Waterfield M. [et al.] // Science. – 1986. – Vol.231. - P 1150–1154. 55. Green S. Human oestrogen receptor cDNA: sequence, expression and homology to v-erb-A / Green S., Walter P., Kumar V. [et al.] // Nature. – 1986. – Vol.320. – P. 134–139. 56. Gronemayer H. Transcription factors 3: nuclear receptors / Gronemayer H., Laudet V. // Protein Profile. – 1995. – Vol.2. – P. 1167–1322. 57. Guarneri V. Prognostic value of pathologic complete response after primary chemotherapy in relation to hormone receptor status and other 136 factors / Guarneri V., Broglio K., Kau S.W. [et al.] // J Clin Oncol. – 2006. – Vol.24. – P. 1037-1044. 58. Hammond M. American society of clinical oncology/college of American pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer / Hammond M., Hayes D., Wolff A. [et al.] // J Oncol Pract . -2010. – Vol.6. - №4. P. 195–197. 59. Hanahan D. Hallmarks of cancer: the next generation / Hanahan D., Weinberg R. // Cell. – 2011. – Vol.144. – P. 646-674. 60. Hanstein B. Functional analysis of a novel estrogen receptor-b isoform / Hanstein B., Liu H., Yancisin M., Brown M. // Mol Endocrinol., 1999. – Vol.13. - 129–137. 61. Hartman J. Estrogen receptor beta inhibits angiogenesis and growth of T47D breast cancer xenografts / Hartman J., Lindberg K., Morani A. // Cancer Res. – 2006. – Vol. 66. – P. 11207–11213. 62. Honma N. Oestrogen receptor-beta1 but not oestrogen receptor-betacx is of prognostic value in apocrine carcinoma of the breast / Honma N., Saji S., Kurabayashi R. [et al.] // Apmis. – 2008. – Vol.116. – P. 923-930. 63. Hopp T. Low levels of estrogen receptor beta protein predict resistance to tamoxifen therapy in breast cancer / Hopp T., Weiss H., Parra I. [et al.] // Clinical Cancer Research. - 2004. – Vol.10. – P. 7490–7499. 64. Howell A. Endocrine therapy for advanced carcinoma of the breast: relationship between the effect of tamoxifen upon concentrations of progesterone receptor and subsequent response to treatment / Howell A., Harland R.N., Barnes DM, [et al.] // Cancer Res. – 1987. – Vol.47. – P. 300-304. 65. ICH Guidelines//Good Clin. Pract. J. – 1998.-Vol.5, № 4. – P.27-37. 66. Improta-Brears T. Estrogen-induced activation of mitogen-activated protein kinase requires mobilization of intracellular calcium / Improta-Brears T., 137 Whorton A.R., Codazzi F. [et al.] // Proc Natl Acad Sci USA. – 1999. – Vol.96. –P. 4686–4691. 67. Jensen E.V. Basic guides to the mechanism of estrogen action / Jensen E.V., Jacobsen H.I. // Rec Prog Horm Res. – 1962. – Vol.18. – P. 387–414. 68. Katzenellenbogen J.A. Nuclear hormone receptors: ligand-activated regulators of transcription and diverse cell responses / Katzenellenbogen J.A., Katzenellenbogen B.S. // Chem Biol. – 1996. – Vol.3. – P. 529–536. 69. Kraus W.L. Ligand-dependent transcriptionally productive association of the amino- and carboxy-terminal regions of a steroid hormone nuclear receptor / Kraus W.L. McInerney E.M., Katzellenbogen B.S. // Proc Natl Acad Sci USA, 1995. – Vol.92. – P. 12314–12318. 70. Kraus W.L. P300 and estrogen receptor cooperatively activate transcription via differential enhancement of initiation and reinitiation / Kraus W.L., Kadonaga J.T. // Genes Dev. – 1998. – Vol.12. – P. 331–342. 71. Kuerer H.M. Clinical course of breast cancer patients with complete pathologic primary tumor and axillary lymph node response to doxorubicin-based neoadjuvant chemotherapy / Kuerer H.M., Newman L.A., Smith T.L. [et al.] // J Clin Oncol. – 1999. – Vol.17. – P. 460-469. 72. Kuiper G.G. Cloning of a novel receptor expressed in rat prostate and ovary / Kuiper G.G., Enmar E., Pelto-Huikko M. [et al.] // Proc Natl Acad Sci USA. – 1996. – Vol.93. – P. 5925–5930. 73. Kuiper G.G. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta / Kuiper G.G., Lemmen J.G., Lemmen J.G. [et al.] // Endocrinology. – 1998. – Vol.139. – P. 4252–4263. 74. Kuter I. Dose-dependent change in biomarkers during neoadjuvant endocrine therapy with fulvestrant: results from NEWEST, a randomized Phase II study / Kuter I., Gee J.M., Hegg R. [et al.] // Breast Cancer Res Treat . – 2012. – Vol.133. - №1. – P. 237-246. 138 75. Lagerkrantz J. Human estrogen receptor b-gene structure, chromosomal localisation and expression pattern / Lagerkrantz J., Nordenskjo L.D., Gustafsson J.A. // J Clin Endocrinol Metab. – 1997. – Vol.82. – P. 4258– 4265. 76. Lazennec G. ERβ inhibits proliferation and invasion of breast cancer cells / Lazennec G., Bresson D., Lucas A. [et al.] // Endocrinology. – 2001. – Vol.142. – P. 4120-3410. 77. Legendre P. Coefficient of concordance / Legendre P. // Encyclopedia of Research Design. – 2010. – Vol.1. – 1776 PP. 78. Losel R. Nongenomic actions of steroid hormones / Losel R., Wehling M. // Nat Rev Mol Cell Biol. – 2003. – Vol.4 –P. 46–56. 79. Madeira M. Estrogen receptor alpha/beta ratio and estrogen receptor beta as predictors of endocrine therapy responsiveness–a randomized neoadjuvant trial comparison between anastrozole and tamoxifen for the treatment of postmenopausal breast cancer / Madeira M. // BMC Cancer. – 2013. – Vol.13. P. 425. 80. Makris A. Changes in hormone receptors and proliferation markers in tamoxifen treated breast cancer patients and the relationship with response / Makris A., Powles T., Allred D.C. [et al.] // Breast Cancer Res. Treat. – Vol.48. – P. 11-20. 81. Mangelsdorf D.J. The nuclear receptor superfamily: the second decade / Mangelsdorf D.J., Thummel C., Beato M. [et al.] // Cell. – 1998. – Vol.83. – P. 835–839. 82. Marotti J. Estrogen receptor-beta expression in invasive breast cancer in relation to molecular phenotype: results from the Nurses’ Health Study / Marotti J., Collins L., Hu R., Tamimi R. // Mod. Pathol. – 2010. – Vol.23. – P. 197-204. 83. Martin L.A. Pre-surgical study of the biological effects of the selective cyclo-oxygenase-2 inhibitor celecoxib in patients with primary breast 139 cancer / Martin L.A, Davies G.L., Weigel M.T. [et al.] // Breast Cancer Res Treat. – 2010. – Vol.123. - №3. – P. 829–836. 84. Masuda N. Neoadjuvant anastrozole versus tamoxifen in patients receiving goserelin for premenopausal breast cancer (STaGE): a double-blind, randomised phase 3 trial / Masuda N., Sagara Y., Kinoshita T. [et al.] // Lancet Oncol. – 2012. – Vol.4. – P. 345-352. 85. McInerney E.M. Different regions in activation function-1 of the human estrogen receptor required for antiestrogen- and estradiol-dependent transcription activation / McInerney E.M., Katzellenbogen B.S. // J Biol Chem. – 1996. – Vol.271. – P. 24172–24178. 86. Migliaccio A. Tyrosine kinase/p21ras/MAP-kinase pathway activation by estradiol-receptor complex in MCF-7 cells / Migliaccio A., Di Domenico M., Castoria G. [et al.] // EMBO J. – 1996. – Vol.15. – P. 1292–1300. 87. Miller W. Oestrogen receptor beta and neoadjuvant therapy with tamoxifen: prediction of response and effects of treatment / Miller W., Anderson T., Dixon J., Saunders P. // Br. J. Cancer. – 2006. – Vol.94. – P. 1333-1338. 88. Moore J.T. Cloning and characterisation of human estrogen receptor beta isoforms / Moore J.T., McKee D.D., Slentz-Kesler K. [et al.] // Biochem Biophys Res Comm. – 1998. – Vol.247. – P. 75-78. 89. Murphy L. Is oestrogen receptor- β a predictor of endocrine therapy responsiveness in human breast cancer? /Murphy L., Watson P. // Endocr Relat Cancer. – 2006. – Vol.13. – P. 327-334. 90. Murphy L. New insights into estogen receptor function in human breast cancer / Murphy L., Cherlet T., Lewis A., Banu Y., Watson P. // Annals of Medicine. – 2003. – Vol.35. – P. 614–631. 91. Myers E. Inverse relationship between ER-beta and SRC-1 predicts outcome in endocrine-resistant breast cancer / Myers E., Fleming F., Crotty T. [et al] // Br. J. Cancer. – 2004. – Vol. 91. – P. 1687-1693. 140 92. Nakopoulou L. The favourable prognostic value of oestrogen receptor beta immunohistochemical expression in breast cancer / Nakopoulou L., Lazaris A., Panayotopoulou E. [et al]. // J. Clin. Pathol. – 2004. – Vol.57. – P. 523528. 93. Novelli F. A divergent role for estrogen receptor-beta in node-positive and node-negative breast cancer classified according to molecular subtypes: an observational prospective study / Novelli F., Milella M., Melucci E. [et al.] // Breast Cancer Res. – 2008. – Vol.10. – P. 74. 94. O’Neill P. Wild-type oestrogen receptor beta (ERbeta1) mRNA and protein expression in Tamoxifen-treated post-menopausal breast cancers / O’Neill P., Davies M., Shaaban A. [et al.] // British Journal of Cancer. – 2004. – Vol.91 – P. - 1694–1702. 95. Osborne C. Steroid hormone receptors in breast cancer management / Osborne C. // Breast Cancer Research Treatment. – 1998. –Vol.51. – P. 227–238. 96. Paruthiyil S. Estrogen receptor β inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest / Paruthiyil S., Parmar H., Kerekatte V. [et al.] // Cancer Res. - 2004. – Vol.64. – P. 432-8. 97. Peng B. Putative functional characteristics of human estrogen receptor-beta isoforms / Peng B., Lu B., Leygue E., Murphy L. // Journal of Molecular Endocrinology. – 2003. – Vol.30. P. 13–29. 98. Perou C.M. Distinctive gene expression patterns in human mammary epithelial cells and breast cancers / Perou C.M., Jeffrey S.S., van de Rijn M. [et al.] // Proc Natl Acad Sci USA. - 1999 – Vol.96. – P. 9212–9217. 99. Pettersson K. Estrogen receptor β acts as a dominant regulator of estrogen signaling / Pettersson K., Delaunay F., Gustafsson J.A // Oncogene. – 2000. – Vol.19. – P. 4970-4978. 100.Poola I. Estrogen receptors β4 and β5 are full-length functionally distinct ERβ isoforms: cloning from human ovary and functional characterization / 141 Poola I., Abraham J., Baldwin K. [et al.] // Endocrine. – 2005. – Vol.27. – P. 227-238. 101.Rahmanzadeh R. Chromophore-assisted light inactivation of pKi-67 leads to inhibition of ribosomal RNA synthesis / Rahmanzadeh R, Huttmann G, Gerdes J, Scholzen T // Cell Prolif. – 2007. – Vol.40. – P. 422-430. 102.Razandi M.Cell membrane and nuclear estrogen receptors (ERs) originate from a single transcript: studies of ERα and ERβ expressed in Chinese hamster ovary cells / Razandi M., Pedram A., Greene G.L., Levin E.R. // Mol Endocrinol. – 1999. – Vol.13. – P. 307–319. 103.Regan M.M. Aassessment of letrozole and tamoxifen alone and in sequence for postmenopausal women with steroid hormone receptorpositive breast cancer: the BIG 1-98 randomised clinical trial at 8.1 years median follow-up / Regan M.M., Neven P., Giobbie-Hurder A. [et al.] // Lancet Oncol. – 2011. – Vol.12. – P. 1101-1108. 104.Sachelarie I. Primary Systemic Therapy of Breast Cancer /Sachelarie I., Grossbard M.L., Chadha M. [et al.] // The Oncologist. – 2006. – Vol.11. - №6. – P. 574-589. 105.Saji S. Clinical significance of estrogen receptor beta in breast cancer / Saji S., Hirose M., Toi M. // Cancer Chemotherapy and Pharmacology. – 2005. – Vol.56. – P. 21–26. 106.Semiglazov V.F. The relative efficacy of neoadjuvant endocrine therapy versus chemotherapy in postmenopausal women with ER positive breast cancer / Semiglazov V.F., Ivanov V.G., Ziltzova E.K. et al. // Proc Am Soc Clin Oncol. – 2004. – Vol.23. - 519. 107.Seol W. An orphan nuclear hormone receptor that lacks a DNA binding domain and heterodimerizes with other receptors / Seol W., Choi H.S., Moore D.D. // Science. – 1996. – Vol.272. – P. 1336–1339. 108.Shaaban A. Nuclear and cytoplasmic expression of ERbeta1, ERbeta2, and ERbeta5 identifies distinct prognostic outcome for breast cancer patients / 142 Shaaban A., Green A., Karthik S. [et al.] // Clin. Cancer Res. – 2008. – Vol.14. – P. 5228-5235. 109.Shibata H. Role of co-activators and co-repressors in the mechanism of steroid/thyroid receptor action / Shibata H., Spencer T.E., Onate S.A. [et al.] // Rec Prog Horm Res. -1997. – Vol.52. – P. 141–165. 110.Smith I.E. A phase II placebo-controlled trial of neoadjuvant anastrozole alone or with gefitinib in early breast cancer / Smith I.E., Walsh G., Skene A. [et al.] // J Clin Oncol. – 2007. – Vol.25. - №25. – P. 3816–3822. 111.Sorlie T. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications / Sorlie T., Perou C.M., Tibshirani R. [et al.] // Proc Natl Acad Sci USA. – 2001. – Vol.98. – P. 10869–10874. 112.Sorlie T. Repeated observation of breast tumor subtypes in independent gene expression data sets / Sorlie T., Tibshirani R., Parker J., [et al.] // Proc Natl Acad Sci USA. – 2003. – Vol.100. – P. 8418–8423. 113.Sotoca A.M. Influence of cellular ERalpha/ERbeta ratio on the ERalphaagonist induced proliferation of human T47D breast cancer cells / Sotoca A.M., van den Berg H., Vervoort J. [et al.] // Toxicol Sci. – 2008. – Vol.105. - №2. – P. 303-311. 114.Stewart J. Estrogen and progesterone receptors: correlation of response rates, site and timing of receptor analysis / Stewart J., King R., Hayward J. [et al.] // Breast Cancer Res Treat. – 1982. –Vol.2. – P. 243-250. 115.Sugiura H. Expression of estrogen receptor beta wild-type and its variant ERbetacx/beta2 is correlated with better prognosis in breast cancer / Sugiura H., Toyama T., Hara Y. [et al.] // Jpn. J. Clin. Oncol. – 2007 – Vol.37. – P. 820-828. 116.Truin W. Effect of adjuvant chemotherapy in postmenopausal patients with invasive ductal versus lobular breast cancer / Truin W., Voogd A., Vreugdenhil G. [et al.] // Ann Oncol. – 2012. – Vol.10. - P. 1093. 143 117.Tsai M.G. Molecular mechanisms of action of steroid/thyroid receptor superfamily members / Tsai M.G., O’Malley B.W. // Annu Rev Biochem. – 1994. – Vol.63. – P. 451–486. 118.Von Maillot K. Steroid receptors and response to endocrine treatment and chemotherapy of advanced breast cancer / Von Maillot K., Gentsch H.H., Gunselmann W. // J Cancer Res Clin Oncol. – 1980. – Vol.98. – P. 301-313. 119.Warner M. The role of estrogen receptor beta (ERbeta) in malignant diseases – a new potential target for antiproliferative drugs in prevention and treatment of cancer / Warner M., Gustafsson J. // Biochem. Biophys. Res. Commun. – 2010. – Vol. 396. – P. 63–66. 120.Yan Y. Expression of both Estrogen Receptor-beta 1 (ER-β1) and its coregulator Steroid Receptor RNA Activator Protein (SRAP) are predictive for benefit from tamoxifen therapy in patients with Estrogen Receptoralpha (ER-α)-Negative Early Breast Cancer (EBC) / Yan Y., Li X., Blanchard A. [et al.] // Annals of Oncology. – 2013. – P. 1-8. 121.Zhao C. Estrogen receptor β2 negatively regulates the transactivation of estrogen receptor α in human breast cancer cells / Zhao C., Matthews J., Tujague M. [et al.] // Cancer Res. – 2007. – Vol.67. – P. 3955-3962. 144