Двойное слепое плацебоконтролируемое рандомизированное
реклама

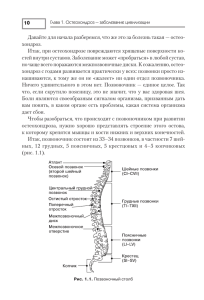
Клиническая больница №1 Института Традиционной Медицины провинции Гуанси, КНР Двойное слепое плацебоконтролируемое рандомизированное клиническое исследование эффективности и безопасности применения лечебного обезболивающего и противовоспалительного пластыря НАНОПЛАСТ форте (Nanoplast forte). Отчет Заявитель: Гуйчжоу Мяояо Фармасьютикл, Ко, Лтд., КНР, производитель. Клинические базы: 1. 2. 3. Клиническая больница №1 Института традиционной медицины г. ГУЙАН. Клиническая больница №1 Института традиционной медицины провинции Гуанси. Клиническая больница №1 Института традиционной медицины провинции Юуинань. Ответственное лицо: Начальник лаборатории клинических исследований Жу Ву. 2008 год 1 Содержание: 1. 2. 3. 4. 5. 6. 7. 8. Определение групп по нозологиям, критериям отбора и количеству пациентов в группах. Методы исследования. Статистические методы оценки. Стандарт оценки. Результаты испытаний. Выявленные побочные действия и методы их устранения. Анализ эффективности испытания. Заключение, выводы. Испытуемые образцы лейкопластыря (изделия медицинского назначения): размер 7х9 см. Описание препарата (инструкция). Показания к применению: остеоартроз, остеохондроз, в том числе крупных суставов, люмбаго, ишиас, ревматические артриты, посттравматические нарушения функции опорно‐ двигательного аппарата (растяжения связок и мышц, вправленные вывихи суставов). Использовать до 12 часов, наклеив на пораженную область. Подходит для ежедневного и длительного использования. Получено разрешение на проведение данного клинического испытания в провинции Гуйчжоу постановлением Минздрава КНР. Согласовано этическим комитетом. Всего приняло участие 180 человек на стационарном лечении. Из них 120 пациентов использовали действующий препарат, 60 человек – плацебо. 1. Определение групп по нозологиям и подбор пациентов по количеству и критериям отбора. Были использований критерии диагностики, принятые в западной медицине, а также в традиционной китайской медицине. Были отобраны следующие нозологии: Остеохондроз распространенный Гонартроз Поясничный остеохондроз Плечевой остеохондроз Шейный и грудной остеохондроз Закрытые травмы 2 Были отобраны следующие пациенты по тем же критериям. 1. Возраст от 18 до 65. 2. Обострение более трех дней. 3. Добровольное участие и подписание договора и информированного согласия. Не было разрешено участие пациентам: 1. Не соответствующим критериям отбора. 2. Имеющим в анамнезе: инсульт, инфаркт, нарушение функции сердечнососудистой системы; заболевания печени и почек в стадии декомпенсации; выраженную астению и психические заболевания. 3. Имеющим тяжелый аллергоанамнез. 4. Беременным и кормящим. 5. В состоянии травмы: переломы костей, открытые раны. 6. Страдающим раком. 7. Участвовавшим незадолго в других клинических исследованиях. 8. В течение 3 дней принимающих обезболивающие средства. 9. По отводу врача. Исключены из испытания пациенты: 1. 2. 3. У которых в процессе выявлено несоответствие согласно критериям отбора. Не явившиеся на лечение. Нерегулярно исполняющие предписания согласно программе. 2. Методы исследования. Двойное слепое плацебоконтролируемое рандомизированное исследование. Распределение пациентов по нозологиям Нозология Остеохондроз распространенный Гонартроз Поясничный остеохондроз Плечевой остеохондроз Шейный и грудной остеохондроз Закрытые травмы Итого: Количество пациентов, Количество принимающих плацебо действующий препарат 20 10 20 20 20 20 10 10 10 10 20 120 10 60 пациентов 3 3. Статистические методы оценки. Ведение карт осмотра и нумерация по системе SAS. У плацебо пациентов использован пластырь без действующих веществ. 1. 2. Метод лечения: 1. Каждый день по 1 пластырю по 12 часов в течение 7 дней. Некоторым пациентам – повторными курсами. 2. Плацебо – аналогично. 4. Стандарты оценки. 1. Линейная шкала оценки боли. 0 ‐10 баллов. 1‐ 3 слабая, 4‐6 средняя, 7‐0 тяжелая, 10 – нестерпимая. 2. Степень эффективности облегчения боли разделена на пять: 1. Нет облегчения 2. Легкая 25‐49% 3. Средняя 50‐74% 4. Выраженная 75‐95% 5. Полное обезболивание Результаты отбора по группам Первая группа пациентов – 120 человек применяла действующий препарат. Вторая группа применяла плацебо. По полу Группы пациентов 1 2 Количество пациентов 120 60 Муж Жен 57 28 63 32 По возрасту Группа 1 2 Количество 120 60 18‐30 10 2 31‐40 22 9 41‐50 68 40 51‐65 20 9 По количеству курсов Группы 1 2 Количество 120 60 0‐1 78 36 2‐3 42 24 4 По степени выраженности заболевания Группа 1 2 Количество 120 60 Легкая 63 31 Средняя 55 28 Тяжелая 2 1 5. Результаты испытаний. Эффективность лечения в целом Группа Количество 1 2 120 60 Очень Заметное 66 4 Заметное Нет 46 5 8 51 % эффективности 93.33% 15.00% Эффективность лечения по нозологиям Нозология Группы Остеохондроз 1 распространенный 2 Гонартроз 1 2 Поясничный 1 остеохондроз 2 Плечевой 1 остеохондроз 2 Закрытые травмы 1 2 Шейный и 1 грудной 2 остеохондроз Количество Очень заметно 20 10 10 1 20 15 10 1 20 12 10 0 20 12 10 2 20 9 10 0 20 8 10 0 Заметно Нет 8 1 4 1 7 0 7 0 9 2 11 1 2 8 1 8 1 10 1 8 2 8 1 9 % эффективности 90% 20% 95% 20% 95% 0% 95% 20% 90% 20% 95% 10% 6. Выявленные побочные действия и методы их устранения. Побочные эффекты и действия. Во время применения у некоторых пациентов возникли аллергические реакции: Покраснение избыточное(2), зуд (1), отечность (1), пузырь на коже (1). Всего 5 пациентов из 120 использующих действующий пластырь, что составляет 4,16% случаев (весьма невысокий процент побочных эффектов). 5 Данные побочные эффекты (за исключением развития кожного пузыря) были скоропроходящими и не потребовали отмены использования. Пациенту с пузырем возобновили терапию пластырем после нормализации кожных покровов в месте появления пузыря без выявления каких бы то ни было других побочных эффектов. Не было случая отмены использования пластыря из‐за побочных эффектов. Констатирована высокая безопасность применения. Также отмечено слабое крепление пластыря в 2 случаях на фоне избыточной потливости. Данное замечание не принято во внимание. 7. Анализ эффективности Общая эффективность: Лечение 120 пациентов показало свою высокую эффективность до 93.33% по сравнению с контрольной плацебо‐группой в 15%. Выявлен очень заметный обезболивающий эффект, а также противовоспалительное и нормализующее обмен действия. Кроме того, выявлена высокая эффективность по нозологиям. 1. Остеохондроз распространенный 90% и 20% соответственно группам 1 и 2 2. Гонартроз 95% и 20% 3. Поясничный остеохондроз (люмбаго) 95% и 0% 4. Плечевой остеохондроз 95% и 20% 5. Закрытые травмы 90% и 20% 6. Шейный и грудной остеохондроз 95% и 10% 8. Заключение и выводы По результатам проведенных клинических испытаний и анализа эффективности сделаны следующие выводы: 1. Высокая эффективность лечения представленных нозологий в целом. 2. Безопасность применения. 3. Выраженный обезболивающий и противовоспалительный эффект. 4. Стимуляция и нормализация крово‐ и лимфообращения. 5. Восстановление функции пораженных органов опорно‐двигательного аппарата (суставы, мышцы и связки). 6. Отсутствие значимых побочных эффектов, требующих отмены использования и весьма невысокий процент (4,16%) проходящих побочных эффектов, не требующих отмены терапии. 6 Область применения. Рекомендации. 1. Широкие терапевтические показания в применении данного пластыря по исследованным и смежным нозологиям. 2. НАНОПЛАСТ форте рекомендован для использования в народной армии КНР. 3. Противопоказано использование при открытых ранах, а также беременным. 4. Возможны аллергические реакции. При легкой выраженности нет необходимости отмены препарата. 5. В среднем пластырь рекомендовано использовать от 1 до 9 дней в зависимости от состояния развития болезни (болевого синдрома), при самоконтроле пациентом или назначении и контроле врачом, в том числе используя пластырь терапевтическими курсами. Исполнители: Лэй Лун, профессор, мануальный терапевт, иглорефлексотерапевт Хуан Чжунь, профессор, иглорефлексотерапевт Танг Диан, профессор, ревматолог Гу Чхау, профессор, ревматолог 7