Приложения к работе
реклама
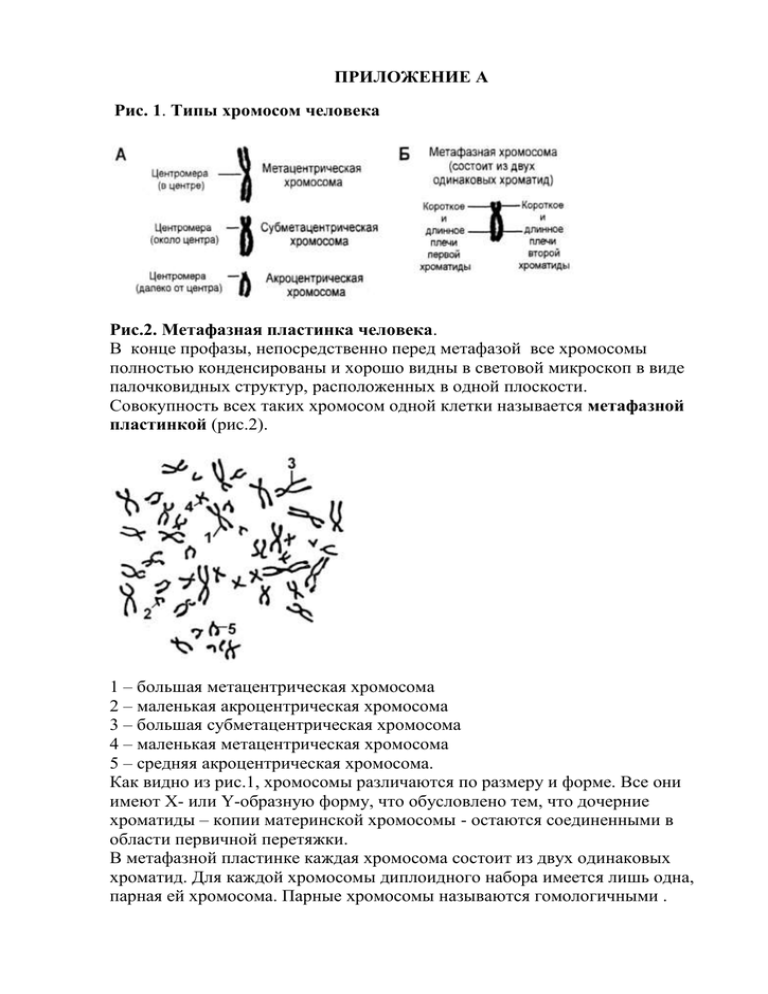
ПРИЛОЖЕНИЕ А Рис. 1. Типы хромосом человека Рис.2. Метафазная пластинка человека. В конце профазы, непосредственно перед метафазой все хромосомы полностью конденсированы и хорошо видны в световой микроскоп в виде палочковидных структур, расположенных в одной плоскости. Совокупность всех таких хромосом одной клетки называется метафазной пластинкой (рис.2). 1 – большая метацентрическая хромосома 2 – маленькая акроцентрическая хромосома 3 – большая субметацентрическая хромосома 4 – маленькая метацентрическая хромосома 5 – средняя акроцентрическая хромосома. Как видно из рис.1, хромосомы различаются по размеру и форме. Все они имеют Х- или Y-образную форму, что обусловлено тем, что дочерние хроматиды – копии материнской хромосомы - остаются соединенными в области первичной перетяжки. В метафазной пластинке каждая хромосома состоит из двух одинаковых хроматид. Для каждой хромосомы диплоидного набора имеется лишь одна, парная ей хромосома. Парные хромосомы называются гомологичными . ПРИЛОЖЕНИЕ Б Нормальная кариограмма человека. Представлена кариограмма мужчины с нормальным кариотипом. В прямоугольной рамке показаны половые хромосомы женщины с нормальным кариотипом В первых семи рядах кариограммы представлены аутосомы групп A – G. Они одинаковы в кариотипах мужского и женского организмов. В последнем ряду представлены половые хромосомы. В мужском кариотипе это Х-хромосома группы С и Y-хромосома группы G. В женском кариотипе это две Ххромосомы. Таким образом, кариограммы мужского и женского организмов легко отличить друг от друга: кариограмма женского организма содержит две одинаковые метацентрические хромосомы среднего размера – Х-хромосомы, а кариограмма мужского организма содержит две разные по размеру и форме хромосомы: одну метацентрическую хромосому среднего размера – Ххромосому и одну акроцентрическую хромосому небольшого размера – Yхромосому. ПРИЛОЖЕНИЕ В Схематическое изображение дифференциальной R– окраски хромосом при использовании красителя Романовского –Гизмы. Хроматин клеточного ядра подразделяется на два основных типа: на эу- и гетерохроматин. Это наследственный материал различной степени спирализации и упаковки белками различной степени конденсации. Эухроматин в метафазных пластинах в виде светлых полос. В эухроматине находятся структурные активные уникальные гены, которые контролируют развитие признаков организма. Эухроматин менее плотно упакован и доступен для ферментов РНК – полимераз, обеспечивающих синтез и – РНК, а затем синтез белков. Гетерохроматин определяется в метафазных хромосомах виде темных полос различных размеров,состоящих из конденсированной (спирализованной) плотно упакованноймолекулы ДНК.Переписывания информации на и – РНК с данных участков не происходит. Эти гены неактивны. ПРИЛОЖЕНИЕ Ж Анализ кариограммы человека. При анализе кариограммы человека следует придерживаться следующей последовательности действий. 1. Пронумеруйте пары гомологичных хромосом; нумеруйте их даже в том случае, если гомологичные хромосомы представлены не двумя, а одной или тремя хромосомами. 2.Найдите на кариограмме аутосомы и половые хромосомы. Половые хромосомы обычно располагают отдельно от аутосом. Нормальная кариограмма содержит 22 пары аутосом и 1 пару половых хромосом. Кариограмма больного человека может содержать 45- 46 аутосом и 1-3 половых хромосомы. 3.Определите пол человека по его кариограмме. Для этого внимательно изучите половые хромосомы. 4.Если все они одинаковые, среднего размера и метацентрические, значит все они – Х-хромосомы, а перед вами кариограмма женского организма. 5.Если среди половых хромосом есть небольшая акроцентрическая хромосома, значит это – Y-хромосома, а перед вами кариограмма мужского организма. 6.Посмотрите, все ли хромосомы представлены парами. 7.Если кариограмма содержит 23 пары хромосом, значит перед вами нормальная кариограмма человека. 8.Если в кариограмме те или иные хромосомы представлены 1 или 3 хромосомами, значит перед вами кариограмма с геномной мутацией – отсутствием или избытком хромосом. В этом случае кариограмма содержит 45 или 47 хромосом. 9. Определите порядковый номер пары хромосом, в которой обнаружена геномная мутация. Наиболее часто встречаются следующие аномалии: o аномалии числа аутосом: - дополнительная хромосома 13-й пары при с. Патау - дополнительная хромосома 18-й пары при с. Эдвардса - дополнительная хромосома 21-й пары при с. Дауна аномалии числа половых хромосом: - дополнительная Х-хромосома в женской кариограмме при с. Трисомии-Х - дополнительная Х-хромосома в мужской кариограмме при с. Клайнфельтера - дополнительная Y-хромосома в мужском кариотипе при с. лишней Yхромосомы - нехватка Х-хпромосомы в женском кариотипе при с. ШерешевскогоТернера. Анализ кариограммы завершается записью формулы кариотипа. Формула кариотипа включает в себя следующее: а) запись общего числа хромосом, б) запись сочетания половых хромосом, в) сведения об аномалии числа хромосом (если имеется): указывают хромосому и вид аномалии. Например: - формула кариотипа женщины, страдающей синдромом Дауна: 47, ХХ, 21+; - формула кариотипа мужчины, страдающего синдромом Клайнфельтера: 47, ХХY, - формула кариотипа женщины с синдромом Шерешевского-Тернера: 45, Х0. ПРИЛОЖЕНИЕ З Самостоятельная работа. 1. Пример анализа кариограммы человека. Кариограмма человека содержит 47 хромосом. Большинство хромосом расположено в порядке уменьшения их размеров. Это аутосомы. В нижнем ряду в стороне от них расположены три хромосомы. Это половые хромосомы. Все аутосомы представлены парами. Всего в кариограмме 22 пары аутосом. Половых хромосом – 3. Две из них – крупные и их первичная перетяжка – центромера – расположена почти посередине. Это Х-хромосомы. Рядом с ними находится небольшая хромосома с первичной перетяжкой, расположенной ближе к краю хромосомы. Это – Y-хромосома. Кариограмма принадлежит представителю мужского пола, так как имеется Y-хромосома. Кариограмма содержит аномалию: лишнюю Х-хромосому. Такая кариограмма характерна для особей мужского пола, страдающих синдромом Клайнфельтера. Формула кариотипа человека - 47, ХХY. 2. Задание для самостоятельной работы. Проведите анализ следующих кариограмм. Кариограмма 1. Кариограмма 2. Кариограмма 3. Кариограмма 4. ПРИЛОЖЕНИЕ К СИНДРОМ ЭДВАРДСА. КАРИОТИП 47,ХХ,+ 18 или 47,ХУ,+18. Впервые трисомия 18 была описана в 1960 г. Синдром Эдвардса встречается 1: 7000, причем поражение синдромом девочек происходит в 3 раза чаще по сравнению с мальчиками. Ученые высказывают предположение о наличии стабилизирующего действия Х-хромосомы при абберациях пары 18, а зиготы с трисомией 18, которые имеют мужской генотип, элиминируются. Причины синдрома Эдвардса. В качестве причины развития синдрома Эдвардса выступает наличие дополнительной 18-й хромосомы в кариотипе зиготы. Обычно лишняя хромосома появляется до того, как произошло оплодотворение, из-за нерасхождения хромосом в случае мейотического деления, в результате чего в половой клетке оказывается 24 хромосомы. Если при оплодотворении такой клеткой встречается гамета от противоположного пола, то ими образуется зигота с трисомией (47). Признаки синдрома Эдвардса. При наличии синдрома Эдвардса беременность длится дольше, чем нормальная, и ее продолжительность в среднем составляет 42 недели. В период беременности диагностируется многоводие и слабая активность плода. Размер плаценты меньше, чем обычно, часто обнаруживается только 1 пупочная артерия. Рождение многих детей происходит в асфиксии, имеется выраженная гипотрофия и очень низкая масса тела. Череп больных с синдромом Эдвардса долихоцефалический, имеет низкий лоб, затылок выступающий и более широкий. Часто наблюдается наличие микроцефалии или гидроцефалии. Глазные щели узкие, надглазничные валики сглажены, наблюдается птоз, эпикант, часто имеет место глазная патология. Переносье вдавленное, но спинка носа выступающая, тонкая, ушные раковины располагаются очень низко, мочки и козелок отсутствуют, завиток и противозавиток недоразвиты. Характерна микроретрогнатия. Рот имеет размеры меньше обычного, треугольной формы, верхняя губа короче, чем обычно. Небо высокое, иногда имеется расщелина, шея короткая, нередко имеется крыловидная складка. Отмечается разнообразие аномалий опорно-двигательного аппарата: грудина может быть укорочена, грудная клетка - расширена, таз узкий, присутствуют деформации конечностей, подвижность в тазобедренных суставах ограничена, отмечается наличие вывихов бедра. Пальцы и кисти короткие. Для трисомии 18 типичная форма стопы - в виде своеобразной «качалки». Отмечается наличие общей мышечной гипотонии. У мальчиков часто наблюдается крипторхизм, гипоспадия; у девочек - гипертрофия клитора. Относительно интеллектуального дефекта - он соответствует олигофрении в степени идиотии или имбецильности. У мозаичного варианта синдрома Эдвардса отличаются менее грубым умственным недоразвитием. Нередко отмечается развитие судорог. ПРИЛОЖЕНИЕ Л Синдром Патау – кариотип 47,ХХ,+15 или 47,ХУ,+15. Это хромосомная аномалия, синдром при котором у пациента есть дополнительная 13 хромосома, в связи с нерасхождением хромосом во время мейоза (также известный как трисомия 13 и трисомия D). Некоторые из них вызваны робертсоновской транслокацией. Дополнительная 13 хромосома нарушает нормальный ход развития ребенка, а именно возникновение дефектов сердца и почек, кроме других особенностей, характерных для синдрома Патау. Как и все болезни, которые вызваны нерасхождением (такие как синдром Дауна и синдром Эдвардса), риск возникновения этого синдрома у потомства увеличивается с возрастом матери при беременности (в среднем с 31 года). Синдром Патау поражает примерно 1 человека из 10000 новорожденных. Причины. В большинстве случаев причиной появления синдрома Патау является трисомия 13, которая означает, что каждая клетка тела имеет три копии 13 хромосомы вместо обычных двух. Кроме того, бывают случаи (их доля очень незначительна), когда лишь некоторые клетки организма имеют дополнительную копию хромосомы в результате смешанной популяции клеток с различным числом хромосом; такие случаи называют мозаичным синдромом Патау. Данное заболевание может также возникать, когда часть 13 хромосомы привязывается к другой хромосоме (транслокуется) до или в момент зачатия. Больные люди имеют две копии 13 хромосомы, плюс дополнительный материал из нее, подключенный к другой хромосоме. С транслокацией, человек имеет частичную трисомия 13 хромосомы, в связи с чем физические признаки синдрома часто отличаются от типичного случая. В большинстве случаев синдром Патау не наследуется, а возникает как случайное событие в процессе формирования половых клеток (яйцеклеток и сперматозоидов). Ошибка в делении клеток, которая называется нерасхождением, может привести к появлению репродуктивных клеток с аномальным числом хромосом. Например, яйцеклетка или сперматозоид могут получить дополнительную копию хромосомы. Если одна из этих атипичных половых клеток будет вовлечена в генетической структуре ребенка, ребенок будет иметь дополнительную 13 хромосому в каждой из клеток организма. Мозаицизм синдрома Патау также не наследуется, а возникает как случайное нарушение при делении клеток в начале развития плода. Здоровый человек может нести измененный генетический материал между 13 и другими хромосомами. Например, ассоциация DD хромосом. Люди, являющиеся носителями данного типа, находятся в зоне повышенного риска рождения детей с этим заболеванием, хотя они и не имеют признаков синдрома Патау. Проявления и физические признаки. Плод, который выживает в течение беременности и рождения, имеет следующие отклонения: Нервнаясистема: - отклонения психического и моторного развития; - микроцефалия; - голопрозэнцефалия (нарушение формирования полушарий мозга); - структурные дефекты глаз, в том числе микрофтальмия, аномалия Питерса, катаракта, колоб, дисплазия или отслоение сетчатки, сенсорный нистагм, пробковая потерю зрения и гипоплазия зрительного нерва; - менингомиелоцеле (спинномозговой дефект) Костно-мышечные и кожные: - полидактилия («лишние пальцы») - низко посаженные и деформированные ушные раковины; - выступающая пятка; - деформация ноги, стопа выглядит как качеля; - омфалоцеле (брюшной дефект, пупочная грыжа); - аномальный вид кисти; - перекрытие пальцами большого пальца; - врожденное отсутствие кожи (отсутствуют участки кожи / волос); - волчья пасть, заячья губа (расщепление неба). Урогенитальные: -аномальные гениталии; -дефекты почек. Другие: - пороки сердца (дефект межжелудочковой перегородки); - одна пуповинная артерия. Риск повторения. Если один из родителей является носителем транслокации, то шансы пары зачать ребенка из трисомией 13 составляют менее 1% (меньше, чем при синдроме Дауна). Признаки ПРИЛОЖЕНИЕ И Синдром Дауна – хромосомная аномалия, при которой в кариотипе имеются дополнительные копии генетического материала по 21-ой хромосоме, т. е. наблюдается трисомия по хромосоме 21. Впервые клиническое описание синдрома Дауна относится к 1866 г. Частота в популяции 1:600-650 новорожденных. Причины синдрома Дауна. Генетические механизмы развития синдрома Дауна кроются в количественном нарушении аутосом, когда к 21-ой паре хромосом присоединяется дополнительный генетический материал. Наличие трисомии по 21-ой хромосоме определяет черты, характерные для синдрома Дауна. Появление дополнительной хромосомы может быть обусловлено генетической случайностью (нерасхождением парных хромосом в овогенезе или сперматогенезе), нарушением клеточного деления уже после оплодотворения либо наследованием генетической мутации от матери или отца. С учетом этих механизмов в генетике различают три варианта аномалии кариотипа при синдроме Дауна: регулярную (простую) трисомию, мозаицизм и несбалансированную транслокацию. Большинство случаев синдрома Дауна (около 94%) связано с простой трисомией (кариотип 47,XX, 21+ или 47,ХY, 21+). При этом три копии 21-ой хромосомы присутствуют во всех клетках вследствие нарушения разделения парных хромосом во время мейоза в материнской или отцовской половых клетках. Около 1-2% случаев синдрома Дауна приходится на мозаичную форму, которая обусловлена нарушением митоза только в одной клетке зародыша, находящегося на стадии бластулы или гаструлы. При мозаицизме трисомия 21-ой хромосомы выявляется только в части клеток, а остальная часть клеток имеет нормальный хромосомный набор. Транслокационная форма синдрома Дауна встречается у 4-5% пациентов. В этом случае 21-я хромосома либо ее фрагмент прикрепляется (транслоцируется) к какой-либо из аутосом и при мейозе отходит вместе с ней во вновь образовавшуюся клетку. Наиболее частыми «объектами» транслокации служат хромосомы 14 и 15, реже – на 13, 22, 4 и 5. Такая перестройка хромосом может носить случайный характер или наследоваться от одного из родителей, являющегося носителем сбалансированной транслокации и имеющего нормальный фенотип. Если носителем транслокации выступает отец, то вероятность рождения ребенка с синдромом Дауна составляет 3%, если носительство связано с материнским генетическим материалом, риск возрастает до 10-15%. Факторы риска рождения детей с синдромом Дауна . Рождение ребенка с синдромом Дауна не связано с образом жизни, этнической принадлежностью и регионом проживания родителей. Единственным достоверно установленным фактором, повышающим риск, является возраст матери. Так, если у женщин до 25 лет вероятность рождения больного ребенка составляет 1:1400, к 35 годам - 1:400, к 40 годам -1:100, а 45- 1:35. Это связано со снижением контроля за процессом деления клеток и увеличением риска нерасхождения хромосом. Однако, поскольку частота родов у молодых женщин в целом выше, то по статистике 80% детей с синдромом Дауна рождается от матерей в возрасте до 35 лет. Возраст отца старше 42-45 лет также увеличивает риск рождения ребенка с синдромом Дауна. Среди прочих факторов риска- наличие в роду лиц с синдромом Дауна, близкородственные браки, возраст матери моложе 18 лет, случайные события, нарушающие нормальное развитие половых клеток или зародыша. Фенотипические признаки синдрома Дауна представлены брахицефалией, плоским лицом и затылком, монголоидным разрезом глазных щелей, эпикантом, кожной складкой на шее, укорочением конечностей, короткопалостью, поперечной ладонной складкой и др. Кроме внешних признаков часто встречаются пороки сердца и органов пищеварительного тракта, деформация скелета, иммунодефицитные состояния. Больные с синдромом Дауна отстают в умственном развитии. Синдром Дауна у ребенка может быть выявлен пренатально (по данным УЗИ, биопсии ворсин хориона, амниоцентеза, кордоцентеза) или после рождения на основании внешних признаков и генетического исследования. Дети с синдромом Дауна нуждаются в коррекции сопутствующих нарушений развития. ПРИЛОЖЕНИЕ Г КЛАССИФИКАЦИЯ НАСЛЕДСТВЕННОЙ ПАТОЛОГИИ Всю наследственную патологию можно разделить на пять групп. 1. Генные болезни — это заболевания, вызываемые мутациями отдельных генов. Мутация может быть выражена в виде замены основания в кодоне, замены кодона. Это приводит к изменению генетической информации. Они передаются из поколения в поколение и наследуются по законам Менделя. Классификация моногенных наследственных заболеваний основана на различных принципах. Генетический принцип: аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленные, У-сцепленные. Клинический принцип: в зависимости от пораженных систем органов. Патогенетический: болезни обмена веществ, синдромы множественных врожденных пороков развития, комбинированные формы. 2. Хромосомные болезни — это заболевания, возникающие в результате хромосомных и геномных мутаций. Геномные мутации это численные нарушения по отдельным хромосомам либо нарушение кратности полного гаплоидного набора хромосом (триплоидии, полиплоидии). Хромосомные мутации это структурные перестройки хромосом (аберрации). Внутрихромосомные: делеции, инверсии, дупликации. Межхромосомные: транслокации, центрическое слияние. 3. Болезни с наследственной предрасположенностью (мультифакториальные болезни) — это заболевания, возникающие в результате соответствующей генетической конституции и наличия определенных факторов внешней среды. При воздействии средовых факторов реализуется наследственная предрасположенность. Это - артериальная гипертензия, атеросклероз, сахарный диабет 1 типа. 4. Группа генетических болезней, возникающих в результате мутаций в соматических клетках (генетические соматические болезни), выделена совсем недавно. К ней относятся некоторые опухоли, отдельные пороки развития, аутоиммунные заболевания. 5. Болезни генетической несовместимости матери и плода. Они развиваются в результате иммунологической реакции организма матери на антиген плода. ПРИЛОЖЕНИЕ М Синдром Марфана Аутосомно- доминантный тип наследования. Синдром Марфана относится к моногенным болезням соединительной ткани. Причины. Патология обусловлена нарушением ферментных систем, контролирующих синтез структурных белков из которых происходит синтез соединительной ткани. Почти все эти болезни, входящие в состав синдрома, приводят к тяжелым инвалидизирующим расстройствам. Синдром Марфана впервые описан Вильямсом в 1876 г. Свое название заболевание получило от французского педиатра Марфана, наблюдавшего девочку с характерным симптомокомплексом болезни. Существует интересный факт, что первая девушка модель - Лесли Хорнби, которая послужила прототипом образа всех моделей, имела синдром Марфана. Так, установлено, что ряд всемирно известных людей страдали синдромом Марфана, среди них следует упомянуть президента США А. Линкольна и великого скрипача Паганини. Лесли Хорнби (Твигги) Симптомы синдрома Марфана Клиническая картина заболевания характеризуется поражением многих жизненно важных органов и систем: опорно-двигательного аппарата, сердечно-сосудистой системы, органов дыхания и зрения, ЦНС. Так, среди конституциональных особенностей и нарушений скелета наиболее часто встречаются долихопластический (астенический) тип, высокий рост (как правило, выше 180см) при выраженном дефиците массы тела (обычно ниже 50 кг.), арахнодактилия («паучьи» пальцы) кистей и стоп, кифосколиоз, воронкообразная или килевидная деформации грудной клетки, плоскостопие, узкий лицевой скелет, «готическое» небо. Не обязательно у одного человека встречаются все эти признаки, это лишь наиболее распространееные Внешний вид больного с синдромом Марфана Типичны также антимонголоидный разрез глаз, «крупный» нос, большие низкорасположенные ушные раковины, «птичье» выражение лица. У новорожденных из перечисленных особенностей скелета, как правило, выявляются только долихопластический тип и арахнодактилия. Остальные симптомы формируются в более поздние периоды развития (обычно в течение первых семи лет жизни ребенка). Поражение сердца и сосудов - один из кардинальных признаков синдрома Марфана. Наиболее типичны среди них - пролапс митрального клапана и аневризма аорты. Сердечно-сосудистые нарушения регистрируются уже на первом-втором годах жизни ребенка, при этом отмечается постепенное увеличение диаметра аорты, достигающее критических размеров (до 6 см и более), чаще в возрасте от 16 до 45 лет. Бронхолегочная система также вовлекается в патологический процесс при синдроме Марфана. Предпосылкой для этого являются механическое сдавление дыхательных путей при деформациях грудной клетки и изменения соединительнотканных структур легочной ткани. Нарушения органов дыхания в виде спонтанного пневмоторакса, легочной эмфиземы, инфаркта легкого встречаются с частотой от 10 до 75%. Типичная патология органа зрения при синдроме Марфана относится вывих и подвывих хрусталика (вследствие слабости цинновой связки). Как правило, эта патология сочетается с миопией или гиперметропией высокой степени. Подвывих хрусталиков диагностируется обычно на 1-5 годах жизни, а иногда даже в 7 лет при оформлении ребенка в школу. Реже встречаются вторичная глаукома, катаракта, отслойка сетчатки. Эти изменения чаще выявляются у больных более старшего возраста 15- 40 лет. IQ (коэффициент интеллектуального развития) у большинства детей с синдромом Марфана обычно соответствует норме – 85-115 единиц. Встречаются лица с очень высоким интеллектом, у которых IQ превышает верхнюю границу нормы -115 ед. Однако может иметь место определенное своеобразие психических процессов, которое проявляется в неравномерной интеллектуальной деятельности, а также в личностных особенностях больных (раздражительности, плаксивости, завышенной самооценке). Для всех детей с синдромом Марфана характерна низкая переносимость физической нагрузки, которая нередко сопровождается болями в мышцах. Возможны также периодические приступы мигренеподобной головной боли, возникающей, как правило, на фоне или после эмоционально-физических нагрузок. Диагностика синдрома Марфана Диагностика синдрома Марфана базируется на генеалогических данных (составление и анализ родословных) и анализе морфофенотипа, который включает изучение физического, нервно-психического развития детей. По резолюции совещания, посвященного синдрому Марфана, для постановки диагноза необходимо наличие минимум одного из пяти основных симптомов заболевания (вывих хрусталиков, аневризма аорты, арахнодактилия, деформация грудины, кифосколиоз) и двух дополнительных (миопия, пролапс митрального клапана, умеренная гиперподвижность суставов, высокий рост, плоскостопие, стрии, пневмоторакс). Лечение синдрома Марфана Детям с синдромом Марфана показана комплексная терапия, включающая широкий спектр лекарственных препаратов - средства, влияющие на сердечнососудистую систему, стимуляторы ЦНС, энерготропные препараты и антиоксиданты по схеме «Комплекс терапевтических воздействий, применяемый для лечения больных с синдромом Марфана» Наряду с медикаментозными средствами, детям с синдромом Марфана необходим также комплекс дополнительных лечебных воздействий, включающий магнитотерапию на суставы (курс 10 сеансов, 3 курса в год), электросон (курс 10 сеансов - дважды в год), лечебную физкультуру с преимущественным воздействием на опорно-двигательный аппарат. Под воздействием комплексной терапии у 78-80% детей с синдромом Марфана отмечаются улучшение или стабилизация основного патологического процесса. Профилактика синдрома Марфана Больным с синдромом Марфана, вступающим в брак, показано медикогенетическое консультирование, информация о степени повторного риска развития у детей аналогичного заболевания. Наряду с этим, необходима также пренатальная диагностика. Арахнодактилия ПРИЛОЖЕНИЕ Н ФЕНИЛКЕТОНУРИЯ (ФЕНИЛПИРОВИНОГРАДНАЯ ОЛИГОФРЕНИЯ) Аутосомно-рецессивное заболевание. Фенилкетонурия (ФКУ) — это одна из самых частых форм наследственных дефектов обмена аминокислот. Частота в европейских странах составляет 1:10000 новорожденных. Однако имеются значительные различия в частотах между популяциями. Так, например, в Турции она составляет 1:2 600, в Ирландии — 1:4 500, в Швеции — 1:30 000, в Японии — 1:119 000. Причины. В основе ФКУ лежит дефицит фенилаланин-4-гидроксилазы, фермента, контролирующего превращение фенилаланина в тирозин. Аутосомно-рецессивный ген, кодирующий данный фермент, картирован на 12-й хромосоме. Описаны формы фенилкетонурии с дефицитом других ферментов. В результате энзимного блока концентрация фенилаланина увеличивается в организме в десятки раз. Часть его выводится с мочой, а остальное количество превращается в фенилпировиноградную, фенилуксусную, фенилмолочную кислоты и другие фенилкетоновые производные, которые в норме присутствуют в организме, но в очень небольших концентрациях. Повышение концентрации этих токсических веществ ведет к нарушению формирования миелиновой оболочки вокруг аксонов в центральной нервной системе. Синдромы. Ребенок рождается без каких-либо симптомов заболевания, но с началом кормления в организм начинает поступать фенилаланин с молоком матери или с искусственным детским питанием и возникают первые симптомы заболевания. В первые месяцы жизни ребенок может быть беспокойным или, наоборот, вялым, сонливым. Отмечается гипопигментация кожи, волос, радужной оболочки (результат снижения уровня тирозина). От больного ребенка исходит своеобразный «мышиный запах». Неврологические симптомы не специфичны, наблюдаются не у всех больных и включают мышечную гипотонию или, наоборот, гипертонию, повышение рефлексов. У части детей отмечается микроцефалия. К полугодию выявляется задержка психомоторного развития. В это же время манифестируют экзематозные изменения на коже и судорожные приступы. У детей после трех лет клиническая картина характеризуется умственной отсталостью (в 95 % случаев это имбецильность или идиотия), нарушением поведения (чаще возбуждение, расторможенность, психотические расстройства), судорожным синдромом. Механизм развития заболевания. Заболевание наследуется только в том случае, если оба родителя (Аа) здоровы, но являются носителями измененного гена (а), который передали ребенку (аа), и поэтому встречается довольно редко. Вероятность того, что малыши будут страдать от фенилкетонурии, составляет 25%. А возможность того, что дети будут носителями патологического гена ФКУ, но сами останутся практически здоровыми, составляет 50%. Лечение. Фенилкетонурия — яркий пример наследственного заболевания с хорошим эффектом раннего профилактического лечения, когда ранняя диагностика заболевания и специфическая диетотерапия (резкое ограничение употребления в пищу фенилаланина) с первого месяца жизни ребенка предотвращает развитие умственной отсталости, нарушение поведения и другие проявления болезни. Диетотерапия проводится постоянно до пубертатного возраста под контролем уровня фенилаланина крови. Недостаток белка в пище компенсируется назначением белковыхгидролизатов. В результате лечения эти дети развиваются нормально, учатся в общеобразовательной школе, получают специальность. Однако у женщин, больных ФКУ, после отмены диетотерапии вновь увеличивается содержание фенилаланина в крови, что при беременности приводит к поражению плода (фенилаланиноваяэмбриопатия). Впоследствии у таких детей наблюдаются: микроцефалия, умственная отсталость, врожденные пороки сердца, низкая масса тела при рождении (менее 2500 г). Если же женщина вновь начинает строго соблюдать диету за несколько месяцев до планируемого зачатия и строго придерживается ее в течение всей беременности, то удается избежать рождения детей с различными отклонениями в развитии. Диагностика фенилкетонурии. В том случае, если есть подозрение, что один или оба родителя являются носителями гена ФКУ, то определить это можно в федеральных медикогенетических центрах. Для установления этого факта проводится генетическая экспертиза.На сегодняшний день все новорожденные дети массово обследуются на наличие фенилкетонурии. На территории России этот вопрос регламентирует приказ Минздрава РФ №316 от 30.12.1993 г. Процедура получила название неонатальный скрининг и является эффективным способом выявления наиболее распространенных наследственных заболеваний, среди них и ФКУ. В роддоме у каждого ребенка берут несколько капель периферической крови из пяточки. Это делается натощак. Проводится анализ крови на содержание в ней аминокислоты — фенилаланина. Результаты теста заносятся в обменную карту ребенка в виде штампа: «На ФКУ и ВГ обследован». В том случае, если в анализе обнаруживают измененный ген, то родителей с ребенком приглашают в медико-генетический центр для обследования. Для того, чтобы подтвердить или опровергнуть диагноз назначаются дополнительные исследования: в сухом пятне крови, в сыворотке крови, потовый тест, ДНКдиагностика. Мышечная дистрофия Дюшенна: а, б — псевдогипертрофия икроножных мышц, ряд последовательных движений при принятии вертикального положения (симптом «лестницы»); в — выраженный поясничный лордоз ПРИЛОЖЕНИЕ О ПСЕВДОГИПЕРТРОФИЧЕСКАЯ МЫШЕЧНАЯ ДИСТРОФИЯ ДЮШЕННА Х - сцепленные рецессивные заболевания. Это одна из самых частых форм наследственных нервно-мышечных заболеваний. Впервые она была описана в 1868 г. Мышечные дистрофии характеризуются дегенеративными изменениями в поперечно-полосатой мускулатуре без первичной патологии периферического мотонейрона. Частота ее составляет 1 : 3 000 — 1 : 5 0 0 0 мальчиков. Причина. Заболевание обусловлено нарушением синтеза белка дистрофина. Ген дистрофина локализован в коротком плече Х-хромосомы, клонирован и секвенирован. Это самый длинный ген из всех изученных. Синдромы. Основная симптоматика заболевания заключается в прогрессирующем нарастании мышечных дистрофических изменений с постепенным обездвиживанием больного. У детей до трехлетнего возраста диагностировать заболевание достаточно сложно. Известно, что эти дети несколько отстают в моторном развитии на первом году жизни — позже начинают сидеть, ходить. Никогда не бегают и не прыгают. Классическая картина заболевания проявляется у детей трех—пяти лет. Одним из первых признаков является уплотнение икроножных мышц и постепенное увеличение их объема за счет разрастания соединительной и жировой ткани. Уже в ранней стадии болезни у детей возникают затруднения при вставании с пола, с «корточек». Из наклоненного вперед положения ребенок поднимается «по себе» (рис. 5.5, а, б). Атрофии мышц бедра и тазового пояса нередко маскируются хорошо развитой подкожно-жировой клетчаткой. Постепенно процесс принимает восходящее направление и распространяется на плечевой пояс, мышцы спины, а затем и на проксимальные отделы рук. В терминальной стадии слабость мышц может распостраняться на мышцы лица, шеи, глотки. Характерны симптомы: утиная походка, поясничный лордоз, крыловидные лопатки. Часто страдает сердечная мышца, поэтому выявляются нарушения сердечного ритма, расширение границ сердца, изменения ЭКГ. Острая сердечная недостаточность – наиболее частая причина смерти. Примерно 50% детей снижение интеллекта. Погибают больные на третьем десятилетии жизни, а к 14-15 годам они обычно обездвижены.