Классификация аминов
реклама
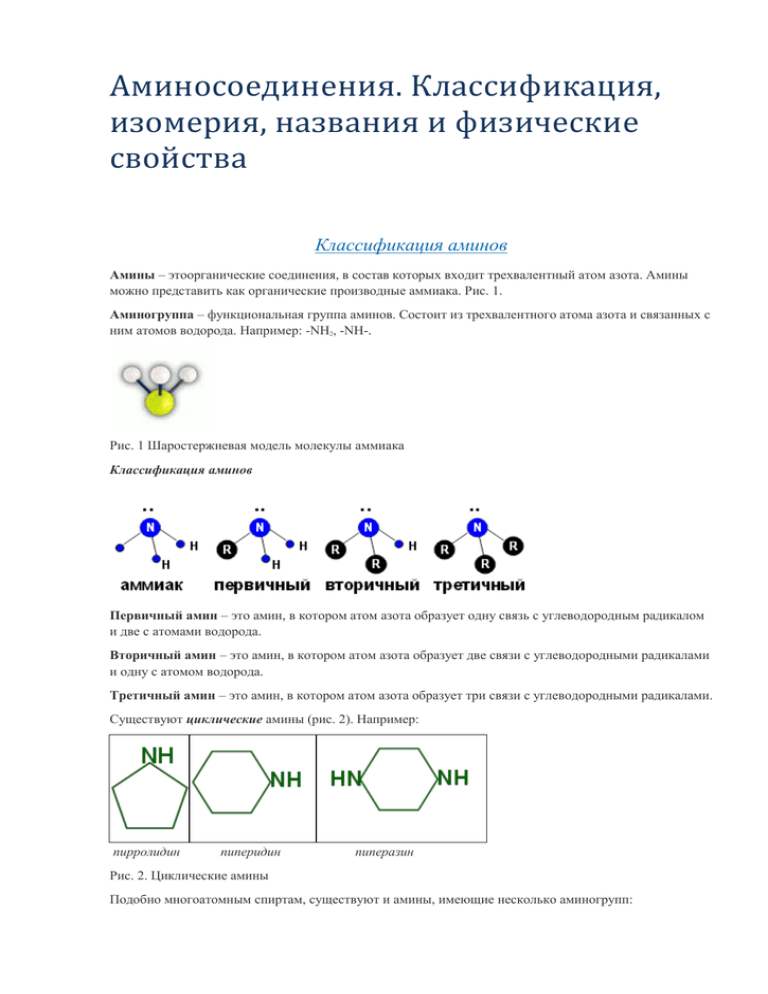
Аминосоединения. Классификация, изомерия, названия и физические свойства Классификация аминов Амины – этоорганические соединения, в состав которых входит трехвалентный атом азота. Амины можно представить как органические производные аммиака. Рис. 1. Аминогруппа – функциональная группа аминов. Состоит из трехвалентного атома азота и связанных с ним атомов водорода. Например: -NH2, -NH-. Рис. 1 Шаростержневая модель молекулы аммиака Классификация аминов Первичный амин – это амин, в котором атом азота образует одну связь с углеводородным радикалом и две с атомами водорода. Вторичный амин – это амин, в котором атом азота образует две связи с углеводородными радикалами и одну с атомом водорода. Третичный амин – это амин, в котором атом азота образует три связи с углеводородными радикалами. Существуют циклические амины (рис. 2). Например: пирролидин пиперидин пиперазин Рис. 2. Циклические амины Подобно многоатомным спиртам, существуют и амины, имеющие несколько аминогрупп: этилендиамин NH2-CH2-CH2-NH2 кадаверин NH2-(CH2)5-NH2 спермин NH2-(CH2)3-NH-(CH2)4-NH-(CH2)3-NH2 Номенклатура аминов Для построения названий первичных аминов используется суффикс «-амин» (или приставка «амино-»). метанамин CH3-NH2 пропанамин-2 гександиамин-1,6 NH2-(CH2)6-NH2 Эта номенклатура неудобна для вторичных и третичных аминов. Их названия строятся, исходя из корня «амин». К нему присоединяются приставки, обозначающие радикалы. Они перечисляются в алфавитном порядке. Первичные амины также можно называть таким образом. СH3-NH-C2H5 метилэтиламин СH3-NH-CH3 диметиламин CH3-NH2 метиламин Изомерия аминов Скелетная изомерия пропанамин-2, изопропиламин CH3-CH2-CH2-NH2 пропанамин-1, н-пропиламин Изомерия положения и взаимного положения аминогрупп NH2-(CH2)4-NH2 бутандиамин-1,4, путресцин бутандиамин-1,3, изопутресцин Оптическая изомерия В молекуле изопутресцина (см. выше) есть асимметрический атом углерода. Он выделен зеленым цветом и отвечает за существование двух разных оптическихизомеров этого соединения. Изомерия, связанная с перераспределением атомов углерода между углеводородными радикалами: CH3-CH2-CH2-NH2 н-пропиламин СH3-NH-C2H5 метилэтиламин N(CH3)3 триметиламин Физические свойства аминов Амины имеют резкий запах, с одной стороны, похожий на запах аммиака, а с другой – на запах гниющей рыбы. Полярность связи N-H и наличие водородных связей Þ 1. Большинство аминов – жидкости (только метиламин, этиламин, диметиламин и триметиламин – газы). 2. Хорошая растворимость в воде. Растворимость третичных аминов меньше, чем вторичных и первичных. Почему? Потому что у третичных аминов отсутствуют атомы водорода при атоме азот, нет сильно полярной связи N-H. Амины с большими углеводородными радикалами растворяются плохо. Почему? Потому что малополярные фрагменты алканов гидрофобны. Химические свойства аминов Строение аммиака и аминов Амины – это производные аммиака, в молекулах которых один или несколько атомов водорода замещены углеводородными радикалами. Химическая формула аммиака – NН3. Атом азота имеет 5 валентных электронов, из них три электрона участвуют в образовании связей с атомами водорода, а пара электронов остается свободной (Рис. 1). Рис. 1. Электронная формула молекулы аммиака Если атом водорода в молекуле аммиака заменить на углеводородный радикал, например метил, то получим органическое вещество – амин. Формула простейшего амина – СН3NH2. Это метиламин. В зависимости от числа замещенных водородных атомов в молекуле аммиака различают амины первичные (например, метиламин), вторичные (диметиламин) и третичные (триметиламин): СН3NH2 метиламин СН3–NH–СН3 диметиламин СН3–N–(СН3)2 триметиламин Основные свойства аминов Свободная электронная пара на атоме азота сохраняется в молекуле амина, следовательно, свойства аминов сходны со свойствами аммиака. Неподеленная пара электронов атома азота способна взаимодействовать с вакантной орбиталью иона водорода Н+ по донорно-акцепторному механизму (Рис. 2). катион аммония катион метиламмония Рис. 2. Донорно-акцепторный механизм образования ковалентной связи в катионах аммония и метиламмония Амины – более сильные основания, чем аммиак. Например, метиламин – более сильное основание, чем аммиак. Диметиламин за счет электронной плотности, подающейся на атом азота от второго радикала, обладает еще более сильными основными свойствами, чем метиламин. Однако триметиламин (из-за пространственного эффекта) по основности занимает промежуточное положение между аммиаком и метиламином (Рис. 3). Следует заметить, что все амины являются более слабыми основаниями, чем щелочи. Рис. 3. Сравнение основных свойств аммиака и аминов Основность аминов в первую очередь проявляется в их реакциях с водой и кислотами. Подобно аммиаку, амины при растворении в воде присоединяют ион водорода из молекулы воды, образуя связь N→H по донорно-акцепторному механизму. В результате в растворе накапливаются гидроксид-ионы, и он становится щелочным: Лакмус в растворах аминов приобретает синий цвет, фенолфталеин – малиновый. Как основания, амины реагируют с кислотами, образуя соли: СН3-NH2 + НCl ↔ [СН3-NH3]Cl Соли аминов (как и соли аммония) – кристаллические вещества ионного строения, хорошо растворимы в воде. В водных растворах они диссоциируют как сильные электролиты: [СН3-NH3]Cl = [СН3-NH3]+ + ClЩелочи, как более сильные основания, вытесняют амины (как и аммиак) из их солей при небольшом нагревании: [СН3-NH3]Cl + NaOH → СН3-NH2 + NaCl + H2O Горение аминов Газообразные амины, в отличие от аммиака, горят на воздухе. При этом образуются углекислый газ, вода и молекулярный азот: 4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2 Горение аминов Наиболее общие свойства всех органических соединений – способность их гореть. Сам аммиак горит и, в общем, легко, но поджечь его не всегда просто. В отличие от него амины загораются легко и горят чаще всего бесцветным или малоокрашенным пламенем. При этом азот аминов традиционно окисляется до молекулярного азота, поскольку оксиды азота малоустойчивы. Амины загораются на воздухе легче, чем аммиак. 4NH3 + 3O2 = 2N2 + 6H2O; 4С2H5NH2 + 15O2 = 8CO2 + 14H2O + 2N2. Основность аминов Основные свойства Первичные, вторичные и третичные амины обязательно содержат неподеленную электронную пару, как и полагается трехвалентному азоту. То есть амины в растворе проявляют основные свойства, или их растворы являются основаниями. Именно поэтому амины в водном растворе окрашивают лакмус в синий цвет, а фенолфталеин в малиновый. Рис. 1, 2. Рис. 1. Окраска лакмуса с аминами Рис. 2. Фенолфталеин с аминами Благодаря этой электронной паре может образовываться донорно-акцепторная связь с ионом водорода: С2Н5NH2 + H+ = C2H5NH3+. Таким образом, подобно аммиаку, амины проявляют свойства оснований: NH3 + H2O С2Н5NH2 + H2O NH4OH; C2H5NH3OH. С кислотами аммиак образует соли аммония, а амины – алкиламмония: NH3 + HBr = NH4Br (бромид аммония) С2Н5NH2 + HBr = C2H5NH3Br (бромид этиламмония) Точно так же, как с кислотами аммиак образует соли аммония, амины образуют соответствующие соли. Эти соли могут быть образованы, как и в случае аммиака, не только при реакции водных растворов, но и в газовой фазе, если амины достаточно летучи. То есть, если поставить рядом сосуды с концентрированной соляной кислотой или даже с органической летучей, например уксусной, и сосуд с летучим амином, то скоро между ними в пространстве появится нечто напоминающее дым без огня, т. е. будут образовываться кристаллики, соответствующие соли алкиламина. Рис. 3. Рис. 3. Образование солей алкиламмония Щелочи вытесняют амины, являющиеся, как и аммиак, слабыми основаниями, из солей алкиламмония: NH4Cl + KOH = NH3 + KCl + H2O; CH3NH3Cl + KOH = CH3NH2 + KCl + H2O. Основные свойства аминов выше, чем у аммиака. Почему? Образование донорно-акцепторной связи с ионом водорода происходит тем легче, чем выше электронная плотность на атоме азота. Углеводородные радикалы содержат много электронов и охотно «делятся» ими с атомом азота (рис. 4). Рис. 4. Донорно-акцепторная связь с ионом водорода Однако основные свойства третичных аминов меньше, чем вторичных (сравните константы основности). Почему? В третичном амине атом азота со всех сторон окружен углеводородными радикалами, и его способность вступать в реакции затруднена. Нуклеофильное замещение Амины, подобно аммиаку, способны реагировать с галогеналканами, замещая атом галогена: СН3Br + NH3 = CH3NH2 + HBr; СH3NH2 + CH3Br = (CH3)2NH + HBr; (CH3)2NH + CH3Br = (CH3)3N + HBr. Замещать галоген могут и третичные амины, так что реакция может пойти и дальше. Образуется четвертичная аммониевая соль – бромид тетраметиламмония (CH3)4NBr: (CH3)3N + CH3Br = (CH3)4N+ + Br-. Особенности свойств анилина. Получение и применение аминов Строение анилина Простейший представитель класса ароматических аминов – анилин. Это маслянистая жидкость, немного растворимая в воде (рис. 1). Рис. 1. Анилин (Источник) Некоторые другие ароматические амины (рис. 2): орто-толуидин 2-нафтиламин 4-аминобифенил Рис. 2. Ароматические амины Как отражается на свойствах вещества сочетание бензольного кольца и заместителя, имеющего неподеленную электронную пару? Электронная пара азота втягивается в ароматическую систему (рис. 3): Рис. 3. Ароматическая система К чему это приводит? Основные свойства анилина Электронная пара анилина «втянута» в общую ароматическую систему, и электронная плотность на азоте анилина понижена. Значит, анилин будет более слабым основанием, чем амины и аммиак. Анилин не меняет окраску лакмуса и фенолфталеина. Электрофильное замещение в анилине Повышенная электронная плотность в бензольном кольце (за счет втягивания электронной пары азота) приводит к облегчению электрофильного замещения, особенно в орто - и пара-положениях. Анилин реагирует с бромной водой, при этом сразу образуется 2,4,6-триброманилин – белый осадок (качественная реакция на анилин и другие аминбензолы). Вспомним: бензол взаимодействует с бромом только в присутствии катализатора (рис. 4). Рис. 4. Взаимодействие анилина с бромом Окисление анилина Высокая электронная плотность в бензольном кольце облегчает окисление анилина. Анилин обычно окрашен в коричневый цвет из-за того, что часть его окисляется кислородом воздуха даже в нормальных условиях. Применение анилина и аминов Из продуктов окисления анилина получают анилиновые красители, отличающиеся стойкостью и яркостью. Из анилина и аминов получают применяющиеся для местного наркоза анестезин и новокаин; противобактериальное средство стрептоцид; популярное обезболивающее и жаропонижающее средство парацетамол (рис. 5): Анестезин новокаин стрептоцид (пара-аминобензолсульфамид парацетамол (пара-ацетоаминофенол) Рис. 5. Производные анилина Анилин и амины – сырье для производства пластмасс, фотореактивов, взрывчатых веществ. Взрывчатое вещество гексил (гексанитродифениламин) (рис. 6): Рис. 6. Гексил Получение анилина и аминов 1. Нагревание галогеналканов с аммиаком или менее замещенными аминами (реакция Гофмана). СН3Br + NH3 = CH3NH2 + HBr (правильнее CH3NH3Br); СH3NH2 + CH3Br = (CH3)2NH + HBr (правильнее (CH3)2NH2Br); (CH3)2NH + CH3Br = (CH3)3N + HBr (правильнее (CH3)3NHBr). 2. Вытеснение аминов из их солей нагреванием со щелочами: CH3NH3Cl + KOH = CH3NH2 + KCl + H2O. 3. Восстановление нитро соединений (реакция Зинина): С6Н5NO2 + 3Fe + 6HCl = C6H5NH2 + 3FeCl2 + 2H2O; С6Н5NO2 + 3H2 С6Н5NH2 + 2H2O.