Формулы и названия некоторых важнейших карбоновых кислот
реклама
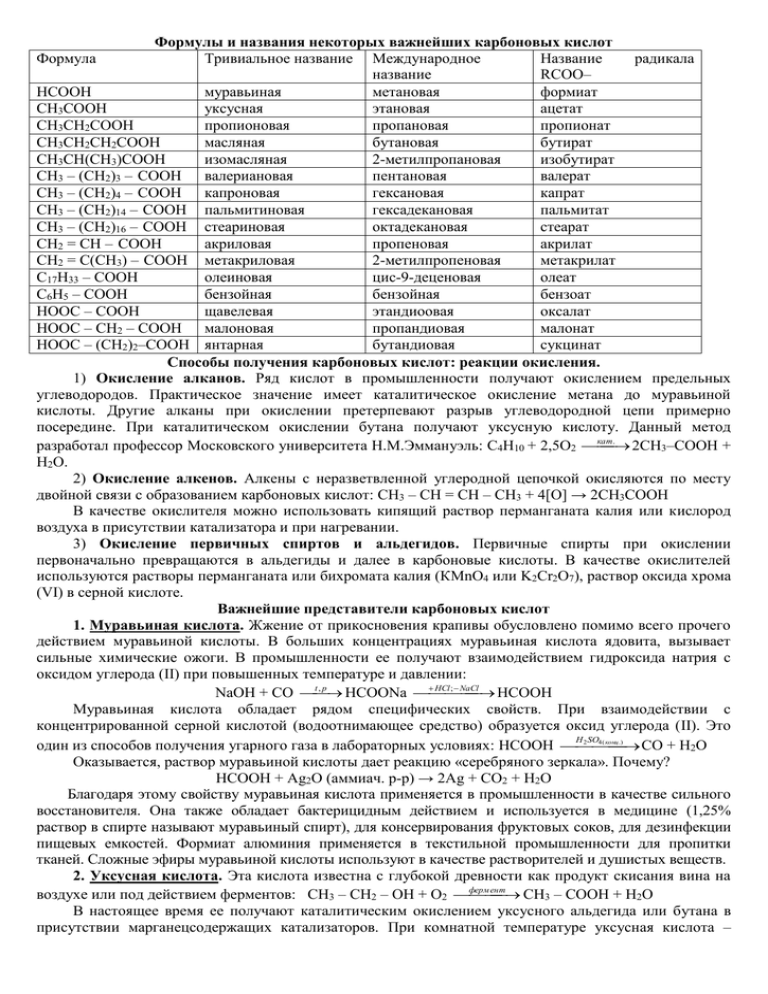
Формулы и названия некоторых важнейших карбоновых кислот Формула Тривиальное название Международное Название радикала название RCOO– HCOOH муравьиная метановая формиат CH3COOH уксусная этановая ацетат CH3CH2COOH пропионовая пропановая пропионат CH3CH2CH2COOH масляная бутановая бутират CH3CH(CH3)COOH изомасляная 2-метилпропановая изобутират CH3 – (CH2)3 – COOH валериановая пентановая валерат CH3 – (CH2)4 – COOH капроновая гексановая капрат CH3 – (CH2)14 – COOH пальмитиновая гексадекановая пальмитат CH3 – (CH2)16 – COOH стеариновая октадекановая стеарат CH2 = CH – COOH акриловая пропеновая акрилат CH2 = C(CH3) – COOH метакриловая 2-метилпропеновая метакрилат C17H33 – COOH олеиновая цис-9-деценовая олеат C6H5 – COOH бензойная бензойная бензоат HOOC – COOH щавелевая этандиоовая оксалат HOOC – CH2 – COOH малоновая пропандиовая малонат HOOC – (CH2)2–COOH янтарная бутандиовая сукцинат Способы получения карбоновых кислот: реакции окисления. 1) Окисление алканов. Ряд кислот в промышленности получают окислением предельных углеводородов. Практическое значение имеет каталитическое окисление метана до муравьиной кислоты. Другие алканы при окислении претерпевают разрыв углеводородной цепи примерно посередине. При каталитическом окислении бутана получают уксусную кислоту. Данный метод . 2СН3–СООН + разработал профессор Московского университета Н.М.Эммануэль: С4Н10 + 2,5О2 кат Н2О. 2) Окисление алкенов. Алкены с неразветвленной углеродной цепочкой окисляются по месту двойной связи с образованием карбоновых кислот: СН3 – СН = СН – СН3 + 4[O] → 2CH3COOH В качестве окислителя можно использовать кипящий раствор перманганата калия или кислород воздуха в присутствии катализатора и при нагревании. 3) Окисление первичных спиртов и альдегидов. Первичные спирты при окислении первоначально превращаются в альдегиды и далее в карбоновые кислоты. В качестве окислителей используются растворы перманганата или бихромата калия (КMnO4 или K2Cr2O7), раствор оксида хрома (VI) в серной кислоте. Важнейшие представители карбоновых кислот 1. Муравьиная кислота. Жжение от прикосновения крапивы обусловлено помимо всего прочего действием муравьиной кислоты. В больших концентрациях муравьиная кислота ядовита, вызывает сильные химические ожоги. В промышленности ее получают взаимодействием гидроксида натрия с оксидом углерода (II) при повышенных температуре и давлении: t, p HCl; NaCl HCOOH NaOH + CO HCOONa Муравьиная кислота обладает рядом специфических свойств. При взаимодействии с концентрированной серной кислотой (водоотнимающее средство) образуется оксид углерода (II). Это H 2 SO4 ( конц .) один из способов получения угарного газа в лабораторных условиях: HCOOH CO + H2O Оказывается, раствор муравьиной кислоты дает реакцию «серебряного зеркала». Почему? HCOOH + Ag2O (аммиач. р-р) → 2Ag + CO2 + H2O Благодаря этому свойству муравьиная кислота применяется в промышленности в качестве сильного восстановителя. Она также обладает бактерицидным действием и используется в медицине (1,25% раствор в спирте называют муравьиный спирт), для консервирования фруктовых соков, для дезинфекции пищевых емкостей. Формиат алюминия применяется в текстильной промышленности для пропитки тканей. Сложные эфиры муравьиной кислоты используют в качестве растворителей и душистых веществ. 2. Уксусная кислота. Эта кислота известна с глубокой древности как продукт скисания вина на ент СН3 – СООН + Н2О воздухе или под действием ферментов: СН3 – СН2 – ОН + О2 ферм В настоящее время ее получают каталитическим окислением уксусного альдегида или бутана в присутствии марганецсодержащих катализаторов. При комнатной температуре уксусная кислота – жидкость с резким запахом. Соли уксусной кислоты (ацетаты) хорошо растворимы в воде, за исключением ацетатов серебра и ртути (I). В отличие от муравьиной кислоты, уксусная кислота устойчива к окислению. Из всех карбоновых кислот уксусная кислота имеет наибольшее применение в промышленности. Основная часть производимой кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы. Уксусная кислота применяется в производстве красителей (индиго), медикаментов (аспирин), ядохимикатов (2,4 - Д), органического стекла. Сама кислота и ее эфиры являются хорошими растворителями. Раствор уксусной кислоты (38%-ный) используется в пищевой промышленности и в быту как вкусовое и консервирующее средство. В продажу поступает также 70%-ный раствор уксусной кислоты и 80%-ный, называемый уксусной эссенцией. 3. Высшие карбоновые кислоты. Карбоновые кислоты с числом углеродных атомов больше 10 широко распространены в природе, обычно они имеют четное число атомов углерода и неразветвленную цепь. Высшие карбоновые кислоты встречаются в виде сложных эфиров с низшими спиртами – в эфирных маслах, в виде сложных эфиров с высшими спиртами – в воске, в виде эфиров с трехатомным спиртом глицерином – в жирах. К числу важнейших гомологов принадлежат пальмитиновая (гексадекановая) и стеариновая (октадекановая) кислоты, имеющие соответственно формулы С15Н31СООН и С17Н35СООН с неразветвленной углеродной цепью. Получают названные кислоты каталитическим окислением парафина или гидролизом жиров. Основное количество производимых высших кислот идет на изготовление мыла и других поверхностно-активных веществ, а также стеариновых свечей. Несмотря на нерастворимость этих кислот в воде, их кислотные свойства легко обнаружить в жидком состоянии. Если расплавленной стеариновой свечей капнуть на индикаторную бумагу, она покраснеет. 4. Высшие непредельные кислоты. Высшие непредельные кислоты, содержащие одну, две или три двойных связи, широко распространены в природе и входят в состав растительных масел. Важнейшими представителями этих кислот являются олеиновая, линолевая и линоленовая кислоты: C17H33 – COOH CН3 – (СН2)7 – СН = СН – (СН2)7 – COOH олеиновая C17H31 – COOH CН3 – (СН2)4 – СН = СН – СН2 – СН = СН – (СН2)7 – COOH линолевая C17H29 – COOH CН3 – СН2 – СН = СН – СН2 – СН = СН – СН2 – СН = СН – (СН2)7 – COOH линоленовая Все приведенные непредельные кислоты имеют цис-расположение заместителей при двойных связях. Указанные соединения также сочетают в себе свойства карбоновых кислот и алкенов: образуют производные по карбонильной группе и способны к реакциям присоединения. Необходимые для жизнедеятельности человека линолевая и линоленовая кислоты не могут синтезироваться в организме и поступают в него только с растительными маслами. Они способствуют снижению содержания в крови холестерина. Способность непредельных кислот окисляться используется при изготовлении олифы из льняного и конопляного масла, в состав которых входят олеиновая и линолевая кислоты в виде сложных эфиров. 5. Бензойная кислота. Простейшим представителем ароматических карбоновых кислот является бензойная кислота С6Н5 – СООН. Она входит в состав различных природных смол, содержится в плодах и ягодах. В промышленности бензойную кислоту получают каталитическим окислением толуола воздухом при повышенных температуре и давлении в присутствии солей кобальта: , p , кат . 2С6Н5 – СООН + 2Н2О. 2С6Н5 – СН3 + 3О2 t Отличительной особенностью ароматических кислот является их склонность к t декарбоксилированию (разложению с выделением оксида углерода (IV)): С6Н5 – СООН С6Н6 + СО2. Ароматические кислоты сильнее алифатических, что объясняется акцепторными свойствами фенильного радикала. Соли бензойной кислоты называются бензоаты. Бензойную кислоту применяют в органическом синтезе для получения лекарственных препаратов, душистых веществ, красителей, а также в пищевой промышленности в качестве консерванта. 6. Щавелевая кислота. Щавелевая кислота НООС – СООН является простейшим представителем двухосновных карбоновых кислот. Она и ее соли (оксалаты) содержится в листьях растений: щавеля, ревеня, кислицы. При нарушении обмена веществ в организме человека образуются камни почек, представляющие собой нерастворимый в воде оксалат кальция. Щавелевая кислота кристаллизуется с двумя молекулами воды. Упрощенно формулу кристаллогидрата записывают Н2С2О4∙2Н2О. Взаимное влияние двух карбоксильных групп выражается в усилении кислотных свойств дикарбоновых кислот по сравнению с монокарбоновыми. Щавелевая кислота растворима в воде и проявляет восстановительные свойства. Раствором перманганата калия в кислой среде она окисляется до углекислого газа: 5Н2С2О4 + 2KMnO4 + 3H2SO4 → 10CO2 + 2MnSO4 + K2SO4 + 8H2O При нагревании с концентрированной серной кислотой щавелевая кислота разлагается на оксиды H 2SO 4 ( конц .) углерода (II) и (IV) и воду: Н2С2О4 СО2 + СО + Н2О Щавелевая кислота применяется в текстильной, кожевенной и пищевой промышленности.