Посттравматическая гидроцефалия
реклама
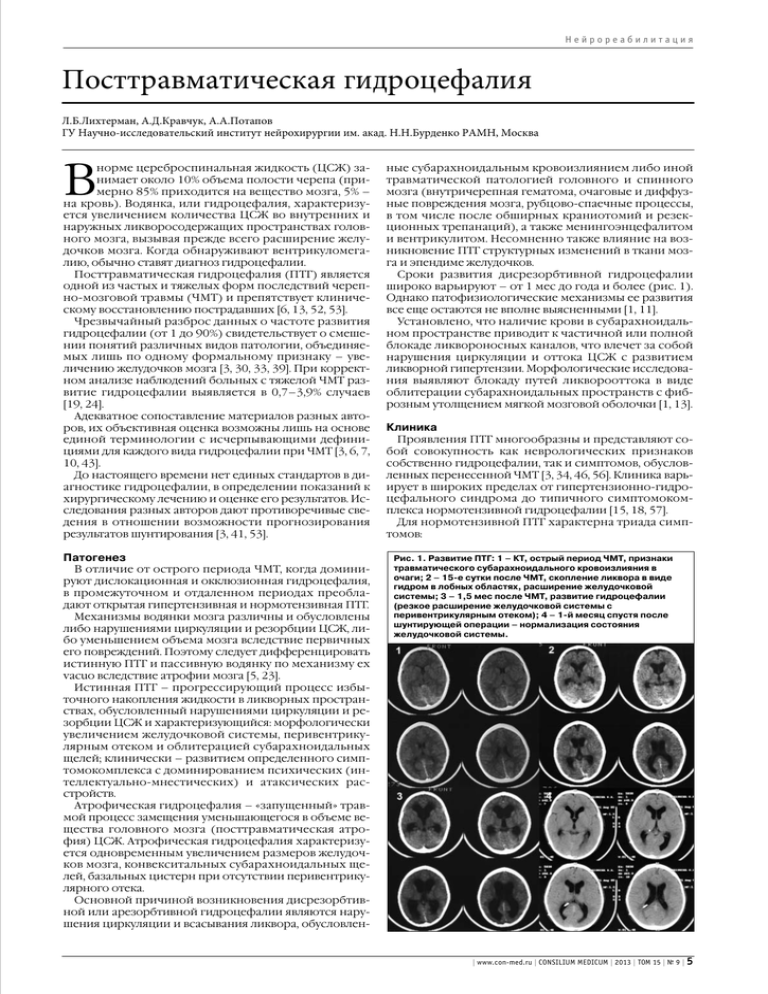
Нейрореабилитация Посттравматическая гидроцефалия Л.Б.Лихтерман, А.Д.Кравчук, А.А.Потапов ГУ Научно-исследовательский институт нейрохирургии им. акад. Н.Н.Бурденко РАМН, Москва В норме цереброспинальная жидкость (ЦСЖ) занимает около 10% объема полости черепа (примерно 85% приходится на вещество мозга, 5% – на кровь). Водянка, или гидроцефалия, характеризуется увеличением количества ЦСЖ во внутренних и наружных ликворосодержащих пространствах головного мозга, вызывая прежде всего расширение желудочков мозга. Когда обнаруживают вентрикуломегалию, обычно ставят диагноз гидроцефалии. Посттравматическая гидроцефалия (ПТГ) является одной из частых и тяжелых форм последствий черепно-мозговой травмы (ЧМТ) и препятствует клиническому восстановлению пострадавших [6, 13, 52, 53]. Чрезвычайный разброс данных о частоте развития гидроцефалии (от 1 до 90%) свидетельствует о смешении понятий различных видов патологии, объединяемых лишь по одному формальному признаку – увеличению желудочков мозга [3, 30, 33, 39]. При корректном анализе наблюдений больных с тяжелой ЧМТ развитие гидроцефалии выявляется в 0,7–3,9% случаев [19, 24]. Адекватное сопоставление материалов разных авторов, их объективная оценка возможны лишь на основе единой терминологии с исчерпывающими дефинициями для каждого вида гидроцефалии при ЧМТ [3, 6, 7, 10, 43]. До настоящего времени нет единых стандартов в диагностике гидроцефалии, в определении показаний к хирургическому лечению и оценке его результатов. Исследования разных авторов дают противоречивые сведения в отношении возможности прогнозирования результатов шунтирования [3, 41, 53]. Патогенез В отличие от острого периода ЧМТ, когда доминируют дислокационная и окклюзионная гидроцефалия, в промежуточном и отдаленном периодах преобладают открытая гипертензивная и нормотензивная ПТГ. Механизмы водянки мозга различны и обусловлены либо нарушениями циркуляции и резорбции ЦСЖ, либо уменьшением объема мозга вследствие первичных его повреждений. Поэтому следует дифференцировать истинную ПТГ и пассивную водянку по механизму ex vacuo вследствие атрофии мозга [5, 23]. Истинная ПТГ – прогрессирующий процесс избыточного накопления жидкости в ликворных пространствах, обусловленный нарушениями циркуляции и резорбции ЦСЖ и характеризующийся: морфологически увеличением желудочковой системы, перивентрикулярным отеком и облитерацией субарахноидальных щелей; клинически – развитием определенного симптомокомплекса с доминированием психических (интеллектуально-мнестических) и атаксических расстройств. Атрофическая гидроцефалия – «запущенный» травмой процесс замещения уменьшающегося в объеме вещества головного мозга (посттравматическая атрофия) ЦСЖ. Атрофическая гидроцефалия характеризуется одновременным увеличением размеров желудочков мозга, конвекситальных субарахноидальных щелей, базальных цистерн при отсутствии перивентрикулярного отека. Основной причиной возникновения дисрезорбтивной или арезорбтивной гидроцефалии являются нарушения циркуляции и всасывания ликвора, обусловлен- ные субарахноидальным кровоизлиянием либо иной травматической патологией головного и спинного мозга (внутричерепная гематома, очаговые и диффузные повреждения мозга, рубцово-спаечные процессы, в том числе после обширных краниотомий и резекционных трепанаций), а также менингоэнцефалитом и вентрикулитом. Несомненно также влияние на возникновение ПТГ структурных изменений в ткани мозга и эпендиме желудочков. Сроки развития дисрезорбтивной гидроцефалии широко варьируют – от 1 мес до года и более (рис. 1). Однако патофизиологические механизмы ее развития все еще остаются не вполне выясненными [1, 11]. Установлено, что наличие крови в субарахноидальном пространстве приводит к частичной или полной блокаде ликвороносных каналов, что влечет за собой нарушения циркуляции и оттока ЦСЖ с развитием ликворной гипертензии. Морфологические исследования выявляют блокаду путей ликворооттока в виде облитерации субарахноидальных пространств с фиброзным утолщением мягкой мозговой оболочки [1, 13]. Клиника Проявления ПТГ многообразны и представляют собой совокупность как неврологических признаков собственно гидроцефалии, так и симптомов, обусловленных перенесенной ЧМТ [3, 34, 46, 56]. Клиника варьирует в широких пределах от гипертензионно-гидроцефального синдрома до типичного симптомокомплекса нормотензивной гидроцефалии [15, 18, 57]. Для нормотензивной ПТГ характерна триада симптомов: Рис. 1. Развитие ПТГ: 1 – КТ, острый период ЧМТ, признаки травматического субарахноидального кровоизлияния в очаги; 2 – 15-е сутки после ЧМТ, скопление ликвора в виде гидром в лобных областях, расширение желудочковой системы; 3 – 1,5 мес после ЧМТ, развитие гидроцефалии (резкое расширение желудочковой системы с перивентрикулярным отеком); 4 – 1-й месяц спустя после шунтирующей операции – нормализация состояния желудочковой системы. | www.con-med.ru | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | 5 Нейрореабилитация Рис. 2. МР-трактографии при ПТГ – растяжение кортикоспинальных трактов расширенными желудочками мозга, более выраженное слева. 1) нарушение интеллекта и памяти; 2) расстройство походки; 3) отсутствие контроля за мочеиспусканием [25]. Как показал наш опыт, слагаемые этого симптомокомплекса часто выражены в различной степени; нормотензивная гидроцефалия может проявляться даже моносимптомно, в частности грубыми нарушениями походки. Неврологическая семиотика Общемозговая симптоматика Прежде всего важна оценка состояния сознания, варьирующего от ясного до грубых его нарушений, включая вегетативное состояние [3, 7]. Общемозговые проявления в виде головной боли, головокружения, тошноты, рвоты характерны для гипертензионной формы ПТГ и нетипичны для нормотензивной гидроцефалии. Эпилептические припадки обычно рассматриваются в кругу общемозговой симптоматики, хотя с не меньшим основанием их можно отнести и к очаговым признакам. Преимущественно отмечаются редкие общие генерализованные припадки с клоническими судорогами. В подавляющем большинстве случаев симптомы раздражения обусловлены не ПТГ, а предшествующей ЧМТ. Оболочечные симптомы – симптом Кернига и ригидность затылочных мышц обычно умеренно выражены и самостоятельного значения в клинике ПТГ не имеют. Состояние глазного дна – наиболее часто застойные явления наблюдаются при окклюзионных и открытых гипертензионных видах ПТГ. Очаговая симптоматика Двигательные нарушения различной степени выраженности присутствуют у подавляющего большинства больных. Являясь в основном отражением последствий ЧМТ и сочетаясь с симптоматикой, обусловленной ПТГ (нарушения походки), они характеризуются разнообразием проявлений. Пирамидный синдром может варьировать от полного отсутствия до грубых форм его выраженности в виде геми- и тетрапарезов. Нарастание гидроцефалии сопровождается их углублением. Вместе с тем паретические признаки сглаживаются вплоть до полного исчезновения после шунтирующих операций. 6 | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | www.con-med.ru | Подкорковый синдром при ПТГ часто выражается обеднением произвольных движений, скованностью, брадикинезией, гипомимией, тремором, пластическими изменениями мышечного тонуса, рефлексами орального автоматизма. Нарушения статики и координации – одни из ведущих симптомов гидроцефалии и проявляются нарушениями походки с характерным «прилипанием стоп к полу». Они связаны с развивающейся лобной атаксией и относятся к ранним признакам гидроцефалии [7, 22]. Последние данные магнитно-резонансной (МР) трактографии позволяют предположить, что в генезе моторных нарушений при гидроцефалии имеет значение растяжение кортикоспинальных трактов расширенными желудочками мозга (рис. 2). По мере прогрессирования гидроцефалии больные перестают ходить. При этом в лежачем положении у них, как правило, движения в ногах сохранены. Очевидно, что движения конечностей не могут быть проверены у больных в вегетативном состоянии и при грубой неврологической тетрасимптоматике. Уменьшение размеров желудочковой системы после шунтирующих операций сопровождается улучшением и нормализацией статики и походки, что подтверждает их зависимость от вентрикуломегалии. Речевые нарушения (включая моторные, сенсорные, амнестические) часто наблюдаются у больных с ПТГ. Сопровождаясь другими симптомами поражения доминантного полушария, они обычно отражают локализацию первичных травматических повреждений головного мозга. Неафатические речевые нарушения отмечаются реже в виде дизартрии и дисфонии. Стволовые симптомы в клинике ПТГ (спонтанный нистагм, нарушение сочетанных движений глазных яблок, нарушения глотания и др.) обусловлены в первую очередь последствиями перенесенной тяжелой ЧМТ. При окклюзионной гидроцефалии может отмечаться появление и углубление вторичных дислокационных стволовых знаков тенториального и заднечерепного уровня. Одним из важных признаков ПТГ являются нарушения функций тазовых органов, главным образом недержание мочи. Гидроцефальный генез дизурических расстройств подтверждается восстановлением контроля за мочеиспусканием после шунтирующих операций. Психопатологическая симптоматика Важнейшей и частой составляющей клиники ПТГ является психопатологическая симптоматика. Те или иные нарушения психики являются ведущими у более чем 1/2 больных. Степень их выраженности разнообразна: от умеренной – в виде снижения мнестикоинтеллектуальных функций, критики, памяти на фоне общего замедления двигательного поведения (при этом больные в большинстве способны к самообслуживанию и выполнению несложной работы) до грубой психопатологической симптоматики в сочетании с выраженным снижением мнестикоинтеллектуальных процессов, скованностью движений и замедлением речи. Возможно слабоумие, в рамках которого переплетаются, с одной стороны, нарастание аспонтанности, а с другой – периодические аффекты раздражения, агрессивность и т.д. В ряде случаев развитие ПТГ наблюдается при смене длительной комы вегетативным состоянием. Проведение шунтирующих операций в этих условиях может способствовать переходу больных на более высокий уровень бодрствования. Диагностика Основным вопросом дифференциальной диагностики остается необходимость четкого разграничения Нейрореабилитация Рис. 3. КТ-картина ПТГ (выраженное расширение желудочковой системы, отсутствие субарахноидальных щелей по конвексу, грубый перивентрикулярный отек с преимущественной локализацией в области передних рогов боковых желудочков). Рис. 4. Трехмерная КТ-реконструкция желудочковой системы у больного с ПТГ (выраженное расширение боковых желудочков, порэнцефалическая киста и менингоцеле лобной области справа). между вентрикуломегалией вследствие атрофии с расширением желудочков ex vacuo и собственно ПТГ, вызванной нарушениями резорбции и циркуляции ликвора. Нейровизуализационные технологии Анализ материала НИИ нейрохирургии им. акад. Н.Н.Бурденко и данные литературы позволили выделить КТ/МРТ-синдром ПТГ. Он включает: баллонообразное расширение боковых и III желудочков, перивентрикулярный отек, преимущественно в области передних рогов, и отсутствие субарахноидальных щелей по конвексу (рис. 3). В количественной оценке выраженности расширения боковых желудочков традиционно используются планиметрические коэффициенты (коэффициент Эванса и др.) и более точные магнитно-резонансные волюметрические методы [36]. Перивентрикулярный отек различной выраженности наблюдается у большей части больных с гипертензионными видами ПТГ, с преимущественной его локализацией в области передних рогов боковых желудочков. Отсутствие перивентрикулярного отека или его незначительность чаще встречаются при нормотензивной гидроцефалии. Сдавление субарахноидальных щелей вплоть до полного отсутствия их визуализации типично для гипертензионных видов ПТГ. При нормотензивной гидроцефалии часто отмечаются неравномерность и деформация субарахноидальных пространств и щелей, особенно у пожилых и стариков. При атрофии мозга обычно наблюдается диффузное увеличение не только желудочковой системы, но и субарахноидальных щелей. Однако, как считает A.Holodny и соавт. [28], расширение субарахноидальных пространств и щелей не всегда следует рассматривать только как признак атрофии, они могут сопровождать и течение гидроцефалии. Методы нейровизуализации позволяют выявлять различные типы ПТГ (открытая, окклюзионная). В ряде случаев уточнить уровни окклюзии желудочковой системы позволяет только магнитно-резонансная томография (МРТ). Таким образом, нарастающие КТ/МРТ-признаки расширения желудочковой системы с перивентрикулярным отеком и изменения субарахноидальных щелей свидетельствуют о развитии гидроцефалии после травмы [3, 7, 31, 35]; см. рис. 1, 4. По данным НИИ нейрохирургии им. акад. Н.Н.Бурденко, обычно уже в течение первых 1–2 нед после шунтирующих операций отмечается умеренное уменьшение размеров желудочковой системы и перивентрикулярного отека, становящееся более очевидным спустя 3–4 нед. Компьютерная томография (КТ) в сроки от 1 до 3 мес после оперативного лечения выявляет у подавляющего большинства больных положительную динамику в виде нормализации размеров желудочков, исчезновения перивентрикулярного отека и появления субарахноидальных щелей (по конвексу). Иногда отмечается диссоциация между очевидным клиническим улучшением и отсутствием динамики в размерах боковых желудочков. В более поздние сроки (от 4–6 мес после операции) существенных изменений КТ-картины обычно не наблюдается. Современные неинвазивные методы визуализации (КТ, МРТ) адекватны для диагностики ПТГ и позволяют с исчерпывающей полнотой судить о состоянии желудочковой системы, конвекситальных субарахноидальных щелей, базальных цистерн и о реакциях мозга в ответ на гидроцефалию, а также полноценно отражают динамику послеоперационных изменений (рис. 5). Наряду с традиционными нейровизуализационными методами в последнее время в диагностике гидроцефалии стала широко применяться МРТ в режиме фазового контраста (ФК МРТ). Метод связан с определением количественных и качественных характеристик ликворотока в области водопровода мозга, отверстия Мажанди и базальных субарахноидальных пространств. ФК МРТ позволяет исследовать различные параметры ликвородинамики, среди них наиболее важными, по данным литературы, являются объемный ликвороток, ударный объем ликвора, максимальная и средняя скорость ликворотока [8, 9, 44, 47, 50]. Считается, что скорость ликворотока на уровне водопровода мозга более 24,5 мл/мин имеет 95% специфичность для пациентов с гидроцефалией, а ударный объем ликвора более 42 мкл/с в большинстве случаев позволяет прогнозировать положительный эффект шунтирующей операции [9]. В качестве возможных предикторов позитивного исхода также рассматривают снижение ударного объема ликвора и гипердинамический характер лик- | www.con-med.ru | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | 7 Нейрореабилитация Рис. 5. КТ больного с ПТГ (1 – выраженное расширение желудочковой системы, отсутствие субарахноидальных щелей по конвексу, перивентрикулярный отек с преимущественной локализацией в области передних рогов боковых желудочков, посттравматическое менингоэнцефалоцеле); 2, 4, 5 – КТ, 3D-КТ после проведения шунтирующей операции – программируемая шунтирующая система, уровень низкого давления (нормализация размеров желудочковой системы, выраженное западение в области посттравматического костного дефекта), визуализация элементов шунтирующей системы по данным 3D-КТ; 3, 6 – КТ, 3D-КТ после пластической реконструкции обширного костного дефекта (методы компьютерного моделирования и лазерной стереолитографии). Рис. 6. Фазоконтрастная МРТ с кардиосинхронизацией визуализации ликворотока в области сильвиевого водопровода в различные стадии кардиоцикла с определением линейного и объемного ликворотока: 1 – область сильвиевого водопровода (диастола); 2 – тот же срез (систола). воротока в желудочковой системе с нормальными его параметрами на краниоспинальном уровне [9, 44]. При сравнительном анализе ФК МРТ и инвазивного мониторинга внутричерепного давления в оценке параметров ликвородинамики у пациентов с гидроцефалией исследователи сообщают о совпадении результатов в 82% [47] наблюдений. Чувствительность и специфичность ФК МРТ при определении скорости 8 | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | www.con-med.ru | ликворотока, по данным тех же авторов, составляют 90 и 50% соответственно [47]. Тем не менее на сегодняшний момент не существует единого мнения о клинической ценности ФК МРТ в диагностике гидроцефалии и построении прогностических моделей [32]. В нашей серии наблюдений у 22 пациентов с ПТГ проведена ФК МРТ (рис. 6). Определяли линейную ско- Нейрореабилитация рость ликворотока и площадь поперечного сечения водопровода мозга, вычисляли ударный объем ликвора. У 5 больных значение ударного объема ликвора значимо не отличалось от нормы (p>0,1). У 17 пациентов выявлено повышение этих показателей ликворотока по сравнению с нормативными значениями (p<0,05). Им проведены шунтирующие операции с положительными исходами во всех наблюдениях. У 5 из этих 17 больных проведен контроль ФК МРТ, у всех отмечена нормализация показателей ликворотока (p=0,12). Таким образом, превышение пороговых значений линейной скорости ликворотока и ударного объема ликвора в области водопровода мозга достаточно характерно для пациентов с ПТГ. ФК МРТ является неинвазивным дополнительным методом обследования пациентов с ПТГ. Рис. 7. Эндоскопическая перфорация дна III желудочка у больного с окклюзионной ПТГ. Инвазивная оценка циркуляции и резорбции ликвора К объективным методам инвазивной оценки состояния циркуляции и резорбции ликвора относятся: однократное выведение ликвора (Taptest), длительное наружное дренирование ликвора, инфузионные тесты с определением сопротивления оттока ликвора, скорости продукции ликвора, градиента упругости цереброспинальной системы, мониторирование внутричерепного давления и др. [3, 16, 39]. Инвазивную диагностику неоклюзионной открытой гидроцефалии следует начинать с выполнения люмбального теста – выведения 40–50 мл ликвора. При этом позитивная нейропсихологическая динамика и улучшение походки являются предикторами хорошего исхода шунтирующей операции. Чувствительность и специфичность метода составляют 62 и 33% соответственно [40]. Осложнения минимальны: как и после люмбальной пункции, иногда может возникнуть головная боль. Длительное дренирование ликвора (10 мл/ч в течение 3 сут) увеличивает чувствительность метода по сравнению с Taptest, однако повышает вероятность осложнений, в том числе воспалительного характера. Люмбальный инфузионный тест разработан для оценки резорбции ликвора. В его основе лежит введение дополнительного объема жидкости в субарахноидальное пространство спинного мозга с последующим измерением давления, сопротивления резорбции ликвора – Rout (мм рт. ст./мл/мин), определение уровня плато давления [40]. Пороговые значения сопротивления резорбции варьируют от 12 мм рт. ст./мл/мин до 18 мм рт. ст./мл/мин. Принято считать, что высокий уровень сопротивления резорбции ликвора положительно коррелирует с хорошим ответом на шунтирующую операцию. Чувствительность метода достаточно высока (57–100%), и он может быть полезен при отрицательных данных Taptest [40]. Ему отводится значительная роль в диагностике ПТГ, тем не менее ряд авторов считают недостаточным использование показателей сопротивления резорбции ликвора Rout как основного диагностического критерия [32, 37]. Будучи инвазивной процедурой, потенциально связанной с различными рисками, люмбальный инфузионный тест не является методом первоначального обследования пациентов с ПТГ. Обладая высокой прогностической способностью в оценке возможных исходов шунтирующих операций, инвазивные методы в настоящее время все же не рассматриваются в качестве стандарта диагностики гидроцефалии [40]. Радионуклидное исследование – качественный метод исследования нарушений ликвороциркуляции при ПТГ, в настоящее время имеет в основном исторический интерес. Пространственно-временное распределение радиофармпрепарата в ликворных простран- ствах головного и спинного мозга и его выведение позволяют судить о степени нарушений ликвородинамики, резорбции и оттока ЦСЖ. «Заброс» радиофармакологического препарата (РФП) в желудочковую систему, полный или частичный блок подоболочечных пространств, временные нарушения резорбции – классические радиологические признаки открытой формы ПТГ [42]. Хирургическое лечение Одним из наиболее эффективных методов лечения гидроцефалии является отведение ЦСЖ за пределы ликворных пространств с помощью шунтирующих систем [3, 7, 27, 48]. Возможности современных биоматериалов стимулировали разработку разнообразных шунтирующих систем, в основе которых лежат клапанные механизмы, работающие в различных режимах давления. Несмотря на новые технологии в изготовлении шунтов и внедрение программируемых систем, многие проблемы остаются нерешенными. Основной из них является сложности точного моделирования условий биомеханики циркуляции ЦСЖ у больных с гидроцефалией [11]. Показания к оперативному лечению ПТГ основываются на клинических (доминирование интеллектуально-мнестических и атаксических расстройств) и нейровизуализационных (КТ/МРТ – увеличение размеров желудочковой системы, сдавление субарахноидальных щелей, перивентрикулярный отек; ФК МРТ – изменение объемных параметров данных ликвородинамики), а также ликвородинамических тестах, свидетельствующих об активном прогрессирующем процессе избыточного накопления жидкости в ликворных пространствах и веществе головного мозга. В хирургии ПТГ используются шунтирующие и эндоскопические методы Варианты операции определяются видом гидроцефалии. При открытой гидроцефалии операциями выбора являются вентрикулоперитонеостомия, реже – вентрикулоатриостомия и люмбоперитонеостомия. При окклюзионной гидроцефалии также возможно использование эндоскопической III вентрикулостомии (рис. 7). Операция проводится с использованием жестких эндоскопов и их стереотаксической навигацией по предварительным КТ- или МРТ-расчетам. Визуально определяется топография III желудочка с идентификацией его структур и фенестрацией дна с нало- | www.con-med.ru | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | 9 Нейрореабилитация Рис. 8. Резкое спадение желудочковой системы вследствие гипердренажа – sрlit-синдром. Рис. 9. Гипердренаж после вентрикулоперитонеального дренирования с формированием хронической субдуральной гигромы. Рис. 10. 1, 2 – КТ ПТГ; 3, 4 – КТ после вентрикулоперитонеального шунтирования, выраженное западение боковых желудочков обусловило нарушение проходимости шунта вследствие обтурации вентрикулярного катетера (внедрение проксимальной части вентрикулярного катетера в ткани мозга). ций по поводу гидроцефалии около 1/2 этой суммы приходится на ревизии имплантированных шунтирующих систем [17]. Осложнениям, связанным с имплантацией шунтирующих систем при лечении гидроцефалии, посвящено большое количество работ. Характерными признаками нарушения функции шунта являются отрицательная клиническая динамика с возвращением к дооперационному уровню неврологической симптоматики и увеличение размеров желудочковой системы по данным КТ или МРТ [3, 21, 38]. Одной из наиболее частых причин осложнений при шунтирующих операциях является неадекватное избыточное дренирование ликвора, что наблюдается в 10–30% случаев [11, 21, 48]. Оно проявляется гипотензионными головными болями, резким спадением желудочковой системы (split-синдром). Это может обусловить развитие хронических субдуральных гематом, изоляции желудочков, обструкций вентрикулярного катетера и т.д. Использование программируемых шунтирующих систем в значительной степени позволяет решать проблему нормализации ликвородинамики [3, 14, 21]. В основе нарушения функции шунта могут лежать механические причины в виде обтурации проксимального или дистального катетера, разъединения системы, миграции катетеров в мозговую ткань или за пределы брюшной полости, затруднения оттока ликвора при ложных абдоминальных кистах и др. [3, 21, 49]. Наиболее сложным и тяжелым осложнением продолжают оставаться случаи инфицирования шунтов, частота которых достаточно велика и составляет в среднем 10–15% [12, 20, 27]. Целый ряд факторов может способствовать их инфицированию: возраст больного, тип шунта, опыт хирурга, длительность операции и др. Целесообразным считается использование антибиотикопрофилактики и катетеров с включением антибиотиков. Однако достоверных данных о снижении частоты инфицирования шунтов при этом нет [20, 21]. Раннее удаление шунта в сочетании с антибактериальной терапией рассматривается в качестве «золотого стандарта» при лечении случаев инфицирования шунтирующих систем [55]. Антибактериальная терапия, как правило, включает системное и интратекальное введение препаратов [3, 21]. Сохраняющийся высокий процент осложнений, связанный с имплантацией шунтирующих систем, требует дальнейших поисков и совершенствования методов лечения ПТГ. Послеоперационные осложнения и их анализ жением соустья между желудочковой системой и межножковой цистерной. Хирургическое лечение, показания к которому основаны на типичных клинических признаках открытой ПТГ, развившейся после ЧМТ, приводит к положительным результатам при шунтирующих операциях в 54–75% наблюдений [2, 5, 24, 35]. По данным J.Hirsch [27] и J.Drake, C.Sante Rose [21], около 70–80% всех имплантированных шунтов перестают функционировать в течение 10–12 лет после их установки. В США ежегодно при затратах почти 100 млн дол. США на проведение шунтирующих опера- 10 | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | www.con-med.ru | В нашей серии наблюдений осложнения в хирургии ПТГ отмечались у 57 (30,7%) больных. В 32 (17,2%) случаях они потребовали проведения повторных операций. Ведущими осложнениями явились нарушения функционирования шунтирующих систем – 36 (19,4%) пациентов. Несоответствие параметров шунта в ближайшем и отдаленном послеоперационном периодах проявляется неадекватным избыточным дренированием ликвора. При этом на фоне регресса КТ-признаков гидроцефалии наблюдается резкое спадение желудочковой системы – split-синдром (рис. 8), что может быть причиной развития хронической субдуральной гигромы (рис. 9). Такие осложнения, как миграция катетера с выходом из брюшной полости, обтурация катетеров на разных уровнях шунта, нарушение работы помпы, вызванные отложениями белка, фибрина и т.д., формирование псевдокист брюшной полости, – являлись наиболее частыми механическими причинами нарушения функционирования шунтирующих систем в более поздние сроки после операций (рис. 10, 11). В нашей серии наблюдений 96 больным имплантированы обычные шунтирующие системы, а 68 – про- Нейрореабилитация Рис. 11. Перитонеальная ликворная псевдокиста после введения РФП в помпу (вверху), распределения его по дистальному катетеру с локальным скоплением (киста) в брюшной полости. Рис. 12. Имплантация программируемой шунтирующей системы: 3 – КТ ПТГ у больного 24 лет, перенесшего тяжелую ЧМТ (резкое расширение желудочковой системы, отсутствие субарахноидальных щелей, обширная порэнцефалическая киста лобной области); 4 – КТ после проведенной шунтирующей операции – уменьшение размеров желудочковой системы (вентрикулярный катетер в просвете правого бокового желудочка); 1, 2 – неинвазивное изменение показателей программируемой шунтирующей системы в процессе подбора ее параметров. граммируемые системы. Во 2-й группе наблюдений отмечалось достоверное снижение случаев нарушений функций шунтирующих систем (p<0,05); рис. 12. Наиболее серьезные послеоперационные осложнения связаны с инфицированием шунтирующих систем – 15 (8,1%) пациентов. По нашим данным, наличие очагов хронической инфекции (трахеостомы, гастростомы и др.) является фактором риска их развития (p<0,01) [3]. При возникновении осложнений в условиях шунтозависимости мы использовали наружное дренирование ликвора на фоне антибиотикотерапии. После санации ликвора выполнялась реимплантация новой системы. Исходы лечения В нашей серии наблюдений проведены обследование и хирургическое лечение 186 пациентам с ПТГ (145 мужчин, 41 женщина). Средний возраст составил 30,9±16,4 года. Из разных механизмов травмы головы преобладали: автотравма – у 77 (41,4%) больных, удар головой и/или по голове – у 37 (19,9%), падение с высоты – у 31 (16,7%), огнестрельные ранения были у 4 (2,2%) пострадавших. У остальных пациентов механизм травмы остался невыясненным. Закрытая ЧМТ наблюдалась у 117 (62,9%) пациентов, открытая непроникающая – у 30 (16,1%), открытая проникающая – у 35 (18,8%), характер травмы остался неизвестным в 4 (2,2%) случаях. Изолированная ЧМТ отмечена в 136 (73,1%) наблюдениях и сочетанная – в 50 (26,9%). В 148 наблюдениях диагностирована открытая гидроцефалия, носившая в 130 случаях гипертензивный и в 18 – нормотензивный характер. Окклюзионная гидроцефалия наблюдалась у 38 пострадавших. Хирургическое лечение проведено всем больным: шунтирующие операции – 178 (98,9%), эндоскопическая вентрикулостомия III желудочка – 2 (1,1%) В послеоперационном периоде у 130 (70,9%) пациентов отмечалась положительная клиническая и нейровизуализационная динамика, в том числе 12 больных вышли из вегетативного состояния. У 25,4 больных с ПТГ, несмотря на работу шунтирующей системы (включая случаи ее ревизии), состояние не улучшилось – главным образом из-за других тяжелых последствий и осложнений перенесенной ЧМТ. Летальные исходы отмечены в 7 (3,7%) случаях, из них у 5 больных (находившихся в персистирующем вегетативном состоянии) причинами явились гнойновоспалительные осложнения и у 2 – соматические проблемы. Результаты наших исследований позволяют рассматривать минимально инвазивную хирургию как важный этап восстановительного лечения пострадавших с ЧМТ. Литература 1. Добровольский Г.Ф. Ультраструктура морфологического субстрата ликвороэнцефалического барьера при субарахноидальном кровоизлиянии (экспериментальное исследование). Вопр. нейрохирургии. 1980; 5: 46–8. 2. Коновалов А.Н. и др. Патогенез, диагностика и лечение черепномозговой травмы и ее последствий. Вопр. нейрохирургии. 1994; 4: 18–25. 3. Кравчук А.Д., Лихтерман Л.Б., Потапов А.А. и др. Современные аспекты диагностики и лечения посттравматической гидроцефалии. В кн.: Реконструктивная и минимально инвазивная хирургия последствий черепно-мозговой травмы. М., 2012; с. 199–225. | www.con-med.ru | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | 11 Нейрореабилитация 4. Лихтерман Л.Б., Потапов А.А., Кравчук А.Д. Современные подходы к диагностике и лечению черепно-мозговой травмы и ее последствий. Вопр. нейрохирургии. 1996; 1: 35–7. 5. Лихтерман Л.Б., Потапов А.А., Сербиненко Ф.А. и др. Классификация и современные концепции хирургии последствий черепно-мозговой травмы. Нейрохирургия. 2004; 1: 34–9. 6. Лихтерман Л.Б., Потапов А.А. Классификация черепно-мозговой травмы. В кн.: Черепно-мозговая травма. Клиническое руководство. 1998; 1: 47–128. 7. Лошаков В.А., Юсеф Е.С., Лихтерман Л.Б. и др. Диагностика и хирургическое лечение посттравматической гидроцефалии. Вопр. нейрохирургии. 1993; 3: 18–23. 8. Algin O, Hakyemez B, Parlak M. The efficiency of PCMRI in diagnosis of normal pressure hydrocephalus and prediction of shunt response. Academic radiology. Acad Radiol 2010; 17 (2): 181–7. 9. Al-Zain FT, Rademacher G, Lemcke J et al. Idiopathic normalpressure hydrocephalus. Flow measurement of cerebrospinal fluid using phase contrast MRI and its diagnostics importance. Der Nervenarzt 2007; 78 (2): 181–7. 10. Aronyk KE. The history and classification of hydrocephalus. Neurosurg Clin N Am 1993; 4 (4): 599–609. 11. Aschoff A, Kremer P, Benesch K et al. Overdrainage and shunt technology. Critical comparosion of programmable, hydroatatic and variableresistance valves and flowreducting devices. Child’s Nerv Syst 1995; 11: 193–202. 12. Bayston R. Hydrocephalus shunt infections. J Antimicrob Chemother 1994; 34 (Suppl. A): 75–84. 13. Beyerl B, Black PM. Posttraumatic hydrocephalus. Neurosurgery 1984; 15 (2): 257–61. 14. Belliard H, Roux FX, Turak B et al. The Codman Medos programmable shunt valve. Evaluation of 53 implantations in 50 patients. Neurochirurgie 1996; 42 (3): 139–45; discus. 145–6. 15. Blomerth PR. Normal pressure hydrocephalus. J Manipulative Physiol Ther 1993; 16 (2): 104–6. 16. Boon A, Tans J, Delwel E et al. Dutch normalpressure hydrocephalus study: prediction of outcome after shunting by resistance to outflow of cerebrospinal fluid. J Neurosurg 1997; 87 (5): 687–93. 17. Bondurant CP, Jimenez DF. Epidemiology of cerebrospinal fluid shunting. Pediatr Neurosurg 1995; 23 (5): 254–8. 18. Bret P, Chazal J, Janny P et al. Chronic hydrocephalus in adults. Neurochirurgie 1990; 36 (Suppl. 1): 1–159. 19. Cardoso ER, Galbraith S. Posttraumatic hydrocephalus retrospective review. Surg Neurol 1985; 23 (3): 261–4. 20. Choux M, Genitori L, Lang D, Lena G. Shunt implantation: reducing the incidence of shunt infection. Neurosurg 1992; 77 (6): 875–80. 21. Drake JM. Sainte Rose С. The Shunt Book. Cambridge. Blackwell Science 1995. 22. Fischer CM. Hydrocephalus as a case of disturbances of gait in the elderly. Neurol Minneap 1982; 32 (12): 1358–63. 23. Gleason PL, Black PM, Matsumae M. The neurobiology of normal pressure hydrocephalus. Neurosurg Clin N Am 1993; 4 (4): 667–75. 24. Groswasser Z, Cohen M, Reider Groswasser I, Stern MJ. Incidence, CT findings and rehabilitation outcome of patients with communicative hydrocephalus following severe head injury. Brain Inj 1988; 2 (4): 267–72. 25. Hakim S. Algunas observaciones sobre la presion del LCR. Syndrome hidro cefalico en al adulto con «pression normal» del LCR (presentacion de un nevro sindrome). Bogota 1964. 26. Hakim S, Venegas JG, Burton JD. The physics of the cranial cavity, hydrocephalus and normal pressure hydrocephalus: mechanical interpretation and mathematical model. Surg Neurol 1976; 5 (3): 187–210. 27. Hirsch JF. Surgery of hydrocephalus: past, present and future. Acta Neurochir Wien 1992; 116 (2–4): 155–60. 28. Holodny A, George A, De Leon M et al. Focal dilation and paradoxical collapse of cortical fissures and sulci in patients with normalpressure hydrocephalus. J Neurosurg 1998; 89 (5): 742–7. 29. Hoppe Hirsch E, Laroussinie F, Brunet L et al. Late outcome of the surgical treatment of hydrocephalus. Childs Nerv Syst 1998; 14 (3): 97–9. 30. Interligi M, Buccigrossi G. Posttraumatic ventricular hydrocephalus. Chir Ital 1977; 29 (5): 498–506. 31. Jeffreys RV. Investigation and management of hydrocephalus in adults. In: Hydrocephalus. Ed. P.Schurr, C.Polkey. Oxford University Press 1993; p. 180–208. 32. Kahlon B, Annertz M, Stahlberg F, Rehncrona S. Is aqueductal stroke volume, measured with cine phase contrast magnetic resonanse imaging 12 | CONSILIUM MEDICUM | 2013 | ТОМ 15 | № 9 | www.con-med.ru | scans useful in predicting outcome of shunt surgery in suspected normal pressure hedrocephalus? Neurosurgery 2007; 60 (1): 124–9. 33. Katz RT, Brander V, Sahgal V. Updates on the diagnosis and management of posttraumatic hydrocephalus. Am J Phys Med Rehabil 1989; 68 (2): 91–6. 34. Kawakami K, Kawamura Y, Kawamoto K et al. Posttraumatic normal pressure hydrocephalus following severe head injury. Result of shunt operation. Neurol Med Chir Tokyo 1983; 23 (12): 945–51. 35. Kishore PR, Lipper MH, Miller JD et al. Posttraumatic hydrocephalus in patients with severe head injury. Neuroradiol 1978; 16: 261–5. 36. Kitagaki H, Mori E, Ishii K et al. CSF spaces in idiopathic normal pressure hydrocephalus: morphology and volumetry. AJNR Am J Neuroradiol 1998; 19 (7): 1277–84. 37. Kosteljanetz M, Nehen AM, Kaalund J. Cerebrospinal fluid out flow resistance measurements in the selection of patients for shunt surgery in the normal pressure hydrocephalus syndrome. A controlled trial. Acta Neurochir 1990; 104: 48–53. 38. Lazareff JA, Peacock W, Holly L et al. Multiple shunt failures: an analysis of relevant factors. Childs Nerv Syst 1998; 14 (6): 271–5. 39. Marmarou A et al. Posttraumatic ventriculomegaly: hydrocephalus or atrophy? A new approach for diagnosis using CSF dynamics. J Neurosurg 1996; 85 (6): 1026–35. 40. Marmarou A, Bergsneide M, Klinge P et al. The value of supplemental prognostic tests for the preoperative assessment of idiopathic normal pressure hydrocephalus. Neurosurgery Suppl 2005; 57 (3): 17–28. 41. Meier U, Zeilinger FS, Kintzel D. Psychophysiology, signs and symptoms of disease the course of normal pressure hydrocephalus. Fortschr Neurol Psychiatr 1998; 66 (4): 176–91. 42. Moretti JL, Thebault B, Mathieu E. Gamma cysternographic data in hydrocephalus and posttraumatic lesions. Neurochirurgie 1976; 22 (4): 371–84. 43. Mori K, Shimada J, Sato K, Watanabe K. Classification of hydrocephalus and outcome of treatment. Brain Dev 1995; 17 (5): 338–48. 44. Mouton Paradot G, Baledent O, Sallioux G et al. Contribution of phase contrast MRI to the management of patients with normal pressure hydrocephalus. Can it predict response to shunting Neurochirurgie. Neurochirurgie 2010; 56 (1): 50–4. 45. Nakamura N, Tsunoda M, Owada T et al. Posttraumatic pregressivenonobstructive hydrocephalus. No To Shinkei 1971; 23 (10): 1217–21. 46. Paoletti P, Pezzotta S, Spanu G. Diagnosis and treatment of posttraumatic hydrocephalus. J Neurosurg Sci 1983; 27 (3): 171–5. 47. Poca MA, Sahuquillo J, Busto M еt al. Agreement between CSF flow dynamics in MRI and ICP monitoring in diagnosis of normal pressure hydrocephalus. Sensitivity and specificity of CSF dynamics to predict outcome. Acta Neurochir Suppl 2002; 81: 7–10. 48. Pudenz RH, Foltz EL. Hydrocephalus: overdrainage by ventricular shunts. A review and recommendations. Surg Neurol 1991; 35 (3): 200–12. 49. Roitberg BZ et al. Abdominal cerebrospinal fluid pseudocyst: a complication of ventriculoperitoneal shunt in children. Pediat Neurosurg 1998; 29: 267–73. 50. Scollato A, Gallina P, Gautam B et al. Changes in aqueductal CSF stroke volume in shunted patients with idiopathic normalpressure hydrocephalus. Am J Neuroradiol AJNR Neuroradiol 2009; 30 (8): 1580–6. 51. Sheffler LR, Ito VY, Philip PA, Sahgal V. Shunting in chronic posttraumatic hydrocephalus: demonstration of neurophysiologic improvement. Arch Phys Med Rehabil 1994; 75 (3): 338–41. 52. Silver BV, Chinarian J. Neurologic improvement following shunt placement for posttraumatic hydrocephalus in a child. Pediat Rehabil 1997; 1 (2): 123–6. 53. Spanu G, Knerich R, Messina AL, Karussos G. Posttraumatic hydrocephalus. Riv Neurol 1985; 55 (3): 185–96. 54. Turnbull IW. Cerebral atrophy or hydrocephalus? Br Med J 1980; 15; 280 (6216): 790. 55. Vanneste J, Augustin P, Tan WF, Dirven C. Shunting normal pressure hydrocephalus: the predictive value of combined clinical and CT data. J Neurol Neurosurg Psychiat 1993; 56 (3): 251–6. 56. Wieser HG, Probst C. Clinical observations on hydrocephalus with special regard to the posttraumatic malresorptive form. Neurol 1976; 23; 212 (1): 1–21. 57. Zeilinger FS, Meier U. Clinically suspected normalpressure hydrocephalus diagnosiscurrent status of diagnosis and therapy. Z Arztl Fortbild Qualitatssich 1998; 92 (7): 495–501.