Примерное календарно-тематическое планирование 8 класс (70 часов, 2 часа в...
реклама
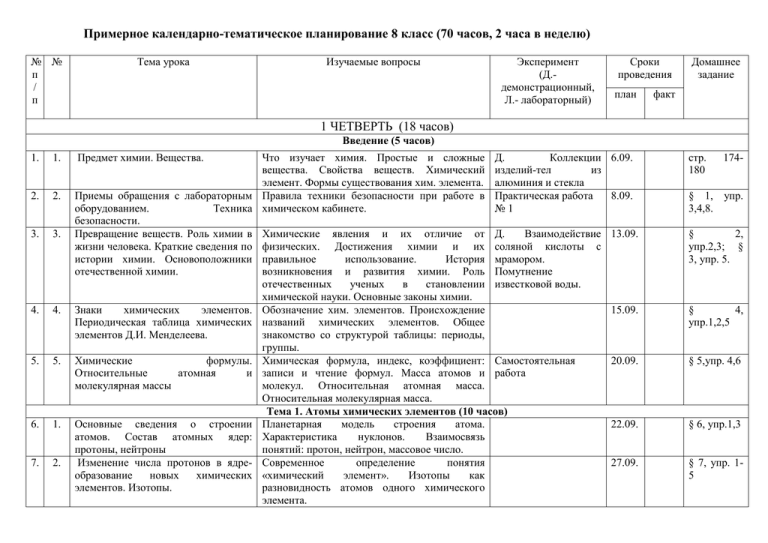
Примерное календарно-тематическое планирование 8 класс (70 часов, 2 часа в неделю) № № п / п Тема урока Изучаемые вопросы Эксперимент (Д.демонстрационный, Л.- лабораторный) Сроки проведения план Домашнее задание факт 1 ЧЕТВЕРТЬ (18 часов) Введение (5 часов) 1. 1. 2. 2. 3. 3. 4. 4. 5. 5. 6. 1. 7. 2. Предмет химии. Вещества. Что изучает химия. Простые и сложные Д. Коллекции вещества. Свойства веществ. Химический изделий-тел из элемент. Формы существования хим. элемента. алюминия и стекла Приемы обращения с лабораторным Правила техники безопасности при работе в Практическая работа оборудованием. Техника химическом кабинете. №1 безопасности. Превращение веществ. Роль химии в Химические явления и их отличие от Д. Взаимодействие жизни человека. Краткие сведения по физических. Достижения химии и их соляной кислоты с истории химии. Основоположники правильное использование. История мрамором. отечественной химии. возникновения и развития химии. Роль Помутнение отечественных ученых в становлении известковой воды. химической науки. Основные законы химии. Знаки химических элементов. Обозначение хим. элементов. Происхождение Периодическая таблица химических названий химических элементов. Общее элементов Д.И. Менделеева. знакомство со структурой таблицы: периоды, группы. Химические формулы. Химическая формула, индекс, коэффициент: Самостоятельная Относительные атомная и записи и чтение формул. Масса атомов и работа молекулярная массы молекул. Относительная атомная масса. Относительная молекулярная масса. Тема 1. Атомы химических элементов (10 часов) Основные сведения о строении Планетарная модель строения атома. атомов. Состав атомных ядер: Характеристика нуклонов. Взаимосвязь протоны, нейтроны понятий: протон, нейтрон, массовое число. Изменение числа протонов в ядре- Современное определение понятия образование новых химических «химический элемент». Изотопы как элементов. Изотопы. разновидность атомов одного химического элемента. 6.09. стр. 180 174- 8.09. § 1, упр. 3,4,8. 13.09. § 2, упр.2,3; § 3, упр. 5. 15.09. § 4, упр.1,2,5 20.09. § 5,упр. 4,6 22.09. § 6, упр.1,3 27.09. § 7, упр. 15 8. 3. 9. 4. 10. 5. 11. 6. 12. 7. 13. 8. 14. 9. 15. 10. 16. 1. 17. 2. 18. 3. 19. 4. Электроны. Строение электронных Характеристика электронов. Понятие о оболочек атомов элементов № 1-20 завершенном и незавершенном электронном уровнях. Периодическая таблица химических Физический смысл порядкового номера тест элементов и строение атома. элемента, номера группы, номера периода. Причины изменения свойств химических элементов в группах и периодах. Ионная химическая связь. Понятие иона. Ионы, образованные атомами металлов и атомами неметаллов. Понятие об ионной связи. Схемы образования ионных соединений. Ковалентная неполярная химическая Схемы образования двухатомных молекул (Н2, связь. Cl2, S2, N2). Электронные и структурные формулы. Кратность химической связи. Электроотрицательность. Схемы образования молекул соединений (HCl, Ковалентная полярная связь. H2O, NH3). Понятие об ЭО и ковалентной полярной химической связи. Металлическая связь. Понятие о металлической связи. тест 29.09 § 8, упр.1,2 4.10. § 9, упр.1 6.10. § 9, упр. 2, 3 11.10. § 10, упр. 2-4 13.10 § 11, упр. 1-4 18.10. Обобщение и систематизация знаний Выполнение упражнений, подготовка об элементах: металлах и неметаллах, контрольной работе. видах химической связи. Атомы химических элементов Проверка знаний учащихся по теме 1 20.10. § 12, упр. 1-3 Задания в тетради к Контрольная №1 работа 25.10. Тема 2 Простые вещества ( 7 часов) Простые веществаметаллы. Строение атомов металлов, физические Д. Коллекция Аллотропия свойства металлов – простых веществ. металлов Аллотропия на примере олова. Образцы белого и серого олова. Простые веществанеметаллы. Строение атомов неметаллов, физические Д. Коллекция Аллотропия свойства неметаллов – простых веществ. неметаллов. Аллотропия на примере кислорода, фосфора, углерода. Количество вещества. Количество вещества и единицы его измерения: моль, ммоль, кмоль. Постоянная Авогадро. 2 ЧЕТВЕРТЬ ( 14 часов) Молярная масса вещества. Расчет молярных масс по их химическим 27.10. §13, упр.1,3,4 1.11. § 14, упр. 3,4 3.11. § 15, упр. 1,2 10.11. § 15, упр. формулам. газообразных Молярный объем, нормальные условия. 28. 6. Молярный объем Д. Модель молярного веществ. объема газа Решение задач по теме «Простые Решение задач и упражнений с вещества» использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро» Обобщение и систематизация знаний Самостоятельная по теме 2 работа по теме 2 Тема 3. Соединения химических элементов (14 часов) Степень окисления. Бинарные Понятие о степени окисления. Составление Д. Образцы хлоридов, соединения: оксиды, хлориды, формул бинарных соединений и определение сульфидов оксидов сульфиды. степени окисления элементов по формулам. металлов. Важнейшие классы бинарных Составление формул, их названия. Расчеты по Д. Образцы оксидов. соединений – оксиды, летучие формулам. водородные соединения Основания. Состав и названия оснований и их Д. Образцы щелочей и классификация. нерастворимых оснований. Изменение окраски индикатора. Кислоты. Состав и названия кислот и их классификация Д. Образцы кислот. Изменение окраски индикатора. Соли как производные кислот и Состав и названия солей Д. Образцы солей оснований. кислородосодержащи х и бескислородных кислот. Соли. Расчеты по формулам солей 29. 7. Классификация сложных веществ. 20. 5. 21. 26. 1 22. 7. 23. 1. 24. 2. 25. 3. 26. 4. 27. 5. 30. 8. 31. 9. Упражнения в составлении формул. Расчеты по формулам соединений. Аморфные и кристаллические Свойства веществ с разным типом вещества. Ионные, атомные и кристаллических решеток, их принадлежность металлические решетки. к разным классам соединений. Чистые вещества и смеси. Понятия о чистом веществе и смеси, их отличия. Способы разделения смесей. 15.11. 17.11. 3,4 § 16, упр. 1-2 § 16 22.11. 24.11 § 17, упр. 1-2 29.11 § 18, упр. 1-6 1.12. § 19, упр. 2-4 6.12. § 20, упр. 3-5 8.12. § 21, табл.5 упр. 1 13.12. § 21,упр.2,3 Самостоятельная 15.12. работа по теме 3 Д. Модели 20.12. кристаллических решеток. Д. Различные образцы 22.12. смесей. Дистилляция воды. § 22, упр. 1,4,5 § 23, упр. 1,2,4 Разделение смеси с помощью делительной воронки. 32. 10. Массовая и объемная компонентов в смеси 26.12. § 24, упр. 1-3 33. 11. Расчеты, связанные с «доля» (,) «Приготовление раствора сахара, с Приготовление раствора с заданной массовой Практическая работа определенной массовой долей сахара долей растворенного вещества №2 в растворе» Обобщение и систематизация знаний по теме 3 Соединения химических элементов Контроль знаний учащихся по теме 3 Контрольная работа №2 Тема 4 Изменения, происходящие с веществами (12 часов) Физические явления. Способы очистки веществ, основанные на Д. Плавление физических свойствах парафина. Л. сравнение скорости испарения воды и спирта с фильтровальной бумаги «Очистка загрязненной поваренной Выполнение простейших способов разделения Практическая работа соли». смеси с соблюдением ТБ. Разделение смесей. № 3 Очистка вещества. Химические реакции. Реакции горения. Экзо- и эндотермические Д. Взаимодействие реакции. НСl c CaCO3, получение Cu(OH)2,взаимодейств ие CuSO4 с Fe Химические уравнения. Закон Химическое уравнение как условная запись Разложение нитрата сохранения массы веществ. Реакции химической реакции с помощью химических калия разложения формул Разложение перманганата калия Реакции соединения Сущность реакции соединения 11.01. § 24, упр. 4-7 13.01. Стр. 117 34. 12 35. 13. 36. 14 37. 1. 38. 2 39. 3. 40. 4. 41. 5. доля Вычисление доли компонента в смеси и расчет массы или объема вещества в смеси по его доле. 3 ЧЕТВЕРТЬ ( 20часов) понятием Решение задач и упражнений на расчет доли. 18.01. 20.01. § 25, упр. 2-4 25.01. Стр.115116 27.01. § 26, упр. 1-4 1.02. § 26, упр. 3 3.02. § 29,упр.1 § 30, упр.2 42. 6. Реакции замещения. 43. 7. Реакции обмена. 44. 8. Признаки химических реакций 45. 9. Расчеты по химическим уравнениям. 46. 10. 47. 11. 48. 12. 49. 1. 50. 2. 51. 3. Сущность реакций замещения Д. Взаимодействие 8.02. щелочных металлов с водой, цинка с раствором кислоты. Л. Взаимодействие металлов (Fe, Al, Zn) с растворами солей Сущность реакции обмена. Реакция Д. Взаимодействие 10.02. нейтрализации. щелочей, окрашенных фенолфталеином, с растворами кислот. Л. Взаимодействие H2SO4 с BaCl2, HCl с NaOH. Проведение опытов с соблюдением ТБ Практическая работа 15.02. №3 Решение задач на нахождение количества, массы или объема продукта реакции. Расчеты по химическим уравнениям. Решение задач с использованием понятия «доля» Обобщение и систематизация знаний Подготовка к контрольной работе по теме 4 Изменения, происходящие с Контроль знаний учащихся по теме 4 Контрольная работа веществами. №3 Тема 5. Раствореиие. Растворы. Свойства растворов электролитов (22 час) Растворение как физико-химический Растворы. Гидраты. Насыщенные, Д. Мгновенная процесс. Растворимость. Типы ненасыщенные растворы. кристаллизация растворов. пересыщенного раствора глауберовой соли. Л. растворение безводного сульфата меди в воде. Электролитическая диссоциация. Электролиты, неэлектролиты. Степень Д. Испытание веществ диссоциации. Слабые и сильные электролиты. и их растворов на электропроводность. Основные положения теории Ионы. Свойства ионов. Основные положения 17.02. 22.02. 24.02. § 31,упр.2,3 § 32, упр. 3,4 § 33, Стр.113114 § 28 задачи 1-3 § 28 задачи 4,5 § 28-32 1.03 3.03. § 34, упр.1,3 10.03. § 35, упр.14 15.03. § 36, упр. 52. 4. 53. 5. электролитической диссоциации Ионные уравнения реакций. Кислоты в свете классификация. ТЭД, ТЭД. Реакции обмена, идущие до конца. Таблица Л. Примеры реакций, 17.03. растворимости. идущих до конца. их Определение, классификация кислот. 22.03. 4 ЧЕТВЕРТЬ ( 18 часов) Химические свойства кислот. 54. 6. Свойства кислот в свете ТЭД 55. 7. Основания в свете ТЭД 56. 8. Оксиды. 57. 9. Соли в свете ТЭД, и их свойства. 58. 10. Генетическая связь между классами Генетические ряды металлов и неметаллов. неорганических соединений. Свойства растворов электролитов. Проведение опытов с соблюдением ТБ 59. 11. Л. Химические 5.04. свойства на примере HCl Определение, классификация, химические Д. Взаимодействие 7.04. свойства. CO2 и NaOH Разложение нерастворимых оснований при Разложение Cu(OH)2 нагревании. Состав, классификация, свойства кислотных и Л. Изучение свойств 12.04. основных оксидов. CaO и CO2 Определение солей, химические свойства. 14.04. 61. 13. Обобщение и систематизация знаний Подготовка к контрольной работе. по теме Свойства растворов электролитов. Контроль знаний учащихся по теме 5 62. 14. Классификация химических реакций 60. 12. 63. 15 64. 16. 65. 17 66. 18. 67. 19. 68. 20. 19.04. Практическая работа 21.04. №4 26.04. Контрольная №4 3-5 § 37, упр.5 § 38, упр. 3,4 § 38, упр. 1,2,5 § 39, упр. 1-5 § 40, упр. 1-3 § 41, упр. 1,2,5 § 42, упр. 2,3 стр.240-241 упр.4,стр 228 работа 28.04. Различные признаки классификации химических реакций. Окислительно-восстановительные Степень окисления. Окислитель, реакции. восстановитель. Окисление, восстановление. Упражнения в составлении ОВР. Составление уравнений методом электронного баланса Свойства изученных классов веществ Характеристика свойств веществ в свете ОВР. в свете ОВР. Обобщение и систематизация знаний Выполнение упражнений. Учет и контроль Самостоятельная по теме «ОВР» знаний по теме работа по теме «ОВР» Решение расчетных задач. Повторение «Периодический закон. Строение атома» 3.05. 5.05. 10.05. 12.05. 17.05. 19.05. 24.05. § 43, упр. 1-3 § 43, упр. 4 § 43, упр. 7,8 упр.5,6 69. 21. Повторение Типы химической связи. 26.05. 70. 22 Повторение Свойства основных классов неорганических веществ 31.05
