Задания для контрольных работ
реклама
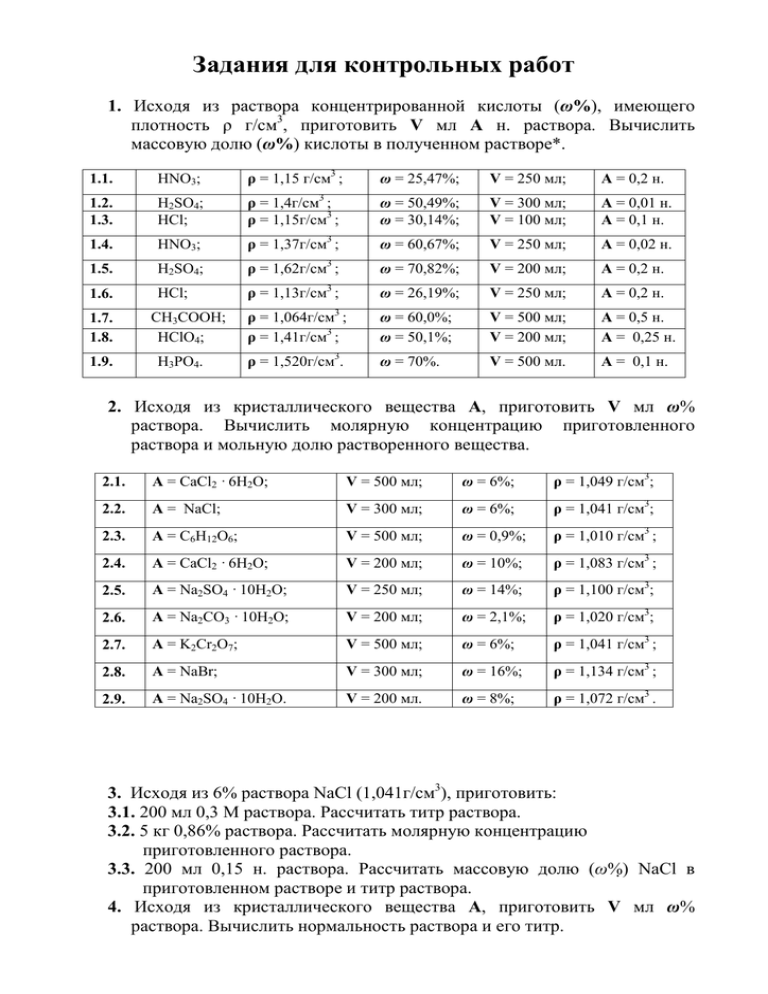
Задания для контрольных работ 1. Исходя из раствора концентрированной кислоты (ω%), имеющего плотность ρ г/см3, приготовить V мл А н. раствора. Вычислить массовую долю (ω%) кислоты в полученном растворе*. 1.1. HNO3; ρ = 1,15 г/см3 ; ω = 25,47%; V = 250 мл; А = 0,2 н. 1.2. 1.3. H2SO4; HCl; ρ = 1,4г/см3 ; ρ = 1,15г/см3 ; ω = 50,49%; ω = 30,14%; V = 300 мл; V = 100 мл; А = 0,01 н. А = 0,1 н. 1.4. HNO3; ρ = 1,37г/см3 ; ω = 60,67%; V = 250 мл; А = 0,02 н. 1.5. H2SO4; ρ = 1,62г/см3 ; ω = 70,82%; V = 200 мл; А = 0,2 н. 1.6. HCl; ρ = 1,13г/см3 ; ω = 26,19%; V = 250 мл; А = 0,2 н. ρ = 1,064г/см ; ρ = 1,41г/см3 ; ω = 60,0%; ω = 50,1%; V = 500 мл; V = 200 мл; А = 0,5 н. А = 0,25 н. ρ = 1,520г/см3. ω = 70%. V = 500 мл. А = 0,1 н. 1.7. 1.8. 1.9. CH3COOH; HClO4; H3PO4. 3 2. Исходя из кристаллического вещества А, приготовить V мл ω% раствора. Вычислить молярную концентрацию приготовленного раствора и мольную долю растворенного вещества. 2.1. А = CaCl2 · 6H2O; V = 500 мл; ω = 6%; ρ = 1,049 г/см3; 2.2. А = NaCl; V = 300 мл; ω = 6%; ρ = 1,041 г/см3; 2.3. A = C6H12O6; V = 500 мл; ω = 0,9%; ρ = 1,010 г/см3 ; 2.4. A = CaCl2 · 6H2O; V = 200 мл; ω = 10%; ρ = 1,083 г/см3 ; 2.5. A = Na2SO4 · 10H2O; V = 250 мл; ω = 14%; ρ = 1,100 г/см3; 2.6. A = Na2CO3 · 10H2O; V = 200 мл; ω = 2,1%; ρ = 1,020 г/см3; 2.7. A = K2Cr2O7; V = 500 мл; ω = 6%; ρ = 1,041 г/см3 ; 2.8. A = NaBr; V = 300 мл; ω = 16%; ρ = 1,134 г/см3 ; 2.9. A = Na2SO4 · 10H2O. V = 200 мл. ω = 8%; ρ = 1,072 г/см3 . 3. Исходя из 6% раствора NaCl (1,041г/см3), приготовить: 3.1. 200 мл 0,3 М раствора. Рассчитать титр раствора. 3.2. 5 кг 0,86% раствора. Рассчитать молярную концентрацию приготовленного раствора. 3.3. 200 мл 0,15 н. раствора. Рассчитать массовую долю (ω%) NaCl в приготовленном растворе и титр раствора. 4. Исходя из кристаллического вещества А, приготовить V мл ω% раствора. Вычислить нормальность раствора и его титр. 4.1. 4.2. 4.3. 4.4. 4.5. 4.6. 4.7. 4.8. A = CaCl2 · 6H2O; А = NaCl; A = C6H12O6 ; А = CaCl2 · 6H2O; А = NaCl; A = Na2CO3 · 10H2O; A = Na2SO4 · 10H2O; A = NaBr. V = 500 мл; V = 300 мл; V = 500 мл; V = 200 мл; V = 250 мл; V = 200 мл; V = 200 мл; V = 300 мл. ω = 6%; ω = 6%; ω = 0,9%; ω = 10%; ω = 14%; ω = 2,1%; ω = 8%; ω = 16%. ρ = 1,049 г/см3 ; ρ = 1,041 г/см3 ; ρ = 1,010 г/см3 ; ρ = 1,083 г/см3 ; ρ = 1,100 г/см3 ; ρ = 1,020 г/см3 ; ρ = 1,072 г/см3 ; ρ = 1,134 г/см3 . 5. Исходя из 10% раствора (1,083 г/см3) хлорида кальция, приготовить V мл ω% раствора. Рассчитайте молярность, нормальность, титр раствора и мольную долю растворенного вещества 5.1. 5.2. 5.3. 5.4. 5.5. V = 250 мл; V = 200 мл; V = 300 мл; V = 500 мл; V = 100 мл. ω = 1%; ω = 2%; ω = 4%; ω = 6%; ω = 8%; ρ = 1,007 г/см3; ρ = 1,015 г/см3; ρ = 1,032 г/см3; ρ = 1,049 г/см3; ρ = 1,066 г/см3. 6. Исходя из 12% раствора CaCl2 (1,066г/см3), приготовить: 6.1. 200 мл 0,02 М раствора. Рассчитать массовую долю CaCl2 (ω%) в приготовленном растворе. 6.2. 250 мл 0,01 н. раствора. Рассчитать массовую долю CaCl2 (ω%) в приготовленном растворе и титр раствора. 6.3. 2 кг 2,8% раствора. Рассчитать молярную концентрацию и моляльность приготовленного раствора. 6.4. 500 г 1,5% раствора. Рассчитать нормальность приготовленного раствора (1,02 г/см3). 7. Приготовить 0,2 М раствор, исходя из фиксанала (0,1 моль эквивалента). 7.1. NaOH. Рассчитать массовую долю (ω%) NaOH в приготовленном растворе, титр раствора. 7.2. HCl. Рассчитать массовую долю (ω%) HCl в приготовленном растворе, титр раствора. 7.3. H2SO4. Рассчитать массовую долю (ω%) H2SO4 в приготовленном растворе, титр раствора. 8. Исходя из 20% раствора аммиака (0,923г/см3), приготовить: 8.1. 200 мл 0,2 М раствора. Рассчитать массовую долю аммиака (ω%) в приготовленном растворе. 8.2. 250 мл 0,15 н. раствора. Рассчитать массовую долю аммиака (ω%) в приготовленном растворе, титр раствора. 8.3. 500 г 2,5% раствора. Рассчитать молярную концентрацию приготовленного раствора. 9. Вычислить молярную концентрацию эквивалента и титр раствора HCl, если на титрование 6,0 мл исследуемого раствора пошло 9,0 мл 0,02 н. раствора NaOH. 10. Чему равна масса декагидрата тетрабората натрия (буры) Na2B4O7·10H2O, если на титрование затрачено 15,1 мл соляной кислоты с концентрацией 0,1030 моль/л? 11. В мерную колбу вместимостью 100 мл поместили пробу концентрированного раствора муравьиной кислоты массой 4,64 г и разбавили водой до метки. На титрование 20,0 мл полученного раствора затрачено 14,4 мл 0,15 М раствора KOH. Рассчитать массовую долю муравьиной кислоты в исходном растворе. 12. Рассчитать нормальную концентрацию и титр раствора азотной кислоты, если на титрование 10 мл этого раствора расходуется 18,3 мл гидроксида натрия с титром 0,004153 г/мл. 13. Определить нормальную концентрацию и титр раствора гидроксида натрия, если на титрование 15,0 мл этого раствора затрачено 14,2 мл раствора серной кислоты с титром по NaOH равным 0,006734 г/мл. 14. Как рассчитать эквиваленты окислителя и восстановителя? Является ли молярная масса эквивалента вещества постоянной величиной? Приведите примеры. 15. Подобрать коэффициенты электронно-ионным методом (методом полуреакций) и рассчитать молярные массы эквивалентов окислителя и восстановителя в следующих реакциях: а) FeSO4 + HNO3 + H2SO4 → Fe2(SО4)3 + NO↑ + H2О; б) FeSO4 + KMnO4 + H2SO4 → Fe2(SО4)3 + MnSO4 + H2О + K2SO4; в) CrCl3 + KMnO4 + KOH → K2CrО4 + KCl + H2О + MnO2; г) CrCl3 + H2O2 + KOH → K2CrО4 + KCl + H2О; д) MnCl2 + H2O2 + KOH → H2MnО3↓ + KCl + H2О; е) KMnO4 + H2O2 + H2SO4 → MnSO4 + K2SO4 + O2 + H2О; ж) K2Cr2О7 + KI + H2SO4 → Cr2(SО4)3 + H2О + K2SO4 + I2; з) K2Cr2О7 + H2SO4 + Na2SO3 → Cr2(SО4)3 + Na2SO4 + K2SO4 + H2О; и) Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2О; к) Mn(NO3)2 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + H2О; л) SnCl2 + BiCl3 + KOH → K2SnО3 + KCl + H2О + Bi.; м) CrCl3 + Br2 + KOH → K2CrО4 + KCl + KBr + H2О; н) P + HNO3 + H2O → H3PО4 + NО↑; о) KCrO2 + Br2 + KOH → K2CrО4 + KBr + H2О; п) Ag + HNO3 → AgNO3 + NO↑ + H2О; 16. Определить молярную концентрацию эквивалента и титр раствора пероксида водорода, если на титрование 5,0 мл этого раствора израсходовалось 6,5 мл 0,0208 н. раствора KMnO4. 17. Определить титр пероксида водорода, если на титрование 20 мл раствора Н2О2 затрачено 17,5 мл раствора перманганата калия с КMnO 4 = 0,000425 г/мл . Т H O 2 2 18. Рассчитать титр раствора перманганата калия по железу, если нормальная концентрация раствора KMnO4 составляет 0,0143 моль/л. 19. Какой объем раствора перманганата калия, титр которого 0,002165 г/мл, необходимо взять для приготовления 500 мл раствора с молярной концентрацией эквивалента, равной 0,0250 моль/л? 20. Вычислить стандартную энтальпию реакции образования аммиака по стандартным энтальпиям реакций: Н2 + ½ О2 = Н2О(ж) , ∆H0 = – 285,83 кДж/моль NH3 + ¾ О2 = ½ N2 + 1,5 Н2О(ж) , ∆H0 = – 316,72 кДж/моль 21. Определить стандартную энтальпию сгорания этилового спирта: С2H5OH(ж) + 3О2 (г) = 2CO2 (г) + 3Н2О(ж) по стандартным энтальпиям образования веществ. 22. Вычислить стандартную энтальпию биохимического брожения глюкозы: C6H12O6 (тв) = 2 С2H5OH(ж) + 2 CO2 (г), если стандартные энтальпии сгорания глюкозы и этилового спирта равны соответственно –2801,69 и –1366,6 кДж/моль. Определить знак ∆S. 23. Вычислить стандартную энтальпию реакции: CaCO3 (тв) = CaO(тв) + СО2 (г), используя стандартные энтальпии образования веществ. 24. Вычислить стандартную энергию Гиббса (∆G0) реакции: Н2 (г) + S(ромбич) = Н2S(г) по стандартным термодинамическим величинам. 25. Вычислить стандартную энергию Гиббса (∆G0) реакции восстановления магнетита: Fe3O4 (тв) + 4Н2 (г) = 3Fe(тв) + 4Н2О(г) по стандартным термодинамическим величинам. 26. Вычислить стандартную энергию Гиббса (∆G0) реакции: α-D-Глюкоза (р-р) + О2 (г) 2 Пируват (р-р) + 2 Н+ (р-р) + 2 Н2О (ж), если известно, что стандартные энергии Гиббса образования веществ соответственно равны: α-D-Глюкоза − 916,34, пируват − 474,18, вода − 236,96 кДж/моль. 27. Определить, может ли процесс: S(ромбич.) S(монокл.) идти слева направо при Т=298 К. Если нет, то при какой температуре это станет возможно? 28. Рассчитать температуру, при которой две формы CaCO3 – кальцит и аргонит – находятся в равновесии при давлении 1 атм. Необходимые термодинамические величины взять из таблицы. 29. Энтальпия реакции гашения извести равна –66,9 кДж/моль. Сколько теплоты выделится при гашении 1 кг 85%-ной извести? 30. Энтальпия сгорания углеводов в организме человека составляет – 17,55 кДж/г, белков – 16,72 кДж/г, жиров – 39,29 кДж/г. Среднесуточная потребность в белках, жирах и углеводах для студентов – мужчин составляет соответственно 113 г, 106 г, 451 г, для студентов – женщин 96 г, 90 г, 383 г. Какова среднесуточная потребность студентов в энергии? 31. Используя значение энтальпий сгорания белков, жиров и углеводов (задача 30), рассчитать энергетическую ценность перловой каши (67 г крупы). В 100 г крупы содержится 9,3 г белков, 1,1 г жиров и 73,7 г углеводов. 32. При растворении 2,67 г SrCl2 · 6Н2О (Р = const) в воде поглощается 309 Дж теплоты, а при растворении 31,8 г SrCl2 выделяется 9,52 кДж теплоты. Вычислите ∆Н образования кристаллогидрата. 33. В калориметре смешали 100 мл 1н. HCl и 50 мл 2н. NaOH, температура поднялась на 8,9 градусов. Вычислить ∆Н нейтрализации, принимая удельную теплоемкость раствора равной 4,18 Дж/(г·К). 34. Образование хлористого нитрозила подчиняется кинетическому уравнению третьего порядка: 2NO + Cl2 → 2 NOCl. Оценить, как изменится скорость реакции: а) при уменьшении концентрации оксида азота (II) в 2 раза; б) при увеличении концентрации хлора в 2 раза. 35. Раствор лекарственного вещества содержит 1500 активных единиц в 1 мл. Через 20 дней концентрация активных единиц снижается до 120 единиц в мл. Рассчитать константу скорости и период полупревращения, если реакция протекает по первому порядку. 36. Температурный коэффициент скорости разложения йодоводорода равен 2. Вычислить константу скорости этой реакции при 684 К, если при 629 К константа скорости равна 8,9 · 10−5 л/(моль·c). 37. Как изменится скорость окисления глюкозы в организме при снижении температуры с 37о до 35,5оС, если температурный коэффициент реакции равен 4? 38. Вычислить энергию активации реакции разложения диоксида азота: 2NO2 2NO + O2 ,если константы скорости этой реакции при 600К и 640К соответственно равны 83,9 и 407,0 л · моль-1 · с-1. 39. Константа скорости распада пенициллина при 37оС равна 0,0216 час-1, а при 43оС – 0,040 час-1. Определить температурный коэффициент и энергию активации реакции. 40. Фермент может в миллион раз повысить скорость биохимической реакции в человеческом организме (37оС). Чему должно быть равно изменение энергии активации данной реакции (∆Еакт = Еакт – Екакт), чтобы стал возможным такой эффект? 41. Период полураспада радиоактивного изотопа 137Cs равен 29,7 лет. Через сколько лет количество этого изотопа, попавшего в атмосферу в результате аварии на Чернобыльской АЭС, уменьшится на 99%? 42. Изотоп 131I, применяющийся для лечения некоторых опухолей, имеет период полураспада 8,1 суток. Через какое время содержание радиоактивного йода в организме пациента уменьшится в 5 раз? 43. Гидролиз некоторого синтетического гормона (фармпрепарата) является реакцией первого порядка с константой скорости 0,25 лет-1 (37оС). Как изменится концентрация этого гормона через 2 месяца? 44. Написать выражения констант равновесия для следующих реакций: а) СО(г.)+Cl2(г.) COCl2(г.); б) 2NO(г.)+O2(г.) 2NO2 (г.); в) CO(г.)+H2O(г.) CO2(г.) + H2(г.); г) NH3 (p-р) +H2O(ж.) NH4+(p-р) + OH−(p-р); д) CH3COOH (p-p) CH3COO−(p-p) + H+(p-p); е) H2O(ж.) H+(p-p)+ OH− (p-р); ж) [HgI4]2-(р-р) Hg2+(p-p)+4I− (p-p); з) MgCO3(кр.) + 4H2O(г.) MgO(кр.)+CO2(г.); и) 3Fe(кр.)+ 4H2O(г.) Fe3O4(кр.)+4H2(г.). Чем отличается форма записи выражения констант равновесия для гомогенных и гетерогенных реакций? 45. Какое значение имеет константа равновесия, если ∆G0 = 0? 46. Какое значение имеет ∆G0, если константа равновесия равна 1? 47. Скорость какой из двух взаимнопротивоположных реакций увеличивается при нагревании равновесной системы? 48. Влияет ли катализатор на положение равновесия и почему? Зависит ли значение константы равновесия от катализатора? 49. При состоянии равновесия в системе N2(г.) + 3H2(г.) 2NH3(г.); ∆H = −92,4кДж, равновесные концентрации участвующих веществ равны: [N2]р = 3 моль/л, [H 2]р = 9 моль/л, [NН3]р = 4 моль/л. Определить: исходные концентрации водорода и азота; направление смещения равновесия с ростом температуры. При некоторой температуре равновесие в системе: 50. 2NО 2(г.) 2NО (г.) + О2(г.) установилось при следующих концентрациях компонентов: [NО2]р = 0,06 моль/л, [NО]р = 0,24 моль/л, [О2]р = 0,12 моль/л. Определить константу равновесия реакции и исходную концентрацию оксида азота (IV). 51. В каком направлении сместится равновесие следующих обратимых реакций: а) 2СО(г.) + О2 (г.) 2СО2(г.); ∆H = −566 кДж при понижении температуры; б) С(граф.) +Н2О(г.) СО(г.)+ Н2; ∆H = 129,9 кДж при повышении давления? 52. Константа равновесия для реакции СО2(г.) + Н2(г.) СО(г.) + Н2О(г.) при 8500С равна 1. Рассчитать, при каких концентрациях всех четырех веществ установится равновесие, если начальные концентрации оксида углерода (IV) и водорода равны, соответственно, 0,2 моль/л и 0,8 моль/л. 53. Определите значение ∆G0298 и константу химического равновесия К при 250С для системы: СО2(г.) + Н2О(г.) Н2 (г.) + СО2(г.) 54. Константа равновесия для реакции HAДН + H+ HAД+ + Н2 при 298 К равна 6,69·10-4, а при 310 К равна 6,32·10-4. Вычислить константу равновесия при 313 К (зависимостью ∆Н0 от температуры пренебречь). 55. Температурный коэффициент скорости прямой реакции в интервале температур 298 – 308 К равен 2, а обратной – 3. В какую сторону сместится равновесие, если повысить температуру? Определить Еакт прямой и обратной реакции и энтальпию прямой реакции. 56. Давление водяного пара при 18оС равно 15,5 мм. рт. ст. Какое будет давление пара при той же температуре, если в 2 кг воды растворить 34,2 г сахара (С12Н22О11)? 57. При 20оС давление водяного пара равно 17,5 мм. рт.ст. Сколько граммов мочевины СО(NH2)2 нужно растворить в 90г воды, чтобы понизить давление на 1%? 58. Раствор, содержащий 0,75г мочевины СО(NH2)2 в 50 г воды, замерзает при –0,465оС. Определить молярную массу мочевины. Екр.= 1,86. 59. Чему равно осмотическое давление раствора при 20оС, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина (C34H33N4O5Fe)? Молярная масса гематина 633 г/моль. 60. Осмотическое давление крови при 37оС равно 7,7 атм. Будет ли изотоничен крови 2% раствор никотинамида C5H4NCONH2 (витамин PP)? (ρ = 1,03 г/мл). 61. Определить, при какой температуре кипит раствор, содержащий 20,48 г нафталина (C10H8) и 400г бензола, если температура кипения чистого бензола 80,1оС. Еэб.(С6Н6) = 2,64. 62. Определить массовую долю глюкозы в растворе изотоничном плазме крови при 37оС ? (ρр-ра = 1 г/мл). 63. Что произойдет с эритроцитами крови, если их поместить в 3 М раствор глюкозы? Росм.крови = 7,7 атм. при 37оС. 64. Осмотическое давление раствора, содержащего 0,2 г белка в 10 мл, при 25оС равно 10-3 атм. Определить молярную массу белка. 65. Температура замерзания сыворотки крови равна –0,56оС. Рассчитайте моляльную концентрацию солей в крови, условно считая все соли бинарными и полностью распадающимися на ионы по схеме: КА К+ + А−. Наличие в сыворотке неэлектролитов во внимание не принимать. Е кр.воды = 1,86. 66. Рассчитайте осмотическое давление физиологического раствора (0,86 % раствора хлорида натрия) при 37оС. Степень диссоциации хлорида натрия принять за 1, ρ = 1 г/см3. 67. Каково будет понижение давления пара раствора содержащего 4 г NaOH в 190 г воды, если кажущаяся степень диссоциации гидроксида натрия в этом растворе 80 % при 100оС? 68. В каком из растворов хлорида натрия: 2 %; 0,86 %; 0,2 % жизнедеятельность эритроцитов не будет нарушена и почему? Росм. крови = 7,7 атм, t = 37оС. Плотность растворов и степень диссоциации NaCl считать равными единице. 69. Раствор хлорида натрия содержит 5,85 г соли в 50 г воды и замерзает при — 5,21оС. Определить степень диссоциации раствора хлорида натрия. Екр.воды = 1,86. 70. Сколько ионов и молекул содержит 1 мл 0,001 М раствора уксусной кислоты, если степень диссоциации такого раствора равна 20%? Чему равен рН этого раствора? 71. Рассчитать ионную силу 0,1 моляльных растворов: а) ацетата натрия, б) Na2SO4, в) MgSO4, г) К3РО4. 72. Рассчитать активность ионов Mg2+ в водном растворе, содержащем 0,001 М Na2SO4 и 0,005М MgCl2 при 250С. 73. Вычислить рН раствора, содержащего 0,56 г КОН в 1 л раствора. 74. Как изменится рН дистиллированной воды, если в 1 л ее растворить 0,001 моль КОН? 75. Смешали равные объёмы 0,01 М Н2SO4 и 0,03 М КОН. Вычислить рН образовавшегося раствора. 76. Для корреляции кислотно-щелочного равновесия при алкалозе используют 5% раствор аскорбиновой кислоты (Ка = 7,9·10-5; М(С6Н8О6) = 167 г/моль; ρ = 1г/см3). Определить рН данного раствора. 77. Вычислить рН 0,2 М раствора СН3СООК. К(СН3СООН) = 1,76 · 10-5. 78. Вычислить рН раствора, полученного добавлением к 2 л Н2О 1,2 мл 40% NaOH (ρ = 1,28 г/см3). 79. Используя справочные данные, определить водный раствор какой соли (концентрации равны) будет иметь больше значение рН: KCl Ответ обосновать. KClO CH3COOK 80. Каково будет конечное значение рН раствора, полученного при смешивании 500 мл 0,1н. гидроксида аммония и 100 мл 0,5н. HCl? 81. Зная, что ПР(KHC4H4O6) = 4·10-4, определить, выпадет ли осадок КНС4Н4О6 при смешении равных объемов 0,03 М раствора КС1 и 0,2 М раствора NaHC4H4O6. 82. Вычислить растворимость BaSО4, зная, что П Р ( BaSO4)=1,1 · 10-10. Во сколько раз растворимость BaSO4 в 0,01 М растворе Na2SO4 меньше, чем в чистой воде? 83. Концентрация хлорид ионов в межклеточной жидкости равна 114 ммоль/л. Образуется ли осадок, если к 20 мл этой жидкости добавить 2 капли 0,01 М раствора AgNO3? (Объём капли 0,05 мл). 84. Даны соли: 1. CH3COONa; 2. Na2S; 3. NaHCO3; 4. NH4NO3; 5. AgNO3; 6. C6H5NH2 · HCl а) написать ионно-молекулярное уравнение гидролиза соли, объяснить механизм гидролиза соли; б) вычислить константу гидролиза соли (в случае ступенчатого гидролиза по первой ступени); в) найти степень гидролиза соли и рН раствора, если концентрация равна: 0,1 моль/л; 0,01 моль/л; г) перечислить факторы: усиливающие гидролиз, подавляющие гидролиз. 85. Известно, что рН 0,01 М раствора соли KatAn, гидролизующейся по аниону, равен 10. Определить степень гидролиза соли, константу гидролиза и константу диссоциации кислоты HAn. 86. Вычислить рН буферных смесей, приготовленных сливанием равных объемов следующих растворов: а) 0,1 М NaH2PO4 и 0,1 M Na2HPO4; б) 0,1 M NaH2PO4 и 0,01 М Na2HPO4; в) 0,01 М NaH2PO4 и 0,1 М Na2HPO4. 87. Вычислить pH буферных смесей, полученных сливанием равных объемов растворов: а) 0,1 М NH4OH и 0,1 М NH4Cl; б) 0,2 М NH4OH и 0,02 М NH4Cl; в) 0,2 М NH4OH и 0,2 М NH4Cl. 88. На сколько единиц изменится значение pH формиатной буферной системы (HCOOH, HCOONa): а) при увеличении концентрации соли в 10 раз; б) при уменьшении концентрации кислоты в 10 раз? 89. Константа диссоциации гемоглобина и оксигемоглобина равны соответственно: 6,3·10-9 и 1,1·10-7. Установить, какая из систем (гемоглобиновая или оксигемоглобиновая) будет более эффективной для поддержания в норме pH крови (рНкрови = 7,40). 90. Как изменится значение рН фосфатного буферного раствора, который приготовили из 100 мл 0,1 М раствора дигидрофосфата и 300 мл 0,1 М раствора гидрофосфата натрия, при добавлении 20 мл 0,1 М раствора NaOH? 91. Для приготовления трех буферных растворов использовали 1,0 н. растворы гидрофосфата и дигидрофосфата натрия, смешав их в соотношениях: а) 7:3; б)5:5; в)1,5:8,5. У какого раствора будет максимальная буферная емкость? Наибольшее значение рН? 92. К 100 мл крови для изменения рН на единицу надо добавить 3,6 мл 0,1 М раствора HCl. Какова буферная емкость крови по кислоте? 93. Сколько щелочи нужно добавить к 1 мл эритроцитов крови, чтобы изменить их pH от 7,36 до 7,50 , если буферная емкость гемоглобинового буфера 0,034 моль/л? 94. Для определения буферной емкости системы проведено титрование 0,1н. раствором щелочи. Изменится ли результат титрования, если использовать 0,05 н. раствор щелочи; изменится ли при этом буферная емкость системы? 95. Как с позиции метода ВС объяснить характер связей и координационное число в соединениях [Zn(NH3)4]SO4; [Ag(NH3)2]Cl; K4[Fe(CN)6]; [Fe(CO)5]? 96. Чем объяснить различное пространственное строение комплексных ионов? Ион-комплексообразователь + Ag 2+ Zn 3+ Cr Соединение + [Ag(NH3)2] 2[Zn(CN)4] 3[Cr(OH)6] Форма Линейная Тетраэдрическая Октаэдрическая 97. Назвать следующие комплексные соединения: [Cu(NH3)4](OH)2; K[Al(OH)4(H2O)2]; [Fe(H2O)6]Cl3; [Cr(H2O)4Cl2]Cl; [Pt(NH3)4][PtCl4]; [Co(NH3)6]SO4; [Pt(NH3)2Cl2]. 98. Написать уравнения диссоциации следующих комплексных соединений: K3[Fe(CN)6]; [Cu(NH3)4]SO4; K[BiI4]; Cu2[Fe(CN)6]; [Cr(H2O)6]Cl3. 99. Написать выражения констант нестойкости для следующих ком3 2+ + 4 плексных ионов: [Co(NO2)6] ¯; [PtCl2(NH3)4] ; [Ag(NH3)2] ; [Fe(CN)6] ¯; 2+ 3+ [Ni(NH3)4] ; [Cr(H2O)6] . 100. Вычислить концентрацию ионов серебра в 0,1М растворе хлорида ди+ амминсеребра (I). Как изменится концентрация [Ag ], если к одному литру раствора соли добавить один литр 0,5 Мраствора NН3? 101. Вычислить концентрацию ионов Ni 2– –22 Kнест.([Ni(CN)4] )=1·10 . 2+ в 0,1 М растворе K2[Ni(CN)4]. 2– 102. Произойдет ли разрушение комплекса [HgCl4] ,если к 1 л 0,1 М 2-17 раствора K2[HgCl4] добавить 0,078 г Na2S? Kнест( [HgCl4] )=6·10 , -52 ПРHgS = 1,6·10 . 103. Какие комплексные соединения называются кластерами, хелатами? Привести примеры. 104. Написать уравнения реакций в молекулярной и ионной форме: , 1) K[Ag(CN)2]+K2S→ 2) K[Ag(NO2)2]+KBr→ , 3) [Cd(NH3)4]Cl2+NaOH→ , зная константы нестойкости комплексных ионов и произведение -50 -13 -14 растворимости: ПРAg2S = 6·10 , ПРAgBr = 6·10 , ПРCo(OH)2 =2·10 . 105. Через водный раствор K4[Fe(CN)6] пропустили Cl2. Написать уравнение реакции. 106. К водному раствору: 1) K2[SnCl6] добавили железо; 2) [Ag(NH3)2]Cl добавили металлический цинк? Написать уравнения химических реакций. 107. Исходя из этана получите монохлоруксусную кислоту; из пропилена – ацетон; из ацетилена – этилацетат. 108. Какие продукты получаются при взаимодействии пропена и 2-метилпропена с хлороводородом? Какой из этих алкенов более активен в реакциях электрофильного присоединения? Дайте обоснование правилу Марковникова с учетом статического и динамического факторов. 109. Дать название следующим соединениям C O H а) CH2=CH б) CH3 CH2 OH CH CH2 CH C CH3 NH2 в) CH2 CH2 CH2 C OH г) д) CH2=C C O H CH3 е) CH 3 C C O OH O O OH O OH CH2 CH2 OH 110. По каким реакциям можно различить: а) стеариновую и олеиновую кислоты; б) глицерин, ацетальдегид и этанол (в растворе); в) фенол и гидрохинон; г) муравьиную и уксусную кислоты? 111. Рассмотреть механизм реакции брома с: а) уксусной кислотой; б) акриловой кислотой; в) бензойной кислотой. 112. Что такое кислота и основание в соответствии с протолитической теорией Бренстеда-Лоури? Приведите примеры. Кислотность какого соединения больше: а) этанола или этилмеркаптана; б) бензилового спирта или фенола; в) бутанола или масляной кислоты? Почему? 113. Расположить приведенные соединения в ряд по увеличению кислотности: C6H5-CH3; (C6H5)3CH; CH4; (C6H5)2CH2. Выбрать для каждого соединения соответствующие значения рКа: 57; 40,9; 33,1; 31,5. 114. Какой реакцией можно отличать н-пропиловый спирт от глицерина? Какой качественной реакцией можно обнаружить многоатомные спирты? Напишите хелатный комплекс глиголята меди. 115. Какую реакцию среды имеет водный раствор этилата (этоксида) натрия? Почему фенолят натрия не разлагается водой? Почему спирты реагируют с натрием медленнее, чем с водой? 116. Написать уравнения реакций, доказывающих кислотные свойства: а) метанола; б) изопропилового спирта; в) гидрохинона; г) уксусной кислоты; д) щавелевой кислоты. Какая из кислот: уксусная или щавелевая имеет большее значение константы диссоциации (Ка) и почему? 117. Какой амин: этиламин или анилин обладает более ярко выраженными основными свойствами? Ответ пояснить. Написать уравнения реакций, доказывающих основные свойства: а) н-пропиламина; б) анилина; в) диэтиламина. 118. Расположить в ряд по увеличению кислотности следующие кислоты: уксусная, трихлоруксусная, пропионовая. Ответ пояснить. Расположить в ряд по уменьшению кислотности следующие спирты: этиловый, трет-бутиловый, метиловый. Решение обосновать. а б в 119. В молекулах карбоновой кислоты R-COOH и спирта ROH три атома кислорода (а, б, в). Расположить их в ряд по изменению основности. К которому из них будет присоединяться ион Н+ в реакции этерификации, катализируемой минеральной кислотой? Разобрать механизм этой реакции. 120. Как средство, повышающее артериальное давление, норадреналин применяется в виде соли винной кислоты (тартрат). Определить место протонирования в молекуле норадреналина: HO HO CH CH2 NH2 OH 121. Привести формулы строения и назвать таутомерные формы: рибозы, глюкозы, фруктозы. 122. Написать структурные формулы: а) α-D-глюкопиранозы; б) α-D-рибофуранозы; в) β-D-галактопиранозы; г) α-D-фруктофуранозы; д) аномеров D-глюкопиранозы в конформации "кресла". 123. Написать для глюкозы уравнения: а) гидрирования; б) присоединения НСN; в) реакции со спиртом. 124. Какие биологически важные продукты могут быть получены при окислении D-глюкозы в различных условиях? Подтвердить уравнениями реакций. 125. Какой моносахарид получается при декарбоксилировании глюкуроновой кислоты? 126. Написать уравнения реакций получения D-галактоновой кислоты, D-галактуроновой кислоты, слизивой кислоты. 127. Почему кетозы легко окисляются в щелочной среде, а окисление в кислой среде проходит только в жестких условиях и сильными окислителями? Написать схему изомеризации фруктозы в щелочной среде. 128. Написать уравнения реакций образования β-D-метилглюкопиранозы, α-D-этилгалактопиранозы, β-D-изопропилфруктофуранозы. 129. Написать уравнения реакций образования сложных эфиров: пентаацетата D-глюкозы, 5-фосфата - β-D-рибофуранозы, β-Dфруктозо-1,6-дифосфата, α-D- глюкозо-3-фосфата. 130. Написать таутомерные формы мальтозы, лактозы, целлобиозы. Какие химические реакции проходят для циклических, а какие для оксоформ этих дисахаридов? Для растворов каких дисахаридов наблюдается мутаротация? 131. По каким химическим реакциям можно различить мальтозу, фруктозу, сахарозу? 132. Написать уравнения реакций, доказывающих многоатомность дисахаридов: а) мальтозы; б) сахарозы. 133. Написать уравнение реакции гидролиза сахарозы. Почему эту реакцию называют инверсией сахарозы? 134. Какие полисахариды называются гомополисахаридами? Указать виды связи между D-глюкозидными остатками в крахмале, целлюлозе, гликогене, декстране. 135. Написать изомеры аминов (шесть) состава C5H13N, которые с азотистой кислотой образуют нитрозамины, а с соляной кислотой – соли. 136. Выбрать реактивы, с помощью которых из пропеновой кислоты можно получить 1) α-аланин; 2) β-аланин: а) HBr + NH3; б) KMnO4; в) H2 + Cl2 + NH3; г) Br2 + NH3; д) H2O + NH3. 137. Написать уравнения реакций, протекающих при нагревании: а) γ-аминовалериановой кислоты; б) глицина; в) β-аминоизомасляной кислоты. Назвать образующиеся соединения. Чем объясняется различие в превращениях аминокислот при нагревании? 138. Какое из перечисленных соединений образуется монодекарбоксилировании глутаминовой кислоты: 3-аминобутановая кислота, 4-аминобутановая кислота, 2-аминобутановая кислота, 3-аминопропановая кислота, при 2-аминопропановая кислота? 139. Написать формулы трех возможных трипептидов, образованных из двух молекул глицина и одной молекулы аланина. Назвать трипептиды. 140. Выбрать правильное название для следующего трипептида: H2N CH C NH CH2 C NH CH COOH CH3 O O а) аланилглицилфенилаланин; в) аланилглицилфенилаланил; CH2 C6H5 б) фенилаланилглицилаланин; г) фенилаланил. 141. Какие из перечисленных продуктов образуются в результате полного кислотного гидролиза дипептида Ala − Gly в среде хлороводородной кислоты? Написать уравнение гидролиза. б) H2NCH2COOH; в) CH3 CH COOH ; а) CH3 CH COOH ; + г) CH3 NH3 CH COO- ; NH2 д) H3 NCH2COOH; е) H2NCH2COO–. + NH2 142. Выбрать α-аминокислоты, которые в условиях электрофореза при рН = 6,0 будут двигаться к аноду, а которые - к катоду: аргинин, pI*=10,8; валин,pI = 6,0; аланин, pI = 6,0; глицин, pI = 6,0; глутаминовая кислота, pI=3,2. 143. Какая из приведенных форм аспарагиновой кислоты будет преобладать при рН=12? а) HOOC CH2 CH COOH б) HOOC CH CH COO2 NH2 в) HOOC CH COO CH2 д) OOC CH2 + NH3 CH COO- NH2 - г) HOOC CH2 CH COOH + NH3 NH2 144. Написать уравнения реакций бромирования пиррола, тиофена, пиридина. Объяснить механизм реакций. Для какого из перечисленных соединений ароматические свойства выражены ярче и почему? 145. Написать уравнения реакций, подтверждающих: а) амфотерный характер пиррола и тиазола; б) основные свойства пирролидина. пирролина и имидазола. Для какого из указанных соединений основные свойства выражены ярче? 146. Написать схему получения метилпиридиний йодида и реакцию взаимодействия его с гидрид-ионом. В состав какого кофермента входит замещенный катион пиридиния? 147. Написать уравнения реакций: а) получения амида никотиновой кислоты из β-пиколина; б) получения кордиамина (N,N-диэтиламид никотиновой кислоты) из пиридина. 148. Написать схему лактим-лактамной таутомерии а) барбитуровой кислоты (2,4,6-тригидроксипиримидин); б) мочевой кислоты (2,6,8- тригидроксипурин). 149. Какие типы солей может образовывать триптофан? Напишите их структурные формулы. 150. Построить трипептиды: Гис-Про-Три, Про-Ала-Гис, Лиз-Три-Про. Определить в какой среде (кислой, щелочной или нейтральной) лежит их изоэлектрическая точка. 151. Написать схему лактим-лактамной таутомерии урацила, цитозина, гуанина. 152. Написать схему дезоксигуанозина. реакции образования цитидина, тимидана, 153. Написать уравнение полного гидролиза: а) 5’-адениловой кислоты; б) 5’-цитидиловой кислоты; в) 5’-гуаниловой кислоты. 154. Написать уравнение ступенчатого гидролиза АТФ. В какой среде гидролизуются сложноэфирные и гликозидные связи? 155. Написать строение участка ДНК, имеющего последовательность: а) А-Г-Ц; б) Т-Г-А; в) Г-А-Т. 156. Написать формулы тимина, цитозина и комплементарных им оснований. Укажите водородные связи.


