2 семестр 01. Галогеналканы
реклама

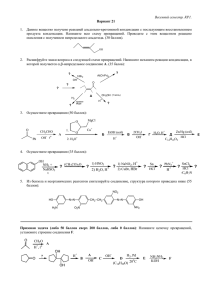
в галогеналканах R-H R-Х Х – функциональная группа Что это такое? Атом или группа атомов, в основном определяющая свойства органического вещества. R-Х, Х = F,Cl,Br,I Hal - По числу атомов галогена: моно-, ди-, три- поли-… - По строению углеводородного радикала: Предельные, непредельные, ароматические… - По типу атома углерода в углеродном скелете: первичные, вторичные, третичные hʋ 1) R-H + Cl2 -> R-Cl + HCl 2) R-CH=CH2 + Cl2 -> R-CHCl-CH2-Cl 3) R-CH=CH2 + HCl -> R-CHCl-CH3 AlCl3 4) C6H6 + Cl2 -> C6H5Cl + HCl 5) ROH + HCl -> RCl + H2O Реакция Вюрца Взаимодействие с реактивом Гриньяра Получение алкенов Связь полярна, склонна к гетеролитическому разрыву: -имеют более высокие температуры плавления и кипения, чем алканы; -практически нерастворимы в воде; -имеют характерные запахи. R-CH -Hal 2 как у углеводородов новые свойства Замещение (атакует нуклеофил): SN или Элиминирование или отщепление (атакует основание): E CH3-CH2-Br + NaOH CH3-CH2OH + NaBr Водный раствор щелочи!!! CH3-CH2-Br + NaOH CH2=CH2 + NaBr +Н2О Спиртовой раствор щелочи, нагревание Нуклеофилы «любят» ядра атомов углерода, т .е. C+ Основания «любят» протоны, т.е. H+ Часто (но не всегда!!) – одни и те же частицы являются и нуклеофилами, и основаниями, а реакции нуклеофильного замещения и отщепления идут параллельно. http://www.youtube.com/watch?v=YGSiUZ443xY&feature=related http://www.youtube.com/watch?v=YGSiUZ443xY&feature=related Основание Cl- слабое У Кислота HCl сильная Н2О слабое Н3О+ сильная OH- сильное H2O слабая ОСН3- сильное СН3ОН слабая NH3 среднее NH4+ средняя SH- сильное H2S слабая H- очень сильное H2 очень слабая CH3- очень сильное CH4 очень слабая NH2- очень сильное NH3 очень слабая HY -процесс, обратный присоединению к алкенам; -происходит конкурентно с реакциями замещения, часто одни и те же реагенты; От строения субстрата От температуры От полярности растворителя От строения реагента