Диаграммы химической и электрохимической устойчивости
реклама

УДК 620.193:669.716
Диаграммы химической и электрохимической
устойчивости горячих металлических покрытий
на низкоуглеродистой стали
А Г. Тюрин
Построены диаграммы рН-потенциал горячих оловянных,
цинковых, алюминиевых и алюмоцщковых покрытий на железе.
Рассмотрены особенности коррозионно-электрохимического поведения различных фаз сплавов в водных растворах.
Горячими называют металлические покрытия, получаемые на изделиях
методом погружения в металлический расплав. Важнейшими металлами и
сплавами для горячих покрытий низкоуглеродистой стали являются олово,
цинк, алюминий [1,2] и алюмоцинковые сплавы [3,4]. В результате
взаимодействия расплавов с подложкой фазовый и химический состав
покрытий полностью соответствует диаграммам состояния систем Fe—Me
[5] (рис.1 и 2), где Me-Sn, Zn, Al.
Равновесия твердое вещество — водный раствор наиболее удобно
представлять с помощью диаграмм рН-потенциал [6,7 ]. Для их расчетов
необходимо описать фазовые и • химические равновесия в исследуемых
системах. Термодинамические свойства твердых растворов металлов, оксидов,
смешанных образований удобно описывать в рамках обобщенной теории
"регулярных" растворов [8]. Избыточная энергия Гиббса бинарного
металлического раствора
Gh = Х\ -АС/г, ι + XrbGtr, 2 + XiX2(Q^ + Q® ·*2 + (2$-XiXi),
(D
где AGir, i — энергии Гиббса фазовых превращений чистых металлов;
Q1^1Q1I? и Q $ — энергетические параметры теории; Xi и Хг ~ мольные,
доли компонентов.
Наиболее распространенное в термодинамике сплавов стандартное
состояние — чистый металл в устойчивой при данной температуре и
давлении модификации (табл.1). Для представления термодинамических
свойств какого-либо компонента в растворах с различными кристаллическими
решетками по отношению к одному и тому же стандартному состоянию
необходимы данные об изменениях энергии Гиббса при фазовых превращениях. Сведения о величинах AGtr, ι для железа и металлов горячих покрытий
сведены в табл.2.
При аппроксимации термодинамических свойств твердых растворов
при помощи уравнения (1) удается, получить адекватное описание
экспериментальных данных, если ограничиться двумя параметрами Q ^ и
Q<$! приняв Q $ = 0. Таким образом, автором были получены выражения
для термодинамических функций смешения бинарных сплавов, энергетические параметры которых представлены в табл.3.
81
Таблица 1
Физико-химические свойства некоторых элементов [5]
Название
элемента
Модификация
Кристаллическая
структура
Тип
превращения
Температура
превращения,
0
C
Железо
а
О.Ц.К
а -* γ
911
У
г.ц.к
γ •* δ
1392
δ
О.Ц.К
1536
13
а
решетка алмаза
α-* β
β
тетрагональная
β-*Ж
232
Цинк
1
гексагональная
η-^Ж
419,6
Алюминий
У
Г.Ц.К
γ-* Ж
660,5
Олово
Таблица 2
Изменение энергии Гиббса при фазовых превращениях чистых металлов
в стандартных условиях (1 атм, 298K) [9,10]
Название элемента
Тип превращения
Железо
Г.Ц.К.(у)
ACfr,298 . Дж/моль
-2880
•? О.Ц.К.(а)
Олово
тетрагональная •? О.Ц.К.(а)
300
Цинк
гексагональная •? Г.Ц.К.(у)
512
гексагональная «- ОЛД.К.(а)
500
Алюминий
' Г.Ц.К.(у)
•? 0Л.К.(«)
10987
Г.Ц.К.(у)
«? гексагональная
502
Таблица 3
Энергетические параметры бинарных твердых металлических растворов
при низких температурах (298-373К)
Двойная система
Тип твердого
раствора
β#
Qf
Fe-Sn
α-фаза
2000
-8000
[H]
Fe-Zn
α-фаза
16250
-5000
[12,13]
Fc-Al
ct-фаза
-63000
-154000
[14,15]
Al-Zn
у-фаза
12100
8900
[16]
Al-Zn
»/-фаза
20125
20125
[16]
Энергетические параметры,
Дж/моль
Использованные
экспериментальные
данные
Реальные сплавы могут содержать не только первичные твердые
растворы, но и промежуточные, или интерметаллидные фазы. Теплоты,
энтропии и энергии Гиббса образования интерметаллических соединений
обычно относят к г-атому сплава [9], т.е. величина, относящаяся к молю
82
соединения, делится на число входящих в него атомов. Это удобно для
сопоставления термодинамических свойств различных интерметаллидов.
Совокупность экспериментальных результатов по термодинамическим свойствам интерметаллических соединений исследуемых в работе систем
представлена в табл.4.
. Таблица 4
Термодинамические свойства интерметаллических соединений [9,12]
№ п/п
Соединение (фаза)
-AHf, кДж/г-ат
-AS?, Дж/Кт-ат
1
FeZn2,2 (Г-фаза)
3,3
-0,5
2
FeZn3,2 (Г]-фаза)
2,8
-1,1
3
FeZn6,69 (<5-фаза)
3,9
0,5
4
FeAI (ft-фаза)
25,1-30,5
3,6-7,5
5
FeAh (£-фаза)
27,2-34,3
5,4-8,4
6
Fe2Als (>/-фаза)
28,5-33,3
6,0-7,9
7
FeAb (0-фаза)
27,6-31,9
5,9-7,3
Некоторые интерметаллиды, в частности промежуточные фазы системы
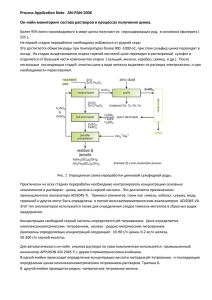
Fe—Zn (рис.1), имеют широкую область гомогенности. Нестехиометрией
интерметаллидных фаз в системах Fe—Sn и Fe—Al в целом можно
пренебречь.
300
"* IJII
Γ
%$00
300:
/
M
so
Zr
I
Zn)
/
t
J
to
ίο
so
Ποκ
\
so
3
ion
Рис. 1 Взаимосвязь между диаграммой состояния
системы Fe-Zn и кривой распределения цинка
и горячем цинковом покрытии
83
eeojs'a
Рис.2, Взаимосвязь между диаграммой состояния
системы Fe—Al и кривой распределения алюминия
в горячем алюминиевом покрытии
В настоящее время известно несколько практических способов расчета
энтальпий и энтропии образования бинарных интерметаллических соединений. Для оценки теплот образования ,интерметаллидов при стандартной
температуре больше подходит метод Миедемы, а энтропии — формула
Истмена {7 J. Авторские результаты расчетов термодинамических функций
образования интерметаллидов из элементов представлены в табл.5.
·'·
Таблица 5
Расчетные энтальпии и энтропии образования интерметаллических соединений
№ п/п
1
2
3
4
5
6
7
8
9
IO
Π
Соединение
FeSn 2
FeSn
;
I C3Zii7(D
FeZn 4 (I - I)
FeZnio(<5)
FeZiM з (ξ)
FejAl
FeA!
FeAI2
Fe 2 AI 5
FeAb
-Δ//?
кДж/ΐ'-ατ
1,447
2,0415
3,666
2,456
1,113
0,877
22,50
31,40
24,20
20,90
29,90
кДж/моль
4,340
4,083
36,660
12,278
12,248
12,280
90,00
62,80
72,60
146,30
119,60
84
Дж/К-г-ат
47,717
42,055
38,29
41,29
39,28
41,27
33,538
22,97
20,77
19,46
19,65
Дж/К-моль
143,15
Дж/К · моль
84,11
382,9
206,4
432,1
5,48
9,4
12,4
24,0
29,6
24,35
-4,77
-10,75
-29,88
-16,78
577,7
134,15
45,94
62,31
136,20
78,60
13,05
Расчетные энтальпии и. энтропии интерметаллидов хорошо согласуются
с имеющимися экспериментальными данными. Малая величина изменения
энтропии реакций образования промежуточных фаз, являющаяся их
отличительной чертой, свидетельствует о том, что энергия Гиббса
образования соединений определяется в основном энтальпией "реакции.
Представим интерметаллидные соединения железа с цинком общей
формулой FeZnx. B соответствии с последним вариантом диаграммы
состояния системы [5 ] области гомогенности промежуточных фаз при низких
температурах приводятся в табл.6.
Таблица 6
Фазовый и химический составы промежуточных фаз системы Fe-Zn при 298К
№ п/п
Фаза
Область гомогенности фазы, X
1
Г-фаза
X = 2,2+2,45
2
Γι-фаза
χ = 3,0+4,4
3
(5-фаза
X = 6,6*11,35 .
4
£-фаза
X = 12,9+13,4
Энергии Гиббса реакций образования "соединений" железа с цинком
(табл.5) аппроксимируются линейным выражением
ЛСЙ98 (Fe Znx) = -13700-570·X,
Дж/моль.
(2)
Формула (2) позволяет судить о влиянии состава на термодинамические характеристики Г-, Γι-, δ- и £-фаз.
Термодинамические свойства твердых оксидных растворов — шпинельных фаз (ZnFe2O4—Fe3O4) т.р., (FeAhC^-Fe3U4) т.р. и (Fe3U4—
ZnFe2O4—FeAhCM) т.р. были описаны автором ранее [6,8]. Энергии Гиббса
реакций образования оксидов железа, олова, цинка и алюминия по
справочным данным [17] приведены в.табяЛ. Данные таблиц и стандартные
электродные потенциалы реакций в водных растворах [18] позволили
рассчитать диаграммы рН-потенциал систем Fe—Sn-НгО, F e - Z n — Щ О ,
Fe-Al-НгО, Fe-Zn-Al-НгО.
Результаты расчетов представлены на рис.3 и 4.
Таблица 7
Энергии Гиббса реакций образования оксидов из элементов при 250C
Соединение
-AG*>ii8, Д ж / м о л ь
Соединение
-AG2 Qs, Д ж / м о л ь
Fe 3 O 4
1020233
Zt)Fc 2 O 4
1095494
Fe 2 O 3
744224
Al 2 O 3
1581338
SnO2
519518
FcAI 2 O 4
1870637
ZnO
320890
Z11AI2O4
1957035
1
Известно [19], что белая жесть — один из основных способов
специальной отделки поверхности листового проката и защиты от коррозии.
В системе Fe—Sn [5] существуют следующие интерметаллические соединс85
ι
ο
<
ι .
ι
ι
ι
ι
. . ι
1
1
ζ
Рис.3. Диаграммы рН-потенциал для систем Fe-Sn-HaO (а),
Fe-Zii-НгО (б) при 298 К и активностях иопои и водном растворе
aj = IM (нсгидратиропанная форма окислов)
86
ния: FeSn2, стабильное при температурах ниже 4960C; FeSn, стабильное
при температурах до 74O0C ; Fe3Sn2, стабильное в интервале температур
815—6000C ; Fe3Sn, стабильное в интервале температур 880—75O0C и
у-фаза, стабильная в интервале температур 900—78O0C. Растворимость олова
в α-железе при 25—1000C составляет порядка 2 атом.%.
Диаграмма рН-потенциал системы Fe—Sn—ЩО представлена на
рис.3,а. Электродвижущая сила гальванической цепи Sn/водный раствор/Fe,
обусловленная образованием на железе интерметаллического соединения
FeSn2, при 250C составляет лишь 40 мВ. Соответственно для флюса -^.
водного раствора хлористого цинка — с содержанием соли 600—800 г/л
при 200—25O0C она составляет 80-—140 мВ [1 ]. Причем если в кислых
средах анодом в цепи является железо (жесть), а катодом — олово, то в
нейтральных и щелочных растворах происходит переполюсовка: олово,
подобно цинку, служит анодом по отношению к стали. Никаким "особым
типом, когда более электроотрицательный металл осаждается на менее
электроотрицательном" [1 ], электрохимическая система Зд/флюс/Ре не
является: в отличие от чистого олова в нейтральных растворах фазы FeSn
и FeSn2 (рис.3,а) остаются более электроположительными по отношению к
железу (жести). Именно образование во флюсе тончайшей пленки покрытия,
состоящей из фаз FeSn и FeSn2, на поверхности листа в результате работы
короткозамкнутой гальванической цепи Sn(ж)/флюс/FeCr) является основой
процесса флюсования при горячем лужении жести.
Горячие цинковые покрытия на стали имеют многофазную структуру,
отвечающую диаграмме состояния железо—цинк [5] (рис.1). При контакте
изделия с расплавом цинка незначительное количество цинка диффундирует
в железо, образуя переходную зону (α-фазу). Непосредственно на стальном
основании находится Г-фаза, содержащая 21—28% по массе железа. Затем
следует слой <5-фазы с содержанием 7—11,5% железа, являющейся основной
составляющей слоя железоцинковых сплавов. Слой ό-фазы обнаруживает
при травлении как бы две зоны: зону, примыкающую к Г-фазе и
представляющую собой компактный, не выявляющий структуры слой, и
зону с явно выраженной столбчатой структурой. Следующая за <5-фазой
!-фаза-.- с содержанием 6—6,2% железа -чаще всего имеет столбчатую
структуру. Верхний слой представляет собой слой почти чистого цинка
(77-фазу). Образование этой фазы происходит при выгрузке изделия из
расплава и кристаллизации захваченного им цинка. Толщина слоя jy-фазы
зависит от вязкости и поверхностного натяжения расплава цинка и скорости
выгрузки изделия из расплава.
Диаграмма рН-потенциал системы Fe—Zn—ЩО при 250C представлена на рис.3,6. На ней нанесены линии химических и электрохимических
равновесий, играющие роль при коррозии диффузионных цинковых покрытий
в водных средах. Равновесные потенциалы Г-, Γι-, О- и £-фаз близки друг
к другу и к равновесному потенциалу цинка, что хорошо коррелируется
со стационарными потенциалами фаз [20]. Поэтому эффективность
электрохимической защиты стали с помощью диффузионного цинкового
покрытия практически не должна уменьшаться по мере растворения 7/-фазы
и вступления в контакт с водным раствором интерметаллидов железа и
цинка. Коррозионная стойкость железоцинковых фаз на порядок выше, чем
у электролитического цинка [20 ]. Таким образом, обеспечивая существенную
экономию цинка, железоцинковые покрытия не снижают ни коррозионных,
ни электрохимических свойств цинка.
87
Алюминирование является одним из эффективных методов увеличения
долговечности металлических конструкций и экономии'черных металлов. В
литературе нет единого мнения о строении' диффузионных алюминиевых
покрытий [21], что объясняется прежде всего способностью системы
алюминий—железо образовывать большое количество различных соединений
и высокой чувствительностью процесса диффузионного насыщения к
условиям его осуществления.
Данные микрорентгеноспектрального анализа покрытия, полученного
из расплава алюминия, представлены на рис.2. Диффузионный слой
покрытия может представлять собой ряд зон, состоящих из интерметаллидов
FeAl3, Fe2Al5, FeAh, FeAl, Fe3Al и твердого раствора алюминия в железе
(α-фазы). Для уменьшения толщины хрупкой интерметаллидной зоны
покрытия в расплав алюминия вводят кремний [22],' резко снижающий
скорость диффузии алюминия в подложку.
Результаты расчета диаграммы рН-потенциал системы Fe-Al—ШО
при 250C представлены на рис.4,а. Различные фазы горячего алюминиевого
покрытия в водных растворах имеют близкие электрохимические характеристики: равновесные потенциалы алюминия и его интерметаллидов с
железом отличаются друг от друга не более чем на 0,3 В. В слабокислых,
нейтральных и щелочных растворах они пассивируются с образованием
пленки оксида-гидроксида алюминия, однако защитная способность пленки
AI2O3 не всегда одинакова [23] (табл.8 и 9). Измерения проводили на
потенциостате П5848. Рабочая поверхность электродов составляла 4—5 мм .
Токи коррозии рассчитывались на основании потенциодинамических (1
мВ/с) поляризационных кривых.
В активной коррозионной среде, какой является 3%-й водный'раствор
NaCI (табл.8), все материалы покрытий осуществляют электрохимическую
защиту стали. Причем потенциалы коррозии FeAl3 и Fe2Als — фаз,
составляющих диффузионный слой алюминиевого и алюмоцинковых покрытий, практически не отличаются от соответствующих электрохимических
характеристик алюминия и цинка. Токи коррозии "гальвалюма" на порядок
выше, чем у цинка или алюминия. Основной причиной высокой
коррозионной активности алюмоцинкового сплава в модельной морской воде
выступает, в соответствии с диаграммой Zn—Al [24 ], образование и распад
промежуточных фаз, которые являются источником напряжений и увеличивают электрохимическую активность сплава.
Таблица 8
Потенциалы уяшр., В (н.в.э.), и токи ϊκορ., мА/см , коррозии металлов
и сплавов в 3%-м водном растворе NaCl (рН 8,2-5-8,5)
Температура раствора, 0 C
Состап металла
70
45
20
90
. 'кор.
Укор·
'кор.
3,2
-0,42
32,0
-0,76
0,45
-0,76
1,4
5,0
-0,83
6,3
-0,82
16,0
0,10
-0,76
0,49
-0,73
2,0
Укор.
ίκορ.
Укор-
•кор.
Укор.
Ст.З
-0,41
0,026
-0,45
0,32
-0,40
Zn
-0,75
0,10
-0,75
0,32
45%Ζη + 55%Λ1
(гальпалюм)
-0,77
0,71
-0,76
ΛΙ
-0,69
0,032
-0,75
FeAb
-0,72
-0,71
-0,70
-0,71
Fe2AIs
-0,74 '
-0,66
-0,64
-0,67
88
- • • _
O
S,
-
- •
- • -
в
4-
—
in
I
1
,ι,
ι
iOplJ /«
Л
(6)
-0,4-
\
JL U
Л.
\ .
^ ^
t-qs-
ityF&il&s+Aity+MiiQb
ч,в
4,1
Vl
O A
->
V^S
^
ι
|
I
I
I
4
Рис.4. Диаграммы рН-потенциал для систем Fe-AI-IhO (а),
Fc-Zn-Al-HzO (б) при 298 К и активностях ионов η водном растпорс
а, = IM (нсгидратированная форма окислов)
89
Использование алюминиевых покрытий в условиях водоснабжения
ограничено склонностью алюминия к питтинговой коррозии [25]. Кроме
того, при комнатной температуре в водах, содержащих менее 100 мг/кг
хлорида, алюминий остается катодным по отношению к стали [26].
Последнее подтверждается и данными автора (табл.9). Для устранения
питтинговой коррозии алюминия в водопроводной воде может применяться
катодная защита, которая достигается различными путями. В этом плане
особый интерес представляют алюмоцинковые покрытия, где цинковая
составляющая (гу-фаза) обеспечивает эффективную катодную защиту
алюминиевой составляющей (у-фазы), а сплав в целом — электрохимическую защиту низкоуглеродистой стали.
Таблица 9
Потенциалы укор., В (н.в.з.), и токи ϊκορ., мА/см ,
коррозии металлов и сплавов в аэрируемой водопроводной воде
(рН 7; общая жесткость 3,9 мг-эк.в/л; хлоридов ~ 20 мг/кг;
сульфатов ~ 50 мг/кг)
Состав металла
Температура раствора, °С
•
45
16
70
5
90
Укор·
•кор.
J KOp.
•кор-
Укор.
'кор.
Укор.
'кор.
Ст.З
-0,385
0,018
-0,385
0,063
-0,375
0,160
-0,355
0,50
Zn
-0,70
0,016
-0,745
0,030
-0,72
0,040
-0,655
0,06
45%Ζη + 55%ΑΙ
(гальвалюм)
-0,69
0,010
-0,70
0,018
-0,87
0,022
-0,985
0,028
Al
-0,365
0,0015
-0,475
0,0028
-0,95
0,0070
-1,08
0,01
Содержание алюминия в сплавах с цинком, используемых в качестве
покрытий на стали, колеблется в пределах от долей процента до 90 мас.%
[23 ]. Наибольшее практическое применение получили горячие алюмоцинковые покрытия типа "гальвалюм", содержащие 55 мас.% алюминия.
Структура алюмоцинковых покрытий в основном соответствует
равновесной диаграмме состояния системы Al—Zn [24]. При температурах
0
ниже 275 C диаграмма имеет гомогенную фазовую область на стороне цинка
(з/-фаза), содержащую при 250C до 0,02% алюминия. В равновесии с ней
находится у-фаза — твердый раствор цинка в алюминии, содержащая при
комнатной температуре около 3 мас.% цинка.
Исследование покрытия, получаемого в алюмоцинковом расплаве,
содержащем 55 мас.% алюминия, показало [23], что диффузионный слой
состоит из твердого раствора алюминия и цинка в железе («-фаза) и
интерметаллических соединений FeAl3 и Fe2Al5 с изменяющейся микроструктурой по его толщине. Основное покрытие состоит из дендритных
зерен богатой алюминием у-фазы и междендритной, богатой цинком ?/-фазы.
Результаты расчетов основных химических и электрохимических
равновесий в системе F e - Z n - A l - Щ О при 250C представлены на рис.4,6.
Равновесные потенциалы у- и ?/-фаз существенно отличаются друг от друга,
приближаясь к потенциалам чистого цинка и алюминия. В щелочных,
нейтральных и слабокислых растворах, т.е. во всех возможных атмосферных
условиях и природных водах, они пассивируются с образованием пленки
АЬОз, ZnAl2U4 или их гидрооксидов. Поэтому коррозионная стойкость
90
покрытия "гальвалюм" существенно выше, чем у цинка, и приближается
к характеристикам горячих алюминиевых покрытий. Пассивируемость
алюминия в воде выше, чем у цинка, поэтому автором с сотрудниками
[23] отмечена избирательность в коррозии цинковой составляющей 07-фазы)
покрытия "гальвалюм" в воде. Диффузионный слой покрытия (фазы Fe2AIs
и FeAl3) обладают высокой химической стойкостью в связи с пассивной
пленкой AI2O3. Кроме того, коррозионно-электрохимическое поведение
алюмоцинковых покрытий "гальвалюм" в воде зависит от условий его
формирования [27], последующей термомеханической обработки [28],
химического состава воды и режимов работы системы водоснабжения [23].
Таким образом, построенные диаграммы рН-потенциал для систем
F e - S n - H 2 O , F e - Z n - H 2 O , F e - A l - H 2 O , F e - Z n - A l - H 2 O при 25 0 C
позволяют связать технологические особенности нанесения горячих покрытий
с их коррозионно-электрохимическим поведением в водных растворах.
Список литературы
1. Виткин А.И., Тейндл И.И. Металлические покрытия листовой и
полосовой стали. M.: Металлургия, 1971. С.496.
2. Бакалюк Я.Х., Проскуркин Е.В. Трубы с металлическим противокоррозионным покрытием. 2-е изд. M.: Металлургия, 1985. С.200.
3. Баник Я., Ясовски Ф. Развитие производства стальных листов с
алюминиево-цинковым покрытием: Обзор по системе Информсталь / Ин-т
"Черметинформация". M., 1982. Вып.8 (132). С.19.
4. Мерекина Н.А. / / Черная металлургия. 1983. № 12(944). С.20—24.
5. Диаграммы состояния двойных систем на основе железа: Справ.
изд. / О.Кубашевски; Пер. с англ. M.: Металлургия, 1985. С.184.
6. Тюрин А.Г. / / Защита металлов. 1988. Т.24, № 4. С.697—700.
7. Тюрин А.Г. / / Электрохимия. 1990. Т.26, вып.12. С.1599—1606.
8. Тюрин А.Г. / / Металлы. 1993. № 2. С.48—56.
9. Могутнов Б.М., Томилин И.А., Шварцман Л.А. Термодинамика
сплавов железа. M.: Металлургия, 1984. С.208.
10. Смитлз К.Дж, Металлы: Справ. 5-е изд.: Пер. с англ. M.:
Металлургия, 1980. С.447.
11. Nussler H.D. / / CALPHAD. 1979. V.3, № 1. Р.19—27.
12. Винокурова Г.А., Самир Абу Али, Гейдерих В.А. / / Термодинамические свойства твердых металлических сплавов: Тез. докл. 3-го
Всесоюз. науч.-техн. совещ. по термодинамике металлических сплавов.
Минск, 6—8 окт. 1976 г. Минск, 1976. C l 12—114.
13. Totnila M., Azakami Т., Togyri J.M. / / Trans. Jap. Inst. Metals.
1981. V.22, № 10. Р.717-722.
14. Вечер А.А., Еськов В.M., Самохвал В.В. / / Термодинамические
свойства твердых металлических сплавов: Тез. докл. 3-го Всесоюз. науч.-тсхн.
совещ. по термодинамике металлических сплавов. Минск, 6—8 окт. 1976 г.
Минск, 1976. С.124—126.
15. Ansara I. / / Commission des Communautes Europeennes. CECA
No 7210—СА/3/303, Nov., 1981. P.I —14.
16. Люпис К. Химическая термодинамика материалов: Пер. с англ.
M.: Металлургия, 1989. С.503.
17. Рузинов Л.П., Гуляницкий Б.М. Равновесные превращения
металлургических реакций. M.: Металлургия, 1975. С.416.
91
18. Справочник.по электрохимии / Под ред. А.М.Сухотина. Л.: Химия,
1981. С.370. : . : . ' . .
19. Гусева Н.Е. Состояние и тенденции развития в мире производства
тарной жести,. листового проката, и гнутых профилей с различными видами
покрытий: Обзор по системе Йнформсталь / Ин-т "Черметинформация".
M., 1988. Вып.11. (314). С.90.
20. Лошкарев Ю.М., Коробов В.И., Трофименко В.В. / / Защита
металлов., 1994. Т.ЗО, № 1.-С.79—84.
=
. 21, Пахмурский В.И., Пих B.C., Бродяк Д.Д. / / Антикоррозионные
покрытия. Л» Наука, 1983. С.22—28.
22. .Аксенова Э.В., Дорошевич Э.И. / / Совместимость и адгезионное
взаимодействие расплавов с металлами. Киев: Наук, думка, 1978. СД54—162.
23. Тюрин А.Г., Ясенева О.Ю., Александров В.Н. и др. / /
Диффузионное насыщение и покрытие на металлах. Киев, 19.88. С.11—26.
24. Пресняков А.А., Горбань Ю.А., Червякова В.В. / / Журн. физ.
химии. 1963. Т.35. С.1289—1291.
25. Ahmad L. / / Aluminium. 1985. Bd.61, № 2. S.128—129.
26. Бакулин А.В. / / Защита металлов. 1985. Т.21, № 3. С.390—393.
27. Куаси Г., Исида А., Кобауши С. и др. / / Тэцу то хаганэ (яп.).
1986. Т.72, № 8. С.1005—1012.
28. Парамонов В.А., Тычинин А.И., Мороз А.Т. / / Металлургия:
проблемы, поиски, решения: Темат. сб. науч. тр. / МЧМ СССР (ЦНИИЧМ).
M.: 'Металлургия, 1989. С.187—194.
92