Ответы ХИМИЯ 9 класс Задание 1. Масса активного фтора в
реклама
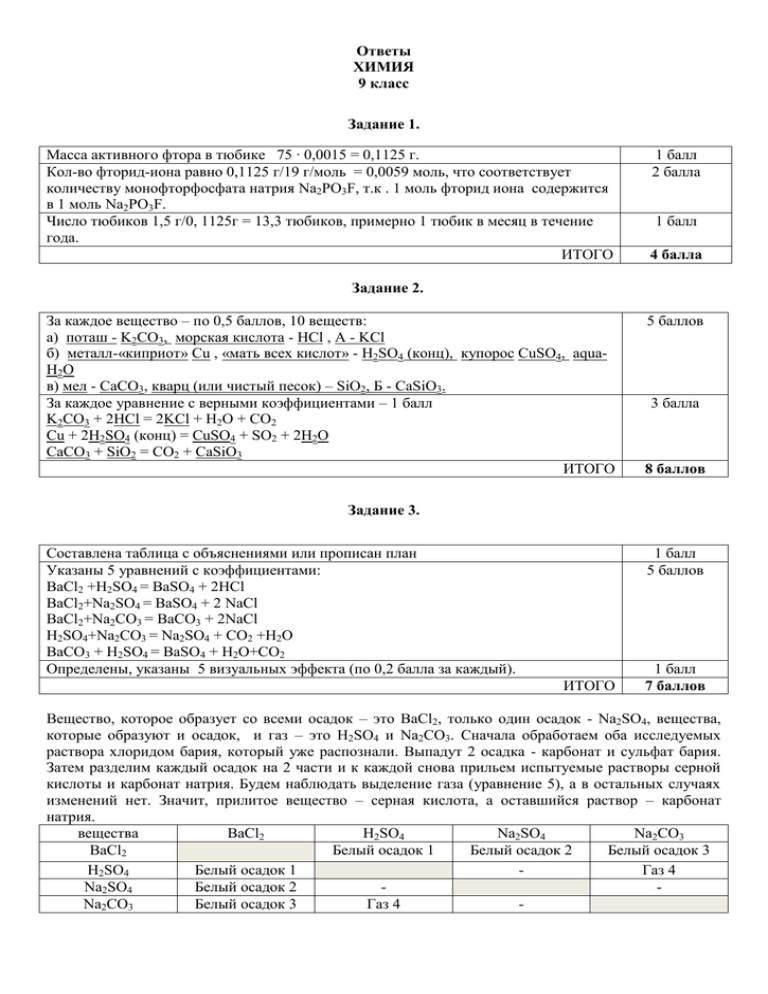
Ответы ХИМИЯ 9 класс Задание 1. Масса активного фтора в тюбике 75 ∙ 0,0015 = 0,1125 г. Кол-во фторид-иона равно 0,1125 г/19 г/моль = 0,0059 моль, что соответствует количеству монофторфосфата натрия Na2PO3F, т.к . 1 моль фторид иона содержится в 1 моль Na2PO3F. Число тюбиков 1,5 г/0, 1125г = 13,3 тюбиков, примерно 1 тюбик в месяц в течение года. ИТОГО 1 балл 2 балла 1 балл 4 балла Задание 2. За каждое вещество – по 0,5 баллов, 10 веществ: а) поташ - K2CO3, морская кислота - HCl , А - KCl б) металл-«киприот» Cu , «мать всех кислот» - H2SO4 (конц), купорос CuSO4, aquaH2O в) мел - CaCO3, кварц (или чистый песок) – SiO2, Б - CaSiO3. За каждое уравнение с верными коэффициентами – 1 балл K2CO3 + 2HCl = 2KCl + H2O + CO2 Cu + 2H2SO4 (конц) = CuSO4 + SO2 + 2H2O CaCO3 + SiO2 = CO2 + CaSiO3 ИТОГО 5 баллов 3 балла 8 баллов Задание 3. Составлена таблица с объяснениями или прописан план Указаны 5 уравнений с коэффициентами: BaCl2 +H2SO4 = BaSO4 + 2HCl BaCl2+Na2SO4 = BaSO4 + 2 NaCl BaCl2+Na2CO3 = BaCO3 + 2NaCl H2SO4+Na2CO3 = Na2SO4 + CO2 +H2O BaCO3 + H2SO4 = BaSO4 + H2O+CO2 Определены, указаны 5 визуальных эффекта (по 0,2 балла за каждый). 1 балл 5 баллов ИТОГО 1 балл 7 баллов Вещество, которое образует со всеми осадок – это BaCl2, только один осадок - Na2SO4, вещества, которые образуют и осадок, и газ – это H2SO4 и Na2CO3. Сначала обработаем оба исследуемых раствора хлоридом бария, который уже распознали. Выпадут 2 осадка - карбонат и сульфат бария. Затем разделим каждый осадок на 2 части и к каждой снова прильем испытуемые растворы серной кислоты и карбонат натрия. Будем наблюдать выделение газа (уравнение 5), а в остальных случаях изменений нет. Значит, прилитое вещество – серная кислота, а оставшийся раствор – карбонат натрия. вещества BaCl2 H2SO4 Na2SO4 Na2CO3 BaCl2 Белый осадок 1 Белый осадок 2 Белый осадок 3 H2SO4 Белый осадок 1 Газ 4 Na2SO4 Белый осадок 2 Na2CO3 Белый осадок 3 Газ 4 - Задание 4. Диссоциация соли MeNO3 → Me+ + NO3- 1 балл Количество ионов = 12 ∙ 1022/6 ∙ 1023 = 0,2 моль 1 балл Количество Me+ = количество соли = 0, 1 моль 1 балл М соли = 10,1 г/0,1 моль = 101 г/моль 1 балл Ar (Ме) = 101 - 62 = 39. Ме - калий 1 балл Молекулярная формула соли KNO3. 1 балл ИТОГО 6 баллов Задание 5. Составление двух уравнений: 2 балла Fe + 2HCl = FeCl2 + H2 Mg + 2HCl = MgCl2 + H2 Количество газа = 0,224л 22,4 л/моль = 0,01 моль 1 балл Составление математического уравнения через одну переменную: 2 балла на один 56х + 24 (0,01-х) = 0,4, где х - количество железа, любой способ или 24х + 56 (0,01-х) = 0,4, где х - количество магния. выражения ИЛИ применение системы уравнений: математического 56х + 24y = 0,4; уравнения х + y = 0,01 Расчет количества железа и магния. n (Fe) = n (Mg) = 0,005 моль. 2 балла Расчет массы железа и магния. Масса железа = 0,28 г. Масса магния = 0,12 г. 2 балла Расчет массовых долей: w(Fe) = 70%, w(Mg) = 30%. 2 балла ИТОГО Итого: 36 баллов 11 баллов





