СИНТЕЗ УГЛЕРОДНЫХ НАНОТРУБОК ИЗ ХЛОРБЕНЗОЛА НА
advertisement

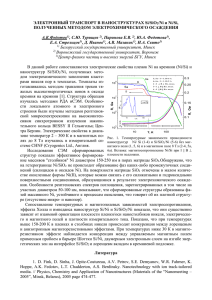
XVIII Международная научно-практическая конференция «СОВРЕМЕННЫЕ ТЕХНИКА И ТЕХНОЛОГИИ» Секция 12: Наноматериалы, нанотехнологии и новая энергетика СИНТЕЗ УГЛЕРОДНЫХ НАНОТРУБОК ИЗ ХЛОРБЕНЗОЛА НА CoO/SiO2 КАТАЛИЗАТОРАХ Чичкань А.С. Научный руководитель: Чесноков В.В., д.х.н. Институт катализа СО РАН, 630090, Россия, г. Новосибирск, пр. академика Лаврентьева, 5 E-mail: AlexCsh@yandex.ru Химическая промышленность является крупЗауглероженные катализаторы были исследоным поставщиком сырья, полупродуктов и раз- ваны методом просвечивающей электронной микличных материалов, включая пластмассы, лаки, роскопии с использованием прибора JEM-100CX с краски, минеральные удобрения и т.д. До полови- разрешением 2 Å по линиям. Детальное изучение ны оборота химической промышленности прямо углеродных наноструктур проводили с применеили косвенно связано с участием хлора [1]. При нием электронной микроскопии высокого разрепроизводстве, переработке и использовании хими- шения (ЭМВР) в сочетании с дифракцией элекческих веществ образующиеся хлорорганические тронов. ЭМВР проводили с помощью прибора отходы требуют утилизации или уничтожения, т.к. JEM-2010 с разрешением 1,4 Å по линиям. На первоначальном этапе было проведено исобладают высокой токсичностью и несут потенциальную опасность для здоровья и жизни людей [2]. следование возможности термического превращеПоэтому задача создания технологии переработки ния самого хлорбензола. В реактор подавали архлорорганических отходов является актуальной. гон, насыщенный парами хлорбензола. Реакцию Существуют различные методы обезвреживания проводили при 600-700 °С с подъемом температухлорорганических отходов: реагентные, окисли- ры в ходе опыта. Состав газовой смеси на выходе тельные, электрохимические, пиролитические, а из реактора был проанализирован с помощью хротакже сжигание, химическая и плазмохимическая матографа «Кристалл 2000». Было показано, что переработка, захоронение. Сжигание применяется термическое превращение хлорбензола незначинаиболее широко и чаще из экономических сооб- тельно и составляет приблизительно 5 %. При выражений. Альтернативой сжигания является метод боре катализатора руководствовались следующикаталитического гидродехлорирования. При ути- ми фактами: оксид кремния устойчив к воздейстлизации отходов каталитическим методом исклю- вию хлороводорода, поэтому более предпочтитечается образование хлордиоксинов и парниковых лен в качестве носителя катализатора, чем, напригазов. Основной проблемой гидродехлорирования мер, оксид алюминия; кобальт обладает каталитиявляется дезактивация катализаторов, которая ческой активностью как в реакции гидродехлориприводит к нестабильной работе системы. рования, так и в процессе образования углерода. Целью настоящего исследования стала разра- Было показано, что оксид кремния обладает некоботка эффективных кобальтсодержащих катализа- торой активностью в реакции гидродехлорироваторов для проведения реакций гидродехлорирова- ния, а конверсия хлорбензола (ХБ) – около 30 %. Кобальтсодержащие катализаторы с крайними ния на примере разложения хлорбензола. Методом пропитки были синтезированы значениями (1 % и 10 %) были исследованы в реCoO/SiO2 катализаторы с различным содержанием акции гидродехлорирования без водорода. На риоксида кобальта (1 %, 5 % и 10 %). Катализаторы сунке 1 представлены кинетические кривые обрабыли испытаны в проточном кварцевом реакторе с зования углерода. весами Мак-Бена, что позволило следить за изменением массы образца непосредственно в ходе реакции. В качестве исходного сырья использовали хлорбензол. В процессе гидродехлорирования проходили следующие основные реакции (1-3): С Н Сl + H → C H + HCl (1); 2 5 2 6 6 C H + 3H → C H (2); 6 6 2 6 12 Co/SiO 2 →12C + 4H + 2HCl (3) 2C H Cl ⎯⎯ ⎯ ⎯⎯ 2 5 2 Таким образом, одновременно проходило несколько реакций: гидродехлорирование до бензола, гидрирование бензола до гексана и образование хлороводорода и углерода на поверхности катализатора. Углерод – это углеродные нанотрубки (УНТ), которые сами по себе представляют большой интерес благодаря своим уникальным свойствам. В перспективе УНТ могут иметь широкий спектр применения: в строительстве, материаловедении, электронике, катализе и т.д. Рис. 1 Кинетические кривые образования углерода (1) и на катализаторах 1 % CoO/SiO2 10 % CoO/SiO2 (2). Подача реагента ХБ:Ar = 1,6:100. Температура реакции 600 °C. Видно, что скорость образования углерода на 10 % CoO/SiO2 катализаторе снижается после 40 399 XVIII Международная научно-практическая конференция «СОВРЕМЕННЫЕ ТЕХНИКА И ТЕХНОЛОГИИ» Секция 12: Наноматериалы, нанотехнологии и новая энергетика зола при T = 600 °C на 1% CoO/SiO2 катализаторе. Условия реакции: Ar (ХБ) = 3 л/час, Н2 = 5 л/ч для графиков 1 (гексан) и 2 (бензол); Ar (ХБ) = 3 л/час, Н2 = 0 л/ч для графиков 3 (гексан) и 4 (бензол). минут эксперимента, однако работает гораздо стабильнее, чем 1 % CoO/SiO2 катализатор. Добавка в исходную реакционную смесь водорода положительно влияет на общий процесс гидродехлорирования: при снижении скорости образования углерода, стабильность работы катализатора возрастает. Влияние водорода на скорость образования углерода из хлорбензола показано на рисунке 2. Лучшими характеристиками в реакции разложения хлорбензола обладал катализатор 5 % CoO/SiO2. При большем содержании оксида кобальта (10 %) частицы металла спекаются и увеличиваются в размере, что приводит к дезактивации катализатора. Для процесса образования углеродных нанотрубок требуются высокодисперсные металлические частицы, поэтому желательно использовать катализаторы с меньшим содержанием оксида кобальта. В результате проведенного исследования были синтезированы катализаторы CoO/SiO2 с различным содержанием оксида кобальта. Полученные катализаторы были изучены в реакции разложения хлорбензола. Показано, что активность носителя в основной реакции незначительна, активность самого катализатора CoO/SiO2 зависит от содержания в нем активного компонента (оксида кобальта). Установлено, что оптимальным по составу катализатором для образования углеродных нанотрубок является 5 % CoO/SiO2 катализатор. Показано, что присутствие водорода в системе увеличивает конверсию хлорбензола и стабильность работы катализатора в процессе образования углеродных нанотрубок. Рис. 2 Кинетические кривые образования углерода из хлорбензола на 1% CoO/SiO2 катализаторе. Подача: (1) – ХБ:Ar = 1,6:100; (2) – ХБ:Ar:Н2 = 0,8:50:50 при T= 600 °C. Добавка водорода увеличивает конверсию хлорбензола, поэтому количественный состав реакционной смеси на выходе меняется (рис. 3). Были проведены электронно-микроскопические исследования углерода, образующегося на CoO/SiO2 катализаторах. Исследования показали, на CoO/SiO2 катализаторах образуются углеродные нанотрубки. Кроме того, для катализаторов CoO/SiO2 был определен оптимальный состав. Список использованных источников: 1. Л.Н. Занавескин, В.А. Аверьянов, О.А. Конорев Окислительные методы переработки и детоксикации хлорорганических отходов. Курс на ресурсосбережение и экологическую безопасность // Химическая промышленность, 2002, № 2, С. 1-17. 2. Л.Н. Занавескин, О.А. Конорев Четыреххлористый углерод. Методы переработки в экологически безопасные продукты и перспективы их развития. // Химическая промышленность, 2002, № 9, С. 4-21 Рис. 3 Изменение концентраций углеводородов от времени в реакции гидродехлорирования хлорбен- 400