УДК 669.168 ВОССТАНОВЛЕНИЕ КАДМИЯ И ЦИНКА В
реклама

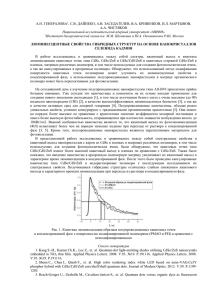
Химия. Химиялық технология 59 УДК 669.168 ВОССТАНОВЛЕНИЕ КАДМИЯ И ЦИНКА В СИСТЕМЕ CdO-ZnS-CO В.М.Шевко, З.К.Абдикулова, Н.Б.Бадирова ЮКГУ им. М. Ауезова, г.Шымкент МКТУ им. Х.А. Яссави, г. Туркестан При сернокислотном выщелачивании цинксодержащего огарка образуется 20-45% от исходного концентрата цинкового кека [1]. Цинк и кадмий в кеках содержатся в виде оксидов, сульфидов, сульфатов и ферритов. Для извлечения Zn и Cd из кеков используется метод вельцевания [2], заключающийся в нагреве кека в смеси с коксом в трубчатой вращающейся печи при температуре 1150-12000С. Эффективность восстановления и отгонки Zn и Cd при вельцевании во многом определяется взаимодействием соединений этих металлов с оксидом углерода (II). В литературе имеется достаточная информация об индивидуальном взаимодействии соединений Zn и Cd с СО [3, 4]. Однако отсутствует информация о восстановлении Zn и Cd из системы CdO-ZnS-CO. Исследования проводились по методике, опубликованной в [5]. На первой стадии работы нами по программе HSC-05 компании «Outokumpu Research OU» установлено, что температура оказывает значительное влияние на изменение ΔGт0 (кДж) реакции 3CdO+ZnS+CO=3Cd+Zn+SO2+CO2 следующим образом: Т, К ΔGт0 373 +311,5 673 +241,6 973 +164,1 1273 +87,9 1573 +13,2 1673 -11,4 1773 -35,8 По величине ΔGт0=0 установили, что процесс возможен при температуре ≥1637К. Для определения последовательности взаимодействия в системе CdO-ZnS-CO нами предварительно исследована возможность протекания реакции: CdO+ZnS=ZnО+CdS. (1) Из рисунка 1 следует, что при Т=1200К равновесие последней реакции сдвинуто вправо. Такая ситуация остается до температуры 1400К, затем в системе ZnО-CdS начинается взаимодействие, продуктами которого являются (в зависимости от Т) ZnS, Zn, Cd, SO2, SO, S2 (рисунки 1, 2). Причем температура начала восстановления Cd составляет 1401К, а Zn – 1434К. Так, при Т=1500К взаимодействие между ZnО и CdS происходит по схеме: ZnО+CdS=0,666ZnSк+0,333ZnО+0,03Zn+Cd+0,334SO2. (2) Элементный кадмий в системе (в отсутствии восстановителя) формируется по реакциям: ZnО+CdS=0,666ZnS+0,333CdS+0,666CdО; 0,666CdО+0,334CdS=Cd+0,334SO2. (3) При этой температуре часть цинка переходит в элементное газообразное состояние: 0,65ZnS+0,35ZnО=0,03Zn+0,64ZnS+0,33ZnО. (4) При температуре 1700К взаимодействие между ZnS и ZnО прекращается в виду недостатка ZnО: 0,666ZnSк+0,333ZnО+0,03Zn+Cd+0,334SO2= Cd+0,591Zn+0,494SO2+0,407ZnS+0,04S2+0,01SO. (5) Продолжающееся образование (при Т=1800К) газообразного Zn объясняется разложением ZnS: 0,407ZnS=0,407Zn+0,203S2. (6) В системе 3CdО-ZnS-СО при Т=800К весь цинк из ZnS перешел в ZnО (за счет реакции (1)), а кадмий распределился между участниками реакции следующим образом: Cdк – 32,1%, CdО – 33,53%, CdS – 33,34%. Восстановителем кадмия при Т=800К является СО. Газовая фаза при этом содержит 96,02% СО2, 3,1% Cd и только 0,50% СО (рисунок 2). Общий вид реакции при Т=800К имеет вид: 3CdО+ZnS+СО=Cd+CdО+CdS+ZnО+СО2. (7) При увеличении температуры до 1100К химизм процесса не меняется (только Cd из конденсированного состояния переходит в газообразное). Химия. Химиялық технология 100 ZnOk 100 Cdг 80 CdSk 80 Znг CdSk ZnSk S, Cd, % Zn, Cd, % 60 60 40 60 SО2 40 S2 ZnSk 20 20 SО 0 1100 1300 1500 1700 Т, К 0 1100 1300 1500 1700 Т, К Рисунок 1 - Влияние температуры (Т) на степень распределения () Zn, Cd и S в системе CdО-ZnS при Р=0,1МПа Химия. Химиялық технология 61 2 100 ZnOk 100 Znг 80 60 S, С % 60 40 40 ZnSk ZnSk 20 20 Cdк 0 700 900 0,5 0 700 900 1100 1300 1500 1700 Т, К 60 Cd 40 20 SО2 CdОк 1100 СО 1 80 SО2 CdSk Cdг Zn, Cd, % СО2 80 CdSk 1,5 СО2 Содержание, об.% 100 Zn СО 1300 1500 1700 Т, К 0 700 900 1100 1300 1500 1700 Т, К Рисунок 2 - Влияние температуры (Т) на степень распределения () Zn, Cd, S и С в системе 3CdО-ZnS-СО при Р=0,1МПа 0 700 900 1100 1300 1500 1700 Т, К Рисунок 3 - Влияние температуры (Т) на состав газовой системы 3CdО-ZnS-СО при Р=0,1МПа Химия. Химиялық технология 62 В температурном интервале 1100-1300К между CdО и CdS происходит взаимодействие с образованием газообразного кадмия. Так, для 1300К этот процесс описывается уравнением: Cd+CdО+CdS+СО2+ZnО=2,5Cd+0,5CdS+ZnО+0,5SO2+СО2. (8) При Т=1400К вследствие взаимодействия CdS с ZnО образуются ZnS и CdО, который реагируя с CdS образует элементный Cd: 2,5Cd+0,5CdS+ZnО+0,5SO2+СО2=3Cd+0,67ZnО+0,31ZnS+0,02Zn+ 0,6795SO2+0,0071S2+0,0013SO+0,029СО+0,971СО2. (9) При Т=1500К в системе появляется в заметных количествах Zn. Причиной этому является взаимодействие между ZnО и ZnS (при этом увеличивается переход S в SO2). СО на этом этапе не восстанавливает Zn, т.к. степень перехода углерода в СО не увеличивается. Взаимодействия при 1500К описывается уравнением: 3Cd+0,67ZnО+0,31ZnS+0,02Zn+0,6795SO2+0,0071S2+0,0013SO+0,029СО+0,971СО2= =3Cd+0,6177ZnО+0,2567ZnS+0,1253Zn+0,7198SO2+0,0082S2+ +0,003SO+0,0605СО+0,9395СО2 . (10) При температуре более 1600К, когда исчезает ZnS, образование элементного Zn происходит за счет взаимодействия ZnО с СО (об этом свидетельствует увеличение степени перехода углерода в СО2 и уменьшение в СО – рисунок 3). Проведенные исследования позволили получить следующие результаты: - в системе CdО-ZnS до 1400К наблюдается образование ZnО и CdS (1400К); при Т=14001500К формируется Cd за счет взаимодействия CdО с CdS: 2CdО+CdS=3Cd+SO2; восстановление Zn (Т=1400-1700К) происходит взаимодействием ZnО с ZnS; образование Zn при Т>1700К происходит за счет диссоциации ZnS (>1700К); - в системе 3CdО-ZnS-СО полный переход Zn из ZnS в ZnО с частичным переходом Cd из CdО в CdS с восстановлением 1/3 Cd из CdО оксидом углерода происходит при Т=800-1100К; образование элементного Cd посредством взаимодействия CdО с CdS наблюдается при Т=11001400К; образование элементного Zn за счет взаимодействия ZnО с ZnS наблюдается при Т=15001600К , а восстановление Zn из ZnО оксидом углерода при Т>1600К. Литература 1 Лакерник М.М., Пахомова Г.Н. Металлургия цинка и кадмия. -М.: Металлургия, 1969. - 488 с. 2 Гудима Н.В. Технологические расчеты в металлургии тяжелых цветных металлов.- М.: Металлургия, 1977. - 256 с. 3 Абдеев М.А., Колесников А.В., Ушаков Н.Н. Вельцевание цинксодержащих материалов. -М.: Металлургия, 1985. -120 с. 4 Чижиков Д.М. Кадмий.- М.: АН СССР, 1982. - 227 с. 5 Шевко В.М., Бишимбаев В.К., Абдикулова З.К. Термодинамические и кинетические закономерности восстановления и отгонки кадмия углеродом и углеводородами. -Шымкент: ЮКГУ, 2006. -140 с. Қорытынды «Астра» бағдарламалық кешенін пайдалана отырып термодинамикалық модельдеу әдісі нәтижесінде, 700-1800К температура аралығында және р=0,1МПа-да ZnS-CdO және ZnS-CdO-CO жүйесінен Zn пен Cd бірге тотықтандыру заңдылықтары анықталған. ZnО пен CdS-нің бастапқы күйінен элементті Zn және Cd алынуы олардың оксидтері мен сульфидтерінің өзара әрекеттесуі есебінен ZnS-CdO жүйесіндегі тотықсыздану реті анықталды. ZnS-CdO-CO жүйесінде бастапқыда мырыш ZnS-тен ZnО-ға (800К), сосын қайтадан ZnS-ке (1400К) өтеді; элементті Zn жүйеде ZnО-нің ZnS-пен (1500К) және ZnО-нің СО-мен (1600К жоғары) әрекеттесуі кезінде түзіледі. Summary With the help of the method of the thermodynamic modeling of the program complex “Astra” balance joint recovering Zn and Cd from system CdO-ZnS and CdO-ZnS-CO have been applied. The research has carried on in the ranges of temperatures 700-1800K pressure 0.1MPa. The chain of recovering ZnO and CdS with initial forming element Cd and Zn with the help of interaction oxides with sulfides has been determinate. In the system of CdOZnS-CO initial forming Zn from ZnS to ZnO (800K), then to ZnS (1400K), element Zn forming interaction ZnS with ZnO (1500K) and ZnO with CO (1600K).