d-элементы V группы
реклама
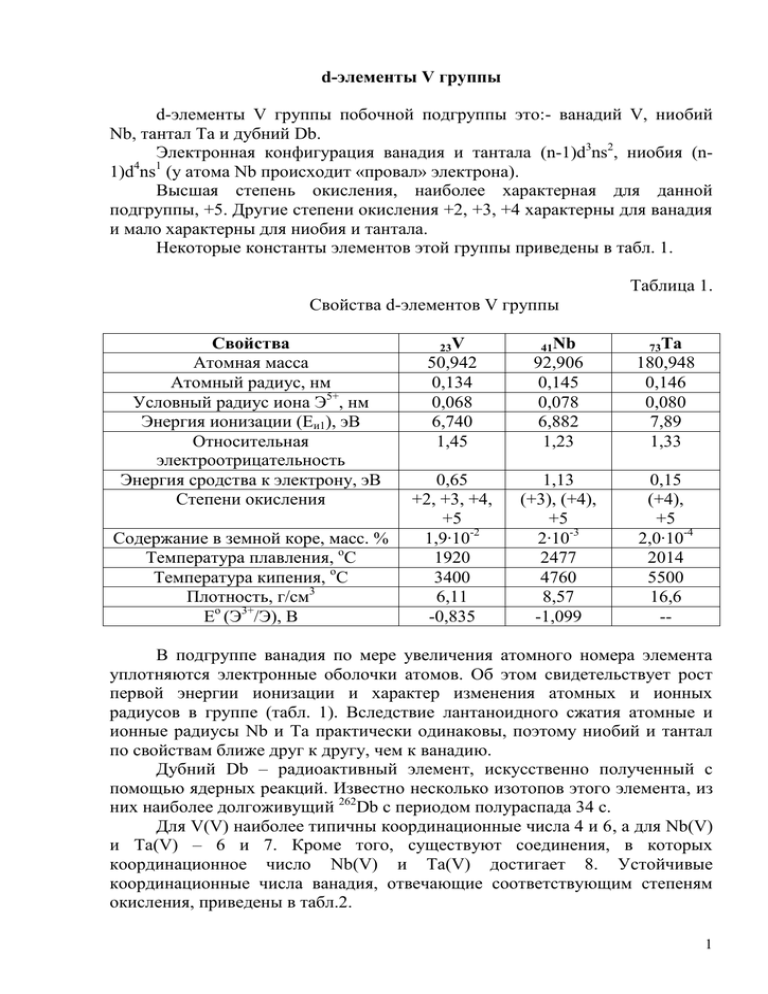
d-элементы V группы d-элементы V группы побочной подгруппы это:- ванадий V, ниобий Nb, тантал Ta и дубний Db. Электронная конфигурация ванадия и тантала (n-1)d3ns2, ниобия (n1)d4ns1 (у атома Nb происходит «провал» электрона). Высшая степень окисления, наиболее характерная для данной подгруппы, +5. Другие степени окисления +2, +3, +4 характерны для ванадия и мало характерны для ниобия и тантала. Некоторые константы элементов этой группы приведены в табл. 1. Таблица 1. Свойства d-элементов V группы Свойства Атомная масса Атомный радиус, нм Условный радиус иона Э5+, нм Энергия ионизации (Еи1), эВ Относительная электроотрицательность Энергия сродства к электрону, эВ Степени окисления Содержание в земной коре, масс. % Температура плавления, оС Температура кипения, оС Плотность, г/см3 Ео (Э3+/Э), В 23V 41Nb 73Ta 50,942 0,134 0,068 6,740 1,45 92,906 0,145 0,078 6,882 1,23 180,948 0,146 0,080 7,89 1,33 0,65 +2, +3, +4, +5 1,9∙10-2 1920 3400 6,11 -0,835 1,13 (+3), (+4), +5 2∙10-3 2477 4760 8,57 -1,099 0,15 (+4), +5 2,0∙10-4 2014 5500 16,6 -- В подгруппе ванадия по мере увеличения атомного номера элемента уплотняются электронные оболочки атомов. Об этом свидетельствует рост первой энергии ионизации и характер изменения атомных и ионных радиусов в группе (табл. 1). Вследствие лантаноидного сжатия атомные и ионные радиусы Nb и Ta практически одинаковы, поэтому ниобий и тантал по свойствам ближе друг к другу, чем к ванадию. Дубний Db – радиоактивный элемент, искусственно полученный с помощью ядерных реакций. Известно несколько изотопов этого элемента, из них наиболее долгоживущий 262Db с периодом полураспада 34 с. Для V(V) наиболее типичны координационные числа 4 и 6, а для Nb(V) и Ta(V) – 6 и 7. Кроме того, существуют соединения, в которых координационное число Nb(V) и Ta(V) достигает 8. Устойчивые координационные числа ванадия, отвечающие соответствующим степеням окисления, приведены в табл.2. 1 Таблица 2. Степени окисления ванадия и структурные единицы его соединений Степень окисления +2 +3 +4 +5 Координационное число 6 4 6 4 6 4 Структурная единица Октаэдр Тэтраэдр Октаэдр Тэтраэдр Октаэдр Тэтраэдр Тригональная бипирамида Примеры соединений [V(OH2)6]2+, VO [VCl4][V(OH2)6]3+, [VF6]3-, V2O3 VCl4 VO2, [VO(OH2)5]2+ VO43-, VOCl3 VF5 Ванадий достаточно широко распространен в природе, но является рассеянным элементом, так как практически не имеет своих минералов. Он содержится обычно в рудах железа [(Fe,V)3O4] и высокосернистой нефти. Наиболее важные минералы – патронит VS2-2,5, сульванит Cu3VS4, алаит V2O3∙H2O, ванадинит Pb5(VO4)3Cl. Ниобий и тантал почти всегда встречаются совместно, чаще всего в составе ниобат-танталатовых минералов типа МЭ2О6 (М = Fe, Mn). В случае преобладания ниобия минерал называется колумбитом Fe(NbO3)2, при преобладании тантала - танталитом Fe(TaO3)2. Для получения металлов подгруппы ванадия их природные соединения сначала переводят в оксиды либо в простые или комплексные галогениды, которые далее восстанавливают металлотермическим методом. Для технических целей обычно выплавляют феррованадий, феррониобий и ферротантал. Ванадий добывают обычно переработкой шлаков черной и цветной металлургии. При совместном восстановлении оксидов железа и ванадия получают сплав железа с ванадием – феррованадий, содержащий около 30% ванадия. Чистый ванадий получают металлотермическим способом. Особо чистый ванадий получают разложением паров иодида VI3 на вольфрамовой проволоке, нагретой электрическим током в вакууме. Ниобий и тантал получают электролизом оксидов Э2О5 в расплавленных комплексных фторидах. При извлечении ниобия и тантала из рудных концентратов основной трудностью является их разделение из-за сходства химических свойств. Данные металлы восстанавливают металлическим натрием из комплексных фторониабатов и фторотанталатов (K2[NbF7], K2[TaF7]). Получаемые в порошкообразном состоянии металлы подвергают спеканию в вакууме или среде благородных газов для получения компактных металлов. Ванадий, ниобий, тантал – светло-серые блестящие металлы, имеющие кубическую объемно-центрированную кристаллическую решетку. Металлы 2 Стандартные условия данной подгруппы хорошо поддаются механической обработке, тугоплавки. Физические характеристики существенно зависят от чистоты металлов. Так примеси (особенно О, Н, N и С) резко снижают пластичность и повышают твердость. В стандартных условиях в компактном состоянии ванадий и особенно ниобий и тантал отличаются высокой химической стойкостью. Химическая активность этих металлов проявляется только при высоких температурах, когда разрушается защитная плёнка, делающая их пассивными при обычных условиях. Особенно прочная пленка образуется на поверхности тантала, который по химической стойкости не уступает платине. Химическая активность элементов иллюстрируется таблицей 3. Таблица 3. Продукты взаимодействия d-элементов V группы Реагенты V с конц. HF VF3 с царской водкой VCl4 со смесью HNO3 и HF H2[VF7] с конц. H2SO4, HNO3, Соединение с HClO3, HClO4 VO2+ с кислородом с водой в порошк. сост. с галогенами с серой Нагревание c азотом c углеродом c кремнием c бором с водородом с газообразным HCl с конц. H2SO4 с расплавленными щелочами в прис. О2 с расплавленными карбонатами, нитратами щелочных металлов V2O5 х VF5,VCl4, VBr3, VI3 V2S3 (изв.VS5, VS4) VN, V2N V5C, V2C, V4C3, VC V2Si, VSi2 VB, VB2, V3B4 ~VH VCl2 VOSO4∙H2SO4 или VOSO4 ванадаты ванадаты Nb х -H2[NbF7] -- Ta х -H2[TaF7] -- Nb2O5 х NbX5 (X=F-,Cl-,Br-) х Ta2O5 х TaX5 (X=F-,Cl-,Br-) х Nb2N, Nb4N3, NbN Nb2C, NbC Ta2N, TaN, Ta3N5 Ta2C, TaC NbSi2 NbB, NbB2, Nb3B4 ~NbH TaSi2 TaB, TaB2, Ta3B4 ~TaH -- -- ниобаты танталаты -- -- 3 Ванадий, ниобий и тантал между собой и металлами, близко расположенными к ним в периодической системе элементов (подгруппы железа, титана, хрома), образуют металлические твердые растворы. По мере увеличения различий в электронном строении взаимодействующих металлов возможность образования твердых растворов уменьшается, а интерметаллических соединений возрастает. В противоположность твердым растворам интерметаллиды имеют кристаллическую структуру, отличную от структур исходных металлов. Порошкообразные V, Nb, Ta, подобно большинству d-металлов, поглощают большие количества водорода, кислород и азот. При этом неметаллы переходят в атомное состояние и участвуют в образовании химических связей в кристалле. Гидриды ЭН – хрупкие металлоподобные порошки серого или черного цвета, имеют переменный состав. Они химически устойчивы к воде и разбавленным кислотам. Большинство бинарных соединений d-элементов представляют собой фазы внедрения. Состав их непостоянен и зависит от способа получения. Нитриды, карбиды, бориды и ряд других соединений d-элементов V группы с малоактивными неметаллами обладают высокой химической стойкостью. Оксиды – при их образовании идет постепенное окисление металла через ряд стадий, так как один и тот же металл может образовывать несколько оксидов различного состава. Физико-химические свойства таких оксидов могут изменяться в широких пределах, потому что по мере увеличения содержания кислорода уменьшается доля металлической и увеличивается доля ковалентной связи. Соединения со степенью окисления +2 d-элементов V группы малоустойчивы и более характерны для ванадия (к.ч. = 6). Оксид ванадия(II) VO серого цвета с металлическим блеском обладает значительной электропроводностью. Он имеет кристаллическую решетку типа NaCl. Получают VO восстановлением V2O5 в токе водорода. С водой не взаимодействует. Легко растворяется в разбавленных кислотах, проявляя основные свойства. Соединения ванадия(II) – сильные восстановители. Фиолетовые растворы [V(OH2)6]2+ легко окисляются даже на воздухе до [V(OH2)6]3+ зеленого цвета. В отсутствие окислителей растворы соединений ванадия(II) постепенно разлагают воду с выделением водорода. Производные Nb(II) и Ta(II) относятся к соединениям кластерного типа, то есть проявляется связь металл – металл. Соединения со степенью окисления +3 так же более характерны для ванадия (к.ч. = 6), чем для других представителей данной группы. Оксид ванадия(III) V2O3 черного цвета с кристаллической решеткой типа корунда α- Al2O3. Соответствующий гидроксид V(OH)3 зеленого цвета (переменного состава V2O3∙nH2O) получают осаждением из растворов соединений ванадия(III). V2O3 и V(OH)3 слабо амфотерны с преобладанием основных свойств, растворяются в кислотах. 4 Галогениды ванадия(III) – кристаллические вещества. С основными галогенидами образуют галогенованадаты ([VHal6]3- [V2Cl9]3-): 3KF + VF3 = K3[VF6]; 3KCl + 2VCl3 = K3[V2Cl9]. Галогениды ванадия(III) при нагревании разлагаются по реакции диспропорционирования: 2VСl3 (к) = VСl2 (к) + VСl4 (г). Для техники важны желто-бронзовый нитрид VN (tпл = 2050 С), устойчивый к воде и кислотам, а также обладающий высокой твердостью карбид VC (tпл = 2800 С). Производные ванадия(III) – сильные восстановители. В растворе они легко окисляются кислородом воздуха до соединений ванадия(IV). Производные Nb(III) и Ta(III) относятся к соединениям кластерного типа. Соединения со степенью окисления +4 при обычных условиях самые устойчивые для ванадия (к.ч. = 6, а так же 4 и 5). Соединения V(III) легко окисляются, переходя в V(IV), а соединения V(V) восстанавливаются до производных V(IV). Оксид ванадия(IV) VO2 синего цвета имеет кристаллическую решетку типа рутила TiO2. Получают осторожным восстановлением V2O5 водородом. В воде VO2 нерастворим. Относительно легко он взаимодействует при нагревании со щелочами с образованием оксованадатов бурого цвета состава М2[V4О9]. Еще легче VO2 растворяется в кислотах, проявляя тем самым амфотерные свойства. В результате образуются аквакомплексы ванадила светло-синего цвета: VO2 + 2Н+ + 4Н2О = [VO(OH2)5]2+. Из галогенидов ванадия(IV) известны коричневый VF4 и красно-бурый VCl4, а так же оксогалогениды типа VOHal2. Тетрахлорид ванадия получают при окислении ванадия (или феррованадия) хлором. Он имеет, как и TiCl4, тетраэдрическое строение. Тетрагалогениды ванадия легко гидролизуются: VCl4 + H2O = VOCl2 + 2HCl. Для ниобия и тантала известны диоксиды ЭО2 и тетрагалогениды ЭHal4. В этих соединениях тоже проявляется связь металл-металл, т.е. они относятся к кластерам. В ряду V(V) - Nb(V) - Ta(V) устойчивость соединений возрастает. Для ванадия(V) известны лишь оксид V2O5 и фторид, тогда как для ниобия(V) и тантала(V) известны и все другие галогениды ЭHal5. Для Э(V) характерны и оксогалогениды типа ЭОHal3. 5 Соединение ЭF5 ЭОF3 Э2O5 Анионный комплекс [ЭF6]- [ЭОF5]2- [ЭО4]3-, [ЭО3]- Для V(V) характерное к.ч. = 4, 6, а для Nb(V) и Ta(V) – 6, 7 (иногда 8). Оксиды – тугоплавкие кристаллические вещества (V2O5 – красный, Nb2O5 и Ta2O5 – белые), проявляющие кислотные свойства. Оксид ванадия(V) получают термическим разложением ванадата аммония. V2O5 плохо растворим в воде (образует кислый раствор светложелтого цвета). Легко взаимодействует со щелочами, с кислотами – лишь при длительном нагревании. Оксиды Nb2O5 и Ta2O5 химически неактивны (в воде и кислотах практически не растворяются), со щелочами реагируют лишь при сплавлении. Оксованадаты(V), оксониобаты(V) и оксотанталаты(V) – кристаллические вещества сложного состава и строения, большинство из которых полимерные соединения. В воде растворимы лишь производные s1 1 элементов I группы и NH4+ типа Ì ЭО3 и Ì 3ЭО4. Пентагалогениды ванадия, ниобия, тантала легкоплавки, летучи, растворяются в органических растворителях, химически активны. В воде легко гидролизуются, образуя аморфные осадки гидратированных оксидов Э2O5∙n Н2О: 2ЭНаl5 + 5Н2О = Э2O5 + 10НHal. Галогениды Э(V), являясь кислотными соединениями, реагируют с основными галогенидами с образованием анионных комплексов: KF + VF5 = K[VF6]; 2KF + TaF5 = K2[TaF7]. Подобным образом ведут себя и оксогалогениды: - в воде легко гидролизуясь с образованием гидратированных оксидов Э2O5∙nН2О 2ЭОНаl3 + 3Н2О = Э2O5 + 6НHal; - взаимодействуя с основными галогенидами 2KF + VОF3 = K2[VОF5]. Оксиды Nb2O5 и Ta2O5 взаимодействуют с водными растворами KF и НF: Nb 2О5 + 4KF + 6НF = 2K2[NbОF5] + 3Н2О; Ta2О5 + 4KF + 10НF = 2K2[TaF7] + 5Н2О. Соединения ванадия(V) в кислой среде проявляют окислительные свойства, например, окисляют концентрированную соляную кислоту: V2O5 + 6HСl = 2VOCl2 + Cl2 + 3Н2О. 6 Для перевода ниобия(V) и в особенности тантала(V) в более низкие степени окисления требуются энергичные восстановители и нагревание. Основные кислородсодержащие соединения d-элементов V группы приведены в таблице 4. Таблица 4. Кислородосодержащие соединения элементов подгруппы ванадия Э С.о. Оксиды +2 Формула VO Основной +3 V2O3 Основной +4 VO2 +5 V2O5 Амфотерный Кислотный Nb +5 Nb2O5 Кислотный Ta +5 Ta2O5 Кислотный V Характер Гидроксиды Формула Название Соли Формула иона V2+ Гидроксид ванадия(II) V2O3∙nH2O Гидроксид V3+ ванадия(III) VO2∙nH2O Гидроксид VO2+ ванадия(IV) HVO3 Ванадиевая VO3кислота HNbO3 Ниобиевая NbO3кислота HTaO3 Танталовая TaO3кислота V(OH)2 Название Соли ванадия(II) Соли ванадия(III) Соли ванадила Ванадаты Ниобаты Танталаты 7



