Оксиды неметаллов
реклама

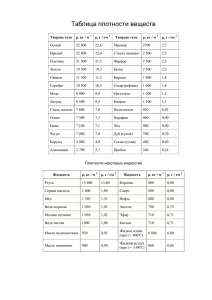
Оксиды неметаллов В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные — СO2, СО, N2O, NO, NO2, Сl2O, СIO2 и др.; жидкие (летучие) SO3, N2O3, Сl2O6, Сl2O7; твердые (летучие) - Р2O5, N2O5, SeO2; твердый, очень тугоплавкий нелетучий оксид SiO2 — вещество с атомной кристаллической решеткой. Оксиды неметаллов, как вы знаете, делят на два подкласса: несолеобразующие и солеобразующие. К несолсобразующим оксидам относят 8Ю, 1М20, N0, СО. Все остальные оксиды неметаллов являются солеобразующими, кислотными. Оксиды серы. Сера образует два оксида — SO2 и SO3. Оба оксида являются кислотными, т.е. взаимодействуют со щелочами, основными оксидами и водой. (Напишите уравнения соответствующих реакций.) При горении серы, полном сгорании сероводорода и обжиге сульфидов образуется оксид серы(IV), который часто называют сернистым газом. (Напишите уравнения соответствующих реакций.) Он хорошо растворяется в воде, образуя слабую сернистую кислоту. Она неустойчива и разлагается на исходные вещества: Н2O + SO2 ⇄ Н2SO3 При взаимодействии со щелочами сернистый газ образует два ряда солей — средние, или сульфиты, и кислые — гидросульфиты. (Почему!) Гидросульфит натрия NaHSO3 и сульфит натрия Na2SO3, как и сам сернистый газ, используют для отбеливания шерсти, шелка, бумаги и соломы, а также в качестве консервирующих средств для сохранения свежих плодов и фруктов. Оксиды азота. Азот образует немало оксидов, из которых наиболее известны оксиды со всем спектром степеней окисления азота от +1 до +5: N2O, NO, N2O3, NO2 (или N2O4) и N2O5. Оксиды азота(I), (II) N2O и NO — несолеобразующие оксиды; остальные — солеобразующие кислотные оксиды. Оксид азота(II) NO токсичен. Представляет собой бесцветный газ, без запаха, почти не растворим в воде. Оксид азота(II) легко окисляется кислородом воздуха в оксид азота(IV): 2NO + O2 = 2NO2 Оксид азота(IV) NO2 —- весьма токсичный бурый газ. Если растворять NO2 в воде в присутствии кислорода, то образуется азотная кислота: 4NO2 + O2 + 2Н2O = 4НNO3 Аналогично оксид NO2 реагирует с растворами щелочей: 4NO2 + 2Са(ОН)2 = Са(NO3)2 + Са(NO2)2 + 2Н2O Оксид азота( V) N2O5 — бесцветные кристаллы при температуре ниже 33,3 °С. Это типичный кислотный оксид, которому соответствует азотная кислота. Взаимодействует с водой, щелочами, оксидами металлов. (Напишите уравнения соответствующих реакций.) Оксид фосфора(V). Оксид фосфора(V), или фосфорный ангидрид, образуется при горении фосфора в виде густого белого дыма, состоящего из мелких белых кристалликов: 4Р + 5O2 = 2Р2O5 Это типичный кислотный оксид, который взаимодействует с водой, образуя фосфорную кислоту, а также с основными оксидами и щелочами с образованием различных солей: средних, или фосфатов, и кислых — гидрофосфатов и дигидрофосфатов: Р2O5 + 6NaOН = 2Na3РO4 + 3Н2O Р2O5 + 4NаОН = 2Na2НРO4 + Н2O Р2O5 + 2NaОН + Н2O = 2NaН2РO4 Оксиды углерода. Углерод образует два оксида: оксид угле-рода(II) СО и оксид углерода(IV) С02. Оксид углерода(II) имеет ряд синонимов: угарный газ, окись углерода, монооксид углерода. Это газ без цвета, запаха и вкуса; плохо растворим в воде. Как следует из тривиального названия, угарный газ очень ядовит, так как соединяется с гемоглобином крови и лишает его способности переносить кислород. Первая помощь при угаре — это свежий воздух. Оксид углерода(II) является сильным восстановителем, поэтому горит: 2СО + O2 = 2СO2 Он также восстанавливает металлы из их оксидов и потому применяется в пирометаллургии. Основой доменного процесса являются реакции, суммарное уравнение которых имеет вид: Fе2O3 + 3СО = 2Fе + 3СO2 Оксид углерода(IV) имеет много синонимических названий: углекислый газ, угольный ангидрид, диоксид углерода и даже химически неверное название «углекислота». В промышленности СO2 получают обжигом известняка, горением кокса или углеводородного сырья. В лаборатории углекислый газ получают действием соляной кислоты на мрамор (рис. 7.5): СаСО3 + 2НСl = СаСl2 + Н2O + СO2↑ Рис. 7.5. Получение углекислого газа в лабораторных условиях Молекула углекислого газа образована двумя двойными полярными ковалентными связями: О=С=О Из-за линейного строения несмотря на полярность связей молекула в целом неполярная, поэтому углекислый газ малорастворим в воде (0,88 объема СO2 в 1 объеме воды при температуре 20 °С). При охлаждении под давлением углекислый газ превращается в сухой лед — твердую снегообразную массу, которую в промышленности прессуют и используют для охлаждения продуктов, прежде всего мороженою. Углекислый газ при обычных условиях не имеет цвета, запаха и примерно в 1,5 раза тяжелее воздуха. По свойствам это типичный кислотный оксид, поэтому взаимодействует со щелочами, основными оксидами и водой: СO2 + ВаО = ВаСO3 СO2 + Са(ОН)2 = СаСO3 + Н2O Последняя реакция является качественной реакцией на углекислый газ, так как сопровождается помутнением известковой воды (цв. вклейка, рис. 27), которое, однако, исчезает при дальнейшем пропускании углекислого газа из-за превращения нерастворимого карбоната кальция в растворимый гидрокарбонат: СаС03 + С02 + Н20 = Са(НСО,)2 Рис. 27. Качественная реакция на углекислый газ: а – до пропускания; б – после пропускания CO2 Углекислый газ применяют в производстве сахара (для очистки сока свеклы), соды, мочевины, для приготовления газированных напитков, при тушении пожаров (рис. 7.6), в газовых лазерах. Твердый СО, — хладагент. Рис. 7.6. Для тушения пожаров используют углекислотный огнетушитель Оксид кремния(IV). Многие минералы образованы оксидом кремния(IV) SiO2. К ним относятся горный хрусталь, кварц, кремнезем. Оксид кремния(IV) составляет основу таких полудрагоценных камней, как агат, аметист, яшма (цв. вклейка, рис. 28). Рис.28. Кристаллы кварца (а) и поперечный разрез агата (б) Диоксид кремния — твердое кристаллическое вещество полимерного строения, в котором каждый атом кремния связан с четырьмя атомами кислорода прочными связями: Это типичный кислотный оксид, который в воде не растворяется. Его гидроксиды — кремниевые кислоты — получают косвенными методами. Диоксид SiO2 взаимодействует со щелочами, образуя силикаты: SiO2 + 2КОН = К2 SiO 3 + Н2O Диоксид кремния сплавляют образованием силикатов: с основными оксидами также с SiO 2 + СаО = Са SiO3 С кислотами (за исключением плавиковой кислоты) диоксид кремния не взаимодействует. Монокристаллы диоксида кремния применяют в генераторах ультразвука, звуковоспроизводящей аппаратуре и т.п. Такие кристаллы выращивают в гидротермальных условиях из расплавов SiO 2. Природный SiO 2 — сырье в производстве кремния, кварцевого стекла, компонент керамики, обычного стекла и цемента. Из расплавленного кварца изготавливают различную кварцевую химическую посуду, которая выдерживает высокую температуру и не трескается при резком охлаждении. Вопросы 1. Какие типы оксидов образуют неметаллы? Какое агрегатное состояние для них характерно? 2. Какие типы кристаллических решеток характерны для твердых оксидов неметаллов? Какие из оксидов имеют полимерное строение? 3. Напишите формулы оксидов серы, а также уравнения реакций, характеризующие их свойства. 4. Напишите формулы оксидов азота, а также уравнения реакций, характеризующие их свойства. 5. Напишите формулы оксидов углерода, а также уравнения реакций, характеризующие их свойства. 6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) FеS2 ⟶ SO, ⟶ Na2SO3 ⟶ SO2 ⟶ SO3 ⟶ Н2SO4 ⟶ Na2SO4 ⟶ ВаSO4 б) N2 ⟶ NH3 ⟶ NO ⟶ NO2 ⟶ НNО3 ⟶ Сu(NO3)3 ⟶ NO2 в) СаСO3 ⟶ СО2 ⟶ СаСO3 ⟶ Са(НСO3)2 ⟶ СаСО3 ⟶ СO2 г) SiO2 ⟶ Si ⟶ Мg2Si ⟶ SiH4 ⟶ SiO2 ⟶ Мg2SiO3 Рассмотрите процессы в свете теории электролитической диссоциации и окисления— восстановления. 7. Сравните строение и свойства оксидов углерода(IV) и кремния(IV).