2Л3. Химия элементов II-а группы. Be Mg Ca Sr Ba Ra № пп 4 12
реклама
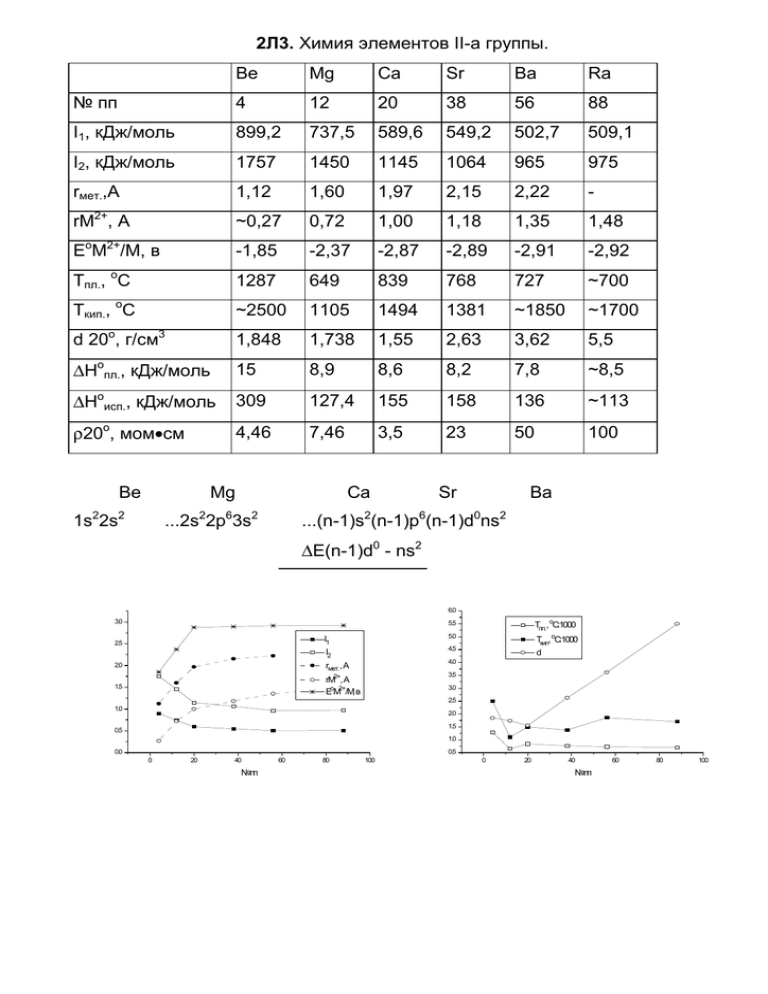
2Л3. Химия элементов II-а группы. Be Mg Ca Sr Ba Ra № пп 4 12 20 38 56 88 I1, кДж/моль 899,2 737,5 589,6 549,2 502,7 509,1 I2, кДж/моль 1757 1450 1145 1064 965 975 rмет.,А 1,12 1,60 1,97 2,15 2,22 - rM2+, A ~0,27 0,72 1,00 1,18 1,35 1,48 EoM2+/M, в -1,85 -2,37 -2,87 -2,89 -2,91 -2,92 Тпл., оС 1287 649 839 768 727 ~700 Ткип., оС ~2500 1105 1494 1381 ~1850 ~1700 d 20o, г/см3 1,848 1,738 1,55 2,63 3,62 5,5 ∆Hoпл., кДж/моль 15 8,9 8,6 8,2 7,8 ~8,5 ∆Hoисп., кДж/моль 309 127,4 155 158 136 ~113 ρ20о, мом•см 4,46 7,46 3,5 23 50 100 Be Mg 1s22s2 Ca ...2s22p63s2 Sr Ba ...(n-1)s2(n-1)p6(n-1)d0ns2 ∆E(n-1)d0 - ns2 6.0 3.0 I1 2.5 rмет., А 1.5 rM2+, A EoM2+/M, в Tпл., оС:1000 5.0 Ткип, оС:1000 4.5 I2 2.0 5.5 d 4.0 3.5 3.0 2.5 1.0 2.0 1.5 0.5 1.0 0.0 0.5 0 20 40 №пп 60 80 100 0 20 40 №пп 60 80 100 Š, %q Š, %q f 1400 - f 1000 I n0j II cor 1000 - 600 - I 20 Š, %q I n0j 800 - 1200 - I 40 I 60 p, *K=! II c0j I 80 I 20 I 40 Be Š, %q f 1000 - 600- 800 - 400 I n0j 600 I 20 I 40 I 60 p, *K=! I 60 p, *K=! I 80 Ca f I n0j II cor 200 I 80 I 20 Sr I 40 I 60 p, *K=! I 80 Ba Окисды. BeO MgO CaO SrO BaO тип решетки ZnS (вюрцит) NaCl NaCl NaCl NaCl Тпл., оС 2530±50 2826±30 2613±30 2430±25 1923±25 2M + O2 → 2MO 2BaO + O2 ⇔ 2BaO2 Галогениды (тип решетки). Be Mg Ca Sr Ba F SiO2 кварц TiO2 рутил CaF2 CaF2 CaF2 Cl SiO2 кеатит CdCl2 TiO2 вюрцит TiO2 вюрцит PbCl2 Br SiO2 кеатит CdI2 TiO2 вюрцит PbCl2 PbCl2 I - CdI2 CdI2 SrI2 PbI2 В газовой фазе: Cl 1,77 Be 180o Cl Cl Be Be Cl Ba Cl Cl (sp) (sp2) c 90o c (sd) BeF2 ⇔ SiO2 270о - кварц кристобалит 227о - α ⇔ β тридимит Стеклообразные фазы. [Be(H2O)4]2+ + H2O ⇔ [Be(OH)(H2O)3]+ + H3O+ [Be(H2O)4]2+ ⇔ Be(OH)2↓ ⇔ [Be(OH)4]2Растворимость гидроксидов (г/л 20о). M(OH)2 Be Mg Ca Sr Ba растворимость 3•10-4 3•10-2 1,3 8 38 Be - к.ч. (2, 3) 4 Be4O(RCOO)6 Be O R C O Be Be Be Be4O(NO3)6 BeCl2 + 2N2O4 → Be(NO3)2 + 2NOCl 4Be(NO3)2 → Be4O(NO3)6 + 2NO2 + 1/2O2 Be O O C R C O O O R Be Be O O BeO O O C C O C R R R O Li,Na,K,Rb,Cs Ca,Sr,Ba Hg,Pb 5.0 CH2 CH2 O CH2 CH2 CH 4.5 4.0 3.5 lg K 3.0 CH2 CH2 O O M CH2 CH CH2 CH2 CH O CH2 CH2 O O CH2 CH2 CH 2 CH2 2.5 2.0 1.5 1.0 CH2 0.5 0.0 0.6 0.8 1.0 1.2 1.4 1.6 1.8 дициклогексил-18-краун-6 2.0 r ион. Энтальпии образования (-∆Hof, кДж/моль) (энергии кристаллических решеток Е, кДж/моль). Металл MF2 MH2 MCl2 MBr2 MI2 MO M2N3 Mg 1123,4 75,3 641,3 524,3 364,0 601,7 460,7 (2402) (2317) (3921) 682,8 533,5 635,1 (2066) (3515) 558,1 592,0 (2922) Ca 1219,6 186,2 (2597) Sr (2226) 1216,3 180,3 (2458) Ba 795,8 828,9 717,6 (2125) 1207,1 178,7 858,6 (2366) 431 391,2 (3310) 757,3 602,1 553,5 (1951) (1841) (3118) MCO3 = MO + CO2 M Mg Ca Sr Ba ∆Go298, кДж/моль 48,3 130,4 183,8 218,1 Тразл., оС 400 900 1280 1360 M(OH)2 = MO + H2O M Mg Ca Sr Ba ∆Ho298, кДж/моль 81,0 109,2 125,2 149,4 Тразл., оС 300 390 466 700 363,2 Литература. 1. Н.С.Ахметов, “Общая и неорганическая химия”, М., “Высшая школа”, 1988, стр.447-460. 2. Ф.Коттон, Дж.Уилкинсон, “Современная неорганическая химия”, М., “Мир”, 1969, ч.2, стр.67-77, 271-280. 3. Б.В.Некрасов, “Основы общей химии”, М., “Хиимиия”, 1974, т.2, стр.159181. 4. В.И.Спицын, Л.И.Мартыненко, “Неорганическая химия”, М., МГУ, 1994, ч.2, стр.26-53. Дополнительная литература. 1. Д.Джжонсон, “Термодинамические аспекты неорганической химии”, М., “Мир”, 1985, стр.86-105. 2Л4. Жесткие и мягкие кислоты и основания ( C.И.Горельский, 1991). Электроотрицательность (Pauling). “Сила, удерживающая электроны и атомы в молекуле”. A - A (E1) B -B (E2) A -B (E3) ∆ (значения приведены в ккал/моль). 23,06 ∆ = E3-(E1+E2)/2; χA -χB = Точка отсчета -χF=4,0 Шкала относительная, размерность:√эв Энергия ионного резонанса Aδ+ - Bδ- ⇔ Ao -Bo ⇔ Aδ- - Bδ+ χA<χB χA>χB пропорциональна квадрату разности электроотрицательности. Потенциал ионизации - энергия, необходимая для удаления электрона (в ∞) от частицы (атома, молекулы, иона). Сродство к электрону - энергия, выделяющаяся при присоединении электрона (из ∞) к частице . IP(A) = EA(A+) , IP(A-) = EA-(A) Размерность этих величин: ЭВ. Энергия иона E= ∞ å anqn. При малых q E ~ a1q + a2q2 n= 1 q=1 E = a1+a2 = IP1 q=-1 E = -a1+a2 = -EA. Решая систему, получим: a1 = (IP1 + EA)/2 a2 = (IP1 -EA)/2 ∂E ∞ Электроотрицательность χ= = å a qn-1= a1+2a2q2 + 3a3q3 + ... ∂q n=1 n При q=0 χ=a1 - электроотриццательность атома. При малых q χ~a1+2a2q, т.е. 2a2 - “скорость” изменения электроотрицательности, η ≡ 1/2 -q ∂χ ≈a2 - параметр, названный жесткостью. ∂q +q . A B Принцип Малликена: в молекуле, находящейся в соновном невозбужденном состоянии, электроотрицательонсти ионов равны. M+ IP, (эв) EA, (эв) χ (эв) η (эв) -∆G гидратации, lgKу [1] lgKу [2] кДж/моль Be2+ 153,983 18,211 86,052 86,052 2487 4,92 Mg2+ 80,143 15,035 47,589 32,554 1922 1,32 2,58 Ca2+ 50,908 11,871 31,389 19,518 1592 0,58 2,58 Sr2+ 43,6 11,030 27,315 16,285 1445 0,1 0,8 Ba2+ 37 10,004 23,502 13,498 1304 -0,3 0,6 Ra2+ 34 10,147 22,073 11,926 1259 [1] M2+ + F- ⇔ MF+ K= [MF+]/[M2+][F-] [2] M2+ + OH- ⇔ MOH+ K=[MOH+]/[M2+][OH-] Литература. 1. R.G.Pearson Inorg. Chem. 1998, 27, p.734-740. 2. R.G.Pearson Survey of Progress in Chtmistry, 1969, v.5. 3. R.G.Pearson “Hard and saft acids and bases”, 4. А.Д.Гарновский, А.П.Садименко, О.А.Осипов, Г.В.Цинцадзе “Жесткомягкие взаимодействия в вкоординацционной химии”, изд-во Ростовского университета, 1986. 5. “Реакционная способность и пути реакций” (под ред. Г.Клопмана), М.,”Мир”, 1977.





