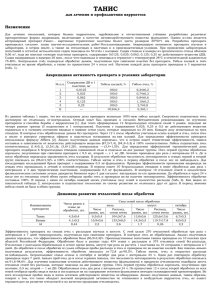
ВПетеринарная атология - Ветеринарная патология
реклама

ISSN 1682-5616 № 3 (26) 2008 Международный научно-практический журнал по фундаментальным и прикладным вопросам ветеринарии етеринарная атология ВП Фундаментальные исследования в ветеринарии Фармакология етеринарная атология ВП № 3 (26) 2008 Международный научно-практический журнал по фундаментальным и прикладным вопросам ветеринарии Главный редактор Гойденко С.К. Редакционный совет: Редакция: Поздняков А.В. — научный редактор Лебзак А.А. — редактор Лебзак А.В. — компьютерный дизайн Макаров В.В. — председатель совета, доктор биологических наук, профессор, действительный член РАЕН и РАМТН, заслуженный деятель науки РФ, заведующий кафедрой ветеринарной патологии Российского университета дружбы народов Дьяконов Л.П., доктор биологических наук, профессор, академик РАЕ, действительный член Нью-Йоркской академии наук, заслуженный деятель науки РФ, заведующий лабораторией ВИЭВ Гулюкин М.И., академик РАСХН, доктор ветеринарных наук, профессор, директор ВИЭВ Жаров А.В., профессор, доктор ветеринарных наук, президент Всероссийской ассоциации патологоанатомов ветеринарной медицины, заслуженный деятель науки Российской Федерации Атамась В.А., доктор ветеринарных наук, профессор, заведующий кафедрой эпизоотологии и паразитологии Одесского государственного аграрного университета Бучацкий Л.П., доктор биологических наук, профессор, иностранный член РАЕН, заведующий лабораторией Киевского государственного университета Бондаренко В.М., доктор медицинских наук, профессор, действительный член (академик) РАЕН и РАМТН, заведующий лабораторией НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Сочнев В.В., доктор ветеринарных наук, профессор, член-корреспондент РАСХН, заведующий кафедрой эпизоотолгии и инфекционных болезней Нижегородской ГСХА Стекольников А.А., доктор ветеринарных наук, профессор, ректор Санкт-Петербургской государственной академии ветеринарной медицины Ятусевич А.И., доктор ветеринарных наук, заслуженный деятель науки Республики Беларусь Алиев А.А., доктор ветеринарных наук, заместитель начальника управления ветеринарии г. Санкт-Петербурга Журнал зарегистрирован в Министерстве Российской Федерации по делам печати, телерадиовещания и средств массовых коммуникаций. Свидетельство о регистрации средства массовой информации ПИ № 77-11332 от 10 декабря 2001 г. Выходит ежеквартально Распространяется в Российской Федерации, странах СНГ и Балтии Учредитель и издатель ООО «Ветеринарный консультант» Индекс в каталоге агентства «Роспечать» «Газеты. Журналы.» — 81265 Адрес редакции: 109428, г. Москва, Рязанский проспект, д. 24, корп. 1 ГНУ ВИЭВ (ООО «Ветеринарный консультант). Тел.: (495) 970-03-69, (903) 133–31–25 (906) 788-75-12 E-mail: [email protected] Журнал входит в Перечень ведущих рецензируемых научных журналов и изданий, выпускаемых в Российской Федерации, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученой степени доктора наук. При перепечатке ссылка на журнал «Ветеринарная патология» обязательна. © «Ветеринарная патология» СОДЕРЖАНИЕ ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ О.Ф. Гробов, А.Н. Сотников, Д.А. Штондина Взаимоотношения Varroa destructor с различными организмами ........................................... 7 Н.И. Антонов, В.В. Краснов, К.П. Кирсанов Аппарат для лечения собак при переломах костей таза.......................................................... 21 В.А. Бабушкин, С.М. Сулейманов, П.А. Паршин Структурная организация мышечной ткани у молодняка свиней при разных вариантах скрещивания ............................................................................................. 24 К.В. Гаврилин Пораженность некоторых видов декоративных рыб, поставляемых из Малайзии, Индонезии и Сингапура простейшими ................................... 28 В.Л. Гаврилова, Т.З. Байбиков Выявление антигена вируса репродуктивно-респираторного синдрома свиней в патологических материалах с помощью непрямой реакции иммунофлюоресценции ......... 31 Т.Ю. Дегтяревская, К.Л. Мальцев Патоморфология легких и печени при диктиокаулезе овец до и после лечения гельмицидом................................................................................................... 34 В.И. Деряженцев, Т.М. Епишина Новый протектор синтетической среды для разбавления и криоконсервации спермы баранов ............................................................................................ 36 Т.М. Епишина Репродуктивные способности ремонтных свинок при электростимуляции биологически активных точек ......................................................... 38 Е.И. Кийко, В.Н. Кургузкин, Ю.В. Саморуков, Н.С. Марзанов Оценка аллелофонда быков-производителей по каппа-казеину и BLAD-синдрому........ 40 К.В. Кулешов Видовая идентификация клеточных культур: разработка новых подходов, основанных на полимеразной цепной реакции с детекцией продукта в реальном времени (ПЦР-РВ) ...................................................................................................... 42 Н.К. Лисун Применение кормовой добавки гумивал в схемах иммунизации цыплят-бройлеров .......... 47 С.Ф. Мелешков Динамика функциональных расстройств мочеиспускания и их клинико-морфологические параллели при урологическом синдроме у кошек ................. 50 П.М. Митрофанов, Л.Н. Митрофанова Хламидийные полисерозиты у коров .......................................................................................... 57 Ш.Ш. Мицаев, М.М. Ахмедов Этиологическая структура лептоспироза животных в Юго-Восточном Предкавказье... 61 М.Н. Мусаева, Н.Р. Будулов, С.А. Жидков Этиология гастроэнтеритов новорожденных телят в республике Дагестан ...................... 66 Ф.Н. Насибов, А.Г. Хмылов, Е.А. Тяпугин, Е.У. Байтлесов, В.В. Власов, В.А. Титова Воспроизводительная активность стада при различных условиях эксплуатации коров.......................................................................................................................... 69 Ф.Н. Насибов, А.Г. Хмылов, Е.У. Байтлесов, Е.А. Тяпугин, В.А. Титова Исследование некоторых факторов, влияющих на образование кист яичников ................... 72 В.В. Попов, М.Ф.Щербаков, С.С. Лавров Монокультура versus травосмесь .................................................................................................. 74 Ю.Н. Федоров, М.П. Альбертян, С.С. Нестреляев Количественная характеристика иммуноглобулинов и динамика титра антител в сыворотке крови баранов, вакцинированных против инфекционного эпидидимита......................................................... 79 В.Ф. Ситников, Л.А. Гнездилова Профилактика симптоматического бесплодия овцематок и контроль состояния их воспроизводства .................................................................................. 81 ФАРМАКОЛОГИЯ В.Е. Абрамов, Т.И. Кугелева Изучение переносимости препарата айсидивит на лабораторных животных .................... 84 А.С. Андрусевич Конструирование инактивированной вакцины против пастереллеза пушных зверей ........................................................................................... 87 К.В. Гаврилин Уровень чувствительности возбудителей бактериальных болезней рыб к антибактериальным препаратам ............................................................................................... 91 А.А. Зверев Изучение фармакокинетики имидокарба в организме собак ................................................ 94 Н.П. Зуев Получение и разработка антимикробных композиций на основе тилозинсодержащих препаратов ................................................................................ 97 Ш.А. Ибрагимова, М.Н. Насибов, С.В. Советкин, В.С. Авдеенко Клиническая оценка препарата эндометромаг-т при послеродовом эндометрите у высокопродуктивных коров................................................................................................. 101 Т.И. Кугелева, К.Г. Курочкина Иммунотропная активность препарата айсидивит ................................................................. 104 О.Л. Куликова Изучение влияния антигельминтной пасты «алезан» на организм лошадей .................... 106 В.В. Напалкова, В.Е. Абрамов Исследования острой и субхронической токсичности суспензии триклабендазола.............107 Д.Д. Новиков Фармакотоксикологические свойства и терапевтическая эффективность препарата амит форте ..................................................................................... 112 Т.В. Новосадюк, В.Д. Соколов, А.А. Комиссаренко Научные исследования и доказательность в гомеопатии ...................................................... 115 В.Н. Обрывин, Г.А. Жоров, П.Н. Рубченков Влияние препаратов гамавит и гала-вет на токсический иммунодефицит у белых крыс ..................................................................................................... 119 СONTENTS N.I. Antonov, V.V. Krasnov, K.P. Kirsanov, V.N. Timofeev The apparatus for pelvic fracture repair in dogs ............................................................................. 21 V.A. Babushkin, S.M.Sulejmanov, P.A.Parshin The structural organization of the muscular tissue at Joung growth of pigs at different variants of cross .................................................................................................. 24 V.L. Gavrilova, T.Z. Bajbikov Indication of porcine reproductive and respiratory syndrome virus in patological materials by indirect immunofluorescence method .............................................. 31 V.I. Deryazhencev, T.M.Epishina The new protector complex medium for dilute and cryoconservation of ram semen ................ 36 E.I. Kiiko, V.N. Kurguzkin, U.V. Samorukov, N.S. Marzanov Evoluation of sire bulls gene-pool by k-casein and BLAD ........................................................... 40 S.F. Meleshkov Dynamics of urinary discomfort and their clinicopathologic parallels under urologic syndrome in cats. ...................................................................................................... 50 Sh.Sh. Mitsayev, M.M. Akhmedov The etiological strukture of leptospirosis of animals in the chechen and ingush republics ....... 61 M.N. Musaeva, N.R. Budulov, S.A. Gidkov The aetiology of newborn calves gastroenteritis in the Daghestan Republic.............................. 66 F.N. Nasibov, E.A. Tyapugin, E.U. Baitlesov, V.V. Vlasov, V.A. Titova Reproductive activity of the herd with different cow management ............................................. 69 F.N. Nasibov, A.G. Khmilov, E.U. Baitlesov, E.A. Tyapugin, V.A. Titova Investigation of some factors affects on cysts formation. .............................................................. 72 V.Sitnikov, A.Gnezdilova Preventive measures of symptomatic barrenness of ewes and the control of their reproduction’s condition................................................................................... 81 V. Abramov, T. Kugeleva Tolerance of the Preparation ACDvit in laboratory animals......................................................... 84 A.S. Andrusevich Designing of the killed vaccine against pasteurellosis fur animals ............................................... 87 K.V. Gavrilin Level of sensitivity bacterial agents of fish to antibacterial drags ................................................ 91 A.A. Zverev Pharmacokinetics of the preparation Imidocarb in dogs. ............................................................. 94 T. Kugeleva, K. Kurochkina The Effect of the Preparation ACDvit on the Immune System. ................................................. 104 V.N. Obrivin, G.A. Zhorov, P.N. Rubchenkov Effect of entering gamavit and gala-vet in white rats to the toxic immunodeficiency ............. 119 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ УДК 638.1 О.Ф. Гробов, А.Н. Сотников, Д.А. Штондина Всероссийский НИИ экспериментальной ветеринарии им. Я.Р. Коваленко, г. Москва ВЗАИМООТНОШЕНИЯ VARROA DESTRUCTOR С РАЗЛИЧНЫМИ ОРГАНИЗМАМИ V. destructor (V. jacobsoni) в гнездах медоносных пчел (Apis mellifera L.) обнаружен в конце 50–х годов прошлого столетия в Юго-восточной Азии и быстро распространился по миру. Самки клеща питаются гемолимфой куколки и взрослых пчел; размножаются в печатных ячейках расплода, предпочитая трутневый расплод; взрослые самки выходят из ячейки сота вместе с сформировавшейся пчелой, самец погибает. При питании клеща варроа у куколки рабочей пчелы снижается объем гемолимфы на 23,6%, у трутня – на 18,9%; среднее число гемоцитов соответственно сокращается на 22,25-37,4% и 4,2-14,93%, изменяется соотношение клеток крови [119, 86]. Уменьшается содержание общего белка в гемолимфе на 39,2-57,1%, падает уровень РНК и ДНК в тканях на 1,1-1,2 раза, происходит снижение веса и размера куколки, у взрослых пчел плохо развиваются глоточные железы, жировое тело, сокращается продолжительность их жизни [36, 15]. Слюна клеща приводит к частичному или полному подавлению синтеза лизоцима гемолимфы – одного из основных факторов гуморальной защиты насекомого [5]. Однако наносимый непосредственно клещами вред семьям пчел не ограничивается только этим, с появлением варроа увеличилось количество случаев возникновения других заболеваний, клещ способствовал более интенсивному их проявлению и Ветеринарная патология. № 3. 2008 летальному исходу от них. Одновременно с ростом знаний о характере взаимоотношений варроа с различными патогенами и вредителями пчел неоднократно предпринимались попытки использования биологических объектов борьбы с этим паразитом [32, 49, 131, 64 и др.]. Отсюда возникает необходимость обобщить накопленные данные по взаимоотношениям варроа с различными организмами. Вирусы. Из 20 известных вирусов медоносных пчел четыре агента (вирусы острого и медленного параличей, Кашмир-вирус и вирус деформации крыла пчел) считают тесно связанными с варроа. Вирус острого паралича широко распространен, вызывает инаппарантную (скрытую) инфекцию, проявляющуюся при лабораторных манипуляциях с пчелами. С появлением варроа заболевание пчел стало регистрироваться на пасеках, вирус легко передается клещом куколкам и взрослым пчелам [2, 3], введенная в тело хозяина слюна паразита провоцирует репликацию вируса при скрытой инфекции пчел [91]. В теле инфицированных клещей может содержаться до 1259 нг вируса или 10 10 вирионов [61]. Для заражения пчелы требуется 102 вириона [63]. Репликация патогена внутри переносчика маловероятна. Накопление возбудителя в популяции варроа происходит к осени. Признаки явной инфекции в семье пчел летом отмечают при наличии 12300 клещей, осе5 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ нью – 6800 варроа [102]. Кашмир-вирус серологически сходен с вирусом острого паралича, имеет ряд штаммов, считается наиболее вирулентным для пчел. Установлен в Австралии, Новой Зеландии, Фиджи, Индии, Канаде, США, Испании. Протекает как инаппарантная и иногда явная инфекция, признаки заболевания чаще обнаруживают в семьях пчел с варроа. Вирус медленного паралича до появления варроа выявлен как инаппарантная инфекция пчел. Вирус установлен в Великобритании, Фиджи, Западном Самоа, на территории континентальной Европы не обнаружен. С появлением варроа в Великобритании, гибель куколок и взрослых пчел с параличом двух передних конечностей, вызванным этим вирусом, отмечена в естественно содержащихся семьях пчел. В теле клеща патогена обнаруживают за 2 месяца до гибели семей пчел осенью [70, 71]. Вирус деформации крыла установлен в 1983 г, широко распространен, при отсутствии варроа протекает как скрытая инфекция. Переносится и активируется клещами, передается пчелами-кормилицами [60, 66]. В теле клеща вирус реплицирует [127], его устанавливают задолго до появления признаков болезни в семье (гибель 20% куколок и молодых пчел часто с измененными деформированными крыльями). При введении в семью 1-7 инфицированных клещей гибель пчел происходит в зиму-весну 3-го года после заражения, при 15 и более инфицированных варроа пчелы погибают в течение года [101]. Явные признаки вироза устанавливают летом при наличии 2300 клещей/семью, осенью - 700 клещей/семью [102]. Снижение пораженности варроа в семьях с признаками вироза не дает положительных результатов [104]. Вирус мешотчатого расплода распространен повсеместно, выделен из тела клеща [3]. Самки способствуют переносу этого агента [107, 54], возможно провоцируют скрытую инфекцию [61, 54]. С появлением варроа увеличивается количество неблагополучных семей по этому заболеванию [114]. Вирус хронического паралича. При слабой и средней пораженности семей пчел клещом отмечено увеличение случаев заболевания параличом в июле-сентябре, при сильном поражении клещом вирус от пчел не выделен [62], отмечено увеличение случаев этого вироза на Дальнем Востоке страны с появлением клеща в этой зоне [21]. 6 Хотя заражение вирусом черных маточников и нитевидным вирусом связано с ноземой, присутствие возбудителей в гемолимфе пчел делает возможным их передачу через клеща [61, 30]. Гибель пчел от филаментовироза, подтвержденная электронной микроскопией и серологической реакцией, при подсадке снятых с больных пчел клещей, установлена у насекомых на 10-14 день [30]. Влияние всех известных свойственных пчеле вирусов на организм клеща остается неясным. У 3,6 и 8,0% самок варроа, снятых с взрослых пчел или расплода соответственно, было отмечено потемнение кишечника и жирового тела, что указывало на определенную патологию [123]. Аналогичные изменения установлены также в потомстве самок [124]. Частота и интенсивность проявления симптома зависела от условий внешней среды. Продолжительность жизни таких самок на 43,8% ниже, чем нормальных. При этом в ядрах жировых клеток и мускульных волокнах таких особей выявлены сферические частицы, образующие паракристаллические скопления неправильной формы 22,4х28,90 нм [124, 125]. Размер свободных частиц в цитоплазме клеток, составлял в среднем 27,04х30,68 нм. Частицы не связывались сывороткой против вируса острого паралича пчел. Подсадка клещей на обработанных (скармливанием и опрыскиванием суспензией измененных варроа) личинок пчел не приводила к их заражению. Bengsch et al., 1999 сообщают о выделении пикорноподобного вируса, который вызывает атонию кишечника клеща, препятствует прохождению корма через него; в клетках жирового тела и нервной ткани образует скопления вирионов размером 32 нм. Авторы также указывают на обнаружение иридоподобного вируса у варроа [126]. Исследования, проведенные в Нидерландах, позволили установить РНК-содержащий вирус у Varroa destructor (VdV), полный геном которого состоит из 10112 нуклеотидов. Вирус отнесен к роду Iflavirus имеет сходство с вирусами деформации крыла и Какуговирусом пчел по 84% последовательностям нуклеотидов и 95% аминокислот полипротеина [127, 128]. По данным I. Bakonyi et al. эти вирусы тесно связаны, происходят от общего предка [129]. Хотя VdV найден у клеща, нет данных о его присутствии и репликации у пчел, в таких семьях отсутствовали признаки деформации крыла, увеличение агрессивности; однако присутствие иннапарантной инфекции вируса дефорВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ мации крыла в семьях пчел с VdV не исследовано [127, 129]. В клетках кишечника и яичниках клещей на территории нашей страны обнаружены скопления различных сферических вирусоподобных частиц размером 23–40 нм, условно отнесенных к семействам Picornaviridae (или Parvaviridae) и Togaviridae. Эти частицы не реагировали с сыворотками против вирусов острого паралича, деформации крыла, черных маточников, Кашмир-вируса и Y-вируса пчел. Наличие вирионов в репродуктивных органах самок варроа, вероятно, оказывает влияние на их репродукцию [130]. Риккетсии. Неидентифицированные риккетсиоподобные организмы выделены электронной микроскопией в ректум [100] и в суспензии из тела варроа [32]. Их значение для медоносных пчел и клеща неясно. Бактерии. Более детальные работы проведены по взаимодействию варроа с бактериями. При питании клещей на пленке они воспринимали патогенную для пчел Spiroplasma melliferum [69]. Извитые формы типа спироплазм установлены на поверхности тела клещей, взятых их ульев, а в их кишечнике и мальпигиевых сосудах обнаружены палочковидные бактерии [100]. Изучение кишечника самок показало различную степень выделения микроорганизмов из образцов от 30% [32] до 90% при концентрации от 10 до 120 колоний-образующих единиц/клещ [80]; микробов реже выделяют у самок из расплода, чем у клещей, снятых с взрослых пчел; с марта по апрель количество стерильных варроа в расплоде снижается с 50 до 12,5%, но возрастает с 12,5% до 25% у паразитов взрослых пчел [83]. Видовой состав микроорганизмов в кишечнике клеща не постоянен, представлен банальной микрофлорой и некоторыми патогенными для пчел видами [32, 83]. Эти результаты подтверждают исследования хозяев при паразитировании на них варроа. Степень обсемененности гемолимфы взрослых пчел достоверно увеличивается от числа паразитирующих на них клещей [18]. Видовой состав микроорганизмов более разнообразен у погибших личинок и куколок [50, 51, 106, 123], признаки поражения которых, проявляющиеся чаще осенью, подобны гнильцам [118]. Чаще и в большем количестве в клеще устанавливают различных представителей Enterobacteriaceae, особенно у паразитов, снятых со взрослых пчел [20, 32, 51, 83]. Выделенные из клеща Hafnia alvei вызывают гибель пчел при скармливании Ветеринарная патология. № 3. 2008 и инокуляции в гемоцель, что предполагало возможное участие варроа в переносе микроорганизма [20, 39]. Отмечено увеличение случаев гибели самих пчел от гафниоза в зоне Дальнего Востока с появлением на этой территории клеща варроа [37, 38], в последующем аналогичные случаи стали регистрироваться в Молдавии [31], Германии [89], Финляндии [85]. Обсемененность поверхности тела самки клеща из неблагополучной по заболеванию семьи пчел составляла до 10 тыс. бактериальных клеток H. аlvei/клещ. Пересадкой варроа с инфицированных гафниозом пчел на здоровых насекомых возбудитель передавался в 18% случаев [9]; переносом одного инфицированного клеща удавалось заразить 16,7% куколок пчел, 2-х клещей – 30,7%; 3-х клещей – 81,4%; 7-ми клещей – 95% куколок. В слабых семьях пчел Германии возбудитель выделен у 17% пчел и 38% клещей; H. аlvei обнаруживали в гемолимфе и слюнных железах варроа [115, 116]. Обнаруженная в клещах с расплода и взрослых пчел Esherichia coli [32, 83] способна передаваться при пересадке самок с больных пчел на здоровых в 13,3% случаев [12], Proteus mirabilis - в 30% [9]. Из суспензии тела клещей, снятых с пчел больной сальмонеллезом семьи, выделены Salmonella pulorum [25]. Отмеченные в 19852000 г вспышки цитробактероза пчел в Армении, Молдавии и ряде мест России, вероятно, также связаны с клещом [11, 44], если учитывать сравнительно высокое обнаружение Citrobacter freundii и Citrobacter spp в кишечнике этого паразита [80, 83]. В Италии из погибших при варроозе личинок пчел был выделен Serratia rubideae [106]. Возможность переноса S. marcensens клещом проверена экспериментально. Микроорганизм легко воспринимался варроа; снятые через 72 часа с инфицированных предкуколок и куколок пчел самки содержали в кишечнике от нескольких тысяч до миллиона микробных клеток/клещ. Подсадка инфицированных варроа на здоровых насекомых на 4-ый день их питания привела к гибели 14-18% личинок рабочих пчел и12% трутней (в среднем 14,6%); на 5 день гибель соответственно составляла 1821% и 13-17,3% при концентрации в трупе 5х107 микробных клеток/личинка. Характерный красный цвет погибших личинок позволяет использовать этот микрооргаанизм для изучения переноса бактериальных агентов варроа [82, 84]. Из кишечника живых [83] и погибших с темными пятнами в этом органе 7 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ самок варроа выделен Enterobacter cloacae. Этот микроорганизм встречается в кишечнике здоровых взрослых пчел [56, 79], но некоторые штаммы могут вызывать гибель насекомых–вредителей. Он описан как причина бактериального меланоза маток пчел [77, 120, 65]. Особого внимания заслуживает штамм Ent. сloacae, выделенный J. Hrabak из погибших клещей. При опрыскивании пораженных варроа пчел суспензией, содержащей 1х107 кл/мм3 микроорганизма, гибель 70–88% клещей наступала через 48–72 часа. У погибших особей затемнение кишечника не наблюдали, но установлено увеличение идиосомы и мальпигиевых сосудов, разрывы мембран между вентральными и латеральными или метаподальными щитками и выделение жидкости, содержащей клетки Ent. cloacae [90]. Возможности его использования требуют тщательного изучения. При исследовании клещей, взятых из больной псевдомонозом (септицемией) семьи пчел, выделен Pseudomonas apiseptica (P.aeruginosa) из семейства Pseudomonaceae. Микроорганизм выявлен у 32,8% особей. В лабораторных условиях при подсадке 22% варроа воспринимали этого агента от инфицированных пчел. Через 24 часа питания инфицированных клещей на здоровых пчелах возбудитель был установлен в гемолимфе 2,6% насекомых, через 48 ч – 3,3%; через 72 ч – 3,6% и 96 ч – у 6,6%; все зараженные пчелы погибли. Патоген сохранял жизнеспособность в живых самках клеща 12-14 часов, в погибших клещах – 25-30 суток, у 32% самок микроорганизм выделен из кала, в котором сохранялся до 20-25 суток [42]. Из представителей семейства Bacillaceae наибольший интерес представляет влияние клеща на возбудителей опасного карантинного заболевания – американского гнильца, Paenibacillus larvae var. larvae. Споры этого микроорганизма установлены сканирующей электронной микроскопией на дорсальном щитке самок варроа из неблагополучного по этому заболеванию нуклеуса. Видовая их принадлежность подтверждена последующим культивированием и изучением свойств возбудителя [52]. Вместе с тем варроа не участвует в переносе патогена непосредственно хозяину, хотя может загрязнять спорами внутреннее содержимое улья. Заражение спорами бацилл происходит per os только у личинок пчел в возрасте до 24-28 часов. Отсутствие связи самок варроа с американским 8 гнильцом отмечено рядом авторов [53, 105, 87]. Возникновение заболевания после переноса клещей из больной семьи [43, 33] не исключает других путей заражения. Увеличение случаев этой болезни при поражении семей пчел клещом более 4% [35], прогрессирование признаков и летальность исхода от гнильца на фоне варрооза [41], очевидно, связано с ослаблением, голоданием личинок из-за вызванных этим паразитом изменений у пчел-кормилиц. Такие личинки требуют меньшую дозу спор для заражения [87, 68]. Из самок клещей и куколок пчел, на которых они питались, выделен Paenib. alvei [45], Bac. gracilosporus и Bac. paraalvei [50, 51], являющихся возбудителями доброкачественного гнильца и парагнильца. Отмечено увеличение случаев обнаружения этих гнильцов на неблагополучных по варроозу пасеках при поражении клещом свыше 4% [35]. Остальные микроорганизмы Bac. subtilitis, Bac. megaterium, Bac. pseudoanthracis, Bac. cereus, установленные в клещах и пораженных ими куколках [50, 51], относятся к бактериальной микрофлоре улья, встречаются в кишечнике здоровых пчел, хотя отдельные штаммы Bac. cereus, вероятно, способны вызывать гибель личинок в отдельных семьях пчел без варроа [6, 65]. Из единичных клещей [83] выделены споры Bac. Thuringiensis. Возбудитель также установлен в погибшем расплоде пчел при варроозе [106]. При попытках использовать штаммы Bac. thuringiensis и их эндотоксин в виде промышленных препаратов, широко применяемых для борьбы с вредителями сельскохозяйственных культур и в лесном хозяйстве (энтобактерин, битоксибациллин, дендробациллин, бактоспеин, туренгин) для контроля за численностью варроа в лабораторных и производственных условиях выявлена опасность этих средств как для клеща, так и для пчел [131133]. Несколько обнадеживающие результаты получены при двукратной обработке в течение одного сезона сотов сухой смесью битоксибациллина с крахмалом (1:10) и тимолом в дозе 0,125 и 2,5 г\рамка [134]. Однако при этом возникает опасность накопления препарата в гнезде пчел, что требует интенсивной выбраковки сотов. По данным греческих исследователей гибель 50% популяции клещей на пчелах в лабораторных условиях вызывает выделенный ими штамм Bacillus sp. и его экзо- и эндотоксины [135]. Грам-положительные кокки выделяВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ются из клещей примерно с равной частотой как и Enterobacteriaceae, но количество их в варроа незначительно. Установлены Staphylococcus epidermidis, Sarcina lutea, Micrococcus spp [83], St. albus haemolyticus [90]. Особое значение имеет обнаружение в клещах и гемолимфе пораженных им куколок Enterococcus faecalis (Streptococcus apis) – возбудителя кислого гнильца пчел [50, 51, 45] и единичное выявление Melissococcus plutonius (St. pluton) [45] – опасного возбудителя карантинного заболевания европейского гнильца. С трудностями выделения и культивирования последнего, вероятно, связаны отрицательные результаты по его обнаружению в Германии и Италии [97, 106]. Клещ явно связан с высококонтагиозным М. рlutonius. При исследовании ран, наносимых клещом куколкам пчел, выделена различная микрофлора, включая возбудителя европейского гнильца Melissococcus рlutonius, что указывает на роль варроа в передаче этого патогена [136, 137]. Отмечено увеличение случаев европейского гнильца в варроозных семьях пчел на Украине [35]. Сравнительное изучение течения варрооза и варрооза с европейским гнильцом в Алтайском крае показало, что появление первых признаков гнильца и дальнейшее увеличение интенсивности поражения им расплода происходит одновременно с нарастанием популяции клеща в семьях пчел (с июня-июля) и достигает максимума к сентябрю; гибель расплода при варроозе была приблизительно 1,7%, при смешанном течении варрооза и европейского гнильца – 72,8%. Клещ влияет на проявление признаков заболевания: на 9-13% увеличивается гибель печатного расплода, в августе в основном погибают 9-12-дневные куколки пчел, из которых в 60% случаев выделен М. рlutonius. Гибель расплода от гнильца сдерживает развитие клеща, численность которого к осени сокращалась на 4,0-8,8% по сравнению с семьями, где варрооз не осложнялся бактериозом [46, 47]. В лабораторных опытах Афинского университета показана гибель клещей от выделенного штамма Micrococcocaceae и Bacillus sp. и их токсинов [135]. Грибы. Из погибших и живых клещей выделены дрожжи и различные виды грибов [31, 32]. В Польше отмечено наличие у 5% паразитов Candida spp., Torulopsis sp. Aspergillus fumigatus, Aspergillus spp. [81, 83], в Чехии – Asp. flavus, Penicillium multicolor, P. simplicissimum, Mucor ramosissimes, M. indicus, M.hiemalis [90]. Споры Asc. apis и Ветеринарная патология. № 3. 2008 Aspergillus sp обнаружены на поверхности тела самок варроа при сканирующей микроскопии [100, 112]. Высказано мнение, что клещ является переносчиком этих возбудителей в гнездах пчел [108]. На северо-востоке Польши в пораженных клещом семьях пчел известковый расплод устанавливался в два раза чаще и протекал он с большим охватом расплода в семье [5]. С 1984 по 1986 гг. в варроозных семьях заболевание аскосферозом возросло с 13,5 до 52,3%, а в семьях без клеща – с 10 до 18,8%. Споры гриба были найдены на теле самок варроа с рабочих пчел в 28,3%, у 10% клещей грибы установлены в кишечнике; у клещей из расплода эти показатели были 16,6 и 6,6% соответственно. При нанесении на тело 3,5х104 конидий гриба/клещ и помещении инфицированных самок на личинок пчел через 2 недели погибло 22% личинок до перехода в имаго, у 27% с тела выделен гриб [81]. В Канаде случаи аскосфероза в семьях с клещом повышались с 13,5% ранней весной до 52,3% поздним летом, при отсутствии варроа заболевание возрастало с 10 до 18,8%. В пораженных аскосферозом семьях на теле клеща находили в среднем 3598 спор [138]. Увеличение случаев обнаружения смешанных инфекций аскосфероза, американского, европейского гнильцов, парагнильца, аспергиллеза в пораженных варроозом семьях отмечено на Украине [34, 35]. При аскосферозе самки клеща заходят для яйцекладки в ячейки только центральных сотов гнезда. Часть самок (26%) погибает в результате мумифицирования хозяина в ячейке. При репродукции самок в ячейках. прилегающих к мумиям, наступает гибель самцов при линьке их из дейтонимф в имаго. При среднем (1,97+0,15%) и сильном (9,72+0,96%) поражении расплода аскосферозом увеличиваются паузы между откладками яиц и длительность развития самок потомства, или воспроизводство у клеща прекращается. Вместе с тем при начально слабой (2,33±0,42%) и средней (11,5±0,42%) заклещеванности семьи количество клещей по сравнению с контролем возрастает за счет неосемененных самок по мере увеличения поражения расплода грибом Asc. apis; при сильной заклещеванности (15,6 ± 0,24) происходит снижение прироста молодых неосемененных самок. Клещ при поражении семьи 2,33±0,42% не оказывал влияния на проявление аскосфероза у 3-4 дневных личинок пчел, но при заклещеванности семьи 11,5±0,42 и 15,6% помимо гибели открытого расплода, отмечали гибель со9 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ответственно 6,28 и 20,3% куколок пчел в ячейках, окружающих мумифицированные особи. При этом обычно в первом ряду таких ячеек находились куколки в возрасте фиолетовых глаз или серой груди и черных глаз, а во втором ряду от мумии – в возрасте розовых глаз, брюшко которых вместе с 1-3 погибшими самками клеща в ячейке было покрыто мицелием гриба, разросшимся на брюшке хозяина [24]. Исследования по взаимодействию варроа с грибами рода Aspergillus ограничены. В Австрии на неблагополучных по варроозу пасеках отмечено появление аспергиллеза [67]. Поражение расплода аспергиллами нередко встречается совместно с аскосферозом и варроозом. Грибы особенно привлекают исследователей в качестве агентов для борьбы с варроозом [139]. В решении симпозиума специалистов Евросоюза по патологии медоносных пчел и варроозу, состоявшемся 28-29 ноября 1989 г в Сант-Христольле Але (Франция) было записано «Важны фундаментальные исследования по патогенным грибам; мы должны найти грибы, патогенные для варроа, для развития биологического метода борьбы с варроозом». Первые проведенные испытания различных грибов, выделенных из тканей погибших самок варроа, не дали результатов или эти грибы были опасны для пчел [31, 90]. При кратковременном контакте самок варроа с культурами Asp. flavus, Asp. niger, Asp. fumigatus, Beauveria bassiana клещи погибали через 1-3 суток в состоянии возбуждения (учащенное движение конечностей, ограниченная способность к передвижению). Споры грибов в обилии заселяли поверхность тела паразита. Подсадка самок варроа с культуры Asp. flavus на взрослых пчел не сопровождалась заболеванием и гибелью насекомых, хотя гриб патогенен для пчел [49]. Промышленный препарат боверин вызывает гибель клещей, но он оказывает токсическое действие на пчел; применение фитобактериомицина (антибиотик стрептомициновой группы) против клеща оказалось неэффективным. При испытании 42 изолята Beauveria bassiana коллекции Чилийского института сельскохозяйственных исследований 4 изолята были устойчивы к температуре улья (30-35°), но суспензия их конидий в лабораторных условиях вызывала меньшую смертность клеща V. destructor, чем один из изолятов Metarrhizium anisopliae [158]. В тоже время исследователями Европейской лаборатории биологического контроля из 10 погибших самок варроа на юге Франции в 2005г. выделен штамм B. bassiana, приводящий к гибели паразита на 5-8 день. Обработка самих пчел путем распыления в улье мицелия этого гриба, смешанного с порошком воска или муки, приводила к достоверной гибели клеща весной, летом и осенью и не влияла на пчел [157]. В последние годы значительный успех был достигнут при использовании гриба Hirsutella thompsonii, который вносили в виде порошка (8х105 спор/г) или суспензии (5 млн спор/мл) в дозах 2-3 г на улей, что способствовало снижению репродуктивной способности клещей и гибели 85100% половозрелых особей. Самки клеща погибали через 72 часа, рост мицелия на поверхности тела паразита отмечен на 12 сутки [140]. Гриб проникает в организм клеща через присоски ног. Изоляты гриба отличаются временем наступления летального исхода у варроа после первого контакта с патогеном, ЛТ50 колеблется от 52,7 до 96,7 часов, при пассажах через варроа отдельные штаммы снижают вирулентность [141]. По результатам последующих испытаний в лабораторных условиях и на семьях пчел ЛД90 H. thompsonii для клеща составляла 1,68 х 107 конидий/ мм2, ЛТ90 - 4,16 (3, 98-4,42) суток [142-144]. В лабораторных условиях суспензия этого гриба в концентрации 1х107 конидий/ мл приводила к гибели 50% варроа в течение 100 ч [145]. При опрыскивании пчел в ульях или внесении пластин, обработанных содержащей конидии и споры гриба суспензией, клещи погибали на 3-4 сутки, продолжительность действия составляла более 42 суток, споры гриба распространялись перелетающими пчелами в необработанные ульи пасеки. При посеве суспензии, приготовленной из погибших клещей обработанных семей, в 98% случаев отмечен рост мицелия гриба, однако действие гриба на клещей в печатном расплоде было недостоверно [143]. В случае обработки сотов отечественным штаммом H. thompsonii (50 млн конидий/мл) погибало в 4 раза больше взрослых клещей и потомства по сравнению с контролем, при этом не выявлено каких-либо нарушений в жизнедеятельности семей: матки откладывали яйца в обработанные соты, гибели яиц, открытого и печатного расплода, взрослых пчел не отмечено, зимовка пчел при внесении суспензии гриба проходила нормально [146]. Гриб длительное время сохраняет жизнеспособность при температуре 30-360, при росте выделяет токсин Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ хирзутиллин, который не опасен для пчел [142-147] и для теплокровных [148]. Эффективным для борьбы с варроа является также гриб Metarrhizium anisopliae, который вызывает гибель 90% клещей при нанесении на поверхность тела пчел 1,29х109 конидий/мм2 в течение 5,85 (5,487,43) суток [142-145]. По данным Lodesani с соавторами, использовавших, вероятно, другой штамм, гибель 50% клещей при обработке суспензией в концентрации 1х107 конидий/мл происходит через 71 час, а при обработке Arthobotrus oligospora – через 116 ч, в контроле – через 202 ч [145]. Чилийский изолят M. anisopliae Qu- M845 в концентрации 105 конидий в 0,1мл воды приводил к гибели 50% клещей; при 107,7 – 90%. При внесении в улей дозы 5x105 конидий на фильтровальной бумаге, распылением, или нанесением на леток, второй способ обработки привел к сокращению поражения на 70% против контроля [158]. В проведенных нами первоначальных лабораторных опытах отечественный штамм M. anisopliae также оказался эффективным против клеща и сравнительно безвредным для пчел (В.Н. Космачев). M. anisopliae давно и широко используется для борьбы с многими вредителями растений, имеет значительные преимущества в сравнении с H. thompsonii в получении биомассы гриба, вместе с тем он опасен для зимующих в природе маток шмелей [149]. Английскими исследователями для борьбы с варроа отобраны и исследованы штаммы B. bassiana, M. anisopliae и Lecanicillium spp. Показано, что потребление пчелами обладающей антифунгальными свойствами перги предупреждает их поражение грибами [150]. Роль варроа в спорадически отмечаемых кандидозах пчел не изучалась. Микроспоридии и простейшие. Наиболее часто, до 63,5% случаев, в Белгородской области [26] и, очевидно, повсеместно варроозная инвазия семьи пчел развивается на фоне нозематоза. Вероятно, за счет снижения образования слоев перитрофической мембраны средней кишки из-за дефицита белка у пораженных варрооа пчел происходит более частое проявление нозематоза. Гибель насекомых от нозематоза, осложненного варроозом, наступает при меньшем количестве спор ноземы в их кишечнике, чем у пчел без клеща [40]. Инвазия варроа влияет на экстенсивность и интенсивность поражения ноземой: при поражении клещом 0,1-0,5% нозематоз отмечен в 29,2% семей со средним наличием спор ноземы в средней кишке пчелы 89х105; при Ветеринарная патология. № 3. 2008 25-30% варроа он регистрировался в 37,8% семей с присутствием в кишечнике 18х105 спор [111]. При варроозе из-за дефицита белка семьи раньше начинают потреблять пергу, закладывать расплод, у них раньше развивается нозематозный процесс в кишечнике. При выставке из зимовника иногда отмечают слет пчелы из слабых семей. Выжившие семьи при совместном поражении имеют плохое развитие, количество расплода снижается на 44%, сила и продуктивность семей – на 15% по сравнению с семьями, имеющими только клеща [23]. Гибель семей при смешанном поражении возрастает на 30-40% [4]. В последние годы в Европе и ряде стран Азии в гнездах медоносных пчел с наличием варроа отмечают вытеснение N.apis морфологически сходным видом N.ceranae, паразитирующим ранее у восковой пчелы Apis ceranae [151]. Возможно, что подавление интенсивности поражения пчел N.apis клещом благоприятствует развитию N.ceranae, как более адаптированному паразиту [152]. Данные по влиянию нозематозного процесса у пчел на клеща варроа отсутствуют, но можно предполагать, что снижение общего количества белка в организме больных пчел будет приводить к длительному периоду питания самок на взрослых пчелах, увеличению случаев их переползания с одной пчелы на другую, что в свою очередь должно вызывать замедление развития клеща весной из-за увеличения промежутков между яйцекладками, снижение и возможное прекращение репродукции, учитывая плохое развитие и дефицит белка у личинок расплода при нозематозе. Сведения по отношениям варроа с простейшими: Malpighamoeba mellificae, Leptomonas apis, L. mellificae и грегаринами, отмечаемыми у пчел, отсутствуют. Можно лишь предполагать усиление патологического процесса при взаимодействии этих агентов на организм хозяина. Гельминты. Также неясны взаимные влияния варроа с некоторыми нематодами (преимущественно мермитидами), встречающимися иногда у отдельных пчел в их семьях. Членистоногие. Гнездо медоносных пчел привлекательно для разнообразных постоянно живущих в улье или временно внедряющихся в него разнообразных членистоногих, которые вступают в контакт с варроа. Хищник, питающийся нематодами и мелкими клещами - книжный скорпион (Chelifer cancroides), активно захваты11 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ вает отпавших на дно улья живых самок варроа, способен удерживать их и, вероятно, частично травмировать [14]. Однако из-за сильной хитинизации покрова клеща и относительно крупного размера вряд ли он способен причинить ему значительный вред. Обычно присутствующий в гнездах пчел хищный клещ Cheyletus eruditus и другие представители семейства Cheyletidae, активно уничтожающие яйца и молодые стадии развития клещей, хотя и обращали внимание исследователей [64, 94], так же не могут иметь существенного значения для варроа в силу крепкого покрова взрослых самок; недоступности для хищника яиц и слабохитинизированных молодых стадий клеща в запечатанном расплоде; ограниченной численности хищников к числу жертв. Хищные клещи Phytoseiulus persimilis, используемые для борьбы с паутинными клещами в теплицах, при внесении в улей активно перемещаются по поверхности сота, обычно не проникают внутрь ячеек, избегают контакта с предлагаемыми им трутневыми яйцами пчел и протонимфами варроа; не оказывают влияния на численность варроа в гнезде, концентрируются на дне улья и сохраняются там не более 6 суток [29]. Данные об отношениях двух питающихся гемолимфой пчел клещей варроа и трахейного клеща Acarapis woodi фактически отсутствуют. С появлением этих двух паразитов на территории США в 80е годы потери семей пчел в 1995 и 1996 гг от них составили от 25 до 80% в различных регионах [75]. В то же время в штате Аризона африканизированые семьи пчел с двумя видами клещей (вероятно, японотайландским гаплотипом варроа) сохранялись длительное время без обработок [74, 112]. Достоверных различий в продолжительности жизни пчел при одновременном их поражении V.destructor и A. woodi не отмечено [153]. Исследования медоносных пчел в Иране, Пакистане, Индии и Шри Ланке показали возможное присутствие в их гнездах нескольких видов клещей V.destructor, Euvarroa sinhai – паразита Apis florae и Tropilaelaps clareae (T. mercedesae), обычно поражающего Apis dorsata. Из-за паразитирования в расплоде между этими видами складываются конкурентные взаимоотношения: E. sinhai вытесняется из гнезд пчел другими видами, имеющими больший потенциал размножения [113, 112]. 12 При искусственном инфицировании расплодных ячеек клещами T. clareae и V.destructor, репродукция первого вида была выше, чем у варроа. При случайном попадании обоих клещей в одну ячейку, откладка яиц снижается, выход половозрелого потомства варроа сокращается на 39,4% - у T. clareae – на 22,4% [154]; вскрытие ячеек и удаление взрослыми пчелами пораженных обоими клещами куколок происходит значительно интенсивнее, в среднем 66,7%, против 19,9% при варроа и 49,9% при T. clareae [155]. Тропилелапс имеет укороченный цикл развития (8-9 дней), самки приступают к яйцекладке через 1-2 дня после выхода из ячеек. Кроме того перерывы между заходами в ячейки сотов самок этих клещей различны: T. clareae питается только на расплоде, ротовой аппарат не позволяет ему питаться гемолимфой взрослых пчел и на последних он сохраняет жизнеспособность не более двух суток, в то время как самки варроа могут находиться на пчелах до 84 и даже 250 дней [10]. В результате этого обычно T. clareae вытесняет V.destructor в семьях медоносных пчел в течение двух лет при условии выживания семьи, гибель которой может наступить в течение 3-4 месяцев с момента заражения [121, 122, 110]. Varroa destructor Anderson et Trueman 2000 как специфический паразит Apis mellifera в зоне Юго-Восточной Азии может встречаться в гнездах медоносной пчелы совместно с морфологически сходными (имеющими только несколько меньшие размеры тела) паразитом восковой пчелы Apis cerana и A. nigrocincta - Varroa jacobsoni Oudemans, 1904, особенно на пасеках при совместном содержании таких пчел. V. jacobsoni находят на взрослых европейских пчелах и в их расплоде во Вьетнаме, Индонезии (о. Ява), Папуа-Новой Гвинее [76, 56]. Сравнение заселяемости пчел этими двумя клещами показано на семьях пчел с матками-сестрами, завезенными из Австралии, в Германию и Папуа-Новую Гвинею: V. destructor в Германии установлен на 26 и 68 день после интродукции маток в 16-17% ячеек рабочих пчел (трутневого расплода не было), самки клеща имели потомство в 93-99% ячеек. V. jacobsoni в Новой Гвинее был обнаружен на 164 день в 2,4% ячейках рабочих пчел и 6,8% ячейках трутней; на 325 день расплод рабочих пчел был поражен на 2,8%, а трутневый на 10,2%, однако самки не имели потомства. Энзиматические и молекулярные исследования ДНК Varroa destructor выявиВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ли различия у клещей из гнезд Apis mellifera в Южной Америке и Европе; клещ был разделен на русский или корейский и японо-тайландский гаплотипы. Первый наиболее широко распространен, отмечен в Азии, Европе, Африке, Северной Америке и считается наиболее патогенным, способным к большой репродукции в семьях медоносных пчел. Второй вариант помимо Японии, Тайланда выявлен в Южной и Северной Америке, отнесен к менее патогенному паразиту со слабой способностью к репродукции в гнездах Apis mellifera [92, 73, 58, 59]. Данные по взаимодействию этих гаплотипов только накапливаются, но, вероятно, японо-тайландский тип будет вытеснен корейским. При завозе из Южной Америки семьи A. mellifera, считавшейся устойчивой к варроа, на территорию Франции, она оказалась восприимчивой к распространенному в этой зоне клещу, как и местные пчелы [98]. В сборах 1989 и 1993 гг клещей из Бразилии был установлен только японо-тайландский гаплотип варроа, а в 1997 г - японо-тайландский и корейский гаплотипы, хотя первый преобладал; в США в 1990 г отмечен корейский гаплотип, а в 1997-1998 гг корейский и японо-тайландский с преобладанием первого [59]. Остается неясным вопрос о скрещивании этих гаплотипов варроа внутри семьи A. mellifera. Из 18 установленных гаплотипов варроа, размножающихся в семьях Apis cerana на территории Азии, 6 отнесены к V. destructor, но из них только гаплотипы из Южной Кореи и Японии-Тайланда представлены также у A. mellifera; у V. jacobsoni Oudemans выделено 16 гаплотипов [59]. При близком размещении семей A. mellifera и A. cerana , происходит обмен клещами. Так корейский гаплотип снят с рабочей пчелы A. cerana во Вьетнаме [76]. Вероятно, клещи из семей европейских пчел могут также попадать в гнезда A. nigrocincta, A. koschevnikovi, A. nuluensis, близких к восковой пчеле в Азии. Характер взаимоотношений V. destructor со сходными клещами этих пчел, а так же со многими другими представителями этой группы членистоногих в обилии представленной в гнездах A. mellifera, остается неясным. Важное значение для подтверждения самостоятельности морфологически подобных видов, возможного дальнейшего изменения паразитов, имеет выяснение скрещиваемости между видами и гаплотипами при попадании 2-х и более различных самок в одну ячейку сота. При этом, очевидно, такВетеринарная патология. № 3. 2008 же следует учитывать неоднородность популяции V. destructor корейского гаплотипа в гнездах A. mellifera, где наряду с неоплодотворенными самками, дающими в потомстве самцов, встречаются самки близко- и разнородственно осемененные. Соотношение таких клещей, имеющих определенные физиологические отличия в семье хозяина, меняются в зависимости от сезона года [24]. Вместе с тем, естественная пораженность A. cerana варроа, очевидно, незначительна, во всяком случае исследованием 15 тыс. куколок рабочих пчел и 12 тыс. трупов пчел зимнего подмора в гнездах пчел этого вида на территории Хасанского района Приморского края клещи варроа не установлены, несмотря на наличие паразитов у A. mellifera [19]. В гнезде пчел V. destructor может вступать во взаимосвязь с различными насекомыми. Ослабленные клещом пчелы вынуждены больше и чаще потреблять корм, что используется браулой (Braula schmitzi), которой становится доступным больше корма. Ассоциирование этих двух видов вызывает более сильный стресс в семье и сокращение ее численности [22]. Вместе с тем вынужденное систематическое использование ряда акарицидов (препараты, содержащие амитраз, на браулу не действуют) против клеща привело к резкому сокращению этого клептопаразита. Одним из критериев оценки устойчивости семей пчел к V. destructor предложено определение числа поврежденных самок клеща в результате их удаления пчелой [103, 88]. В зимнем подморе до 83,8% таких особей имеют нарушения целостности тела, преобладали повреждения ног (61,6%), идиосомы – 31,6%, реже гнатосомы (6,8%) клеща. У удаленных с помощью акарицида с пчел варроа как результат повреждения хозяином отмечены нарушения целостности у 16,7% паразитов, при этом также преобладали повреждения конечностей (15,1%), особенно передней пары ног (39,4%) [72]. Однако в последующем было указано на некорректность такого рода оценки, аналогичные повреждения вызывают гусеницы большой восковой огневки (Galleria mellonella), число измененных особей зависело от количества гусениц размером до 1 см и экспозиции [109]. Клещи на гусеницах большой восковой огневки не питаются [7]. Подобные изменения вызывали также различные муравьи [117], которые могли уносить клещей и без повреждений [109]. Formica rufa нападают на живых варроа, процесс обездвижи13 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ вания их занимает около 3 мин. Вне улья при температуре воздуха 22-240 и динамической плотности насекомых 6,01 особь на 1 см2/мин муравьи уносили за 36,2 мин 53,45% положенных на тропах клещей, но предпочитали им обездвиженных гусениц чешуекрылых и комаров, имеющих более мягкий хитиновый покров [29]. Очевидно, что степень повреждения пчелами клещей должна оцениваться в условиях, исключающих воздействие на варроа других членистоногих [88]. Использование этих насекомых для борьбы с клещом исключается из-за наносимого им вреда пчелам. Из насекомых, внедряющихся в гнезда пчел, самки варроа были обнаружены на осах, гнездо которых находилось под ульями пчел в Московской области [28], на одной из 6-ти исследованных обыкновенных ос в Тюменской области, хотя исследование 18 гнезд этой осы дало отрицательные результаты [17]. Однако клещей удавалось содержать на личинках и куколках ос в лабораторных условиях [1]. В Швейцарии было обнаружено гнездо ос, в котором из 1154 ячеек открытого расплода было извлечено 33 клеща, один клещ - из 268 ячеек с личинками перед окукливанием, 2 самки установлены на куколках ос из ячеек; поражение гнезда составило 1,6%. Кроме того, от одного до двух клещей находили на взрослых осах, вылетающих из этого гнезда [78]. Клещей на осах наблюдали в Германии [99]. При вскрытии гнезда Vespa (Paravespula) vulgaris в Польше 3 самки варроа были найдены на передней части тела прядущих кокон личинках осы [93]. В лабораторных условиях в течение 10-30-минутного контакта 20-30% клещей прикреплялось к телу ос, которые проявляли резкое беспокойство и в течение 3 часов освобождались от паразитов; перенесенные из расплода пчелы на личинок ос клещи покидали ячейки сотов последних через 30 мин; в естественных условиях гнезда ос освобождались от введенных варроа через 3-5 дней [17, 26]. Самок варроа находили на теле шмелей в Башкирии [48]. В Тюменской области они были выделены с тел двух Bombus agrorum из 470 исследованных шмелей и шмелей-кукушек (Psithyrus), но не обнаружены в 8 исследованных гнездах этих насекомых. В лабораторных условиях клещи в равной степени прикреплялись к шмелям и пчелам (49,8 и 50,2%) [17]. Варроа также найдены на теле B.pennsylvanicus, снятого с цветков, доставленных из Южной Америки во Флориду (США) [95, 96]. Предпо14 лагается перенос самок варроа шмелямикукушками [96]. Исследование на клеща 30 видов одиночных диких пчелиных из семейств Collectidae, Andrinidae, Halictidae, Melittidae и др. на неблагополучных по варроозу пасеках Белгородской и Крымской областей дало отрицательные результаты [1, 27]. В экспериментах клещи долго не выживали на осах, шмелях, мухах [159]. В лабораторных условиях отмечено выживание клеща в расплоде осмий (Megachelidae) (Кашенцев). При подсадке в лабораторных условиях на мух-журчалок (Syrphidae) клещей они фиксировались, но отпадали на 2-3 сутки [1]; во Флориде (США) варроа был обнаружен на мухе Palpada vinetorum того же семейства [95, 96] Форезия клеща возможна также на жуках (Coleоptera), варроа был найден на божьих коровках (Coccinellidae), часто в обилии покрывающих переднюю стенку ульев пчел на Дальнем Востоке [8], а также на Phanaeus vindex (Scarabeidae) во Флориде [95, 96]. Обследование на клеща божьих коровок на пасеках Тюменской области дало отрицательные результаты, в лабораторных условиях к этим насекомым прикрепилось только 7,6% самок варроа, при 92,2% фиксации их на пчеле [7]. Отмечено, что пораженные клещом варроа, ослабленные семьи пчел чаще поражаются малым ульевым жуком Aethina tumida [156]. Эти насекомые могут играть ограниченную по сравнению с медоносной пчелой роль в распространении варроа с цветков, при проникновении в гнезда пчел; из них наибольшую опасность могут представлять осы, активно внедряющиеся в улей, и, вероятно, могущие более длительно, в течение сезона, сохранять варроа в своих гнездах. Питание и репродукция клеща в гнездах ос и шмелей не установлена. Сохранение самок варроа на теле большинства насекомых, вероятно, не превышает нескольких часов. Растения. Важным вопросом в распространении V. destructor является сохранение самок клеща на цветках, посещаемых пчелами. 3-5% клещей на цветках белого клевера и одуванчика при 20-28° С и влажности 70-75% прикреплялись к насекомым в течение 5 дней [160], по другим данным наиболее длительно, 144 часа, паразиты сохранялись на одуванчике [161]. Однако следует иметь ввиду, что многие растения, выделяющие эфирные масла, могут приводить к гибели паразита. Пораженные клещом семьи пчел, размещенные в посеве коВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ риандра, через месяц имели поражение расплода на 3% ниже, чем в начале опыта, а в контрольной группе семей, содержащихся на цветущей гречихе, поражение расплода за это время возросла на 9% [26]. Несмотря на фрагментарность исследований по связи различных патогенов пчел с варроа, показано, что клещ участвует в переносе многих вирусных и микробных агентов, особенно присутствующих в гемолимфе насекомых и вызывающих сепсис; активизирует ряд латентных вирозов; за счет снижения резистентности организма пчел способствует более интенсивному течению болезни в семье пчел; возможно участвует в отборе отдельных штаммов патогенных микроорганизмов, пассирование которых на пчелах может приводить их к гибели [108]. Появление варроа в семьях пчел внесло изменение в эпизоотологию болезней этих насекомых: появились новые нозологические единицы (острый паралич, болезнь деформации крыла, цитробактероз), увеличилось количество случаев многих септических заболеваний пчел (гафниоз, псевдомоноз и др.), возросло число смешанных инфекций; повсеместно распространился аскосфероз, ранее отмечаемый спорадически; увеличилась контагиозность заболеваний (в осенний, безвзяточный период перемещение клещей на пчелах из одной семьи в другую может достигать 50 особей/сутки); передаче инфицированного варроа на местности могут способствовать осы, шмели и реже другие насекомые. Вызванное клещом ослабление семей пчел способствует заселению их многими вредителями. Клещ изменил особенности течения болезней: увеличилось поражение печатного расплода европейским гнильцом, аскосферозом; форма проявления заболеваний по тяжести течения чаще приобретает средний и тяжелый характер; увеличилось время течения болезней; возрастание популяции клеща во второй половине лета - осенью приводит к более интенсивному развитию их в этот период, способствует частому возникновению рецидивов. Паразитирование варроа в печатном расплоде делает паразита слабо уязвимым для многих патогенов. К сожалению, остается неясным действие большинства патогенов пчел на организм и поведение варроа, требуют более углубленного изучения тех или иных взаимосвязей, отмеченных в настоящем обзоре, особое внимание следует уделить разработке использования биологических агентов для борьбы с паразитом. Наличие клеща в гнездах пчел вызывает необходимость постоянного контроля за его численностью с учетом силы развития семьи этих насекомых; заблаговременного выявления отдельных вирусов пчел в теле этих паразитов. Профилактика и борьба с болезнями пчел в условиях варрооза должна строиться на: 1. максимальном снижении численности варроа в семьях пчел на протяжении всех периодов жизнедеятельности хозяина; 2. повышении резистентности организма пчел семьи; 3. усиленных мер по предупреждению заноса патогенов различной природы на пасеку и окружающую ее местность, максимальному сокращению любых неблагоприятных стрессовых воздействий на семью пчел. РЕЗЮМЕ Представлены данные о роли варроа в активации и передаче возбудителей вирусной, бактериальной, грибной природы и отношения его с различными членистоногими гнезд пчел. Приведены сведения по патогенам клеща, возможности их использования для биологического метода борьбы с этим паразитом. Литература 1. Артеменко Л.П., Сабатин Б.М. (1980) Некоторые вопросы эпизоотии варроа и биологии клеща Varroa jacobsoni Oud. В кн.: Технология производства продуктов пчеловодства. Научн. тр. ВАСХНИЛ, Колос, М., 185-189 2. Батуев Ю.М. (1979) Новая информация о вирусном параличе. Пчеловодство 7, 10-11 3. Батуев Ю.М. (1984) Вирусные заболевания медоносных пчел на фоне варрооза и методы их диагностики. Дисс. на соиск. уч. ст. канд. биол. наук М. 4. Глебова Н.А., Ненилина Т.В. (1980) Эпизоотологические данные о варроозе пчел в Омской и Курганской областях. В кн.: Технология производства продуктов пчеловодства. Научн. тр. ВАСХНИЛ, Колос, М., 189-191 5. Глински З., Ярош Е. (1987) Вредное воздействие Ветеринарная патология. № 3. 2008 клеща Варроа якобсони на медоносную пчелу. Апиакта 23, 41-51 6. Гонсалес Герра А.Р. (1986) Смешанная форма доброкачественного, кислого гнильца и аскосфероза у медоносных пчел в республике Куба. Дисс. на соиск. уч. ст. канд. биол. наук М. 7. Гробов О.Ф. (1976) Итоги исследования в области патологии пчел. Тр. ВИЭВ, 44(1), 51-59 8. Гробов О.Ф. (1977) Варрооз (варроатоз) пчел. В кн.: Варроатоз – болезнь медоносных пчел. Бухарест, 49-94 9. Гробов О.Ф., Гузева Л.Н., Микитюк В.В., Батуев Ю.М., Обухов М.Н., Чернов К.С. (1985) Клещ варроа – переносчик возбудителей заболеваний пчел. Пчеловодство 6, 15-16 10. Гробов О.Ф. (1991) Клещи: паразиты пчел и вредители продукции. Росагропромиздат М. 15 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ 11. Гробов О.Ф., Фомин Б.А., Батуев Ю.М., Гузева Л.Н., Тарнуева Е.Ю. (1993) Цитробактероз пчел. Пчеловодство 11-12, 22-23 12. Гузева Л.Н. (1981) Колибактериоз пчел. Бюлл. ВИЭВ 41, 56-58 13. Данные лаборатории ВИЭВ 14. Дмукаускас И. (1978) Санитар ульев. Пчеловодство 7, 35 15. Домацкая Т.Ф. (1982) Влияние клеща Varroa jacobsoni на организм медоносной пчелы Apis mellifera и разработка способов повышения жизнеспособности пчелиных семей при варроозе. Дисс. на соиск. уч. ст. канд. биол. наук М. 16. Егорова А.И. (1968) Микрофлора пчелиной семьи. В кн.: Системы ведения пчеловодства в различных природно-климатических зонах. Колос, М., 137-141 17. Жаров А.В. (1979) Экологическая связь Varroa jacobsoni Oud. (Parasitoformes, Gamasoidea) со свободноживущими насекомыми. Научн.-техн. бюлл. ВНИИВЭА Вопросы ветеринарной арахно-энтомологии, вып 16 Тюмень 51-54 18. Кoх В., Риттер В. (1988) Второстепенные бактериальные инфекции медоносной пчелы, причиненные варроатозом. Апиакта 23 (1), 11-13 19. Кузнецов В.Н. (2002) Китайская восковая пчела Apis cerana F (Hymenoptera, Apidae) в Приморском крае. Владивосток, 42 стр. 20. Куценко Ю.М. (1975) К вопросу о роли гамазового клеща Varroa jacobsoni (Oudemans 1904) в переносе гафниоза пчел. В кн.: Борьба с болезнями сельскохозяйственных животных в Забайкалье и на Дальнем Востоке, вып. 2 Благовещенск, 50-52 21. Куценко Ю.М. (1976) Выделение возбудителя гафниоза пчел из клеща Varroa jacobsoni на пасеках Дальнего Востока. В кн.: Эпизоотология, профилактика и лечение болезней животных на Дальнем Востоке. Благовещенск, 28-30 22. Марканджелли Х., Эгуарас М., Оппендисано М., Фернандес Н. (1993) Ассоциирование Varroa jacobsoni (Acari: Varroidae) c Braula schmitzi (Diptera: Braulidae) в ульях Apis mellifera (Hymenoptera: Apidae). Апиакта 28 (3-4), 65-68 23. Марков В.И. (1986) Нозематоз при варроатозной инвазии. Пчеловодство 9, 11-12 24. Масленникова В.И. (2002) Структурные элементы популяции клещей Varroa jacobsoni Oudemans, их возрастная репродуктивная активность и механизмы адаптации к изменениям биотических и абиотических факторов в гнезде пчел Apis mellifera. Дисс. на соиск. уч. ст. докт. биол. наук М. 25. Масленникова В.И. (2003) – личное сообщение 26. Микитюк В.В. (1990) Способы снижения численности и плодовитости варроа и использовании их для борьбы с варроозом пчел. Дисс. на соиск. уч. ст. докт. биол. наук. Белгород. 27. Микитюк В.В., Седин И.Ф. (1980) Распространение Varroa jacobsoni в местах с высокой популяцией диких пчел (Apoidea). Тр. ВИЭВ т. 52, 101-103 28. Мочагин П.Ф. (1975) – личное сообщение 29. Обухов М.Л. (1980) Клещ варроа и хищные членистоногие. Пчеловодство 10, 24 30. Обухов М.Л. (1986) Ультраструктурная организация и некоторые вопросы биологии нитевидного вируса пчел. Дисс. на соиск. уч. ст. канд. биол. наук, М. 31. Отчет лаборатории ВИЭВ (1981) 32. Платухина Н.И., Егорова А.И., Столбов Н.М. (1975) Микрофлора клещей Варроа якобсони Уд. (Паразитиформис, Гамазоидеа) – возбудителей варроатоза пчел. Научно-технич. Бюлл. ВНИИВЭА. Вопросы ветеринарной арахно-энтомологии, вып 6, Тюмень, 161-165 33. Попов Е.Т. (1990) Меры борьбы с американским гнильцом на фоне варроатоза. Ветеринария 5, 16 36-39 34. Руденко Е. (1997) Варрооз бджiл та iнфекцiинi хвороби. Пасiка 7, 19 35. Руденко Е. (2004) Змiшанi хвороби розплоду медоносних бджiл (епiзоотологiя, диференцийна дiагностика, комплексна система заходiв боротьби та профiлактики) Дисс. на соиск. уч. ст. докт. вет. наук. Харькiв 36. Садов А.В. (1978) Влияние клеща Varroa jacobsoni на биохимические показатели пчелы. Ветеринария 9, 66-68 37. Салимов Р.М. (1977) Изучение гафниоза (паратифа) пчел. 26 Международный конгресс по пчеловодству Апимондии. Изд. Апимондии, Бухарест, Румыния 474-480 38. Салимов Р.М. (1994) Распространение и роль некоторых представителей семейства Enterobacteriacae в патологии пчел. Дисс. на соиск. уч. ст. докт. вет. наук М. 39. Салимов Р.М., Куценко Ю.М., Кумков В.Т. (1975) Результаты бактериологических и вирусологических исследований в зоне неблагополучия по варроозу пчел. Бюлл. ВИЭВ, вып 21, 64-65 40. Сидоров Н.Г., Столбов Н.М. (1975) Экспериментальная смешанная инвазия нозематоза и варроатоза пчел. Научно-техн. бюлл. ВНИИВЭА. Вопросы ветеринарной арахно-энтомологии вып. 6, Тюмень, 154-160 41. Скрыпник Е.И. (1977) – личное сообщение 42. Смирнов А.М., Игнатьева Г.И. (1985) Мероприятия при септицемии и варроатозе. Пчеловодство 7, 16-17 43. Смирнов А.М., Кудрявцев Е.А. (1977) Клещ варроа и гнильцовые болезни. Пчеловодство 5, 13-14 44. Тарнуева Е.Ю., Гузева Л.Н., Гробов О.Ф. и др. (1994) Citrobacter sp. – возбудитель болезни пчел. Ветеринария 1, 35-37 45. Титов В.Ф. (1980) Бактериальная обсемененность гемолимфы пчел при варроатозе. Научн.технич. бюлл. ВНИИВЭА Вопросы вет. арахноэнтомологии вып 19, Тюмень, 3-5 46. Трубин А.В. (1985) Варроатоз и европейский гнилец. Пчеловодство 7, 17-18 47. Трубин А.В. (1990) Смешанная инвазия – инфекция варрооза, европейского, доброкачественного и кислого гнильцов медоносных пчел. Дисс. на соиск. уч. ст. канд. биол. наук М. 48. Чанышев З.Г., Смирнов А.М. (1977) Диагностика и лечение варроатоза пчел. В кн.: Пути повышения эффективности пчеловодства в Башкирии, Ульяновск, 51-58 49. Чернов К.С. (1982) Изучение клеща варроа в микологическом аспекте. Бюлл. ВИЭВ, вып 41, 59-60 50. Шабанов М. (1984) Ролята на Varroa jacobsoni Oudemans в пчелнато семейство като носител на микроорганизми. – Acta microbiol. Bulgaria 15, 78-82 51. Шабанов М. (1985) Akapът Varroa jacobsoni Oudemans. Природа (НРБ) 34 (6), 62-67 52. Alippi A.M. (1992) Transporte de esporas de Bacillus larvae per el acaro Varroa jacobsoni. Rev. de la Facult de Agronomia 68, 83-86 53. Alippi A.M., Albo G.N., Marcangeli J. et al. (1995) The mite Varroa jacobsoni does not transmit American Foulbrood from infected to healthy colonies. – Exp. Appl. Acarol. 19, 607-613 54. Allen M., Ball B. (1996) The incidence and world distribution of honey bee viruses. Bee World 73 (3), 141-162 55. Anderson D.L. (1994) Non-reproduction of Varroa jacobsoni in Apis mellifera colonies in Papua New Gunea and Indonesia. Apidologie 25, 412-421 56. Anderson D.L., Fuchs St. (1998) Two genetically distinct populations of Varroa jacobsoni with contrasting reproductive abilities on Apis mellifera. Journ. Apic. Res. 37 (2), 69-78 57. Anderson D.L., Gibbs A.J. (1988) Inapparent vi- Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ rus infections and their interaction in pupae of the honey bee (Apis mellifera Linnaeus) in Australia – Journ. Gen. Virol. 69, 1617-1625 58. Anderson D.L., Trueman J.W.H. (1999) Are there different species of Varroa jacobsoni? – Proceed. 36th Intern. Apicult. Congr. of Vancouver. 12-17 Sept 1999 59-60 59. Anderson D.L., Trueman J.W.H. (2000) Varroa jacobsoni (Acari, Varroidae) is more than one species. Exp. Appl. Acarol. 24, 165-189 60. Ball B.V. (1983) The association of Varroa jacobsoni with virus diseases of honey bees. In.: Cavallaro R(ed) Varroa jacobsoni Oud. affecting honey bees present status and needs. A.A.Bolkema, Rotterdam, 21-23 61. Ball B.V. (1989) Varroa jacobsoni as a virus vector. In.: Cavallaro R(ed) Present status of varroatosis in Europe and progress in Varroa mite control. ECSCEEC-EAEC, Luxemburg, 241-244 62. Ball B.V., Allen M.F. (1988) The prevalence of pathogens in honey bee (Apis mellifera) colonies infested with the parasitic mite Varroa jacobsoni. Ann. Appl. Biology 113, 237-244 63. Bailey L, Gibbs A.J., Wood R.D. (1963) Two viruses from adult honey bees (Apis mellifera Linnaeus) – Virology 21, 390-395 64. Bihlmaier E (1986) Biologische Heilmittel zur Eindammung der Varroatose der Honigbiene. Patent BRD 3515851 A61K35/56 6Nov. 1986 65. Borchert A (1974) Die Krankheiten und Schadlinge der Honigbiene. – S. Hizel Verlag, Leipzig 66. Bowen-Walker R.L., Martin S.J., Gunn A (1999) The transmission of deformed wing virus between honey bees (Apis mellifera L.) by the ectoparasitac mite Varroa jacobsoni Oud. – Journ. Invertebr. Pathol. 73, 101-106 67. Bretschko J (1983) Der Varroa-milbe als Risikofaktor. Alpenlandische Bienenzeit. 71 (8/9), 181-186 68. Brodsgaard C.J., Ritter W., Hansen H., Brodsgaard H.P. (2000) – Interaction among Varroa jacobsoni mite, acute paralysis virus and Paenibacillus larvae larvae and their influence on mortality of larvae honeybees in vitro. Apidologie 31, 543-554 69. Bruce W.A., Hackett K.J., Shimanuki H., Henegar R.B. (1990). Bee mites: vectors of honey bee pathogens? – Proceed. of the internat. Symp. on recent reseach on bee pathology. Sept. 5-7, 1990, Gent, 180-182 70. Carreck N.L. (1999) Varroa research at JACK-Rothamsted: progress and prospects. 4pp. 71. Carreck N.L., Ball B.V., Allen M.F. (1997) Felduntersuchungen uber Varroa jacobsoni und Sekunderinfektionen in Vereinigten Konigreich. 35 Intern. Bienenzuchterkongress der Apimondia Antwerpen, Apimondia-Verlag, Bukarest, Rumanien, 208 72. Chmielewski W. (1992) Proba scharakteryzowania uszkodzen ciala – Varroa jacobsoni Oud spotykanego w osypie naturalnym zimujacych pszczol. Ann UMCS, DD, 47 (4), 19-23 73. De Guzman L.J., Rinderer T.E., Stelzer J.A. (1997) DNA evidence of the origin of Varroa jacobsoni Oudemans in the Americas. Biochemical Genetics 35, 327-335 74. Erickson E.H., Atmowidjojo A.H., Hines I. (1998) Can we produce varroa – tolerant honey bees in the United States? – Am. Bee Journ. 138, 828-832 75. Finley J., Camazine S., Frazier M. (1996) The epidemic of honey bee colony losses during the 199596 season. Amer. Bee Journ. 136, 805-809 76. Fuch St., Le Tu Long, Anderson D.L. (2000) A scientific note on the genetic distinctness of Varroa mites on Apis mellifera L and Apis cerana Fabr in North Vietnam. Apidologie 31 (3), 459-460 77. Fyg W (1963) Anomalien und Krankheiten der Bienenkonigin. Bull. Apic. 6, 7-151 78. Gerig L (1987) Wespen als Varroatragerinnen. Schweiz. Bienenztg. 110, 341-345 79. Gilliam M., Lorenz B.J., Richardson G.V. (1988) Digestive enzymes and micro-organisms in honey Ветеринарная патология. № 3. 2008 bee, Apis mellifera: influence of streptomycin, age, season and pollen. Microbios 55, 95-114 80. Glinski Z (1987) Mikroflora przewodu pokarmowego Varroa jacobsoni Oud. w okresie zimowli. Med. Weter. 43 (5), 150-154 81. Glinski Z (1988) The effect of on the incidence and course of chalkbrood disease in Apis mellifera L. on colonies. Ann. UMCS, DD, 48, 23-27 82. Glinski Z., Jarosz J. (1988) A model on the role of Varroa jacobsoni as a vector of bacterial infections in the honey bee. Proc. 18th Intern. Congr. Entomol., Vancouver, July 3-9th, 1988. Abstr. And Author Index Vancouver, 240 83. Glinski Z., Jarosz J. (1990) Micro-organisms associated fortuitously with Varroa jacobsoni – Microbios 62 (250), 59-68 84. Glinski Z., Jarosz J. (1992) Varroa jacobsoni as a carrier of bacterial infections to a recipient bee host. Apidologie 23 (1), 25-31 85. Glinski Z., Kauko L., Buczek J., Gacek G (1994) Hafnioza pszczoly miodnej Apis mellifera L. – Med. Weter. 50 (2), 74-77 86. Glinski Z., Klimont S. (1987) Aktywnosc hemocytow pszczol rabotnic w przebiegu naturalwego zarazenia Varroa jacobsoni Oud. – Med. Weter. 43 (11), 664-667 87. Hansen H., Brodgaard C.J. (2001) American foulbrood – biology and control. Euroconf. on Molecular Mechanism of Disease Tolerance in Honeybee, Momedito, Kralupy near Prague 17-19.10.2000. Proceedings Publ. Bee Res. Inst. in Dol 2001, 75-96 88. Hoffmann S (1993) Das Auftreten beschadigter Milben in Labortest und unter Feldbedingungen bei verschiedenen Carnica-Linienkombinationen. Apidologie 24 (5), 493-495 89. Horn H. (1984) Zum Zusammenhang zwischen Varroa jacobsoni und Bakteriosen bei der Honigbiene. Allg. Dtsch. Imkerztg. 18, 328-329 90. Hrabak J. (2003) The microorganisms insolated from the mites Varroa destructor and the verification of it’s pathogenity for it. – 38 Apimondia Intern. Apicult. Congr. Ljubljana, Slovenia, Aug. 24-29, 2003 91. Hung A.C.F., Ball B.V., Adams J.B. et al (1996) A scientific note on the detection of American strans of acute paralysis virus and Kashmir bee virus in dead bee in one US honeybee (Apis mellifera L.) colony. Apidologie 27, 55-56 92. Issa M.R.C. (1989) Enzyme patterns in Varroa and Apis from Brazil and Germany. Apidologie 20 (6), 504-506 93. Jelinski M. (1990) Rostocz Varroa jacobsoni Oudemans 1904 na larwach osy pospolitej Vespa (Paravespula) vulgaris L. Wiadomsci Parazytol. 36 (1-3), 55-58 94. Jendrejak R. (1993) Study on the biologic control of Varroa jacobsoni with the Cheyletus eruditus. 33 Intern. Apicult. Congr. of Apimondia, 224-225 95. Kevan P.G., Laverty T.M. (1990) Alternative hosts for the dispersal of Varroa jacobsoni and a cautionary note about insect imports into Canada. Bull. Eutomol. Soc. San 22 (3), 129-131 96. Kevan P.G., Laverty T.M., Denmark H.A. (1990) Association of Varroa jacobsoni with organisms other than honeybees and implications for it’s dispersal. Bee World 71 (3), 119-121 97. Koch W., Ritter W. (1989) Examination of artificially infested brood with Varroa mites for secondary infection. Apilogie 20 (6), 491-531 98. Koeniger N., Schmidt J., Wilde J. et al (1995)Versuche zur Varroatose-Tolerance von Bienen aus Uruguay in Europa. – Pszczeln. Zesz. Nauk 39 (1), 121-131 99. Lips F (1988) Wespen und Varroa-Milben. Allg. Dtsch. Imkerztg. 22, 276-277 100. Liu T.P., Ritter W. (1988) Morphology of some microorganisms associated with the female mite Varroa jacobsoni: a survey by electron microscopy. In.: Needham et al (ed.) Africanized honey bees and bee mites. Ellis Horwood, Chichester, 467-474 101. Martin St.J. (2001) The role of Varroa and viral patho- 17 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ gens in the collapse of honeybee colonies a modeling approach. Journ. of Appl. Ecol. 38, 1082-1093 102. Martin St.J., Ball B., Carreck N. (2003) The role of deformed wing virus in the mortality of Varooa infested honeybee colonies. 38 Apimondia Intern. Apicult. Congr. Ljubljana, Slovenia, Aug 24-27 103. Moosbeckhefer R. (1992) Beobachtungen zum Auftreten beschadigten Varroa Milben in naturlichen Totenfall bei Volkern von Apis mellifera carnica. Apidologie 23, 523-531 104. Nordstrom S. (2000) Mite-mediated spread and prevalence of deformed wing viruses. Euroconf. on Molecular Mechanism of Disease tolerance in honeybee (MOMEDJTO). Schedull and Summaries, Kralupy near Praguc 17-19.10, 26 105. Otten C. (1993) Americanische Faulbrut mogliche Ursachen des gehauften Auftretens. Imkerfreund 8, 6-9 106. Panizzi L., Pinzauti M. (1988) Prоliferation of pathogenic bacteria in the nest of the Apis mellifera following attack by Varroa jacobsoni Oud. – Apiacta 23 (3), 74-78 107.Puerto F., Castellano A., Bustos M. et al (1988) Caracteristicas epizooticas de la parasitosis por Varroa jacobsoni Oud. en comenas de la provinсia de Almeria. Rev. Iber. Parasitol. 48, 195-202 108. Puerto F., Flores J.M., Jimenez A.J. et al (1990) Enfermedades secundarias a la parasitacion por Varroa en Apis mellifera. Vida Apicola 43, 54-59 109. Radtke J (1995) Damage of Varroa mite are not caused only by the bees. Pszczeln. Zesz. Naukowe 39 (1), 237 110. Ritter W., Schneider-Ritter U. (1987) Varroa jacobsoni und Tropilaelaps clareae in Bienenvolkern von Apis mellifera in Thailand. Apidologie 18 (3) 384-386 111. Romaniuk K., Wawrzyniak S. (1991) Inwazya Nosema apis u pszczel norazonych roztoczem Varroa jacobsoni. Med. Wet. 47 (2), 62-64 112. Sammataro D., Gerson U., Needham G (2000) Parasitic mites of honey bees: life, history, implications and impact. Annu Rev. Entomol., Palo Alto (Calif) 45, 519-548 113. Sihag R.C. (1988) Incidence of Varrooa, Euvarroa and Tropilaelaps mites in the colonies of honey bee Apis mellifera L. in Heryana (India) – Amer Bee Journ 128, 212-213 114. Spitzer M. (1990) The viral disease of honeybees: A new danger - Proceed. of the Intern. Symp. on recent research on bee pathology. Sept. 5-7.1990 Gent, 166-168 115. Strick H., Madel G. (1986) Varroatose und bakterielle Secundarseuchen. Allg. Deuts. Imkerztg. 20 (10), 321-325 116. Strick H., Madel G. (1988) Transmission of the pathogenic bacterium Hafnia alvei to honey bees by the ectoparasitic mite Varroa jacobsoni. In.: G.R.Needham et al (ed.) Africanized honey bees and bee mites. Chichester, UK. Ellis Horwood 462-466 117.Szabo T.J., Walker C.R.T. (1995) Damages to dead Varroa jacobsoni caused by the larvae of Galleria mellonella. Amer. Bee Journ. 135 (6), 421-422 118. Tomaszewska B. (1992) Choroby towarzyszace warrozie. Pszczelarstwo 43 (7), 7 119. Weinberg K.P., Madel G. (1985) The influence of the mite Varroa jacobsoni Oud. on the protein concentration and the haemolymph volume of the blood of worker and drone of the honey bee Apis mellifera. Apidologie 16, 421-436 120. Weiser J. (1966) Nemoci hmyzu. Academia. Praha 121. Woyke J. (1984) Survival and prophylactic control of Tropilaelaps clareae infestating Apis mellifera colonies in Afganistan. Apidologie 15(4), 421-434 122. Woyke J. (1987) Comparative population dynamics of Tropilaelaps clareae and Varroa jacobsoni mites on honeybees. Journ. Apic. Res. 26 (3), 196-202 123. Акимов И.А., Гробов О.Ф., Пилецкая И.В., Барабанова В.В., Ястребцев А.В., Горголь В.Т., 18 Залозная Л.М., Галактионов Ю.К., Ефимов В.М., Непомнящих В.А. (1993) Пчелиный клещ Varroa jacobsoni. Наукова думка. Киев. 124. Camazine D., Liu T.P. (1998) A putative iridovirus from the honey bee mite Varroa jacobsoni Oudemans.- J.Invertebr. Path. 71; 177-187 125. Kleespies R.J., Radtke J., Bienfeld K. (2000) Viruslike perticle found in the ectoparasite bee mite Varroa jacobsoni Oudemans.- J.Invert. Path. 75; 87-90 126. Bengsch E., Bonmatin J.M. (1999) Mise au point d’un nouveau precede de lutte biologique canter le Varroa: approache virologique. Une nouvella voie pour la destruction selective de l’acarien Varroa jacobsoni parasitant Apis mellifera l’abeille domestique. La Sante de l’Abeille. 72; 245-252 127.Ongus J.R., Peters D., Bonmatin J.M., Bengsch E., Vlak J.M., van Oers M.M. (2004) Complete sequence of picorna-like virus of the genus Iflavirus replicating in the mite Varroa destructor. Journ. Gen. Virol. 85; 3747-3755 128. Terio V.. Martella V., Bonerba E., Conversano C., Di Pinto A., Tantillо G., Buonavoglia C. (2005) An Iflavirus of honeybee associated to unduly aggressive behaviour in genetically more related to deformed wing virus rather than to kakugo virus, 39th Internat. Apicult. Congress. Abstracts Dublin, Ireland Aug 21-26;162-163 129. Bakonyi T., Ruslai M., Nowotny N. (2005) Phylogenetic analysis of bee viruses: genetic relationships with other insect viruses and support of the current taxonomic classification. “Bee Research and Virus in Europe [BRAVE]”. Proceeding of the Meeting in Sophia-Antipolis (France) 2426 april 2005, 65-86 130. Гущина Е.А., Березина Л.К., Батуев Ю.М., Гробов О.Ф., Ершов Ф.И., Кузнецов В.Н., Бейко В.Б., Березин М.В., Карцев В.М. (2002) Вирусоподобные частицы, обнаруженные в клещах варроа. Ветеринария, 1, 24-27 131. Сальченко В.Л. (1981) Результаты испытания ряда препаратов против варроатоза пчел. В кн. Варроатоз пчел. Мат. совещ. МОИП, М., 47-50 132. Микитюк В.В., Коржова ЛН. (1982) О применении бактериальных инсектоакарицидов при варроатозе пчел. Бюлл. ВИЭВ, М., 41, 76-78 133. Антонян М.Г. (1985) Биологические препараты для борьбы с варроатозом. Пчеловодство, 5, 16-17 134. Микитюк В.В. (1984) О возможности сочетанного применения БТБ с препаратами химической природы для борьбы с варроатозом пчел. Тр. ВИЭВ., М., 60, 126-130 135. Tsagou V., Lianou A., Lazarakis D., Emmanouel N., Aggelis G. (2004) Newly isolated bacterial strains belonging to Bacillaceae (Bacillus sp.) and Micrococaceae аccelerate death of the honey bee mite, Varroa destructor (V. jacobsoni) in laboratory assays.- Biotechnol. Lett., 26(6), 529-532 136. Kanbar G., Engels W. Ultrartructure and bacterial infection of wounds in honey bee (Apis mellifera) pupae punctured by Varroa mites. – Parasitol. Research, 90(5), 349-354 137.Kanbar G., Engels W., Nicholson, Hertle R., Winkelmann Y. (2004) Tyramine function as a toxin in honey bee larvae during Varroa-transmitted infection by Melissococcus pluton FEMS Microbiology Letters, 234, 149 138. Liu T.P. (1996) Varroa mites as carriers of honeybee chalkbrood.- Amer. Bee Journ., 136 (9), 655 139. Chandler D., Sunderland K.D., Ball B.V., Davidson G. (2001) Prospective biological control agents of Varroa destructor n.sp an important pest of the European honey-bee Apis mellifera. Biocontrol. Science and Technology, 11, 429-448 140. Haragsim O., Ruzicka V. (2001) Biological control of Varroa mites in honey bee hives with Hirsutella thompsonii. US Patent N 6. 277. 371 b 1.21.08.2001 141. Peng C.V., ZhouX, Kaya H.K. (2002) Virulence and Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ site of infection of the fungus, Hirsutella thompsonii, to the honey bee ectoparasitic mite, Varroa destructor. J. Invertebr. Рathol. 81(3), 185-195 142. Kanga L.H.B., James R.R., Iracia C. and oth. (2001) Biological control of the honeybee parasite Varroa destructor with entomopathogenic hyphomycetes. Internet. Tectran 143. Kanga L.H.B., James R.R., Boucias D.G. (2002) Hirsutella thompsonii and Metarrhizium anisopliae as potential microbial control agents of Varroa destructor, a honey bee parasite. J. Invertebr Pathol 81 (3), 175-184 144. Kanga L.H.B., Jones W.A., James R.R. (2003) Field trials using the fungal pathogen, Metarrhizium anisopliae (Deuteromycetes; Hyphomycetes) to control the ectoparasitic mite Varroa destructor (Acari: Varroidae) in honeybee, Apis mellifera (Hymenoptera: Apidae) colonies. J. Econ. Entomol 96 (4), 1091-1099 145. Lodesani M., Losta C., Nipoti P. (2003), Prodi A Use of three mitosporic fungi for the control of the honey bee parasite mite Varroa destructor Anderson and Trueman. Abstracts 38 Apimondia Internat. Apicult Congr., Ljubljana Slovenia, 422. 146. Космачев В.Н. (2004) Предварительные данные по действию энтомопатогенного гриба Hirsutella thompsonii Fisher на клещей Varroa destructor и медоносных пчел. В кн. Основные достижения и перспективы развития паразитологии. М. 143-146 147.Cantwell G.E., Lehnert T. (1979) Lack of effect of certain microbial insecticides on the honeybee. J. of Invertebr. Pathol. 33(3), 381-382 148. Ignoffo C.M., Barker W.M., Mc Coy C.W. (1973) Lack of per os toxicity or pathogenicity in rats fed the fungus Hirsutella thompsonii – Entomophaga 18(3), 333- 335 149. Гробов О.Ф., Гузева Л.Н., Сотников А.Н. (2000) Наиболее распространенные микозы маток шмелей. Ветеринария 7, 26-29 150. Birchall C., Pynson B., Davidson G., Ball B.V., Pell J.K., Chandler D (2005) Biological control of Varroa destructor-impact of spore inoculum on bees. Abstract 39th Apimondia Intern. Apicult Congr. Dublin, Ireland 21-26 Aug 2005, 168-169 151. Ritter W (2006) Nosema ceranae Internet von 4.03.06 152. Гробов О.Ф., Сотников А.Н. (2007) О возбудителях нозематоза. Пчеловодство №1, 26-27. 153. Romero-Vera C., Otero-Colina G. (2002) Effect of single and succussive infectation of Varroa destructor and Acarapis woodi on the longevity of worker honeybees Apis mellifera. Amer Bee Journ 142(1), 54-57 154. Rath W., Boecking O., Drescher W. (1995) The phenomena of simultaneous infestation of Apis mellifera in Asia with the parasitic mite Varroa jacobsoni Oud and Tropilaelaps clareae Delfinado and Baker. Amer Bee Journ. 135 (2), 125-127 155. Boecking O., Rath W., Drescher W (1992) Apis mellifera removes Varroa jacobsoni and Tropilaelaps clareae from sealed brood cells in the tropic. Amer. Bee. Journ. 132(10), 732-734 156. Hint W.M. (2004) The small hive beetle. Aethina tumida: a review. Bee world 85(3), 51-59 157.Meikle W.G., Mercadier G.,Holst N., Nansen Chr, Girod V. (2007) Impact of a treatment of Beauveria bassiana (Deuteromycota: Hyphomycetes) on honeybee colony health and on Varroa mites (Acari: Varroidae). Proceed of IBRA Intern. Conf. on recent Trends in Apicutural Science 10-14 June 2007, Mikkeli, Finland, 34. 158. Rodriguez Sanhueza M., Gerding M., France A. (2007). Potential use of entomopathogenic fungi against Varroa destructor. 40th Apimondia Internat. Apicult. Congr. Programme & Alstracts, Sept. 9th to 14th 2007, Melbourne, Australia, 133-134 159. Смирнов А.М., Попов Е.Т. (1983) Профилактика варроатоза пчел. Вестник сельскохозяйственных наук №11, 20-22. 160. Громыко Г.И. (1982) Выживаемость самок Varroa вне пчелиной семьи. Пчеловодство №5, 16-17. 161. Хартвиг А., Йедрушук (1987). Выживание V. jacobsoni на цветах. XXXI Междун. конгресс по пчеловодству. Программа и аннотации докладов 19-25 авг. 1987. Варшава, Польша, 116-117. УДК:619:616.728.2-001.5-089.84 Н.И. Антонов, В.В. Краснов, К.П. Кирсанов ФГУ «РНЦ «ВТО» им. акад. Г.А. Илизарова Росмедтехнологий», г. Курган АППАРАТ ДЛЯ ЛЕЧЕНИЯ СОБАК ПРИ ПЕРЕЛОМАХ КОСТЕЙ ТАЗА Введение Монолатеральные переломы таза у собак составляют 18,6 % от всех его повреждений [10, 14, 15]. При переломах подвздошной и седалищной костей, а также костей, формирующих суставную впадину, возникают как ранние, так и поздние повреждения седалищного нерва [7, 11, 12]. Нарушается кровоснабжение ряда мышц бедра и тазобедренного сустава, вследствие чего изменяются их функции. Отклонение от функциональных норм приводит к изменениям постановки конечности, походки, нагрузки на суставы. Возникающая хромоВетеринарная патология. № 3. 2008 та тазовой конечности становится неразрешимой проблемой для рабочей и выставочной собаки. Для лечения переломов седалищной кости и костей, формирующих суставную впадину, в практической ветеринарии применяют стягивающие винты, спицы Киршнера, интрамедуллярные штифты, проволоку, пластинки и различные конструкции [1, 6-9, 13]. Однако при погружном остеосинтезе неизбежны дополнительные травмы мягких тканей, окружающих отломки. Отсутствует возможность репозиции при возникновении вто19 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 1. Устройство для лечения переломов тазовой кости у собак Рис. 2. Внешний вид собаки с аппаратом. ричных смещений отломков. Для создания благоприятных условий течения репаративных процессов в поврежденных тканях академиком Г.А. Илизаровым сформулированы основные принципы чрескостного остеосинтеза, заключающиеся в необходимости выполнения точной репозиции отломков поврежденных костей и их стабильной фиксации на протяжении всего периода лечения с сохранением трофики костей и мягких тканей в условиях сохранения функ20 циональной нагрузки поврежденной анатомической области. На сегодняшний день в ветеринарной хирургии имеются работы, в которых приводятся сведения о реконструктивновостановительных операциях при переломах костей таза методом чрескостного остеосинтеза [2,4,5]. Предлагаемые конструкции универсальны, применимы при нестабильных переломах таза с двусторонней фиксацией тазовых костей и бедра. При этом конструкции сложны в выВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ полнении, имеют большие габариты и на время фиксации ограничивают функции тазовых конечностей, ухудшая качество жизни животного. Целью работы являлась разработка малоинвазивной конструкции аппарата для лечения полифрагментарных и монолатеральных переломов седалищной кости и костей в области суставной впадины у собак, обеспечивающего при малых габаритах возможность закрытой репозиции и стабильной фиксации отломков. Аппарат для лечения переломов седалищной кости у собак (рис. 1) имеет две опоры с отверстиями, на которых посредством спицефиксаторов закреплены спицы[3]. При этом опора, зафиксированная на подвздошной кости выполнена в виде планки, снабженной симметрично расположенными полками, на которых установлены кронштейны. Опора, зафиксированная на седалищной кости выполнена в виде С-образной планки. Опоры соединены между собой резьбовыми стержнями, подвижно закрепленными в кронштейнах, а также двумя парами стержней, снабженных на концах ушками. Детали устройства соединены между собой с помощью крепежных болтов и гаек. Первым этапом проводят фиксацию подвздошной кости 3-4 спицами, введенными в сагиттальной плоскости под углами 50, 100 и 130 градусов. Наружные концы спиц крепят на внешней опоре при помощи болтов-спицефиксаторов. Устранив грубые смещения фрагментов седалищной кости, в них также вводят три взаимоперекрещивающиеся спицы диаметром 1,5 мм. Концы спиц крепят при помощи кронштейнов, шайб и гаек на вне- шней С-образной опоре. Аппарат для лечения переломов седалищной кости используют следующим образом. Смещения краевого фрагмента во фронтальной, сегментальной и сагиттальной плоскостях устраняют путем вращения крепежных гаек, фиксирующих кронштейны, стержни с ушками и резьбовые направляющие стержни. После выполнения репозиции и последующей рентгенографии при полном сопоставлении отломков, спицу, введенную вдоль ости седалищной кости дополнительно проводят на 1-1,5 см через зону перелома в тело седалищной кости. При переломах костей в области суставной впадины также возможно проведение данной спицы через зону перелома. Операцию завершают стабилизацией положения деталей и узлов устройства и выполнением контрольных рентгенограмм. Как правило, на следующий день после операции у собак восстанавливается опорная и двигательная функции тазовых конечностей (рис. 2). Фиксацию осуществляют в течение 35 суток, после чего аппарат внешней фиксации демонтируют. Заключение Использование аппарата в клинической практике показало, что он, при малых габаритах обеспечивает возможность закрытой репозиции во фронтальной, сагиттальной и сегментальной плоскостях и стабильной фиксации отломков седалищной кости и костей, формирующих суставную впадину. Предлагаемый способ чрескостного остеосинтеза легко выполним при знании топографической анатомии. SUMMARY The authors propose the apparatus for treating monolateral pelvic fractures in dogs that being small in size provides closed reduction in three principal planes and stable fixation of the ischium and the acetabulum. This technique of transosseous osteosynthesis is low invasive and not difficult technically if one is aware of the topographic anatomy. Литература 1. Бейдик, О. В. Использование аппарата внешней фиксации при переломах позвоночника и таза у собак и кошек / О. В. Бейдик, В. В. Анников // Ветеринария. 2003. № 12. С. 48-50. 2. Борисов, И.В., Кирсанов К.П., Мельников Н.М., Меньщикова И.А. Применение аппарата внешней фиксации при лечении переломов вертлужной впадины у мелких домашних животных / И. В. Борисов, К.П. Кирсанов, Н.М. Мельников, И.А. Меньщикова // Актуальные проблемы биологии и ветеринарной медицины мелких домашних животных: Матер. 4-ой междун. науч. – практ. конф. Троицк: УГАВМ, 2001. с. 45-46. 3. Заявка на полезную модель №2007125027 Российская Федерация, МКИ7 А 61 D 1/00, «Устройство для лечения переломов костей таза у Ветеринарная патология. № 3. 2008 мелких домашних животных» Антонов Н.И., Краснов В.В., Кирсанов К.П. заявлено 02.05.2007; положительное решение от 02.07.2007. 4. Кирсанов, К. П. Аппарат и способы спицестержневой фиксации таза мелких домашних животных / К. П. Кирсанов, Н. М. Мельников, И. А. Меньщикова // Ветеринар. 2001. № 3. С. 26-28. 5. Краснов, В.В. Способы внешней фиксации седалищной кости у мелких домашних животных / В.В. Краснов, А.Ю. Мельцова, Н.М. Мельников // Материалы 12-го Московского международного ветеринарного конгресса по болезням мелких домашних животных. М., 2004. С. 117 6. Петраков, К.А. Переломы тазовых костей у собак и кошек / К.А. Петраков, С.М. Панинский // 21 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ «Ветеринария» № 12, 1995, с. 49-51. 7. Щейбиц, Х. Оперативная хирургия собак и кошек / Х. Щейбиц, В. Брасс / Перев. с нем. Пулинец В., Степкин М. М.: «Аквариум ЛТД», 2001. 8. Brinker, W.O., Hohn R.B., Prieur W.B. Manual of internal fixation in small animals. Springer Verlag, Berlin, 1984. 9. Braden, T.D. New plate for acetabular fractures: technique of application and long-term follow-up evaluation / T.D. Braden, W.D. Prieur // J. Am. Vet. Med. Assoc. 1986. Vol. 188, No 10. P. 1183–1186. 10. Denny, H.R.: Pelvis Fractures in the Dog: a reviem of 123 cases. Vet. Comp. Orthop. Traumatol. 1978; 19: 151-166. 11. Sharp, N.J. Neurological deficits in one limb/ Jn: Weheler SJ (Ed). Manual of Small Animal Neurology, 2 end. Cheltenham; BSAVA, 1995; 159-178. 12. Walker. T.L. Ischiatic nerve entrapment. J. Am. Vet. Med. Assoc., 1981, 178, 1284-1288. 13. Jacobson, A., Schrader S.C. Peripheral nerve injury associated with fracture or fracture- dislocation of the pelvis in dogs and cats: 34 cases [1978-1982]. J. Am. Vet Med. Assoc., 1987, 180, 569-576. 14. Houlton, J., Dyce J.: Management of pelvic fracture in the dog and cat. Walthon Focus, 1994: 4(2): 17-25. 15. Payne, J.T.: Selecting a method for managing pelvic fractures in dog and cats. Veterinary Medicine, 1993; 969-973. УДК 636.4.6.068:637.072 В.А. Бабушкин, С.М. Сулейманов, П.А. Паршин Мичуринский государственный аграрный университет, Всероссийский НИВИ патологии, фармакологии и терапии, Российский университет дружбы народов СТРУКТУРНАЯ ОРГАНИЗАЦИЯ МЫШЕЧНОЙ ТКАНИ У МОЛОДНЯКА СВИНЕЙ ПРИ РАЗНЫХ ВАРИАНТАХ СКРЕЩИВАНИЯ В настоящее время в свиноводстве особое внимание уделяется изучению не только мясных и откормочных качеств животных, но и показателей качества продуктов убоя. Однако далеко не во всех случаях хорошие мясные и откормочные качества свиней гарантируют высокие качественные показатели продуктов убоя, и в первую очередь - мяса и сала. Поэтому нужны морфологические характеристики мяса, которые позволяют оценить структурную организацию ткани в процессе селекции свиней (М. А. Барсукова с соавт., 2004). Существует отрицательная корреляция мясности туш и качества мяса. При этом масса внутренних органов свиней связана с их типом конституции и, соответственно, с продуктивностью (Давидсон Х.Р., 1956; Дементьев В.Н., 2003). В связи с этим изучение структуры длиннейшей мышцы спины свиней пород крупной белой, белой короткоухой, крупной чёрной и дюрок как при чистопородном их разведении, так и в разных вариантах скрещивания осуществлялось на базе свинокомплексов: ООО «Никифоровское» Никифоровского района; ОАО «Сатинское», ОАО «Сампурский» и СПК «Русь» Сампурского района. Материал для гистологического и гистохимического исследования фиксирова22 Рис. 1. Структурная организация мышечной ткани длиннейшей мышцы спины у поросенка от свиноматки КБ-БК: а, б) Компактность мышечных волокон; в, г) Расширение эндомизия и сохранения поперечной исчерченности. Окр. гем.эозин. Ув. ок. 7, об. 3, 2 ( а ), 10 ( в ), 40 ( б, г ). ли в 10-12%-ном растворе нейтрального формалина, в жидкостях Росмана и Карнуа. Образцы заливали в парафин с послеВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 2. Ультраструктура мышечной ткани у поросенка от свиноматки КБ-БК: а) Электронно-плотные митохондрии с вакуолизацией; б) Увеличение количества полиморфных митохондрий; в) Выраженность вставочных дисков в мышечных пучках. Ув. а, б) 2800, в) 5600 Рис. 3. Структурная организация мышечной ткани у поросенка от свиноматки КБД: а, б, в, г) Компактность мышечных волокон. Окр. гем. – эозин. Ув. ок. 7, об. 3,2 ( а ), 10 ( в ), 40 ( б, г ) Рис. 5. Структурная организация мышечной ткани у поросенка от свиноматки БК: а) Расширение стромы в мышечной ткани; б) Расширение эндомизия; в) Компактность мышечных волокон; г) Выраженность поперечной исчерченности в мышечных волокнах. Окр. гем. – эозин. Ув. ок. 7, об. 3,2 ( а, в ), 40 ( б, г ). Рис. 4. Структурная организация мышечной ткани у поросенка группы КБД: а) Очаговое скопление гликогена в виде черной зернистости между мышечных пучков; б) Расширение внутреннего перемизия с незначительным количеством гликогена. Ув. а) 2200, б) 5600 дующим приготовлением серийных срезов, а при необходимости срезы готовили на замораживающем микротоме. Фиксацию материала для электронно-микроВетеринарная патология. № 3. 2008 скопических исследований проводили в 2,5%-ном глютаровом альдегиде на коллидиновом буфере с постфиксацией в 1% растворе тетраокиси осмия, обезвожива23 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 6. Ультраструктура мышечной ткани у поросенка группы БК: а) Кровеносный капилляр в межмышечном пространстве; б) Миофибриллярность мышечного пучка между вставочными дисками. Ув. а) 1800; б) 7100. Рис. 8. Электронограммы мышечной ткани у поросенка группы КБ-КЧ: а) Расширение стромы и разволокнение мышечных волокон; б) Цепочка электронно-плотных митохондрий в цитоплазме мышечной клетки. Ув. а) 1100, б) 5600. Рис. 7. Структурная организация мышечной ткани у поросенка от свиноматки КБКЧ: а, в) Расширение стромы и разволокнение мышечных волокон; б, г) Фрагментация мышечных волокон. Окр. гем. – эозин. Ув. ок. 7, об. 3,2 ( а, в ), 40 ( б, г ). Рис. 9. Структурная организация мышечной ткани у поросенка от свиноматки КБ: а, б, в) Очаговое расширение эндомизия; г) Значительное убывание гликогена в отдельных мышечных волокнах. Окр. гем.-эозин (а, б, в), ШИК-реакция (г). Ув. ок. 7, об. 3,2 (а), 10 (в), 40 (б, г). ли в спиртах, заключали в эпон-812. Срезы контрастировали цитратом свинца и уранилацетатом, просматривали в электронном микроскопе «Тесла-500» и Philips EM-208. Парафиновые срезы окрашивали гематоксилин - эозином и гематоксилин - пикрофуксином. Нейтральные жиры выявиляли реакцией с суданом черным «В» (Елисеев В.Г.,1999), содержание гликогена - по Бесту и Шабадашу (Артишевский А.А. с соавт., 1999) с использованием реактива Шиффа. 24 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 10. Ультраструктура мышечной ткани у поросенка группы КБ: а) Инвагинация ядерной оболочки на фоне рассширенной стромы; б) Следы гликогена в виде пылевидной зернистости в саркоплазме. Ув. а) 1800, б) 7100. Установлено, что длиннейшая мышца спины у поросенка от свиноматки КБ-БК имела компактную архитектонику мышечных волокон (рис. 1 а, б), в некоторых из них сохранялась поперечная исчерченность (рис. 1 г), в эндомизии наблюдались единичные гистиоцитарные клетки с веретеновидными темными ядрами, а строма мышечной ткани местами значительно расширялась (рис. 1).В ультраструктурной организации мышечной ткани у поросят данной группы увеличивалось количество митохондрий с различной электронной плотностью. Здесь же расширялись пространства в межмышечных волокнах (рис. 2 а, б), а мышечные волокна с выраженными вставочными дисками имели соответсвующую ультраструктуру и были бедны гликогеном (рис. 2 в). Мышечные волокна в длиннейшей мышце спины у поросенка от свиноматки КБД располагались компактно, в них наблюдалась типичная структурная организация с соответствующими им атрибутами (рис. 3). При электронной микроскопии мышечной ткани наблюдалось насыщение её гликогеном, который образовывал очаговые скопления в межмышечных волокнах (рис. 4). Мышечные волокна в длиннейшей мышце спины у поросенка от свиноматки БК выглядели компактно с выраженной поперечной исчерченностью (рис. 5). При этом в ультраструктуре мышечной ткани также наблюдалась компактность мышечных волокон с выраженной васкуляризацией и миофибриллярной структурой (рис. 6). В мышечных волокнах длиннейшей мышцы спины у поросенка от свиноматки КБ-КЧ наблюдалась фрагментация эозинофилии, т.е. окрашивание мышц по интенсивности имело резкие перепады, хотя структурная организация их сохранялась в пределах нормы (рис. 7). В данной группе поросят ультраструктура мышечной ткани соответствовала структуре световой микроскопии. Происходило расширение стромы мышечной ткани с единичными стромальными элементами, разволокнение мышечных волокон и появление электронно-плотных митохондрий в мышечных клетках (Рис. 8). В длиннейшей мышце спины у поросенка от свиноматки КБ наблюдалось расширение эндомизия и очаговое убывание гликогена, а местами до значительного (рис. 9). При электронной микроскопии строма мышечной ткани значительно расширялась, ядра миоцитов имели светлую кариоплазму с незначительной инвагинацией кариолеммы, а в саркоплазме наблюдались следы гликогена в виде мелкой зернистости (рис. 10). Таким образом, структурная организация длиннейшей мышцы спины у поросят от свиноматок генотипов КБ-БК, КБД и БК в период новорожденности выгодно отличалась от генотипов КБКЧ и КБ и находилась в пределах нормы. В ультраструктуре мышечной ткани наблюдалась компактность мышечных волокон с хорошо выраженной поперечной исчерченностью, увеличивалось количество электронно-плотных митохондрий и происходило насыщение гликогеном мышц. РЕЗЮМЕ Установлено, что происходит улучшение ультраструктурной организации длиннейшей мышцы спины у поросят от свиноматок генотипов КБ-БК, КБД и БК, которое характеризовалось наличием в мышечных волокнах компактности с выраженной поперечной исчерченностью, множества элект- Ветеринарная патология. № 3. 2008 25 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ронно-плотных митохондрий и гранул гликогена в саркоплазме клеток. SUMMARY It fixed, that there is an enriching the ultrastructural organization long muscles of a back at pigs from sows of genotypes of KB - БК, КБД and БК which was characterized by presence in muscular fibers of compactness with the expressed transversal striation, sets of electrons-dense mitochondrions and beads of a glycogen in a sarcoplasm of cells. Литература 1. Артишевский, А.А. Гистология с техникой гистологических исследований / А.А. Артишевский, А.С. Леонтюк, Б.А. Слука. М.: Высшая школа, 1999. 16 с. 2. Барсукова М.А. Морфологическая и качественная характеристика продуктов убоя свиней скороспелой мясной породы СМ-1 / М.А. Барсукова, К.В. Жучаев, И.И. Гудилин // Матер. Конфер., посвящ. 100 летию профессору В.Я. Суетину «Актуальные аспекты экологической, сравнительно-видовой, возрастной и экспериментальной морфологии», Улан-Удэ, 2004, С. 29-31. 3. Давидсон X. Р. Свиноводство. М.: Издательство иностранной литературы, 1956. 408 с. 4. Дементьев В. Н. Прогнозирование мясной продуктивности свиней по различным источникам информации // Мат-лы Второй международной конференции «Ветеринарная генетика, селекция и экология» / НИИВГиС. Новосибирск, 2003. Т. 2. С. 71-72. 5. Елисеев, В.Г. Основы общей гистологии и гистологическая техника / В.Г. Елисеев. М.: Медгиз, 1999. 214 с. УДК: 639.3.091 К.В. Гаврилин ООО «НВЦ Агроветзащита» ПОРАЖЕННОСТЬ НЕКОТОРЫХ ВИДОВ ДЕКОРАТИВНЫХ РЫБ, ПОСТАВЛЯЕМЫХ ИЗ МАЛАЙЗИИ, ИНДОНЕЗИИ И СИНГАПУРА ПРОСТЕЙШИМИ Введение В настоящее время на территорию РФ завозят значительное количество пресноводных тропических рыбок для дальнейшего их содержания в декоративных аквариумах. Одним из основных регионов поставщиков служат страны Юго-Восточной Азии, где рыбки выращиваются на крупных рыбоводных фермах или отлавливают из природных водоемов. В странах Западной Европы, так же закупающих тропических аквариумных рыбок в этом регионе отмечено, что значительный удельный вес среди их заболеваний занимают протозойные инвазии [1]. При содержании рыб в условиях декоративных аквариумов отличающихся постоянством условий и высокой плотностью популяции потенциальных хозяев, паразиты находят благоприятные условия для своего развития и размножения [2]. Развивающиеся, под действием инвазионных агентов патологические процессы приводят к массовой гибели рыб, а выжившие особи, как правило, утрачивают товарные качества необходимые для их успешной реализации, и нуждаются в достаточно 26 длительной реабилитации. Проведение работ по выяснению эпизоотической ситуации по протозойно-бактериальным заболеваниям рыб, поступающих на территорию РФ, позволит оценить потенциальную опасность интродукции опасных паразитов аквариумных рыб и в дальнейшем явится основой для разработки научных рекомендаций по карантинированию экзотических гидробионтов, и повышению экономической эффективности функционирования отечественных аквариальных хозяйств. Материалы и методы Работа выполнена на базе аквариальных закупочно-карантинных цехов предприятий: ЗАО «Аква-Лого» и ООО «Аргус», расположенных в г. Москве и ближайшем Подмосковье. Эти хозяйства выбраны для проведения работ как одни из наиболее крупных и активных поставщиков декоративных рыб в Московском регионе. В течение 2005 и 2006 г.г. исследованиям подвергали партии поставляемых изза рубежа рыб. Из каждой исследуемой группы случайным образом отбирали по 10 экз. Объектом исследования служили Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица Группы пресноводных тропических рыб подвергнутые паразитологическому исследованию в 2005–2006 г.г. № Регион поставки Вид рыб Общая численность, экз. Подвергнуто исследованию, экз, (% от общей численности) 1. Малайзия Hiphophorus helleri 890,0 40,0 (4,5) 2. Малайзия Poecilia velifera 900,0 20,0 (2,2) 3. Малайзия Poecilia shenops 1200,0 100,0 (8,3) 4. Малайзия Trichogaster trichopterus 200,0 20,0 (10,0) 5. Малайзия Colisa lalia 800,0 40,0 (5,0) 6. Индонезия Poecilia velifera 550,0 30,0 (5,4) 7. Индонезия Poecilia shenops 300,0 20,0 (6,7) 8. Сингапур Poecilia shenops 400,0 20,0 (5,0) 9. Сингапур Colisa lalia 420,0 40,0 (9,5) 5660,0 330,0 (5,8) ИТОГО: представители нескольких наиболее массовых видов рыб: меченосцы (Xiphophorus helleri), пецилии (Poecilia velifera), моллинезии (Poecilia sphenops), гурами (Trichogaster trichopterus) и лялиусы (Colisa lalia), закупаемые в Малайзии, Индонезии и Сингапуре. Паразитологические исследования проводили согласно существующим методическим указаниям [3]. Экстенсивность инвазии определяли как процент представленных в выборке особей, у которых обнаружен хотя бы один паразит. Интенсивность инвазии рассчитывали, как среднее количество паразитов обнаруженное на всех инвазированных особях в рассматриваемой группе. Количество паразитов на рыбе определяли, как отношение между их численностью, найденной при микроскопировании соскоба слизи с поверхности тела и жабр к числу просмотренных полей зрения микроскопа (увеличение х 154). Идентификацию обнаруженных простейших проводили до рода, при помощи определителя паразитов пресноводных рыб СССР [4]. Математический и статистический анализ полученных результатов осуществляли при помощи пакета прикладных программ для ПК Microsoft Office Excel 2003. Результаты и обсуждение Всего в ходе проведенных работ паразитологическому исследованию были подвергнуты группы рыб представленные в таблице. Динамика развития патологического процесса в группах инвазированных костиозом, триходинозом, криптобиозом, гексамитозом и кератоморфозом рыб была сходной. Признаки поражения рыб простейшими (участки помутнения чешуи, повышенное ослизнение поверхности тела, распад межлучевой каймы плавников, Ветеринарная патология. № 3. 2008 ослизнение и анемия жабр) появлялись обычно на 3–4 сутки после поставки. Затем наряду с клинической картиной характерной для протозоозов начинали развиваться признаки септического бактериоза (асцитный синдром, ерошение чешуи, петехии и геморрагии на поверхности тела, кровоизлияния в белковую оболочку глаз, формирование язв на теле и плавниках). Исходя из этого, можно говорить о необходимости изучения роли вторичных бактериальных осложнений в развитии патологического процесса и гибели рыб при протозойных инвазиях. В группах рыб являющимися носителями сидячих инфузорий – апиозом и трихофрий каких либо болезненных симптомов отметить, как правило, не удавалось. Это может быть связано, как с достаточно низкой интенсивностью инвазии, так и с более низкой по сравнению с подвижными простейшими патогенностью сидячих инфузорий. Ниже представлены данные, полученные при паразитологических исследованиях рыб. Меченосцы из Малайзии были поражены жгутиконосцами, относящимися к роду Costia. В среднем в группе рыб этого вида инвазия характеризовалась следующими параметрами ЭИ – 52,5% а ИИ колебалась от 22,4±1,8 до 39,0±4,5 шт./п.з. Пецилии из Малайзии наиболее часто являлись носителями паразитических жгутиконосцев идентифицированных как Costia necatrix. В среднем по исследованным группам инвазия характеризовалась следующими параметрами: ЭИ – 75%, ИИ колебалась от 6,0±1,1 до 54,7±0,3 шт./п.з. Пецилии из Индонезии были более благополучными. Общий уровень носительс27 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ тва костий (Costia sp.) не превышал 6,7%, а ИИ составляла 26,0±1,8 шт./п.з. У моллинезий доставленных из Малайзии в 10% случаев были обнаружены сидячие инфузории рода Apoisoma (ИИ – 20,0±3,6 шт./п.з.), Costia sp. – 10% (ИИ – 18,0±2,9 шт./п.з.), Trichofria sp. – 20% (ИИ – 26,0±3,7 шт./п.з.) и у 20% была отмечена смешанная инвазия Apiosoma sp.+ Costia sp. (ИИ – 15,0±2,5 и 25,0±1,2 шт./п.з. соответственно). Партии моллинезий получаемых из Индонезии, были свободны от паразитов. В целом можно говорить о более высокой паразитарной безопасности завозимых из Индонезии гидробионтов. Моллинезии из Сингапура были носителями триходин (ЭИ – 15%, ИИ – 25,0±2,4 шт./п.з.) или смешанной инвазии Trichodina sp. + Costia sp. ЭИ – 30%, а ИИ 1,5±0,4 и 2,0±0,3 шт./п.з. соответственно. Гурами доставляемые из Малайзии были поражены криптобиозом (Cryptobia sp.). Инвазия в среднем характеризовалась следующими параметрами: ЭИ-15%, ИИ – 40,0±3,4 шт./п.з. Лялиусы, получаемые из Малайзии, являлись носителями простейших, идентифицированных как Keratomorpha sp. Инвазия в среднем характеризовалась следующими параметрами ЭИ – 50%, ИИ колебался от 28,0±1,8 до 40,0±3,4 шт./п.з. Лялиусы из Сингапура являлись носителями жгутиконосцев рода Hexamita. В среднем, по исследованным группам инвазия характеризовалась следующими параметрами: ЭИ-25%, ИИ – 15,0±3,2 шт./ п.з. С такой же частотой отмечали поражение рыб триходинозом (Trichodina nigra), ИИ составляло 45,0±1,0 шт./п.з. У 12,5% исследованных особей обнаруже- ны сидячие инфузории, идентифицированные как Apiosoma rurense, а ИИ составила 3,0±0,5 шт./п.з. Заключение Декоративные рыбы поставляемых в нашу страну в 64,6% случаев являются носителями простейших эктопаразитов, количество и состав которых зависит от региона и вида рыб. Всего обнаружены представители 7 родов: Costia – 25% от всех случаев обнаружения паразитов, Apiosoma, Kerotomorpha и Trichodina по 7,2%, и по 3,6% на Trichofria, Hexamita, Cryptobia. С частотой 3,6% выявлены случаи смешанных инвазий Apiosoma + Costia и Trichodina + Costia. Можно говорить, что завоз декоративных рыб из-за рубежа является мощным источником интродукции опасных для них патогенов. Необходимо констатировать не только неудовлетворительное эпизоотическое состояние рыбоводных хозяйств расположенных в Малайзии и Сингапуре, но и отсутствие эффективных лечебных и карантинных мероприятий. В связи, с вышеизложенным весьма актуальными являются дальнейшие более подробные исследования эпизоотической ситуации по инвазионным заболеваниям декоративных рыб и вопросы разработки соответствующих лечебнопрофилактических средств, для их карантинирования. Отечественным предприятиям закупающим рыб в неблагополучных регионах можно рекомендовать не дожидаясь появления клинических проявлений заболеваний, связанных с гибелью и потерей товарного вида рыбок с целью профилактики использовать имеющиеся на рынке противопаразитарные средства. РЕЗЮМЕ В ходе исследований широко распространенных видов декоративных тропических рыб поставляемых из Малайзии, Индонезии и Сингапура выявлено, что 64,6 % общего поголовья пораженно простейшими эктопаразитами. Наиболее распространенными были представители рода Costia – 25% от всех случаев обнаружения паразитов, по 7,2% приходилось на представителей родов Apiosoma, Kerotomorpha и Trichodina, и по 3,6% на представителей родов Trichofria, Hexamita, Cryptobia и смешанные инвазии Apiosoma + Costia и Trichodina + Costia. SUMMARY The widespread kinds of decorative fishes delivered of Malawian, Indonesia and Singapore were investigation. It was determined that 64,4% of total of fishes struck. The most widespread were representatives of a genus Costia – 25%, Apiosoma – 7,2%, Kerotomorpha – 7,2%, Trichodina – 7,2%, Trichodina – 3,6%, Hexamita – 3,6%, Cryptobia – 3,6% and mixed invasion Apiosoma + Costia – 3,6%, Trichodina + Costia – 3,6. Литература 1. Bassleer G. The new illustrated guide to fish diseases in ornamental tropical and pond fish. – Westmeerbeec: Responsible publisher. 2005. 232. p. 2. Гаврилин К.В. Мамыкина Г.А. Антибак ПРО для аквариумных рыб. Мат-лы докл. научн.-практ. конф. «Аквариум как средство познания мира», Москва 1–2 февраля. Москва 2006. 28 3. Проведение ихтиопатологических исследований – методические указания. М.: Россельхозиздат, 1968. 20 с. 4. Определитель паразитов пресноводных рыб СССР – справочное пособие. Т 1.,М.: Колос. 1984. Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ УДК 619:616.98:578.831.31:616-074 В.Л. Гаврилова, Т.З. Байбиков Федеральное государственное учреждение «Федеральный центр охраны здоровья животных», г. Владимир, Россия ВЫЯВЛЕНИЕ АНТИГЕНА ВИРУСА РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ В ПАТОЛОГИЧЕСКИХ МАТЕРИАЛАХ С ПОМОЩЬЮ НЕПРЯМОЙ РЕАКЦИИ ИММУНОФЛЮОРЕСЦЕНЦИИ Введение Репродуктивно-респираторный синдром свиней причиняет значительный экономический ущерб свиноводству многих стран мира, поэтому, возникает необходимость своевременной постановки диагноза и проведения плановых мероприятий по профилактике и ликвидации очагов острых вспышек заболевания [3, 4, 5]. Диагностика РРСС основывается на анализе эпизоотологических, клинических, патологоанатомических данных и результатах лабораторных исследований [1, 2, 4]. Антиген вируса РРСС выявляют в зафиксированных в формалине срезах тканей органов при помощи НРИФ и других тестов, геном вируса – в ПЦР [7, 8]. НРИФ является экспресс методом в диагностике РРСС и обладает большой чувствительностью и специфичностью. Выявление вируса РРСС при помощи НРИФ в патологических материалах с использованием перевиваемой культуры клеток позволяет протестировать большое количество проб, значительно сократить срок получения результатов, а также заметно снизить трудоемкость процесса и расход используемых компонентов реакции. Целью нашей работы явилось изучение возможности выявления вируса РРСС в полевых образцах методом НРИФ в культуре клеток MARC-145. Материалы и методы В качестве патологического материала использовали пробы внутренних органов, полученных от экспериментально инфицированных вирусом РРСС подсвинков в период с 1994 по 2006 гг. из хозяйств Российской Федерации различных регионов России: Белгородской, Владимирской, Вологодской, Воронежской, Ивановской, Калужской, Кемеровской, Кировской, Костромской, Курской, Нижегородской, Новгородской, Новосибирской, Омской, Оренбургской, Пензенской, Пермской, Рязанской, Саратовской, Свердловской, СмоленВетеринарная патология. № 3. 2008 ской, Тульской, Тюменской, Ульяновской и Челябинской областей, Краснодарского и Ставропольского краев. При постановке НРИФ использовали коммерческие антивидовые конъюгаты, выпускаемые на предприятии по производству бакпрепаратов при НИИЭМ им. Н.Ф. Гамалеи, представляющие собой глобулиновую фракцию, выделенную из антисыворотки, полученной иммунизацией кроликов иммуноглобулинами свиньи, меченную ФИТЦ, а также антивидовой кроличий иммунофлюоресцирующий конъюгат против IgG свиней производства фирмы «SIGMA» (США). В работе была использована перевиваемая культура клеток MARC-145 (клон культуры клеток почки макаки-резус MA-104), которую поддерживали путем регулярных пересевов с использованием питательной среды Игла с 10% сыворотки КРС. Вначале отработали постановку реакции в монослое клеток MARC-145, выращенном в пенициллиновых флаконах. Постановка реакции включала следующие этапы: - получение монослоя клеток MARC145: засевали пенициллиновые флаконы клеточной суспензией с посевной концентрацией 150 тыс. кл/см3 по 1 см3 и инкубировали при +37° С в термостате в течение 48-72 часов; - инфицирование монослоя клеток: на монослой наносили исследуемую суспензию в объеме 0,5 см3 и выдерживали в течение 2 часов при температуре 37° С в термостате. Затем заливали в пенициллиновые флаконы поддерживающую питательную среду Игла в объеме 2 см3 и инкубировали в течение 24-48 часов; - получение препаратов из инфицированной вирусом и интактной культуры клеток. С этой целью вносили во флаконы по 0.2 см3 смеси версена и трипсина и выдерживали в термостате в течение 10-15 29 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Результаты обнаружения вируса РРСС в органах экспериментальных подсвинков, n=5 № п/п Исследуемый материал 1 2 Результаты исследований в НРИФ органов поросят инфицированных не инфицированных сгусток крови + - сыворотка крови + - 3 легкие + - 4 макрофаги + - 5 миндалины + - 6 лимфатические узлы + - 7 селезенка + - минут до начала дезагрегации клеток. Затем клетки диспергировали пипетированием и раскапывали на предметные стекла (по 3-4 капли с концентрацией 106 кл/см3) с помощью микродозатора; - фиксация препаратов охлажденным при -20° С ацетоном, который дважды, с интервалом 5 минут, наносили на препараты, затем высушивали их на воздухе; - взаимодействие антигена с антителами, для этого наслаивали на препараты гипериммунную к вирусу РРСС сыворотку крови свиней в разведении 1:80, выдерживали на контакте 30 минут, промывали водопроводной водой и высушивали препараты; - взаимодействие комплексов антигенантитело с антивидовым флюоресцирующим конъюгатом - кроличьими анти-свиными глобулинами, меченными флюоресцеина-5-изотиоцианатом. Данный конъюгат наслаивали на препараты в рабочем разведении (1:200), инкубировали в течение 20 минут при комнатной температуре, затем препараты промывали водопроводной водой и высушивали; - контрастирование препаратов с помощью окрашивания их водным раствором Эванса голубого в разведении 1/106 в течение 10 минут при комнатной температуре с последующим промыванием водопроводной водой и высушиванием; - учет результатов реакции в люминесцентном микроскопе: при регистрации ярко зеленого внутриплазматического свечения клеток в положительном контроле и отсутствии такого свечения в отрицательном контроле переходили к просмотру препаратов с исследуемым материалом. Затем, методику постановки НРИФ отработали с использованием монослоя клеток MARC-145, выращенного в лун30 ках 96-луночных полистироловых микропланшетов: в лунки 96-луночных микропланшетов вносили по 50 мкл питательной ростовой среды Игла, затем – по 100 мкл клеточной суспензии MARC-145 с посевной концентрацией 200000 кл/см3. Через 24-48 часов инкубирования в СО2-инкубаторе с 5% СО2 при 37° С выросший монослой клеток инфицировали испытуемыми 33%ными суспензиями патологических материалов, которые вносили по 50 мкл в лунки (по 4 повторности). В качестве положительного контроля использовали суспензию, полученную из патматериала от экспериментально инфицированного интратрахеально вирусом РРСС, штамма Lelystad, подсвинка. В качестве отрицательного контроля использовали суспензию, полученную из кусочков внутренних органов от клинически здорового подсвинка. Плашки помещали в СО2-инкубатор на 24-48 часов при температуре 37° С. Через 24-48 часов удаляли содержимое лунок, плашку высушивали на воздухе в течение ночи и проводили фиксацию в смеси, состоящей из равных частей дистиллированной воды, спирта и ацетона при комнатной температуре (смесь вносили по 50 мкл в каждую лунку и тот час удаляли), затем, микропланшеты высушивали на воздухе. Потом, в каждую лунку вносили серопозитивную к вирусу РРСС сыворотку крови свиней в рабочем разведении и инкубировали в течение 30 минут при комнатной температуре. Затем, плашки тщательно промывали под слабой струей водопроводной воды, ополаскивали дистиллированной водой и подсушивали на фильтровальной бумаге. После этого, в каждую лунку вносили по Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 2 Результаты исследования на наличие вируса РРСС в НРИФ полевых патологических материалов от свиней Наименование проб патологических материалов Количество исследованных проб всего положительных % Внутренние органы 236 142 33,51 Транссудат или экссудат 128 83 64,84 Кровь от домолозивных поросят 33 22 66,67 Кровь от свиноматок 259 185 71,42 Кровь от мертворожденных поросят 13 9 69,23 Кровь от поросят-сосунов 38 26 68,42 Кровь от хряков 7 3 42,85 Молозиво 3 2 66,67 717 472 65,83 Всего: 50 мкл рабочего разведения антивидового флюоресцирующего конъюгата и инкубировали в течение 20 минут при комнатной температуре. Затем, микропланшеты промывали и высушивали, как было указано выше. С целью повышения контрастности препаратов в каждую лунку вносили по 50 мкл водного раствора Эванса голубого в разведении 1/106 и инкубировали в течение 10 минут при комнатной температуре. По истечении времени плашку промывали дистиллированной водой, затем тщательно высушивали и просматривали под люминесцентным микроскопом. Результаты и обсуждения При оценке результатов учитывали количество флюоресцирующих клеток и интенсивность свечения цитоплазмы. На первых этапах работы использовали в качестве испытуемого материала пробы органов и тканей, полученные от экспериментально инфицированных вирусом РРСС, штамма Lelystad, и незараженных подсвинков. Опыты проводили на серонегативных к вирусу РРСС подсвинках с массой тела 20-25 кг. Животных заражали вирусом РРСС, штамма Lelystad, прошедшим 5 пассажей в перевиваемой культуре клеток MARC-145 с титром инфекционности 4.25 lg ТЦД50/см3 интратрахеально. На пике температурной реакции (отмечали повышение температуры тела до 40.5-40.9° С) животных убивали и отбирали пробы различных органов и тканей для исследования на наличие вируса в непрямой реакции иммунофлюоресценции. Результаты проведенных исследований Ветеринарная патология. № 3. 2008 представлены в табл. 1. Как видно из табл. 1, положительные результаты были получены в НРИФ только в тех препаратах, которые были приготовлены из проб органов инфицированных вирусом РРСС свиней. В неинфицированных клетках не наблюдали флюоресцирующего цитоплазматического свечения, что являлось отрицательным результатом. Следовательно, данная методика позволяет специфично обнаруживать антиген вируса РРСС в исследуемом патологическом материале, полученном от больных РРСС животных, и может быть использована в специализированных ветеринарных лабораториях страны. На втором этапе исследования разработанную методику по выявлению вируса РРСС при помощи НРИФ апробировали при тестировании проб патологических материалов, полученных из различных хозяйств РФ. Результаты данных исследований представлены в табл. 2. Из данных табл. 2 видно, что в НРИФ на наличие вируса РРСС было исследовано 717 проб патологических материалов, из них выявлено положительных – 472 (65,82%). Результаты проведенных исследований свидетельствовали о широком распространении РРСС в свиноводческих хозяйствах России. В дальнейшем, пробы патологического материала, в которых при помощи НРИФ был выявлен вирус РРСС, использовали для выделения и адаптации изолятов к перевиваемой культуре клеток MARC-145 с целью дальнейшего изуче31 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ния и оценки их пригодности в качестве производственных штаммов. Выводы Результаты проведенных исследований показывают, что использование метода иммунофлюоресценции в культуре клеток MARC-145, выращенной в микропланшетах, позволяет специфично выявлять наличие вируса РРСС в пробах патологического материала, одновременно исследовать большое количество проб и экономно расходовать все компоненты реакции. РЕЗЮМЕ В статье приведены результаты выявления вируса репродуктивно-респираторного синдрома свиней (РРСС) в пробах суспензий патологических материалов, отобранных от экспериментально инфицированных свиней или полученных из различных свиноводческих хозяйств Российской Федерации, при помощи непрямой реакции иммунофлюоресценции (НРИФ) с использованием монослоя перевиваемой культуры клеток MARC-145. SUMMARY Possibility of indication of porcine reproductive and respiratory syndrome virus in patological materials by indirect immunofluorescence method is shown. Indication of porcine reproductive and respiratory syndrome virus in microplates not only gains time, but also economize all components of essay. Литература 1. Байбиков, Т.З. Репродуктивно-респираторный синдром свиней / Т.З. Байбиков // Вет. врач. 2000. №2. С. 20-24. 2. Использование реакции непрямой иммунофлюоресценции для обнаружения антител к вирусу репродуктивно-респираторного синдрома свиней (РРСС) / В.В.Куриннов, И.Ф. Вишняков, Е.А. Балашова [и др.] // Актуал. вопр. вет. вирусол.: матер. науч.-практ. конф. ВНИИВВиМ «Классическая чума свиней - неотложные проблемы науки и практики». Покров, 1995. С. 151-152. 3. Кукушкин, С.А. Особенности течения и вакцинопрофилактика репродуктивно-респираторного синдрома свиней в Российской Федерации: дис. … канд. вет. наук / Кукушкин Сергей Анатольевич. Владимир, 2000. 176 с. 4. Кукушкин, С.А. Репродуктивно-респираторный синдром свиней (эпизоотология, диагностика, специфическая профилактика) / С.А. Кукушкин // Пром. и племенное свиноводство. 2006. №3. С. 60-61. 5. Мищенко, В.А. Состояние и перспективы исследований по репродуктивно-респираторному синдрому свиней / В.А. Мищенко // Актуал. вопр. вет. вирусол.: матер. науч.-практ. конф. ВНИИВВиМ «Классическая чума свиней - неотложные проблемы науки и практики». Покров, 1995. С 148-151. 6. Суханова, О.В. Разработка средств и методов лабораторной диагностики репродуктивно-респираторного синдрома свиней: дис. … канд. вет. наук. / Суханова Ольга Валентиновна. Покров, 1997. 8. A sensitive fluorescence in situ hybridization technique for detection of porcine reproductive and respiratory syndrome virus / L.L. Chueh, K.H. Lee, C.R. Jeng, V.F. Pang // J. Virol. Methods. 1999. V.79, №2. P. 133-40. Т.Ю. Дегтяревская, Московская медицинская академия им. И.М. Сеченова К.Л. Мальцев, Научно-внедренческий центр Агроветзащита ПАТОМОРФОЛОГИЯ ЛЕГКИХ И ПЕЧЕНИ ПРИ ДИКТИОКАУЛЕЗЕ ОВЕЦ ДО И ПОСЛЕ ЛЕЧЕНИЯ ГЕЛЬМИЦИДОМ Введение В последние годы созданы новые простые и общедоступные в применении лекарственные средства, обладающие широким спектром действия против гельминтов, со слабо выраженным побочным влиянием на организм животного. Гельмицид – новый препарат, произведенный «Научно-внедренческим центром Агроветзащита», разработанный на основе альбендазола и оксиклозанида. Это антигельминтик широкого спектра действия, активен в отношении половозрелых и не32 половозрелых нематод желудочно-кишечного тракта и легких, цестод. Препарат обладает выраженным трематодоцидным действием, губительно действует на все фазы развития Fasciola spp., Paramphistomum spp. и Dicrocoelium lanceatum. Обладая овоцидным действием, снижает зараженность пастбищных животных гельминтами. Целью нашей работы явилось изучение микроморфологических изменений в органах мелкого рогатого скота после действия гельмицида. Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Материалы и методы В опытах было использовано 18 овец (валухов), 10 – 11-месячного возраста породы советский меринос, спонтанно инвазированных диктиокаулюсами. Животных разделили на 2 группы. Первая опытная группа получала препарат перорально, индивидуально в смеси с концентрированными кормами в дозе из расчета 2,5 г гранул на 100 кг массы животного, вторая группа являлась контрольной и препарат не получала. После дегельминтизации по 3 головы животных из группы убивали через 24, 48 и 72 часа, брали органы и проводили патоморфологические исследования. Кусочки тканей овец фиксировали в 10%-ном нейтральном формалине, а также в жидкости Буэна, Карнуа и Ценкера с уксусной кислотой по общепринятым методикам (О.В.Волкова, Ю.К. Елецкий, 1982). После фиксации проводили обезвоживание в спиртах восходящей концентрации, затем через смесь хлороформа с абсолютным спиртом, чистый хлороформ и заливали в парафин. Парафиновые срезы толщиной 7 – 8 мкм окрашивали гематоксилином по Гейденгайну и по методу Маллори. Срезы изучали и фотографировали на МБИ - 15. Результаты исследований и обсуждение Характер патанатомических изменений в легких, вызываемых диктиокаулюсами, находится в зависимости от интенсивности инвазии и формы заболевания. При осмотре бронхо-легочной ткани обнаружены явления воспалительного характера. Слизистая оболочка бронхов резко гиперемирована, покрыта слизью, содержащей гельминтов. Через 24 часа после дачи гельмицида просвет большинства альвеол расширен, стенки склерозированы. Спустя 48 часов после действия гельмицида в просвете альвеол и в межальвеолярных перегородках (зона нахождения паразита) отмечается выраженная инфильтрация, характерная для хронического воспаления в стадии обострения с преобладанием макрофагов. Через 72 часа после применения препарата в легких наблюдается утолщение и склероз межальвеолярных перегородок, скопление в них лимфогистиоцитарных элементов Исследование печени животных, зараженных диктиокаулюсами, показало, что она увеличена в размерах. Наблюдаются Ветеринарная патология. № 3. 2008 изменения с образованием мелкоклеточных инфильтратов. Границы между гепатоцитами становятся плохо различимыми. Нарушается балочное строение. Через 24 часа после дачи гельмицида овцам центральная печеночная вена расширена, отдельные балки поджаты. Спустя 48 часов после действия препарата строение печени сохранено. Выраженное полнокровие крупных и мелких сосудов. Эпителий гепатоцитов зернист. После 72 часов с момента действия препарата балочное строение сохранено, отмечается полнокровие сосудов. В портальных трактах небольшая лимфоидная инфильтрация. Гепатоциты с мутной набухшей цитоплазмой. Заключение. Установлено, что в легких овец (место локализации диктиокаулюсов) преимущественно развивается острое интерстициальное воспаление с очаговой десквамацией эпителия бронхов и явлениями лимфоидно-клеточной инфильтрации. Высокая активность интерстициального воспаления после действия гельмицида сохраняется. Кроме того, отмечается выраженная макрофагальная реакция и разрастание соединительной ткани в местах локализации паразита. Сравнивая полученные результаты по морфологии легких до и после применении антигельминтика можно сделать вывод, что он не оказывает заметного морфологического влияния на ткани легких. В печени овец при спонтанном диктиокаулезе отмечается выраженная белковая зернистая дистрофия гепатоцитов. Характерна воспалительная реакция лимфоидными элементами. Однако, под действием гельмицида в гепатоцитах развивается очаговое мелкокапельное ожирение. При патологических процессах в печени нарушается обмен веществ, метаболизм лекарственного средства и скорость его циркуляции в крови и тканях. Поэтому, при выборе антигельминтного препарата, его дозы и определении схемы лечения необходимо учитывать особенности функционального состояния органа и степень развития болезненного процесса в нем. Так как основными факторами считаются, наряду с экономической выгодой, высокая эффективность и малая токсичность данного препарата, то он может использоваться в борьбе с паразитарными болезнями. 33 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ УДК 636. 082. 4 52/55 В.И. Деряженцев, Т.М. Епишина Всероссийский НИИ племенного дела НОВЫЙ ПРОТЕКТОР СИНТЕТИЧЕСКОЙ СРЕДЫ ДЛЯ РАЗБАВЛЕНИЯ И КРИОКОНСЕРВАЦИИ СПЕРМЫ БАРАНОВ Известно, что в устойчивости сперматозоидов к глубокому замораживанию первостепенную роль играют прочность и характер межмолекулярных связей белков и липидов, водородные связи мембран. При криоконсервации вследствие фазового перехода воды и липидов происходит нарушение этих связей, окисление SН-групп. Это приводит к дестабилизации мембранных белков, потере и инактивации ферментов, перекисному окислению липидов и нарушению метаболизма (Ерохин А.С., Платов Е.М. и др. 1989г., Jones R., Mann T. 1976 ). Этому способствует также предшествующее перед криоконсервацией разбавление нативной спермы, ведущее к существенному уменьшению концентрации химических компонентов плазмы спермы. Поэтому оплодотворяющая способность криоконсервированной спермы значительно ниже по сравнению со свежеполученной спермой. В этой связи необходимо проводить дальнейшие исследования, направленные на поиск более совершенных криопротекторов в составе синтетических сред для разбавления и хранения спермы животных в глубокозамороженном состоянии без потери сперматозоидами основных биологических свойств. С этой целью многими отечественными и зарубежными учеными (Деряженцев В.И. и др 1991, Watson P.F Avderson W.J., 1983) изучается криозащитное воздействие на сперматозоиды животных различных природных и синтетических соединений как перспективных экстрацеллюлярных криопротекторов в составе синтетических сред. По нашему мнению хорошими криопротекторами могут быть природные соединения животного происхождения, которые обладают свойствами поверхностно-активных сорбентов. Одним из таких сорбентов является костный клей, представляющий собой сложное белковое образование - коллаген, относящийся к группе фибриллярных белков - склеропротеидов. Для него характерно высо34 кое содержание глицина (26%), пролина (14%), оксипролина (12%), оксилизина (12%) и полисахаридов (2%). Являясь отличным сорбентом, костный клей в водных растворах хорошо поглощает воду, образуя несколько видов гелей. Имея высокую молекулярную массу - 300000, при включении в состав сред, он существенно не изменяет осмотическое давление, даже при значительных – 20-25% концентрациях. Эти свойства объясняют его большую роль в регуляции водного обмена в различных соединениях. В связи с тем, что ранее костный клей не применялся в составе синтетических сред для криоконсервации спермы животных, в задачу наших исследований входило изучение влияния данного биологического полимера на устойчивость спермы баранов к криоконсервации и хранению в глубокозамороженном состоянии. Методика. Сперму для исследований получали с помощью искусственной вагины от взрослых баранов северо-кавказской породы, принадлежащих ФГУП «Белгородское» по племенной работе. Использовали эякуляты объемом более 0,5 мл, с концентрацией сперматозоидов не ниже 2,5 млрд/мл и подвижностью 8 баллов и выше. При криоконсервации опытных и контрольных партий разбавленной спермы использовали метод разделенного эякулята. При изучении криозащитных свойств костного клея в состав ГЖУК - трис-буферной среды вместо декстрина предварительно вводили различные дозы костного клея, изготовленного Московским заводом «Клейтук» ( ГОСТ 2067-80). Разбавленную таким образом сперму баранов после 2-х часовой эквилибрации замораживали в гранулах по 0,2 мл, на фторопластовой пластине в парах жидкого азота, а затем хранили при -196° С. Для биологического контроля качества криоконсервированной спермы замороженные гранулы оттаивали в водяной бане при 40°С, по одной грануле в стеклянной пробирке с 1мл 3%-ного раствора цитрата натрия. Оценивали на подВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Влияние костного клея в составе ГЖУК-трис-буферной среды на устойчивость сперматозоидов барана к замораживанию Концентрация костного клея в среде, г/100мл Подвижность семени после оттаивания, % Абсолютный показатель живучести, Усл. ед. Концентрация водородных ионов, рН 2,0 43 ± 1,6 334,0 ± 12,5 6,83 2,5 46± 1,3 354,0 ±10,7 6,78 3,0 42± 0,9 282,0 ±13,3 6,70 3,5 41± 1,4 245,0±12,1 6,65 (контроль) 43± 1,5 286,0 ±12,1 6,90 Таблица 2 Влияние костного клея в составе ГЖУК-трис-буферной среды на оплодотворяемость овцематок Криопротектор Костный Клей Декстрин (контроль) Подвижность, балл Абс. показатель Живучести, усл.ед. Осеменено, Голов Объягнилось, гол. - %. 4,5±0,04 374±12,3х 260 149 - 55,3 х 4,2±0,03 315±10,4 285 137 - 44,8 х - Р<0,01. вижность и инкубировали при 38° С. Через каждый час инкубации проверяли активность сперматозоидов вплоть до полной их гибели и вычисляли абсолютный показатель живучести спермы. После подбора оптимальной концентрации костного клея в составе криоконсервированной среды для спермы барана, нами были проведены научно-производственные опыты по искусственному осеменению овцематок. Осеменение проводили двукратно утром и вечером дозами по 0,2 мл замороженно-оттаянной спермы. В качестве контроля использовали ГЖУКтрис-буферную среду. Результаты исследований. Экспериментальные данные по изучению влияния костного клея на биологические показатели сперматозоидов после криоконсервации представлены в таблице 1. Как видно из таблицы 1, самые высокие показатели качества спермы были получены после оттаивания второго опытного образца, где содержалось 2,5% костного клея. Активность сперматозоидов достигала 46%, а абсолютный показатель живучести - 354 усл.ед. Это было выше аналогичных показателей полученных в контроле (среда без костного клея), по активности спермиев на 3%, а по абсолютному показателю живучести - на 23,6%. Полученная разница статистически достоверна Р< 0,01. На основании полученных данных были проведены научно - производственные опыты по изучению влияния оптимальной концентрации костного клея в составе Ветеринарная патология. № 3. 2008 ГЖУК-трис-буферной среды на оплодотворяемость овцематок (таблица 2). Из данных таблицы 2 видно, что костный клей, включенный в состав ГЖУКтрис-буферной среды, как криопротектор лучше способствует сохранению биологической полноценности сперматозоидов после криоконсервации чем декстрин. Подвижность сперматозоидов в опытной среде была равна 4,5 балла, живучесть 374 условных единиц. Это выше, чем было получено в контроле соответственно на 7,0 % и 18,7%. При искусственном осеменении овец в опытной группе объягнилось 55,3% овцематок, а в контроле - 44,8%. Полученная в пользу опыта разница - 10,5%, статистически достоверна, Р<0,01. Таким образом, проведенные нами исследования показали, что криозащитное действие костного клея в составе ГЖУКтрис-буферной среды выше, чем у декстрина. Этот криозащитный эффект, вероятно, обусловлен не только влиянием костного клея на вязкостные свойства синтетической среды, но так же и тем, что являясь прекрасным сорбентом, в водных растворах он способен к образованию ряда агрегатных свойств, т.е. нескольких видов гелей. Эти свойства объясняют его роль в регуляции водного обмена и поддержании изотонии в среде. Защитное действие костного клея в составе сконструированной синтетической среды проявляется также в том, что, являясь природным поверхностно-активным веществом, он адсорбируется на поверх35 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ности сперматозоидов и, как биологический полимер животного происхождения, лучше, чем декстрин выполняет роль криопротектора - способствует поглощению и витрификации воды непосредственно вокруг сперматозоидов, предохраняя их от соприкосновения с кристаллами льда, снижает эвтектическую точку солей. Следова- тельно, защитное действие костного клея на сперматозоиды при их криоконсервации выше, чем у других криопротекторов. Синтетический разбавитель для спермы баранов с содержанием костного клея признан Государственным институтом патентной экспертизы изобретением и на него выдан патент № 2198622 от 2003 года. SUMMARY Our results concluded that the new protector complex medium for dilute and cryoconservation of ram semen at optimal concentrations has cryoprotective effect on the ram semen. Литература 1. Деряженцев В.И., Епишина Т.М. «Научные труды ВНИИ плем » М, 1991, с 9-12. 2. Ерохин А.С., Платов Е.М., Тимофеев К.Н. и др «Доклады ВАСХНИЛ» М, 1989, № 3, с. 30-31. 3. Jones R. , Mann T. Proc. R. Soc. Lond. B., 1976, v. 193, p. 317-333. 4. Watson P.F., Avderson W.J. J.Repr. Fert., 1983, v. 69, p. 229-235. УДК 636. 082. 4 52/55 Т.М. Епишина Всероссийский НИИ племенного дела РЕПРОДУКТИВНЫЕ СПОСОБНОСТИ РЕМОНТНЫХ СВИНОК ПРИ ЭЛЕКТРОСТИМУЛЯЦИИ БИОЛОГИЧЕСКИ АКТИВНЫХ ТОЧЕК Известно, что наступление эструса у ремонтных свинок происходит не синхронно и в условиях промышленной технологии содержания довольно часто у них отмечается задержка полового созревания и нарушение половой цикличности. С целью ускорения наступления полового созревания и синхронизации эструса у ремонтных свинок применяются различные технологические и биологические приемы, в частности стимулируют эструс с помощью иглоукалывания определенных биологически активных точек (Konig R., 1988; Hsia L.C., Lee J.H., 1988). Акупунктура или иглоукалывание применяется в медицинской практике уже на протяжении тысячелетий, но несмотря на очень древнее происхождение акупунктуры, в ветеринарной практике данный метод стал применяться совсем недавно. В исследованиях ряда ученых установлена возможность эффективной стимуляции эструса у свиноматок в послеотъемный период с помощью электро-акупунктурного воздействия на биологически активные точки (Ерохин А.С, Макаров М.И., 2002). 36 В задачу наших исследований входило изучение возможности индуцирования эструса у ремонтных свинок с помощью электростимуляции определенных биологически активных точек. Исследования были выполнены в ЗАО «Мордовский бекон» республики Мордовия на свинках крупной белой породы. В своих экспериментах для электростимуляции биологически активных точек у свиней мы использовали, медицинский портативный электростимулятор «ДЭНАС», воздействующий на точки акупунктуры импульсным током. Сертификат соответствия № РОСС РУ. МЕ27. ВО5035. Сертифицированный орган: РОСС РУ. 0001.11 МЕ27 РЦАРТ 00.000 РЭ. Физические параметры обработки: длительность серий импульсов 4,5 сек.; длительность паузы между сериями импульсов 2 сек; частота импульсного тока 10 Гц. Биологически активная точка №38 расположена на дорзо-медиальной линии между последним поясничным и первым кресцовым позвонком, а точка №41- расположена на дорзо-медиальной линии вблизи корня хвоста. Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица Влияние электро-акупунктурной стимуляции биологически активных точек на индуцирование эструса у ремонтных свинок Изучаемые показатели Обработано свинок, голов Группа ремонтных свинок 1 2 3 (контроль) 130 135 132 140 Общая продолжительность электростимуляции 2х точек у свиней, мин. 5 10 15 - Проявление признаков эструса в течение 12 дней после стимуляции: голов 48 84 х 72 х 45 36,9 62,2 х 54,5 х 32,1 8,7±0,6 6,9х ±1,0 7,5х±0,9 9,2±0,7 40 71 61 38 83,3 84,5 84,7 84,4 9,6±0,3 10,1±0,6 10,0±0,5 9,9±0,7 Средний вес поросенка, кг: при рождении 1,31±0,08 1,34±0,06 1,28±0,07 1,30±0,1 при отъеме в 60 дней 19,2±0,8 19,3±1,0 19,3±0,6 19,2±0,9 98,8 99,2 98,2 98,8 % Средний интервал времени от стимуляции до наступления эструса, дней Опоросилось: голов % Среднее многоплодие маток, голов Сохранность поросят к отъему, % х – Р<0,05 Для проведения эксперимента было сформировано 4 группы ремонтных свинок в возрасте 9-10 месяцев. У свинок 1й, 2й и 3й опытных групп проводили однократную электростимуляцию биологически активных точек №38 и №41 в течение 2;5; 5 и 7,5 минут на каждую точку соответственно. Общее время стимуляции двух точек соответственно составляло 5; 10 и 15 минут. У свинок контрольной группы данную обработку не проводили. Искусственное осеменение свинок всех групп проводили дважды в течение эструса. В экспериментах было изучено влияние электропунктурной стимуляции данных биологически активных точек на сроки наступления эструса у ремонтных свинок после обработки, их оплодотворяемость, многоплодие и энергию роста поросят. Результаты опыта суммированы в таблице. Из данных таблицы видно, что однократная электростимуляция двух биологически активных точек (41 и 38) на протяжении 10 и 15 минут, оказала заметный стимулирующий эффект на индуцирование эструса у ремонтных свинок. При этом проявление признаков эструса в течение 12 дней после электростимуляции в 1ой опытной группе отмечено у 36,9 % свинок; во 2ой у 62,2 %; в 3ей у 54,5 % в сравнении с 32,1 % в контроле. Кроме того, средний интервал времени Ветеринарная патология. № 3. 2008 от электростимуляции до наступления эструса в Гй; 2й и 3й группах был соответственно короче на 2,1%; 25 % и 18,5% по сравнению с контролем: 9,0; 6,9 и 7,5 дня против 9,2 дней в контроле. По другим изученным показателям различий между группами выявлено не было. Оплодотворяемость свинок, их многоплодие и сохранность поросят были практически на одном уровне во всех группах. Более короткая общая продолжительность электростимуляции двух биологически активных точек в первой группе (5 минут) не оказала статистически достоверного положительного влияния на стимуляцию эструса у ремонтных свинок. Таким образом, результаты этого эксперимента показали, что однократная последовательная электро-акупунктурная стимуляция у ремонтных свинок двух определенных биологически активных точек, с общей продолжительностью времени 10-15 минут, оказала заметный стимулирующий эффект на индуцирование эструса. Полученные результаты свидетельствуют о перспективности использования электропунктурной стимуляции для индуцирования эструса у ремонтных свинок. Исследования в данном направлении необходимо продолжить на большем поголовье животных с дальнейшей оценкой репродуктивных показателей ремонтных свинок. 37 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ РЕЗЮМЕ Изучено влияние электро-акупунктуры на индуцирование эструса у свинок. Наши результаты свидетельствуют, что электро-акупунктура оказала заметный стимулирующий эффект на индуцирование эструса у свинок. SUMMARY Effect of the electro - acupuncture on inducing of estrus by pigs. Our results concluded that electro acupuncture help to unduce estrus of the pigs. Литература 1. Ерохин А.С, Макаров М.И. Стимуляция эструса у свиней с помощью электроакупунктуры // Зоотехния. 2002. № 12. с. 24-25. 2. Казеев Г.В. Ветеринарная акупунктура. М. 200 398 С. 3. Konig R. Does acupuncture help to unduce estrus // Pigs. 1988. V. 2. N2 2. P. 13-14. 140. 4. Hsia L.C., Lee J.H. Inducing of estrus by acupuncture //Pig. I. 1988. April. P. 24-27. УДК 636.2:637.04:57.088:577.2 Е.И. Кийко, В.Н. Кургузкин, Ю.В. Саморуков, Н.С. Марзанов ВИЖ, п. Дубровицы, Подольский район, Московская область ОЦЕНКА АЛЛЕЛОФОНДА БЫКОВПРОИЗВОДИТЕЛЕЙ ПО КАППА-КАЗЕИНУ И BLAD-СИНДРОМУ Современные молекулярно-биологические методы позволяют по образцу ДНК, выделенной от животного, устанавливать генотип по тому или иному локусу и, следовательно, прогнозировать развитие определенных признаков. Так, например, на основе использования метода ПЦР-ПДРФ можно выявлять носительство BLAD-синдрома, устанавливать генотипы по локусу каппа-казеина (κ-CN). Интерес исследователей к изучению генетического полиморфизма белков молока связан с тем, что их генетически детерминированные варианты оказывают влияние на конкретные признаки молочной продуктивности и, соответственно, могут быть использованы в качестве прямых генетических маркеров хозяйственно-ценных признаков [Сулимова Г.Е., 1998]. В последние годы в селекции молочного скота, особенно при оценке быков по качеству потомства, большое значение стали придавать качественной и количественной характеристике каппа-казеина в молоке. Обычно количество каппаказеина составляет около 80% от общего количества белка в коровьем молоке, и он представлен в основном двумя полиморфными генетическими вариантами: κCNА и κ-CNВ из 13 выявленных у различных видов крупного рогатого скота (Bos genus: В. taurus, В. indicus, В. grunnniens, В. javanicus) [Сулимова Г.Е., 1998]. Извес38 тно, что аллель В положительно ассоциирует с содержанием общего белка и казеина в молоке, а также с технологическими свойствами молока при производстве белковомолочных продуктов. Молоко, полученное от коров с генотипом ВВ, обладает более высоким содержанием белка и выходом сыра и творога, а также лучшими коагуляционными свойствами, соответствует лучшей консистенции и композиции при изготовлении твёрдых сыров. Таким образом, ген каппа-казеина связан с конкретными экономически значимыми признаками. Поэтому обосновано ведение селекции на увеличение частоты аллеля В каппа-казеина. BLAD-синдром крупного рогатого скота - наследственная аутосомная болезнь рецессивного типа, которая является мутацией, проявляющейся в дефиците адгезии лейкоцитов. Данная мутация обуславливает резкое снижение устойчивости телят к бактериальным инфекциям, предрасположенность к респираторной инфекции и диарее. Фенотипическое проявление данного генетического дефекта обусловлено точечной мутацией в кодирующей части аутосомного гена CD 18. Этот ген контролирует синтез гликопротеида κ-интегрина, играющего ключевую роль в миграции нейтрофилов к очагу воспаления. Фенотипически мутация проявляется только у гомозиготных животных, которые, как правило, гибВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Полиморфизм гена каппа-казеина у быков-производителей различных пород Кол-во животных Распределение Черно-пестрая 14 Черно-пестрая голштинская Красно-пестрая голштинская 7 16 КПГ х С 10 Симментальская 38 Айрширская 5 Красная степная 4 Джерсейская 3 Н* О Н 0 Н О Н О Н О Н О Н О Н О Порода Частота генотипов, % Частота аллелей χ2 АА АВ ВВ А В 85,71 86,49 71,43 50,41 62,5 60,84 60,00 56,25 39,48 43,56 80,00 81,00 75,00 75,69 33,33 44,89 14,29 13,02 0 41,18 31,25 34,32 30,00 37,5 52,63 44,88 20,00 18,00 25,00 22,62 66,67 44,22 0 0,49 28,57 8,41 6,25 4,84 10,00 6,25 7,89 11,56 0 1,00 0 1,69 0 10,89 0,928 0,072 0,62 0,714 0,286 98,27 0,781 0,219 0,73 0,75 0,25 4 0,658 0,342 2,89 0,90 0,10 1,23 0,875 0,125 1,95 0,667 0,333 15,26 * Н - наблюдаемое; О - ожидаемое нут в первые месяцы жизни. Экономический ущерб при распространении BLAD осложняется еще тем, что проявление диарей и пневмоний у молодняка вызывает необходимость проведения ветеринарных мероприятий, которые, как правило, оказываются малоэффективными [Яковлев А. и др., 2004]. Данное заболевание считается наиболее изученным из всех известных наследственных патологий животных. Целью данной работы является характеристика аллелофонда у быков-производителей 8 пород по генетическим маркерам (BLAD и каппа-казеин). В связи с этим, в задачу исследований входило проведение оценки генетической структуры по локусу каппа-казеина у 97 быков-производителей черно-пестрой, голштинской черно-пестрой (ЧПГ), голштинской красно-пестрой (КПГ), симментальской, помесей симментальская х красно-пестрая голштинская (С х КПГ), айрширской, джерсейской и красной степной породам крупного рогатого скота, принадлежащих ОАО по племенной работе «Тамбовское» (табл. I). У исследованных животных черно- и красно-пестрого голштинизированного скота отсутствовали носители мутантного гена BLAD-синдрома. Анализ генетической структуры у 8 исследованных пород и помесных животных ОАО по племенной работе «Тамбовское» проводили путем определения встречаемости генотипов и аллелей, оценки генетического равновесия на основе χ2. Как видно из табл. I, во всех 8 породах крупного рогатого скота наблюдается преобладаВетеринарная патология. № 3. 2008 ние аллеля А каппа-казеина. В то же время частота аллеля В колеблется от 0,342 до 0,072. Наиболее высокий результат наблюдается соответственно у симментальской (0,342) и джерсейской пород (0,333). Вместе с тем анализ, проведенный с использованием χ2, показывает о превалировании у большинства пород гомозигот над гетерозиготами. Исключением являлись симментальская и джерсейская породы, у которых соответственно число гетерозигот превалировало над гомозиготами. Нарушение генетического равновесия по локусу каппаказеина отмечали у джерсейской за счет дефицита гомозигот и избытка гетерозигот (χ2 = 15,26; df = 1; р < 0,01) и у голштинской черно-пестрой породы, наоборот, за счет дефицита гетерозигот и избытка гомозигот (χ2 = 98,27; df = 1; р < 0,01). У всех остальных исследованных популяций быков данная система находилась в состоянии генетического равновесия. Исходя из данных табл. 1 следует, что у обильно молочных популяций скота частота встречаемости аллеля κ-CNВ отражает в целом ситуацию проблемы низкой белковомолочности и ведения однонаправленной селекционно-племенной работы на повышение удоя и получения от них в основном «питьевого» молока [Марзанов Н.С. и др., 2005]. В ряде литературных источников имеются данные о том, что при увеличении интенсивности отбора наблюдается снижение частоты встречаемости аллельного варианта В каппа-казеина. Этот аллельный вариант как бы «вымывается» из генотипа 39 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ животных [Сулимова Г.Е. и др., 1992]. Таким образом, для улучшения качества молока необходимо максимально использовать быков с генотипом ВВ или АВ и закреплять их за коровами и телками, имеющими аллель В (ВВ или АВ) для получе- ния или выведения животных с генотипом каппа-казеина ВВ. Накопление животных с генотипом каппа-казеина ВВ или АВ возможно только при целенаправленном отборе быков-производителей и формировании отдельных групп коров. SUMMARY The article presents the results from test for k-casein gene in sire bulls of 8 breeds and hybrids, belonging to Animal Improvement Organization «Tambovskoye»(Russia).Obtained information used with a view of animal classification by level of k-CnB gene frequency. Among the tested holsteinized red and white bulls, there is no evidence presents of BLAD- gene carriers. Литература 1. Сулимова Г.Е. Молекулярно-генетический анализ генома животных и человека с использованием ДНК-маркеров // Автореф. дис. докт. биол. наук. Москва. 1998. 50 с. 2. Яковлев А., Терлецкий В., Митрофанова О., Дементьева Н. Определение носителей генетических дефектов среди быков-производителей // Молочное и мясное скотоводство. 2004. №7. С. 31-32. 3. Марзанов Н.С., Саморуков Ю.В., Ескин Г.В. Ге- нетические исследования животных в России и за рубежом. Материалы международного научно-практического семинара. Быково. 2005. С. 6-10. 4. Сулимова Г.Е., Соколова С.С, Семикозова О.П. и др. Анализ полиморфизма ДНК кластерных генов у крупного рогатого скота: гены казеинов и гены главного комплекса гистосовместимости(BOLA) // Цитология и генетика. 1992. № 5. С. 18-26. УДК 57.063.7 : 576.535 : 57.088.1 К.В. Кулешов ВНИИ экспериментальной ветеринарии им. Я.Р. Коваленко РАСХН (ВИЭВ), Москва (Россия) лаборатория клеточной биотехнологии ВИДОВАЯ ИДЕНТИФИКАЦИЯ КЛЕТОЧНЫХ КУЛЬТУР: РАЗРАБОТКА НОВЫХ ПОДХОДОВ ОСНОВАННЫХ НА ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ДЕТЕКЦИЕЙ ПРОДУКТА В РЕАЛЬНОМ ВРЕМЕНИ (ПЦР-РВ) Введение Длительно культивируемые клеточные линии человека и животных широко применяются как модельная система во многих отраслях экспериментальной биологии и ветеринарии. В Коллекции ВИЭВ депонировано большое количество клеточных линий и их сублиний от сельскохозяйственных животных основную часть составляют культуры клеток, полученных от коровы (71), овцы (17), свиньи (65) (Дьяконов Л.П., Ситьков В.И., 2000). Эти линии активно используются для вирусологических целей, получения гибридных культур клеток и исследовательской работы в разных областях иммунологии, биохимии, молекулярной биологии и генетики. Одной из основных задач при длительном культивировании клеток является периодическая оценка (мониторинг) их ви40 довой принадлежности. Ранние методы видовой идентификации клеток в культуре были основаны на анализе белкового полиморфизма (Gartler, 1968; Tsareva et al., 1976). Изоферментный анализ используется и сегодня как один из основных методов видовой идентификации клеточных линий (Hay, 1992; Parodi et al., 2002; Stacey et al., 1992). Позднее был предложен ряд подходов, связанных с окраской видоспецифическими антителами и цитогенетическим анализом (Clausen and Syverton, 1962; Coriell et al., 1958; Defendi et al., 1960; Simpson and Stulberg, 1963). В 1990-х гг. в связи с значительным прогрессом молекулярной биологии особое значение приобрели методы молекулярно-генетического анализа, основанные на полимеразной цепной реакции (ПЦР) (Cooper et al., 2007; Hay, 1992; Liu et al., 2008; Losi et al., Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ 2008; Milanesi et al., 2003; Ono et al., 2007; Parodi et al., 2002; Stacey et al., 1992; Steube et al., 2008; Steube et al., 2003). В последнее время особую актуальность приобретают методы основанные на ПЦР с детекцией продукта в реальном времени. Для данного подхода характерна более высокая чувствительность и специфичность, в сравнении с традиционными методами детекции основанными на электрофоретическом разделении продуктов. Целью данной работы являлась разработка методики анализа видовой принадлежности клеточных линий, полученных от коровы, овцы и свиньи на основе полимеразной цепной реакции с гибридизационно-флюоресцентной детекцией продуктов амплификации в режиме реального времени (ПЦР-РВ). Материалы и методы. Материалом для исследований являлись клеточные культуры, депонированные в Коллекции ВИЭВ полученные от свиньи (СПЭВ, А4С2, ПК-15), коровы (ЛЭК, МДБК, ПТ-80) и овцы (ПО2, ПОхСО). Было проанализировано по 3 закладки каждой из клеточной культур и их сублиний. Тотальную ДНК из культуры клеток выделяли с использованием коммерческого набора Рибопреп (ФГУН «ЦНИИЭ» Роспотребнадзора) согласно инструкциям производителя. На стандартное выделение брали 100 мкл суспензии концентрацией 1х105 клеток/мл. Панель контрольных образцов включала в себя ДНК выделенную из тканей: человека, свиньи, кошки, собаки, кролика, крысы, мыши, коровы (4 породы), овцы (4 породы) и свиньи (3 породы). Из тканей ДНК выделяли используя Протеиназу К с экстракцией фенол-хлороформной смесью и преципитацией солями (Sambrook et al., 2001). Чистоту и концентрацию полученной ДНК оценивали на спектрофотометре (Nanodrop, США). Для оценки чувствительности реакции готовили десятикратные разведения клеточной суспензии 1 – 1Ч106 кл/мл с последующим выделением ДНК. Анализ эффективности амплификации в ПЦР-РВ определяли, используя десятикратные разведения ДНК (7 точек) минимум по 3 повторности на точку, выделенной из 106 клеток, видовая принадлежность которых была подтверждена ранее. Амплификацию мишени с детекцией в режиме реального времени проводили на приборе RotorGene 6000 (Corbett Research, Австралия). ПЦР смесь в объВетеринарная патология. № 3. 2008 еме 25 мкл включала: по 6 пмоль каждого из двух видоспецифических праймеров, 3 пмоль зонда, дНТФ 200 мкМ каждого, 1x ПЦР-буфер с ионами магния и Taq-полимеразой (Синтол, Россия) и образец выделенной ДНК в объеме 10 мкл. Температурный цикл был следующим: начальная денатурация – 950С 5 минут, затем 10 раундов с повышенной температурой отжига и без детекции флуоресцентного сигнала: 950С – 20 секунд, 610С – 25 секунд, 720С – 20 секунд. Последующие 35 раундов проводили с детекцией флуоресценции на стадии отжига праймеров, 950С – 20 секунд, 60 0С – 25 секунд, 720С – 20 секунд. Результаты исследований. В качестве мишени для идентификации видов Sus scrofa, Ovis aries, Bos taurus выбраны участки генов митохондриальной ДНК (мтДНК), кодирующие белки цитохром b и субъединицу I цитохром с-оксидазы (cytb и соxI). В качестве внутреннего контроля образца использовали гомологичный участок среди всех эукариот участок 18S рибосомальной ДНК (рДНК). Для дизайна праймеров и зондов использовали последовательности мтДНК депонированных в GeneBank от 10 разных видов животных. Специфичность подобранных праймеров и зондов оценивали на наличие гомологии со всеми последовательностями в GeneBank, используя программу BLAST (Altschulet al. 1997). Температуру отжига праймеров и зондов рассчитывали по программе Primer Select (DNAStar, США). Название праймеров и зондов для идентификации мтДНК свиньи, коровы и овцы, а также 18S рДНК приведены в таблице. Праймеры SsF и SsR, предложенные (Cooper et al., 2007), модифицировали добавлением нуклеотидов к 5’-концу с целью оптимизации температуры отжига. Зонд SsZ2 rev соответствовал линейному типу (TaqMan) c температурой отжига 680С, при этом сохранял стабильную вторичную структуру при 530С. Для увеличения температуры отжига и эффективного тушения флуорохрома на АТ-богатых последовательностях мтДНК коровы и овцы подобраны длинные зонды OaZ и BovZ1 (27-29 п.о.), которые имели стабильную вторичную структуру в виде шпильки при температуре не выше температуры гибридизации с мишенью. Данная структура трех олигонуклеотидных зондов, конъюгированных с флуоресцентными красителями позволяет проводить детекцию флуоресценции как во время ПЦР, так и после 41 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица Вид животного Название праймеров и зондов Sus scrofa (свинья) Ovis aries (овца) Bos Taurus (корова) Внутренний контроль (18S рДНК) SsF SsR R6G-SsZ2 rev OaF OaF FAM-OaZ BtF BtR ROX-BovZ1 ICF ICR FAM-ICZ1 Размер ампликона, п.о. 460 169 675 143 Рис. 1 Кривые флуоресценции при оценке специфичности праймеров и зондов для идентификации мтДНК коровы (А), свиньи (Б), овцы (В) разных пород (пунктирная линия) и клеточных культур (сплошная линия). Внутренний контроль панели контрольных образцов и исследуемых культур клеток (Г). окончания реакции, что позволяет использовать в качественном формате детекции простые флуоресцентные детекторы (например, Ala-1 «Биосан», Латвия). Видоспецифичность выбранных праймеров и зондов оценивали на панели ДНК, выделенной из десяти видов животных, вместе с тем, исследовали культуры клеток на их видовую принадлежность. При анализе панели контрольных образцов и клеточных культур с праймерами и зондами специфичными к мтДНК Bos 42 taurus, положительный результат наблюдался только в образцах содержащих ДНК коров разных пород и ДНК клеточных культур ЛЭК, МДБК и ПТ-80 (Рис. 1А). Видоспецифическая ПЦР-РВ на панели контрольных образцов и клеточных культур с праймерами и зондами специфичными к мтДНК Sus scrofa, положительный результат обнаруживался в образцах только с ДНК свиней разных пород и с клеточными культурами СПЭВ, А4С2, ПК-15 (Рис. 1Б). Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис.2. Графики кривых флуоресценции при детекции свиной (А) и овечьей (Б) мтДНК в смеси клеток ПО2 (≈100000 клеток) : СПЭВ (≈1 клетка). При анализе с той же панелью образцов, но с праймерами и зондами, специфичными к мтДНК Оvis aries, положительный результат наблюдался только в образцах куда вносили ДНК овец разных пород и клеточных культур ПО2, ПОхСО (Рис. 1B). Наличие ДНК во всех образцах подтверждено положительным результатом амплификации участка 18S рДНК (Рис. 1Г). Чувствительность ПЦР-РВ оценивали, используя суспензии клеточных культур СПЭВ, МДБК, ПО2 содержащих от 1– 1Ч106 кл/мл, видовая принадлежность, которых была уже подтверждена в видоспецифической ПЦР-РВ. Предел детекции метода для культур клеток каждого вида варьировал от 0,1 до 1 геном-эквивалента на миллилитр питательной среды (1 ГЭ/ мл соответствует 1 клетке в мл питательной среды), что свидетельствует об аналитической надежности и возможности обнаружить следовые количества клеток. Эффективность ПЦР-РВ для детекции мтДНК коровы, свиньи и овцы составила 96%, 97,3%, 98% соответственно, при коэффициенте детерминации R2 = 0,99. Чтобы определить возможность данного метода выявлять межвидовую клеточную контаминацию был поставлен эксперимент, где клеточные культуры СПЭВ, МДБК и ПО2 смешивали друг с другом в различных соотношениях. Последующая постановка ПЦР-РВ с праймерами и зондом к мтДНК свиньи, овцы и коровы показала, что данный метод способен надежно обнаружить приблизительно 1 клетку в Ветеринарная патология. № 3. 2008 присутствии порядка 100 тыс. клеток другого вида (Рис. 2). Выводы В статье впервые представлен метод видовой идентификации клеточных культур с помощью подобранных нами видоспецифических праймеров и зондов к митохондриальной ДНК, который основан на полимеразной цепной реакции с детекцией продукта амплификации в режиме реального времени (ПЦР-РВ). По сравнению с ранее предложенными подходами для видовой идентификации клеточных культур, где в качестве мишени применялись ген альдолазы, ген b-актина, короткие диспергированные повторы (SINE), мтДНК является наиболее предпочтительной. Многокопийность последовательности мтДНК (120 – 1700 копий на клетку (Robin and Wong, 1988)), напрямую влияет на чувствительность метода, что позволяет выявлять даже следовые количества клеток. Использование видоспецифического зонда наряду с видоспецифическими праймерами увеличивает число генотипирующих позиций, и соответственно повышает специфичность реакции при высоких количествах посторонней ДНК в реакционной смеси. Применение зондов с разными флуорофорами, в отличии от использования красителей-интерколяторов, позволяет разработать надежную мультиплексную систему для одновременной детекции мтДНК нескольких видов в одной реакции. 43 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Метод детекции основанный на измерении интенсивности флуоресценции продукта реакции в реальном времени позволяет избежать риска контаминации ампликонами, который значительно повышается при электрофоретической детекции продукта, а также упростить процедуру исследования. С помощью данного метода идентифицирована видовая принадлежность 8 культур клеток и их 17 сублиний. Метод явля- ется предпочтительным по сравнению с используемыми в настоящее время кариологическим и изоферментным анализами и традиционной видоспецифической ПЦР и электрофоретической детекцией продуктов. Являясь полуколичественным, метод позволяет оценить концентрацию контаминирующих клеток. Метод может быть использован в качестве видоспецифического внутреннего контроля при экспертизе и сертификации биологических материалов. РЕЗЮМЕ Одной из основных задач при длительном культивировании клеток является периодическая оценка их видовой принадлежности. Нами разработан новый подход к идентификации клеточных линий следующих видов: Ovis aries (овца), Bos taurus (корова) and Sus scrofa (свинья). Метод основан на полимеразной цепной реакции с детекцией продукта амплификации в режиме реального времени (ПЦР-РВ). Для видовой идентификации в качестве мишени выбраны последовательности митохондриальной ДНК, кодирущие цитохром b и субъединицу I цитохром с-оксидазы. Валидированы праймеры и зонды, позволяющие добиться специфичности ПЦР. Высокая чувствительность метода позволяет надежно выявлять единичные клетки постороннего вида в смеси с значительно большим количеством (порядка сотен тысяч) клеток другого вида. С помощью данного метода идентифицирована видовая принадлежность 8 культур клеток и 17 сублиний. Метод является предпочтительным по сравнению с используемыми в настоящее время кариологическим и изоферментным анализами и традиционной видоспецифической ПЦР и электрофоретической детекцией продуктов. SUMMARY Testing of species specificity is a major requirement to maintain the identity of cell lines during long-term culturing. We developed a new method of identification of cell lines from the following species: Ovis aries (sheep), Bos taurus (cow) and Sus scrofa (pig) . The method is based on polymerase chain reaction with real time detection of the amplification product. For species identification the sequences of mitochondrial DNA encoding cytochrome b and cytochrome c oxidase were used. Specificity of PCR was achieved with validated primers and probes. High sensitivity of the method allowed to reliably detect single cells of an irrelevant species as an admixture to hundreds of thousands cells of the species whose identity is analyzed. Eight cell lines and 17 sublines were tested, and their identity was confirmed. Thus, our method is advantageous over conventional karyologic and isoenzyme analyses or traditional PCR-based, electrophoresis-assisted identification of species. Литература 1. Дьяконов Л.П., Ситьков В.И. (ред.). Животная клетка в культуре. М.: «Спутник+», 2000, 400 с., илл. 2. Altschul SF, Madden TL, Schaeffer AA, Zhang J, Zhang Z, Miller W, Lipma DJ (1997) Gapped BLAST and PSI BLAST:a new generation of protein database search programs. Nuc Acid Res 25:3389-3402 3. Clausen J.J. Comparative chromosomal study of 31 cultured mammalian cell lines [Text]/ Clausen J.J., Syverton J.T. // J Natl Cancer Inst. 1962. Vol. 28. P. 117-45. 4. Cooper J. Species identification in cell culture: a two-pronged molecular approach [Text]/ Cooper J.. [et al.] // In Vitro Cellular & Developmental Biology Animal. 2007. Vol. 43. № 10. P. 344-351. 5. Coriell L.L. Common antigens in tissue culture cell lines [Text]/ Coriell L.L., Tall M.G., Gaskill H. // Science. 1958. Vol. 128. № 3317. P. 198-9. 6. Defendi V. Immunological and karyological criteria for identification of cell lines [Text]/ Defendi V., Billingham R.E., Silvers W.K., Moorhead P. // J Natl Cancer Inst. 1960. Vol. 25. P. 359-85. 7. Gartler S.M. Apparent Hela cell contamination of human heteroploid cell lines [Text]/ Gartler S.M. // Nature. 1968. Vol. 217. № 5130. P. 750-1. 8. Hay R.J. Methods for authenticating cell lines [Text]/ Hay R.J. // Dev Biol Stand. 1992. Vol. 76. -. - P. 25-37. 9. Liu M. Rapid identification and authentication of closely related animal cell culture by polymerase chain reaction [Text]/ Liu M., Liu H., Tang X., Vafai A. // In Vitro Cell Dev Biol Anim. 2008. Vol. 44. № 7. 44 P. 224-227. 10. Losi C. An alternative method to isoenzyme profile for cell line identification and interspecies crosscontaminations: cytochrome b PCR-RLFP analysis [Text]/ Losi C., Ferrari S., Sossi E., Villa R., Ferrari M. // In Vitro Cellular & Developmental Biology Animal. 2008. 11. Milanesi E. Molecular detection of cell line crosscontaminations using amplified fragment length polymorphism DNA fingerprinting technology [Text]/ Milanesi E.. [et al.] // In Vitro Cell Dev Biol Anim. 2003.Vol. 39. № 3-4. P. 124-30. 12. Ono K. Species identification of animal cells by nested PCR targeted to mitochondrial DNA [Text]/ Ono K.. [et al.] // In Vitro Cell Dev Biol Anim. 2007. Vol. 43. № 5-6. P. 168-75. 13. Parodi B. Species identification and confirmation of human and animal cell lines: a PCR-based method [Text]/ Parodi B.. [et al.] // Biotechniques. 2002. Vol. 32. № 2. P. 432-4, 436, 438-40. 14. Robin E.D. Mitochondrial DNA molecules and virtual number of mitochondria per cell in mammalian cells [Text]/ Robin E.D., Wong R. // J Cell Physiol. 1988. Vol. 136. № 3. P. 507-13. 15. Simpson W.F. Species Identification of Animal Cell Strains by Immunofluorescence [Text]/ Simpson W.F., Stulberg C.S. // Nature. 1963. Vol. 199. P. 616-7. 16. Stacey G.N. DNA fingerprinting transforms the art of cell authentication [Text]/ Stacey G.N., Bolton B.J., Doyle A. // Nature. 1992. Vol. 357. № 6375. P. 261-2. 17. Steube K. Identification and verification of rodent cell lines by polymerase chain reaction [Text]/ Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Steube K., Koelz A.-L., Drexler H. // Cytotechnology. 2008. Vol. 56. № 1. P. 49-56. 18. Steube K.G. A simple method using beta-globin polymerase chain reaction for the species identification of animal cell lines-a progress report [Text]/ Steube K.G., Meyer C., Uphoff C.C., Drexler H.G. // In Vitro Cell Dev Biol Anim. 2003. Vol. 39. № 10. P. 468-75. 19. Tsareva A.A.Isoenzyme characteristics of glucose- 6-phosphage dehydrogenase and lactate dehydrogenase of continuous cells from the collection of the Sverdlovsk Research Institute of Virus Infections [Text]/ Tsareva A.A., Glinskikh N.P., Dreizin R.S., Kolesnikova G.G., Zhdanov V.M. // Vopr Virusol. 1976. № 5. P. 620-3. 20. Molecular cloning : a laboratory manual / Sambrook, Joseph; Russell, David W. 3rd ed. New York: Cold Spring Harbor Laboratory, 2001. УДК:619:616.391:636.5(07) Н.К. Лисун Кафедра клинической диагностики и болезней молодняка ФГОУ ВПО МГАВМиБ им. К.И. Скрябина ПРИМЕНЕНИЕ КОРМОВОЙ ДОБАВКИ ГУМИВАЛ В СХЕМАХ ИММУНИЗАЦИИ ЦЫПЛЯТ-БРОЙЛЕРОВ В борьбе с инфекционными заболеваниями все большее значение приобретают методы специфической профилактики. Вакцинация – необходимое средство защиты от инфекционных болезней, от которой мы не можем отказаться. Ряд вакцин являются обязательными. В тоже время многие из них вызывают осложнения: токсические реакции, связанные с остаточной токсичностью препаратов; аллергические (местные и общие) реакции; поражения нервной системы; обострение латентных процессов и хронических очагов инфекции, а также повышение температуры тела, угнетение, отказ от корма. Число животных с такими осложнениями достигает иногда 20-30%. Иммунизация, как первичный контакт с антигеном, должна быть безвредной, причем вероятность осложнений при вакцинации должна быть меньше, чем ожидаемый риск заболевания с его собственными осложнениями. Другая проблема вакцинации- выработка напряженного длительного иммунитета, способного защитить каждую привитую птицу от заражения. Большинство вакцин не гарантируют этого, иногда по причине низкой иммуногенности самой вакцины, иногда в связи с недостаточной реактивностью иммунной системы вакцинированного животного. Для повышения иммунного ответа организма птицы на проводимые специфические мероприятия в условиях интенсивного ведения отрасли, чаще всего используют препараты, стимулирующие естественную резистентность и иммунный ответ Ветеринарная патология. № 3. 2008 организма птицы. Сравнительно новым направлением специфической профилактики инфекционных болезней является сочетанное применение вакцин и иммуномодуляторов. Ранее исследователями проводился ряд работ направленных на использование иммуномоделирующих препаратов в схемах вакцинации птиц. Большинство из них применялись парентерально, что в масштабах промышленного птицеводства, крайне затруднительно. В связи с этим разработка новых схем и средств повышения эффективности специфической профилактики болезней птиц, а также удобство применения иммуномодулирующих препаратов является актуальной проблемой и требует решения. Выяснение эффективности и целесообразности использования кормовой добавки Гумивал для повышения специфической профилактики в условиях промышленного птицеводства и явилось целью нашего исследования. ГУМИВАЛ – кормовая добавка, используемая для улучшения продуктивности сельскохозяйственных животных на основе натриевых и калиевых солей гуминовых кислот (от 60 до 90% действующего вещества (ДВ)). Не содержит генномодифицированные организмы. Представляет собой порошок от темно-коричневого до черного цвета с размером частиц не более 2 мм, растворимый в воде, хорошо распределяемый в массе корма. Длительное применение не вызывает привыкания, токсических и аллергических реакций, нарушений в обмене веществ. 45 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Побочных явлений и осложнений после применения ГУМИВАЛА не установлено, за исключением индивидуальной непереносимости. Для проведения научно-исследовательской работы по изучению влияния гуминовых производных на показатели естественной резистентности цыплят-бройлеров при осуществлении мероприятий специфической профилактики мы поставили перед собой следующие задачи: - разработать схемы применения гумивала в системе специфической профилактики с учетом плановых вакцинаций цыплят- бройлеров; -определить напряженность иммунитета после вакцинаций на фоне применения гумивала; - обосновать возможность применения гумивала для повышения интенсивности выработки специфических антител и профилактики поствакцинальных осложнений у цыплят-бройлеров в промышленном птицеводстве. Научно-производственный опыт проводился на базе ООО ПТФ «Мирная», Люберецкий район Московской области. Материалом для проведения работы послужили 12000 голов цыплят-бройлеров кросса «Конкурент-1» завозимые из ОНО ППЗ «Конкурсный». Сформировали две группы (опытную и контрольную) по 6000 голов в каждой разместили в разные птичники. Условия содержания всех цыплят на протяжении всего времени откорма (1-36 дней) были одинаковыми. Система содержания - напольная, поение - групповые поилки, кормление - гранулированный комбикорм. Разработали схему применения гумивала с учетом плановых вакцинаций цыплят -бройлеров (инфекционная бурсальная болезнь, болезнь Ньюкасла, инфекционный бронхит кур). В опытной группе по разработанной нами схеме с 1 по 7 сутки, с 10 по 14, с 28–33 сутки жизни перед плановыми вакцинациями и для снижения поствакцинальных осложнений после них, выпаивали питьевую воду с кормовой добавкой гумивал. В первые два периода - в дозе препарата 0,025 г, а в третий – 0,075 г на цыпленка. Нужный объем препарата рассчитывали, исходя из количества и массы обрабатываемых цыплят; готовили маточный раствор в соответствии с наставлением и доводили до необходимой концентрации. За животными вели ежедневное наблюдение, учитывая общее состояние, прием корма, употребление раствора гумива46 ла при водопое, сохранность поголовья, привесы живой массы. Лабораторные исследования по определению напряженности иммунитета на основе определения титров противовирусных антител (ИФА) к болезни Ньюкасла, инфекционной бурсальной болезни, и инфекционному бронхиту кур проводили в Государственном учреждении научной методической лаборатории МСХ РФ в отделе болезней птиц ПЦР и ИФА. При анализе напряженности иммунитета к вирусу болезни Гамборо (ИББ) у цыплят - бройлеров в опытной группе у всех птиц установлены титры специфических антител, т.е. через две недели после вакцинации все 100%-е поголовье группы иммунологически защищено. Средний титр и коэффициент корреляции в опытной группе соответствуют нормам, принятым в лаборатории, они составили: Ср.Т. = 3250 (С.Г.Т .= 3070), %КВ = 7,6, что говорит об однородности стада. Среднее значение титров в контрольной группе ниже показателей в опытной группе, хотя и соответствуют норме принятой в лаборатории. Ср.Т = 2126 (С.Г.Т. = 1735), %КВ = 14,5. Коэффициент корреляции выше, чем в опытной группе - соответственно вакцинация данной птицы менее успешна (более большой разброс в титрах антител), либо иммунная система организма в контрольной группе более низкая, чем в опытной группе. Среднее значение титров в опытной группе при анализе титров антител к инфекционному бронхиту кур показало следующие результаты: Ср.Т.=2698 (С.Г.Т. = 2401), %КВ = 24,9, в опытной же Ср.Т =2144 (С.Г.Т. = 1812), %КВ = 31,4. Среднее значение титров в опытной группе после вакцинации против болезни Ньюкасла оказалось следующим: Ср.Т.= 3537 , в опытной Ср.Т.= 4588 . Показатели напряженности иммунитета в опытной группе опять же имели более высокое значение, чем в контрольной группе. Инфекционная бурсальная болезнь (405) контроль Разведение 1/400 Ср.Т = 2126 С.Г.Т. = 1735 %КВ=14,5. Инфекционная бурсальная болезнь (405) опыт Разведение 1/400 Ср.Т = 3250 С.Г.Т. = 3070 %КВ = 7,6 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица Показатели сохранности поголовья и привесов живой массы цыплят-бройлеров Показатели Опытная группа Контрольная группа Падеж(гол) 187 273 Сохранность(%) 97 95 Привес(%) 40 30 Инфекционный бронхит кур (405) опыт Разведение 1/400 Ср.Т = 2698 С.Г.Т. = 2401 %КВ = 24,9 Инфекционный бронхит кур (405) контроль Разведение 1/400 Ср.Т = 2144 С.Г.Т. = 1812 %КВ = 31,4 Болезнь Ньюкасла (405) контроль Разведение 1/400 Ср.Т = 3537 Болезнь Ньюкасла (405) опыт Разведение 1/400 Ср.Т = 4588 Побочных эффектов токсического характера при применении гумивала за период выращивания бройлеров не обнаружили: цыплята характеризовались спокойным поведением, равномерно перемещались по залу, активно потребляли корм и воду в течение всего периода откорма. В контрольной группе в поствакцинальный период мы все же наблюдали небольшое угнетение животных и низкую поедаемость корма. За время проведения эксперимента не было зарегистрировано случа- ев заболевания птицы. Все использованные вакцинные препараты относились к категории живых вакцин, однако не только уровень специфических антител, но и переносимость их на фоне применения гумивала была лучше. Об этом свидетельствуют показатели сохранности и приростов. (таблица) Заключение. Таким образом, в результате проведенного эксперимента установлено положительное влияние применения кормовой добавки Гумивал в схемах плановой вакцинации цыплят-бройлеров на сохранность поголовья и привесы живой массы. Кроме того, при сравнении напряженности поствакцинального иммунитета было установлено повышение титров антител против болезни Гамборо, инфекционного бронхита кур и болезни Ньюкасла в опытной группе по сравнению с контрольной. Практические предложения: 1. Использовать Гумивал в схемах плановой вакцинации цыплят - бройлеров для повышения выработки иммунитета и профилактики поствакцинальных осложнений. 2. Применять Гумивал цыплятам бройлерам путем выпойки, как менее трудоемкий и простой метод введения препарата. SUMMARY N.K.Lisun. Application fodder additive Gumival in schemes immunization of chickens-broilers. As a result of the lead experiment positive influence of fodder additive Gumival in schemes of scheduled vaccination of chickens-broilers on safety of a livestock, increase in alive weight and increase of immunity is established. Литература 1. Апатенко В.М. Болезни птиц при интенсивных методах ведения отрасли. Харьков, 1996. С. 3-5. 2. Бессарабов Б., Крыканов А. и др. Влияние пробиотиков на рост и сохранность цыплят. // Птицеводство, 1996. №1. С. 25. 3. Биологические приемы повышения продуктивности сельскохозяйственной птицы.: Сб. науч. тр. М. вет. акад. 1992 г. С. 92. 4. Немитов Ю., Ивницкий Ю., Леккина О. Иммуно- Ветеринарная патология. № 3. 2008 модулятор повышает продуктивность. // Птицеводство, 1996. №6 С. 24. 5. Роберт А. О. Иммунная система птицы. // Птицеводство. 1996. №2 С. 39-41. 6. Садовников Н.В. Влияние некоторых цитомедиков на клеточные и гуморальные факторы защиты организма цыплят разной степени физиологической зрелости. // Морфология, физиология и патология животных. С.-П. 1993. С. 39.-41. 47 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ УДК 619:616.62-008.22:636.8 С.Ф. Мелешков ФГОУ ВПО Омский государственный аграрный университет, институт ветеринарной медицины ДИНАМИКА ФУНКЦИОНАЛЬНЫХ РАССТРОЙСТВ МОЧЕИСПУСКАНИЯ И ИХ КЛИНИКО-МОРФОЛОГИЧЕСКИЕ ПАРАЛЛЕЛИ ПРИ УРОЛОГИЧЕСКОМ СИНДРОМЕ У КОШЕК Урологический синдром кошек (УСК) – наиболее частое заболевание нижних мочевых путей у котов, возникающее при полной или частичной непроходимости уретры (А.В. Липин и др., 2002). Как отечественными, так и зарубежными исследователями было установлено, что УСК способствует закупорка уретры камнями или уретральной пробкой, кристаллурия, гипермагниемия, защелачивание мочи, бактериальный и стерильный цистит и уретрит, содержание животных на сухих рационах без достаточного обеспечения водой (Е.М. Козлов, 2002; О.В. Громова, 2003; P.J. Markwell, B.H.E. Smith, 1998; A. Bernarde, E. Viguier, 2006; T.Buffington, 2003; К.Дж. Гаскел, 2002) Установлено также, что УСК приводит к развитию уремического синдрома, из-за чего и происходит гибель животных (А.В. Ермолаева, 2005). Имеются отдельные работы, посвященные описанию клинических симптомов и морфологических изменений органов мочеотделения при УСК (D.A. Elliott, 2003), но нет сведений о динамике функциональных расстройств мочевого пузыря и морфологических изменениях, которые их сопровождают. Цель работы – изучить причины и характер функциональных расстройств мочеиспускания, выяснив при этом морфологические изменения мочевого пузыря при УСК. Задачи исследования: 1) установить причину УСК. 2) изучить клиническую картину в динамике проявления синдрома. 3) выявить характер функциональных расстройств наполнения, удержания и выведения мочи. 4) выяснить морфологические изменения в стенке мочевого пузыря в динамике проявления синдрома. Материал и методы исследования. Под наблюдением находилось 108 котов, у которых в процессе клинического исследования были выявлены признаки урологического синдрома. Всем животным, наряду с общеклиническим исследованием, 48 проводилась катетеризация мочевого пузыря с последующим лабораторным исследованием мочи, цистоманометрия аппаратом Вальдмана по методике В.А. Мохорт, Н.С. Севастьянова (1985), ультразвуковое сканирование мочевого пузыря диагностическим комплексом ЭТС-ДМУ02, рентгенологическое исследование аппаратом Арман-1. Лабораторное исследование мочи включало: определение количества (мерным цилиндром), цвета (визуально), плотности (урометром), рН, белка (тест-полосками), а также исследование организованного и неорганизованного осадка сухим методом (A. Lanevschi, J.W. Kramer, 1994). Интероперационная биопсия вентральной стенки мочевого пузыря проводилась 5 котам при появлении первых признаков УСК, 5 котам при задержке мочеиспускания в течение 2-3 суток и 5 котам при задержке мочеиспускания свыше 3 суток. Полученный материал обрабатывали по методике: кусочки ткани фиксировали в 4% растворе нейтрального формальдегида, обезвоживали и заливали в парафин. Срезы готовили на санном микротоме, окрашивали их гематоксилин-эозином и по Ван-Гизону. Математико-статистическое описание данных исследования и оценку значимости различия производных величин проводили с помощью персонального компьютера с использованием пакетов прикладных программ электронной таблицы Microsoft Excel 7,0, Statistica 6 с учетом рекомендаций Г.Г. Автандилова (2002), В.Я. Гельмана (2002), Ю.И. Юнкерова и С.Г. Григорьева (2002). Результаты исследования. Проведенное исследование позволяет утверждать, что во всех наблюдаемых случаях УСК вначале появляются симптомы, характерные для многих болезней органов мочевыделения: поллакиурия и дизурия. В этот период, который по нашим наблюдениям, продолжается 7-10 суток общее состояние животных остается удовлетворительным: Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1. Лабораторные показатели мочи в динамике УСК Периоды проявления синдрома Показатели Объем наполнения мочевого пузыря, мл Цвет Плотность, кг/м3 рН Белок, г/л Эритроциты Лейкоциты Клетки эпителия Кристаллы Начальный (дизурия, поллакиурия, периурия) Острая ишурия до 3-суток Острая ишурия свыше 3-суток 3 – 17 56 – 125 87 – 385* Желтый 1016 – 1050 5–6 300±100 3 – 35 0 – 27 10 – 30 0 – 10 Красный 1018 – 1035 6–7 >300 >100 – 20 – 50 2 – 70 Коричневый, черный 1008 – 1022* 6 – 8* >300 >100 – – 2 – 52* Примечание: Эритроциты, лейкоциты, клетки эпителия и кристаллы подсчитаны в поле зрения светового микроскопа при Об. 40. Ок. 12,5. * – различия между группами значимы по критерию Краскела–Уоллиса на уровне значимости 0,05. Рис. 1. Цистометрограмма при УСК в начальный период. аппетит и упитанность сохранены, хотя может наблюдаться привередливость в выборе пиши. Жажда не выражена. Ректальная температура в этот период у 78 котов превышала 39,0 Со, а у 30 котов оставалась в пределах рефренных значений. При исследовании мочевого пузыря было установлено, что объем его наполнения у всех животных был в пределах 5– 20 мл. Проведенный анализ цистометрограмм показывает, что в отличие от здоровых котов, у котов в начальный период УСК цистометрограммы отличаются наличием только двух кривых подъемов давВетеринарная патология. № 3. 2008 ления (рис. 1), уменьшением объема наполнения в период эквифинального уровня и повышением внутрипузырного давления до значений 98,6 мм рт ст у отдельных особей, что указывает на нарушение не только емкостной функции мочевого пузыря, но и на повышенную чувствительность детрузорной мышцы в ответ на введение жидкости. Показатели лабораторных исследований мочи котов представлены в табл. 1. Лабораторные показатели свидетельствуют о протеинурии, умеренной эритроцитурии, кристаллурии. Следует отме49 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 2. Кристаллы. Из осадка мочи в начальной стадии УСК. Об. 40. Ок. 12,5 Рис. 3. Организованные осадки мочи кота при УСК. Окраска метиленовым синим. Об. 40. Ок. 12,5. Рис. 4. Десквамация эпителия слизистой оболочки и гиперемия сосудов стенки мочевого пузыря в начальный период УСК. Окраска гематоксилин–эозином. Об. 90. Ок. 12,5. Рис. 6. Ультрасонограмма мочевого пузыря кота. В полости пузыря видно гиперэхогенное образование, не дающее дорсальной тени. тить, что в рассматриваемый период УСК, кристаллы солей в моче обнаруживались в 92% случаев, причем, как правило, одиночные, реже собранные в конгломераты (рис. 2). Кристаллы имели правильную прямоугольную форму и острые края, хотя встречались и с «оплавленными» гранями. Среди организованного осадка мочи больных животных во всех случаях выявлялись клетки пузырного эпителия, одиночные лейкоциты и небольшое количество эритроцитов (рис. 3). При гистологическом исследовании стенки мочевого пузыря в рассматриваемый период УСК отмечается десквамация не только поверхностных, но и глубоких слоев эпителия, гиперемия сосудов слизистой оболочки (рис. 4). По мере развития болезни, слизистая оболочка теряет эпителий на всем протяжении, поверхностные сосуды переполняются кровью, наблюдается массовый выход эритроцитов в полость мочевого пузыря. Клинически это проявляется макрогематурией, периурией, поллакиурией и дизурией. По нашим данным вышеназван- ные клинические признаки могут наблюдаться в течение 3-5 суток, а затем наступает острая задержка мочи (острая ишурия), обусловленная закупоркой мочеиспускательного канала уретральной пробкой, которая состоит из неорганических и органических веществ: кристаллов солей, слизи, клеток эпителия на различных стадиях разрушения. Цистометрограммы, полученные в этот период позволяют сделать вывод о том, что у больных котов нарушается емкостная функция мочевого пузыря, так как характер цистографической кривой указывает на нестабильность детрузорной мышцы. В этот период отсутствуют тонические сокращения мочевого пузыря в ответ на его заполнение, что отражается на цистографической кривой (рис. 5). При продолжительности острой ишурии не более 3-х суток (под наблюдением находились 32 кота), общее состояние животных может оставаться удовлетворительным, ректальная температура находиться в пределах 37,6–39,1 С°. Сонографически у некоторых котов были обна- 50 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 5. Цистометрограмма при УСК после устранения острой ишурии в течение суток. Рис. 7. Пневмоцистограмма кота. Видны контуры мочевого пузыря и тень в его полости. Прямая кишка заполнена плотными массами. Рис. 8. Потеря эпителия. Гиперемия сосудов. Окраска гематоксилин–эозином. Об.90. Ок. 12,5 ружены признаки хронического уроцистита: утолщение стенки мочевого пузыря и образование «слаша» – неоформленного осадка (рис. 6). У всех котов клинически проявлялся и рентгенологически подтверждался копростаз (рис. 7). При гистологическом исследовании стенки мочевого пузыря при острой ишурии до 3 суток отмечается десквамация эпителия на всем протяжении (рис. 8). В некоторых участках сохраняются только базальные клетки, многие из которых дистрофически изменены. Сеть кровеносных капилляров, лежащих под базальной мембраной, расширена и переполнена кровью. Эритроциты имеются также и на лишенной эпителия базальной мембране. Собственный слой и подслизистая основа утол- щены за счет набухания. Сеть коллагеновых волокон расположена рыхло. В некоторых участках наблюдается также набухание фиброцитов, их ядра становятся округло-овальными со слабо окрашенной бесструктурной кариоплазмой. Набухают также и волокна между мышечными пучками мышечного слоя (рис. 9). Кровеносные сосуды всех калибров расширены и переполнены кровью. В некоторых венулах отмечается стаз. У котов с острой ишурией свыше 3 суток (57 животных) наблюдали угнетение различной степени выраженности, жажду, потерю аппетита, у некоторых рвоту. Ректальная температура у животных этой группы была снижена до 37±0,8 С°. Рентгенологически и сонографически у 90% ко- Ветеринарная патология. № 3. 2008 51 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 9. Участок стенки мочевого пузыря кота при острой ишурии в течение 3 суток. Окраска по Ван-Гизону. Об. 90. Ок. 12,5. Рис. 10. Стенка мочевого пузыря пропитана эритроцитарной массой. Окраска гематоксилин–эозином. Об. 90. Ок. 12,5. Рис. 11. Цистометрограмма кота при ишурии свыше 3 суток. тов обнаружено утолщение стенки мочевого пузыря при его переполнении. Моча таких животных представляет жидкость черного или буро коричневого цвета. Лабораторное исследование позволяет выявить тенденцию к увеличению рН до 8, уменьшение плотности мочи, гематурию, лейкоцитурию, протеинурию. При гистологическом исследовании стенки мочевого пузыря отмечали потерю эпителиальной выстилки. Во всех оболочках наблюдали гиперемию, отек и кровоизлияния (рис. 10). Установлено, что в большинстве случаев происходит пропитывание всех слоев стенки мочевого пузыря эритроцитарной массой, а в серозной оболочке отмечается десквамация эпителия. В этот период болезни наблюдается атония мочевого пузыря. Как показывают цистоманометрические исследования, ем52 костная функция мочевого пузыря у таких животных зависит только от механических свойств пузырной стенки (рис. 11). При атонии детрузора быстро происходит переполнение мочевого пузыря мочой, содержащей кровь, клеточный детрит. Наступает защелачивание мочи до рН=8. Во всех случаях в моче выявляются кристаллы трипельфосфатов. Плотность мочи у таких животных по сравнению с другими группами понижается до значений 1008 кг/м3, что может свидетельствовать о снижении одной из основных функций почек – концентрационной. Таким образом, в течении УСК можно условно выделить 3 периода: 1 – период острого воспаления слизистой оболочки мочевого пузыря, функционально характеризующийся снижением емкостной функции и увеличением эквифинального уровня. 2 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ – период формирования слаша и снижения опорожнительной функции мочевого пузыря. 3 – период образования уретральной пробки и атонии мочевого пузыря. Обсуждение полученных результатов. Результаты проведенного исследования позволяют согласиться с утверждением T. Buffington (2003) о том, что по клинической симптоматике УСК мало отличается от многих других болезней нижних отделов мочевыводящих путей, то есть, представленные симптомы – странгурия, гематурия, поллакиурия и периурия не являются специфичными для синдрома. В отношении причины и пускового механизма УСК мнения исследователей расходятся. Так, T. Buffington (2003) указывает на интерстициальный цистит как на возможную причину УСК, P.J. Markwell, B.H.E. Smith (1998) приводят данные о полиэтиологичности УСК: мочекаменная болезнь (МКБ), инфекции мочевыводящих путей, анатомические аномалии, поведенческие нарушения и новообразования, но считают, что у большинства животных невозможно точно выявить специфическую причину симптоматики УСК, особенно если отсутствует обструкция уретры. Мы согласны с Д.Л. Вестропп (2007), что общий анализ мочи у кошек с болезнями нижнего отдела мочевых путей позволяет выявить различные признаки, в том числе гематурию, протеинурию, кристаллурию и изменение плотности мочи, которые непатогномоничны для УСК. Основываясь на данных литературы и результатах собственных исследований можно утверждать, что анализ лабораторных показателей в динамике позволяет отметить закономерность для данного синдрома: постоянную кристаллурию, тенденцию к снижению удельной плотности мочи. Наши данные позволяют утверждать, что УСК определяется симптоматикой МКБ. Следует пояснить, что у кошек развитие симптомов УСК происходит периодами: для периода начала болезни характерны симптомы и признаки, свойственные многим урологическим болезням, протекающим с явлениями острого цистита, но выявляется и специфический признак – кристаллурия. Не все исследователи считают кристаллурию признаком МКБ, на том основании, что ее выявляют у «здоровых» животных с высокой удельной плотностью мочи, а кошки, как вид, способны концентрировать мочу до значений 1080 кг/м3 без выраженных признаков болезни (A. Lanevschi, J.W. Kramer, 1994). ПротивопоВетеринарная патология. № 3. 2008 ложного мнения придерживается Д.Л. Вестропп, 2007, которая утверждает, что кристаллурия имеет большое значение для диагностики рецидивирующей мочекаменной болезни. По нашему мнению процесс камнеобразования следует рассматривать как динамический процесс, поэтому появление кристаллов в мочевых путях следует оценивать как специфичный признак МКБ. Механизм образования первичных камней в мочевом пузыре и уретральных пробок у котов представляется следующим образом. При воздействии любой из причин, которые способны приводить к кристаллизации мочи могут образовываться два типа кристаллов: одни способны склеиваться, образуя сростки, другие, обладая адгезивными свойствами, образуют так называемый мочевой песок. Если процесс идет по пути образования сростков, то образуются камни в мочевом пузыре, как правило, без обструкции уретры. В случаях образования мочевого песка происходит его эвакуация по нижним мочевым путям при условии сохраненной функции мочевого пузыря – у таких животных может только наблюдаться кристаллурия без наличия других признаков болезни. Некоторые исследователи определяют этот период как субклинический период МКБ (О.В. Громова, 2003). Следует подчеркнуть, что непременным условием эвакуации мочевого песка из мочевого пузыря является сохраненная функция мочевых путей и, прежде всего мочевого пузыря. По современным представлениям мочевой пузырь выполняет три основные функции: накопление мочи, ее удержание и эвакуацию. При выполнении этих функций в деятельности мочевого пузыря различают две фазы: наполнения и опорожнения (Ю.А. Пытель и др., 1992). Основными показателями, характеризующими объем наполнения мочевого пузыря, являются: 1) его физиологическая емкость, 2) минимальное и максимальное давление. Эти показатели позволяют выявлять нарушения динамики опорожнения мочевого пузыря и судить об их характере и причине (А.М. Войно-Ясенецкий и др., 1980). В результате проведенного исследования было установлено, что максимальный объем наполнения мочевого пузыря у котов в динамике проявления симптомов УСК изменяется. Вначале проявления УСК объем наполнения мочевого пузыря не превышал 20 мл при максимальном давлении до 98,6 мм рт ст, что указывает на снижение емкостной функции и 53 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ на повышенную чувствительность детрузорной мышцы. Результаты собственных исследований позволяют утверждать, что снижение емкостной функции мочевого пузыря может происходить из-за острого воспаления слизистой оболочки, что подтверждается проведенными гистологическими исследованиями, которые согласуются с данными А.В. Ермолаевой, 2005; D.A. Elliott, 2003. По мере прогрессирования болезни, помимо основных симптомов УСК (странгурия, гематурия, поллакиурия и периурия), о которых сообщает T. Buffington, 2001 и, которые мы также отмечаем в своих исследованиях, наблюдаются и симптомы, характерные для синдрома острой ишурии. К последним можно отнести максимальное наполнение мочевого пузыря, болезненность его стенки, признаки мочевой колики (животное старается лечь на живот, издает гортанные крики) и приапизм, свидетельствующий о непроходимости мочеполового канала. При невозможности создания условий для свободного оттока мочи из мочевого пузыря наступают структурные изменения в его стенке с потерей функциональной способности к сокращению. Таким образом, нельзя согласиться с высказываниями, что УСК характеризуется только симптомами странгурии, гематурии, поллакиурии и периурии. Мы считаем, что перечисленные симптомы характерны только для начальной стадии развития синдрома. По нашему мнению УСК – симптомокомлекс, характеризующийся клинико-лабораторными проявлениями не специфических симптомов (поллакиурия, странгурия, периурия, приапизм, гематурия, изостенурия, алкалоз мочи, гиперрефлексия мочевого пузыря, атония мочевого пузыря) и клинических признаков (отсутствие наполнения мочевого пузыря, переполнение мочевого пузыря), которые по времени патогенетически связанны между собой. Анализ результатов собственного исследования и данных литературы позволяет сделать ряд выводов: 1. Причиной УСК является мочевой песок, способный образовываться в мочевом пузыре в ответ на воспаление его слизистой оболочки. 2. Мочевой песок как механический раздражитель способствует развитию воспаления слизистой оболочки нижних мочевых путей, затрудняет отток мочи и приводит к снижению емкостной функции мочевого пузыря, что клинически у котов проявляется дизурией, поллакиурией, периурией и микрогематурией. 3. Снижение опорожнительной функции мочевого пузыря на фоне отека структурных элементов его стенки приводит к задержке мочи – ишурии, которая вызывает ишемию сосудов стенки мочевого пузыря с последующим выходом эритроцитов, что клинически проявляется макрогематурией и атонией мочевого пузыря. 4. Дальнейшая симптоматика УСК зависит от выраженности уремического синдрома, который становится ведущим в течении МКБ и определяет ее исход. Заключение. Представленное исследование не может претендовать на широкий охват проблемы расстройств мочеиспускания у домашних котов, но позволяет ответить на вопросы: в какой последовательности возникают симптомы УСК, насколько они исчерпывающе обрисовывают картину болезни, что лежит в их основе и какие морфологические признаки им сопутствуют. За рамками исследования остаются вопросы о пусковых механизмах образования кристаллов, их характеристики с позиций биофизики, биохимии, микробиологии. Не приводятся сведения о механизмах прерывающих звенья патогенеза УСК. Ответы на поставленные вопросы позволят клиницистам не только эффективно проводить лечение животных, но и выработать меры профилактики МКБ и ее крайне опасного проявления – УСК. РЕЗЮМЕ Под наблюдением находилось 108 домашних котов с урологическим синдромом (УСК, FLUTD). Методами общеклинических, лабораторных, специальных инструментальных и гистоморфологических исследований были изучены причины, клинические признаки, патогенез УСК. Установлена стадийность проявления симптомов при УСК и их временная связь. Результаты исследования могут быть использованы клиницистами при дифференциальной диагностике заболеваний, связанных с расстройством мочеиспускания у домашних котов, морфологами и патофизиологами при обосновании патогенеза мочекаменной болезни. SUMMARY 108 tame cats having urologic syndrome (FLUTD) have been under observation. Using methods of general clinical, laboratory, special instrumental and histo-morphological examinations reasons, clinical features and pathogenic mechanism of FLUTD have been studied. Staging of symptoms expression for FLUTD and their time relationships have been established. The results of the research can be used by clinicians during differential diagnostics of diseases related to 54 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ urinary discomfort for tame cats, by morphologists and pathophysiologists during reasoning of pathogenic mechanism of kidney stone disease. Литература 1. Автандилов, Г.Г. Основы количественной патологической анатомии: учебное пособие / Г.Г. Автандилов. М.: Медицина, 2002. 240 с. 2. Вестропп, Д. Кошки с клиническими признаками поражения нижних мочевых путей / Д. Вестропп // Veterinary Focus «Болезни нижних мочевых путей». 2007. С. 10–17. 3. Гельман, В.Я. Медицинская информатика: Практикум (последипломное образование). – 2-е изд., перераб. и доп. С.-Пб. М. Харьков. Минск: ПИТЕР, 2002. С. 162. 4. Громова, О.В. Ранняя диагностика, лечение и профилактика уролитиаза кошек: автореф. дис. … канд. ветеринар. наук: 16.00.01 / О.В. Громова; МГАВМиБ им. К.И. Скрябина. М., 2003. 18 с. 5. Ермолаева, А.В. Морфологические и функциональные показатели у котов при уролитиазе: автореф. дис. … канд. биолог. наук: 16.00.02 / А.В. Ермолаева; СтГАУ. Ставрополь, 2005. 23 с. 6. Козлов, Е.М. Мочекаменная болезнь кошек: монография / Е.М. Козлов. Новосибирск. 2002. 52 с. 7. Мохорт, В.А. Диагностические возможности цистоманометрии / В.А. Мохорт, Н.С. Севастьянов // Урология и нефрология. 1985. №3. С.33–56. 8. Пытель, Ю.А. Физиология человека. Мочевые пути: учеб. пособие. / Ю.А. Пытель, В.В. Борисов, В.А. Симонов. М.: Высш. шк., 1992. 228 с. 9. Справочник по урологии / А.М. Войно-Ясенецкий [и др.] М.: Медицина, 1980. С. 64. 10. Юнкеров, В.И. Математико-статистическая обработка данных медицинских исследований: учеб. пособие / В.И. Юнкеров, С.Г. Григорьев; СПб.: ВМедА, 2002. 266 с. 11. Bernarde, A., Viguier, E. Транстазовая уретростомия (ТТУ) у котов / A. Bernarde, E. Viguier // Вестник ветеринарной медицины. 2006. №1. С. 16-23. 12. Buffington, T. Заболевания мочевыводящих путей у кошек и стерильный цистит / T.Buffington // WOLTHAM FOCUS. 2003. Т. 13, № 3. С. 21-22. 13. Elliott, D.A. Клинический случай: кошка, подверженная странгурии / D.A. Elliott // WALTHAM FOCUS. 2003. Т. 13. № 2. С. 16-20. 14. Lanevschi, A. Составные элементы анализа мочи / A. Lanevschi, J.W. Kramer // WALTHAM FOCUS. 1994. Vol. 4. No 3. P. 21-29. 15. Markwell, P.J. Заболевания нижних отделов мочевыводящих путей у кошек – диетотерапия / P.J. Markwell, B.H.E. Smith // WOLTHAM FOCUS. 1998. Т. 8. № 2. С. 21-24. УДК 619:616.98:579.882.11 П.М. Митрофанов, Л.Н. Митрофанова Чувашская Государственная сельскохозяйственная академия ХЛАМИДИЙНЫЕ ПОЛИСЕРОЗИТЫ У КОРОВ Вовлечение в патологический процесс серозных оболочек при хламидиозе исследователями было замечено ещё в период пандемии пситтакоза в 1929-30гг. S. Oberndorfer (1930), A.P.Thomson и W.T.Hiller (1930). У людей, умерших от пситтакоза наблюдали фибринозный плеврит, перикардит и перитонит. Сходную картину отмечали у попугаев, павших от пситтакоза, у индеек, уток и голубей, павших от орнитоза (R.D.Lillie 1930; H.Fuhs и W.Volavsck 1938; W.H.Shelton и др.1947). Серозно-фибринозный плеврит, перикардит и перитонит обнаруживали у людей, умерших от венерического лимфогранулематоза. Судя по многочисленной медицинской литературе, фибринозный венерический перигепатит особенно часто развивается у женщин при воспалительных заболеваниях органов малого таза и обозначается синдромом Фитц-Хью-Куртиса (Л.К.Глазкова, О.Е.Акилов,1998). В последние годы достоверно установлена этиологическая роль хламидий в развитии указанного синдрома. По данным Ж.Анри-Сюше (1990), в 50% случаев периВетеринарная патология. № 3. 2008 гепатит хламидийной природы протекает субклинически. По данным разных авторов, частота перигепатитов при хламидийных сальпингитах у женщин варьирует от 4.4-27 до 96% ( Wang et al 1980; Dalaker K. et al., 1981). Отдельные элементы полисерозитов были описаны исследователями у телят и коров, больных хламидиозом (Menges R.W et al., 1953; Storz J.,1971). Отсутствие целенаправленных патоморфологических исследований не позволило указанным авторам выяснить морфологические и патогенетические особенности хламидийных полисерозитов. Целью наших исследований явилось выяснение частоты, патоморфологии и патогенеза полисерозитов у коров, больных генитальным хламидиозом. Все 120 исследованных животных находились в хозяйствах, неблагополучных по хламидиозу крупного рогатого скота, были выбракованы и убиты по причине бесплодия или аборта. При жизни у них в крови выявлены антитела к хламидиям, в мазках отпечатках со слизистой оболочки влагалища обнаружены хламидии. После убоя 55 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица Частота фибринозных полисерозитов у коров, больных хламидиозом (120 случаев) № п/п Вид серозита Частота % 1. Периспленит 113 94 2 Плеврит 95 78 3 Диафрагматит 80 75 4 Перигепатит 62 51,6 5 Сальпингоофорит 48 40 6 Периметрит 30 25 7 Перикардит 18 15 8 Перитонит 4 3,3 9 Пельвиоперитонит 17 14,1 10 Пельвиоперитонит с закрытием брюшного отверстия яйцевода 8 5 туши подвергались тщательному патологоанатомическому исследованию. Особое внимание обращали на состояние серозных оболочек (висцеральная и париетальная брюшина, плевра, перикард, капсула селезенки и печени). Материал (кусочки различных участков половых и паренхиматозных органов, регионарных лимфоузлов) забирали сразу после убоя животных для гистологического исследования. Фиксацию патматериала проводили в 10%-ном нейтральном растворе формалина и в жидкости Карнуа. Парафиновые срезы окрашивали гематоксилином и эозином, по Ван-Гизону, кислые мукополисахариды выявляли альциановым синим, тучные клетки- толуидиновым синим, РНК- по Браше, фибрин – по Шуенинову. Иммуноглобулины выявляли с помощью антисывороток к различным классам Ig, изготовленных НИИЭМ им. Н.Ф. Гамалеи. Для импрегнации отпрепаровывали различные участки серозных оболочек, в том числе висцеральной брюшины покрывающей тело и рога матки, брыжейки яйцеводов от 10 больных хламидиозом коров и от 4-х здоровых. Оболочки размером от 1х1,5 до 2-5 см. осторожно расправляли на картоне, маркировали и помещали в 10% - раствор нейтрального формалина на 7-10 дней. После фиксации оболочки промывали в проточной воде в течение нескольких часов, затем оболочки разрезали на мелкие части и под лупой расслаивали на тонкие слои. С поверхности расслаиваемых оболочек удаляли жировую клетчатку, слой мезотелия, стволы крупных сосудов и субсерозную рыхлую соединительную ткань. Образцы расслоенных пленок до импрегнации сохраняли в 10% - ном растворе нормального формалина. Перед импрегнацией материал промывали в проточной воде 56 в течение 2 часов. Импрегнацию проводили по методике В.В. Куприянова (1969). Экспериментальное воспроизведение полисерозитов проводили совместно с Р.Х.Хамадеевым на 20 морских свинках, которых заражали возбудителем хламидийного аборта коров (штамм 250). Для этого 10% - ную суспензию желточных мешков РЭК, инфицированных хламидиями, вводили 5-ти морским свинкам интраперитонеально в дозе 2,5 мл однократно, 5-двухкратно, 5 - трехкратно и 5 свинкам пятикратно. В той же дозе с интервалом в три дня 5 морским свинкам аналогичным методом ввели 10% -ную суспензию незараженных РЭК. При жизни опытные морские свинки подвергались систематическим клиническим исследованиям, а после падежа или убоя органы их были взяты для патоморфологических исследований. Для обнаружения хламидий из содержимого брюшной и грудной полостей и с поверхности разреза пораженных органов готовили мазки, которые фиксировали ацетоном и окрашивали по Романовскому-Гимзе или обрабатывали флуоресцирующими моноклониальными родоспецифическими антителами. Результаты исследований Частота серозитов в различных органах приведена в таблице, из которой видно, что наибольший процент поражений наблюдается на капсуле селезенки. В начальной стадии болезни выпавший фибрин выглядит в виде серовато-белой нитчатой массы, легко отделяющейся от капсулы. Со временем, в связи с прорастанием соединительной тканью, фибрин уплотнялся и не отделяется от капсулы. Участками в ней появлялась жировая ткань. У некоторых коров и телок, наряду с организованным фибрином, обнаруживались свежие наложения экссудата с элементами крови. Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ При этом выпавший фибрин имел пестрый и слоистый вид, что свидетельствует о многократном выпоте фибрина в разное время в период рецидивов болезни. На висцеральной плевре фибрин преимущественно откладывался по краям диафрагмальных долей в виде бахромки или между долями легких, приводя к образованию нитевидных сращений. На диафрагме фибрин обнаруживался очагово на стороне грудной полости. Отложения фибрина на поверхности тела, рогов матки и яйцеводов обычно нитчатого реже пленчатого вида. У 40% больных животных фибрин, подвергшийся организации, на уровне яйцеводов и яичника послужил причиной формирования спаек. Соединительнотканные тяжи нередко приводили к нарушению проходимости в яйцеводах и развитию гидросальпинкса. Спаечный процесс в указанных органах часто наблюдался у коров со вторичным бесплодием, у которых иногда массивные отложения фибрина приводили к закрытию брюшного отверстия яйцеводов, что явилось причиной развития трубно-перитонеального бесплодия. По нашим данным, каждый очередной рецидив болезни усиливает тяжесть поражений серозных оболочек половых органов, и в конечном итоге, вместе с патологическими изменениями слизистой оболочки половых путей, приводит к резкому снижению или потере воспроизводительной функции. Изучение гистологических срезов и импрегнированных серебром пленчатых препаратов показало, что морфологические изменения всех вышеуказанных серозных оболочек имеют однотипный характер, что дает возможность суммарно описать обнаруженные патологические процессы, развившихся в них. В начальной стадии болезни в участках выпота фибрина артериолы, капилляры и венулы собственной пластинки полнокровны, содержали увеличенное количество нейтрофилов, стенки их и окружающая соединительная ткань отечны. В стенках мелких сосудов серозной оболочки полового тракта, селезенки, печени, легких и диафрагмы больных хламидиозом коров были обнаружены компоненты иммунных комплексов (хламидийный антиген, Ig M, Ig G). Некоторые кровеносные сосуды были облитерированы скоплениями лейкоцитов, тромбоцитов или фибриновым тромбом. В срезах, окрашенных толуидиновым синим отчетливо видны многочисленные базофилы. Эндотелиальные клетки кровеносных сосудов с явлениями Ветеринарная патология. № 3. 2008 дистрофических изменений, местами слущены. В пораженных участках лимфатические капилляры и посткапилляры растянуты, окружающая соединительная ткань пропитана серозным, а местами фибринозным экссудатом. В артериолах и прекапиллярах отмечали набухание, дистрофию и десквамацию эндотелиоцитов, плазматическое пропитывание и фибриноидный некроз стенок и инфильтрацию окружающего интерстиция лимфоидно – гистиоцитарными клетками. В рыхлой клетчатке очаговые лимфоидно-гистиоцитарные инфильтраты по ходу артерий имели своеобразную структуру, напоминающую по виду почечное тельце. Импрегнационный метод позволил выявить изменения базальной мембраны и эндотелиальной выстилки капилляров, пре-и посткапилляров. Базальная мембрана местами разрыхлена, размыта и отечна. Просвет некоторых капилляров закрыт отекшими и набухшими клетками эндотелия. Острые сосудистые и интерстициальные изменения особенно сильно выражены в ампулярной части яйцеводов. Степень выраженности их в серозной оболочке половых органов у разных больных варьировала в широких пределах, начиная с вовлечения в патологический процесс отдельных посткапилляров и венул, кончая множественными поражениями артериол и прекапилляров. Часть коллагеновых волокон была с явлениями мукоидного и фибриноидного набухания. Диффузное поражение сосудов микроциркуляторного русла приводило к развитию серознофибринозного или фибринозного воспаления серозных оболочек. У многих больных животных по мере стихания острых воспалительных явлений постепенно происходило уменьшение кровенаполнения сосудов микроциркуляторного русла, исчезновение отека интерстиция. При дальнейшем развитии болезни преобладали пролиферативные процессы эндотелия, особенно в посткапиллярных и венулярном звеньях. В периваскулярных клеточных инфильтратах уменьшалось количество макрофагов, лимфоцитов и появлялись клетки типа фибробластов. Но у части животных, наряду со склеротическими изменениями сосудов и периваскулярной ткани, вновь появлялись изменения, сходные с теми, которые были обнаружены в начальной стадии болезни, что свидетельствует о рецидивирующем и хроническом течении хламидиоза. Многократная смена фаз затухания и обострения патоло57 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ гического процесса приводила к уплотнению интерстициальной ткани за счет образования в ней коллагеновых фибрилл, спадению капилляров и посткапилляров. При этом часть запустевших сосудов капиллярного типа исчезала. В конечном итоге это приводит к перестройке микроциркуляторного сосудистого русла и появлению новых, а также извилистых и спиралевидных артериол и капилляров, что, по-видимому, способствует восстановлению нарушенной гемодинамики в пораженных органах и тканях. Опыты на морских свинках, зараженных культурой хламидий, выделенных от больных коров показали, что частота и тяжесть полисерозитов зависит от кратности введения хламидий. Из 5-ти морских свинок, зараженных однократно, фибринозный периспленит обнаружен лишь в одном случае, тогда как из 5-ти свинок, зараженных двукратно перисплепнит отмечен у 3-х. У свинок, зараженных 3 и более раз, кроме фибринозного периспленита, отмечен также фибринозный перитонит, плеврит и перигепатит. У всех зараженных морских свинок обнаружены изменения и других органов (пролиферативный гломерулонефрит, эндокардит, системные васкулиты, гепатиты и т.д.), характерные для хламидиоза. Заключение Результаты наших исследований показали, что у коров, больных генитальным хламидиозом, часто развивается распространенный серозно-фибринозный или фибринозный полисерозит. Причем в воспалительный процесс в брюшной полости вовлекаются серозные оболочки как половых (периметрит, перисальпингит и периоофорит), так и паренхиматозных органов (периспленит, перигепатит). В грудной полости преимущественно поражается легочная (висцеральная) плевра и серозная оболочка, покрывающая диафрагму, редко в патологический процесс вовлекаются перикард и эпикард и в единичных случаях - париетальная плевра. В 5-ти случаях у больных коров наблюдали серозно-фибринозный или фибринозный полиартрит. Наиболее частыми элементами полисерозита являются: пельвиоперитонит +периспленит +диафрагматит+плеврит или периспленит + плеврит + диафрагматит. По нашим данным, фибринозный полисерозит, закономерно возникающий в ходе хламидийной инфекции у коров, связан с поражением сосудов микроциркуляторного русла. Как известно, основным струк58 турным элементом гисто-гематических барьеров являются кровеносные капилляры. Уникальные свойства серозных оболочек, в т.ч. брюшины, обусловлены не столько своеобразным строением и функцией мезотелия, волокнистого каркаса и межклеточного вещества, сколько анатомическими особенностями микроциркуляторного русла. На 1 мм брюшины располагается до 75 тыс. кровеносных капилляров. Сосудов микроциркуляторного русла особенно много на уровне рогов матки и яйцеводов, а в области перешейки и бахромчатой воронки имеются многочисленные капиллярные сплетения. Эта морфологическая особенность в нормальных условиях эффективно помогает выполнению физиологической функции яйцеводов. В частности, полнокровный бахромчатый конец яйцевода млекопитающих, близко прилегая к яичнику во время овуляции, обеспечивает перемещение овулировавших яйцеклеток от поверхности спадающихся фолликулов в полость яйцеводов. Развитие воспалительных процессов в органах малого таза (пельвиоперитонит, перисальпингит, перигепатит) у больных женщин большинство исследователей объясняют проникновением хламидий из маточных труб в брюшную полость. Но эта гипотеза не может полностью объяснить механизм развития других элементов полисерозита – висцерального плеврита, перикардита и диафрагматита. Патоморфологические и иммуногистологические исследования, проведенные нами на большом материале от больных хламидиозом животных, позволяют утверждать, что развитие полисерозитов, также как и других характерных морфологических признаков (системные васкулиты, эндокардиты, гломерулонефриты), связано с иммунокомплексным механизмом и служит выражением гиперчуствительности Ш-типа. Сходная картина и патогенез полисерозитов описаны при сывороточной болезни и других иммунокомплексных болезнях у человека и животных (Dulois E.L., Taffanely D.L., 1964: Albini B. и др.,1977). Иммунопатологический генез хламидийных плисерозитов подтвердили и наши опыты на морских свинках, у которых частота поражения серозных оболочек зависит от кратности введения в организм патогена. Следует также отметить, что восходящая инфекция при генитальном хламидиозе и у коров является одной из ведущих причин трубно-перитонеального фактора бесВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ плодия. Как у больных хламидиозом женщин, так и у больных коров, наблюдается несоответствие между тяжелыми деструктивными изменениями верхнего отдела полового тракта и слабо выраженной клинической картиной болезни. Поэтому многие клинические признаки при жизни не выявляются, а морфологические изменения могут быть обнаружены только при послеу- бойном осмотре органов или при вскрытии трупов больных животных. У бесплодных коров, имеющих в крови специфические антитела к хламидиям, нам удалось обнаружить в различной степени выраженный спаечный процесс в тазовой полости или тканях, окружающих яйцеводы и яичники, приводящий в исходе к нарушению воспроизводительной функции их. SUMMARY Pathomorhologic research on study 120 cows organs sick by genital chlamydiosis is carried out. It is established that a capsule of a spleen (fibrinous perisplenitis), of a liver (perihepatitis), visceral pleura (pleuritis), serous membrane of a uterus (perimetritis), of a oviduct (perisalpingitis), of ovaries (perioophoritis) ore often involved in inflammatory process. Establishet this pathology have immunopathologische genes (immune complex – mediated hypersensitivity). Литература 1. Анри-Сюше М. Хламидиозы в гинекологии. Актуальные микробиологические и клинические проблемы хламидийных инфекций. М. 1990. 2. Глазкова Л.К., Акилов О.Е. Синдром ФитцаХью-Куртиса: Венерический перигепатит.// ЗППП, 1998, №4: 32-38 3. Данченко Г.Н. Хламидиоз птиц. // Ветеринария в птицеводстве. 2007№2: 8-32. 4. Куприянов В.В. Пути микроциркуляции. Кишинев.1969. 5. Albini B., Ossi E. and AndresG.//Laboratory Investigation, 1977,37,1:64-78. 6. Andersen A.A. Trappe J.P. A laboratory Manual for the isolation and identification of Avian Pathogens. 3 rd ed. Kendall // Hunt Publ.Co.,USA:1989:68-74. 7. Dalaker K.,Gjonnaess H., Kvile G., Umes A. et al.// Br.J Vener. Dis.,1981,57,1:41-43. 8. Dubois E.L. Tuffanelli D.L.// JAMA, 1964, 90:104. 9. Fuhs H. Volavsek W. // Arch. f. Dermat. and Syph., 1938, 177:209-214. 10. Lillie R.D.,Pub. Health Rep. 1930,45:773. 11. Menges R.W., Harshfield G.S. and Wenner H.A.// Amer. J. Hygiene., 1953,57.1:1-14/ 12. Oberndofer S. //Munch. med Wochenschr., 1930, 77: 311. 13. Sheldon W.H., Heyman A. //Am. J.Path. 1947, 23: 653-671. 14. Storz J.Chlamydia and Chlamydia induced diseases. Verlag Charles Thomas.Sprindfilld Illinois. USA. 1971. 15. Thomson A.P. and Hillet W.T. Human Infection in psittacosis.// Lancet, 1930, 218-396. 16. Wang S.P.Eschenbach D.A.,Holmes K.K. et al. // Am. J.Obstet. Gynecol., 1980, 138, (7) 1034-1038). УДК 619: 616.98.779.842.615 Ш.Ш. Мицаев, М.М. Ахмедов ГНУ «Чеченский научно – исследовательский институт сельского хозяйства» РАСХН, ФГОУ ВПО «Дагестанская государственная сельскохозяйственная академия» ЭТИОЛОГИЧЕСКАЯ СТРУКТУРА ЛЕПТОСПИРОЗА ЖИВОТНЫХ В ЮГО-ВОСТОЧНОМ ПРЕДКАВКАЗЬЕ Введение Территория Южного федерального округа РФ издавна характеризуется широким распространением лептоспироза среди животных и людей, что объясняется наличием благоприятных природно-климатических условий для сохранения возбудителя во внешней среде, а также обилием и активностью факторов передачи инфекции [1, 2, 4, 6, 8, 11, 12, 13]. Несмотря на улучшение эпизоотической обстановки в регионе в целом, проблема лептоспироза не утратила своей актуВетеринарная патология. № 3. 2008 альности, и в частности на территории Чеченской и Ингушской республик /ЧР, РИ/ остается до сих пор не изученной. В литературе имеются единичные сообщения о выделении лептоспир от некоторых видов домашних животных и диких грызунов в отдельных районах бывшей Чечено-Ингушской Республики [5, 7, 10]. Цель настоящей работы - изучение этиологической структуры лептоспироза различных видов животных в природно-хозяйственных условиях ЧР и РИ. Материалы и методы. Материалом ис59 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Tarassovi Icterohaemorragiae Canicola Смешан. реакции 37,2 25,6 21,8 - - 3,8 - 10,3 33,4 12,6 18,5 3,0 - - - 2,4 1984-1988 45474 1366 3,0 30,5 19,5 42,4 - - - - 7,6 1989-1994 63110 1108 1,8 24,6 14,8 51,4 - - - - 9,2 всего: 1974-1994 130217 3280 2,5 29,3 16,5 46,3 0,7 - 0,1 - 7,0 1974-1978 10443 273 2,6 - - - 65,2 25,3 - - 9,5 1979-1983 25641 2565 10,0 - - - 98,6 1,4 - - 0 1984-1988 25918 2671 10,3 - - - 82,0 9,4 - - 8,6 всего: абс. % 1989-1994 11761 356 3,0 - - - 93,5 6,5 - - 0 1974-1994 73763 5867 7,9 - - - 89,2 6,5 - - 4,4 следования служили 17400 проб сывороток крови различных видов животных, полученные в 48 хозяйствах и населенных пунктах, охватывающих административные районы Чечни и Ингушетии, кровь и экскреты от 1369 голов больных и клинически здоровых животных, а так же органы павших животных. Сыворотки крови исследовали в реакции микроагглютинации /РМА/ по общепринятой методике с использованием антигенов лептоспир семи серологических групп [4, 9]. В необходимых случаях применяли реакцию иммуноадсорбции. Бактериологическое исследование проводили методами прямой микроскопии мочи, крови, фильтрата суспензии из печени и почек, выделения чистой культуры лептоспир путем высевов из органов и тканей в питательные среды. Биологическую пробу ставили на молодых морских свинках и крольчатах. Идентификацию выделенных штаммов осуществляли в перекрестной РМА с групповыми и типоспецифическими агглютинирующими сыворотками. Ретроспективному анализу подвергнуты также результаты диагностических исследований республиканских ветлабораторий за 21 год. Результаты и обсуждение В течение 1974-1994 гг. ветеринарными лабораториями ЧР и РИ исследовано на лептоспироз в РМА 203980 голов сельскохозяйственных животных, в том числе крупного рогатого скота - 130217, свиней - 73763, овец - 582 и лошадей – 18. При этом положительные результаты получе60 Pomona 2,9 3,8 в т.ч. положительных Hebdomadis 78 728 всего 2635 18998 Годы 1974-1978 1979-1983 кр. рог. скот Grippotyphosa Процент положительных РМА с серогруппами Sejroe Исследовано проб свиньи Вид животных Результаты серологических исследований животных на лептоспироз в ЧР и РИ / данные республиканских ветлабораторий, 1974-1994 гг./ ны в 9147 случаях, что составляет 4,5 % исследованного поголовья. Из них на долю крупного рогатого скота приходилось 3280 /2,5%/ и свиней -5867 /7,9 %/ проб сывороток крови, содержащих специфические антитела. У других видов животных антитела установлены не были. Следует отметить, что этиологическая структура лептоспироза животных подвержена периодическим колебаниям, обусловленным существенными изменениями патогенетической активности различных серогрупп возбудителя болезни через определённое время, что подтверждается данными и других исследователей [3, 4, 8, 11 ]. Поэтому за основу анализа мы взяли четыре периода по пять лет каждый /табл. 1/. Представленные в таблице 1 данные свидетельствуют о прогрессирующем увеличении поголовья крупного рогатого скота и свиней, исследованного на лептоспироз в первые три периода, с синхронным повышением количества положительно реагирующих животных. И лишь в четвёртый период наметилась тенденция существенного сокращения положительных реакций, что, по-видимому, связано с повышением качества диагностических и профилактических мероприятий. В этиологии лептоспироза крупного рогатого скота и свиней играют роль различные серогруппы L. interrogans. У крупного рогатого скота выявлена приуроченность лептоспир Grippotyphosa /46,3%/, Hebdomadis /29,3%/, и Sejroe /16,5%/ , гомологичные антитела которых в том или ином сочетании выявлялись во все периВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 2 Результаты серологических исследований животных на лептоспироз /1992-2000 гг./ Исследовано проб Sejroe Grippotyphosa Pomona Tarassovi Icterohaemorragiae Canicola в т.ч. положительных Hebdomadis Вид животных Процент положительных реакций с серогруппами кр.рог. скот 8454 48,6 1066 12,6 39,6 20,5 32,8 5,8 - 1,3 - свиньи 3556 20,4 658 18,5 0,8 1,4 - 64,6 24,3 8,2 0,8 овцы 4476 25,7 426 9,5 16,9 11,5 65,3 2,6 - 2,1 1,6 лошади 672 3,9 118 17,6 16,9 13,6 15,2 19,5 - 32,2 2,5 собаки 118 0,7 37 31,4 - - 13,5 - 5,4 18,9 62,2 крысы 124 0,7 48 38,7 - - 4,2 16,7 - 78,2 - 17400 100 2353 13,5 16,9 10,1 26,3 27,4 8,9 8,4 2,1 абс. всего % абс. % оды практически у всех инфицированных животных. При этом очевидна обратная взаимосвязь между количеством положительных РМА с Hebdomadis и Grippotyphosa, а Sejroe как бы занимала промежуточное положение между ними. В смешанных реакциях /2,4-10,3%/ преобладали также эти серогруппы при наиболее частых сочетаниях сероваров kabura + polonica, hardjo + kabura, реже и с cеротипом grippotyphosa. В отдельных случаях /1974 – 1976 гг./ у крупного рогатого скота обнаруживали антитела серогрупп Pomona, Autumnalis, Icterohaemorragiae, Canicola, Tarassovi. Исследованиями сывороток крови свиней установлено, что доминирующая роль в этиологической структуре болезни принадлежит серогруппам Pomona и Tarassovi. Количество положительных реакций с серотипом pomona варьировало от 65,2% в первый период до 93,5% - в четвёртый период, а с серотипом tarassovi - от 25,3 до 6,5% соответственно. В целом за анализируемый период антитела серогруппы Pomona обнаружены в 90% случаев, тогда как число положительных РМА с Tarassovi выявлено лишь в 6,5% случаев, с колебаниями в различные годы от 0 до 24%. Процент серопозитивных животных, содержащих одновременно антитела к Pomona и Tarassovi, достигал в отдельные годы 9,5%. Следует отметить, что количество серопозитивных свиней в целом три раза превышал показатель инфицированности крупного рогатого скота. Ветеринарная патология. № 3. 2008 При бактериологическом исследовании 860 голов различных видов животных на лептоспироз во всех случаях были получены отрицательные результаты. На наш взгляд, результаты представленных диагностических исследований были недостаточны для объективной оценки этиологической структуры болезни, так как они не отражали истинную эпизоотическую ситуацию по лептоспирозу в республиках. В официальной отчетности отсутствовали данные о заболеваемости или инфицированности овец, лошадей и собак, что настоятельно диктовало необходимость проведения целенаправленных и более детальных исследований животных на эту инфекцию. Исследования, выполненные нами в течение 1992-2000 годов, показали более высокий уровень инфицированности животных лептоспирами, чем в предыдущие годы /табл.2/. Из материалов таблицы 2 видно, что в популяциях исследованных животных ЧР и РИ циркулируют лептоспиры семи серогрупп, хотя степень участия их в заражении того или иного вида существенно отличалась. Так, общее число серопозитивных животных среди крупного рогатого скота в среднем составило 12,6% от исследованного поголовья. В ряде хозяйств количество положительных РМА достигало 28-34% . В сыворотках крови выявлены антитела к серогруппам Hebdomadis /39,6%/, Sejroe /20,5%/, Grippotyphosa /32,8%/, Po61 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 3 Результаты бактериологических исследований животных на лептоспироз в ЧР и РИ за 1992-2000 гг. Исследовано животных Pomona Icterohaemorragiae Canicola круп.рог.скот 684 49,9 4 - 6 3 - - - 13 свиньи 201 14,7 - - - 5 3 1 - 9 4,5 овцы 364 26,6 2 - 4 1 - 1 - 8 2,2 лошади 22 1,6 - - - - - - - 0 0 собаки 50 3,6 - - - 3 - 2 4 9 18 крысы 48 3,5 - - 1 2 - 3 - 6 12,5 всего: 1369 100 6 - 11 14 3 7 4 45 3,3 абс. % mona /5,8%/ и Icterohaemorragiae /1,3%/. В целом, инфицированность крупного рогатого скота лептоспирами в 90-х годах оказалась в пять раз выше чем в среднем за предыдущие двадцать лет с характерными количественными изменениями в соотношениях доминирующих серогрупп Grippotiphosa, Hebdomadis и Sejroe. Бактериологическим исследованием материала от 684 голов больных и клинически здоровых животных было выделено 13/1,9%/ культур лептоспир, принадлежащих к серогруппам Hebdomadis - 4 штамма, Grippotyphosa - 6 и Pomona – 3 /табл. 3/. В этиологической структуре лептоспироза свиней основную роль играют серогруппы Pomona /64,6%/, Tarassovi /24,3/ и Icterohaemorragiae /8,2%/. Циркуляция их среди поголовья свиней подтверждается и результатами бактериологических находок /9 культур/, отнесенных именно к этим серогруппам. При этом наблюдается увеличение поголовья свиней, инфицированных лептоспирами Tarassovi и Icterohaemorragiae. Следует отметить, что лептоспироз овец, собак и лошадей на территории Чеченской и Ингушской республик диагностирован нами впервые в 1993-1994 годах. В сыворотках крови овец обнаружены специфические антитела к сероварам шести серогрупп : Grippotyphosa /65,3%/, Hebdomadis /16,9%/, Sejroe /11,5%/, Pomona /2,6%/, Icterohaemorragiae /2,1%/ и Canicola /1,6%/. В большинстве хозяйств и районов находили сочетание первых трех серогрупп, тогда как в предгорных районах они дополнялись еще серогруппами Pomona или Icterohaemorragiae и Canicola. Однако при бактериологических исследованиях были выделены культуры лептоспир че62 Tarassovi Grippotyphosa абс Вид животных Hebdomadis Sejroe Выделены культуры лептоспир серогрупп Всего % 1,9 тырех серогрупп: Hebdomadis - 2 штамма, Grippotyphosa - 4, Pomona -1 и Icterohaemorragiae -1. В сыворотках крови лошадей антитела установлены к тем же серогруппам лептоспир, что и у овец. Доминирующую роль в этиологии болезни занимала серогруппа Icterohaemorragiae, гомологичные антитела которой находили в 32,2% случаев, тогда как антитела к серогруппам Pomona и Canicola выявлены только в 19,5% и 2,5% случаев соответственно. При бактериологическом исследовании органов и мочи от 22 голов животных выделить возбудителя инфекции не удалось. Представляет несомненный интерес и изучение роли собак и грызунов в эпизоотологии заболевания как возможных источников и распространителей возбудителя лептоспироза. С этой целью серологическим исследованиям подвергнуто 118 собак и 124 крысы. При этом установлена высокая инфицированность собак /31,4%/ и крыс /38,7%/ лептоспирами. В сыворотках крови собак выявлены антитела к серогруппам Canicola /62,2%/, Icterohaemorragiae /18,9%/, Grippotyphosa /13,5%/ и Tarassovi /5,4%/. Материал от 50 собак был исследован и бактериологически. В результате от девяти животных выделены чистые культуры лептоспир, которые при идентификации отнесены к серогруппам: Canicola - 4, Pomona- 3 и Icterohaemorragiae -2. У 48 /38,7%/ синантропных крыс, отловленных на животноводческих фермах, неблагополучных по лептоспирозу, установлены антитела преимущественно серогруппы Icterohaemorragiae /78,2%/, реже - Pomona /16,7%/ и в некоторых случаях – Grippotyphosa /4,2%/. От всех серопозиВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ тивных крыс были сделаны высевы в питательные среды, в результате которых получены шесть культур лептоспир, отнесенные к серогруппам Icterohaemorragiae /50%/, Pomona /33,3%/ и Grippotyphosa /16,7%/. Полученные нами данные о степени лептоспироносительства среди синантропных крыс согласовываются с результатами других исследователей [7]. Таким образом, представленные материалы свидетельствуют о значительной инфицированности основных видов сельскохозяйственных животных, традиционно разводимых в Чечне и Ингушетии, а также собак и крыс лептоспирами, различной серогрупповой принадлежности. Еще в 50-х годах прошлого столетия было доказано лептоспироносительство среди грызунов открытых стаций ЧР /полевых, лесных и домовых мышей, полуденной песчанки, лесной сони/ и наличие участков природной очаговости лептоспироза в ЧР и РИ [5, 7]. По-видимому, дикие грызуны играют роль первичных источников заражения домашних животных, которые в свою очередь формируют вторичные /ан- тропургические/ очаги инфекции. Выводы. Возбудителями лептоспироза животных на территории Чеченской и Ингушской республик являются лептоспиры следующих серологических групп: Hebdomadis, Sejroe, Grippotyphosa, Pomona, Icterohaemorragiae, Canicola и Tarassovi. Основная роль в заболевании крупного рогатого скота принадлежит лептоспирам серогрупп Hebdomadis, Grippotyphosa и Sejroe. Среди поголовья cвиней выявлена циркуляция преимущественно серогруппы Pomona, реже Tarassovi и Icterohaemorragiae. Этиологическая структура лептоспироза овец представлена, в основном, серогруппами Grippotyphosa, Hebdomadis и Sejroe. В организме инфицированных лошадей преобладали лептоспиры серогрупп Icterohaemorragiae и Pomonа. Наиболее высокая инфицированность лептоспирами установлена среди безнадзорных собак /31,4%/ и синантропных крыс /38,7%/, что свидетельствует о потенциальной эпизоотической / эпидемической / роли этих животных в возникновении и распространении болезни. SUMMARY For the first time the results of the long serological and bacteriological research characterising the etiological structure of leptospirosis of animals in the territory of the Chechen and Ingush Republics are given. The infection of various species of animals by leptospira of seven serological groups is established. The etiological role of leptospira in the infection of agricultural animals is made known. The possibility of the particepation of dogs and rats in the episootical condition of leptospirosis is proved. Литература 1. Ахмедов М.М., Амаев К.Г., Салимханов А.К. Этиологическая структура лептоспирозов сельскохозяйственных животных в Дагестане //Лептоспирозы: Труды 5-ой Всесоюзной научной конференции по лептоспирозам человека и животных. Казань, 1971. С. 242-246. 2. Белоусов В.И., Абрамов В.Н., Калмыков М.В. Лептоспироз животных в Российской Федерации и меры борьбы с ним //Лептоспироз: Материалы 10-й Всероссийской научно-практической конференции по лептоспирозу в Анапе 1820 сентября 2003г. М. Краснодар, 2003. С. 6-10. 3. Бозоров А.А., Мурватуллоев С.А. Этиологическая структура лептоспироза животных в Таджикистане //Лептоспироз: Материалы 10-й Всероссийской научно-практической конференции по лептоспирозу в Анапе 18-20 сентября 2003 г. М. Краснодар, 2003. С. 12-13. 4. Болоцкий И.А. Этиологическая структура лептоспироза животных на Северном Кавказе // Ветеринария. 1999. № 11. С. 17-19. 5. Горшанова Е.Н. Дикие грызуны, носители патогенных лептоспир в Дагестане // Материалы докладов научн. конфер. по лептоспирозам зон Северного Кавказа и Поволжья. Краснодар, 1969. С. 232-239. 6. Дорофеев В.И. Этиологическая структура и некоторые вопросы эпизоотологии лептоспироза сельскохозяйственных животных в Калмыцкой АССР: Автореф. дисс. канд. вет. наук. Ставрополь, 1970. 27с. 7. Коковин И.Л., Свешникова Н.П., Межидова Ветеринарная патология. № 3. 2008 М.М., Митрофанов В.И. Роль сельскохозяйственных и диких животных в заболеваниях лептоспирозом людей в Чечено-Ингушской АССР// Лептоспирозы: Труды 3-й Всесоюзн. конфер. по лептоспирозам человека и животных. М., 1962. С. 227 230. 8. Кушхабиева З.И. Лептоспироз сельскохозяйственных животных в Кабардино-Балкарской АССР // Тезисы докладов третьей Всесоюзн. науч.-практич. конфер.: Профилактика и меры борьбы с лептоспирозом сельскохозяйственных животных. Махачкала, 1981. С. 46-47. 9. Любашенко С.Я., Серегин Н.Г., Ахмедов М.М. и др. Серологическая характеристика штаммов лептоспир // Ветеринария. 1974. № 10. С. 61-62. 10. Любашенко С.Я. Распространение, этиология и некоторые вопросы эпизоотологии лептоспироза животных // Лептоспирозы: Труды 4-й Всесоюзн. конфер. по лептоспирозам человека и животных. М., 1967. Часть 1. С. 152-158. 11. Сидневец Л.В. Этиологическая роль вариантов лептоспир и особенности эпизоотологии лептоспироза животных в Краснодарском крае: Автореф. дисс. канд. вет. наук. Ставрополь, 1978. 23 с. 12. Соболева Г.Л., Панин А.Н., Малахов Ю.А. и др. Распространенность и этиологическая структура лептоспироза животных в России // Ветеринария. 2000. № 12. С. 11-14. 13. Тутов И.К. Этиологическая структура и эпизоотология лептоспироза сельскохозяйственных животных в Ставропольском крае: Автореф. дисс. канд. вет. наук. Ставрополь, 1967. 29 с. 63 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ УДК 619:616.34-008.314.4/636.22/.28 М.Н. Мусаева, Н.Р. Будулов, Прикаспийский зональный научно-исследовательский ветеринарный институт С.А. Жидков, Всероссийский институт экспериментальной ветеринарии им. Я.Р. Коваленко ЭТИОЛОГИЯ ГАСТРОЭНТЕРИТОВ НОВОРОЖДЕННЫХ ТЕЛЯТ В РЕСПУБЛИКЕ ДАГЕСТАН В патологии крупного рогатого скота одно из ведущих мест занимают желудочно-кишечные заболевания новорожденных телят. Проблема сохранения молодняка в ранний постнатальный период остается актуальной в связи с тем, что общий показатель смертности у телят до месячного возраста колеблется от 17 до 21%, причем 55% случаев гибели животных приходится на первую неделю жизни и еще 27% – на вторую. При этом существует прямая зависимость сохранности телят от содержания иммуноглобулинов в их сыворотке крови и титров гуморальных антител, полученных через молозиво отелившихся коров- матерей (Федоров Ю.Н., 2002). В изменившихся условиях содержания животных, особенно при наличии неблагоприятных санитарно-гигиенических факторов, на первое место выходят инфекционные болезни желудочно-кишечного тракта. Ведущую роль в этиологии диареи у молодняка сельскохозяйственных животных играют рота-, коронавирусы, вирус диареи-болезни слизистых оболочек крупного рогатого скота (ВД-БС) и в меньшей степени – другие возбудители инфекционных заболеваний (Коромыслов Г.Ф. с соавт., 1982). Указанные болезни широко распространены как в Российской Федерации, так и за рубежом и наносят животноводческим хозяйствам ощутимый экономический ущерб. А их диагностика, в связи с многообразием вирусов и бактерий, которые самостоятельно или в комплексе способны вызывать сходные по клиническому течению желудочно-кишечные заболевания телят, является сложной и трудоемкой. Ситуация по массовым желудочно-кишечным заболеваниям новорождённых телят в республике Дагестан остается напряженной ещё и потому, что их диагностика в ветеринарных лабораториях региона на сегодняшний день не проводится. В связи с вышеизложенным, наши исследования были направлены на изучение этиологии массовых желудочно-кишеч64 ных болезней новорожденных телят. Материал и методы. Выявление ассоциаций рота-, коронавирусов и вируса диареи с патогенной и условно-патогенной микрофлорой осуществляли путем исследования проб фекалий от больных и патологического материала в виде суспензии из тонкого отдела кишечника от убитых или павших телят до 15-дневного возраста. Идентификацию ротавируса и вируса диареи осуществляли методами диффузной преципитации (РДП) и иммуноферментного анализа (ИФА), коронавирус обнаруживали в реакции торможения гемагглютинации (РТГА), а бактерии – методами, предложенными в «Методических указаниях по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями», утвержденных Департаментом ветеринарии МСХ и продовольствия РФ 11 октября 1999 г. Определение уровня антител к коронавирусу в сыворотках крови коров и телят различного возраста проводили в РТГА, а к ротавирусу и вирусу вирусной диареи – методом ИФА. Для бактериологического исследования посевы делали на среды – МПБ, МПА и Эндо. Выделенные культуры E. coli подвергали серологическому типированию по О-антигену с набором поливалентных и серогрупповых О-колисывороток согласно действующему наставлению по их применению. Не агглютинирующие с поливалентными и серогрупповыми О-колисыворотками культуры эшерихий исследовали на патогенность в биопробе на белых мышах. Результаты исследований. Комплексные исследования были выполнены в 13 неблагополучных по массовым желудочно-кишечным заболеваниям телят, с диарейным синдромом (n = 423), хозяйствах Кумторкалинского, Кизилюртовского, Хунзахского, Бабаюртовского и Кизлярского районов Дагестана в период 2005-2008 гг. Как показывает опыт, для полноценноВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица Результаты исследования проб фекалий и патматериала от больных и павших новорожденных телят на наличие вирусных и бактериальных агентов Наименование агента Ротавирусный антиген Коронавирусный антиген Антиген вируса ВД-БС Антиген вируса ВД-БС + ротавирусный антиген Антиген вируса ВД-БС + коронавирусный антиген Рота- + коронавирусный антигены Антиген вируса ВД-БС + рота- + коронавирусный антигены Антиген вируса ВД-БС + эшерихии коли Ротавирусный антиген + эшерихии коли Коронавирусный антиген + эшерихии коли Антиген вируса ВД-БС + рота- + коронавирусные антигены + эшерихии коли Эшерихии коли Количество положительных проб 148 115 86 Выявлено положительных проб от числа исследованных, % 35,0 27,2 20,3 78 18,4 43 10,2 81 19,1 36 8,5 33 7,8 103 24,3 69 16,3 32 7,6 164 38,8 го оборота стада важно не только получить приплод, но и сохранить его. К сожалению, на фермах Дагестана сохранность молодняка крупного рогатого скота недостаточно высока. Наибольшее количество случаев заболевания и гибели молодняка сельскохозяйственных животных происходит по причине острых кишечных заболеваний. Экономический ущерб от этой патологии огромен, так как ежегодно заболевает 4550% (10-15 тыс. голов) новорожденных телят. Из числа заболевших погибает 15-20% (1,5-3,0 тыс. голов). В отдельных хозяйствах заболеваемость молодняка может доходить до 70-90%, а падеж – до 30-40%. Массовые заболевания и падёж телят с признаками расстройства функции пищеварения регистрируются во все периоды года, но пик, главным образом, приходится на зимний и ранневесенний периоды. Как показали наблюдения, телята заболевали в возрасте 2-10 дней и реже в старшем возрасте. У больных наблюдали депрессию, отсутствие аппетита, понос, испражнения со слизью, соломенно-желтого цвета. Температура тела, как правило, не повышалась, в редких случаях поднималась до 40 0С. Смерть наступала на почве сильного угнетения и обезвоживания организма. У части телят болезнь протекала злокачественно и принимала затяжной характер. В таких случаях обычно имели место рецидивы острой диареи. При патологоанатомическом вскрытии павших или вынужденно убитых телят от Ветеринарная патология. № 3. 2008 желудочно-кишечных заболеваний, установили истощение, западание глазных яблок, взъерошенность волосяного покрова, загрязненность его вокруг ануса и задней части туловища, синюшность видимых слизистых оболочек. Комплексному исследованию был подвергнут патологический материал от 33 павших и 390 больных телят (таблица). Полученные данные показывают, что при одновременном комплексном исследовании 423 проб материала 148 содержали ротавирусный антиген, 115 коронавирусный антиген и 86 – антиген вируса диареи, что составило 35,0; 27,2 и 20,3%, соответственно. В патологическом материале от павших или убитых телят ротавирусный антиген обнаружен в 17 (51,5%) пробах, коронавирусный антиген – в 9 (27,3%) пробах, антиген вируса ВД-БС – в 5 (15,2%) пробах. В ассоциациях антигены вирусов ВДБС и ротавируса выявляли в 18,4% случаев, ВД-БС + коронавирусы – в 10.2%, ротаи коронавирусы – в 19,1% случаев и все три вида вирусов – в 8,5%. Спектр микроорганизмов, вызывающих диарею у новорожденных телят, достаточно широк. Бактериальные инфекции часто являются осложняющим фактором, но могут протекать как сопутствующие или самостоятельные. Отмечали различные ассоциации вирусов и бактерий. Результатами наших исследований ус65 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ тановлено, что наиболее часто в качестве осложняющего течение рота-, коронавирусных энтеритов и вирусной диареи является Escherichia coli (70,0%). Культуры – протей, цитробактер и сальмонеллы – изолировали, соответственно, в 15,1; 7,6 и 4,75% случаев. В неблагополучных по гастроэнтеритам хозяйствах от больных телят чаще выделяли E. coli, относящиеся к следующим сероварам: 02, 08, 09, 020, 026, 055, 078, 086, 0101, 0109, 0115, 0117, 0119, 0127, 0141, 0142, 0144 и 0149. Серологической типизацией по О-антигену удалось идентифицировать только 42% культур Е. коли и они относились к сероварам: 02, 08, 09, 020, 055, 0101, 0115, 0117, 0141, и 0144. У больных животных выявляли следующие ассоциации вирусов и бактерий. Вирус ВД-БС и кишечная палочка – 7,8%, ротавирус и кишечная палочка – 24,3% (наиболее часто встречаемая ассоциация), коронавирус и кишечная палочка – 16,3%, вирус ВД-БС, рота-, коронавирусы и кишечная палочка – 7,6%. Изолированные культуры E. coli часто обладают низкой вирулентностью, что говорит об их «вторичной» роли в развитии инфекционного процесса при массовых желудочно-кишечных заболеваниях новорожденных телят. В результате проведенных исследований была установлена роль ротавируса и его ассоциаций с коронавирусом и Escherichia coli в возникновении энтеритов новорожденных телят в совхозе «Султанянгиюртовский» Кизилюртовского района. Ротавирусный антиген, как правило, выявляли только от больных телят и в большинстве случаев – от тяжелобольных. В совхозе «Султанянгиюртовский» ротавирус в ассоциации с E. coli выявлен от 78% больных телят и 90% – тяжелобольных, а в СПК «Вперед» Кизлярского района – от 67,5% больных и 85,8% телят с тяжелым течением диареи. Коронавирусный антиген и энтеропатогенные бактерии E. coli в ассоциации с вирусом диареи в СПК «Вперед» обнаружены у 18,6% больных телят. Ассоциация 3 агентов, а также ассоциация ротавируса и E. coli усугубляют течение и исход болезни. Но, вместе с тем, ротавирус, видимо, иг- рает главную роль в возникновении заболевания, а E. coli, наслаиваясь, отягощает течение болезни. Как правило, ротавирус выявляли чаще в начале заболевания, а E. coli – в основном, в более поздние сроки. Степень распространения ротавирусной инфекции оценивали по результатам серологических исследований. Всего серологически исследовали 348 проб сыворотки крови от телят и взрослых животных. Специфические к ротавирусу антитела выявили в 109 пробах, или 31,3%. Серопозитивность крупного рогатого скота к коронавирусу составила 25%. Титр антител варьировал в пределах 1:32 – 1:128. Отмечена зависимость серопозитивности у животных от их возраста. Колостральные антитела в титре 1:1024–1:2048 обнаруживали в первые два дня молозивной лактации, затем их количество падало на четвертый день до нуля. Ротавирусная инфекция возникает у телят, как правило, в первые сутки после рождения, а при поражении коронавирусом – через 6-10 дней. Об участии вируса диареи крупного рогатого скота в этиологии ассоциированной с рота- и коронавирусной инфекцией у телят первых дней жизни сообщили Гуненков В.В. и др. (2002). Авторы в некоторых случаях при установленном рота- и коронавирусном энтерите у новорожденных телят наблюдали не только типичные, но и атипичные для данной болезни симптомы (лихорадку, эрозии, изъязвления на слизистой рта, особенно на деснах, истечения из глаз и носа и др.), которые возникают при диарее крупного рогатого скота. Таким образом, массовые желудочнокишечные заболевания новорожденных телят в хозяйствах Дагестана имеют смешанную этиологию. В одних случаях заболевание вызывается ассоциировано вирусами и бактериями, в других случаях – несколькими видами бактерий, что значительно осложняет течение болезни. С учетом этиологических факторов, при разработке средств, методов профилактики и борьбы с этими заболеваниями необходимо учитывать смешанный характер течения болезней и применять комплексные биологические и химиотерапевтические препараты. РЕЗЮМЕ В статье представлены данные о роли вирусов и бактерий в этиологии диареи новорожденных телят. В неблагополучных по желудочно-кишечным болезням новорожденных телят хозяйствах Дагестана в пробах материала от больных животных и трупов в 35% случаев обнаруживается ротавирус, в 27,2% – коронавирус, в 20,3% – ВД-БС и в 47,8% – ассоциация этих возбудителей в различных соче- 66 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ таниях. Смешанная инфекция бактерий с вирусами встречается в 56,0% случаев. SUMMARY The facts about the role of viruses and bacteria in the aetiology of newborn calves diarrhea are presented in this article. In the unfortunate by gastrointestinal newborn calves diseases farms of Daghestan in the tests of material from sick animals and corpses rotavirus is discovered in 35% of cases, coronavirus 27,2%, ВДБС – 20.3% and the association of these stimuluses in various combinations – 47.8%. The mixed infection of bacteria with viruses is discovered in 56.0% of cases. Литература 1. Гуненков В.В., Зеленов А.Е., Соколова Н.Л. Профилактика вирусных гастроэнтеритов телят. // Ветеринария. 2002. № 12. С. 21-23. 2. Коляков Я.Е., Гительсон С.С., Каврук Л.С. Колибактериоз телят // М. Колос”.- 1970.- 223 с. 3. Коромыслов Г.Ф. Профилактика и борьба с инфекционными болезнями молодняка сельскохозяйственных животных // Бюллетень ВИЭВ, вып. 47. 1982. С. 3-6. 4. Сидоров М.И., Субботин В.В. Основы профи- лактики желудочно-кишечных заболеваний новорожденных животных. Ветеринария сельскохозяйственных животных. 2008, №3, 8-12. 5. Федоров Ю.Н., Стратегия и принципы иммунопрофилактики болезней новорожденных телят// Состояние и перспективы внедрения достижений ветеринарной науки и практики в сельскохозяйственное производство: Материалы научно-производственной конференции. Вологда. 2002. С. 41-43. УДК 636.2.082.4:636.2 Ф.Н. Насибов, А.Г. Хмылов, Е.А. Тяпугин, Е.У. Байтлесов, В.В. Власов, В.А. Титова ВОСПРОИЗВОДИТЕЛЬНАЯ АКТИВНОСТЬ СТАДА ПРИ РАЗЛИЧНЫХ УСЛОВИЯХ ЭКСПЛУАТАЦИИ КОРОВ Имеющиеся в арсенале специалистов гормональные, или биотехнические, методы регуляции репродуктивного процесса при условии совершенствования, представляют собой хорошую перспективу борьбы с бесплодием, поскольку принципиально новых методов в обозримом будущем не предвидится (1). Однако, для повышения эффективности биотехнических мероприятий по регуляции репродуктивной функции, необходим постоянный учёт состояния воспроизводительной активности поголовья, а главное—специфики причин, лежащих в основе снижения репродуктивного статуса. Учитывая, что на каждый период развития отрасли скотоводства репродуктивный статус и характер причин его снижения не одинаковы, исследования в этом направлении всегда актуальны и являются первоочередными, т.к. в противном случае разработка и планирование концептуально направленной работы по оптимизации репродуктивной активности стада не представляется возможной (2). В этой связи целью наших исследований явилось изучение воспроизводительной активности коров при различных условиях их эксплуатации. Материалы и методы исследования. Характеристику воспроизводительного Ветеринарная патология. № 3. 2008 статуса поголовья в различных хозяйствах Вологодской обл. определяли, руководствуясь общепринятыми в зоотехнической практике методами. В исследованиях использовали официальные данные ветеринарного и зоотехнического учета: статистические обзоры и отчеты отделов животноводства при администрации области и районной ветеринарной лаборатории, а также материалы акушерскогинекологических диспансеризаций, экспертных оценок и верификации клиникогинекологического состояния крупного рогатого скота в хозяйствах с различными технологиями и формами собственности. В контролируемых хозяйствах условия кормления и содержания животных соответствовали зоогигиеническим нормативам. Результаты исследования и обсуждение. Данные исследований показывают, что число проблемных по воспроизводству коров при всех технологиях эксплуатации из года в год остаётся высоким. Были изучены формы нарушений воспроизводительной функции проблемных коров в условиях двух систем содержания (табл. 1). Зафиксировано большое число коров с различными формами овариопатологии, которое может составлять 67,5% от общего числа коров с патологи67 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Структура нарушений репродуктивной функции коров в условиях СХПК «Надеево» Год Состояние половой системы у обследованных проблемных коров 2003 1 2004 В среднем за 3 года 2005 n % n % n % n % 2 3 4 5 6 7 8 9 Беспривязно-боксовое содержание Число обследованных коров 426 100,0 309 100,0 390 100,0 1125 100 Выявлено с нарушениями воспроизводительной функции: 120 28,1 99 32,0 99 25,4 318 28,2 - гипофункция яичников 39 32,5 48 48,5 45 45,5 132 41,5 - яичники с персистирующими фолликулами - яичники с персистентными желтыми телами 12 10,0 9 9,09 6 6,06 27 8,5 42 35,0 27 27,2 15 15,1 84 26,0 Структура патологии*: - кисты яичников** 12 10,0 6 6,0 12 12,1 30 9,4 - эндометриты*** 60 50,0 48 48,5 48 48,5 156 49,0 Привязное содержание Число обследованных коров 411 100,0 336 100,0 366 100,0 1113 100,0 Выявлено с нарушениями воспроизводительной функции: 111 27,0 102 30,3 96 26,2 309 27,8 - гипофункция яичников 75 67,5 57 55,8 48 50,0 180 58,2 - яичники с персистирующими фолликулами - яичники с персистентными желтыми телами 9 - 15 14,7 15 15,6 39 12,6 12 10,8 12 11,8 12 12,5 36 11,6 - кисты яичников** 12 10,8 12 11,8 15 15,6 39 12,6 - эндометриты*** 18 16,2 48 47,0 30 31,25 96 31,0 Структура патологии*: * - процент к общему числу коров с репродуктивными нарушениями; ** - без учёта дифференциации на фолликулярные и лютеальные кисты; *** - следует учитывать, что эндометриты, как правило, протекают сочетано с другими видами патологий. Таблица 2 Структура овариальных нарушений у коров разных пород Породы n Обследовано проблемных коров % n 34 100,0 60 % n % n % Привязное содержание n % Беспривязнобоксовое содержание Черно-пестрая Беспривязнобоксовое содержание Привязное содержание Показатели Холмогорская Беспривязнобоксовое содержание Привязное содержание Айрширская n % 100,0 100 100,0 60 100,0 100 100,0 100 100,0 Виды патологий: - гипофункция яичников 11 32,4 21 35,0 36 35,0 22 36,6 35 35,0 35 35,0 -фолликулярные и лютеальные кисты 11 32,4 19 31,7 31 31,0 20 33,3 30 30,0 31 31,0 - персистентные желтые тела 12 35,3 20 33,3 34 34,0 18 30,0 35 35,0 34 34,0 - в т.ч. эндометриты, протекающие сочетанно с овариопатологией 18 52,9 30 50,0 53 53,0 30 50,0 54 54,0 52 52,0 68 Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 3 Структура нарушений репродуктивной функции коров № п/п Характер нарушений репродуктивной функции 1 2 2003 n 3 2004 % 4 n 5 2005 % 6 n 7 % 8 Всего за 3 года n % 9 10 СХПК «Северная ферма» Число обследованных коров с нару- 286 шениями репродуктивной функции Структура нарушений: 2 Гипофункция яичников 72 3 Киста яичников* 34 4 Эндометриты 129 5 Сальпингиты, вульвовагиниты и др. 51 1 100,0 338 100,0 326 100,0 950 100,0 25,2 11,9 45,1 17,8 81 28 157 72 24,1 8,2 46,5 21,2 98 20 167 41 30,2 6,1 51,3 12,4 251 82 453 164 26,4 8,7 47,6 17,3 100,0 167 100,0 140 100,0 417 100,0 23,7 11,8 47,2 17,3 46 15 81 25 27,3 9,2 48,7 14,8 43 10 70 17 30,8 7,1 50,0 12,1 115 38 203 61 27,5 9,1 48,8 14,6 100,0 177 100,0 159 100,0 483 100,0 23,2 10,2 46,3 20,3 46 17 81 33 25,9 9,5 45,9 18,7 44 15 77 23 27,6 9,4 48,5 14,5 124 47 226 86 25,6 9,7 46,8 17,9 ООО «Заря» Число обследованных коров с нару- 110 1 шениями репродуктивной функции Структура нарушений: 2 Гипофункция яичников 26 3 Киста яичников* 13 4 Эндометриты 52 5 Сальпингиты, вульвовагиниты и др. 19 СХПК «Куркино» Число обследованных коров с нару- 147 1 шениями репродуктивной функции Структура нарушений: 2 Гипофункция яичников 34 3 Киста яичников* 15 4 Эндометриты 68 5 Сальпингиты, вульвовагиниты и др. 30 Всего по трём хозяйствам Число обследованных коров с нарушениями репродуктивной функции Структура нарушений: 2 Гипофункция яичников 3 Киста яичников* 4 Эндометриты 5 Сальпингиты, вульвовагиниты и др. 1 543 100,0 682 100,0 625 100,0 1,850 100,0 132 62 249 100 24,3 11,4 45,9 18,4 173 60 319 130 25,3 8,9 46,8 19,0 185 45 314 81 29,6 7,2 50,2 13,0 490 167 882 311 26,5 9,0 47,7 16,8 * без дифференциации на фолликулярную и лютеальную ей репродуктивной функции. В сентябре 2003 года сравнили степень распространения овариальных нарушений у коров айрширской, холмогорской и чёрно-пестрой пород (табл. 2). Анализ соотношения количеств коров с различными видами нарушений овариальной функции показал, что чаще всего регистрировали животных с гипофункциональным состоянием яичников. Процент коров с гипофункцией яичников у коров айрширской породы при привязном содержании был на 2,6 ниже, чем у коров холмогорской, черно-пестрой и айрширской пород при беспривязном содержании. Количества коров с другими нарушениями было Ветеринарная патология. № 3. 2008 примерно одинаково. Однако наличие эндометритов в сочетании с овариопатологией в группах коров при привязном содержании было выше. В СХПК «Северная ферма», ООО «Заря» и СХПК «Куркино» были установлены следующие градации патологий: в первую очередь – гипофункция яичников, эндометриты, затем кисты яичников, персистентные жёлтые тела и др. нарушения (табл.3). В ряде случаев за период исследований (20002005 гг.) гипофункцию яичников констатировали более чем у 1/3; эндометриты у 2/3; кисты яичников у 1/4 общей численности поголовья. По этой причине в некоторые годы уровень выбраковки коров 69 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ достигал 35% в год. Таким образом, главная проблема на пути достижения экономически целесообразного уровня воспроизводства поголовья при всех применяемых техноло- гиях содержания, кормления и эксплуатации молочного стада фокусируется на наличии большого числа коров с гипофункцией яичников, сопряжённой с эндометритами. SUMMARY The aim of this study was to investigate the reproductive activity of the herd with different cow management. The results suggested the percent of some reproductive disorders related with different cow management. Литература 1. Oettel M. Ausgewalte Probleme der Entwicklung Arzeinmitteln zur Biotechnik der fortpflanzung // Mh. Vet. Med. 1994. V 5. P. 148-150. 2. Мадисон В.В., Мадисон В.Л. Трансплантация эмбрионов в практике разведения молочного скота. М.:Агропромиздат, 1988. 128 с. УДК 619:618.11-006.2 Ф.Н. Насибов, А.Г. Хмылов, Е.У. Байтлесов, Е.А. Тяпугин, В.А. Титова ИССЛЕДОВАНИЕ НЕКОТОРЫХ ФАКТОРОВ, ВЛИЯЮЩИХ НА ОБРАЗОВАНИЕ КИСТ ЯИЧНИКОВ Кисты яичников являются одной из наиболее трудноустранимых патологий репродуктивной системы у коров молочных и мясных пород [1]. Кисты яичников диагностируют у коров всех возрастов, но чаще после второй-пятой лактации, через 1-4 мес. после отёла, т.е. в период наивысшей лактационной активности [2]. По данным литературы частота образования кист яичников может достигать 5,6%–19,0%, что наносит ощутимый ущерб в результате увеличения межотёльного периода до 64 дней [3, 4, 5]. Ряд авторов приводит и более высокие цифры, учитывая, что у 60% коров перед первой после отёла овуляцией кистозные изменения, как правило, остаются не выявленными. Большое число коров с кистозным перерождением яичников выбраковывают из-за необратимого бесплодия, т.к. данная патология имеет весьма негативное свойство: у большинства животных после лечения кистозное перерождение возобновляется [6, 7]. На протяжении многих лет исследований была установлена взаимосвязь образования кист яичников с отдельными факторами, которые были названы «факторы риска». Многие из них описаны, но не исследованы в достаточной степени. Так, нет ясного представления о связи высокой молочной продуктивности со случаями образования кист. В этом отношении данные противоречивы. Особенно это касается коров, у которых были осложнения во время или после отёла [8,9]. 70 Целью нашего исследования мы определили изучение частоты формирования кист яичников (без учёта дифференциации на фолликулярную и лютеальную) у высокопродуктивных коров с учётом факторов, влияющих на данный процесс. Материалы и методы исследования. Исследования были проведены в 20042005 гг. в СХПК «Куркино» на 320 коровах чёрно-пёстрой породы низкой, средней и высокой молочной продуктивности. Кормление, условия содержания и эксплуатации экспериментальных животных соответствовали общепринятым в зоотехнии нормам. В исследованиях по характеристике воспроизводительного статуса поголовья руководствовались общепринятыми в зоотехнической практике методами. Оценку влияния сезонности на случаи образования кист яичника определяли методом ретроспективного анализа данных зоотехнического учета. Концентрацию гормонов в крови определяли радиоиммунологическим методом (РИА). Статистическую обработку экспериментального материала проводили по Е.К. Меркурьевой на персональном компьютере с использованием программы Microsoft Excel. Результаты исследования и обсуждение. Исследованиями определили соотношения количества коров, имеющих кисты яичников, другие овариопатологии и эндометриты при разных уровнях продуктивности (табл. 1). Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Кол-во лактаций Структура патологий репродуктивной системы коров в зависимости от молочной продуктивности и числа лактаций Уровень продуктивности НП ** (n=326) СП** (n=367) ВП** (n=320) Всего выявлено с патологией (n-%) 198-60,7 247-67,3 259-80,9 Соотношения патологий (%)* ГЯ ПЖТ КЯ ЭМ ГЯ ПЖТ КЯ ЭМ ГЯ ПЖТ КЯ ЭМ 2 22,3 21,1 1,4 55,2 34,7 10,6 4,6 50,1 36,8 17,7 3,4 42,1 3 24,7 18,8 4,4 52,1 35,1 9,3 4,2 51,4 35,4 9,4 4,6 50,6 5 8,8 12,1 22,9 56,2 10,8 20,7 22,4 46,1 14,1 24,3 25,9 35,7 6 6,8 14,7 19,4 59,1 9,1 22,6 25,8 42,5 7,7 19,5 26,9 45,9 * Процент от выявленных с патологией; Г.Я. – гипофункция яичников; П.Ж.Т.- персистентное жёлтое тело; К.Я.- кисты яичников; ЭМ- эндометрит и другие патологии. ** НП-низкопродуктивные (до 4 тыс. кг. молока за лактацию); СП-среднепродуктивные (от 4 до 7 тыс. кг.); ВП-высокопродуктивные (от 7 тыс. кг.) животные. Рис. 1. Средние концентрации гормонов до и после начала эструса: 1 - конц. ЛГ у животных впоследствии не имевших кисты яичника; 2 - конц. ЛГ у животных в последствии имевших кисты яичника; 3 - конц. прогестерона у животных впоследствии имевших кисты яичника; 4- конц. прогестерона у животных впоследствии не имевших кисты яичника. *Р<0,05; **Р<0,001. Было подтверждено правило, что образование кист яичников характерно для высокопродуктивных животных, т.к. процесс интенсивной лактации требует повышенных энергетических затрат. Переход некого порогового уровня в процессе обмена веществ, приводит к стойкому метаболическому дисбалансу, что выражается, прежде всего, в возникновении проблем на всех уровнях эндокринной регуляции репродуктивной функции. С увеличением числа лактаций повышался процент образования кист: по 2-й и 3-й лактациям заболеваемость не превышала 6,0%, в то время как по 5-й и 6-й лакВетеринарная патология. № 3. 2008 тациям этот показатель достигал 26,0%. Образование кист более характерно в зимние месяцы при недостатке моциона и нехватке в рационах витаминов (Е) и минеральных веществ (селен). Скармливание некачественных кормов, поражённых плесневыми грибками также способствовало образованию кист яичников, особенно у первотёлок. У коров, имевших тяжёлые роды и осложнения после отёла (задержание последа, эндометриты) кисты яичников наблюдались чаще. Зарубежными исследователями было показано, что эндотоксины, выделяемые бактериями в полость матки 71 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ при воспалительных процессах, стимулируют секрецию кортизола, который супрессирует предовуляторное волнообразное выделение ЛГ. Особенно к такому явлению чувствительны высокопродуктивные коровы [7]. Повышение концентрации прогестерона в предовуляторный период (от 1,0 до 2,5 нг/мл) сопровождается общим дефицитом концентрации ЛГ в крови, что впоследствии приводит к кистозным перерождениям (рис. 1). Данное обстоятельство в определённой степени подтверждает одну из гипотез этиологии кист яичников, согласно которой непосредственной причиной патологии является общий дефицит предовуляторного волнообразного высвобождения ЛГ или недостаточный предовуляорный ЛГ-пик, что обусловлено повышением концентрации прогестерона в крови в предовуляторный период. Таким образом, образование кист яичника является довольно распространённым явлением в современном молочном скотоводстве и опосредованно связано с высокой молочной продуктивностью животных, отсутствием моциона, адекватного кормления, особенно в зимний период, и высоким процентом животных, имеющих другие нарушения в репродуктивной сфере. Непосредственным фактором, приводящим к формированию кист яичников, является гормональный дисбаланс, вызванный нарушенным обменом веществ у коров в период повышения лактационной активности. SUMMARY The objective of the present study was to determine the frequency of the cows with ovarian follicular cysts and the factors related with cysts formation. Литература 1. Hooijer G., Lubbers R., Ducro B. et al. Genetic parameters for cystic ovarian disease in Dutch Black and White dairy cattle// J. Dairy Sci. 2001. V. 8. P. 286–291. 2. Бриль Э.Е. Гормоны и воспроизводство крупного рогатого скота.-Мн: Ураджай, 1979. 88 с. 3. Garverick H. Ovarian follicular cysts in dairy cows// J. Dairy Sci. 1997. V.80. P. 995–1004. 4. Eyestone W., Ax R. A review of ovarian follicular cysts in cows, with comparisons to the conditions in women, rats, and rabbits//Theriogenology 1984. V. 22. P. 109–125. 5. Jordan E., Fourdraine R. Characteristics of the management practices of the top milk producing herds in the country// J. Dairy Sci. 1993. V.76. P. 3247–56. 6. Lee C., Cook D., Parfet J. et al. Induction of persis- tent ovarian follicular structures following administration of progesterone near the onset of estrus in dairy cattle //J. Dairy Sci. 1988 V.71. P. 3505–8. 7. Borsberry S, Dobson H. Periparturient diseases and their effect on reproductive performance in five dairy herds// Vet Rec. 1989. V.124. P.217–9. 8. Casida L., Chapman A. Factors affecting the incidence of cystic ovaries in a herd of Holstein cows// J. Dairy Sci. 1951. V.34. P.1200–5. 9. Ashmaway A., Vogt D., Youngquist R., Garverick H. Heritability of liability to cystic ovary development in Holstein cattle// J. Hered. 1990. V.81. P.165-166. 10. Mutayoba B. Development of a sensitive enzyme immunoassay for LH determination in bovine plasma using the streptoavidin-biotin technique//Acta Endocrinol. 1990. V. 122. P. 227-232. УДК 619:616.34-008.314.4/636.22/.28 В.В. Попов, М.Ф.Щербаков, С.С. Лавров МОНОКУЛЬТУРА VERSUS ТРАВОСМЕСЬ Стало аксиомой, что возделывать травосмеси выгоднее, чем одновидовые посевы. Научными исследованиями было показано, что смешанные посевы повышают урожаи, качество и устойчивость травостоев. Между тем, по данным РАСХН, травяные смеси, в состав которых входят злаковые или бобовые культуры, выращивают всего 7-8 % хозяйств. Во ВНИИ кормов был проведен сравнительный опыт по изучению продуктивности и качества злаковых трав (тимофеевки луговой, лисохвоста лугового, тре72 бующих повышенного увлажнения, а также овсяницы луговой, костреца безостого и ежи сборной, требующих средней степени увлажнения) в одновидовых посевах и в смесях при трехкратном использовании. На опытные делянки ежегодно вносили минеральные удобрения в следующих дозах: аммиачную селитру (N80) применяли под каждый укос, хлористый калий (К60) – под первый и третий укосы, простой гранулированный суперфосфат (Р90) – один раз весной. Первый укос проводили в фазе выметывания растений, второй и Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 1 Сбор сырого протеина с урожаем монокультур и травосмесей при разных режимах использования (т/га) Компоненты травосмеси 3 укоса 4 укоса среднее, n=3 травосмесь среднее, n=3 Ежа, тимофеевка, кострец 1,98 1,93 Овсяница, тимофеевка, кострец 1,97 1,91 Лисохвост, овсяница, кострец 1,96 1,94 5 укосов травосмесь среднее, n=3 травосмесь 2,08 2,17 2,03 2,07 2,08 1,96 1,99 1,95 2,10 2,00 2,05 1,93 Рис. 1 Концентрация сырого протеина и сырой клетчатки в злаковых травах и травосмесях без орошения (-) и при орошении (+) третий – через 50-55 дней. Поливали травы с помощью дождевальной установки КДТ-25 при снижении влажности до 60% НВ в слое 0-30 см. Метериологические условия в период исследований резко различались: крайне засушливая и жаркая погода в 1972 г. (сумма среднесуточных температур превысила среднюю многолетнюю на 340-440°С), средняя по количеству осадков в 1973 г., влажная – в 1974 г. На рис. 1 показано содержание сырого протеина и сырой клетчатки в отдельных видах изучаемых трав и травосмесях при трехукосном использовании в условиях дождевания и естественного увлажнения (в среднем за сезон и годы исследований). Содержание сырого протеина в травостоях при орошении было более равномерным во всех трех укосах использования. За годы исследований не установлено четкой закономерности влияния орошения на конВетеринарная патология. № 3. 2008 центрации сырого протеина. В табл. 1 сопоставлены усредненные данные по монокультурам и фактический сбор сырого протеина при выращивании их в травосмеси. Максимальный валовой сбор сырого протеина в среднем за 3 года исследований был получен у большинства видов трав и травосмесей при четырехукосном использовании, меньший – при пяти- и наименьший при трех укосном использовании. Увеличение числа скашиваний с трех до пяти привело к резкому снижению в травостое тимофеевки луговой, овсяницы луговой и костреца безостого и менее резкое снижение лисохвоста лугового и ежи сборной. Поэтому ежа сборная и ежовокострецово-тимофеечная смесь сохраняли это превосходство и при четырех- и пяти укосном использовании. Близкой к еже сборной по этому показателю была овсяница луговая. 73 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 2 Переваримость (%) сухого вещества различных травостоев Без орошения Виды трав и травосмеси Тимофеевка л. Овсяница л. Кострец б/з Ежа сб. Лисохвост л. Травосмеси: Кострецово-овсяничнотимофеечная Лисохвосто-кострецовоовсяничная Ежово-кострецовотимофеечная При орошении 1972 1973 1974 в среднем 1972 1973 1974 в среднем 54,2 59,0 49,5 57,4 50,2 63,3 67,0 65,2 67,8 65,0 67,4 64,2 66,6 69,6 68,2 61,6 63,4 60,4 64,9 61,1 55,8 58,6 50,4 55,4 55,2 63,7 64,3 62,1 62,2 62,3 69,8 68,9 68,5 68,1 68,3 63,1 63,9 60,3 61,9 61,9 60,7 62,8 68,1 63,8 53,0 68,9 69,1 63,7 52,9 61,9 68,0 60,9 51,4 61,7 67,7 60,3 53,6 62,6 70,4 62,2 54,1 64,1 67,5 61,9 Таблица 3 Переваримость (%) сухого вещества орошаемых злаковых травостоев в зависимости от кратности их использования (по годам и в среднем) Виды трав и травосмеси Тимофеевка Овсяница л. Кострец б/з Ежа сб. Лисохвост л. Травосмеси: Кострецовоовсяничнотимофеечная Лисохвостокострецовоовсяничная Ежовокострецовотимофеечная Три укоса Четыре укоса 1973 1974 среднее 1973 1974 среднее 1973 1974 среднее 63,7 64,3 62,1 62,2 62,3 69,8 68,9 68,5 68,1 68,3 66,8 66,6 65,3 65,2 65,3 66,6 68,4 72,6 75,5 73,2 74,5 68,2 72,6 75,5 73,2 70,6 68,3 68,6 71,0 70,6 67,7 70,7 70,6 70,8 68,4 76,1 80,9 75,4 74,9 75,9 71,9 75,8 73,0 72,8 72,1 68,9 69,1 69,0 70,1 74,7 72,4 65,0 75,3 68,7 61,7 67,7 64,7 62,6 73,8 68,2 66,3 75,1 70,7 64,1 67,5 65,8 63,9 73,3 68,6 68,1 75,1 71,6 Травосмесь из ежи, тимофеевки и костреца была эквивалентна или даже превосходила (при 4 укосах) чистые посевы этих культур. Травосмесь из овсяницы, тимофеевки и костреца, а также из лисохвоста, овсяницы и костреца несущественно уступала усредненному сбору сырого протеина с урожаем монокультур при всех режимах использования. Самыми продуктивными по валовому сбору сырого протеина оказались кострец безостый и ежа сборная (несколько меньше овсяница луговая) при трех укосном использовании. Травосмеси, даже с включением этих компонентов уступали по этому показателю чистым посевам этих культур, были сходны с тимофеевкой, но превосходили лисохвост. Для более полной оценки результатов агротехнического опыта была определена in vitro-переваримость сухого вещества травостоев по всем вариантам опытов (табл. 2). Анализ показал, что существенной разницы по этому показателю от весны к осе74 Пять укосов ни (по укосам) не обнаружено. Межвидовые различия в переваримости незначительны, однако наименьшая переваримость отмечена у костреца безостого. В среднем за 3 года переваримость сухого вещества in vitro трав с неорошаемых участков и вариантов с дождеванием была примерно одинаковой. Существенные различия по переваримости имеются по годам исследований. Как при орошении, так и без орошения с годами пользования переваримость сухого вещества травостоев увеличивается, что связано с выпадением из травостоя верховых крупностебельных злаков с более высоким содержанием клетчатки и заменой их низовыми, более облиственными видами с меньшим содержанием сырой клетчатки. Как при орошении, так и без орошения наибольший выход переваримого сухого вещества дали посевы костреца безостого и ежи сборной, а также ежово-кострецовотимофеечная смесь, наименьший – лисохвост луговой. При естественном увлажнении резкие колебания по сбору перевариВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Таблица 4 Сбор переваримосго сухого вещества монокультур и травосмесей при разных режимах использования (т/га) Компоненты травосмеси Ежа, тимофеевка, кострец Овсяница, тимофеевка, кострец Лисохвост, овсяница, кострец 3 укоса среднее, n=3 4 укоса травосмесь среднее, n=3 7,75 7,71 7,62 7,34 5 укосов травосмесь среднее, n=3 травосмесь 7,52 8,00 7,12 7,26 7,92 7,20 7,66 6,95 6,52 7,02 7,16 6,72 6,92 6,28 Рис. 2. Переваримость орошаемых травосмесей и составляющих их компонентов (в среднем по всем вариантам и годам исследований) мого сухого вещества по годам исследований объясняются влиянием погодных условий. В среднем за четыре года наибольшую прибавку от орошения по сбору переваримого сухого вещества дали тимофеевка луговая (1,49 т/га), ежа сборная (1,13 т/ га), кострецово-овсянично-тимофеечная смесь (1,25 т/га), наименьшую – овсяница луговая (0,86 т/га) и лисохвостово-кострецово-овсяничная смесь (0,9 т/га). В другом опыте изучали влияние разного количества укосов (от трех до пяти за сезон) на этих же травах и травосмесях в условиях орошения. По содержанию основных питательных веществ (протеина, клетчатки) и переваримости сухого вещества злаковые травостои отвечали зоотехническим требованиям кормлении животных. Наиболее благоприятное содержание и соотношение питательных веществ установлено при трех- и четырехкратном режимах использования травостоев (сырой протеин 16,0-21,0%, сырая клетчатка 25-30%, сырой жир 3,0-4,3%, сырой золы 7,2-8,3%). В среднем за два года исследований коэффициенты переваримости сухого вещества орошаемых злаковых травостоев были довольно высокими по всем вариантам (табл. 3). Ветеринарная патология. № 3. 2008 С увеличением числа скашиваний переваримость сухого вещества как в чистых посевах, так и в травосмесях повышается, причем на большинстве вариантов наиболее существенная разница по этому показателю наблюдается между трех- и четырехукосным использованием. В среднем за годы исследований переваримость сухого вещества при трехукосном использовании составила 60-64%, при четырех укосах – 65-68%, при пяти – 69-76%. Изменения переваримости корма в течение вегетационного периода были незначительны. Наиболее высокая переваримость сухого вещества всех видов трав и травосмесей отмечена в 1974 г., что связано в первую очередь с коротким вегетационным периодом этого года и травы убирали в более ранние фазы вегетации, а также с заменой крупностебельных злаков (кострец безостый, лисохвост луговой, тимофеевка луговая, овсяница луговая) низовыми злаками и разнотравьем, отличающихся более высокой переваримостью. При сопоставлении травосмесей и их составляющих установлено, что переваримость сухого вещества смешанного посева лисохвоста, овсяницы и костреца при всех режимах использования ниже, чем у этих компонентов, выращенных в чистых по75 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис. 3. Сбор переваримого сухого вещества при трехкратном использовании Рис. 4. Сбор переваримого сухого вещества при четырехкратном использовании севах. Аналогичная тенденция отмечена у травосмеси ежи-тимофеевки-костреца. У смеси овсяницы, тимофеевки и костреца снижение переваримости отмечено только при пятикратном использовании. Для более полного сравнения влияния режимов использования на продуктивность злаковых трав и травосмесей необходимы данные о сборе переваримого сухого вещества с единицы площади. В табл. 4 сопоставлены усредненные данные по монокультурам и фактический сбор переваримого сухого вещества при выращивании их в травосмеси. Сбор с урожаем переваримого сухого вещества корма в большинстве случаев был выше при трехкратном отчуждении травостоев и снижался при увеличении числа укосов. Кострец безостый, тимофеевку луговую, овсяницу луговую и травосмеси с их ведущим участием целесообразно скашивать не более 3 раз за сезон. В связи с полеганием травостоев и недобором урожаев ежи, лисохвоста и ежово-кострецово-тимофеечной смеси при трехукосном использовании максималь76 ный выход переваримого сухого вещества этих культур получен при четырех скашиваниях (рис. 8). Травосмесь из ежи, тимофеевки и костреца была эквивалентна или даже превосходила (при 4 укосах) чистые посевы этих культур. Травосмесь из овсяницы, тимофеевки и костреца уступала усредненному сбору переваримого сухого вещества лишь при пятикратном скашивании. Что касается травостоя из лисохвоста, овсяницы и костреца, то травосмесь существенно уступала монокультурам при четырех- и пятикратном режимах использования (рис. 9). По наиболее важным показателям: содержанию и сбору сырого протеина и сырой клетчатки, переваримости и сбору переваримого сухого вещества оптимальным для ежи сборной, лисохвоста лугового и травосмесей с участием ежи сборной является четырехкратной скашивание орошаемых сенокосов. При трех укосах эти травостои полегают, поражаются болезнями, что затрудняет их механизированную уборку. При оптимальном режиме использоваВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ния (трех-четырехкратном скашивании) орошаемые злаковые травостои дают наибольший экономический эффект. Наибольший чистый доход получили при возделывании ежи сборной, костреца безостого, тимофеевки луговой и травосмесей с участием этих видов. Таким образом, решение вопроса о возделывании трав в чистых посевах или сме- сях зависит от множества факторов: вида трав, одновременности их созревания, режима их использования, орошения, удобрения и других. Помимо этого в производстве учитывается потребительская стоимость агроприема: смеси на 30% дороже монокультур, в хозяйствах отсутствует техника для смешивания семян, за смешанными посевами сложнее ухаживать и т.д. УДК 619:616.98:579.841.93 Ю.Н. Федоров, М.П. Альбертян, С.С. Нестреляев ГНУ Всероссийский НИИ экспериментальной ветеринарии им. Я.Р. Коваленко КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА ИММУНОГЛОБУЛИНОВ И ДИНАМИКА ТИТРА АНТИТЕЛ В СЫВОРОТКЕ КРОВИ БАРАНОВ, ВАКЦИНИРОВАННЫХ ПРОТИВ ИНФЕКЦИОННОГО ЭПИДИДИМИТА Количественная характеристика уровня иммуноглобулинов разных изотипов в сыворотке крови является важным критерием при оценке иммунного статуса животных, особенно в процессе онтогенеза иммуногенеза. Иммунологический профиль биологических жидкостей организма может принципиально отличаться в зависимости от физиологического состояния, а также при различных патологических состояниях и в процессе иммуногенеза. Динамика изменений уровня иммуноглобулинов в процессе иммуногенеза дает важную информацию о характере гуморального иммунного ответа на раздражение антигенами различной природы. При этом значительный интерес представляет дифференцированное изучение биосинтеза макро(19S) и микроглобулинов (7S) при иммунизации разнообразными антигенами. Макроглобулины (естественные, нормальные, тяжелые антитела) имеют обозначение IgM, YM, 19 SY, молекулярная масса 900000, константу седиментации 19S, валентность, равную 5-10, термолабильны, разрушаются под действием меркаптоэтанола, солянокислого цистеина и риванола. Они наделены сильными агглютинирующими, преципитирующими, бактерицидными, гемолитическими и гемагглютинирующими свойствами [6]. IgM первыми появляются в крови в качестве слабоафинных антител при иммунВетеринарная патология. № 3. 2008 ном ответе на инфекционные агенты и составляют около 10% от общего пула иммуноглобулинов сыворотки крови [3]. Способностью к связыванию комплемента обладает только субизотип IgМ1. Микроглобулины, или легкие, приобретенные антитела (IgG, G, 7S) имеют молекулярную массу 180000 и константу седиментации 6,5-7S, термостабильны, резистентны к редуцирующим веществам, наделены агглютинирующими, преципитирующими и др. свойствами. [9]. IgG c константой седиментации 7S – основные иммуноглобулины, преобладающие в сыворотке крови животных при бруцеллезе – на них приходится 70-80% от общего пула антител сыворотки [1]. Среди иммуноглобулинов G-изотипа у овец различают четыре субизотипа – IgG1, IgG2, IgG3, IgG4. IgG1 в большей степени, и IgG2 - в меньшей, участвуют в агглютинации и преципитации антигенов, а также взаимодействуют в РСК. Кроме этого IgG1 обуславливает реакцию гиперчувствительности немедленного типа и селективно транспортируется в секреты. Иммуноглобулины изотипа А (IgA) у овец представлены двумя типами – сывороточным и секреторным. Сывороточный IgA, представленный двумя субизотипами – IgA1 и IgA2, имеет молекулярную массу 170 тыс., константу седиментации 7S, термоустойчив, синтезирует77 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ ся в селезенке, лимфоузлах и в слизистых оболочках, не обладает преципитирующими и комплементсвязывающими свойствами, составляет 15-20% общего пула иммуноглобулинов в сыворотке крови. Секреторный IgA (SIgA) с молекулярной массой 380 тыс., константой седиментации 11S и 15S, образуются при переходе IgA в различные секреты [1,4]. Многие авторы считают что, IgM появляются через 5-7 дней после первичной иммунизации, и достигают максимальной концентрации на 13-21 день; IgG появляются через 14-21-й день и их количество достигает максимума на 28-42-й день. Синтез IgM вскоре прекращается, а IgG и IgA – продолжают синтезироваться многие месяцы. Другие авторы придерживаются мнения, что IgM и IgG образуются одновременно. [1,7,8]. Таким образом, не существует единого мнения в отношении последовательности биосинтеза определенных классов иммуноглобулинов. Б.И. Кондауров и Н.Г. Михайлова, изучая биосинтез 19S-антител (IgM) и 7S-антител (IgG) у ягнят после вакцинации бруцеллезными вакцинами, показали, что синтезируемые на первом этапе 19S-антитела имеют низкий титр, который увеличивается в процессе иммуногенеза. Антитела, принадлежащие к IgG-изотипу (7S), появляются позднее [5]. Характер этих изменений имеет определенные закономерности, но может существенно отличаться в зависимости от природы антигена. Установлено, что иммунизация убитыми вакцинами вызывает у привитых животных образование антител, повышает фагоцитарную активность нейтрофилов и сенсибилизацию организма, хотя и в меньшей степени, чем иммунизация живыми вакцинами [2]. В своей работе мы поставили цель – провести сравнительную количественную оценку сывороточных иммуноглобулинов баранов в процессе формирования иммунного ответа на введение живой и убитой противобруцеллезных вакцин. Для этого были проведены исследования по определению уровня иммуноглобулинов различных изотипов (IgG, IgM, IgA), а также титра специфических антител в сыворотке крови вакцинированных баранов. Материалы и методы. В опыте находился 21 баран 18-месячного возраста, 9 из которых иммунизировали инактивированной адъювант-вакциной «ЭВАК» против инфекционного эпидидимита баранов 78 в дозе 20 млрд.м.к., 9 других – живой вакциной из штамма Rev-1 Br. melitensis в дозе 2 млрд.м.к., 3 барана составляли контрольную группу и не подвергались вакцинации. Вакцинные препараты животным вводили подкожно справа в области локтевого сустава. Количественное определение уровня трех основных изотипов иммуноглобулинов (IgG, IgM и IgA) и титра агглютинирующих антител в испытуемых сыворотках крови вакцинированных и контрольных баранов в целях оценки иммунного ответа в поствакцинальный период определяли на 7, 15, 24, 31, 46, 61, 90 и 127-й дни после иммунизации методом РИД по Манчини и в стандартной РА. В исследованиях использовали моноспецифические сыворотки к IgG, IgM и IgA мелкого рогатого скота, иммунохимически чистые препараты IgG, IgM и IgA мелкого рогатого скота и стандартные сыворотки, полученные и охарактеризованные ранее в лаборатории иммунологии ВИЭВ. Объем вносимой пробы при постановке РИД составлял 1 мкл для определения концентрации IgG и IgM и 2 мкл для определения концентрации IgA. В качестве стандарта была использована сыворотка крови овец с известным содержанием в ней иммуноглобулинов каждого изотипа. Результаты исследований. Установлено, что на 7-й день после иммунизации вакциной из штамма Rev-1 наблюдался подъем уровня агглютинирующих антител, титр которых составил 1:400. Максимальных значений (1:544) титр антител достигал на 24 день. В дальнейшем происходит постепенное снижение титра антител, который достигал 1:44 к 61 дню после вакцинации. К 90-му дню – антитела перестали определяться в стандартной РА (рис 1). Основную массу антител, выявляемых на 7-й день после иммунизации, составили иммуноглобулины М-изотипа, о чем свидетельствуют результаты его количественной характеристики, представленные на рис 2 (1 – «ЭВАК»; 2 – Rev-1). Максимального уровня IgM достигали у баранов, которые иммунизировались вакциной «ЭВАК», на 31-й день, а у баранов, иммунизированных вакциной из штамма Rev-1, – на 24-й день после вакцинации. В дальнейшем титр агглютинирующих антител начал снижаться, достигая исходного уровня к 90-му дню после вакцинации. Причем у вакцинированных животных, независимо от характера антигена, наблюдалась одиВетеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис 1. Динамика титра агглютинирующих антител у баранов в процессе поствакцинального иммуногенеза. Рис 2. Динамика уровня IgG в процессе поствакцинального иммуногенеза. наковая тенденция роста и снижения уровня антител. При этом количественные показатели IgM у животных, иммунизированных вакциной из штамма Rev-1, были незначительно выше, чем у животных, иммунизированных вакциной «ЭВАК». В сыворотках крови обеих групп животных до 31-го дня после вакцинации наблюдалось незначительное увеличение концентрации IgG, с последующим ее снижением (рис 3). При этом отмечено выраженное увеличение уровня IgA в сыворотке крови животных обеих групп (рис 4). Максимальная же концентрация IgA наблюдается в группе баранов, иммунизированных Ветеринарная патология. № 3. 2008 вакциной «ЭВАК», на 46-й день, а в группе, вакцинированных Rev-1, – на 61-й день после вакцинации, оставаясь практически без изменений до окончания сроков наблюдения (127 дней). В результате исследований было установлено, что динамика количественных изменений уровня IgG, IgM и IgA была практически одинакова у баранов, иммунизированных как «ЭВАК», так и Rev-1, и имела ряд аналогичных закономерностей. Из полученных данных следует, что в отличие от инфекционного процесса, в нестерильной фазе поствакцинального иммуногенеза преобладают в основном IgM. При первичной иммунизации образуется 79 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Рис 3. Динамика уровня IgM в процессе поствакцинального иммуногенеза. Рис 4. Динамика уровня IgA в процессе поствакцинального иммуногенеза. также некоторое количество IgG, появляющихся уже через несколько дней после начала синтеза IgM. Исследования показали, что через 30 дней после первичной иммунизации происходит переключение синтеза IgM и IgG плазматическими клетками на синтез IgA, о чем свидетельствует резкое повышение его уровня в сыворотке крови иммунизированных баранов. Анализ результатов по количественной характеристике иммуноглобулинов основных изотипов и титра антител, выявляемых в РА, показал, что имеется достоверная прямая корреляционная связь между этими показателями (r=0,91). С 91-го дня после вакцинации со снижением концентрации агглютинирующих антител IgM и IgG в сыворотке крови иммунизированных 80 баранов и в связи с тем, что антитела IgA не обладают агглютинирующими свойствами, антитела в РА не выявляются. Повышение уровня секреторных иммуноглобулинов в сыворотке крови при первичной иммунизации баранов против бруцеллеза, говорит о создании защитного барьера, в первую очередь, на уровне слизистых оболочек и кожных покровов, то есть мест, наиболее вероятных для проникновения возбудителя в макроорганизм. Таким образом, анализ полученных экспериментальных данных свидетельствуют о том, что вакцина «ЭВАК» при иммунизации баранов против ИЭБ, практически не уступает вакцине из штамма Rev-1 в выраженности поствакцинального иммуногенеза. Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ Литература 1. Бернет Ф. Клеточная иммунология. М.: «МИР», 1971, 543 с. 2. Вершилова П.А., Чернышева М.И., Князева Э.Н. Патогенез и иммунология бруцеллеза. М.: «Медицина», 1974, 270 с. 3. Игнатов П.Е. Иммунитет и инфекция. М.: Время, 2002. 352 с. 4. Колычев Н.М., Госманов Р.Г. Ветеринарная микробиология и иммунология. 3-е изд., перераб. и доп. М.: КолосС, 2006. 432 с. 5. Кондауров Б.И., Михайлова Н.Г. Биосинтез 19Sи 7S-антител у ягнят после введения бруцелл. // Сб. научных работ СибНИВИ, 1975, вып. 23, с.8-13 6. Красиков А.П. Искусственная регуляция паразито-хозяинных отношений при бруцеллезе животных. Монография. Омск: Изд-во ИВМ ОмГАУ, 2002. 272 с. 7. Майборода А.А., Кирдей Е.Г., Семинский И.Ж., Цибель Б.Н. Учебное пособие по общей патологии (иммунный ответ, воспаление). 2-е изд., доп. М.: МЕДпресс-информ, 2006. 112 с. 8. Объедков Г.А. Бруцеллез крупного рогатого скота и борьба с ним. Мн.: «Ураджай», 1977. 176 с. 9. Хоч А.А. Бруцеллез северных оленей в Якутии. / А.А. Хоч, Е.С. Слепцов; РАСХН. Сиб. отд-ние. Якут.сел. хоз-ва. Якутск: Сахаполиграфиздат, 2001, 216 с. 10. Manchini G., Carbonara A.O., Heremans J.P. Immunochemical quantitation br. antigens by sinle radial immunodiffusion. // Immunochemistry, 1965, 2, 3, s. 235-254 УДК 619:678-07:636.3(07) В.Ф. Ситников, Россельхознадзор Л.А. Гнездилова, ФГОУ ВПО «МГАВМиБ им. К.И. Скрябина» ПРОФИЛАКТИКА СИМПТОМАТИЧЕСКОГО БЕСПЛОДИЯ ОВЦЕМАТОК И КОНТРОЛЬ СОСТОЯНИЯ ИХ ВОСПРОИЗВОДСТВА Проблема борьбы с бесплодием овец и повышения их многоплодия весьма актуальна, требует дальнейшего разрешения и до настоящего времени является важной проблемой зооветеринарной науки и практики овцеводства; улучшение воспроизводства и ликвидация бесплодия животных невозможны без устранения их причин. Имеющиеся в специальной литературе данные по этому вопросу, особенно об акушерско-гинекологических заболеваниях овец и их лечении, нельзя считать достаточными. Считаем, что в овцеводческих хозяйствах необходимо ввести, по аналогии со скотоводством, акушерско-гинекологическую диспансеризацию. Это позволит осуществлять контроль состояния воспроизводства овец, своевременно выявлять больных животных и проводить профилактические и лечебные мероприятия. Акушерско-гинекологическая диспансеризация - это комплекс диагностических, лечебных и профилактических мероприятий, направленных на выявление причин и форм бесплодия самок, восстановление воспроизводительной функции и их высокой продуктивности (Шипилов B.C. и др.). В сельскохозяйственных предприятиях акушерско-гинекологическая диспансеВетеринарная патология. № 3. 2008 ризация должна проводиться в период осеменения и после родов - планово, в период суягности животных - при необходимости. При этом важно соблюдение поэтапности, систематичности, комплексности (проведение мероприятий в течение года в связи с особенностями технологии выращивания овец и их физиологии). Основные задачи акушерско-гинекологической диспансеризации овец. 1. Изучение физиологического состояния животных путем общего клинического исследования. 2. Выявление наиболее характерных признаков патологических изменений в половых органов с применением гинекологического исследования. 3. Диагностика физиологического состояния репродуктивных органов овцематок в период полового цикла. 4. Постановка точного диагноза заболевания. Определение полного состава возбудителей инфекций. 5. Изучение естественной резистентности организма животных, прогнозирование патологии родового акта. 6. Разработка схем лечебных и профилактических мероприятий. В период осеменения овец проводят исследование животных непосредственно перед осеменением, а также изу81 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ чают причины отсутствия стадии возбуждения у маток в течение двух половых циклов. Животных подвергают клиническому обследованию, определяют показатели естественной резистентности организма - фагоцитарную функцию лейкоцитов, бактерицидную, лизоцимную активность сыворотки крови, фагоцитарную активность нейтрофилов маточной слизи. С целью выявления возбудителей инфекционных заболеваний применяют бактериологическую диагностику с идентификацией и типизацией выделенных микроорганизмов, методы серологических исследований, люминесцентной микроскопии, ИФА, ПНР и др. Овцематок, не проявляющих половой охоты, подвергают гинекологическим исследованиям с использованием специальных лабораторных тестов, включающих цитохимический анализ влагалищных мазков, исследование влагалищной слизи и патоморфологические исследования участков полового аппарата животных с целью изучения особенностей протекания патологических процессов. В период суягности проводят обследование больных (абортировавших) животных и наблюдение за матками - микробоносителями, выявленными в процессе проведения первого этапа гинекологической диспансеризации. Больных животных исследуют клинически, гинекологически, патоморфоло-гически, бактериологически (абортированные плоды) с целью исключения стационарных инфекций. Больных и микробоносителей метят и изолируют. Перед родами возможно проведение цитохимических исследований влагалищных мазков с целью прогнозирования их течения. Проводят также определение фагоцитарной активности нейтрофилов и количества глюкозоаминогликанов в маточной слизи, как факторов местной защиты в половом аппарате овцематок. В послеродовой период осуществляют клиническое, гинекологическое обследование овец на 7, 14, 20 день с целью контроля послеродовой инволюции матки с исследованием лохий и выявления патологических процессов. На клинически больных животных изучают особенности течения патологического процесса - исследуют экссудат при эндометритах с определением их клинических форм, выявляют и идентифицируют возбудителей инфекции, используя специаль82 ные лабораторные методы исследования: бактериологический, серологический, иммунофлуоресцентный, ПЦР и патоморфоло-гический (по возможности). Проведение разработанной нами акушерско - гинекологической диспансеризации с последующими лечебно - профилактическими мероприятиями позволило в ряде сельскохозяйственных предприятий Московской области снизить процент заболеваемости овец с 40 до 10%, повысить плодовитость овцематок до 110%, а сохранность молодняка - до 96%. Плановое комплексное проведение мероприятий в рамках диспансеризации дало возможность установить причины нарушения половых циклов, в последующем осуществить мероприятия по стимуляции половой функции, повышению неспецифической резистентности организма (применение адаптогена стресс - корректора лигфол), проведению общих и специфических профилактических мероприятий с использованием дезинфицирующего средства дезконтен и с помощью комплексной вакцинации. Вывод. Причинами симптоматического бесплодия у овец являются патологии беременности, родов и послеродового периода. Нарушение технологии содержания, кормления, дисбаланс параметров микроклимата животноводческих помещений, перегруппировки, зооветеринарные мероприятия являются серьезными стресс-факторами для суягных овец. Инфекционные болезни, поражающие органы воспроизводства, также являются серьезными стресс-факторами для беременных овец. Конечный результат всего этого – бесплодие маточного поголовья и заболеваемость молодняка. В настоящее время нет еще единого мнения об эффективности применения методов профилактики акушерско-гинекологических заболеваний у овец. Для контроля воспроизводства необходимо тщательно разбираться в причинах бесплодия и разрабатывать научно-обоснованные схемы лечебно-профилактических мероприятий, направленные на восстановление воспроизводительной функции овцематок и их высокой продуктивности. Считаем, что плановое проведение в овцеводческих хозяйствах акушерско-гинекологической диспансеризации позволит решить комплекс вопросов по повышению воспроизводительной функции животных и профилактике симптоматического бесплодия. Ветеринарная патология. № 3. 2008 ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ В ВЕТЕРИНАРИИ SUMMARY Struggle with a sheep’s barrenness and the increase of their prolificacy is actual problem that need to be solved. Authors suggest to do an obstetric and gynecological clinical examination in sheep-breeding farms. The offered scheme of clinical examination with the following medical and preventive measures have allowed to lower percent of sheep’s diseases in a number of the agricultural enterprises. It also has allowed to increase their prolificacy and safety of young animals. Литература 1. Акатов В.А., Кононов Г.А. Ветеринарное акушерство и гинекология. Л.: «Колос», 1977. 2. Козлов Г.Г., Акназаров Б.К. Определение факторов местной защиты матки и влияние на них препаратов, применяемых внутриматочно при лечении эндометритов у коров: Рекомендации. М., 1989. 3. Панков Б.Г. Диагностика состояния половых органов коров с использованием акушерской Ветеринарная патология. № 3. 2008 ложки Панкова: Методические рекомендации М., 2000. 4. Студенцов А.П. Ветеринарное акушерство и гинекология /А.П. Студен-цов, B.C. Шипилов, В.Я. Никитин и др. М.: Колос, 1999. 490 с. 5. Шипилов B.C. и др. Практикум по акушерству, гинекологии и искусственному осеменению сельскохозяйственных животных. М.: «Агропром-издат», 1988. 83 ФАРМАКОЛОГИЯ ФАРМАКОЛОГИЯ В.Е. Абрамов, Т.И. Кугелева ФГУ «ВГНКИ» ИЗУЧЕНИЕ ПЕРЕНОСИМОСТИ ПРЕПАРАТА АЙСИДИВИТ НА ЛАБОРАТОРНЫХ ЖИВОТНЫХ Целью настоящего исследования было изучение переносимости препарата айсидивит, обладающего адаптогенными свойствами, на лабораторных животных. Материалы и методы. Изучение субхронической токсичности проводилось на 30 самцах белых крыс массой 220-240 г., которых разделили на три группы по 10 животных в каждой. Длительность эксперимента – 60 суток. Животным первой группы препарат вводили внутримышечно в дозе 0,1 мл/кг, второй группе - в пятикратно увеличенной дозе. Третья группа служила контролем. В течение 60 дней в процессе эксперимента у животных проводили гематологические и биохимические исследования крови и мочи. До начала эксперимента, а далее на 15 и 60 дни животных взвешивали и следили за их клиническим состоянием. Состояние периферической крови оценивалось с помощью общепринятых метоТаблица 1 Влияние препарата айсидивит на массу тела крыс Исследования, через недель 84 Масса тела крыс, г контроль 1 группа 0,1 мл/кг 2 группа 0,5 мл/кг 0 130±2,2 130,2±4,8 131,4±1,4 1 132±2,8 132,4±3,1 136,2±1,3 2 157±2,8 154,6±2,4 151,8±2,2 3 172,2±2,3 169±1,8 164±2,4 4 185,2±1,2 184±2,1 178,2±2,6 5 200,3±3,8 199,2±2,2 192,8±1,3 6 227,4±1,8 239,2±2,2 231,4±2,2 7 223,2±7,6 226,4±2,9 230,4±2,2 8 228,6±3,2 242,4±2,3 234,6±1,7 Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 2 Показатели периферической крови у крыс при внутримышечном введении препарата айсидивит Показатели Контроль До начала опыта 12,1±0,4 7,7±0,1 112,0±0,2 Через 15 дней 12,0±0,3 7,9±0,4 114,4±0,3 Через 30 дней 12,2±0,3 8,1±0,3 114,2±0,4 Через 60 дней 12,2±0,3 8,2±0,2 113,2±0,3 Лейкоциты, (х109/л) Эритроциты, (х10 12/л) Гемоглобин, г/л Лейкоциты, (х109/л) Эритроциты, (х10 12/л) Гемоглобин, г/л Лейкоциты, (х109/л) Эритроциты, (х10 12/л) Гемоглобин, г/л Лейкоциты, (х109/л) Эритроциты, (х10 12/л) Гемоглобин, г/л 1 группа 0,1 мл/кг 2 группа 0,5 мл/кг 11,9±0,4 7,5±0,2 113,4±0,1 11,7±0,4 7,4±0,3 112,0±0,7 12,2±0,3 8,2±0,3 115,1±0,4 12,1±0,2 8,1±0,4 115,6±0,2 12,3±0,4 8,2±0,4 116,7±1,4 12,2±0,3 8,0±0,2 115,3±0,2 112,6±0,2 8,4±0,3 113,8±0,9 112,7±0,3 8,5±0,4 113,6±0,7 Таблица 3 Биохимические показатели сыворотки крови крыс при внутримышечном введении препарата айсидивит Показатели Ед. измерения Контроль 1 группа 0,1 мл/кг 2 группа 0,5 мл/кг 52,80±2,3 До начала опыта Общий белок г/л 54,50±1,2 55,80±2,6 Глюкоза ммоль/л 5,50±0,20 5,3±0,10 5,40±0,2 Холестерин ммоль/л 1,10±0,02 1,1±0,03 1,10±0,05 Мочевина ммоль/л 7,22±0,2 7,24±0,50 7,28±0,4 Креатинин мг% 0,67±0,02 0,69±0,03 0,67±0,02 22,8±1,2 23,0±0,2 22,9±0,4 ЩФ ед./100 мл Через 15 дней Общий белок г/л 55,80±0,7 56,80±0,9 55,8±0,8 Глюкоза ммоль/л 5,50±0,4 5,50±0,3 5,7±0,20 Холестерин ммоль/л 1,3±0,02 1,2±0,04 1,3±0,02 Мочевина ммоль/л 7,30±0,2 7,20±0,1 7,2±0,7 Креатинин мг% 0,69±0,03 0,68±0,01 0,70±0,04 23,8±0,2 23,6±0,5 23,9±0,1 ЩФ ед./100 мл Через 60 дней Общий белок г/л 55,8±2,4 55,9±2,7 55,7±2,3 Глюкоза ммоль/л 5,50±0,3 5,40±0,2 5,30±0,4 Холестерин ммоль/л 1,30±0,2 1,31±0,01 1,29±0,04 Мочевина ммоль/л 7,1±0,60 7,2±0,50 7,20±0,6 Креатинин мг% 0,72±0,01 0,75±0,04 0,71±0,03 дик. Определялись: количество гемоглобина, лейкоцитов и эритроцитов. Для вычисления лейкограммы кровь фиксировали спиртом на мазках и окрашивали по Романовскому-Гимзе. Функциональное состояние печени оценивалось с помощью биохимических методов определения глюкоВетеринарная патология. № 3. 2008 зы, холестерина, щелочной фосфатазы и креатинина. О белковообразовательной функции печени судили по содержанию белка в сыворотке крови. Функциональное состояние почек оценивали по содержанию в моче белка, креатинина (по методу Яффе) и мочевины. 85 ФАРМАКОЛОГИЯ Таблица 4 Результаты исследования функции почек крыс при внутримышечном введении препарата айсидивит Показатели Субстрат Единицы измерения Контроль 1 группа 0,1 мл/кг 2 группа 0,5 мл/кг До начала опыта мл 8,0±0,4 8,60±0,2 8,60±0,60 Мочевина Диурез моча мг/% 0,98±0,02 1,00±0,04 0,92±0,06 Креатинин моча мг/% 24,0±0,4 24,1±0,2 24,0±0,8 Белок моча г/сут. 0,022±0,002 0,024±0,002 0,020±0,004 Через 15 дней мл 8,8±0,6 9,0±0,02 8,2±0,4 Мочевина Диурез моча мг/% 0,92±0,02 1,00±0,04 1,00±0,06 Креатинин моча мг/% 23,8±0,80 24,00±0,20 23,80±0,60 Белок моча г/сут. 0,018±0,003 0,021±0,004 0,020±0,006 Через 60 дней Диурез мл 9,2 9,0 9,4 Мочевина моча мг/% 0,9±0,02 0,92±0,01 0,92±0,01 Креатинин моча мг/% 21,8±0,4 22,2±0,5 22,4±0,6 Белок моча г/сут. 0,010±0,002 0,012±0,004 0,011±0,002 Данные, полученные при вышеуказанных исследованиях, были проанализированы методом математической статистики с вычислением средней арифметической величины (М), ее ошибки (+m) и уровня значения величины Р. Результаты исследования. В процессе опыта гибели крыс не отмечали. Клиническое состояние животных не изменялось. В течение эксперимента подопытные крысы были активны, подвижны, аппетит был сохранен. Потребление воды и корма в опытных и контрольных группах было одинаково. Достоверного различия в приросте массы тела опытных и контрольных животных не наблюдали (таблица 1). Показатели периферической крови у животных опытных групп находились на одном уровне с контролем и от них не отличались (таблица 2). При изучении биохимических показателей крови крыс мы не установили достоверных различий в показателях контрольной и опытных групп (таблица 3). При изучении функциональных показателей почек (количество белка, мочевины, креатинина) у подопытных и контрольных крыс, достоверных различий не установлено (таблица 4) Заключение. Айсидивит в терапевтической и в пять раз увеличенной дозах при внутримышечном введении крысам в течение 60 дней не оказывает отрицательного действия на показатели, характеризующие функциональное состояние печени, почек, крови и различных обменных процессов в организме животных. SUMMARY The intramuscular administration of therapeutic dose and the quintuple of the recommended one to rats in the course of 60 days does not affect adversely the indices of functional condition of liver, kidneys, blood and various metabolic process in animals’ organism. 86 Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ УДК 619:616-084:579.843.95:636.93 А.С. Андрусевич РУП «Институт экспериментальной ветеринарии им. С.Н. Вышелесского», г. Минск, Республика Беларусь КОНСТРУИРОВАНИЕ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ПАСТЕРЕЛЛЕЗА ПУШНЫХ ЗВЕРЕЙ Вакцинопрофилактика имеет первостепенное значение в защите пушных зверей от различных инфекционных заболеваний. Особенно это важно в отношении болезней, возникающих в звероводческих хозяйствах при концентрации большого поголовья на ограниченных площадях. Вакцина против пастереллеза пушных зверей по серовариантному составу должна готовиться с учетом этиологической структуры заболевания у животных данного вида на данной территории. Проведенные нами исследования по установлению этиологической структуры пастереллеза у пушных зверей на территории Республики Беларусь показали, что эта болезнь вызывается наиболее важными в эпизоотическом отношении пастереллами серовариантов А и В. С учетом этого для приготовления инактивированной вакцины против пастереллеза пушных зверей мы использовали следующие штаммы пастерелл: штамм Pasteurella multocida серовариант А (КМИЭВ-67) – штамм - антиген, штамм Pasteurella multocida серовариант В (КМИЭВ-68) – штамм – антиген. Инактивированная вакцина против пастереллеза пушных зверей изготавливалась в условиях РУП «Институт экспериментальной ветеринарии им. С.Н. Вышелесского» в соответствии с разработанным нами ТНПА. Исследования по получению инактивированной вакцины против пастереллеза пушных зверей проводились в 7 этапов: 1. Реактивация и контроль штаммов 2. Хранение и поддержание производственных штаммов; 3. Получение матровой расплодки; 4. Инактивация; 5. Составление серии вакцины; 6. Расфасовка серии вакцины; 7. Маркировка, упаковка и хранение вакцины; 8. Контроль биопрепарата: - внешний вид, наличие механических включений; - стерильность; - безвредность; Ветеринарная патология. № 3. 2008 - реактогенность; - иммуногенность; - концентрация водородных ионов (рН). Реактивация и контроль штаммов. Вакцину готовили из штаммов пастерелл: Pasteurella multocida КМИЭВ-67, КМИЭВ -68. Перед использованием штаммов в производстве их проверяли, на соответствие паспортным данным, на морфологические, культуральные, биохимические свойства. Для этого горлышко ампулы с сухой культурой надпиливали, обжигали над пламенем спиртовки, отламывали и растворяли культуру в 1-2 см3 МПБ, вносили ее в пробирку с мясопептонным бульоном (МПБ) и культивировали в течение 18 часов при температуре от +37 до +380С. После этого культуру пересевали 2 раза через каждые 6 часов в МПБ. Затем культуру высевали на чашки Петри с 2%-ным МПА для отбора колоний только в «S» форме, с которыми в дальнейшем и вели работу по изучению всех свойств штаммов. Культуральные свойства: Культуры пастерелл на МПА в чашках Петри через 18-24 часа культивирования при температуре 37-380С давали мелкие голубовато-прозрачные колонии «S» формы. На МПБ пастереллы в первые дни роста вызывали легкое помутнение среды с образованием слизистого осадка через 23 суток, который при встряхивании поднимался в виде «косички». Морфологические свойства: Морфологию изучали в мазках, окрашенных по Граму из агаровых и бульонных культур. Пастереллы представляли собой неподвижные, грамотрицательные, очень мелкие коккообразные или овальной формы палочки, спор не образовывали. Подвижность определяли посевом в полужидкий агар (ПЖА). Биохимические свойства: Сахаролитические свойства пастерелл определяли на жидких питательных средах Гисса с индикатором Андреде. Пастереллы ферментировали с образованием кислоты без газа глюкозу, галак87 ФАРМАКОЛОГИЯ тозу, сахарозу, ксилозу, маннит, сорбит. Не расщепляли раффинозу, мальтозу, арабинозу, дульцит и лактозу. Протеолитические свойства пастерелл определяли посевом на молоко и мясопептонную желатину. Пастереллы не разжижали желатину, не свертывали молоко. Образовывали индол и сероводород. Способность образовывать индол и сероводород определяли на бульоне Хоттингера или Мартена. Для этого под пробку пробирки с засеянной культурой помещали две индикаторные бумажки. Если культура выделяла индол, то индикаторная бумажка приобретала сиреневый или малиновый цвет различной интенсивности. При выделении сероводорода бумажка чернела. Учет биохимических свойств проводили через 1, 2, 3, 5 и 10 суток культивирования пастерелл при температуре от +37 до +380С. Хранение и поддержание производственных штаммов. Производственные штаммы хранятся в ампулах при температуре +2 +40С после лиофильного высушивания в сахароза - желатиновой среде в течение 5 лет. Жизнеспособность поддерживается путем пересева на питательные среды – ПЖА, бульон Хоттингера, МПА на основе перевара Хоттингера 1 раз в течение месяца при условии хранения при +2 +40С. Получение матровой расплодки. Штаммы пастерелл засевали в пробирки с бульоном Хоттингера и выращивали при температуре 370С 18 часов. После окончания культивирования культуру проверяли на чистоту путем микроскопии мазков, окрашенных по Граму. После инкубации бульонные культуры засевали на агар Хиттингера из расчета 1 пробирка бульонной культуры на матровую колбу. Засеянные на агар Хиттингера в матрах культуры равномерно распределяли по поверхности агара путем покачивания матр и культивировали в термостате при температуре 370С в течение 18 часов. Выборочно проводили микроскопический контроль чистоты матровых расплодок. Культуры смывали с агара из расчета 50 см3 физиологического раствора на матру. Смытые культуры Pasteurella multocida серовариантов А и В смешивали в соотношении 1:1 в одной стерильной емкости, определяли концентрацию микробных клеток по оптическому стандарту мутности ГИСК им. Л.А. Тарасевича и физиологическим раствором доводили содержание микробных клеток до 5 млрд/мл. Инактивация. Для инактивации пасте88 релл использовали формалин с содержанием не менее 36% формальдегида. Формалин предварительно разводили дистиллированной водой в соотношении 1:1 и добавляли при постоянном помешивании до конечной концентрации в среде 0,5%. Инактивацию культур проводили в течение 5-7 суток при температуре от +37 до +420С. В процессе инактивации культуры перемешивали в течение 5 минут 2-4 раза в сутки. Полноту инактивации проверяли путем посева культур на питательные среды в объеме 0,2 см3 в пробирки с МПБ, МПА. Посевы выдерживали в термостате при температуре от +37 до +380С в течение 10 суток. Все посевы к процессе культивирования были стерильными. Составление серии вакцины. К инактивированной смеси культур пастерелл, добавляли 10%-ный раствор алюмокалиевых квасцов до концентрации 10% к объему вакцины. Вакцину подщелачивали 4%ным раствором гидроокиси натрия до pH 7,0-7,6. Тщательно перемешивали и оставляли на 24 часа при температуре 18-240С. Затем, брали пробу вакцины и проверяли на стерильность путем посева на питательные среды. Расфасовка серии вакцины. После установления стерильности (отсутствия роста микрофлоры на питательных средах) вакцину расфасовывали по 50, 100 и 200 см3 в хорошо промытые стеклянные стерильные флаконы (режим стерилизации Т= +1320С, время 2 часа), плотно закрывали стерильными резиновыми пробками и обкатывали металлическими колпачками (согласно действующим ТНПА). Маркировка, упаковка и хранение вакцины. На флаконы с вакциной наклеивали этикетку, на которой указывали: - наименование изготовителя; - наименование вакцины; - номинальное количество в см3; - номер серии; - номер контроля; - дату изготовления; - срок годности; - условия хранения; - обозначение настоящих ТУ BY 600049853.129-2008; - надписи «Стерильно», «Перед применением взбалтывать», «Для ветеринарии» (рисунок). Флаконы с вакциной упаковывали в картонные ящики по действующему ТНПА (масса брутто не более 20 кг). Внутрь Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ каждого ящика вкладывали контрольный листок с указанием: - наименования вакцины; - номинального количества в см3 в транспортной таре; - номера серии; - даты упаковки; - номера и фамилии упаковщика. Каждую единицу потребительской тары снабжали инструкцией по применению. Маркировали транспортную тару этикеткой, содержащей следующую информацию: - наименование изготовителя; - наименование вакцины; - номер серии; - номер контроля; - дата изготовления; - срок годности; - обозначение настоящих ТУ BY 600049853.129-2008; - количество единиц потребительской тары (флаконов) в единице транспортной тары; - манипуляционные знаки «Верх», «Ограничение температуры» по ГОСТ 14192-96. Вакцину хранить в сухом, темном помещении при температуре от плюс 2 до плюс 150 С. Контроль биопрепарата. Контроль качества инактивированной вакцины против пастереллеза пушных зверей (исследования внешнего вида, стерильности, безвредности, реактогенности, иммуногенности, определение концентрации водородных ионов) проводили в условиях отдела бактериальных инфекций и вивария РУП «Институт экспериментальной ветеринарии им. С.Н. Вышелесского». Для определения внешнего вида, наличия механических включений, плесени, неразбивающихся конгломератов все флаконы с вакциной встряхивали, просматривали в проходящем свете. Одновременно проверяли правильность маркировки. Флаконы с вакциной были без трещин, плотно укупорены, содержали жидкость соломенно-желтого цвета с серо-белым осадком, который при встряхивании легко разбивается в гомогенную взвесь, без посторонних механических включений. Анализ стерильности инактивированной вакцины против пастереллеза пушных зверей проводили в соответствии с ГОСТ 28085-89 «Препараты биологические. Методы бактериологического контроля стерильности». Суть опыта заключается в определении отсутствия роста бактериальной и грибковой микрофлоры на питательных средах в посевах из образцов сеВетеринарная патология. № 3. 2008 Рисунок. Инактивированная вакцина против пастереллеза пушных зверей рии биопрепарата. Роста микрофлоры в пробирках с посевами вакцины не обнаружено, что свидетельствует о стерильности инактивированной вакцины против пастереллеза пушных зверей. Определение безвредности инактивированной вакцины против пастереллеза пушных зверей определяли путем подкожного введения препарата 10-ти белым мышам массой 18-20 г. в дозе 0,5 см3. Животные оставались живыми в течение 10 дней (срок наблюдения), а на месте введения препарата не было отека и некроза тканей. Реактогенность инактивированной вакцины против пастереллеза пушных зверей устанавливали путем внутримышечного введения 6-и клинически здоровым кроликам в дозе 5 см3 с внутренней стороны бедра и судили по местной и общей реакции организма на введение в течение 10 дней. Через 10 дней после введения препарата проводили убой кроликов, место введения осматривали на наличие остатков вакцины. В течение наблюдения местной и общей реакции организма на введение препарата не отмечали, остатков вакцины на месте введения не обнаружено. Проверку иммуногенных свойств ина89 ФАРМАКОЛОГИЯ Таблица Иммуногенная активность инактивированной вакцины против пастереллеза пушных зверей Группы животных Количество павших животных Количество выживших животных 1 опытная 1 (10%) 9 (90%) 2 опытная 1 (10%) 9 (90%) 1 контрольная 10 (100%) - 2 контрольная 10 (100%) - 3 контрольная - 10 (100%) ктивированной вакцины против пастереллеза пушных зверей проводили на 50 белых мышах массой 16-18 г. путем двукратной иммунизации с интервалом 7 дней с последующим заражением. По принципу аналогов из животных сформировали 5 групп (2 опытные и 3 контрольные) по 10 мышей в каждой. Мышей опытных групп иммунизировали вакциной подкожно в дозе 0,3 см3. Напряженность иммунитета определяли через 10 дней после повторной иммунизации путем подкожного заражения животных 18 – часовой бульонной культурой в дозе 2LD50. Опытных животных 1 группы заражали культурой Pasteurella multocida серовариантом А; 2 группы - Pasteurella multocida серовариантом В; 1 контрольную группу - Pasteurella multocida серовариантом А; 2 контрольную - Pasteurella multocida серовариантом В и животным 3 контрольной группы вводили физиологический раствор по той же схеме. За животными вели наблюдение в течение 10 дней (таблица). При изучении иммуногенной активности инактивированной вакцины против пастереллеза пушных зверей на лабораторных животных результаты исследований показали, что в опытных группах № 1 и № 2 пало по одной мыши. В контрольных группах № 1 и № 2 отмечали гибель 100% животных, в контрольной группе № 3 – все мыши остались живы. Таким образом, иммуногенная активность инактивированной вакцины против пастереллеза пушных зверей составила для Pasteurella multocida сероварианта А 90%, и Pasteurella multocida сероварианта В - 90%. Концентрацию водородных ионов в вакцине определяли потенциометрическим методом согласно инструкции, приложенной к прибору. рН вакцины находился в пределах 7,07,6, что соответствует требованиям ТНПА. Выводы 1. Разработанная и приготовленная нами инактивированная вакцина против пастереллеза пушных зверей является стерильным, безвредным, ареактогенным и иммуногенным биопрепаратом. 2. На инактивированную вакцину против пастереллеза пушных зверей, и способ ее получения получен положительный результат предварительной экспертизы Национального центра интеллектуальной собственности при Совете Министров Республики Беларусь на патент. РЕЗЮМЕ В данной статье речь идет о способе конструирования инактивированной вакцины против пастереллеза пушных зверей и результатах изучения ее биологических свойств. SUMMARY In given article it is a question of a way of designing of the killed vaccine against pasteurellosis fur animals and results of studying of its biological properties. Литература 1. Азарян С. Л. Изучение реактогенности и иммуногенности противопастереллезных вакцин с различными адъювантами на лабораторных животных // Диагностика, профилактика и меры борьбы с инфекц. и инваз. болезнями с.-х. животных и птиц на Сев. Кавказе: Сб. науч. тр. Новочеркасск, 1990. С. 52-59. 2. Басканьян И.А. Культивирование микроорганизмов с заданными свойствами. М.: Медицина, 1992. 192с. 3. Воробьев А. А., Васильев Н. Н. Адъюванты. М.: 90 Медицина, 1969, 206 с. 4. ГОСТ 28085-89 «Препараты биологические. Методы бактериологического контроля стерильности». 5. Медуницын Н. В. Вакцинология. М.: Триада-Х, 1999. 272 с. 6. Carter G. The preparation and use of vaccines for the prevention of pasteurellosis // Can. Vet. J. 1961. N. 2. P. 96. 7. Gilmour N.J. et al. Pasteurellosis vaccines // Pat. 2029219 G.Br. МКИ2А61К39/102. Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ УДК: 639.9.091 К.В. Гаврилин «НВЦ Агроветзащита» УРОВЕНЬ ЧУВСТВИТЕЛЬНОСТИ ВОЗБУДИТЕЛЕЙ БАКТЕРИАЛЬНЫХ БОЛЕЗНЕЙ РЫБ К АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ Введение Значительную долю среди патологий рыб занимают бактериальные болезни [1, 2, 3]. Несмотря на большой арсенал химиотерапевтических средств борьба бактериозами рыб представляет значительную проблему. Эта ситуация во многом связана с развитием у возбудителей антибиотикорезистентности. Появление устойчивых штаммов отмечено у широкого круга бактериальных патогенов рыб появились сообщения о появлении лекарственноустойчивых штаммов бактерий в товарном рыбоводстве, аквариумистике, разведении креветок [4, 5, 6]. Устойчивость к антибиотикам формируется у широкого круга бактериальных патогенов рыб: аэромонад, псевдомонад, флавобактерий, миксобактерий и некоторых других [7, 8, 9]. В настоящее время особо остро проблема бактериальных заболеваний рыб стоит в декоративном аквариумном рыбоводстве, при проведении карантина закупленных за рубежом гидробионтов. В связи с чем, целью нашей работы было исследование уровня чувствительности основных групп возбудителей бактериозов рыб к различным антибактериальным химиопрепаратам. Материалы и методы Работы провели течение 2006 и 2007 г.г. в аквариальных карантинных цехах г. Москвы и Московской области. Объектом исследования служили тропические рыбы различных видов спонтанно пораженных бактериальными инфекциями, протекавшими в виде генерализованных септицемий. Больных рыб подвергали микробиологическим исследованиям. Материал печени и почек засевали на плотные питательные среды МПА (мясопептонный агар) и Эндо. Посевы инкубировали в термостате при 290 С, 72 часа. Первичную дифференциациацию выделенных культур проводили на среде Олькеницкого. Образование индола учитывали мо методу Синева [10], а наличие цитохромоксидазы по Эрлиху [11]. Отношение к окраске по Граму определяли тестом с 3% КОН. Ветеринарная патология. № 3. 2008 Идентификацию выделенных бактериальных штаммов проводили при помощи Определителя бактерий Бержи [12] и руководства по изучению энтеробактерий Ф. Кауфмана [13]. Антибиограммы исследовали методом стандартных индикаторных дисков (диффузии в агар) [14] содержащих антибактериальные вещества различных групп: фторхинолонов – ципрофлоксацин; цефалоспоринов – цефтазидим и цефтриаксон; аминогликозидов – гентамицин; тетрациклинов – тетрациклин и левомицетин. Всего было изучено 214 культур микррорганизмов. Результаты и обсуждение В ходе исследований была выделена нижеследующая доминирующая микрофлора: подвижные представители рода Aeromonas – 22,5% от общего числа изученных культур, семейства Enterobacteriaceae – 22,5%, неферментирующих щелочеобразователей родов Moraxella – 21,4% и Acinetobacter – 19,3%, родов Flavobacterium – 3,1% и Staphilococcus – 4,2%. Большинство этих микроорганизмов описаны в качестве патогенов рыб [15, 16, 17]. Остальные 7% приходилось на грампозитивные сапрофитные микроорганизмы проникшие во внутренние органы рыб видимо за счет критического снижения их иммунофизиологического статуса. Данные, полученные при изучении антибиограмм выделенных возбудителей представлены в таблицах 1 и 2. Помимо этого отмечены случаи скоротечного формирования антибиотикорезистентных мутантов in vitro. Аэромонады формировали мутанты резистентные к цефтазидиму в 5% случаев, к цефтриаксону в 5%, к гентамицину 10%. Моракселлы к цефтизидиму в 5%. При исследовании культур ацинетобактеров обнаружено 6,6% мутантов резистентных к цефтазидиму и 4,2% к цефтриаксону. При изучении представителей семейства кишечных бактерий обнаружено 5% культур формировавших устойчивые мутанты к левомицетину. Из полученных результатов видно, что возбудители бактериальных болезней тро91 ФАРМАКОЛОГИЯ Таблица 1 Уровень чувствительности к антибактериальным препаратам доминирующих групп микроорганизмов выделенных от больных рыб в 2006 Группа микроорганизмов Aeromonas Enterobacteriaceae Moraxella Acinetobacter Flavobacterium Staphilococcus Уровень чувствительности Антибактериальный препарат Ципро- Цефта- Цефт- Левоми- Гента- Тетрафлоксацин зидим риаксон цетин мицин циклин Чувствительные 80,0 50,6 62,0 30,5 70,5 Промежуточные 10,5 0,0 0,0 9,5 15,0 0,0 0,0 Резистентные 9,5 49,4 38,0 60,0 14,5 100,0 100,0 Чувствительные 85,0 50,0 87,5 50,0 75,0 Промежуточные 5,0 12,5 0,0 24,1 3,4 0,0 Резистентные 10,0 37,5 12,5 25,9 21,6 0,0 Чувствительные 72,8 25,0 25,0 0,0 Промежуточные 13,2 0,0 25,0 0,0 Резистентные 14,0 75,0 50,0 100,0 50,0 Н/И 0,0 Чувствительные 86,0 57,1 57,1 80,0 Промежуточные 14,0 14,2 28,1 0,0 3,6 Резистентные 0,0 28,7 14,4 20,0 19,4 Чувствительные 89,1 60,0 Промежуточные 8,9 24,1 Н/И Н/И Резистентные 2,0 15,9 Чувствительные 80,0 Промежуточные 10,0 Резистентные 10,0 80,0 100,0 10,9 0,0 10,0 14,2 15,2 Н/И 79,1 70,6 Н/И 50,0 0,0 0,0 Н/И Н/И 100,0 0,0 Примечание: Н/И – не исследовали. пических рыб имеют высокий уровень устойчивости к практически всем группам антибактериальных химиопрепаратов. Это скорее всего связано с массированным и не рациональным применением антибиотиков при их выращивании (в рыбоводных хозяйствах Юго-Восточной Азии) и карантинировании. Наибольшую активность против всех основных групп возбудителей продемонстрировал ципрофлоксацин. Цефтриаксон превосходит ципрофлоксацин по активности против энтеробактерий, но значительно уступает в ему в эффективности по отношению к другим группам возбудителей. Уровень резистентности бактериальных агентов по отношению к традиционно применяемым в рыбоводстве препаратам: левомицетину и тетрациклину, обуславливает их низкую эффективность (что подтверждается терапевтической практикой). Активность против достаточно большого количества штаммов возбудителей продемонстрировал гентамицин, хотя он и несколько уступает ципрофлоксацину. В ходе работ были так же отмечены случаи формирования резистентных мутантов in vitro. У моракселл к цефтазидиму в 10% изученных культур, энтеробактерий 92 к левомицетину 5% случаев, моракселл к гентамицину 10% случаев. Исследования 2007 г. подтвердили закономерности выявленные в 2006 г. Наиболее активным антибактериальным агентом является ципрофлоксацин. Цефтриаксон по прежнему превосходит его в активности против отдельных групп возбудителе, значительно уступая в активности против других. Отмечены достаточно существенные колебания активности цефтазидима и гентамицина. На фоне возрастания активности против одних групп возбудителей наблюдается ее падение по отношению к другим группам. Наличие большого количества случаев скоротечного формирования резистентных мутантов in vitro свидетельствует о высокой способности патогенов рыб формировать лекарственную устойчивость. В этих условиях необходим строгий научный подход к терапии бактериальных заболеваний рыб. Выводы В ходе исследований выявлен высокий уровень резистентности бактериальной микрофлоры к антимикробным химиопрепаратам. Это скорее всего связано с массированной не рациональной химиотерапией используемой при выращивании и каранВетеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 2 Уровень чувствительности к антибактериальным препаратам доминирующих групп микроорганизмов выделенных от больных рыб в 2007 г. Группа микроорганизмов Aeromonas Enterobacteriaceae Moraxella Acinetobacter Flavobacterium Staphilococcus Уровень чувствительности Антибактериальный препарат ЦипроЦефта- Цефт- Левоми- Гента- Тетрафлоксацин зидим риаксон цетин мицин циклин Чувствительные 82,0 75,0 75,0 40,0 25,0 Промежуточные 12,0 0,0 0,0 0,0 50,0 0,0 0,0 Резистентные 6,0 25,0 25,0 60,0 25,0 100,0 100,0 Чувствительные 87,0 75,0 75,0 75,0 75,0 Промежуточные 13,0 0,0 0,0 0,0 0,0 0,0 Резистентные 0,0 25,0 25,0 25,0 25,0 0,0 25,0 Чувствительные 73,3 42,7 14,4 12,5 28,7 Промежуточные 10,6 28,5 57,1 0,0 14,2 25,0 Резистентные 16,1 14,2 28,5 87,5 57,1 50,0 Чувствительные 84,0 10,0 0,0 100,0 0,0 Промежуточные 14,8 80,0 50,0 0,0 100,0 Резистентные 3,2 10,0 50,0 0,0 0,0 Чувствительные 89,0 100,0 100,0 100,0 100,0 100,0 Промежуточные 9,0 0,0 0,0 0,0 0,0 0,0 Н/И Резистентные 2,0 0,0 0,0 0,0 0,0 0,0 Чувствительные 85,0 60,0 60,0 100,0 100,0 100,0 Промежуточные 0,0 40,0 40,0 0,0 0,0 0,0 Резистентные 15,0 0,0 0,0 0,0 0,0 0,0 Примечание: Н/И – не исследовали. тинировании рыб. В настоящий момент для импирической терапии бактериозов рыб пригоден только ципрофлоксацин. При этом в течение двух лет не отмечено снижение его активности, что свидетельствет о более медленном (по сравнению с другими препаратами) формировании устойчивости к фторхинолонам. Это согласуется с данными, полученными при его использовании в гуманной медицине [18]. Цефтриаксон и гентамицин активны только против отдельных групп возбуди- телей, что диктует необходимость проведения микробиологического исследования перед их использованием. Применение «традиционных» для рыбоводства левомицетина и тетрациклина низкоэффективно. Доля устойчивых к их действию штаммов возбудителей достигает 100%. В данной ситуации необходим научнобоснованный подход к терапии бактериальных болезней рыб, мониторинг уровня антибиотикорезистентности возбуделей и превентивный поиск новых эффективных препаратов. РЕЗЮМЕ Исследован уровень чувствительности различных групп микроорганизмов выделенных от больных рыб к антибиотикам. Выявлен высокий уровень чувствительности выделенной микрофлоры к различным классам антибиотиков. Наиболее активными препаратами из исследованных нами препаратов были ципрофлоксацин, цефтриаксон и гентамицин. Традиционно применяемые, в рыбоводстве антибиотики левомицетин и тетрациклин малоэффективны. SUMMARY The level of sensitivity of various groups of microorganisms allocated from sick fishes to antibiotics is investigated. Low level of sensitivity of the allocated micro flora to various classes of antibiotics is revealed. The most activity monitored: ciprofloxacin, ceftriacson and gentamycin. Traditionally applied, in fish culture antibiotics chloramphenicol and tetracyclin are ineffective. Литература 1. Гаврилин К.В. Опыт борьбы с бактериальной геморрагической септицемией (БГС) в условиях декоративной аквариумистики // Мат-лы Междунар. научн.-практ. конф. Молодых ученых Киев. 2002. С. 147–149. 2. Dr. Chris Andrews, Adrian Exell & Dr. Neville Car- Ветеринарная патология. № 3. 2008 ington. The interpet manual of fish health. Interpet Ltd. 2005/ 208 p. 3. Bassleer G. The new illustrated guide to fish diseases in ornamental tropical and pond fish. Westmeerbeec: Responsible publisher. 2005. 232. p. 4. Brown J.H. Antibiotics: Their use and abuse in 93 ФАРМАКОЛОГИЯ aquaculture //World Aquaculture. 1989. P. 34-43. 5. Dixon B.A. Antibiotic resistance of bacterial fish pathogen //World Aquaculture Society. 1994. N 25. P. 60-63. 6. Dixon B.A. The biology of antibiotic resistance // World Aquaculture. 2001. V 32, N 4. P. 63-65. 7. Schlotfeldt H.J., Neumann W., Fuhrmann H., Pfortmueller K., Boehm H. Remarks on increasing resistance of fish pathogenic and facultative-fishpatogenic bacteria in Lower Saxony (FRG) // Fish Pathology. 1985. N 9. P. 85-91. 8. Mc Pherson R.M., De Paola A., Zuwno S.R., Motes J.R., Miles L., Guarino A.M. Antibiotic resistance in Gram-negative bacteria from cultured catfish and aquaculture ponds //Aquaculture. 1991. 99, N 34. P. 203-211. 9. Lewin C.S., Mechanisms of resistence development in aquatic microorganisms // Chemiotherapy in aquaculture from ther to reality. Paris: O.I.E., 1992. P. 288-301. 10. Юхименко Л.Н., Койдан Г.С. Современное состояние проблема аэромоноза рыб //Рыбн. хоз.-во / Сер. Аквакультура: Информ. пакет Болезни рыб. М.: ВНИЭРХ, 1997. Вып. 2. C. 1-5. 11. Юхименко Л.Н., Койдан Г.С., Бычкова Л.И., Гаврилин К.В. Этиологическая структура аэромо- над и эпизоотическая ситуация в рыбоводных хозяйствах // Рыбн. хоз.-во / Сер. Болезни гидробионтов в аквакультуре. Аналит. и реф. информ. М.: ВНИЭРХ. 2001. Вып. 4. С. 1-9. 12. Amlacher E. Taschenbuch der fishkrankheiten. Jena: Gustaf fisher verlag, 1961. 286 s. 13. Bullook G.L., Conroy D.A., Snieszko S.F. Bacterial diseases of fish (eds. Snieszko S.F., Axelord H.R.). Neptune city: T.F.H. Publications, 1972. 14. МУК 4.2.1890-04. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания. 15. 9. Юхименко Л.Н., Койдан Г.С., Бычкова Л.И., Гаврилин К.В. Этиологическая структура аэромонад и эпизоотическая ситуация в рыбоводных хозяйствах. // Рыбн. хоз.-во / Сер. Болезни гидробионтов в аквакультуре. Аналит. и реф. информ. М.: ВНИЭРХ, 2001; 4: 1–9. 16. Amlacher E. Taschenbuch der fishkrankheiten. Jena: Gustaf fisher verlag, 1961. 17. Bullook G.L., Conroy D.A., Snieszko S.F. Bacterial diseases of fish (eds. Snieszko S.F., Axelord H.R.). Neptune city: T.F.H. Publications, 1972. 18. Падейская Е.Н., Яковлев В.П. Антимикробные препараты группы фторхинолонов в клинической практике. М.: ЛОГАТА, 1998. 352 с. УДК 619:616.995.1-085 А.А. Зверев ФГУ «ВГНКИ» ИЗУЧЕНИЕ ФАРМАКОКИНЕТИКИ ИМИДОКАРБА В ОРГАНИЗМЕ СОБАК Исследование фармакокинетики имидокарба проводили на 4 беспородных собаках массой 14-17 кг. Перед проведением опыта животные были клинически обследованы, проведены биохимический и общий анализ крови. По результатам исследований патологий выявлено не было. Препарат животным вводили однократно, внутримышечно в дозе 4 мг/кг. Взятие крови проводили из периферических вен в заранее определенные сроки (15, 30, 45 минут и далее по часам 1; 3; 6; 9; 12; 15; 18; 21; 24; 48; 72; 96 и 120). Количественное определение содержания имидокарба дипропионата в плазме крови собак проводили методом высокоэффективной жидкостной хроматографии с ультрафиолетовым детектированием. Принцип метода заключается в экстракции действующего вещества из проб плазмы соляной кислотой с метанолом, переэкстракции в диэтиловый эфир, выщелачивании, упаривание экстракта и хроматографировании на жидкостном хроматографе высокого давления с использованием обращеннофазовой колонки и компьютер94 ной программы обработки данных Мультихром (версия 1.52). Для определения имидокарба в плазме крови собак использовали: жидкостной хроматограф высокого давления Bischoff с УФ-детектором Lambda 1000; хроматографическая обращеннофазовая колонка Lichrospher 100 RP 18 E (250/4,6 мм) с размером частиц сорбента 5 мкм («Bischoff»); вакуумный ротационный испаритель BŰCHI R-114 с вакуумным насосом BŰCHI B-169 и водяной баней BŰCHI B-480 («Donau»); центрифугу лабораторную Sigma 2 K 15; ультразвуковую ванну DLS-310-T; встряхиватель Techmatic TM 1; весы лабораторные, ГОСТ 24104-2001; посуду мерную, лабораторную стеклянную, ГОСТ 1770; воду деионизированную; кислоту фосфорную, о.с.ч., ТУ 6-09-5480-90 (ООО «Авогадро»); кислоту соляную, 65%, х.ч., ТУ 6-09-287884 («Химмед»); диэтиловый эфир, ч.д.а., ТУ 2600-001-43852015-02 («Химмед»); фосфат калия однозамещенный, х.ч. (ООО «Авогадро»); метанол, HPLC Grade («Fisher Chemicals»). Наиболее оптимальные условия хромаВетеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ тографирования были достигнуты при следующих параметрах: - элюент: ацетонитрил 0,02 М фосфат калия однозамещенный (180/850). - скорость протекания элюента: 0,6 мл/ мин. - объем вводимой пробы: 20 мкл. - длина волны УФ-детектирования: 240 нм. - время удерживания имидокарба: ~ 6,57,5 мин. Для приготовления раствора элюента готовили смесь ацетонитрила с 0,02 М раствором КН2Р04 в соотношении 180/850, доводили рН раствора до значения 2 фосфорной кислотой и фильтровали с одновременным дегазированием непосредственно перед использованием. Предколонку и колонку промывали элюентом в количестве 20 свободных объемов колонки при скорости протекания элюента 0,3 мл/мин. После окончательного уравновешивания колонки устанавливали нулевую линию УФ-детектора на λ= 240 нм. Приготовление растворов стандарт- ного образца имидокарба дипропионата (фирма «Topharman», Китай, А=99,48%) для построения калибровочного графика проводили методом последовательных разведений водой, готовя стандартные рабочие растворы с концентрациями 1,0; 0,5; 0,25 и 0,1 мкг/мл. Подготовку проб плазмы к анализу проводили следующим образом: в центрифужные пробирки объемом 50 мл переносили 2 мл плазмы, перемешивали с 2 мл физиологического раствора, добавляли 4 мл 5% соляной кислоты в метаноле, повторно гомогенизировали, полученную смесь встряхивали в течение 10 мин и обрабатывали ультразвуком в течение 15 мин, затем добавляли 4 мл 40% раствора гидроксида натрия. Пробу перемешивали в течение 1 мин, добавляли 25 мл диэтилового эфира, интенсивно встряхивали в течение 5 мин и выдерживали 24 часа при температуре 4-6° С (в холодильнике). После этого пробу центрифугировали в течение 5 мин при скорости 3000 об/мин, фракцию диэтилового эфира отбирали и переносили в круглодонную колбу для последуюТаблица 1 Концентрация, мкг/мл Площадь пика в стандартном растворе, мВ*сек Площадь пика в модельной пробе, мВ*сек Коэффициент экстракции 1,0 275,375 251,283 0,9125 0,5 138,688 98,517 0,7103 0,25 56,166 41,759 0,7435 0,1 35,568 31,656 0,8900 Среднее значение коэффициента экстракции 0,8141 График 1 Ветеринарная патология. № 3. 2008 95 ФАРМАКОЛОГИЯ Таблица 2 Кинетика имидокарба в плазме крови собак Сроки исследования 15 мин 30 мин 45 мин 1ч 3ч 6ч 9ч 12 ч 15 ч 18 ч 21 ч 24 ч 48 ч 72 ч 96 ч 120 ч 1 0,849 0,794 0,623 0,876 0,506 0,106 0,204 0,156 0,216 0,076 0,244 О 0,072 О О 0,060 Концентрация имидокарба, мкг/мл 2 3 0,948 0,517 1,145 0,791 1,332 1,020 1,361 1,045 0,341 0,387 0,184 0,120 0,122 0,088 0,104 0,188 0,182 0,194 О 0,226 0,091 0,058 0,068 0,086 О О О О 0,061 О О О щего упаривания на ротационном испарителе при температуре 40° С. Полученный сухой остаток растворяли в 1 мл метанола, одновременно обрабатывая ультразвуком, переносили в пробирки Эппендорфа объемом 1,5 мл и хранили при температуре не выше минус 20° С до начала опыта. Для вычисления коэффициента экстракции готовили модельные пробы. В контрольные образцы плазмы крови объемом 0,9 мл, отобранных от животных до обработки, вносили по 0,1 мл стандартных растворов имидокарба для получения требуемых концентраций: 1,0; 0,5; 0,25 и 0,1 мкг/мл. Пробы тщательно перемешали. Пробоподготовку проводили по вышеописанной методике с образцами плазмы крови. Конечный объем модельных проб экстрактов плазмы составлял 0,5 мл. Хроматографирование модельных проб экстрактов плазмы крови и растворов стандартного образца имидокарба проводили в соответствии с вышеописанными условиями. Строили график корреляции площади хроматографического пика и концентрации имидокарба в плазме и рассчитывали коэффициент экстракции (Кэ) имидокарба по следующей формуле: Кэ = Sоб. / Sст., где: Sоб. – площадь пика имидокарба в модельной пробе, mV*s; 4 0,560 0,995 0,861 1,613 0,304 0,158 0,198 0,237 0,154 0,132 0,070 0,138 О 0,062 О О Среднее 0,718+0,21 0,931+0,17 0,959+0,29 1,224+0,33 0,384+0,09 0,142+0,04 0,153+0,06 0,171+0,06 0,186+0,03 0,108+0,09 0,116+0,08 0,073+0,05 0,018+0,01 0,015+0,01 0,015+0,01 0,015+0,01 Sст. – площадь пика имидокарба в стандарте, mV*s. Полученные результаты представлены в таблице 1 и на графике 1. Порог определения имидокарба дипропионата (чувствительность метода) в плазме крови – 0,06 мкг/мл. Концентрацию имидокарба в плазме крови рассчитывали по уравнению, полученному для линии тренда градуировочного графика: у = 0,0039х + 0,0528 где: у - искомая концентрация имидокарба в плазме крови собак, мкг/мл; х площадь пика в пробе, мВ*сек. Полученный коэффициент корреляции близкий к 1 (0,9853) свидетельствует о достоверности аппроксимации полученных данных. Уже через 15 минут после введения препарата (таблица 2) имидокарб обнаруживался в крови в высоких концентрациях (0,718 мкг/мл), и достигал максимума (1,224 мкг/мл) через 1 час после инъекции Фортикарба 5% раствора. К 6 часу после введения препарата концентрация имидокарба в крови снижалась примерно в 10 раз и сохранялась на этом (0,108-0,186 мкг/мл) уровне в течение суток. В последующие четверо суток (время наблюдения - 120 часов) концентрации имидокарба определялись на пределе чувствительности метода. SUMMARY The carried out research has shown that the preparation Imidocarb is detected in dogs’ blood plasma in 15 minutes after the administration, reaches a maximum in 1 hour after the administration. 4 days afterwards the concentration of Imidocarb is determined at the method sensitivity level. 96 Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Литература 1. Гублер Е.В. Вычислительные методы распознавания патологических процессов. М.: Медицина, 1970, с. 319. 2. Кондрахин И.П., Курилов Н.В., Малахов А.Г. и др. Клиническая лабораторная диагностика в ветеринарии. М.: Агропромиздат, 1985, 183 с. 3. Eureby J., Moreau У., et.al., Experimentation des proprieties antipiroplasmigues de I› Imidocarb sur Babesia canis, agent de lа piroplasmose canine еn Europe.// 3. Bull. Acad.Vet. Fгаnсе. 1980. Vоl. 53. Р. 475. 4. Ui1enberg G., Verdiesen Р.А., Zwart D. Imidocarb: а chemo prophylactic experiment with Babesia canis.// Vet. Q. 1981. Vol.3 Р. 118. УДК:619.615.33.576.8 Н.П. Зуев Белгородская государственная седьскохозяйственная академия ПОЛУЧЕНИЕ И РАЗРАБОТКА АНТИМИКРОБНЫХ КОМПОЗИЦИЙ НА ОСНОВЕ ТИЛОЗИНСОДЕРЖАЩИХ ПРЕПАРАТОВ Одной из основных предпосылок создания композиционных тилозинсодержащих препаратов является широкий спектр их антимикробной активности как к грамнегативной, так и к грампозитивной микрофлоре. Цель исследований: На основе фрадизина – 40 (50) разработать композиционные антимикробные препараты, обладающие повышенной ингибирующей активностью по отношению к болезнетворным микроорганизмам, циркулирующим среди больного молодняка сельскохозяйственных животных ЦЧЗ Российской Федерации. Задачи исследований: - Определить антибактериальную эффективность антибиотиков и нитрофурановых препаратов, входящих в состав тилозинсодержащих препаратов; - in vitro выяснить бактериостатическое потенцирующее влияние комбинаций фрадизина с антибиотиками, производными 8-оксихинолина и препаратами нитрофуранового ряда; - установить оптимальные соотношения ингредиентов самых эффективных сочетаний, проявивших достаточно высокое ингибирующее воздействие на полевые штаммы выделенных микроорганизмов. Материалы и методы исследований. Работа выполнялась на кафедре диагностики болезней, терапии, акушерства и хирургии БелГСХА. Исследования по созданию лекарственных композиций проводили на основе широко известных препаратов, прошедших проверку временем и практикой. Логически сконструированные соотношения фрадизина-40 (50) с биовитом-80(120), Таблица 1 Сравнительная антимикробная активность препаратов Антимикробная активность препаратов в мкг/мг Препараты E.coli (n=5) B.bronchiseptica (n=5 ) P.multocida (n=3 ) P.vulgaris (n=5) S.dublin (n=10) St.aureus (n=10 ) Фрадизин-40(50) 12,5-16,0 50,0-70,0 13,0-17,0 190,0-220,0 12,0-12,5 5,0-15,0 Биовит-80(120) 12,0-25,0 20,0-160,0 0,2-1,6 130,0-180,0 12,0-25,0 30,0-50,0 Левомицетин 2,0-30,0 - 1,0-2,0 - 2,0-30,0 - Неомицин 1,0-8,0 - 1,0-8,0 - 1,0-8,0 - Олаквиндокс 120,0 - 30,0 - 30,0 - Фармазин 13,0-17,0 60,0-80,0 14,0-18,0 200,0-230,0 13,0-17,0 10,0-20,0 Фуразонал 25,0 - 35,0 - 35,0 - Эритромицин 6-50 - 1,0-5,0 - 6,0-50,0 - Ветеринарная патология. № 3. 2008 97 ФАРМАКОЛОГИЯ Таблица 2 Антимикробная активность комбинаций фрадизина-40(50) с биовитом-80(120), эритромицином, неомицином, олаквиндоксом, левомицетином и фуразоналом Фракционная ингиМинимальная бактериостатичесбирущая конценткая концентрация (МБК, мкг/мл) рация (мкг/мл) Вид ФИК- индекс фрадизин микроорсоединения фрадизин- синергист в соединефрадизи- синергиста ганизмов 40(50) нии с синерна-40(50) гистом 1:1 E.сoli S.сh.suis S.dublin M.hiorini P.multocida 12,5-16,0 12,0 12,0-12,5 3,0-5,0 13,0-17,0 E.сoli S.сh.suis S.dublin M.hiorini P.multocida 12,5-16,0 12,0 12,0-12,5 3,0-5,0 13,0-17,0 E.сoli S.сh.suis S.dublin M.hiorini P.multocida 12,5-16,0 12,0 12,0-12,5 3,0-5,0 13,0-17,0 E.сoli S.сh.suis S.dublin M.hiorinis P.multocida 12,0-16,0 12,0 12,0-12,5 3-5 13,0-17,0 E.coli S.сh.suis S.dublin M.hiorinis P.multocida 12,5-16,0 12,0 12,0-12,5 3,0-5,0 13,0-17,0 Е.coli S.сh.suis S.dublin M.hiorini P.multocida 12,5-16,0 12,0 12,0-12,5 3,0-5,0 13,0-17,0 Фрадизина-40(50) с биовитом-80(120) 12,0-25,0 8,0 0,3 12,0-25,0 8,0 0,3 12,0-25,0 8,0 0,3 12,0-25,0 0,2-1,6 6,0 0,2 Фрадизина-40(50) с левомицетином 12,0 5,0 0,2 10,0 5,0 0,2 10,0 5,0 0,2 1,0-2,0 4,0 0,1 Фрадизина-40(50) с неомицином 8,0 6,0 0,2 8,0 6,0 0,2 8,0 6,0 0,2 6,0 8,0 0,2 Фрадизина-40(50) с олаквиндоксом 120,0 70,0 2,5 30,0 20,0 0,8 30, 20,0 0,8 30,0 20,0 0,8 Фрадизина-40(50) с фуразоналом 25,0 12,0 0,4 35,0 15,0 0,6 35,0 15,0 0,6 35,0 12,0 0,4 Фрадизина-40(50) с эритромицином 8,0 0,3 0,4 10,0 10,0 8,0 0,3 8,0-50,0 5,0 10,0 0,1 0,2 0,2 0,2 1,9 0,5 0,5 0,5 2,1 0,2 0,3 0,3 1,0 0,4 0,5 0,5 1,1 0,4 0,4 0,4 0,5 0,6 0,6 0,6 0,7 0,25 0,3 0,3 0,8 2,8 1,1 1,1 1,6 0,2 0,2 0,2 0,2 0,6 0,8 0,8 0,6 0,7 1,1 0,4 1,0 0,7 1,1 ФИК-индекс), а неомицин плохо всасывается из желудочно-кишечного тракта, то для дальнейшей работы, в плане создания композиционных препаратов, предпочтение было отдано биовиту и фуразоналу. левомицетином, неомицином, олаквиндоксом, фармазином, фуразоналом и эритромицином, были определены для первоначального скрининга как 1:1. Чувствительность бордетелл, микоплазм, пастерелл, протея, стафилококков и эшерихий к каждому ингредиенту и сочетанию определяли методом двукратных серийных разведений в трёх повторностях. 98 Потенцирование комплексных препаратов отражали в показателях фракционной ингибирующей концентрации препарата (ФИК), чем она меньше, тем сильнее потенцируется данное средство другим, входящим вместе с изучаемым в композицию. Сумма ФИК препаратов, составляющих композицию, обозначают как ФИКиндекс. Если он меньше единицы, то имеет Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 3 Антимикробная активность комбинаций фрадизина-40(50) с биовитом-80(120) и фуразоналом Минимальная бактериостатическая концентрация (МБК, мкг/мл) Вид микроорганизмов фрадизина-40 синергист Фракционная ингибирущая концентрация фрадизина в соедин. с синергистом 1:1 1:2 1:3 фрадизин 1:1 синергист 1:1 ФИК-индекс соединения Фрадизина-40(50) с биовитом-80(120) E.coli 12,5-16 12-25 8,0 10,0 12,0 0,3 0,2 0,5 S.сh.suis 12,0 12-25 8,0 10,0 12,0 0,3 0,2 0,5 S.dublin 12,0-13 12-25 8,0 10,0 12,0 0,3 0,2 0,5 M.hiorini 3,0-5,0 12-25 - - - - - - P.multocida 13,0-17 0,2-1,6 6,0 8,0 10,0 0,2 1,9 2,1 Фрадизина-40(50) с фуразоналом E.coli 12,5-16 25,0 12,0 15,0 18,0 0,4 0,2 0,6 S.сh.suis 12,0 35,0 15,0 19,0 24,0 0,6 0,2 0,8 S.dublin 12,0-13 35,0 15,0 19,0 24,0 0,6 0,2 0,8 M.hyorini 3,0-5,0 - - - - - - - P.multocida 13,0-17 35,0 12,0 15,0 18,0 0,4 0,2 0,6 смысл применять разработанное комплексное средство, нежели в отдельности его составляющие. Сочетания, проявившие высокую антимикробную активность в соотношении 1:1, подвергали дальнейшим исследованиям с целью выяснения наиболее оптимальных пропорций ингредиентов, повышающих их бактериостатическое действие. Результаты исследований. Сводные данные по бактериостатической активности препаратов в отношении бордетелл, микоплазм, пастерелл, протея, стафилококков и эшерихий приведены в таблице 1. Исследуемые микроорганизмы, кроме бордетелл и протея, оказались чувствительными почти ко всем химиотерапевтическим средствам. Исключение в данном случае составил олаквиндокс и частично биовит-80(120). В дальнейших исследованиях при изучении в порядке скрининга характера потенцирования фрадизина с биовитом, левомицетином, неомицином, олаквиндоксом, фуразоналом, и эритромицином, установлено, что при соотношении 1:1 наиболее эффективны комбинации фрадизина с левомицетином, неомицином, и фуразоналом, а затем по убывающей с биовитом, эритромицином и олаквиндоксом (табл. Ветеринарная патология. № 3. 2008 2). ФИК фрадизина в отношении эшерихий при взаимодействии с левомицетином и неомицином равнялся 0,2, а с биовитом, фуразоналом, эритромицином и олаквиндоксом - 0,3; 0,4; 0,4; 2,5; в отношении сальмонелл соответственно 0,2; 0,2; 0,2; 0,2; 0,3; 0,8 и в отношении пастерелл соответственно 0,1; 0.2; 0,2; 0,4; 0,1; 0,8 мкг/мл. Данные таблицы также свидетельствуют о степени изменения ФИК вторых компонентов, входящих в состав тилозинсодержащих композиций. Так, например, наиболее эффективно действовали на эшерихий и сальмонелл биовит и фуразонал, ФИК которых была 0,2 мкг/мл. В отношении пастерелл их ФИК равнялось соответственно 1,9 и 0,2 мкг/мл. В остальных комбинациях влияние синергистов просматривается несколько слабее. ФИК - индекс сочетания фрадизина с левомицетином и неомицином для E.coli составил 0,4 и 0,6; для S.dublin и S.ch.suis 0,5 и 0,6; для P.multocida -1,1 и 0,7. Суммарный показатель ФИК следующих комплексных соединений: фрадизина с биовитом, фуразоналом и эритромицином - для эшерихий составил 0,5; 0,6 и 1,1; для сальмонелл - 0,5; 0,8 и 0,7; а для пастерелл - 2,1; 0,6 и 1,1. Сочетание фрадизина с олаквиндоксом оказалось не эффективным, так 99 ФАРМАКОЛОГИЯ как установленный ФИК-индекс для вышеуказанных микроорганизмов соответственно равнялся 2,8; 1,1 и 1,6. Несмотря на то, что сочетания фрадизина-40(50) с левомицетином и неомицином имели самый низкий ФИК-индекс, мы учитывали, что левомицетин не способен устранять факторы резистентности бактерий и проявляет почти такие же антибактериальные характеристики, как и фуразонал (ФИК, Логически обоснованные комбинации фрадизина с биовитом и с фуразоналом в эксперименте по изысканию наиболее результативных пропорций составляющих ингредиентов проявляли различную противомикробную активность (табл. 3). Представленные в таблице сведения неопровержимо подтверждают существенное влияние удельной массы базового активно действующего вещества (АДВ) композиции на её ингибирующие показатели, где процентное содержание АДВ тилозина, представленного фрадизином 40(50), находилось в диапазоне от 50 до 25 %. Изученная антимикробная активность сочетаний фрадизина с биовитом и фуразоналом в соотношении 1:1 оказалась самой оптимальной. В этом случае биовит и фуразонал потенцировали минимальную бактериостатическую концентрацию фрадизина, особенно в отношении пастерелл и кишечной палочки, в среднем на 46 и 26, а также на 44 и 16% соответственно. Одновременно отмечалось повышение антибактериальной активности к сальмонеллам композиции фрадизина с биовитом. Фрадизин также проявил потенцирующее влияние на фуразонал и биовит на 48-60 процентов. В то же время сочетание фрадизина с фуразоналом не способствовало проявлению потенцирующего действия фрадизина на сальмонелл. Менее эффективными оказались пропорции 1:2 и 1:3. Анализируя полученные результаты можно с уверенностью констатировать, что синергидный эффект по отношению ко всем исследованным микроорганизмам в обоих рецептах был более выражен при соотношении ингредиентов 1:1. Выводы. Данные проведенных исследований по определению бактериостатической активности препаратов и их физико-химической совместимости и потенцирующего проявления оптимальных соотношений с фрадизином, анализ существующей литературы, свидетельствуют, что наиболее перспективными для дальнейшего изучения, разработки, определения оптимальной дозы, степени безвредности и специфической активности, являются композиции фрадизина с биовитом и с фуразоналом в сочетании 1:1. Составляющими компонентами двух разработанных комплексных тилозинсодержащих препаратов (фрадизн + биовит и фрадизин + фуразонал) являются кормовые антибиотики. Поскольку энтеральное введение лекарственных средств, по сравнению с парентеральным, является технологически приемлемым и в меньшей степени стрессирует животных, то немаловажное значение будет иметь менее затратное использование этих препаратов на производстве в виде премиксов. РЕЗЮМЕ Определены оптимальные соотношения фрадизина с биовитом и фуразоналом и определена антимикробная активность этих композиций к грамположительной и грамотрицательной микрофлоре. SUMMARY Оptimal correlations fradisine with biovit and furasolidon are determined and antimicrobe of these compositions to grampositive and gramnegative to microflora defined Литература 1. Химиотерапия дизентерии и инфекционных пневмоний свиней / А.В. Голиков, В.Н. Скворцов, А.А. Прасолов; Рец.: А.М. Шихаев. Белгород, 2001 52 с. 2. Шахов А.Г., Зуев Н.П., Буханов В.Д., Логачёв А.В. Применение тилозинсодержащих препаратов при дизентерии свиней // Ветеринария. № 7 100 С. 22–27. 3. Gosse F. O., Myat I. A. // Vet. Med. 1964, 59, 169–171. 4. Hamill K. L. et al. Tylosin a new antibiotic // Isolation properties and praparation of desmycosin a mmicrobiologically active degradation product / K. L. Hamill, M. E. Haney //Antibiotics and chemotherapy. 1961. II. 328. Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Ш.А. Ибрагимова, М.Н. Насибов, С.В. Советкин, В.С. Авдеенко ФГОУ ВПО «Саратовский государственный аграрный университет им. Н.И. Вавилова» КЛИНИЧЕСКАЯ ОЦЕНКА ПРЕПАРАТА ЭНДОМЕТРОМАГ-Т ПРИ ПОСЛЕРОДОВОМ ЭНДОМЕТРИТЕ У ВЫСОКОПРОДУКТИВНЫХ КОРОВ Молочное скотоводство является ведущей отраслью агропромышленного комплекса, призванной удовлетворять потребности людей в белковых продуктах питания животного происхождения. В значительной степени факторами, обусловливающими экономический ущерб и сдерживающими темпы увеличения производства скотоводческой продукции, являются заболевания неинфекционной этиологии. Неблагоприятные условия внешней и внутренней среды при разведении, выращивании, содержании и эксплуатации высокопродуктивных молочных коров, являющиеся стрессовыми, приводят к функциональным и структурным патологическим изменениям. Особенно ярко это происходит после родов, что находит проявление в так называемом послеродовом синдроме (partus syndrome), при котором деструктивные изменения распространяются на весь организм [1; 2]. Поэтому изучению проблем, связанных с осложнениями, протекающими на всех этапах послеродового периода, уделяют наибольшее внимание. Доказано, что после завершения послеродового периода, на протяжении которого были зафиксированы даже минимальные нарушения любого характера, плодотворность осеменения коров снижается на 1740%, выход приплода и молочная продуктивность—на 12-18%, сервис-период увеличивается на 40-60 дней, а индекс плодотворности осеменений—на 0,9. При этом в перечне заболеваний высокопродуктивных коров значительный удельный вес занимают эндометриты и маститы, наносящие экономический ущерб, превышающий суммарный ущерб от всех других заболеваний [4; 5]. Несмотря на то, что послеродовые эндометриты у молочных коров являются предметом многочисленных исследований, разработка методов и способов их терапии и профилактики остается недостаточно изученной и дискуссионной. До настоящего времени окончательно не решена проблема коррекции послеродового периода превентивной терапией острого эндометрита. Ветеринарная патология. № 3. 2008 Ретроспективный анализ литературы и современное состояние репродукции у высокопродуктивных молочных коров требуют усовершенствования и конкретизации лечебно-профилактических мероприятий, а также поиск новых, эффективных форм препаратов патогенетического действия, содержащих компоненты, сокращающие миометрий. При этом разработку патогенетических химиотерапевтических и химиопрофилактических средств и методов их применения следует проводить, принимая во внимание обязательное решение важнейших задач химиотерапии и химиопрофилактики—уменьшение затрат и сведение к минимуму или исключению возникновения нежелательных побочных эффектов [4; 5]. Материалы и методы исследований. Фармакотоксилогические свойства препарата эндометромаг-Т (производство ЗАО «Мосагроген», г. Москва) изучали в соответствии с «Требованиями к документам, представляемым для регистрации ветеринарных фармакологических препаратов» (2000 г.) и согласно «Методическим указаниям по определению токсических свойств препаратов, применяемых в ветеринарии и животноводстве» (1988 г.). Терапевтическую и профилактическую эффективность эндометромага-Т определяли в хозяйствах различных форм собственности Саратовской области. Применение препарата осуществляли согласно наставлению. Опыты проводили на коровах чёрно-пёстрой породы 3-4 лактации, продуктивностью 5-7 тыс. кг молока в год, больных послеродовым гнойно-катаральным эндометритом. Кормление соответствовало детализированным нормам ВИЖ. Группой сравнения служили больные животные, которым проводили курс терапии пенообразующими маточными средствами «фуропен» и «йодопен» согласно наставленям, относящимися к группам нитрофурановых и йодистых препаратов (производство ЗАО «Нитрофарм», г. Саратов). Диагностику осуществляли общепринятыми клиническими методами. Еже101 ФАРМАКОЛОГИЯ дневно у больных коров измеряли температуру тела, пульс, частоту дыхания и количество сокращений рубца за 5 минут. Результаты исследований. Результаты токсикологических исследований препарата эндометромаг-Т показали, что препарат относится к группе малотоксичных веществ. ЛД50 эндометромага-Т для белых мышей при внутрибрюшинном введении составляет 46,5 мл/кг массы тела. Введение в желудок максимально допустимой дозы, равной 1 см3, не вызывало гибели мышей. Препарат не оказывает сенсибилизирующего влияния и раздражающего действия на конъюнктиву и не обладает кумулятивными свойствами. Типичные симптомы послеродового гнойно-катарального эндометрита фиксировали преимущественно у коров на 6-9 сутки после отела. При микробиологическом анализе маточно-влагалищного экссудата выделяли стрептококки (59,9%), диплококки (40,3%), стафилококки (37,5%), хламидии (49,7%) и микоплазмы (49,5%). Культуры эшерихий выделяли в экссудате в 19,7% случаев, протея в 13,8%, йерсений в 16,8%, Bacillus subtillis в 18,7%, грибов в 10,9%, в меньшем количестве – клебсиеллы и нокардии (2,58%). В цитограмме влагалищных выделений коров преобладали гранулоциты (деструктивные и нормальные нейтрофилы), значительные скопления микробных клеток, эритроциты и эпителиальные клетки. Показатели температуры тела, пульса, частоты дыхания и количество сокращений рубца как до лечения, в процессе лечения, так и при наступлении выздоровления находились в пределах физиологической нормы. Проводили гематологические исследования крови больных животных с выведением лейкограммы. При анализе морфологических показателей крови коров, больных послеродовым гнойно-катаральным эндометритом зафиксировали уменьшение количества гемоглобина на 8,9%, а эритроцитов на 37,5% относительно нормы при статистически достоверных величинах; в лейкоформуле - относительный эозинофильный лейкоцитоз и лимфоцитоз при моноцитопении. В процессе лечения различными средствами гематологические показатели постепенно нормализовывались и приближались к показателям, характерным для клинически здоровых животных. Воздействие эндометромага-Т при 102 внутриматочном введении положительно сказалось на эритропоэзе: количество эритроцитов достоверно увеличивалось с 5,5±0,08 до 5,8±0,11 10 12/л (Р<0,05) и превосходило показатели у контрольных животных. В то же время содержание в лейкограмме нейтрофилов, лимфоцитов и моноцитов приблизилось к показателям таковых у клинически здоровых животных. Общее количество лейкоцитов в одной объемной единице крови снизилось с 9,3±1,9 до 9,0±1,66 · 109/л (Р<0,05). Достоверное уменьшение количества лейкоцитов по сравнению со значением этого показателя необходимо расценивать как свидетельство затухания под влиянием проведенной терапии воспалительного процесса в организме. По завершению курса лечения количество эозинофилов достоверно увеличивалось на 24,0%. Такое изменение форменных элементов характерно для благоприятного течения воспалительного процесса в организме животного. Отмечали также достоверное увеличение количества палочкоядерных нейтрофилов на 27,1%, а число сегментоядерных нейтрофилов оказалось сниженным после лечения на 11,1%. Такое содержание нейтрофилов, характеризующее наличие ядерного сдвига влево, указывает на нейтрофильную фазу воспалительного процесса. Наблюдаемое снижение числа лимфоцитов после проведённых мероприятий характеризовало наступление фазы выздоровления. Клиническая картина заболевания изменялась на третий день после введения эндометромага-Т и проявлялась увеличением количества выделяемых лохий. При этом отмечали уменьшение размеров матки у 95,3% больных животных и восстановление её регидности, резкое уменьшение лохиальных выделений (на 8-ой день проводимого лечения). Через 9 дней лохи имели вид прозрачных тяжей и выделялись в незначительном количестве. Цитограмма влагалищных выделений характеризовалась уменьшением количества нейтрофилов и макрофагов с преобладанием эпителиальных клеток. Микробиологический анализ влагалищной слизи показал уменьшение количества колоний Staph. аurehs, Staph. аlbus, E. сol, Str. fecalis, S. dublis, Proteus. При терапии препаратом эндометромаг-Т коров, больных послеродовым гнойно-катаральным эндометритом, клиническое выздоровление наступало через Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 1 6,8±0,21* 54,7 56,7±2,41** 1,8±0,11** 50-100,0 Фурапен 50 3,0 7,3±0,46* 52,1 58,5±1,90* 1,9±0,17 50-100,0 Йодопен 50 8,0 11,5±2,3** 48,1 79,9±2,05** 2,6±0,19** 40-80,0 М±m Послное выздоровление, n-% Интервал до наступления клинического выздоровления, дн. 3,0 Индекс осеменений Продолжительность лечения, дн. М±m 50 Сервис-период, дн. Число коров М±m Эндометрамаг-Т Оплодотворяемость после первого осеменения, % Препарат Терапевтическая эффективность препаратов при послеродовом гнойно-катаральном эндометрите у коров Р<0,05 Р<0,01 6,8±0,75 дня, что на 4,7 дня раньше, чем при лечении йодопеном. С применением фуропена разница была незначительная, всего 0,5 дня. Индекс осеменения коров увеличивался после терапии фурапеном и йодопеном на 9,14 и 45,7 процентов по сравнению с коровами, которым вводили эндомеромаг-Т. Стельность от первого осеменения у коров подвергнутых лечению препаратом Эндометромаг-Т составила 54,72%, что на 2,64% выше, чем при лечении фуропеном и на 6,68% после лечения йодопеном. Из группы коров, в которой применяли йодопен, у 20% животных эндометрит перешёл в хроническую форму. Все результаты статистически достоверны. Таким образом, наши исследования показали, что эндометромаг-Т является эффективным терапевтическим средством при послеродовых катарально-гнойных эндометритах у высокопродуктивных коров. Опыт собственной практической и исследовательской работы позволяет утверждать, что из этиотропных средств, предпочтительно применять лекарственные формы, содержащие сокращающие миометрий компоненты. Они позволяют достигать высокого эффекта нормализации эндометральных нарушений при минимальных затратах труда. Применение препарата эндометромагТ и аналогичных препаратов, например эндотетрамага-К в разовой дозе от 50 до 100 мл при кратности введения 2-4 раз с интервалом 48 часов дает стабильно высокий терапевтический эффект без возникновения рецидивов, сокращая срок выздоровления на 5-7 дней, уменьшая срок бесплодия с 5560 до 30-40 дней. Литература 1. Авдеенко B.C., Щелюгина З.Г., Гончар А.М., Салганик Р.И. Способ лечения острых послеродовых эндометритов // Авторское свидетельство на изобретение № 1424627 (СССР), 1987. 2 с. 2. Авдеенко B.C. Способ лечения гнойно-катаральных эндометритов // Авторское свидетельство на изобретение № 1600372 (СССР), 1990. 2 с. 3. Авдеенко B.C., Гавриш В.Г. Новые препараты для лечения и профилактики эндометритов у коров // Состояние и перспективы научных ис- Ветеринарная патология. № 3. 2008 следований по профилактике и лечению болезней с.-х. животных и птиц / Матер, науч. конф., посвящ. 50-летию Краснодар. НИВС. Краснодар, 1996. 4.11. С. 3-4. 4. Нежданов А.Г. Физиологические основы профилактики симптоматического бесплодия коров.: Автореф. дис. д-ра вет. наук. Воронеж, 1987. 39 с. 5. Полянцев Н.И. Воспроизводство в промышленном животноводстве. М.: Росагропромиздат, 1990. 240 с. 103 ФАРМАКОЛОГИЯ Т.И. Кугелева, К.Г. Курочкина ФГУ «ВГНКИ», ВИГИС ИММУНОТРОПНАЯ АКТИВНОСТЬ ПРЕПАРАТА АЙСИДИВИТ Целью настоящего исследования было изучение иммунотропной активности препарата айcидивит, обладающего адаптогенными свойствами. Материалы и методы. Иммунотропные свойства препарата айcидивит изучены в 3 опытах на 72 мышах линии CBA массой 18 – 20 г. Влияние препарата на антителообразование изучали методом локального гемолиза и в реакции гемагглютинации при иммунизации мышей эритроцитами барана (ЭБ). Титры агглютининов определяли в микроварианте прямой реакции гемагглютинации, вычисляли супрессивный индекс (СИ). О влиянии препарата на клеточный иммунитет судили по индукции им гиперчувствительности замедленного типа (ГЗТ) и по изменению количества ауторозеткообразующих клеток (ауто-РОК) по Jondal M. et al.(1972), в качестве эритроцитарного маркера в этом тесте применяли 1,5% ную взвесь аутологичных эритроцитов. При определении иммунотропных свойств препарата айсидивит пользовались «Руководством по экспериментальному (доклиническому) изучению фармакологических веществ» (2000). Препарат испытывали при однократном внутримышечном введении мышам в дозе 0,1 мл/мышь. Достоверность результатов исследования оценивали по критерию Стьюдента. Результаты исследований. Опыт 1. Для определения антителообразующих клеток (АОК) в селезенке препарат вводили мышам внутримышечно в дозе одновременно с внутрибрюшинной иммунизацией их эритроцитами барана (2 % взвесь в объеме 0,5 мл/мышь). На 4-е сутки извлекали селезенки, получали лимфоциты и проводили исследование. Вокруг каждой АОК возникает зона гемолиза, которая видна на агаре в виде прозрачной точки. Увеличение числа продуцентов антител в селезенке мышей, которым вводили препарат, не наблюдалось. Индекс стимуляции (ИС) определяли как отношение числа АОК в опыте к числу АОК контроле (введение только ЭБ). Судя по полученным данным, введение препарата приводит к активизации трансформации В-лимфоцитов в АОК. Опыт 2. В данном опыте определяли изменение титров антител в сыворотке крови мышей при внутримышечном введении препарата айсидивит. Реакция основана на способности агглютининов, содержащихся в сыворотке крови иммунизированных ЭБ животных, «склеивать» ЭБ, используемые для иммунизации. Испытуемый препарат вводили в дозе 0,1 мл/мышь одновременно с внутрибрюшинной иммунизацией 2 % взвесью ЭБ (индуктивная фаза иммунного ответа). На 7-й день после введения препарата титры агглютининов в сыворотке крови Таблица 1 Изменение количества антителопродуцентов (АОК) в селезенке после внутримышечного введения препарата Айсидивит Препарат Доза Содержание АОК ИС Айсидивит 0,1 мл/мышь 1,02±0,01 1,2 Контроль ЭБ 2 % – 0,5 мл 0,82±0,04 - *достоверно по отношению к контролю, Р < 0,05 Таблица 2 Титры гетерофильных агглютининов Номер группы Препарат 1 Айсидивит 2 Контроль Доза препарата Результаты реакции (Log2) 7-й день ИС = (О:К) 0,1 мл/мышь 3,7±0,1 1,2 (ЭБ) 3,1±0,2 – *достоверно по отношению к контролю, Р <0,05 104 Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 3 Результаты реакции гиперчувствительности замедленного типа Препарат Доза ИВ Айсидивит 0,1 мл/мышь 15,2±0,2 Контроль только разрешающая доза ЭБ 13,7±0,9 Р < 0,05 мышей 1-й группы достигли уровня 3,7±0,1 Log2. У контрольных животных этот показатель был на уровне 3,1 (log2). Результаты исследования представлены в таблице 2. Под влиянием терапевтической дозы препарата у мышей наблюдали активизацию гуморального иммунного ответа, и титр агглютининов в крови составил 3,7 log2. Индекс стимуляции составил 1,2, что говорит о наличии иммуностимулирующих свойств препарата айсидивит. На основании результатов проведенных исследований следует отметить, что однократное введение препарата айсидивит сопровождается незначительной стимуляцией иммунного ответа на тимусзависимый антиген (ЭБ). Гуморальная антителопродукция к тимус-зависимому антигену (ЭБ) обусловлена кооперативным взаимодействием В-лимфоцитов и Т-хелперной популяцией иммунокомпетентных клеток (Петров Р.В., Чередеев А.И. 1974). Препарат айсидивит оказывает стимулирующее воздействие на гуморальный иммунный ответ, т.к. индекс стимуляции равен 1,2. Опыт 3. Изучение действия препарата на клеточное звено иммунного ответа предполагает использование модельных систем, дающих представление о функциональной активности лимфоцитов Т-ряда. К таким тестам относится реакция гиперчувствительности замедленного типа (ГЗТ) и определение изменения количества ауторозеткообразующих клеток, которые у мышей аналогичны Т-лимфоцитам. Одновременно с внутримышечным введением тестируемого препарата мышей внутрибрюшинно иммунизировали 2% взвесью ЭБ, на 5-е сутки вводили раз- решающую дозу ЭБ – 10% взвесь в объеме 0,02 мл в подушечки правых лап, в коллатеральную лапу вводили 0,9% раствор натрия хлорида. Через 24 часа определяли сдвиг ИВ (индекс воспаления), который вычисляли по формуле: опыт – контр. х 100% контр. Установлено, что препарат айсидивит в дозе 0,1 мл/мышь вызывает индукцию ГЗТ у мышей, т.е. местную воспалительную реакцию, которая обусловлена инфильтрацией клетками воспалительного очага, а не сосудистой реакцией (Ройт И. 1991). У мышей это полиморфноядерные лейкоциты, мононуклеары, которые через несколько дней превращаются в тканевые макрофаги. Введение препарата айсидивит вызывало сдвиг ИВ на 15,2 %, что достоверно отличалось от показателей контрольных животных – 13,7 %. Интенсивность синтеза и секреции лимфоцитами факторов клеточного иммунитета соответствует степени выраженности воспалительной реакции в месте введения разрешающей дозы антигена (ЭБ), характеризует активность популяции хелперных клеток, ответственных за проявление реакции гиперчувствительности замедленного типа. Заключение. Препарат айсидивит в дозе 0,1 мл/мышь оказывает стимулирующее влияние на показатели гуморального иммунного ответа, т.к. ИС в реакциях достигал 1,2±0,01 по АОК и 3,7±0,1 log2 по титрам; мы также отмечали повышение активности иммунокомпетентных клеток у животных, получавших препарат айсидивит - ИВ составил 15,2% против 13,7% в контроле. SUMMARY When applied in a dose of 0,1 ml to a mouse, the preparation ACDvit is stimulating for the humoral immune response rate, as the stimulation index reaches 1,2±0,01 for antibody-forming cells and 3,7±0,1 log2 for titers. Besides, the increase of immune competent cells’ activity of the animal receiving the preparation ACDvit is recorded: the inflammation index is 15,2% against 13,7% in the control group. Ветеринарная патология. № 3. 2008 105 ФАРМАКОЛОГИЯ УДК 619:616.99:636.1. О.Л. Куликова ФГОУ ВПО «Нижегородская государственная сельскохозяйственная академия» ИЗУЧЕНИЕ ВЛИЯНИЯ АНТИГЕЛЬМИНТНОЙ ПАСТЫ «АЛЕЗАН» НА ОРГАНИЗМ ЛОШАДЕЙ В системе основных мероприятий борьбы с инвазионными заболеваниями животных наиболее эффективным методом является химиотерапия. Применение антигельминтных препаратов в профилактических и терапевтических целях при кишечных паразитозах способствует скорейшему освобождению организма животных от инвазии. Достаточно обширный ассортимент противопаразитарных средств, используемых в современной ветеринарной медицине, постоянно пополняется новыми препаратами. Это вызвано продолжающимся поиском наиболее эффективных и безопасных лекарственных средств, удобных форм для их применения животным. Экономическая целесообразность использования того или иного препарата является, хотя и не основной, но также важной определяющей в выборе антипаразитарных средств. Лечение и профилактика гельминтозных заболеваний лошадей на данный момент продолжает оставаться актуальной задачей, поскольку, по данным многих авторов (Н.М. Пономарев, 1999; Кузьминов, Д.А., 2003; И.А.Архипов, 1992, 2004; и др.), эти болезни широко распространены и наносят огромный ущерб коневодству вследствие падежа, снижения работоспособности и продуктивности животных, задержки роста и плохого развития молодняка. В ветеринарии для лечения и профилактики паразитарных болезней лошадей, в частности нематодозов, в настоящее время используется множество зарубежных и отечественных препаратов: фенотиазин, пиперазин, тиабендазол, панакур гранулят, мебенвет гранулят, оксфендазол, авермектины и ивермектины (И.А.Архипов, 2004; И.Ф. Кленова [и др.], 2004; К.Л.Мальцев, 2005; и др.). В научно-внедренческом центре «Агроветзащита» за последние годы разработана и сконструирована новая лекарственная форма антигельминтной пасты против гельминтозов лошадей на основе ивермектина и празиквантела. Материалы и методы. Производственные испытания антигельминтной пасты «Алезан» проводили в ФГОУ ГЗК «Нижегородский ипподром» на 10 лошадях 2-4 летнего возраста спонтанно инвазированных нематодами и отобранных по принципу аналогов и разделенных на 2 группы. Животным 1-й подопытной группы пасту «Алезан» вводили перорально на корень языка в дозе 0,2 мг/кг по ДВ ивермектина и 1 мг/кг по ДВ празиквантела из расчета 1,0 г пасты на 100 кг массы животного. Лошади 2-й группы препарат не получали и служили контролем. Всех животных в течение опыта содержали в одинаковых условиях. Контроль за состоянием животных проводили с помощью клинических, биохимических и гематологических исследований за сутки до и через 1 и 5 суток после презентации препарата по общепринятым методикам. Клинические исследования и отбор проб крови проводили утром в одно и то же время до кормления животных. Таблица Гематологические показатели крови лошадей при применении антигельминтной пасты «Алезан» гематологические показатели по результатам исследования № гр. п/п 1 2 подопытные 10 мг/кг контроль В%к контролю 106 Доза препарата Не получали Фон (до обработки) Через 1 сутки Через 5 суток эрит. 1012/л лейк. 109/л гемогл. г/л эрит. 1012/л лейк. 109/л 8,2± 0,9 8,0± 0,5 12,1± 1,1 8,1± 0,3 8,2+ 0,6 12,2± 1,4 8,2± 0,7 8,0± 0,5 12,2± 1,2 8,2± 0,7 8,4± 0,7 12,2± 1,2 8, 3± 0,5 8,2± 0,4 12,0± 1,3 8,1± 0,6 8,3± 0,3 12,3± 1,5 100 95,2 99,1 97,5 100 101,6 101,2 96,3 99,1 гемогл. эрит. лейк. гемогл. г/л 1012/л 109/л г/л Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Результаты исследований. Установили, что температура тела у лошадей подопытной и контрольной групп варьировала в пределах 37,6–38,4° С, пульс — 32–39 ударов в минуту, дыхание 10–13 вдохов в минуту. Полученные результаты свидетельствуют о том, что показатели клинического состояния животных подопытной группы, получавших антигельминтную пасту в дозе 1 г/100 кг были в пределах физиологической нормы лошадей и существенно не отличались от их исходного клинического состояния и от состояния животных контрольной группы. В результате исследований установили, что количество эритроцитов и лейкоцитов в 1 мкл крови, содержании гемоглобина и показатели лейкоцитарной форму- лы лошадей 1 и 2-й групп в течение всего периода исследований находились в пределах физиологической нормы и практически не отличались от показателей животных контрольной группы. При исследовании биохимических показателей сыворотки крови нами также не установлено существенных достоверных изменений во всех исследуемых показателях (общего белка, альбуминов, альфа-, бета- и гаммаглобулинов) у животных контрольной и подопытной групп. Таким образом, по результатам исследований антигельминтная паста «Алезан» в терапевтической дозе 1 г/100 кг не оказывает отрицательного влияния на клиническое состояние лошадей, гематологические и биохимические показатели крови. Резюме В статье приводится оценка влияния антигельминтной пасты «Алезан» на организм лошадей спонтанно зараженных кишечными нематодозами. Установлено, что в терапевтической дозе 1 г/100 кг препарат не оказывает отрицательного влияния на клиническое состояние лошадей, гематологические и биохимические показатели крови. SUMMARY Anthelmintic paste «AIezan» was tested at dose level of 1 g/100 kg of body weight against intestinal nematodes by horses. Литература 1. Архипов, И.А. Изыскание новых препаратов для терапии гельминтозов животных / И.А. Архипов //Материалы докладов научн. конф. «Теория и практика борьбы с паразитарными болезнями». М. Выпуск 5. 2004. С.32-35 2. Кузьминов, Д.А. Эффективность ивермека при кишечных нематодозах лошадей/ Д.А. Кузьминов, В.А.Оробец // Актуальные проблемы инвазионной, инфекционной и незаразной патологии животных. Ставрополь, 2003. С.61-63. 3. Кленова, И.Ф. Ветеринарные препараты в России / И.Ф. Кленова, К.Л. Мальцев, Н.А. Яременко [и др.]. М.: Сельхозиздат, 2004. Т. 1. 464 с., Т. 2. 576 с. 4. Мальцев, К.Л. Лечение однокопытных при стронгилятозах / К.Л. Мальцев, Л.А. Бундина, Д.В. Гришин // Ветеринарная патология. 2005. №2. С. 73. 5. Понаморев, Н.М. Эффетивность антгельминтиков при нематодозах лошадей / Н.М. Понаморев, // Ветеринария 1997. № 10. С. 28-29 В.В. Напалкова, В.Е. Абрамов ФГУ «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» ИССЛЕДОВАНИЯ ОСТРОЙ И СУБХРОНИЧЕСКОЙ ТОКСИЧНОСТИ СУСПЕНЗИИ ТРИКЛАБЕНДАЗОЛА Введение Успех борьбы с гельминтами животных во многом зависит от наличия антигельминтных средств, обладающих достаточно высокой эффективностью и безопасностью для жизни и здоровья животных и человека (Веселова Т.П., 1964, 1978). В условиях постоянного повышения роли химических веществ в борьбе с гельминтозами, ввиду их потенциальной опасности для животных, человека и окружающей среды, одной из ключевых задач при Ветеринарная патология. № 3. 2008 внедрении и дальнейшем применении антигельминтных препаратов является их токсикологическая оценка. Для обеспечения безопасности применения антигельминтных средств каждый предлагаемый препарат для ветеринарной практики подвергается всестороннему токсикологическому исследованию, одним из этапов которого является определение параметров острой токсичности и кумулятивного эффекта. В настоящее время за рубежом при тре107 ФАРМАКОЛОГИЯ матодозах жвачных успешно применяются лекарственные средства на основе триклабендазола: 6-хлор - 5-(2,3-дихлорфенокси)2-метилтиобензимидазол, который активен как против половозрелых, так и против ранних и поздних стадий развития неполовозрелых фасциол, что выгодно отличает его от других трематодоцидных средств. Механизм действия триклабендазола основан на угнетении активности фумаратредуктазы и микротубулярной функции трематод. По данным ряда зарубежных исследователей, триклабендазол относится к малотоксичным соединениям: ЛД50 при пероральном введении лабораторным животным составляет более 8000 мг/кг массы животного, обладает слабо выраженными кумулятивными свойствами, не оказывает эмбриотоксического и тератогенного действия (Dorchies P., Franc M., Ducos de Lahitte, 1983; Eckert J., Schneider G, 1984.). После перорального введения животным триклабендазол легко всасывается в желудочно-кишечном тракте, проникает в большинство органов и тканей организма и биотрансформируется в печени с образованием сульфоксида, сульфона, кетона и 4гидрокси-триклабендазола. Опытами на овцах и козах с радиоактивными изотопами установлено, что при пероральном введении препарата в терапевтической дозе, максимальная концентрация триклабендазола и его метаболитов устанавливается в крови через 24-36 часов после введения, затем снижается в течение 10 суток. В молоке лактирующих коров концентрация указанных соединений достигает максимальных значений в течение первых суток и сохраняется, постепенно снижаясь, в течение 10 дней. Выделяется триклабендазол из организма в основном с фекалиями, частично с мочой (до 2%), а у лактирующих животных также с молоком (менее 1%). В органах и тканях овец и коз остаточные количества триклабендазола и его метаболитов обнаруживаются на протяжении 28 суток, в молоке – 10 суток после однократного перорального введения препарата в терапевтической дозе. За рубежом для дегельминтизации недойного крупного рогатого скота и овец препараты на основе триклабендазола используют в форме гранул, болюсов и суспензий для перорального применения. Препараты назначают индивидуально однократно из расчета по ДВ: крупному рогатому скоту в дозе 12 мг/кг, овцам – 10 мг/ 108 кг массы животного. Учитывая немногочисленные данные о степени токсичности лекарственных средств на основе триклабендазола, в задачу наших исследований входило изучение на лабораторных животных острой и субхронической токсичности триклабендазола суспензии 5%. 1. Материал и методы Для исследования были взяты образцы опытных серий триклабендазола суспензии 5% (далее триклабендазола), разработанной отечественными специалистами. Исследования проводили в соответствии с рекомендациями Фармакологического Государственного комитета («Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ», Москва, 2005) [4; 8]. Для изучения острой и субхронической токсичности исследуемого препарата использовали белых мышей обоего пола массой 19-21 г, которых готовили к опытам в соответствии с указаниями ОФС «испытание на токсичность» ГФ XI [2]. Мышей получали из питомника «Филиал Андреевка ГУ НЦ биомедицинских технологий РАМН». Животных содержали в виварии согласно санитарным правилам [5] и на стандартном рационе с использованием сухого брикетированного корма. Перед введением препарата животных выдерживали на голодной диете в течение 6 часов. При изучении острой токсичности устанавливали переносимые и токсические дозы, выявляли наиболее чувствительные к триклабендазолу органы и системы организма, характер и степень патологических изменений в них, обратимость вызываемых поражений. Для установления параметров острой токсичности препарат вводили в желудок с помощью шприца с оливой в следующих дозах: 8000; 10000; 15000; 20000; 25000; 30000; 35000; 40000; 45000; 50000; 55000 и 60000 мг/ кг. Препарат в дозах 50000; 55000 и 60000 мг/ кг вводили в желудок дробно с интервалом 2 часа. Каждую дозу препарата испытывали на 7 животных, контрольным мышам вводили воду в том же объеме. Наблюдения за белыми мышами проводили в течение 14 суток после введения препарата (первые сутки наблюдение вели непрерывно), фиксируя общее состояние животных, особенности их поведения, интенсивность и характер двигательной активности, координации движений, тонус Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 1. Число животных Доза препарата, мг/кг Количество животных в группе выжило пало 8000 10000 15000 20000 25000 30000 35000 40000 45000 50000 55000 60000 7 7 7 7 7 7 7 7 7 7 7 7 7 6 5 4 3 3 2 1 1 1 1 0 0 1 2 3 4 4 5 6 6 6 6 7 Таблица 2. LD0 (мг/кг) 8000 LD16 (мг/кг) LD50 (мг/кг) LD84 (мг/кг) LD100 (мг/кг) 11500 27000 (21865÷32135) 42500 60000 Таблица 3 Группа Доза, часть от LD50 или (мг/кг/сутки) Количество животных в группе I II III IV 1/5 (5400) 1/10 (2700) 1/20 (1350) контроль (1% крахмальный клейстер) 10 10 10 10 скелетных мышц, реакцию на тактильные, звуковые и световые раздражители, частоту и глубину дыхательных движений, ритм сердечных сокращений, состояние кожноволосяного покрова, окраску слизистых оболочек, положение хвоста, количество и консистенцию фекальных масс, частоту мочеиспускание и окраску мочи, потребление корма и воды. Регистрировали сроки развития интоксикации и гибели мышей, проводили макроскопическое исследований внутренних органов погибших животных (степень кровенаполнения, наличие кровоизлияний, изъязвлений слизистой оболочек и др.) На основе полученных данных методами Кербера и Першина, Миллера и Тейнтера [1] рассчитывали значения параметров острой токсичности препарата: ЛД0 (максимально-переносимая доза), ЛД50 (среднесмертельная доза), а для установления доверительных границ средней смертельной дозы определяли ЛД16 и ЛД84 (Машковский М.Д., 1971), устанавливали терапевтическую широту и степень опасности препарата. Исследования субхронической токсичности триклабендазола провели на 40 мышах, из которых сформировали 4 группы по 10 голов в каждой, с исходной массой 19– Ветеринарная патология. № 3. 2008 23 г. Препарат вводили животным ежедневно в течение 15 суток в дозах 1/5, 1/10 и 1/20 от ЛД50, установленной в остром опыте Животным контрольной группы ежедневно вводили 1% крахмальный клейстер в сравнимом объеме введения. В процессе опыта ежедневно регистрировали массу мышей, выявляли наиболее чувствительные к триклабендазолу органы и системы организма, характер и степень и обратимость патологических изменений, отбирали пробы крови (с и без антикоагулята) для последующих гематологических и биохимических исследований. Биохимические исследования проводили на биохимическом анализаторе «Spekol 220/221» (Германия). Через 15 суток животных убивали, внутренние органы взвешивали и определяли массовые коэффициенты. Статистическую обработку данных проводили по Стьюденту-Фишеру с использованием t-критерия. 2. Результаты исследований 2.1. Результаты изучения острой токсичности триклабендазола суспензии 5% приведены в таблице 1. Как следует из приведенных данных, при введении препарата в дозе 8000 мг/кг гибели животных не наблюдалось. Даль109 ФАРМАКОЛОГИЯ Таблица 4 Группы Срок исследования, сутки 1/5 от LD50 (5400 мг/кг) 1/10 от LD50 (2700 мг/кг) 1/20 от LD50 (1350 мг/кг) контроль 0 20,2±0,25 21,3±0,15 22,5±0,16 23,3±0,37 3 20,9±0,23 22,7±0,30 23,90±0,31 24,7±0,26 5 21,3±0,15 23,8±0,25 24,4±0,22 25,5±0,34 7 21,8±0,20 24,9±0,28 25,8±0,39 26,9±0,38 10 22,1±0,23 25,6±0,22 26,4±0,31 27,7±0,37 15 22,6±0,16 26,0±0,26 27,7±0,37 28,7±0,26 % к исходной массе 112 122 123 123 Таблица 5 Группы Орган 1/5 от LD50 (5400 мг/кг) 1/10 от LD50 (2700 мг/кг) 1/20 от LD50 (1350 мг/кг) контроль Печень 57,47±0,84 54,72±2,16 59,14±1,70 58,49±3,02 11,78±0,31 Почки 13,43±0,88 11,23±0,46 12,18±0,52 Сердце 4,44±0,17 4,28±0,13 4,71±0,13 4,66±0,10 Легкие 8,99±0,22 8,07±0,38 7,90±0,49 8,25±0,40 Селезенка 5,56±0,18 5,65±0,20 5,54±0,20 5,77±0,41 Таблица 6 Группы Показатели 1/5 от LD50 (5400 мг/кг) 1/10 от LD50 (2700 мг/кг) 1/20 от LD50 (1350 мг/кг) контроль 142,80±2,17* 141,1±2,08* 152,50±1,84 153,3±3,13 8,80±0,09 8,73±0,12 8,71±0,22 8,53±0,10 273,10±9,76 279,6±6,77 323,00±10,06 290,80±10,07 6,89±0,38 7,10±0,06 7,46±0,16 7,50±0,15 32,20±0,65* 27,10±1,48 30,00±1,98 32,30±2,62 Моноциты 2,30±0,26* 2,70±0,42 3,60±0,40 3,50±2,17 Эозинофилы 2,00±0,26* 1,40±0,27 1,20±0,20 1,20±0,13 Лимфоциты 62,60±0,70* 68,80±1,30 65,20±2,00 63,00±2,53 Гемоглобин, г/л Эритроциты, 10 12/л 9 Тромбоциты, 10 /л Лейкоциты, 109/л Сегментоядерные Лейкограмма, % * Различие по данному показателю статистически достоверно между опытной и контрольной группами (Р≤0,05). нейшее повышение дозы приводило к гибели определенной части мышей в опытных группах. Доза препарата 60000 мг/кг была абсолютно смертельной. При введении препарата в интервале доз 10000–60000 мг/кг у животных отмечали отказ от корма, угнетение, учащенное дыхание, нарушение двигательной активности. Сроки появления и выраженность указанных симптомов зависели от вводимой дозы. Так, при введении препарата в дозах 10000–30000 мг/кг признаки отравления появлялись примерно через 2-3 часа, в то время как в дозах 35000–60000 мг/ кг уже через 30-60 минут. Основная гибель животных наблюдалась течение 1-2 суток после введения препарата. На основе полученных данных были 110 рассчитаны параметры острого токсического действия триклабендазола суспензии 5%: LD50, рассчитанная по методу Кербера составила 27000±2429 мг/кг массы животного. В таблице 2 приведены параметры острого токсического действия препарата, рассчитанные с использованием метода Першина, Миллера и Тейнтера. Как следует из приведенных данных, значения LD50, рассчитанные двумя методами, практически совпадают. Согласно гигиенической классификации ГОСТ 12.1.007-76 триклабендазола суспензия 5 % по степени воздействия на организм относится к 4 классу опасности – «вещества малоопасные» 2.2. Для оценки кумулятивного эфВетеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 7. Группы Показатели Белок, мг/мл 1/5 от LD50 (5400 мг/кг) 1/10 от LD50 (2700 мг/кг) 1/20 от LD50 (1350 мг/кг) контроль 56,30±0,29 55,10± 0,36 54,70±0,11 55, 50 ± 0,34 Щелочная фосфатаза, Е/л 10,42±0,09 10,18±0,23 10,04±0,15 9,73 ± 0,25 Холестерин, мг/дл 117,50±0,31 115,10±0,46 114,80±0,62 116,40±0,42 Аспартатаминотрансфераза, Ед/л 40,70±0,85 41,00±0,90 40,23±0,41 38,50±0,50 Аланинаминотрансфераза, Ед/л 41,60±0,77 39,30±0,38 38,90±0,54 39,50±0,32 Креатинин, мкмоль/л 106,2±0,89 107,8±1,21 107,10±1,25 109,50±1,45 фекта триклабендазола суспензию 5% вводили животным опытных групп ежедневно в течение 15 дней, в дозах, указанных в таблице 3. При введении суспензии в трех тестируемых дозах общее состояние и поведение животных, видимые физиологические функции оставались без изменений. В таблице 4 представлена динамика прироста массы тела мышей трех опытных и контрольной групп. Из данных таблицы следует, что введение триклабендазола в дозе 1/5 от LD50 приводило к замедлению динамики прироста массы животного, процент прироста массы тела к исходной составил 112% по сравнению со 123% в контроле. В то же время при введении препарата в более низких дозах - 1/10 и 1/20 от LD50 динамика прироста массы тела практически не отличалась динамики в контрольной группе. Значения массовых коэффициентов внутренних органов мышей после перорального введения триклабендазола суспензии 5% приведены в таблице 5. Данные таблицы свидетельствуют о том, что значения массовых коэффициентов сердца, легких, печени, почек и селезенки у мышей трех опытных и контрольной группы достоверно не отличаются друг от друга. В частности, массовый коэффициент для печени у мышей, которым препарат вводили в дозах 1/5; 1/10 и 1/20 от LD50, составил соответственно 57,47±0,84; 54,72±2,16 и 59,14±1,70 (в контроле - 58,49±3,02); для почек соответственно 13,43±0,88; 11,23±0,46 и 12,18±0,52 (в контроле 11,78±0,31); для легких соответственно 8,99±0,22; 8,07±0,38 и 7,90±0,49 (в контроле 8,25±0,40) Результаты исследования гематологических показателей представлены в таблице 6. При введении препарата в дозах 1/5 и 1/10 от LD50, имело место незначительное снижение концентрации гемоглобина, а Ветеринарная патология. № 3. 2008 в дозе 1/5 от LD50 — появление в лейкограмме палочкоядерных нейтрофилов. Остальные тестированные показатели (количество эритроцитов, тромбоцитов, лейкоцитов, цветовой показатель, СОЭ) не претерпели достоверных изменений. Многократное введение суспензии в течение 15 суток в дозе 1/20 от LD50 не оказало достоверного влияния на все тестированные гематологические показатели. В частности, уровень гемоглобина, количество эритроцитов, тромбоцитов, лейкоцитов и СОЭ составили соответственно 152,5±1,84; 8,71±0,22; 323,0±10,06; 7,46±0,16 и 1,50±0,17 против 153,3±3,13 (г/л); 8,53±0,10 (102/л); 290,8±10,07 (109/л); 7,50±0,15 (109/л) и 1,50±0,17 (мм/ч). В таблице 7 представлены результаты определения биохимических показателей сыворотки крови мышей после введения триклабендазола суспензии 5% в трех дозах в сравнении с контрольными животными. Как следует из представленных данных, введение препарата в испытанных дозах не оказало достоверного влияния на концентрацию белка, холестерина, креатинина, а также активность аспартат- и аланинаминотрансферазы, щелочной фосфатазы – ферментов, активность которых является показателем функционального состояния печени и почек . Выводы 1. Триклабендазола суспензия 5% по параметрам острой токсичности согласно ГОСТ 12.1.007-76 относится к веществам малоопасным (4 класс опасности): ЛД50 для белых мышей составила 27000±2429 мг/кг массы животного. 2. Триклабендазола суспензия 5% в субхроническом эксперименте при преоральном введении в дозах 1/5, 1/10 и 1/20 от ЛД50, установленной в остром опыте, гибели подопытных мышей не вызывала. 3. При пероральном введении белым мышам триклабендазола суспензии 5% в течение 15 суток в дозе равной 1/5 от LD50 111 ФАРМАКОЛОГИЯ (5400 мг/кг/сутки) выявлено замедление 5. При пероральном введении суспендинамики прироста массы тела подопытзии в течение 15 суток в дозе равной 1/20 от ных животных и изменение гематологиLD50 (1350 мг/кг/сутки) отклонений в клиническом состоянии, гематологических и ческих показателей. биохимических показателях подопытных 4. При пероральном введении белым животных не выявлено; доза суспензии мышам триклабендазола суспензии 5% в 1350 мг/кг/сутки является недействующей. течение 15 суток в дозе равной 1/10 от LD50 (2700 мг/кг/сутки) выявлено незначительЗаключение. Триклабендазола суспенное снижения концентрации гемоглобина зия 5% согласно ГОСТ 12.1.007-76 отнов крови подопытных животных; доза суссится к веществам малоопасным и облапензии триклабендазола 2700 мг/кг/сутки дает слабо выраженными кумулятивными является пороговой. свойствами. Литература 1. Веселова Т.П. К вопросу сравнительной токсичности антгельминтиков.// Материалы науч. конф. ВОГ.М.,1964, ч.1, с. 58-60. 2. Веселова Т.П. Проблемы фармакологии и токсикологии антгельминтиков, применяемых в ветеринарии.//Животноводство и ветеринария.Паразитарные заболевания.М., 1978, т. 10, с. 92-108. 3. Вредные вещества. Классификация и общие требования безопасности / ГОСТ 12.1.007-76. М.: Издательство стандартов, 1984, с. 2. 4. Демидов Н.В Гельминтозы животных. М. Агропромиздат, 1978. 5. Положение о порядке экспертизы, испытания и регистрации ветеринарных препаратов в Российской Федерации. Москва, 1995, С.12. 6. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Ремедиум, 2000, с. 18-24. 7. Dorchies P., Franc M., Ducos de Lahitte J. Etude de llactivite du triclabendazole (DCI) sur Fasciola hepatica chez l1agneau.//Revue de Medecine Veterinaire, 1983, V. 134, N4, P.231-234. 8. Eckert J., Schneider G., Wolff K. Fasinex (triclabendazole)- a new fasciolicide //Berl und Munch. Tierarztliche Wschr.- Schr., 1984, V.97, N10, P.349-356. Д.Д. Новиков Нижегородская государственная сельскохозяйственная академия ФАРМАКОТОКСИКОЛОГИЧЕСКИЕ СВОЙСТВА И ТЕРАПЕВТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ПРЕПАРАТА АМИТ ФОРТЕ Введение. Фирмой ООО «НВЦ Агроветзащита» создан комплексный акарицидный препарат амит форте. Препарат существенно отличается от препаратованалогов имеющихся в данный момент на рынке препаратов ветеринарного назначения. В состав препарата вошли компоненты различных фармакологических групп, научно обоснованное сочетание которых является залогом эффективной терапии арахнозов плотоядных животных. Целью настоящей работы было изучение фармакотоксикологических свойств препарата амит форте. Материалы и методы. Оценку фармакотоксикологических свойств препарата амит форте проводили согласно Методическим указаниям из «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ», М, 2000, с. 18-33. Изучение острой токсичности препа112 рата проводили на 36 белых беспородных мышах массой 18 – 20 г. Препарат в чистом виде насильно вводился в желудок с помощью металлического зонда. Было испытано 6 доз. Каждая доза вводилась 6 животным. Контрольным животным вводили воду. Наблюдения за экспериментальными животными после однократного введения проводили в течение 14 дней, после многократного - в течение 2 месяцев. Подострую токсичность препарата проводили на белых крысах, при этом исследовали гематологические и биохимические показатели: количество эритроцитов и лейкоцитов подсчитывали в камере Горяева; гемоглобин определяли гемометром Сали; мазки красили по Романовскому – Гимза; определение холинэстеразы проводили по методу Хестрина; активность щелочной фосфатазы в сыворотке крови определяли по методу Боданского; общий белок в сыворотке крови определяли на Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ рефрактометре. При изучении раздражающего и кожно-резорбтивного действия учитывали клинику отравления, состояние кожи (отек, утолщение кожной складки, расчесы, болезненность), как критерии всасывания препарата через кожу. Местно-раздражающее действие препарата на слизистые оболочки изучали при однократном внесении в конъюнктивальный мешок кролика, отмечая появление и выраженность гиперемии, отечность, инъекцию сосудов склеры и роговицы, ширину зрачка, состояние век. Оценку действия на слизистую оболочку проводили по характеру конъюнктивита Кумулятивные свойства препарата изучали на белых мышах по методу Лима с соавторами (1961). Препарат вводили в желудок, начиная с 1/10 ЛД50, установленной в остром опыте, и увеличивали дозу в 1,5 раза каждые 4 дня. Оценку кумулятивных свойств проводили на основании вычисленного коэффициента кумуляции (отношения ЛД50, установленной в подостром опыте, к ЛД50, установленной в остром опыте). Сенсибилизирующее действие изучали на морских свинках при многократном накожном нанесении препарата в концентрации, не вызывающей при разовом воздействии реакции нормальной кожи. Препарат наносили на один и тот же участок кожи до появления выраженного контактного дерматита и по истечении инкубационного периода после последней аппликации, на свежевыстриженный участок кожи противоположной части спины наносили препарат в разрешающей дозе. Учет аллергической реакции и её оценку проводили через 24 часа по характеру реакции кожи (эритема, инфильтрация, изъязвления). Терапевтическую эффективность препарата при демодекозе изучали на пораженных клещами собаках, проходивших лечение в ветеринарной клинике. Диагноз заболевания ставили на основании клинических и микроскопических исследований. Препарат наносили тонким слоем на предварительно подготовленные участки кожи (шерсть выстригали, очищали от струпьев тампоном, смоченным спиртом) равномерно распределяя от периферии к центру с захватом пограничной здоровой кожи до 1 см. В зависимости от степени поражения процедуру повторяли от 2 до 5 раз с интервалом 5 дней. Всего в опытах было использовано 32 больных демодекозом собак, пораженных сквамозной и пустулезной форВетеринарная патология. № 3. 2008 мами демодекоза. Сквамозная форма болезни обнаружена у 14, пустулезная форма - у 12 собак. Эффективность препарата при саркоптозе изучали на 17 пораженных собаках. Диагноз заболевания подтверждали акарологическими исследованиями – обнаружением при микроскопии соскобов клещей S. canis. Препарат наносили однократно, тонким слоем на пораженные участки равномерно, распределяя от периферии к центру, с захватом пограничной здоровой кожи до 1 см. Изучение эффективности препарата при нотоэдрозе кошек провели на 18 кошках, пораженных нотоэдрозом в средней (поражения в области головы) и сильной степени (поражения по всему телу). Препарат равномерно наносили тонким слоем, слегка втирая от периферии к центру с захватом здоровой кожи в пораженные места головы и туловища однократно. Эффективность препарата определяли по наличию и состоянию клещей до и после обработки путем микроскопирования соскобов. Эффективность препарата при отодектозе собак и кошек изучалась на 8 кошках и 13 собаках, пораженных отодектозом. Диагноз заболевания подтверждали акарологическими исследованиями (микроскопией соскобов). Смоченным препаратом тампоном очищали ушную раковину от струпьев и корок, затем закапывали в каждое ухо по 3-5 капель препарата, после чего ушную раковину складывали вдоль пополам и слегка массировали основание для более полной обработки всей поверхности. Обработку проводили дважды с интервалом 35 дней. Эффективность терапии контролировали микроскопией соскобов с внутренней поверхности ушной раковины. Результаты исследований. В результате исследования острой токсичности ЛД0 препарата составила 5,0 мл/кг по лекарственной форме; ЛД16 составила 11,0 мл/кг; ЛД50 составила 20,0 мл/кг; ЛД84 составила 26,0 мл/кг; ЛД100 – 30,0 мл/кг. Таким образом, среднесмертельная доза препарата для белых мышей при алиментарном введении составляет 20 мл/кг, что позволяет отнести этот препарат к 4-му классу опасности (ГОСТ 12.01.007-76). При изучении местно-раздражающего действия препарата в опыте на крысах выявили, что однократное и десятикратное нанесение препарата на кожу крысам, в дозах 0,5 и 5 мл/кг не приводит к гибели 113 ФАРМАКОЛОГИЯ животных. Воздействие препарата при однократном нанесении на кожу сопровождалось признаками раздражения, при повторных аппликациях препарата в дозе 5 мл/кг у крыс отмечалась реакция кожи в виде гиперемии, которая проходила через 2-4 часа. Изучение препарата при его ежедневном накожном нанесении в течение 14 дней в суммарной дозе 3,5 мл/кг массы тела показывает, что он не обладает способностью проникать в организм через неповрежденную кожу в количествах, вызывающих отравление животных, о чем свидетельствуют полученные результаты гематологических, биохимических показателей жизненно важных органов и систем организма. Местно-раздражающее действие препарата изучали и на кроликах. При воздействия препарата на слизистые было отмечено слезотечение и умеренно выраженная гиперемия. Указанные явления исчезали через 6-10 часов. Таким образом, местно-раздражающее действие препарата слабо выражено и носит кратковременный характер. В качестве интегральных показателей были изучены гематологические показатели: уровень гемоглобина (г/%) составил 14,8±0,22 в опытной группе и 15,2±0,40 в контрольной, содержание лейкоцитов (х109/л) 12,5±1,2 и 12,0±1,3, эритроцитов (х10 12/л) 6,2±0,50 и 6,1±0,35 соответственно; биохимические: содержание общего белка в сыворотке крови животных опытной группы составило 7,77±0,42 (г/%), контрольной – 7,88±0,19;активность щелочной фосфатазы в образцах животных опытной группы составила (мкмоль/л) 4,57±0,67, контрольной – 4,52±0,84, холинэстеразы (мкг/мин) – 827±29,8 и 780±21,4 соответственно. Таким образом, анализ интегральных показателей функциональной активности печени указывает на отсутствие какого либо токсического действия препарата. При изучении кумулятивных свойств препарата установлено, что суммарная доза (ЛД50 многократная), вызвавшая 50% гибель мышей составила 60,80 мл/кг. ЛД50 при однократном введении составила 20 мл/кг. Коэффициент кумуляции составил 3,04. По классификации веществ по кумулятивным свойствам препарат относится к группе веществ со слабо выраженной кумуляцией. В рамках стандартного протокола исследования препарат не обладает сенсиби114 лизирующими свойствами. Семикратные аппликации при комплексной сенсибилизации дали отрицательный результат, что позволяет сделать вывод о том, что препарат амит форте не вызывает развития аллергического дерматита. При лечении сквамозной формы демодекоза собак с локальными участками поражения, лечебная эффективность составляла 100% и была достигнута после двукратного нанесения препарата амит форте, а при множественных участках поражения - после трехкратного применения препарата с 5-дневным интервалом. В результате применения препарата при лечении саркоптоза уже через 2 дня в соскобах были обнаружены мертвые клещи, деформированные личинки и яйца. Клинические признаки заболевания начали проходить через 3-4 дня после первого нанесения препарата, что проявлялось исчезновением гиперемии, уменьшением экссудации, отпадением корочек. Через 7-10 дней после применения препарата, все животные выздоровели, что было подтверждено клиническими и акарологическими исследованиями. Рецидивов заболевания при наблюдении за животными в течение месяца не наблюдалось. Через 2 дня после обработки кошек с диагнозом нотоэдроз, в соскобах были обнаружены только мертвые клещи, через 4 дня корочки подсыхали, осыпались, кожа становилась бледно - розовой, сухой. Выздоровление животных наблюдалось на 7-9 сутки. При акарологическом исследовании клещей обнаружено не было. Таким образом, результаты опыта показали, что лечебная эффективность препарата амит форте при однократной обработке кошек против нотоэдроза составила 100 % . В результате обработки собак и кошек с диагнозом отодектоз были получены следующие данные: через 3 дня после обработки препаратом, в соскобах были обнаружены мертвые клещи, деформированные личинки и яйца. Клинические признаки заболевания начали проходить через 3-4 дня после первого введения препарата, что проявлялось исчезновением гиперемии, уменьшением экссудации, отпадением корочек. После второго введения препарата на 8-10 день от начала лечения все животные выздоровели, что было подтверждено клиническими и акарологическими исследованиями. Рецидивов заболевания при наблюдении за животными в течение месяца не наблюдалось Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ РЕЗЮМЕ Препарат амит форте в терапевтической дозировке не вызывает у подопытных животных токсического действия. Широкий терапевтический диапазон позволяет значительно снизить опасность передозировки при его применении на домашних животных. Применение комплексного препарата амит форте при саркоптоидозах и демодекозе показал 100% терапевтическую эффективность. Препарат обладает пролонгированным эффектом и защищает от повторного заражения в течение 25-28 дней. SUMMARY Preparation Аmit forte in a therapeutic dosage does not cause in experimental animals of toxic action. The wide therapeutic range allows to lower considerably danger of overdose at his application on pets. Application of complex preparation Аmit forte at sarcoptoidosis and demodecosis has shown 100 % therapeutic efficiency. The preparation has prolonged effect and protects from repeated infection within 25-28 days. УДК: 61:615.015.32:619 Т.В. Новосадюк, В.Д. Соколов, А.А. Комиссаренко СПб ГАВМ НАУЧНЫЕ ИССЛЕДОВАНИЯ И ДОКАЗАТЕЛЬНОСТЬ В ГОМЕОПАТИИ В ветеринарии постоянно ведется поиск эффективных средств и оптимальных методов лечения животных с различными заболеваниями. Однако в решении этих проблем государства всего мира столкнулись с нарастающими трудностями контроля над расходами. В настоящее время даже в экономически развитых странах возникла необходимость выбора оптимальных диагностических и лечебных вмешательств с высоким соотношением их эффективности и стоимости. В связи с этим были разработаны критерии доказательности результатов исследований многочисленных методов лечения, профилактики и диагностики [1,6]. Для обозначения лечебной практики, основанной на данных хорошо организованных клинических исследований, был введен термин «доказательная медицина». В концепции доказательной медицины теоретические представления о патогенезе, мнения авторитетных специалистов, традиции, личный опыт, соображения приоритетности не считаются убедительными научными основаниями для использования того или иного медицинского вмешательства [1]. При лечении животных одним из вариантов выбора является гомеопатия - метод лечения лекарствами, подобранными по принципу подобия, в сверхвысоких разведениях,. Основой гомеопатии является фармакологический принцип, получивший название «закон Арндта-Шульца» и гласящий: слабые стимулы повышают физиолоВетеринарная патология. № 3. 2008 гическую активность, средние - подавляют, а сильные - полностью тормозят. Этот медикаментозный метод, введенный в ранг науки С.Ганеманом, приобретает все большую популярность в медицине. Даже в тех странах мира, где доминирует академическая медицина, от 30% до 70% больных прибегают к услугам комплементарной медицины и, прежде всего, гомеопатии [21]. Несмотря на многочисленные свидетельства эффективности этого метода, некоторые скептики настаивают на несостоятельности гомеопатии, так как используемые при этом крайне малые дозы или вообще отсутствие таковых, по их мнению, бесполезно. Такое отношение объясняется характерным образом мышления - «чем больше доза лекарства, тем сильнее его эффект». Тем не менее, в результате многочисленных исследований, эффективности применения различных гомеопатических препаратов, в соответствии с международными требованиями доказательной медицины, удалось поставить гомеопатию в ряд «дисциплин основанных на доказательствах» («evidence besed medicine») [21]. Так, в рамках молекулярной биологии проведена серия экспериментов, свидетельствующих не только об эффектах гомеопатических микродоз на культуры клеток, но также получены подтверждения, что эти микродозы действенны лишь при выполнении основного гомеопатического принципа подобия [24]. Проводившиеся в течение 8 лет иссле115 ФАРМАКОЛОГИЯ дования влияния ацетилсалициловой кислоты на кровеносную систему показало, что гомеопатические дозы кислоты сокращают время кровотечения, хотя известно, что большие дозы аспирина вызывают повышенную кровоточивость [12]. В другом исследовании в воду с головастиками добавляли тироксин (тиреоидный гормон) в потенции С30. При этом морфогенез головастиков был замедлен по сравнению с головастиками в контрольной группе, получавшими плацебо [15]. Известно, что тиреоидные гормоны в больших дозах ускоряют морфогенез, но в гомеопатических дозах они его замедляют. В других опытах авторы погружали в воду стеклянную бутылку с гомеопатическим раствором тиреоидного гормона, оставляя горлышко бутылки над поверхностью воды. Результаты этой работы показывают, что потенцированные лекарства могут действовать и через стекло. Этот эффект был неоднократно воспроизведен и в других независимых исследованиях. Опытным путем также установлено, что приближение к человеку емкости с раствором индивидуально подобранного гомеопатического лекарства влияло на зрачковый рефлекс, пульс, мышечную силу и электрическую проводимость кожи [5]. При изучении влияния высоких разведений гистамина (выше С30) на изолированное сердце морской свинки удалось выявить, что это средство повышает сердечный кровоток. Особенно интересно, что этот эффект был нейтрализован после прогревания потенцированного раствора в течение 30 минут при температуре 70 градусов или после 15-минутного воздействия переменного магнитного поля с частотой 50 Гц [8]. Очевидно, что все представленные результаты исследований невозможно объяснить ответом организма на плацебо, что является типичным упреком скептиков. Для того чтобы определить, можно ли измерить какие-либо эффекты, оказываемые гомеопатическими лекарствами в высоких потенциях при растворении, был использован ядерный магнитный резонанс (ЯМР). Исследователи обнаружили четкие отличия эффекта при растворении высоких потенций Silicea от воздействия на воду плацебо [10]. Единая научная база, полученная благодаря использованию принципов, основанных на хорошо организованных и достоверных исследованиях, позволяет ветеринарному врачу судить, в какой мере его усилия в борьбе с другими факторами – физическими, биологическими, климатическими, физиологическими, и т.д., способны повлиять 116 на исход болезни. Поэтому клинические испытания с использованием этих принципов позволяют объективно выявлять изменения здоровья животного при воздействии на него определенного лекарства. Современные клинические исследования предназначены для оценки результатов лечения по сравнению с плацебо и/или другой терапией. Эффективность может изучаться в исследованиях с разной организацией (дизайном): описание серии случаев, одномоментные, ретроспективные, двойные слепые исследования - эксперименты, в которых исследователи не знают, проводится специфическое лечение или назначено плацебо. В рандомизированных исследованиях животные случайным образом определяются в опытную группу или в группу плацебо. В перекрестных (кроссоверных) исследованиях половине животных дают плацебо на одном этапе и активно действующее лекарство - на втором, тогда как другая половина получает активное лечение на первом и плацебо - на втором этапе. Результаты сравниваются. Однако по современным мировым стандартам надежная оценка эффективности методов может быть получена только в ходе проспективных рандомизированных двойных слепых контролируемых исследований методов диагностики, лечения или профилактики - наиболее доказательных и объективных. Необходимо отметить, что в гомеопатии существуют различные специфические особенности клинических исследований, которые необходимо иметь в виду, чтобы получить наиболее качественные объективные результаты. В некоторых из них, исходя из важнейшей черты гомеопатической методологии, лечение индивидуализировано. В других работах всем животным с похожим заболеванием назначается наиболее типичное средство. В третьих исследованиях при похожих состояниях назначается комплекс гомеопатических лекарств. Так, исследователи из университета в Глазго, выявляли аллергены, к которым были наиболее чувствительны больные бронхиальной астмой. После этого пациентов рандомизировали на опытную и плацебогруппы. В опытной группе назначали аллерген в потенции С30, вызвавший наибольшую сенсибилизацию. Результаты лечения оценивали как гомеопаты, так и обычные терапевты. Улучшение выявлено у 82% пациентов, получавших гомеопатическое лечение, и у 38% в группе плацебо [23]. В другом случае рандомизированное Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ двойное слепое исследование под контролем плацебо по испытанию гомеопатического лечения диареи, от которой ежегодно в мире умирают более 5 млн. детей, проведено на 81 ребенке в Никарагуа. Назначение индивидуально подобранного гомеопатического средства на 20% ускоряло излечение от инфекции по сравнению с плацебо. Наиболее ярко на гомеопатическое лечение реагировали дети в более тяжелом состоянии[17]. В настоящее время гомеопатия востребована в тех случаях, для которых ветеринария ещё не может предложить эффективной терапии. В качестве примера хронического заболевания, эффективно поддающегося гомеопатическому лечению в рамках контролируемых испытаний, может служить диабетический ретинит, при котором воспаление сетчатки вызывает снижение и потерю зрения, отек, выделения из глаз, иногда кровоизлияния в сетчатку. Так в медицине при двойном слепом рандомизированном плацебо-контролируемом исследовании 60 пациентам была назначена Arnica C5. У 47% пациентов, получавших этот препарат, выявлялось улучшение центрального кровотока в глазу, против 1% среди получавших плацебо. У 52% пациентов, принимавших Arnica C5, улучшался кровоток в других участках глаза, а у принимавших плацебо – у 1,5% пациентов, [25]. Помимо работ с индивидуальным подбором препаратов в литературе представлено много испытаний лекарственных гомеопатических средств, назначаемых при разных заболеваниях без их индивидуального подбора. При этом удалось показать, что если исследование гомеопатического лечения определенной болезни проводится без индивидуального подбора лекарства и результаты лечения при этом не отличаются от назначения плацебо, такие испытания – не опровергают эффективность гомеопатии. Это всего лишь доказывает, что данное лекарство неэффективно в лечении всех пациентов, страдающих данным заболеванием, каждый из которых может иметь уникальный комплекс симптомов, нуждающихся в индивидуальном подборе. Эти данные только подтверждают, что для наиболее эффективного лечения необходимы индивидуализация и тщательный подбор средства [5]. Вместе с тем, при лечении животных гомеопатическими средствами, индивидуальный подбор препаратов по подобию представляет большую трудность. Использовать в ветеринарии методики подбора, существующие в медицине, не возможно, что связано Ветеринарная патология. № 3. 2008 с большой ролью субъективных ощущений пациента в подборе препарата. Это явилось стимулом для поиска принципиально нового подхода к подбору гомеопатических препаратов у животных. Разработкой такого подхода в настоящее время успешно занимается кандидат ветеринарных наук Т.В.Новосадюк на кафедре фармакологии Санкт-Петербургской государственной академии ветеринарной медицины [3]. Вместе с тем, в НПФ «Кронвет» (Санк-Петербург), НПЦ «Видродження»* (Одесса), под руководством Ф.И.Полежаева разрабатываются методики подбора гомеопатических средств для промышленного животноводства [4]. Наработанные принципы гомеопатического лечения промышленного стада успешно применяется группой исследователей под руководством профессора Санкт-Петербургской государственной академии ветеринарной медицины В.А.Кузьмина [2]. В то же время проводятся клинические исследования и с комплексными гомеопатическими препаратами, в которых в одной лекарственной форме смешаны несколько гомеопатических веществ. Такой нетрадиционный, с точки зрения классической гомеопатии, подход популярен во многих странах. По мнению гомеопатов, такие лекарства не столь эффективны, как индивидуально подобранные средства, тем не менее, они действуют, и исследования подтверждают это. Гомеопаты постоянно убеждаются в том, что отдельно взятые гомеопатические лекарства способны привести к истинному излечению от болезни, комплексные же препараты обеспечивают безопасное, но временное облегчение симптомов [5]. Так, в ходе двойного слепого плацебоконтролируемого испытания исследователи оценивали лечение сенной лихорадки комплексным препаратом из 12 наиболее распространенных видов пыльцы в потенции С30. Результаты показали, что пациенты, принимавшие гомеопатическое лекарство, испытывали симптомы заболевания в 6 раз реже, чем те, кто получал плацебо [22]. Девятистам женщинам на девятом месяце беременности назначали лекарства Caulphyllum, Arnica, Cimicifuga, Pulsatilla, Gelsemium в потенции С5. Это комплексное средство давали дважды в день в течение девятого месяца. Двойное слепое плацебоконтролируемое испытание показало, что у женщин, принимавших гомеопатическое лекарство, в четыре раза реже развивались осложнения родов, а длительность родов была на 40% меньше, чем у получавших плацебо[11]. Такие же результаты получе117 ФАРМАКОЛОГИЯ ны и другими исследователями [13,14]. В настоящее время разработан метод систематического обзора данных оригинальных работ какого-либо метода или препарата с учетом различия результатов многочисленных исследований. При этом обобщаются только доброкачественные данные, регулярно обновляющиеся по мере получения новых результатов. Подготовка такого обзора наиболее эффективна при использовании особого статистического подхода - метаанализа. При проведении метаанализа результатов 107 клинических исследований гомеопатических лекарств за 25 лет 81 работа свидетельствовала об эффективности гомеопатических средств, 24 работы - о неэффективности и 2 дали сомнительный результат [18]. Опубликованные в 1997 г. результаты метаанализа 186 клинических рандомизированных контролируемых испытаний в области гомеопатии показали, что 119 из них отвечали методологическим критериям включения. По 89 из этих 119 испытаний имелось достаточное количество данных, что позволило включить их в метаанализ. Это означает, что оценке были подвергнуты результаты лечения более чем 10500 больных. Результаты испытаний показали статистически достоверное различие между гомеопатической терапией и плацебо, свидетельствующее в пользу гомеопатии [20]. Совместными усилиями ученых исследовательских институтов Германии и американским Walter Reed Hospital проведен метаанализ работ по оценке профилактических и лечебных эффектов гомеопатических доз токсичных веществ [19]. В частности, несколько исследователей давали животным значительные дозы мышьяка, висмута, кадмия, хлорида ртути или свинца. Результаты показали, что у животных, получавших гомеопатические дозы этих веществ до и повторно после введения больших доз, наблюдалось более активное выделение этих токсических веществ с мочой, фекалиями и потом, чем у животных, получавших плацебо. Среди наиболее качественных работ положительные результаты встречаются на 50% чаще, чем отрицательные. Наиболее достоверные результаты получены при тестировании доз субмолекулярного уровня (потенции выше С12), где чаще обнаруживались статистически достоверные результаты действия таких микродоз. Приведенная работа позволяет предположить, что гомеопатические лекарства могут играть важную роль в лечении токсических поражении. В условиях сокращения экономических ресурсов сегодня уже не достаточно демонстрации эффективности проводимого лечения на основании результатов клинических испытаний, контролируемых при помощи плацебо. Необходимы исследования, доказывающие, что тот или иной метод лечения дает общий народнохозяйственный и конкретный для каждого отдельного случая экономический эффект. Сейчас многие авторы приходят к необходимости дальнейших поисков методов исследования в области гомеопатии. Одним из подходов к будущим исследованиям в гомеопатии могло бы стать воспроизведение уже существующих простых клинических моделей силами независимых групп исследователей и изучение основных принципов гомеопатии при помощи экспериментальных моделей на самом современном уровне научных знаний. Еще одним подходом могло бы стать изучение полезного эффекта гомеопатии в ветеринарии в рамках проспективных исследований в форме наблюдения [9,19]. Таким образом, к настоящему времени получены веские доказательства о том, что гомеопатические лекарства биологически активны и действенны [7]. Многочисленные исследования [16] показывают, что гомеопатия, по меньшей мере, столь же эффективна, как и препараты в больших дозах. Это обстоятельство в сочетании с отсутствием нежелательных действий лекарственных веществ доказывает хорошую переносимость и безопасность гомеопатического лечения. SUMMARY Advance of science-based homeopathy oriented to laws of nature will undoubtedly allow to find a regularity in this phenomenon that is far from being fully explored and provide an opportunity to discover new biology laws the unawareness of which hinders the study of the organism functions as well as development of medical treatment. Литература 1. Верещагин Н.В., Реброва О.Ю. Методы лечения в зеркале доказательной медицины Журн. Лечение нервных болезней, 2000, 1, 33-35 2. Кузьмин В.А., Черняков В.П., Корнеева Н.Ю., Новосадюк Т.В., Цыганова С.В., Каблучеева Т.И. // Труды 57 Конгресса Международной медицин- 118 ской гомеопатической лиги. М. 2002 г. С. 397 3. Новосадюк Т.В., Комиссаренко А.А. // Материалы Х Московского международного ветеринарного конгресса 11-13 апреля 2002 года. Москва, Россия. С. 124 4. Полежаев Ф.И., Чистякова Г.И., Джавадов Э.Д. и Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ др.//Материалы второй международной конференции «Современные вопросы ветеринарной гомеопатии». СПб, 2004. 5. Ульман Д. //Жур. Гомеопатическая медицина и акупунктура, 1997, № 2, 3-14. 6. Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины Издательство Медиа Сфера, Москва, 1998, с. 347. 7. Bellavite P., Signorini A., Homeopathy: A Frontier in Medical Science. Berkeley: North Atlantic, 1995. 8. Benveniste J. ‘Further Biological Effects Induced by Ultra High Dilutions: Inhibition by a Magnetic Field,’ in Ultra High Dilution, P. C. Endler and J. Schulte, (eds.), Dordrecht: Kluwer Academic, 1994, 35. Also J. Benveniste, B. Arnoux, L. Hadji, ‘Highly Dilute Antigen Increases Coronary Flow of Isolated Hart from Immunized Guinea-pigs,’ FASEB Journal, 1992, 6:Abs.l610. 9. Bol А. Новый метаанализ рандомизированных контролируемых клинических испытаний в гомеопатии: клиническая эффективность гомеопатии превосходит эффект плацебо. HOMINT R&D NewsLetter, 1/1998, 10-13. 10. Demangeat J.L., et al., ‘Modifications des Temps de Relaxation RMN a 4 z des Protons du Solvant dans les Tres Hautes Dilutions Salines de Silice/lactose.’ Journal of Med. Nucl. Biophy, 1992, 16:35-45. 11. Dorfman P., Lasserre M.N., Tetau M., ‘Preparation. a I’accouchement par Homeopathie: Experimentation en double-insu versus Placebo,’ Cahiers de Biotherapie, April 1987, 94:77-81. 12. Doutremepuch C., de Seze 0., Le Roy D., et al, ‘Aspirin at Very Ultra Low Dosage in Healthy Volunteers: Effects on Bleeding Time, Platelet Aggregation and Coagulation,’ Haemostasis, 1990, 20:99. 13. Eid E. Felisi, M. Sideri, ‘Applicability of Homoeopathic Caulophyllum thalictroides during Labour,’British Homoeopathic Journal, 1993, 82:245. 14. Eid Е., Felisi E., Sideri M. ‹Super-placebo ou action Pharmacologique? Une Etude en Double AveugJe, Randomisee avec un Remede Homeopathique (Caulophyllum thalictroides) dans le Travail de I›accouchement, Proceedings of the 5th Congress of the 0. M.H.I. (International Organization for Ho- meopathic Medicine), Paris, October 20-23, 1994. 15. Endler P.C., Pongratz W., Kastberg G. et al, ‘The Effect of Highly Diluted Agitated Tfiyroxine on the Climbing A ctivity of Frogs,’ Veterinary and Human Toxicology, 1994, 36:56. Also, P.C. Endler, W. Pongratz, R. van Wijk, et al, ‘Transmission of Hormone Information by Non-molecular Means,’ FASEB Journal, 1994, 8, Abs.2313. 16. Heger V. Prospektive Dokumentation in der homoopathischen Praxis – Ein essentieller Beitrag zur Qualitatssicherung. Homint R& NewsLetter 1998,2: 3-19 17. Jacobs J., Margarita L.J., Gloyd S., ‘Treatment of Acute Childhood Diarrhea with Homeopathic Medicine: A Randomized Clinical Trial in Nicaragua,’ Pediatrics, May 1994, 93,5:719-25. 18. Kleijnen J., Knipschild P., G. ter Riet, ‘Clinical Trials of Homoeopathy,’ British Medical Journal, February 9, 1991, 302:316-323. 19. Linde K., Jonas W.B., Melchart D. et al., Critical Review and Meta-Analysis of Serial Agitated Dilutions in Experimental Toxicology, Human and Experimental Toxicology, 1994, 13:481-92. 20. Linde K.,Clausius N., Raminez G., Eitel F., Hedges L.V., Jonas W.B. Are the clinical of homeoeopathy placebo effects? A meta-analysis of placebo-controlled trials. The Lancet 1997, 350; 834-843. 21. Niedele S.Гомеопатия – свод эмпирических знаний или наука (Сообщение о совещании экспертов. Homint R&D NewsLetter,1999,1,14-18. 22. Reilly D., Taylor M., McSharry C., et al., ‘Is Homoeopathy a Placebo Response? Controlled Trial of Homoeopathic Potency, with Pollen in Hayfever as Model’Lancet, October 18, 1986, 881-86. 23. Reilly D., Taylor M., Beanie N., et al, ‘Is Evidence for Homoeopathy Reproducible?’ Lancet. December 10, 1994. 344:1601-6. 24. van Wijk R., Wiegant F.A.C., Cultured Mammalian Cells in Homeopathy Research: The Similia Principle in Self-Recovery, Utrecht: University of Utrecht. 1994. 25. Zicari D., et al., ‘Valutazione dell’azione Angioprotettiva di Preparati di Arnica nel Trattamento della Retinpatia Diabetica,’ Bolletino de Oculistica, 1992, 5:841-848. УДК: 636:612.014.482 В.Н. Обрывин, Г.А. Жоров, П.Н. Рубченков Всероссийский научно-исследовательский институт ветеринарной санитарии, гигиены и экологии, г. Москва ВЛИЯНИЕ ПРЕПАРАТОВ ГАМАВИТ И ГАЛА-ВЕТ НА ТОКСИЧЕСКИЙ ИММУНОДЕФИЦИТ У БЕЛЫХ КРЫС Получение экологически безопасной продукции является одной из актуальных задач современности. Это связано с тем, что загрязнение окружающей среды токсичными элементами обусловлено постоянным ростом числа источников их поступления (19, 8). В системе мер, направленных на получение нормативно чистой продукции животноводства в условиях повышенного загрязнения сельскохозяйственВетеринарная патология. № 3. 2008 ных угодий, ветеринарные специалисты в последнее время более пристальное внимание стали уделять иммунному статусу организма животных, а именно проблеме иммунодефицитов (10, 20). Иммунодефициты являются следствием нарушения колострального иммунитета или изменений обмена веществ при воздействии на организм неблагоприятных факторов окружающей среды, таких как 119 ФАРМАКОЛОГИЯ радиация, токсические вещества, различные виды микроорганизмов и др. (2). При этом нарушается функциональная активность клеток неспецифической (моноциты, макрофаги, нейтрофилы) или специфической иммунной системы (21). Решение данной проблемы лежит не только в устранении причин, вызывающих иммунодефициты, но и в изыскании эффективных иммуномодулирующих средств и разработке технологии их применения. Эффективность иммуномодуляторов определяется их способностью восстанавливать врожденные и приобретенные нарушения клеточного и гуморального иммунитета, повышать антибактериальную и противовирусную резистентность, оказывать дезинтоксикационное действие, снижать влияние свободно-радикальных продуктов при химическом, радиационном воздействии и при попадании различных экотоксикантов в организм животных (2). Результаты исследований последних лет показали, что для повышения устойчивости организма животных к токсическому действию тяжелых металлов и радионуклидов можно использовать средства неспецифической защиты, обеспечивающие восстановление нарушений в различной степени иммунитета. Так, по данным Новикова В.А. с соавт. (17), применение янтарной кислоты при хроническом отравлении сулемой снижает содержание ртути во внутренних органах и приводит к коррекции нарушений гематологических показателей и факторов неспецифической защиты. В работах Ивановского А.А. (6, 7) научно обоснована и экспериментально доказана целесообразность коррекции неспецифической резистентности организма животных при терапии желудочно-кишечных и респираторных заболеваний препаратами гистоген, биоинфузин, грамин. По данным Елисеева С.М. с соавт. (5), введение овцам за 2-4 сут. до радиационного поражения препарата сульфотозифан оказывает положительное влияние на клиническое состояние животных, нормализует гематологические показатели, повышает количество Т- и В-лимфоцитов. В условиях радиоактивного загрязнения территорий на следе аварийного выброса Чернобыльской АЭС Бударков В.А. и др. (3), Кабась С.С. (11) показали эффективность применения иммуномодуляторов Т-активина и тимолина для лечения желудочно-кишечных заболеваний телят. Для нормализации обменных процессов и снижения содержания в организме 120 птицы свинца и кадмия в неблагополучных по содержанию тяжелых металлов районах Новосибирской области предложено применять биологически активные вещества фагостим и поливедрим (15). Наше внимание привлекли препараты гамавит и гала-вет, которые разрешены Департаментом ветеринарии для применения в качестве биогенных стимуляторов, адаптогенов и иммуномодуляторов (18). Гамавит – комплексный препарат, основными действующими веществами которого являются плацента денатурированная эмульгированная и нуклеат натрия. Препарат изготавливают в жидкой форме на основе ростовой питательной среды, содержащей сбалансированный раствор солей, аминокислот и витаминов. Гамавит содержит комплекс биологически активных веществ, благодаря которым оптимизирует обменные процессы в организме, повышает бактерицидную активность сыворотки крови, оказывает иммуномодулирующее и общее биотонизирующее действие. Препарат вводят подкожно, внутримышечно, внутривенно, а также путем выпаивания. Гала-вет – 5-амино-2,3-дигидрофталазин-1,4-дион натрия, обладает иммуномодулирующим действием, так как регулирует биосинтез активных веществ, контролирующих иммунные реакции, увеличивает фагоцитарную активность лейкоцитов. Гала-вет применяют всем видам животных для повышения иммунного статуса в качестве профилактического и лечебного средства. Препарат назначают животным внутримышечно в виде раствора. В данной статье представлены результаты исследований по изучению возможности использования препаратов гамавит и гала-вет для коррекции токсического иммунодефицита у животных при сочетанном поступлении с кормом радионуклидов (137Cs и 90Sr) и тяжелых металлов (свинец, кадмий). Материалы и методы исследований Экспериментальная часть работы проведена на базе лаборатории радиобиологии ГНУ ВНИИВСГЭ Россельхозакадемии. В опытах использовали беспородных белых крыс-самцов живой массой 185-190 г, из которых было сформировано 4 группы животных по 8 голов в каждой. Животные первой группы ежедневно в течение 45 суток получали с кормом нитрат кадмия и нитрат свинца в дозах соответственно 5 и 50 мг/кг (по элементу), что составляло 10 ПДК каждого экотоксиканта в кормах, и радионуклиды 137Cs и 90Sr в Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 1 Гематологические показатели периферической крови белых крыс при сочетанном воздействии экотоксикантов и применении препаратов гамавит и гала-вет, М±m, n = 6 №№ групп жив-х Вид воздействия Срок исследования через, сут. Гемоглобин, г/л Эритроциты, 1012/л Лейкоциты, 109/л Только экотоксиканты (Pb, Cd, 137Cs, 90Sr) 15 138,25 ± 4,32 8,26 ± 0,66 13,41 ± 0,82 1 30 120,56 ± 3,27 7,12 ± 0,76 7,22 ± 0,74 45 129,57 ± 3,21 7,30 ± 0,52 6,26 ± 0,42 15 140,53 ± 3,34 8,45 ± 0,65 12,27 ± 0,57 Экотоксиканты + гамавит 30 146,24 ± 3,18 7,86 ± 0,73 11,32 ± 0,75 45 152,53 ± 3,36 8,57 ± 0,68 12,43 ± 0,69 15 142,35 ± 3,23 8,38 ± 0,42 11,21 ± 0,36 30 152,46 ± 3,55 9,08 ± 0,82 13,67 ± 0,63 45 160,21 ± 4,12 9,23 ± 0,76 14,29 ± 0,87 15 156,23 ± 6,14 9,14 ± 0,86 11,80 ± 0,58 30 148,38 ± 5,29 8,82 ± 0,67 10,63 ± 0,45 45 154,62 ± 4,21 8,60 ± 0,72 12,26 ± 0,64 2 3 4 Экотоксиканты + гала-вет Контроль (интактные животные) количестве 2000 и 1400 Бк/кг. Животные второй группы также получали с кормом указанные экотоксиканты, а через 15 суток затравки им подкожно вводили препарат гамавит в дозе 0,5 мл/ кг массы тела с интервалом 48 ч, всего 15 инъекций. Крысы третьей группы получали все взятые в опыт экотоксиканты, а через 15 суток эксперимента им внутримышечно вводили препарат гала-вет в дозе 10 мг/кг один раз в три дня, всего 10 инъекций. Четвертая группа животных служила контролем. В ходе опыта вели наблюдение за общим состоянием животных (аппетит, жажда, поведение, проявление признаков интоксикации, прирост живой массы). В начале эксперимента, а затем через 15, 30 и 45 сут. у крыс из хвостовой вены отбирали кровь для проведения гематологических, биохимических и иммунологических исследований. Гематологические исследования заключались в определении в периферической крови количества эритроцитов, лейкоцитов и гемоглобина. Биохимические исследования сыворотки крови включали определение содержания общего белка и белковых фракций, активности ферментов щелочной фосфатазы и аланинаминотрансферазы (1). Для оценки состояния факторов клеточного и гуморального иммунитета экспериментальных животных определяли фагоцитарную активность нейтрофилов, абсолютное содержание Т- и В-лимфоцитов в крови, бактерицидную и лизоцимВетеринарная патология. № 3. 2008 ную активность сыворотки крови, а также концентрацию иммунных белков в плазме крови (4, 9, 13, 14, 16, 22). Результаты исследований При скармливании белым крысам в течение 45 суток гранулированного корма с одновременным содержанием тяжелых металлов и радионуклидов в количестве 10 ПДК каждого у животных не наблюдали внешних признаков интоксикации. Однако прирост живой массы белых крыс, получавших только экотоксиканты (группа № 1), через 45 суток эксперимента был ниже в среднем на 34 г/гол. по сравнению с контролем. При исследовании гематологических показателей периферической крови (табл. 1) у крыс первой группы через 15 суток с начала эксперимента выявлено снижение содержания гемоглобина и количества эритроцитов на 12 и 10%, а через 45 суток снижение составило 16,2 и 15,6% соответственно. Снижение количества лейкоцитов на 33% наблюдали через 30 суток, а в конце эксперимента снижение составило 49%. У крыс, которым через 15 суток затравки были применены препараты гамавит и гала-вет, количество гемоглобина, эритроцитов и лейкоцитов через 30 суток колебалось в пределах показателей контрольных животных. Результаты гематологических исследований свидетельствуют, что количество лейкоцитов у экспериментальных животных при сочетанном поступлении экотоксикантов достоверно снижается по сравнению с контролем. Иными словами, при сочетанном действии инкорпорированных 121 ФАРМАКОЛОГИЯ Таблица 2 Биохимические показатели белой крови крыс при сочетанном воздействии экотоксикантов и применении препаратов гамавит и гала-вет, М ± m, n = 6 Показатели Общий белок, г/л Алибумины, % Гаммаглобулины, % ЩФ, ммоль/л АЛТ, ммоль/л Сроки исследования через, сут. Вид воздействия Только Экотоксиканты (Pb, Cd, 137Cs, 90Sr) Экотоксиканты + гамавит 15 63,52 ± 4,28 66,44 ± 3,24 70,38 ± 2,16 30 65,21 ± 2,30 70,65 ± 2,40 66,27 ± 2,39 72,66 ± 3,15 45 67,42 ± 1,67 78,36 ± 2,53 68,43 ± 2,47 76,38 ± 1,24 15 42,35 ± 1,15 45,21 ± 2,11 43,32 ± 1,45 40,46 ± 1,20 30 50,64 ± 2,32 43,32 ± 1,18 45,56 ± 1,26 42,23 ± 1,57 45 56,62 ± 2,48 40,54 ± 1,22 41,33 ± 1,38 41,26 ± 2,19 15 16,36 ± 1,56 16,52 ± 1,38 15,82 ± 1,21 17,58 ± 1,14 30 14,23 ± 1,47 20,44 ± 1,36 18,54 ± 1,56 18,21 ± 1,23 45 12,32 ± 0,49 23,27 ± 1,16 20,54 ± 1,82 18,62 ± 1,08 15 1,77 ± 0,06 1,72 ± 0,07 1,68 ± 0,08 1,18 ± 0,05 30 2,81 ± 0,11 1,30 ± 0,06 1,40 ± 0,07 1,08 ± 0,03 45 3,48 ± 0,08 1,62 ± 0,05 1,74 ± 0,04 1,16 ± 0,04 15 0,76 ± 0,03 0,74 ± 0,05 0,72 ± 0,04 0,63 ± 0,05 30 1,74 ± 0,04 0,87 ± 0,07 0,76 ± 0,03 0,58 ± 0,06 45 2,56 ±0,07 0,98 ± 0,05 0,87 ± 0,04 0,61 ± 0,08 радионуклидов (137Cs и 90Sr) и тяжелых металлов (свинец, кадмий) в указанных выше дозах наиболее выраженные изменения наблюдаются со стороны клеток белой крови. Лейкопения может свидетельствовать как о гибели клеток в кровяном русле, так и о снижении кроветворной функции лимфоидных органов в результате токсического действия тяжелых металлов и радионуклидов. При применении препаратов гамавит и гала-вет количество эритроцитов и лейкоцитов восстанавливалось до уровней физиологической нормы к 30 дню эксперимента и в последующем сохранялось на протяжении всего срока эксперимента. Результаты биохимических исследований сыворотки крови представлены в таблице 2. Данные таблицы свидетельствуют, что сочетанное поступление с кормом в течение 45 суток тяжелых металлов и радионуклидов приводит к увеличению количества альбуминов на 15,4% и одновременно к снижению гамма-глобулинов на 6,3%. Установлено, по сравнению с контролем, повышение активности ферментов щелочной фосфатазы (ЩФ) в 3 раза и аланинаминотрансферазы (АЛТ) в 4,2 раза. Последнее может свидетельствовать о начальном процессе гепатоза, так как при заболеваниях печени в первую очередь и наиболее значительно изменяется активность 122 Контроль Экотоксиканты (интактные животные) + гала-вет 75,44 ± 2,12 АЛТ (12). В этой связи определение активности аминотрасфераз (в т.ч. и АЛТ) в сыворотке крови животных, находящихся в зонах антропогенного загрязнения территорий радионуклидами и тяжелыми металлами, может иметь важное диагностическое значение. Показатели клеточного и гуморального иммунитета, а также уровня естественной резистентности белых крыс при сочетанном воздействии взятых в опыты экотоксикантов представлены в таблицах 3 и 4. Из данных таблицы 3 видно, что количество Т-и В-лимфоцитов в крови белых крыс при сочетанном поступлении тяжелых металлов и радионуклидов снижается по сравнению с контролем через 15 суток в 1,3 и 1,4 раза, а через 45 суток – в 1,8 и 2,4 раза соответственно. Следовательно, при сочетанном воздействии тяжелых металлов и радионуклидов на фоне общего снижения количества лейкоцитов в крови происходит снижение и абсолютного содержания Т- и В-лимфоцитов крови. При этом наибольшие изменения наблюдаются со стороны В-системы, что в свою очередь сопровождается снижением концентрации иммунных белков на протяжении всего эксперимента. При введении экспериментальным животным препарата гамавит абсолютное содержание Т- и В-субпопуляций лимфоцитов в крови через 30 суток достигало уровВетеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ Таблица 3 Показатели клеточного и гуморального иммунитета крыс при сочетанном воздействии экотоксикантов и применении препаратов гамавит и гала-вет, М±m, n = 6 № групп жив-х 1 2 3 4 Содержание Т- и В-лимфоцитов в крови (× 109/л) Т-клетки В-клетки Концентрация иммунных белков, мг/мл Только экотоксиканты (Pb, Cd, 137Cs, 90Sr) 15 2,20 ± 0,12 0,88 ± 0,10 3,28 ± 0,47 30 1,13 ± 0,11 0,57 ± 0,08 3,06 ± 0,29 45 1,02 ± 0,09 0,50 ± 0,07 3,12 ± 0,36 15 2,12 ± 0,11 0,91 ± 0,11 3,16 ± 0,33 Экотоксиканты + гамавит 30 2,39 ± 0,14 1,22 ± 0,12 3,48 ± 0,44 Вид воздействия Экотоксиканты + гала-вет Контроль (интактные животные) Срок исследования через, сут. 45 3,18 ± 0,17 1,90 ± 0,09 3,84 ± 0,25 15 2,16 ± 0,13 0,82 ± 0,08 3,31 ± 0,32 30 2,94 ± 0,15 2,17 ± 0,13 3,64 ± 0,27 45 3,26 ± 0,12 2,25 ± 0,14 3,77 ± 0,41 4,23 ± 0,52 15 2,86 ± 0,17 1,23 ± 0,11 30 2,78 ± 0,15 1,25 ± 0,09 4,14 ± 0,38 45 2,30 ± 0,16 1,21 ± 0,12 4,26 ± 0,64 Таблица 4 Показатели уровня естественной резистентности крыс при сочетанном воздействии экотоксикантов и применении препаратов гамавит и гала-вет, М±m, n = 6 № групп жив-х Вид воздействия Срок исследования через, сут. ФАН, % Только экотоксиканты (Pb, Cd, 137Cs, 90Sr) 15 1 30 45 15 2 3 4 Экотоксиканты + гамавит Экотоксиканты + гала-вет Контроль (интактные животные) БАСК, % Концентрация лизоцима, мг/мл 44,27 ± 2,12 39,14 ± 1,32 1,44 ± 0,13 35,32 ± 1,36 30,52 ± 2,22 1,12 ± 0,07 25,24 ± 2,64 27,38 ± 1,39 0,96 ± 0,09 45,04 ± 2,17 40,22 ± 1,14 1,48 ± 0,07 30 53,28 ± 2,32 51,81 ± 2,37 1,33 ± 0,06 45 52,32 ± 2,25 48,42 ± 2,42 1,46 ± 0,08 15 47,86 ± 2,16 41,38 ± 2,19 1,42 ± 0,06 30 54,24 ± 3,21 48,74 ± 1,82 1,53 ± 0,07 45 57,35 ± 3,32 56,37 ± 2,13 1,62 ± 0,09 15 52,45 ± 2,64 54,26 ± 2,36 1,64 ± 0,13 30 53,24 ± 2,22 52,63 ± 3,21 1,56 ± 0,13 45 51,76 ± 1,39 53,87 ± 2,46 1,62 ± 0,12 Примечание. ФАН – фагоцитарная активность нейтрофилов; БАСК – бактерицидная активность сыворотки крови. ня контрольных животных. Введение препарата гала-вет приводило к увеличению абсолютного содержания Т-лимфоцитов в 3,2 раза по сравнению с животными, не получавшими препарат, а В-лимфоцитов – 4,5 раза. Не установлено достоверных изменений концентрации иммунных белков сыворотки крови при введении препаратов гамавит и гала-вет. Данные, представленные в таблице 4, свидетельствуют, что у подопытных животных при сочетанном поступлении радионуклидов и тяжелых металлов через 45 сут. эксперимента наблюдается снижение Ветеринарная патология. № 3. 2008 фагоцитарной активности нейтрофилов на 26%, бактерицидной активности сыворотки крови на 31% и концентрации лизоцима на 42%. При введении препаратов гамавит и гала-вет фагоцитарная активность нейтрофилов повышается на 27 и 32%, а бактерицидная активность сыворотки крови на 21 и 28% соответственно по сравнению с животными, которым препараты не вводили. Концентрация лизоцима под действием препаратов гамавит и гала-вет также повышалась и достигла уровня контрольных животных через 30 и 45 суток соответственно. 123 ФАРМАКОЛОГИЯ Таким образом, сочетанное поступление с кормом нитратов свинца и кадмия, радионуклидов 137Cs и 90Sr вызывает у экспериментальных животных состояние иммунодефицита, проявляющееся в угнетении факторов неспецифической защиты, а также клеточного и гуморального звеньев иммунной системы. Введение препаратов гамавит и гала-вет на фоне радиационно-химического воздействия приводит к нормализации иммунологических показателей организма экспериментальных животных. Последнее указывает на развитие компенсаторной реакции и активизацию работы иммунной системы по защите организма от воздействия внешних неблагоприятных факторов. Выводы 1. Сочетанное поступление с кормом в течение 45 суток радионуклидов (137Cs и 90Sr) и тяжелых металлов (свинец, кадмий) в дозах, в 10 раз превышающих ПДК, вызывает у белых крыс токсический имму- нодефицит, проявляющийся в снижении уровня естественной резистентности и угнетении клеточного и гуморального звеньев иммунной системы. 2. Поступление с кормом взятых в опыт экотоксикантов вызывает выраженную лейкопению и достоверное повышение активности ферментов щелочной фосфатазы и аланинаминотрансферазы. Последнее может свидетельствовать о начале развития гепатоза. 3. Введение экспериментальным животным препаратов гамавит или гала-вет в терапевтических дозах на фоне сочетанного воздействия радионуклидов и тяжелых металлов вызывает стимулирующее действие на иммунокомпетентные системы и восстановление до уровня физиологической нормы основных показателей иммунологического статуса животных. При этом препарат гала-вет проявляет более выраженный эффект для восстановления неспецифических факторов защиты организма. РЕЗЮМЕ В условиях хронического эксперимента изучено влияние препаратов гамавит и гала-вет на некоторые гематологические, биохимические и иммунологические показатели организма белых крыс при сочетанном поступлении с кормом радиоактивных веществ (137Cs и 90Sr) и тяжелых металлов (свинец и кадмий) в дозах, в 10 раз превышающих ПДК. Применение препаратов гамавит и гала-вет приводило к восстановлению исследуемых показателей до уровня физиологической нормы. SUMMARY Chronic combinated entering radionuclides (137Cs and 90Sr) and heavy metals (Pb and Cd) in white rats with feed in doses 10 times exceeding highest permissible concentrations resulted in change of hematological, biochemical and immunological indices and in toxic immunodeficiency of animals. Use of Gamavit and Gala-vet produced normalization of investigated indices and lowering toxic immunodeficiency. Литература 1. Антонов В.Я., Блинов П.Н. Лабораторные исследования в ветеринарии. М.: «Колос». 1971. 648 с. 2. Апалькин В.А., Иванов А.В., Юсупов Р.Х. Структурная организация и функция иммунной системы в обеспечении гомеостаза макроорганизма // Ж. «Ветеринарный врач». 2005. № 3. С. 17-23. 3. Бударков В.А., Антоненко А.Е., Кабась С.С. Лечение Т-активином заболеваний желудочнокишечного тракта телят в зоне радиоактивного загрязнения БССР // Тез. докл. 3 Всес. конф. по с/х радиол. Обнинск. 1990. т. 2. С. 159-160. 4. Дорофейчук В.Г. Определение активности лизоцима нефелометрическим методом // Ж. «Лабораторное дело». 1968. № 1. С. 28-30. 5. Елисеев С.М., Конюхов Г.В., Гареев Р.Д. Влияние сульфотозифана на физиологический статус облученных овец // Ученые записки КГАВМ «Особенности физиологических функций животных в связи с возрастом, составом рациона, производительностью, экологией и этологией». Казань. 2006. т. 185. С. 88-93. 6. Ивановский А.А. Влияние препарата биоинфузин на некоторые показатели иммунитета // Ж. «Ветеринария». 2000. № 9. С. 43-46. 7. Ивановский А.А. Влияние препаратов иммуномодуляторов на неспецифическую резистентность телят // Ж. «Аграрная наука Евро-СевероВостока». Киров. 2000. С. 75-79. 8. Ильязов Р.Г. Проблемы экологической безопасности животноводства в условиях радиационной катастрофы и нефтегазового техногенеза // В сборнике «Проблемы экотоксикологического, 124 радиационного и эпизоотологического мониторинга». Казань. 2005. С. 29-41. 9. Иммунологические методы // Под. ред. Г. Фримеля. М.: «Медицина». 1987. 412 с. 10. Исамов Н.Н., Бударков В.А., Сургучева Л.М. Диагностика и специфическая профилактика инфекционных болезней сельскохозяйственных животных на территории, загрязненной радиоактивными веществами// Ж. «Ветеринарная патология». 2002. № 3. С. 134-151. 11. Кабась С.С., Антоненко А.Е., Бударков В.А. Влияние Т-активина на иммунитет телят, содержащихся в зоне радиоактивного загрязнения БССР // Тез. докл. респ. научно-практ. конф. по радиобиол. и радиоэкол. Минск. 1990. С. 82. 12. Калюжный М.И., Баринов Н.Д., Козлов С.В. Диагностическое значение ферментов АСТ и АЛТ при болезнях печени // В сб. «Научные основы обеспечения защиты животных от экотоксикантов и возбудителей опасных инфекционных заболеваний». Мат. Международного симпозиума, 28-30 ноября 2005 г. Казань. С. 477-479. 13. Кондрахин И.П., Курилов Н.В., Малахов А.Г. //В кн.: «Клиническая лабораторная диагностика в ветеринарии». Справочное издание. М.: «Агропромиздат». 1985. 287 с. 14. Кост С.А., Стенко М.И. Определение фагоцитарной активности лейкоцитов // Клиническая гематология животных. М. 1974. С. 99-100. 15. Кропачев Д.В. Применение БАВ фагостим и поливедрим для снижения аккумуляции свинца и кадмия в организме птицы // Материалы реги- Ветеринарная патология. № 3. 2008 ФАРМАКОЛОГИЯ он. научн. конф. молодых ученых аграрн. ВУЗов Сиб. фед. округа «Аграрная наука России в новом тысячелетии». Омск. 2003. т. 3. С. 45-47. 16. Никитин В.Н. Справочник методов иммунологии. Кишинев: «Штиинца». 1982. 303 с. 17. Новиков В.А., Хасанов Р.М., Конюхова В.А., Тремасов М.Я. и др. Лечение животных при отравлении ртутью // Ж. «Ветеринарный врач». 2005. № 1. С. 22-26. 18. Скребкова Е.А., Пахмутова И.А. Иммуномодулирующие эффекты препаратов «Гамавит» и «Полиферрин-А» // В сб. «Научные основы обеспечения защиты животных от экотоксикантов и возбудителей опасных инфекционных заболеваний». Мат. Международного симпозиума, 28-30 ноября 2005 г. Казань. С. 535-537. Ветеринарная патология. № 3. 2008 19. Смирнов А.М., Симецкий М.А., Таланов Г.А. Современные задачи ветеринарной науки в решении проблем ветеринарной санитарии и экологии //Тезисы докладов Всеросс. конф. «Экологические проблемы сельского хозяйства и производства качественной продукции». М.-Ч. 1999. С. 8-9. 20. Сутыгина А.Н. «Фелуцен» – защита от иммунодефицита//Ж. «Ветеринария и кормление». 2007. № 5. С. 17. 21. Тремасов М.Я., Новиков М.А., Конюхова В.А. и др. Совместное действие микотоксина Т-2 и кадмия на животных// Ж. «Ветеринарный врач». 2005. № 2. С. 9-11. 22. Турко М., Де Петрис С., Такач Б. и др. Иммунология: методы исследований. М.: «Мир». 1983. 125 Вниманию авторов 1. Редакция принимает статьи, не опубликованные и не переданные в редакции других периодических изданий. 2. С целью ускорения публикации статей редакция принимает статьи и рисунки на любых электронных носителях и в любом формате. Принимаются и статьи в отпечатанном виде. 3. В начале статьи, над ее названием, просим проставлять индекс Универсальной десятичной классификации (УДК). Под заголовком необходимо указывать инициалы, фамилию автора (авторов), полное название института (организации), в котором работают авторы, должность, ученую степень и ученое звание. Статья должна заканчиваться конкретными выводами, содержать краткое резюме на русском и английском языках и список литературы. 4. К статье необходимо приложить: - точный домашний адрес или адрес для переписки, номер служебного и/или домашнего телефона, факса, адрес электронной почты (если есть); - название статьи, Ф.И.О. автора (авторов) на английском языке. 5. С целью ускорения публикации статей желательно переписку осуществлять по электронной почте. 6. Материалы не возвращаются. 7. Авторский гонорар не выплачивается. Редакция Учредитель и издатель ООО «Ветеринарный консультант» Лицензия на издательскую деятельность: ИД № 06140 от 26 октября 2001 г. Свидетельство о регистрации средства массовой информации ПИ № 77-11332 от 10 декабря 2001 г. Адрес редакции: 109428, г. Москва, Рязанский проспект, д. 24, корп. 1 ГНУ ВИЭВ (ООО «Ветеринарный консультант) Тел.: (906) 788-75-12; (903) 133-31-25; (495) 970-03-69 E-mail: [email protected] http://www.vetcons.ru Бумага офсетная. Формат 70×108/16. Гарнитура Таймс. Печать офсетная. Усл. печ. л. 15. Уч.-изд. л. 17,2. Тираж 500 экз. Заказ № 445. Отпечатано в типографии ООО «ТИССО-Полиграф», г. Москва, ул. Шарикоподшипниковская, д. 4.