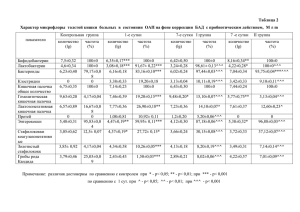
Создание и оценка биологического действия ген
реклама

78 Оригинальные исследования Создание и оценка биологического действия ген-активированного остеопластического материала, несущего ген VEGF человека Р.В. Деев 1, А.Ю. Дробышев 2, И.Я. Бозо 1, 2, Д.В. Галецкий 3, В.О. Королев 3, И.И. Еремин 4, Е.С. Филоненко 5, С.Л. Киселев 6, А.А. Исаев 1 1 Институт Стволовых Клеток Человека, Москва 2 Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва 3 Санкт-Петербургский государственный медицинский университет им. И.П. Павлова, Санкт-Петербург 4 Федеральный медицинский биофизический центр ФМБА России, Москва 5 Научно-исследовательский центр «Курчатовский институт», Москва 6 Институт общей генетики им. Н.И. Вавилова РАН, Москва Construction and biological effect evaluation of gene-activated osteoplastic material with human vegf gene R.V. Deev 1, A.Y. Drobyshev 2, I.Y. Bozo 1, 2, D.V. Galetsky 3, O.V. Korolev 3, I.I. Eremin 4, E.S. Philonenko 5, S.L. Kiselev 6, A.A. Isaev 1 1 Human Stem Cells institute, Moscow 2 A.I. Evdokimov Moscow State University of Medicine and Dentistry, Moscow 3 Saint-Petersburg Pavlov State Medical University, Saint-Petersburg 4 A.I. Burnazyan Federal Medical and Biophysical Center of FMBA, Moscow 5 Russian Scientific Centre «Kurchatov Institute», Moscow 6 N.I. Vavilov Institute of General Genetics of RAS, Moscow Разработка новых эффективных остеопластических материалов высоко востребована в практике травматологии и ортопедии, хирургической стоматологии и челюстно-лицевой хирургии. Целью исследования являлось создание ген-активированного костного графта (ГАКГ) из носителя на основе коллагена и гидроксиапатита и плазмидной конструкцией, имеющей в своем составе генVEGF-A165 человека, а также оценка его биологического действия in vitro и in vivo. Было установлено, что ко-инкубирование ГАКГ с культурой мультипотентных мезенхиальных стромальных клеток приводит к повышению экспрессии ими белка VEGF. При имплантации ГАКГ в дефекты теменных костей кроликов наблюдалась трансфекция клеток реципиентного ложа, что сопровождалось более выраженным ангиогенезом, по сравнению с контролем. На сроках 15 и 30 сут. определялся больший объем костного регенерата при использовании ГАКГ. При этом, источником репаративного остеогенеза являлись не только теменные кости, но и фрагменты ГАКГ (даже из центральной части дефекта), большинство из которых были окружены новообразованной костной тканью. В контроле остеоиндуктивного действия материала не наблюдалось. Таким образом, ГАКГ с плазмидной конструкцией, имеющей в своем составе ген VEGF-A165 человека, обладает ангиогенной активностью, обеспечивающей остеоиндуктивное действие. Development of new effective osteoplastic materials is highly requested in practice of traumatology and orthopedics, oral and maxillofacial surgery. The goals of our research were design and construction of gene-activated bone graft (GABG) consisting of collagen/hydroxyapatite scaffold and plasmid DNA encoding vegf-a165 and evaluation of its biological effect in vitro and in vivo. We have shown that GABG co-incubation with multipotent mesenchymal stromal cells increased their VEGF protein expression. After GABG implantation into parietal bones defects the transfection of «recipient bed cells» was observed and accompanied by more pronounced angiogenesis as compared with control. The lager volume of bone regenerate was in case of GABG on 15 and 30 days after application. The source of reparative osteogenesis was not only parietal bones but also the GABG fragments (even from central part of the defect) majority of which were surrounded by newly formed bone tissue. In control group no osteoinductive effect has been observed. Thus, GABG with plasmid DNA encoding VEGF-A165 possesses angiogenic activity providing osteoinductive properties. Ключевые слова: ген-активированный костный графт, vegf-a165, ангиогенез, остеогенез, остеоиндуктивные свойства. Key words: gene-activated bone graft, vegf-a165, angiogenesis, osteogenesis, osteoinductive properties. Одной из наиболее актуальных проблем травматологии и ортопедии, хирургической стоматологии и челюстно-лицевой хирургии является эффективное лечение пациентов, нуждающихся в реконструктивных операциях [1–3]. Воспалительные заболевания, травмы, врожденные аномалии развития и дефор- мации костей, онкологическая патология, а также первые этапы их хирургического лечения неизбежно приводят к формированию костных дефектов или атрофии костной ткани. В зависимости от объемов утраченной костной ткани, степени морфофункциональных нарушений, специфики соматического e-mail: [email protected] Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 Оригинальные исследования статуса пациентов используются различные методы реконструкции костей, которые, за исключением дистракционного остеогенеза и протезирования, базируются на применении остеопластических материалов. При этом, если степень развития современных хирургических технологий очень высока и теоретически позволяет добиться успешных результатов в большинстве клинических ситуаций, то лимитирующим фактором, ограничивающим практическую эффективность их применения (результат лечения), являются именно остеопластические материалы [4]. «Золотым стандартом» костнозамещающих материалов является аутогенная костная ткань, применимая практически в любой клинической ситуации. Так, для восполнения костных дефектов малого и среднего размеров эффективно использование свободных костных фрагментов (в перемолотом виде, в виде блоков и т.д.), для пластики больших (протяженных и (или) объемных) – костных аутотрансплантатов на «сосудистой ножке» [3, 5]. В ряде случаев непосредственно в ходе выполнения оперативного вмешательства удается получить некоторое количество аутогенной костной ткани, которая может быть использована (в том числе при смешивании с другими материалами) в костнопластическом этапе той же операции для восполнения малых костных дефектов. Однако в большинстве случаев требуется расширение или выполнение дополнительного операционного доступа для получения нужного объема костной ткани, что сопряжено с увеличением продолжительности оперативного вмешательства, нанесением дополнительной травмы, увеличением риска осложнений и т.д. [6, 7]. В связи с вышеуказанными предпосылками, параллельно развитию хирургических технологий активно разрабатываются новые остеопластические материалы, обладающие биологической активностью, за счет которой способны по эффективности в замещении костных дефектов составить «конкуренцию» аутогенной костной ткани. Данное исследование было нацелено на создание и оценку биологического действия генактивированного костного графта (ГАКГ) – остеопластического материала, содержащего в качестве активного компонента плазмидную ДНК с геном, кодирующим сосудистый эндотелиальный фактор роста (VEGF-A165). Материал и методы Дизайн исследования Исследование включало два последовательных этапа: 1) in vitro, нацеленный на создание прототипа ГАКГ и оценку его специфической активности на культурах клеток; 2) in vivo, направленный на определение биологического действия разработанного ГАКГ в модели замещения костных дефектов критических размеров. Исследования in vitro Создание ГАКГ. Матриксы-носители для генных конструкций выбирали из ряда групп ординарных остеопластических материалов, разрешенных для клинического применения и не обладающих биологической активностью: аллогенные деминерализованные костные матриксы, синтетические β-трикальцийфосфаты, композитные материалы на 79 основе коллагена и гидроксиапатита, ксеногенные костные матриксы и ряд других. Обработку материалов и совмещение с генными конструкциями – плазмидными ДНК с геном vegf-a165 (plVEGF-A165) – выполняли по специальной методике: последовательная отмывка матриксов 0,5 М (в течение 10 ч) и 10 мМ (4 раза по 10 мин) растворами фосфатного буфера при постоянном перемешивании и температуре 37°С с последующим высушиванием; инкубирование с раствором плазмидных ДНК (концентрация 1 мкг/мкл) в течение 10 ч при постоянном перемешивании и температуре 37°С, промывание материалов и высушивание. Определение уровня плазмидных ДНК, сорбированных материалами, производили с помощью флуоресцентной фотометрии после элюирования нуклеиновых кислот 0,5 М раствором фосфатного буфера. Из полученных ГАКГ для последующих исследований отбирали один вариант, матрикс-носитель которого обладал наибольшей емкостью для генных конструкций. Оценка специфической активности. Фрагменты полученного ГАКГ массой 10 мг (содержание plVEGF-A165 – 1,7 мкг) были ко-инкубированы с культурами мультипотентных мезенхимальных стромальных клеток (ММСК), количеством 2×105 кл. Культивирование выполнялось в стандартных условиях (среда MesenCult (StemCell Technology, США) с добавлением 2 мM L-глутамина (StemCell Technology, США), 100 ед./мл пенициллина и 100 мг/мл стрептомицина (StemCell Technology, США) и 10% добавки для культивирования клеток MesenCult (StemCell Technology, США) при температуре 37°С и содержании СО2 в атмосфере 5% в течение 5 сут. без смены среды. На 1, 3, 5 сут. забирали пробы культуральной среды и с помощью иммуноферментного анализа определяли концентрацию VEGF. В качестве контроля служили культуры клеток с продукцией только эндогенного VEGF – без ко-инкубирования с какимилибо материалами. Исследования in vivo Исследования выполнены на кроликах породы Шиншилла (n = 10), массой 2,0–2,5 кг, обоего пола с соблюдением международных правил гуманного обращения с животными. Изготовление ГАКГ. Для создания ГАКГ, подлежащих исследованию in vivo, использовали двухкассетные плазмидную ДНК, содержащую под одним промотором помимо vegf-а165, еще и ген, кодирующий зеленый флуоресцирующий белок (GFP), что было обусловлено необходимостью детекции экспрессии плазмид in vivo. Двухкассетные плазмиды были предоставлены Казанским федеральным университетом. Имплантация в костные дефекты. В качестве модели критического костного дефекта использовался стандартный протокол – краниальные дефекты (диаметром 10 мм) теменных костей. После премедикации (атропин 0,04 мг/кг, цефазолин 25 мг/кг) и антисептической обработки операционного поля под инфильтрационным обезболиванием (раствор Ультракаина 1,7 мл) и седацией (2,5% раствор тиопентала натрия внутримышечно 2 мл) производился линейный разрез (2–2,5 см) мягких тканей в проекции сагиттального шва от бугра затылочной кости кпереди. Поверхность теменных костей обнажалась распатором. Каждому животному с помощью боров Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 80 Оригинальные исследования (обратный конус, 1,0 мм) выполнялись двусторонние симметричные дефекты теменных костей без повреждения твердой мозговой оболочки. В дефект правой теменной кости вносили ГАКГ (экспериментальная группа, № 1), а в дефект левой – соответствующий носитель без плазмидной ДНК (контрольная группа, № 2) (рис. 1). В группе № 3 дефекты оставляли без имплантации каких-либо материалов. Операционная рана ушивалась послойно узловыми швами (Vicryl 5/0, 4/0), сведение краев рассеченной надкостницы обеспечивало фиксацию материалов в пределах костных дефектов. кассетных плазмидных ДНК клетками регенерата) и α-гладкомышечному актину (α-SMA, детекция гладкомышечных клеток сосудов). Результаты Разработанный ГАКГ С помощью флуоресцентной спектрофотометрии нами были установлены средние концентрации плазмидной ДНК, сорбируемые различными остеопластическими материалами. Из широкой линейки различных материалов для создания ГАКГ был выбран композитный материал на основе коллагена и гидрокисапатита, обладающий наибольшей ёмкостью для нуклеиновых кислот (табл. 1). Продукция VEGF культурой ММСК С помощью иммуноферментного анализа была установлена статистически значимо большее содержание VEGF в культуральной среде ММСК при их ко-инкубировании с ГАКГ, по сравнению с культурой клеток без каких-либо материалов. Максимальный уровень VEGF наблюдался на пятые сутки и составлял, в случае ГАКГ, 4720±244,8 пг/мг. Биологическое действие ГАКГ в костном дефекте Рис. 1. Дефекты теменных костей кролика, заполненные остеопластическими материалами Методы оценки результатов. Результаты определяли через 15 и 30 сут. с использованием двух групп методов. С целью оценки эффективности материалов в замещении костных дефектов определяли характеристики регенерата с помощью мультиспиральной компьютерной томографии (МСКТ) и гистологического исследования, а также долю новообразованной костной ткани в общем объеме дефекта гистоморфометрическим анализом. При изготовлении препаратов срезы во всех случаях производили во фронтальной плоскости через центр ранее выполненного дефекта. Для установления механизма действия генных конструкций ГАКГ использовали иммуногистохимический анализ с антителами к GFP (обнаружение экспрессии двух- Через 15 сут., по данным МСКТ, в экспериментальной и контрольной группах 1 существенной разницы между регенератами правой (имплантация ГАКГ) и левой (имплантация носителя без плазмидной ДНК) теменных костей не было выявлено: определялись четкие контуры дефектов, плотность регенерата соответствовала «мягким тканям» с включением частиц с повышенной рентгенконтрастностью (по всей видимости, гранул гидроксиапатита носителя). Однако контуры дефекта в контрольной группе 2 (без имплантации каких либо материалов) были ровными, тогда как после имплантации ГАКГ – «изрезанными», менее четкими. Через 30 сут. при имплантации ГАКГ наблюдались более выраженные признаки остеогенеза – неровные, нечеткие контуры дефектов за счет повышенной плотности периферических зон регенерата (2-3 мм), в то время как в контроле границы дефектов сохранялись четкими и ровными, их диаметр не сокращался (рис. 2). Результаты МСКТ были подтверждены гистологическим и гистоморфометрическим исследованиями. Через 15 сут. во всех группах большая часть дефектов была заполнена реактивно измененной рыхлой волокнистой соединительной тканью (рис. 3). Емкость различных остеопластических материалов для генных конструкций Перечень исследованных носителей «Емкость» для нуклеиновых кислот, нг/мг (M±m) β-трикальцийфосфат 52,1±1,3 Композитный материал на основе коллагена и гидроксиапатита 170,6±3,5 Аллогенный деминерализованный костный матрикс 69,7±1,8 Ксеногенный депротеинизированный костный матрикс 116,4±2,9 Прочие Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 до 50 81 Оригинальные исследования А Б Рис. 2. Дефекты теменных костей кролика: А – через 15 сут.; Б – через 30 сут. после имплантации материалов. Белой стрелкой обозначен дефект правой теменной кости с введенным ГАКГ, противоположный – контроль. Мультиспиральная компьютерная томография А Б В Г Д Рис. 3. Дефекты теменных костей кролика, 15 сут. операции: А, Б – введение ГАКГ; В, Г – введение носителя без plVEGF-A165; Д – без введения каких-либо материалов. Окраска по Голднеру. Ув.: А, В, Д ×40; Б, Г ×400 Однако в случае имплантации ГАКГ определялся более выраженный репаративный остеогенез со стороны костных опилов, по сравнению с контролем. При этом, гранулы ГАКГ, расположенные даже в центральной части дефекта, были окружены узким ободком новообразованной ретикуло-фиброзной костной ткани (рис. 3Б). При использовании носите- ля без плазмидной ДНК остеоиндуктивного действия не наблюдалось – все гранулы введенного материала были окружены только реактивно измененной рыхлой волокнистой соединительной тканью без признаков остеогенеза (рис. 3Г). В группе № 3, без имплантации каких-либо материалов, периферический остеогенез был минимален, а реактивно измененная рых- Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 82 Оригинальные исследования лая волокнистая соединительная ткань, заполнявшая дефект, истончена, что характерно для естественного хода репаративного процесса в случае костных дефектов «критического размера» (рис. 3Д). При иммуногистохимической реакции с антителами к GFP в регенератах экспериментальной группы на сроке 15 сут. были выявлены клетки, экспрессирующие данный белок (рис. 4), а также выявлено значимо большее количество сосудов, чем в контроле (рис. 5). Через 30 сут. в группе с имплантацией ГАКГ наблюдался еще более выраженный регенерат из ретикуло-фиброзной костной ткани, исходящей как из костных опилов, так и из гранул материала. При имплантации носителя без плазмидной ДНК определялся лишь периферический костный регенерат умеренного объема, а фрагменты введенного материала были все также окружены реактивно измененной рыхлой волокнистой соединительной тканью без признаков репаративного остеогенеза (рис. 6). А Рис. 4. Регенерат из области костного дефекта через 15 сут. после имплантации ГАКГ. Иммуногистохимическая реакция с антителами к GFP. Докраска ядер: гематоксилин. Ув.: ×250 Б Рис. 5. Регенераты из областей костных дефектов, 15 сут. после имплантации материалов: А – носителя без plVEGF-A165; Б – ГАКГ. Иммуногистохимическая реакция с антителами к GFP. Ув.: ×100 А Б В Г Рис. 6. Дефекты теменных костей кролика, 30 сут. операции: А, Б – введение ГАКГ; В, Г – введение носителя без plVEGF-A165. Окраска по Голднеру. Ув.: А, В, Д ×40; Б, Г ×400 Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 Оригинальные исследования В группе № 3 – гистологическая картина оставалась практически без изменений, объем костного регенерата с периферии увеличивался незначительно. Результаты гистологического исследования были подтверждены количественно гистоморфометрией: при использовании ГАКГ доля костного регенерата в общей площади ранее выполненного дефекта составила через 15 сут. 19±3%, а через 30 – 28±7%, в то время как в контроле – 14±2% и 17±3%, соответственно. Обсуждение Все остеопластические материалы, как уже применяющиеся в клинической практике, так и находящиеся на стадии разработки, могут быть разделены на две основные категории: «ординарные» и «оптимизированные» («активированные»). Первая включает относительно простые материалы, механизм действия которых обусловлен лишь остеокондукцией (выполнение роли своеобразной «матрицы» для формирующегося регенерата, направляющей его рост) и привнесением в область костного дефекта структурных компонентов межклеточного матрикса, которые высвобождаются при биодеградации материала и теоретически могут быть включены в состав костного регенерата. В результате предел эффективности «ординарных» материалов ограничивается оптимизацией естественного хода репаративного остеогенеза, что достаточно для замещения небольших костных дефектов, характеризующихся высоким уровнем активности нативных остеоиндуцирующих факторов [8]. Вторая категория представлена более сложными остеопластическими материалами, состоящими из матрикса-носителя и активного компонента, определяющего ключевой механизм действия «оптимизированного» остеопластического материала, а именно: остеоиндукцию и (или) остеогенность. В этой связи, они призваны не столько поддержать естественный ход репаративного остеогенеза, сколько индуцировать и обеспечить его высокую активность, что теоретически делает их применимыми в замещении не только малых, но и протяженных, объемных костных дефектов, характеризующихся «остеогенной недостаточностью» – низкой активностью естественных остеоиндуцирующих факторов: клеток и продуцируемых ими регуляторных белков [9]. В настоящее время в качестве активных компонентов «оптимизированных» остеопластических материалов используются белки (факторы роста), различные типы клеток и геннотерапевтических конструкций, что позволяет разделить разработки на три технологических направления – постгеномное, клеточное и генное [10]. Создание ГАКГ Данное исследование было нацелено на создание и оценку биологического действия ГАКГ, состоящего из носителя и plVEGF-A165. Выбор в качестве генных конструкций ГАКГ именно plVEGF-A165 был обусловлен тем фактом, что ангиогенез является критически значимым остеоиндуцирующим фактором [11], реализующим свое действие как за счет повышения парциального давления кислорода, приводящего к активизации пролиферации и дифференцировки предшественников остеобластов [8, 12], так и за счет привлечения в область костного дефекта дополнительных камбиальных резервов [13]. При 83 этом, для использованных в работе plVEGF-A165 уже была показана выраженная ангиогенная активность в ходе экспериментальных и клинических исследований препарата «Неоваскулген» (Институт стволовых клеток человека, Россия), действующим веществом которого являются те же самые plVEGF-A165 [14]. Существует несколько основных технологий объединения генных конструкций и носителей из твердых материалов. Наиболее известными являются: совмещение компонентов на этапе синтеза носителя, имеющего на одном из этапов процесса изготовления жидкую фазу [15]; помещение генных конструкций в гелевую субстанцию и последующая комбинация полученного комплекса с носителем [16], сонопорация генных конструкций в гелевый носитель и т.д. [17]. Нами же была использована другая технология, основанная на образовании нековалентной химической связи между нуклеиновыми кислотами и гидроксиапатитом, в том или ином варианте входящим в состав большинства остеопластических материалов, выбранных нами для исследования. Биологическое действие ГАКГ Остеоиндуцирующее действие ГАКГ определяется биологически активным компонентом, входящим в его состав, – генными конструкциями. В соответствии с современными данными, механизм действия генных конструкций основан на их поступлении в клетки-мишени, далее в их ядра и экспрессии целевого гена клетками, в данном конкретном случае гена VEGF-A165 человека. Клетки начинают работать как «биореакторы» терапевтического белка (кодируемого плазмидой), который в свою очередь обеспечивает специфическое действие. Вероятность встраивания (интеграции) плазмидной ДНК в геном клетки очень низка, ген экспрессируются с эписомы ограниченное время (10–14 сут.), что обеспечивает безопасность технологии. В этой связи, для реализации своего терапевтического действия плазмидная ДНК plVEGF-A165, использованная нами для создания ГАКГ, должна высвобождаться из структуры носителя (в т.ч. при его биодеградации), проникать в клетки-мишени и приводить к повышению продукции белка VEGF, который в свою очередь должен активировать специфические биологические эффекты, главным образом, неоангиогенез. В ходе экспериментов in vivo была выявлена значимо большая концентрация VEGF в кондиционированной среде ММСК, ко-инкубированных с ГАКГ, по сравнению с контролем. Такой эффект дает основания полагать, что клетки экспрессировали не только эндогенный vegf, но и экзогенный, привнесенный ГАКГ, что подтвердило реализацию проникновения плазмидной ДНК in vitro и согласуется с литературными данными [18]. Для определения механизма действия ГАКГ in vivo мы использовали при его создании двухкассетные плазмидные ДНК, кодирующие, помимо VEGF, еще и GFP. Учитывая отсутствие в геноме эукариотических клеток кролика гена gfp, его экспрессия, установленная на сроке 15 сут. в регенерате в группе № 1, однозначно свидетельствовала о проникновении в клетки плазмидной ДНК с целевыми генами. Таким образом, высвобождение plVEGF-A165 из структуры материала-носителя, проникновение в клетки in vivo и экспрессия целевых генов были подтверждены результатами исследования. Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 84 Оригинальные исследования Для проверки реализации второй части механизма действия, связанной с непосредственным эффектом терапевтического белка, кодируемого генными конструкциями, нами был выполнен иммуногистохимический анализ с антителами к α-SMA – белку цитоскелета клеток, формирующих в том числе и сосудтистую стенку, начиная с уровня артериол, что позволяет использовать его для идентификации таких и более крупных сосудов. В регенерате, образовавшемся в костном дефекте через 15 сут. после имплантации ГАКГ определялось значительно большее количество сосудов, чем в случае введения носителя без генных конструкций. Данный факт подтвердил активацию ангиогенеза, по всей видимости, обусловленную действием VEGF, кодируемого plVEGF-A165 ГАКГ. При этом, динамика генной индукции ангиогенеза согласуется с литературными данными, описывающими пик синтеза мРНК VEGF через 2 сут. после трансфекции клеток плазмидными ДНК с геном vegf, а наибольший уровень продукции терапевтического белка – на 5–7 сут. [19]. Полученные данные о реализации механизма действия активного компонента ГАКГ стали основой для оптимистичных ожиданий в отношении влияния материала на репаративный остеогенез, поскольку ангиогенез является ключевым остеоиндуцирующим фактором [20]. И действительно на сроках 15 и 30 сут. объем костного регенерата при имплантации ГАКГ был статистически значимо большим, чем в контроле. Характерно, что наибольший объем костного регенерата наблюдался со стороны латерального костного опила (часть теменной кости, обращенная к височной), что, вероятно, обусловлено более интенсивным кровоснабжением данной области, а также малой шириной медиального костного фрагмента (участок шириной 3–4 мм между дефектами теменных костей). Безусловно, столь ранние сроки наблюдения не позволяют в полной мере оценить эффективность исследуемого материала в восполнении костных дефектов, тем более «критических» размеров, однако являются достаточными для определения механизма действия генных конструкций и биологического эффекта изделия в целом. Помимо указанных характеристик, нами была обнаружена еще одна особенность восстановления костной ткани при имплантации ГАКГ: уже через ЛИТЕРАТУРА: 1. Дробышев А.Ю. Клинико-экспериментальное обоснование применения биокомпозиционных материалов при костно-восстановительных операциях на челюстях. Диссертация на соиск. ст. д-ра. мед. наук. Москва: МГМСУ. 1999. 2. Дробышев А.Ю., Киселев А.А. Применение дистракционного метода у больных при дефектах и атрофии альвеолярной части нижней челюсти. Москва. 2007; 62 с. 3. Кулаков Л.А., Робустова Т.Г., Неробеев Л.И., редакторы. Хирургическая стоматология и челюстно-лицевая хирургия. Национальное руководство. Москва: «ГЭОТАР-Медиа»; 2010. 4. Deev R.V., Drobyshev A.Y., Bozo I.Y., Galetsky D.V., Korolev O.V., Philonenko E.S., Kisekev S.L., Isaev A.A. New approach for development of osteoplastic materials. Bioceramica and Cells for Reinforcement of Bone: Symposium [Riga, Latvia, october 18–20]. – Riga: Riga Stradins University, 2012. p.32. 5. Shaw R.J., Brown J.S. Osteomyocutaneous deep circumflex iliac artery perforator flap in the reconstruction of midface defect with facial skin loss: a case report. Microsurgery 2009; 29(4): 299–302. 6. Rogers G.F., Greene A.K. Autogenous bone graft: basic science and clinical implications. J Craniofac. Surg. 2012; 23(1): 323–7. 7. Chiapasco M., Colletti G., Romeo E. et al. Long-term results of mandibular reconstruction with autogenous bone grafts and oral implants after tumor resection. Clin. Oral Implants Res. 2008; 19(10): 1074–80. 15 сут. после имплантации большинство гранул введенного ГАКГ были окружены регенератом из ретикуло-фиброзной костной ткани (более выраженным на сроке 30 сут.). При использовании материала без plVEGF-A165 такого эффекта не наблюдалось. Учитывая непосредственную связь сформированного костного регенерата с гранулами ГАКГ и удаленность от границ костного дефекта, именно фрагменты материала являлись источником репаративного остеогенеза в центральной части дефекта, что служит прямым подтверждением остеоиндуктивного действия, обеспеченного plVEGF-A165. Заключение Таким образом, нами разработан первый в России прототип ГАКГ и на его примере показана выполнимость концепции локальной генной индукции репаративного процесса. plVEGF-A165 при введении на носителе в область костного дефекта сохранили биологическую активность и реализовали специфический механизм действия, проявившийся в конечном итоге в остеоиндукции. Необходимо также отметить, что исследования в области создания ген-активированных материалов не отличаются особой новизной – первые работы датируются 90-ми годами XX в. [21]. Однако наибольшие достижения в данной области, наиболее успешные результаты, а также интенсификация исследований отмечается лишь в последние 7–8 лет, что связано с развитием генных технологий в целом и все более активными попытками транслировать результаты разработок в данной области в клиническую практику [22–26]. Наше исследование выгодно отличается от всех других в рамках технологической платформы ген-активированных остеопластических материалов за счет использования в качестве активного компонента уже проработанной, зарегистрированной и разрешенной для клинического применения в составе препарата «Неоваскулген» генной конструкции – plVEGF-A165. Благодарности Авторы выражают благодарность сотрудникам Казанского (Приволжского) федерального университета А.П. Киясову, А.А. Ризванову и А.А. Гумеровой. 8. Гололобов В.Г., Дулаев А.К., Деев Р.В. и д.р. Морфофункциональная организация, реактивность и регенерация костной ткани. СПб: 2006; 47 с. 9. Данилов Р.К., редактор. Руководство по гистологии. Том. 1. СПб: «Спецлит»; 2012. 10. Deev R.V., Drobyshev A.Y., Bozo I.Y., Sviridov E.G., Tsupkina N.V., Philonenko E.S., Kiselev S.L., Isaev A.A. Current approaches of bone tissue engineering. 3rd TERMIS World Congress 2012, 5-8 September 2012, Vienna, Austria. J. Tissue Eng. Reg. Med. 2012; 6 (Suppl. 1): 292. 11. Krompecher S. Reaction of tissue differentiation to various effects in granulating bone surface, particularly in callus formation. Langenbecks Arch. Klin. Chir. Ver. Dtsch. Z. Chir. 1956; 281(5): 472–512. 12. Hsieh C.P., Chiou Y.L., Lin C.Y. Hyperbaric oxygen-stimulated proliferation and growth of osteoblasts may be mediated through the FGF-2/MEK/ERK 1/2/NF-κB and PKC/JNK pathways. Connect. Tissue Res. 2010; 51(6): 497–509. 13. Fiedler J., Leucht F., Waltenberger J. et al. VEGF-A and PlGF1 stimulate chemotactic migration of human mesenchymal progenitor cells. Biochem. Biophys. Res. Commun. 2005; 334(2): 561–8. 14. Швальб П.Г., Гавриленко А.В., Калинин Р.Е. и др. Эффективность и безопасность применения препарата «Неоваскулген» в комплексной терапии пациентов с хронической ишемией нижних Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013 Оригинальные исследования конечностей (IIb–III фаза клинических испытаний). Клеточная трансплантология и тканевая инженерия 2011; VI(3): 76–83. 15. Huang Y., Kaigler D., Rice K.G. et al. Combined angiogenic and osteogenic factor delivery enhances bone marrow stromal cell-driven bone regeneration. J. Bone Miner. Res. 2005; 20(5): 848–57. 16. Kolk A., Haczek C., Koch C. et al. A strategy to establish a gene-activated matrix on titanium using gene vectors protected in a polylactide coating. Biomaterials 2011; 32(28): 6850–9. 17. Nomikou N., Feichtinger G.A., Redl H. et al. Ultrasoundmediated gene transfer (sonoporation) in fibrin-based matrices: potential for use in tissue regeneration. J. Tissue Eng. Regen. Med. 2013; Apr17 [Epub ahead of print]. 18. Wang Y.M., Liu B., Sun L.C. et al. Construction of VEGF recombinant plasmid pcDNA/V and its expression in model rats with acute myocardial ischemia. Sheng Wu. Gong. Cheng. Xue. Bao. 2006; 22(2): 220–5 19. Samee M., Kasugai S., Kondo H. et al. Bone morphogenetic protein-2 (BMP-2) and vascular endothelial growth factor (VEGF) transfection to human periosteal cells enhances osteoblast differentiation and bone formation. J Pharmacol Sci. 2008; 108(1):18–31. 85 20. Kanczler J.M., Oreffo R.O. et al. Osteogenesis and angiogenesis: the potential for engineering bone. Eur. Cell Mater. 2008; 15: 100-14. 21. Bonadio J., Smiley E., Patil P. et al. Localized, direct plasmid gene delivery in vivo: prolonged therapy results in reproducible tissue regeneration. Nat Med. 1999; 5(7): 753–9. 22. Geiger F., Bertram H., Berger I. et al. (2005). Vascular endothelial growth factor gene-activated matrix (VEGF165-GAM) enhances osteogenesis and angiogenesis in large segmental bone defects. J Bone Miner. Res. 20(11): 2028–2035. 23. Guo T., Zeng X., Hong H. et al. (2006) Gene-activated matrices for cartilage defect reparation. Int J Artif Organs. 29(6): 612–621. 24. Heyde M., Partridge K.A., Oreffo R.O. et al. (2007) Gene therapy used for tissue engineering applications. J Pharm. Pharmacol. 59(3): 329–350. 25. Huang Y.C., Simmons C., Kaigler D. et al. (2005) Bone regeneration in a rat cranial defect with delivery of PEI-condensed plasmid DNA encoding for bone morphogenetic protein-4 (BMP-4). Gene Ther. 12(5): 418–26. 26. Ito H., Koefoed M., Tiyapatanaputi P. et al. (2005) Remodeling of cortical bone allografts mediated by adherent rAAV-RANKL and VEGF gene therapy. Nat Med. 11: 291–297. Поступила 07.06.2013 Клеточная трансплантология и тканевая инженерия Том VIII, № 3, 2013