19 живое
реклама
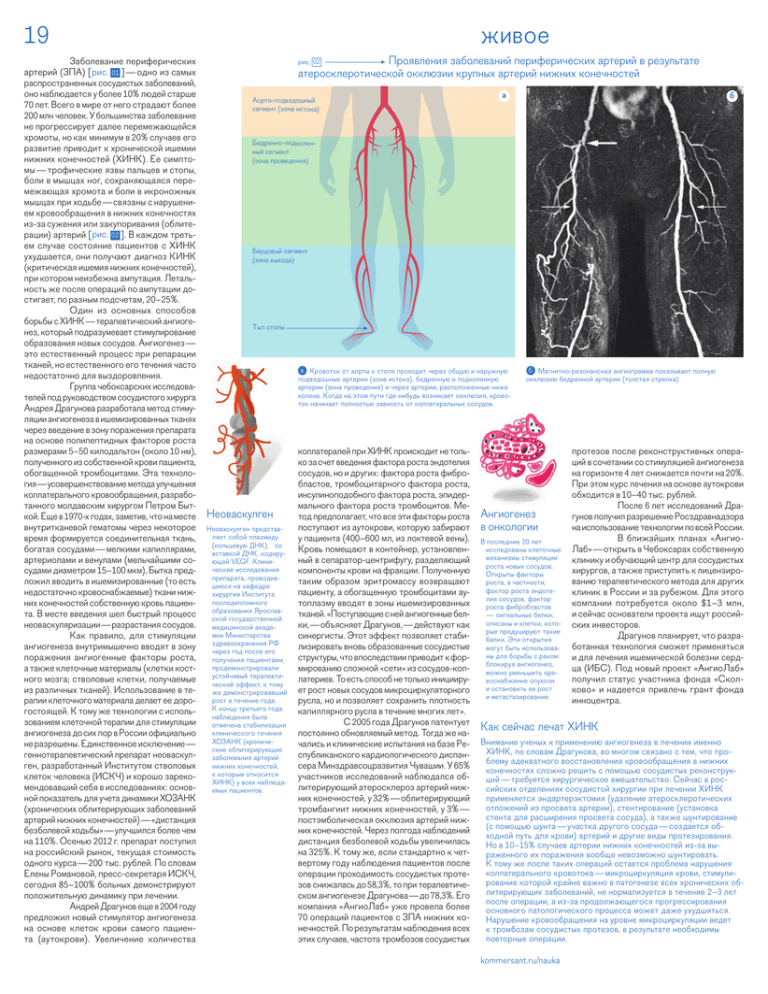
19 Заболевание периферических артерий (ЗПА) [рис. 01 ] — одно из самых распространенных сосудистых заболеваний, оно наблюдается у более 10% людей старше 70 лет. Всего в мире от него страдают более 200 млн человек. У большинства заболевание не прогрессирует далее перемежающейся хромоты, но как минимум в 20% случаев его развитие приводит к хронической ишемии нижних конечностей (ХИНК). Ее симпто‑ мы — трофические язвы пальцев и стопы, боли в мышцах ног, сохраняющаяся пере‑ межающая хромота и боли в икроножных мышцах при ходьбе — связаны с нарушени‑ ем кровообращения в нижних конечностях из‑за сужения или закупоривания (облите‑ рации) артерий [рис. 02 ]. В каждом треть‑ ем случае состояние пациентов с ХИНК ухудшается, они получают диагноз КИНК (критическая ишемия нижних конечностей), при котором неизбежна ампутация. Леталь‑ ность же после операций по ампутации до‑ стигает, по разным подсчетам, 20–25%. Один из основных способов борьбы с ХИНК — терапевтический ангиоге‑ нез, который подразумевает стимулирование образования новых сосудов. Ангиогенез — это естественный процесс при репарации тканей, но естественного его течения часто недостаточно для выздоровления. Группа чебоксарских исследова‑ телей под руководством сосудистого хирурга Андрея Драгунова разработала метод стиму‑ ляции ангиогенеза в ишемизированных тканях через введение в зону поражения препарата на основе полипептидных факторов роста размерами 5–50 килодальтон (около 10 нм), полученного из собственной крови пациента, обогащенной тромбоцитами. Эта техноло‑ гия — усовершенствование метода улучшения коллатерального кровообращения, разрабо‑ танного молдавским хирургом Петром Быт‑ кой. Еще в 1970‑х годах, заметив, что на месте внутритканевой гематомы через некоторое время формируется соединительная ткань, богатая сосудами — мелкими капиллярами, артериолами и венулами (мельчайшими со‑ судами диаметром 15–100 мкм), Бытка пред‑ ложил вводить в ишемизированные (то есть недостаточно кровоснабжаемые) ткани ниж‑ них конечностей собственную кровь пациен‑ та. В месте введения шел быстрый процесс неоваскуляризации — разрастания сосудов. Как правило, для стимуляции ангиогенеза внутримышечно вводят в зону поражения ангиогенные факторы роста, а также клеточные материалы (клетки кост‑ ного мозга; стволовые клетки, получаемые из различных тканей). Использование в те‑ рапии клеточного материала делает ее доро‑ гостоящей. К тому же технологии с исполь‑ зованием клеточной терапии для стимуляции ангиогенеза до сих пор в России официально не разрешены. Единственное исключение — геннотерапевтический препарат неоваскул‑ ген, разработанный Институтом стволовых клеток человека (ИСКЧ) и хорошо зареко‑ мендовавший себя в исследованиях: основ‑ ной показатель для учета динамики ХОЗАНК (хронических облитерирующих заболеваний артерий нижних конечностей) — «дистанция безболевой ходьбы» — улучшился более чем на 110%. Осенью 2012 г. препарат поступил на российский рынок, текущая стоимость одного курса — 200 тыс. рублей. По словам Елены Романовой, пресс-секретаря ИСКЧ, сегодня 85–100% больных демонстрируют положительную динамику при лечении. Андрей Драгунов еще в 2004 году предложил новый стимулятор ангиогенеза на основе клеток крови самого пациен‑ та (аутокрови). Увеличение количества живое рис. 02 Проявления заболеваний периферических артерий в результате атеросклеротической окклюзии крупных артерий нижних конечностей Аорто-подвздошный сегмент (зона истока) а б Бедренно-подколенный сегмент (зона проведения) Берцовый сегмент (зона выхода) Тыл стопы а Кровоток от аорты к стопе проходит через общую и наружную подвздошные артерии (зона истока), бедренную и подколенную артерии (зона проведения) и через артерии, расположенные ниже колена. Когда на этом пути где-нибудь возникает окклюзия, крово‑ ток начинает полностью зависеть от коллатеральных сосудов. Неоваскулген Неоваскулген представ‑ ляет собой плазмиду (кольцевую ДНК), со вставкой ДНК, кодиру‑ ющей VEGF. Клини‑ ческие исследования препарата, проводив‑ шиеся на кафедре хирургии Института последипломного образования Ярослав‑ ской государственной медицинской акаде‑ мии Министерства здравоохранения РФ через год после его получения пациентами, продемонстрировали устойчивый терапевти‑ ческий эффект, к тому же демонстрировавший рост в течение года. К концу третьего года наблюдения была отмечена стабилизация клинического течения ХОЗАНК (хрониче‑ ские облитерирующие заболевания артерий нижних конечностей, к которым относится ХИНК) у всех наблюда‑ емых пациентов. коллатералей при ХИНК происходит не толь‑ ко за счет введения фактора роста эндотелия сосудов, но и других: фактора роста фибро‑ бластов, тромбоцитарного фактора роста, инсулиноподобного фактора роста, эпидер‑ мального фактора роста тромбоцитов. Ме‑ тод предполагает, что все эти факторы роста поступают из аутокрови, которую забирают у пациента (400–600 мл, из локтевой вены). Кровь помещают в контейнер, установлен‑ ный в сепаратор-центрифугу, разделяющий компоненты крови на фракции. Полученную таким образом эритромассу возвращают пациенту, а обогащенную тромбоцитами ау‑ топлазму вводят в зоны ишемизированных тканей. «Поступающие с ней ангиогенные бел‑ ки, — объясняет Драгунов, — действуют как синергисты. Этот эффект позволяет стаби‑ лизировать вновь образованные сосудистые структуры, что впоследствии приводит к фор‑ мированию сложной «сети» из сосудов-кол‑ латериев. То есть способ не только иницииру‑ ет рост новых сосудов микроциркуляторного русла, но и позволяет сохранить плотность капиллярного русла в течение многих лет». С 2005 года Драгунов патентует постоянно обновляемый метод. Тогда же на‑ чались и клинические испытания на базе Ре‑ спубликанского кардиологического диспан‑ сера Минздравсоцразвития Чувашии. У 65% участников исследований наблюдался об‑ литерирующий атеросклероз артерий ниж‑ них конечностей, у 32% — облитерирующий тромбангиит нижних конечностей, у 3% — постэмболическая окклюзия артерий ниж‑ них конечностей. Через полгода наблюдений дистанция безболевой ходьбы увеличилась на 325%. К тому же, если стандартно к чет‑ вертому году наблюдения пациентов после операции проходимость сосудистых проте‑ зов снижалась до 58,3%, то при терапевтиче‑ ском ангиогенезе Драгунова — до 78,3%. Его компания «АнгиоЛаб» уже провела более 70 операций пациентов с ЗПА нижних ко‑ нечностей. По результатам наблюдения всех этих случаев, частота тромбозов сосудистых б Магнитно-резонансная ангиограмма показывает полную окклюзию бедренной артерии (толстая стрелка) Ангиогенез в онкологии В последние 20 лет исследованы клеточные механизмы стимуляции роста новых сосудов. Открыты факторы роста, в частности, фактор роста эндоте‑ лия сосудов, фактор роста фибробластов — сигнальные белки; описаны и клетки, кото‑ рые продуцируют такие белки. Эти открытия могут быть использова‑ ны для борьбы с раком: блокируя ангиогенез, можно уменьшить кро‑ воснабжение опухоли и остановить ее рост и метастазирование. протезов после реконструктивных опера‑ ций в сочетании со стимуляцией ангиогенеза на горизонте 4 лет снижается почти на 20%. При этом курс лечения на основе аутокрови обходится в 10–40 тыс. рублей. После 6 лет исследований Дра‑ гунов получил разрешение Росздравнадзора на использование технологии по всей России. В ближайших планах «Ангио‑ Лаб» — открыть в Чебоксарах собственную клинику и обучающий центр для сосудистых хирургов, а также приступить к лицензиро‑ ванию терапевтического метода для других клиник в России и за рубежом. Для этого компании потребуется около $1–3 млн, и сейчас основатели проекта ищут россий‑ ских инвесторов. Драгунов планирует, что разра‑ ботанная технология сможет применяться и для лечения ишемической болезни серд‑ ца (ИБС). Под новый проект «АнгиоЛаб» получил статус участника фонда «Скол‑ ково» и надеется привлечь грант фонда инноцентра. Как сейчас лечат ХИНК Внимание ученых к применению ангиогенеза в лечении именно ХИНК, по словам Драгунова, во многом связано с тем, что про‑ блему адекватного восстановления кровообращения в нижних конечностях сложно решить с помощью сосудистых реконструк‑ ций — требуется хирургическое вмешательство. Сейчас в рос‑ сийских отделениях сосудистой хирургии при лечении ХИНК применяется эндартерэктомия (удаление атеросклеротических отложений из просвета артерии), стентирование (установка стента для расширения просвета сосуда), а также шунтирование (с помощью шунта — участка другого сосуда — создается об‑ ходной путь для крови) артерий и другие виды протезирования. Но в 10–15% случаев артерии нижних конечностей из‑за вы‑ раженного их поражения вообще невозможно шунтировать. К тому же после таких операций остается проблема нарушения коллатерального кровотока — микроциркуляция крови, стимули‑ рование которой крайне важно в патогенезе всех хронических об‑ литерирующих заболеваний, не нормализуется в течение 2–3 лет после операции, а из‑за продолжающегося прогрессирования основного патологического процесса может даже ухудшиться. Нарушение кровообращения на уровне микроциркуляции ведет к тромбозам сосудистых протезов, в результате необходимы повторные операции. kommersant.ru/nauka