1.Химические свойства галогензамещенных углеводородов
advertisement
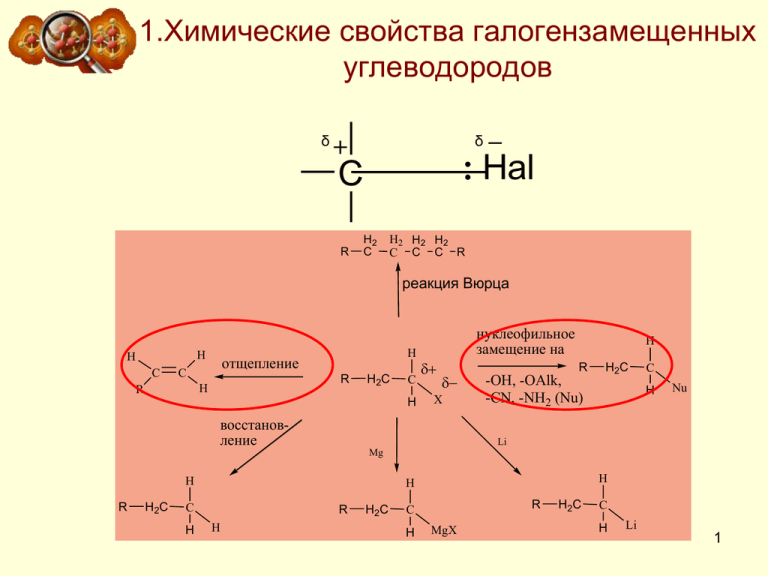
1.Химические свойства галогензамещенных углеводородов δ δ Hal C R H2 C H2 H2 H2 C C C R реакция Вюрца H H C отщепление C R H R H H2C C H нуклеофильное замещение на X восстановление H R -OH, -OAlk, -CN, -NH2 (Nu) H2C C H Nu Li Mg H R H2C C H H H R H H2 C R C H MgX H2 C C H Li 1 Использование алкилгалогенидов в органической химии RCH2Li металлорг. соединения RCH2MgHal реактив Гриньяра RCH2SH тиолы RCH2NH2 амины RCH2NO2 нитросоединения Li NaOH Mg R1ONa RSH NH3 NaNO2 RCH2Hal R1COONa NaCN C6H6 AlCl3 RCH2OH спирты RCH2OR1 простые эфиры RCH2COOR1 сложные эфиры RCH2CN нитрилы C6H6CH2R алкиларены 2 2.Реакция нуклеофильного замещения в ряду алкилгалогенидов Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента Нуклеофильные («любящие ядро») реагенты – это К.Ингольд (1893 -1970 гг.) частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне. . Галоген, который вытесняется (замещается), называется уходящей группой Строение некоторых нуклеофильных реагентов 3 Общая схема нуклеофильного замещения H C H H H + Nu- X субстрат H нуклеофил + X- C H Nu уходящая группа Пример нуклеофильного замещения Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]). 4 Механизм нуклеофильного замещения SN1 SN2 5 Мономолекулярное нуклеофильное замещение (SN1) Реакция характерна для третичных и вторичных алкилгалогенидов. SN1 - реакция является несогласованным процессом и состоит из двух отдельных стадий Схема протекания процесса: Медленно 6 Стадии процесса Первая стадия – медленная CH3 H3C C : Br CH3 ≠ CH3 H3C C Br CH3 Первое переходное состояние CH3 + H3C C CH3 Br Третичный карбкатион Вторая стадия – быстрая CH 3 CH 3 C CH 3 OH 2 Быстро CH 3 CH 3 C CH 3 ≠ OH 2 CH 3 CH 3 C OH + H CH 3 Второе переходное состояние Разрыв связи С-Х и образование новой связи С-Nu протекают последовательно 7 Энергетическая диаграмма реакции SN1 Е Е пот. ≠ (CH 3)3C + Br H 2O ≠ (2) Еа (1) Еа (CH 3)3CBr (CH 3)3COH 2 1 стадия медленная 2 стадия быстрая Координата реакции Скорость реакции. В медленной стадии, определяющей скорость реакции, принимает участие только одна молекула, поэтому механизм называют мономолекулярным замещением. Скорость реакции V зависит только от концентрации галогеналкана: V = K[R-Hal]. 8 Перегруппировка Hal медленно H3C CH CH3 CH -BrCH3 H C H3C CH CH3 CH3 H2 H перегруппировка H3C C C CH3 H3C C C CH3 1,2-сдвиг гидрид-иона H3C H CH3 OHH OH H3C C C CH3 H CH3 OHOH H 2 H3C C C CH3 CH3 Перегруппировка считается признаком SN1-механизма. 9 Растворитель Протекание реакции замещения по механизму SN1 способствуют протонные растворители с высокой диэлектрической проницаемостью, способные образовывать водородные связи H O H = 80 HC O C 2H 5 O H O H = 56 = 25 CH 3 C O O H = 6 Н2О 2) несольватированный карбокатион 1) Сольватированный карбокатион Стабильность карбокатиона 1) > 2) 10 Стереохимия В карбокатионе, образующемся в медленной стадии, связи sp2 гибридизованного атома углерода расположены в одной плоскости. Если SN1замещение протекает у хирального атома углерода, то образуется смесь двух оптических изомеров (рацемическая смесь) CH3 Br CH3 H C2H5 D(+)-2-Бромбутан Молекула хиральна BrH C2H5 Карбкатион плоский Ахирален 11 Реакционная способность Главным фактором, определяющим реакционную способность в SN1-реакции, является электронный фактор - устойчивость образующегося в медленной стадии реакции карбокатиона. Чем устойчивее карбокатион, тем легче он образуется, тем быстрее протекает замещение. CH 3 X < R CH 1 Алкилгалогениды R3 2 X < R 1 CH X < R 1 C X , C = C R2 R2 C X C X, увеличение реакционной способности в SN1-реакции Соответствующие карбокатионы R3 CH 3 < R 1CH 2 < R 1CH < R 1C R2 , C=C C , C R2 Устойчивость соответствующих карбокатионов увеличивается Реакционная способность увеличивается Увеличение стабильности карбокатиона . 12 Бимолекулярное нуклеофильное замещение (SN2) Типичный механизм взаимодействия метилгалогенидов и первичных алкилгалогенидов с Nu бимолекулярное нуклеофильное замещение SN2. Схема протекания процесса: медленно D-конфигурация алкилгалогенида L-конфигурация продукта 13 Стадии процесса H H HO Br H H HO H Br H H Br HO H H H HO Е Е пот. б H Br H V = K [R-Hal] [Nu] а HO + CH 3 Br в CH 3 OH + Br Координата реакции Диаграмма изменения потенциальной энергии в реакции бимолекулярного нуклеофильного замещения, SN2 - процесс согласованный одностадийный: а - энергия исходных веществ, б - энергия переходного состояния, в - энергия продуктов реакции. 14 Уходящие группы Сильные основания являются «плохими» уходящими группами, слабые основания - «хорошими» уходящими группами Ряд уменьшения способности частицы быть уходящей группой: C H S O ( C H ) S , C H S O I B r H O > > > > C l > F > 3 3 3 2 3 3 2 I, Br , Cl , F. сила основания увеличивается, способность быть хорошей уходящей группой уменьшается 15 Сила нуклеофила Нуклеофил - частица, имеющая пару электронов, которую она может отдать атому углерода, несущему целый или частичный положительный заряд. Чем сильнее атом удерживает пару электронов, тем меньше его способность выступать в качестве нуклеофила Активность (нуклеофильность) аниона в реакции SN2 выше, чем активность нейтральной молекулы. HO RO R1 R2 > > HO > NH >R H 3C O NH 2 > > > H 2N > H 2S HS H 2O , CH 3C O O NH 2 > HO > HC > RC >F , O O NH 2 O H 2N >O N O > H 3N Чем больше распределен заряд тем слабее нуклеофил Заряд ядра больше нуклеофил слабее 16 Реакционная способность стерический фактор R1 H Nu X H Nu H АК образуется легко R3 X R2 АК недостижим СН3–Х > RСН2–Х > R1R2СН–Х > R1R2R3С–Х реакционная способность в SN2-реакциях уменьшается 17 Влияние различных факторов на реакции нуклеофильного замещения у насыщенного атома углероды Факторы (SN1) (SN2) Строение субстрата Реакционная способность падает в ряду: третичный > вторичный > первичный Реакционная способность растет в ряду: третичный < вторичный < первичный Сила нуклеофила Практически нет влияния Чем больше нуклеофильность, тем вероятнее протекание реакции Уходящая группа Чем ниже энергия связи, тем легче протекает реакция Скорость падает с увеличением Стерические факторы Увеличение числа алкильных заместителей и электронодонорных групп у нуклеофильного центра ускоряет реакции. Препятствуют атаке нуклеофильного центра и затрудняют реакцию Влияние растворителя Реакции способствуют протонные полярные растворители Влияние растворителя сказывается значительно меньше, но реакцию затрудняют растворители, сольватирующие нуклеофил. Концентрация нуклеофила На скорость реакции не влияет Скорость реакции пропорциональна концентрации нуклеофила нуклеофильности (основности) уходящей группы 18 3. Элиминирование β α В ходе реакции элиминирования от молекулы галогеналкана отщепляются два фрагмента: ион галогена (уходящая группа) от С и протон - от соседнего атома углерода С. Такой тип реакций называется -элиминированием β-Элиминирование может протекать по механизму Е2 и Е1. 19 Механизм реакции Е1 Первая стадия Hal H C Вторая стадия + C C H H C медленно C+ C :B + Hal- _ C C + HB Конкурирующий механизм SN1 полярный растворитель Механизм Е1 и SN1 являются конкурирующими. Направления по желаемому механизму варьируется полярностью растворителя. Увеличение полярности 20 способствует SN1 маршруту Механизм реакции Е2 δ δ δ ≠ энергия δ H C 2H 5O H C H H C B r C H 3 v = k [(CH3)2CHBr][C2H5O-] _ C H C HC H + C H O 3 3 2 5 B r _ C H C H C H + C H O H + B r 2 3 2 5 координатареакции 21 Правило реакции элиминирования Реакция элиминирования подчиняется правилу Зайцева: преимущественно образуются интернальные алкены. Причина - большая термодинамическая стабильность последних _ C H O 2 5 C H C H C H C H 3 2 3 B r C H C H C H C H C H C H C H C H + + H B r 3 3 2 2 3 2 б у т е н 8 1 %1 б у т е н 1 9 % 22