На правах рукописи Бочкарева Светлана Сергеевна ВЛИЯНИЕ
реклама

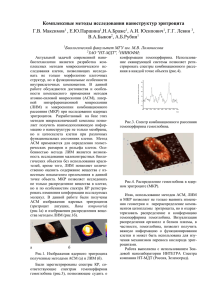
На правах рукописи Бочкарева Светлана Сергеевна ВЛИЯНИЕ АТФ И ИНСУЛИНОПОДОБНОГО ФАКТОРА РОСТА 1 НА КИСЛОРОДТРАНСПОРТНУЮ ФУНКЦИЮ ЭРИТРОЦИТА 03.01.02 – «биофизика» Автореферат диссертации на соискание ученой степени кандидата биологических наук Москва 2016 Работа выполнена на кафедре биофизики биологического факультета Федерального государственного бюджетного образовательного учреждения высшего образования «Московский государственный университет имени М.В.Ломоносова» Научный руководитель: Максимов Георгий Владимирович, доктор биологических наук, профессор кафедры биофизики биологического факультета МГУ имени М.В.Ломоносова Официальные оппоненты: Сурин Александр Михайлович доктор биологических наук, главный научный сотрудник лаборатории фундаментальных и прикладных проблем боли в Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт общей патологии и патофизиологии», г.Москва Артюхов Валерий Григорьевич доктор биологических наук, профессор, заслуженный деятель науки РФ, декан биолого-почвенного факультета, заведующий кафедрой биофизики и биотехнологии в Федеральном государственном бюджетном образовательном учреждении высшего образования "Воронежский государственный университет", г.Воронеж Ведущая организация: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Мордовский государственный университет им. Н.П.Огарѐва", г. Саранск Защита диссертации состоится «16» июня 2016 года в 16:00 часов на заседании диссертационного совета Д 501.001.96 биологического факультета Московского государственного университета имени М.В.Ломоносова по адресу: 119234, Москва, Ленинские горы, д.1, стр. 24, МГУ, биологический факультет, кафедра биофизики, аудитория «Новая». С диссертацией можно ознакомиться в научной библиотеке Московского государственного университета имени М.В. Ломоносова и на сайте http://istina.msu.ru/media/dissertations/dissertation/063/4ee/19433485/Bochkareva_disser.pdf Автореферат разослан «28» апреля 2016 года. Ученый секретарь диссертационного совета, доктор биологических наук М.Г. Страховская 2 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность исследования. Исследование молекулярных механизмов переноса кислорода гемоглобином эритроцита является актуальной задачей биофизики, физиологии и медицины (Осипов А.Н., 2007, Yachie-Kinoshita A., 2014, Kelm М.,2014). Известно, что нарушение кислородного гомеостаза организма и развитие тканевой гипоксии наблюдаются при изменении содержания в кровеносном русле факторов роста (ИФР-1) и пуринергических соединений (АТФ) (Janssen J.A., 2000, Seminario-Vidal L., 2009, González-Alonso J., 2012, Sluyter R., 2013, Панкратова М.С., 2014, Faassen М., 2014). Специфические рецепторы к данным лигандам (АТФ и ИФР-1) присутствуют как в гладкомышечных клетках кровеносных сосудов (Соуэрс Дж., 1999, Шушанов С., 2012), так и на поверхности различных клеток крови, в частности, эритроцитов (Рис.1). Активация пуринергических Р2Х7-рецепторов эритроцита сопровождается деполяризацией мембраны за счет входа ионизированного кальция через ионную пору канала (Seminario-Vidal et al., 2009, Wang B., 2013, Langsley G., 2014). При продолжительной активации рецепторов наблюдается экстернализация фосфатидилсерина на внешней поверхности плазматической мембраны эритроцита, образование активных форм кислорода (АФК) и апоптоз (Lang K.S., 2003, Foller M., 2008, Solá E., 2009). Другой рецептор, связывающий ИФР-1, обладает тирозинкиназной активностью и, за счет фосфорилирования белков, активирует киназы и фосфолипазы клетки, а также Na+/H+-обмен, меняет состояние белков цитоскелета и механические свойства плазматической мембраны (Catanese V.M., 1986, Bengtsson B.A, 1999, Kiess W., 2005, Saukkonen T., 2006, De Rosa M.K., 2008, Drexler A., 2013). Следовательно, активация этих двух различных типов рецепторов на мембране эритроцита может сопровождаться не только изменениями их активности, но и морфологии клетки, ионного состава цитоплазмы и состояния белков цитоскелета. С другой стороны, изменение сродства гемоглобина к кислороду при выполнении кислородтранспортной функции эритроцита зависит от конформации гемопорфирина молекул гемоглобина (Максимов Г.В., 2015, Лунева О.Г., 2007), их локализации в цитоплазме и, в частности, способности образовывать комплексы (Муравлева Л.Е., 2013, Чеснокова Н.П., 2015, Браже Н.А., 2015). Все это, в комплексе, контролирует и диффузию молекул газов (кислород О2, оксид азота NO) через плазматическую мембрану эритроцита, и гемодинамику эритроцитов в сосудах. Известно, что связывание рецепторами эритроцита молекул АТФ и ИФР-1 зависит от межклеточных взаимодействий и функциональной активности других клеток крови. Так, на поверхности мембраны макрофагов, тромбоцитов, лимфоцитов тоже присутствуют 3 пуринергические и тирозинкиназные рецепторы, активация которых стимулирует выброс в плазму ряда медиаторов (NO). Это косвенно может отразиться на реализации кислородтранспортной функции эритроцитов и их гемодинамики. Кроме того, в крови АТФ и ИФР-1 связываются специфическими белками плазмы, что меняет их концентрацию и модифицирует активность (Saukkonen T., 2006, Казакова Р.Р., 2011). Рис. 1 Схема взаимодействия молекул АТФ и ИФР-1 с клетками и компонентами плазмы в крови При патологии (ишемия, гипертония, атеросклероз) в организме наблюдается кислородное голодание, а в эритроцитах человека выявлен ряд характерных изменений морфологии, вязкости (упорядоченность «хвостов» жирных кислот липидов) мембраны, активности ионных каналов и АТФаз, а также свойств гемоглобина (Venkatesh B.,1999, Pinzaru S.C., 2001; Максимов Г.В., 2005, Wood R., 2006; Юсипович А.И., 2012, Паршина Е.Ю., 2013). В связи с этим, в настоящей работе исследовали динамику изменения компонентов кислородтранспортной функции изолированных эритроцитов и эритроцитов в крови в присутствии пуринергических лигандов и факторов роста, в частности, морфологию эритроцитов, УЖК липидов мембраны и амплитуду рельефа поверхности, содержание внутриклеточного Са2+, а также конформацию гемопорфирина гемоглобина и плотность его распределения в клетке. Цель и задачи работы. Цель работы заключалась в исследовании влияния пуринергических соединений и факторов роста на кислородтранспортную функцию эритроцита. 4 В связи с поставленной целью были сформулированы следующие задачи: 1. Исследовать вклад изменений конформации гемопорфирина гемоглобина в реализацию кислородтранспортной функции изолированного эритроцита и эритроцита в крови при действии АТФ и ИФР-1; 2. Исследовать изменения морфологии и плотности упаковки молекул гемоглобина в цитоплазме клетки при действии АТФ и ИФР-1 в суспензии эритроцитов и крови; 3. Исследовать изменение содержания внутриклеточного кальция в присутствии АТФ и ИФР-1, а также изменения свойств гемоглобина, вязкости мембраны, цитоскелета и морфологии изолированного эритроцита при активации входа ионов кальция под действием ионофора А23187; 4. Исследовать изменения упорядоченности «хвостов» жирных кислот липидов мембраны и рельефа поверхности клеток в присутствии АТФ и ИФР-1 в суспензии эритроцитов и крови; 5. Исследовать изменения молекулярно-клеточных параметров эритроцита в крови доноров до и после терапии патологий роста. Научная новизна. В работе впервые выявлены основные стадии действия АТФ и ИФР-1 на молекулярно-клеточные параметры эритроцита в суспензии клеток и крови. Установлено, что в присутствии АТФ и ИФР-1, активирующих специфические рецепторы на поверхности эритроцита, изменяется конформация гемопорфирина, что приводит как к увеличению доли комплексов гемоглобина с NO, так и плотности упаковки молекул гемоглобина в цитоплазме, что важно для гемодинамики, прохождении эритроцита через узкие капилляры и реализации его кислородтранспортной функции. Также, выявлены изменения формы, структуры цитоскелета и вязкости мембраны эритроцитов при инкубации клеток с АТФ и ИФР-1. Впервые, с помощью метода КР-спектроскопии показано, что изменения конформации гемопорфирина молекул гемоглобина эритроцита зависят от присутствия в инкубационной среде клеток крови и плазмы. Для эритроцитов в крови с АТФ и ИФР-1 выявлено как перераспределение молекул гемоглобина в цитоплазме клетки, так и увеличение числа комплексов молекулы гемоглобина с оксидом азота. Показана возможность влияния на кислородтранспортную функцию эритроцитов белков плазмы, связывающих АТФ и ИФР-1, а также медиаторов (NO), высвобождаемых другими клетками крови в ответ на активацию пуринергических и тирозинкиназных рецепторов. 5 Научно-практическая значимость. Полученные оригинальные результаты имеют важное научно-практическое значение для понимания роли рецепторов, локализованных на поверхности эритроцита, в регуляции транспорта молекул газов и поддержании тонуса сосудов. В работе представлены доказательства изменения кислородтранспортной функции эритроцитов, не только в связи с конформационными перестройками гемопорфирина гемоглобина или модификацией распределения молекул гемоглобина в цитоплазме клетки, но и вязкостью мембраны, структурой цитоскелета и входом Са2+ как в изолированных эритроцитах, так и в эритроцитах в крови в присутствии АТФ и ИФР-1. Анализ результатов позволил выявить характерные особенности изменения кислородтранспортной функции и морфологии эритроцитов до и после терапии патологий роста. Полученные данные могут использоваться в разработке методологии диагностики и скрининга новых фармакологических препаратов для лечения соматотропной (СТГ) недостаточности, синдрома Шерешевского-Тернера, акромегалии. Апробация работы. Апробация работы проведена на заседаниях кафедры биофизики биологического факультета Московского Государственного Университета имени М.В. Ломоносова. Основные результаты диссертационной работы были изложены на Международном молодежном научном форуме «ЛОМОНОСОВ-2012» (Москва, 2012), «ЛОМОНОСОВ-2014» (Москва, 2014); 9th Joint Meeting of Paediatric Endocrinology (Милан, 2013); Всероссийской научной конференции с международным участием «Перспективы развития химических и биологических технологий в 21-м веке» (Саранск, 2015). Публикации. По теме диссертации опубликовано 16 печатных работ, включая 10 статей из списка ВАК. Структура и объем диссертации. Диссертация состоит из введения, трех глав, заключения и выводов. Список литературы содержит 271 источников. Работа изложена на 172 стр. 6 СОДЕРЖАНИЕ РАБОТЫ В первой главе представлен обзор литературы, содержащий данные о реализации кислородтранспортной функции эритроцита как за счет изменений морфологии клетки, так и способности гемоглобина связывать лиганды в результате изменения конформации гемопорфирина и четвертичной структуры молекулы гемоглобина. Представлен анализ состояния современных экспериментальных исследований роли пуринергических соединений и факторов роста в обеспечении тканей кислородом и функционировании отдельного эритроцита. Дается характеристика строения и механизм активации пуринергических и ИФР-1-рецепторов, локализованных на поверхности эритроцита. Анализируются каскады внутриклеточных реакций, влияющие на свойства мембраны, цитоскелета и цитоплазмы эритроцита. В связи с исследованием функционирования рецепторов эритроцита в крови анализируются данные о роли белков плазмы в модификации действия АТФ и ИФР-1, а также о роли клеток крови, на поверхности которых существуют аналогичные рецепторы, в изменении кислородтранспортной функции эритроцита. Вторая глава содержит описание объекта и структуры исследования. В ней перечислены использованные в работе реактивы, описаны составы буферных сред, приведены протоколы приготовления препаратов и основные принципы методов исследования. Объект исследования Исследование проводили на эритроцитах венозной крови здоровых доноров и пациентов с СТГ-недостаточностью. Суспензию эритроцитов получали методом центрифугирования в изотоническом буфере для выделения клеток (мМ: 145 NaCl, 5 KCl, 1 CaCl2, 1 MgSO4, 4 Na2HPO4∙12 H2O, 1 NaH2PO4∙2 H2O, 10 C6H12O6, рН=7,4). Методы исследования Спектроскопия комбинационного рассеяния (КР) Исследование конформации гемопорфирина гемоглобина эритроцитов в суспензии и крови проводили с помощью метода спектроскопии комбинационного рассеяния (КР) (Parthasarathi N., 1987, Wood B., 2002, Torres Filho I.P., 2008, Браже Н.А., 2009, Максимов Г.В., 2015). Спектры регистрировали на спектрометре (каждые 5 минут в течение получаса) при λех=473 нм, W~20 мВт. Результаты обрабатывались стандартными статистическими 7 методами в программе Statistica 8.0 (Statistica software): вычисляли среднее арифметическое значение (M) и стандартную ошибку среднего (se). Используя t-критерий Стьюдента (p<0.05), оценивали достоверность полученных экспериментальных данных относительно контроля. Непараметрический критерий Вилкоксона (p<0.05) применяли для оценки значимости различий двух связанных выборок. Лазерная интерференционная микроскопия Методом лазерной интерференционной микроскопии исследовали изменение показателя преломления цитоплазмы эритроцита и геометрических размеров клетки. Исследование проводили на лазерном интерференционном микроскопе, разработанном во ВНИИОФИ на базе микроинтерферометра Линника МИИ-4 (ЛОМО, Россия) с объективом 30х (NA=0,65). Размер регистрируемого кадра составлял 195 * 145 мкм. Источником излучения являлся полупроводниковый лазер с λех = 650 нм и W = 5 мВт (W на объекте < 2 мВт). Для получения изображений использовали ПЗС видеокамеру VS-415U (NPK Videoscan, Russia), с размером матрицы 650*483 мкм, разрешением 782*582 точек. Фазовое изображение регистрировали в течение 10 секунд. Для восстановления фазового изображения по 9 интерферограммам использовали программу WinPhast, для последующей работы с изображениями – программы FIJI (США) и Microcal Origin (MicrocalInc., США). Реконструкцию фазового изображения из интерференционной картины осуществляли с помощью метода фазовых шагов. По полученному фазовому изображению вычисляли площадь, оптическую разность хода (ОРХ), плотность упаковки гемоглобина эритроцитов (Rappaz B., 2005, Юсипович А.И., 2008, Tychinsky V.P.,2010). Атомно-силовая микроскопия Амплитуду рельефа поверхности эритроцита, обусловленную структурами цитоскелета и мембранными белками, регистрировали с помощью метода атомно-силовой микроскопии (АСМ). Исследование проводили на атомно-силовом микроскопе, входящем в состав NTEGRA SPECTRA (NT-MDT, Россия). Сканирование осуществляли в области 1х1 мкм (256 x 256 точек) с частотой 0.5-1 Гц, используя кантилеверы NSG 10-A с жесткостью 11.8 Н/м и радиусом кривизны 10 нм. Изображения регистрировали при помощи программного обеспечения Nova и ImageAnalysis (NT-MDT, Russia). Для характеристики амплитуды рельефа поверхности эритроцитов использовали интегральный параметр шероховатости (S), показывающий отклонение рельефа поверхности от среднего значения. 8 Вклад структур цитоскелета различного размера (S2>150нм>S1) оценивали с применением Фурье-фильтрации и преобразованием пространственного спектра поверхности эритроцита (Паршина Е.Ю., 2011, Белоусова О.Д., 2012). Метод спиновых меток В работе использовали метод спиновых меток, или электронного парамагнитного резонанса (ЭПР), который позволяет исследовать изменение вязкости или упорядоченности жирнокислотных «хвостов» (УЖК) липидов мембраны эритроцита. Работу проводили на ЭПР-спектрометре РЭ 1307 (Россия). В качестве зонда использовали 16-доксилстеариновую кислоту (16-ДС), локализованную в гидрофобной области (~2,2 нм.) мембраны. Для оценки изменений УЖК липидов рассчитывали время корреляции вращения молекулы нитроксильного радикала зонда относительно жирнокислотной цепи липидов мембраны эритроцита (Grigoriev A.I., 2004, Luneva O.G., 2005). Флуоресцентные методы Динамику изменения содержания внутриклеточного ионизированного кальция в эритроците исследовали с помощью зонда Fura 2-AM на спектрофлуориметре Hitachi 850 (Hitachi, Япония). Регистрировали спектры флуоресценции внутриклеточного комплекса «Fura 2 + Ca2+» (λex = 335 нм) и свободного Fura 2 (λex = 362 нм, λem = 480 нм), оценивали соотношение интенсивностей спектров пропорциональное содержанию внутриклеточного Са2+. С помощью спектрофлуориметра фирмы Horiba Fluoromax 4 (Франция) и комплекса на основе системы однофотонного счета SimpleTau 140 (Becker&Hickl, Германия) получали мгновенные спектры флуоресценции и определяли число фотонов, а также время жизни флуоресценции комплекса «Fura2 + Ca2+» (Roe M.W., 1990, So P., 2002, Максимов Е.Г., 2012). Длительность импульса составляла 25 пс, частота следования импульсов – 50 МГц, энергия одиночного импульса – 13 пДж (ИОС, Россия). Накопление сигнала проводили в течение 10 с. Для оценки жизнеспособности эритроцитов исследовали изменение их морфологической формы по классификации М. Bessis (1973) визуально на микроскопе «Carl Zeiss Axioplan 2» (Carl Zeiss Group, Германия). 9 В третьей главе приведены результаты и обсуждение исследования. Установлено, что при действии АТФ и ИФР-1 на рецепторы изолированных эритроцитов и эритроцитов в крови меняется кислородтранспортная функция клеток. Выявленный эффект сопровождается комплексом изменений молекулярно-клеточных параметров эритроцита. 1. Исследование роли АТФ в регуляции кислородтранспортной функции эритроцита 1.1 Исследование роли рецепции АТФ в регуляции кислородтранспортной функции изолированного эритроцита В данной серии экспериментов исследовали динамику изменения вязкости мембраны, структуры цитоскелета и свойств гемоглобина изолированных эритроцитов при активации пуринергических рецепторов. Для активации Р2Х7-рецепторов использовали полумаксимальную концентрацию АТФ (100 мкМ) (Friederichs E., 1992, Oonishi T, 1997, Sluyter R, 2004, Bartlett R., 2014). С помощью КР-спектроскопии установлено, что через 5 минут инкубации эритроцитов с АТФ в гемоглобине изменяется конформация гемопорфиринового макроцикла, что проявляется в усилении способности сбрасывать лиганды (Рис.2). I1375/I1580, усл.ед. 1.9 1.8 1.7 1.6 1.5 1.4 1.3 1.2 1.1 1.0 0.9 0.8 250 200 1375 КР-спектр гемопорфирина 150 Изолированные эритроциты контроль 100 мкМ АТФ 1580 100 50 0 Частотный сдвиг, см-1 1300 1400 1500 1600 1700 * * * 5 минута 10 минута 20 минута Рис. 2 Динамика изменения соотношения величин интенсивностей полос КР-спектра гемопорфирина (способность гемоглобина сбрасывать лиганды) изолированных эритроцитов 10 в присутствии 100 мкМ АТФ (М±se, *-результаты достоверно отличаются от контроля по tкритерию (p<0.05)) В данных условиях меняется форма эритроцитов: уменьшается доля дискоцитов и возрастает число эхиноцитов. Известно, что морфология эритроцита зависит от рельефа поверхности клетки, характеризующегося состоянием цитоскелета (Kelemen C., 2001, Боровская М.К., 2010). Нами установлено, что в присутствии АТФ амплитуда рельефа поверхности эритроцитов возрастает на 27%, причем в первую очередь изменения рельефа обусловлены структурами цитоскелета и мембранными белками (размер менее 150 нм) Параметры эритроцита, усл.ед. (Рис.3). 90 80 70 60 50 40 30 24 22 20 18 16 14 12 10 Изолированные эритроциты морфология контроль z,нм 12 * 8 * 4 * 0 амплитуда РП * 6 4 * * 2 0 100 мкМ АТФ Диск Эх2 Эх3 S S1 S2 10 минута Рис. 3 Изменения морфологии и рельефа поверхности мембраны изолированных эритроцитов в присутствии 100 мкМ АТФ (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) В ходе исследования показано, что в присутствии АТФ меняется не только форма и рельеф поверхности изолированных эритроцитов, но и вязкость мембраны, а также конформация гемопорфирина гемоглобина эритроцита: за 10 - 15 минут инкубации на 14% возрастает УЖК липидов эритроцитов, а к 20 минуте на 32% возрастает способность гемоглобина сбрасывать лиганды, обусловленная, вероятно, деформаций метиновых связей 11 в молекуле гемопорфирина. Отметим, что в ходе исследуемого процесса наблюдается рост ОРХ эритроцитов, что свидетельствует об увеличении плотности упаковки гемоглобина в эритроцитах (Рис. 2, 4). 1.3 1.1 1.0 0.9 10-15 минута 1.2 1 2000 * 1.0 0.9 2 1000 0 -500 -1000 -1500 -2000 300 1.3 1.1 100 мкМ АТФ 1 производная 1500 0.8 1.2 контроль 500 4 3 25 минута Параметры эритроцита, усл.ед. Изолированные эритроциты * 0,22 0,20 * 400 500 600 700 5 Фазовый профиль, мкм 0,18 0,16 0,14 0,12 0,10 0,08 0,06 0.8 50 75 100 125 150 175 200 Рис. 4 Изменения упорядоченности жирнокислотных хвостов липидов мембраны (1), ЭПРспектров зонда в мембране эритроцита (2), оптической разности хода (3), плотности упаковки гемоглобина (4) и фазового профиля (5) изолированного эритроцита в присутствии 100 мкМ АТФ (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) Итак, при действии АТФ, активация Р2Х7-рецепторов изолированных эритроцитов приводит к изменению конформации гемопорфирина и повышению способности гемоглобина сбрасывать лиганды. Важно, что при этом меняется состояние клетки: увеличиваются как амплитуда рельефа поверхности эритроцитов, так и УЖК липидов плазматической мембраны. Деформация метиновых связей между пирролами гемопорфирина, вероятно, приводит как к изменению сродства гемоглобина к лигандам, так и увеличению плотности упаковки молекул в эритроците за счет формирования комплексов (ассоциатов). 12 1.2 Исследование роли рецепции АТФ в регуляции кислородтранспортной функции эритроцита в крови Как отмечалось выше, действие АТФ на рецепторы эритроцита в крови может зависеть от изменения функционального состояния других клеток, а также способности связывать АТФ белками плазмы крови. Известно, что уровень внеклеточной АТФ регулируется эктоАТФазами и эктонуклеотидазами, локализованными на поверхности клеток крови, а также фосфатазами и трансфосфорилазами плазмы (Coade S. & Pearson J., 1989, Gorman M.W., 2007, Montalbetti N., 2011). Кроме того, на поверхности лейкоцитов, макрофагов и тромбоцитов присутствуют пуринергические рецепторы, активация которых вызывает выброс активных веществ в межклеточное пространство, что, вероятно, оказывает опосредованное действие на свойства эритроцита (Lüthje J., 1989, Yegutkin G.G., 2007, Казакова Р.Р., 2011, Riteau N., 2012,Graziano F., 2015). С учетом этого, в следующей серии экспериментов мы исследовали динамику изменения молекулярно-клеточных параметров эритроцита в крови в присутствии высоких концентраций экстраклеточного АТФ. Установлено, что в течение 5 минутной инкубации с АТФ меняется конформация гемопорфирина, что приводит к увеличению на 32% способности гемоглобина сбрасывать лиганды. При этом меняется и состояние цитоскелета клетки: на 18% уменьшается амплитуда рельефа поверхности эритроцитов, причем эффект более выражен для крупных Параметры эритроцита, усл.ед. структур цитоскелета и мембранных белков (размер более 150 нм) (Рис. 5). 6,0 5,5 5,0 4,5 4,0 3,5 3,0 2,5 2,0 1,5 1,0 0,5 0,0 Эритроциты в крови контроль 5 мМ АТФ амплитуда РП * * * I1375/I1580 * S S1 S2 5 минута 13 Рис. 5 Изменения конформации гемопорфирина гемоглобина и рельефа поверхности эритроцита на 5 минуте инкубации крови с АТФ (5 мМ): I1375/I1580 – соотношение интенсивностей КР-полос (способность гемоглобина сбрасывать лиганды), S – амплитуда рельефа поверхности клетки (S1 – вклад структур менее 150 нм, S2 – вклад структур более 150 нм) (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) Также, начиная с 5 минуты инкубации крови с АТФ, меняется распределение молекул гемоглобина в эритроците и возрастает плотность их упаковки. Установлено, что к 15 минуте обратимо изменяется конформация гемопорфирина и увеличивается доля комплексов гемоглобина с NO I типа. В данном случае, пирролы молекулы гемопорфирина располагаются более симметрично, а молекула гемоглобина, вероятно, становится компактнее (Perutz M.F, 1987). Отметим, что к 30 минуте воздействия АТФ меняется Параметры эритроцита, усл.ед. морфология клетки и возрастает доля эхиноцитов 1 порядка (Рис. 6). 11 10 9 8 7 6 5 4 3 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 30 минута Б Эритроциты в крови контроль 5 мМ АТФ * 15 минута * 5 минута * * а 1 2 3 4 Рис. 6 Изменения оптической разности хода (1), плотности упаковки гемоглобина (2), конформации гемопорфирина гемоглобина (соотношение интенсивностей полос КР-спектра I1618/I1355+I1375, доля комплексов гемоглобина I типа с NO) (3), числа эхиноцитов 1 порядка (4, а) для эритроцитов в крови с 5 мМ АТФ (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) 14 Итак, у эритроцитов в крови при действии АТФ меняется конформация гемопорфирина и возрастает способность гемоглобина сбрасывать лиганды, за счет деформации метиновых мостиков. Параллельно изменяются свойства эритроцита: увеличивается плотность упаковки гемоглобина и уменьшается амплитуда рельефа поверхности. При этом скорость изменения формы эритроцитов в крови (образование эхиноцитов) значительно уменьшается. Важно, что у эритроцитов в цельной крови в присутствии АТФ изменение конформации гемопорфирина приводит к увеличению доли комплексов гемоглобина с NO. Установлено, что в изолированных эритроцитах в течение первых 5 минут инкубации клеток с 5 мМ АТФ увеличивается содержание внутриклеточного ионизированного кальция (Рис. 7). Данный факт согласуется с тем, что пуринергические P2X7-рецепторы представляют собой быстро открывающиеся ионные поры (Donnelly-Roberts D.L., 2007, 1.40 1.35 1.30 1.25 1.20 1.15 1.10 Изолированные эритроциты число фотонов время жизни * 1,06 1,05 1,04 1,03 1,02 1.00 1,01 1,00 0,99 0.99 0 5 10 * * * * 5 15 * * I 335 / I 362 , усл.ед. Интенсивность флуоресценции, усл.ед. Hewinson J., 2007, Shemon A., 2008, Bartlett R., 2014). 10 15 20 25 30 20 25 Время инкубации, мин 30 Рис. 7 Динамика изменения содержания внутриклеточного Са2+ в изолированных эритроцитах в присутствии 5 мМ АТФ (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) 15 Через 10 минут инкубации эритроцитов с 5мМ АТФ, выявлена тенденция возрастания УЖК липидов мембраны клеток, увеличивается доля стоматоцитов 1 порядка, при этом амплитуда рельефа поверхности уменьшается на 24%, преимущественно за счет структур цитоскелета и Параметры эритроцита, усл.ед. мембранных белков размером более 150 нм (Рис. 8). 20 Изолированные эритроциты контроль 5 мМ АТФ Морфология 18 16 14 12 * * 10 Амплитуда РП 8 * 6 4 * 2 0 * Эх1 Стом1 S 10 минута S1 S2 Рис. 8 Изменения формы и рельефа поверхности мембраны изолированных эритроцитов в присутствии 5 мМ АТФ на 10 минуте инкубации (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) В этих условиях к 15 минуте меняется конформация гемопорфирина гемоглобина, при этом обратимо увеличивается как доля комплексов I типа гемоглобина оксидом азота (в 3 раза), так и с кислородом, а к 20 минуте возрастает способность гемоглобина сбрасывать лиганды (Рис. 9). Выявленные изменения конформации гемопорфирина могут быть обусловлены тем, что связывание лиганда сопровождается перераспределением электронов в плоскости порфиринового макроцикла, когда пирролы занимают симметричное положение. Вероятно, при этом уменьшается деформация метиновых мостиков и реализуются кооперативные «гемгем» взаимодействия между субъединицами гемоглобина (Блюменфельд Л. А., 1998, De Rosa M.C., 2008, Браже Н.А., 2015). Также, при этом обнаружено увеличение на 27% плотности упаковки молекул гемоглобина в цитоплазме эритроцита, которая достигает максимума к 30 минуте инкубации. 16 Параметры гемопорфирина, усл.ед. Интенсивность КР, усл.ед. Изолированные эритроциты: 3,5 3,0 2,5 2,0 1,5 1,0 0,5 0,0 200 -0,5 175 -1,0 150 -1,5 125 -2,0 100 -2,5 75 50 -3,0 25 -3,5 0 контроль 5 мМ АТФ 2 * 3* 1* 20 минута 15 минута 1375 1355 1552 1580 1618 Частотный сдвиг, см-1 1300 1350 1400 1450 1500 1550 1600 1650 Рис. 9 Спектры КР изолированных эритроцитов и изменения соотношения интенсивностей полос: 1 – I1375/I1355+I1375 (доля комплексов оксигемоглобина в изолированных эритроцитах, 2 – I1618/I1355+I1375 (доля комплексов I типа гемоглобина с оксидом азота), 3 – I1375/I1580 (способность гемоглобина сбрасывать лиганды) при инкубации клеток с 5 мМ АТФ (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) Таким образом, действие АТФ на рецепторы эритроцита в суспензии и крови приводит к изменению конформации гемопорфирина гемоглобина и образованию плотно упакованных ассоциатов гемоглобина (в крови скорость формирования комплексов выше, чем в изолированных эритроцитах). Обнаруженные изменения конформации гемопорфирина характеризуются деформацией метиновых связей и более симметричным расположением пирролов в порфириновом макроцикле: для эритроцитов в крови сначала меняется конформация метиновых мостиков гемопорфирина, а затем расположение пирролов, что важно, для оптимального связывания NO. Вероятно, в изолированных эритроцитах в присутствии высокой концентрации АТФ изменение локализации пирролов в молекуле гемопорфирина и деформация метиновых связей происходят одновременно, что вызывает увеличение доли комплексов гемоглобина с кислородом и оксидом азота (I тип) (Рис. 10). 17 Важно, что изменение состояния гемоглобина сопровождается изменениями структуры цитоскелета (уменьшением амплитуды рельефа поверхности клетки). 2 2 1 1 2 1 Рис. 10 Схема формирования комплексов гемоглобина с лигандами (O2 и NO). Комплексы гемоглобина с кислородом и оксидом азота (I типа) содержат гексакоординированный атом Fe2+, Гис – остаток гистидина глобина, 1 – гемопорфириновый макроцикл, 2 – координационные связи между Fe2+, глобином, атомами азота гемопорфирина, молекулами O2 и NO Как отмечалось выше, активация P2X7-рецепторов эритроцита в присутствии АТФ сопровождается увеличением содержания ионизированного кальция. В связи с этим, мы исследовали изменения некоторых параметров эритроцитов при инициации входа кальция в клетку с помощью ионофора А23187: к 5 минуте увеличивается число эхиноцитов (в 4,5 раза) и ОРХ дискоцитов, а к 10 минуте на 42% возрастает доля комплексов I типа гемоглобина с оксидом азота и на 16% уменьшается способность гемоглобина сбрасывать лиганды в изолированных эритроцитах. (Рис. 11). 18 Параметры эритроцита, усл.ед. 100 5 минута 80 Изолированные эритроциты 5 мкМ А23187 - Са2+ 5 мкМ А23187 + Са2+ * 60 40 20 1.2 1.0 0.8 0.6 0.4 0.2 0.0 * 10 минута * * 20-25 минута * * * 1 2 3 4 5 3 4 Рис. 11 Изменения количества дискоцитов (1) и эхиноцитов 3 порядка (2), оптической разности хода (3), соотношения интенсивностей КР-полос I1618/I1355+I1375 (доля комплексов гемоглобина с NO I типа) (4), I1375/I1580 (способность гемоглобина сбрасывать лиганды) (5) для изолированных эритроцитов с 5 мкМ А23187 (М±se, *-результаты достоверно отличаются от контроля с безкальциевым буфером по t-критерию (p<0.05)) По-видимому, при действии АТФ вход Са2+ вызывает изменение ряда параметров эритроцита: увеличение ОРХ клетки, плотности упаковки гемоглобина в цитоплазме и доли комплексов гемоглобина с оксидом азота (I). Вероятно, Са2+ оказывает комплексное воздействие на эритроцит, активируя внутриклеточную NO-синтазу, уменьшая гидратную оболочку молекул гемоглобина и изменяя локальный заряд его белковых цепей (Kelemen C.,2001, De Rosa M., 2008.Cortese-Krott M.M.,2014). Отметим, что при этом изменяется и конформация гемопорфирина гемоглобина, вероятно, за счет перераспределения электронов и перемещения атома железа в плоскость порфиринового макроцикла, а пирролы располагаются более симметрично, что важно для реализации кооперативных свойств гемоглобина. Таким образом, в присутствии внеклеточной АТФ и рецептор-опосредованном увеличении содержания внутриклеточного Са2+ изменяются компоненты кислородтранспортной функции эритроцитов. 19 2. Исследование роли инсулиноподобного фактора роста 1 в регуляции кислородтранспортной функции эритроцита 2.1. Исследование роли рецепции инсулиноподобного фактора роста 1 в регуляции кислородтранспортной функции изолированного эритроцита В следующей серии экспериментов исследовали клеточные аспекты изменения сродства гемоглобина к кислороду и оксиду азота в присутствии ИФР-1. Установлено, что присутствие 13 нМ ИФР-1 в среде с изолированными эритроцитами меняет конформацию гемопорфирина, что приводит к увеличению на 90% доли комплексов гемоглобина с оксидом азота I типа. Данный процесс сопровождается также некоторым увеличением (к 15 Параметры эритроцита, усл.ед. минуте на 16%) ОРХ эритроцитов (Рис. 12). 2.3 2.2 2.1 2.0 1.9 1.8 1.7 1.6 1.5 1.4 1.3 1.2 1.1 1.0 0.9 0.8 0.7 0.6 0.5 20 минута 5 минута * * Изолированные эритроциты контроль 13 нМ ИФР-1 15 минута * * 1 2 * 3 1 2 Рис. 12 Динамика изменения соотношения интенсивностей полос КР-спектра I1618/I1355+I1375 (доля комплексов I типа гемоглобина с NO) (1), площади клетки (2), оптической разности хода (3) изолированных эритроцитов в присутствии 13 нМ ИФР-1 (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) При увеличении концентрации ИФР-1 (40 нМ) на 5 минуте инкубации наблюдается уменьшение УЖК липидов и увеличение ОРХ эритроцитов. При этом, плотность упаковки гемоглобина в цитоплазме увеличивается к 25 минуте инкубации, а конформация 20 гемопорфирина гемоглобина остается неизменной. Установлено, что к 30 минуте инкубации с ИФР-1 меняется морфология эритроцитов: на 46 % увеличивается число стоматоцитов Параметры эритроцита, усл.ед. (Рис. 13). 8 7 6 5 Изолированные эритроциты контроль 40 нМ ИФР-1 30 минута * 4 3 * 2 1,0 25 минута 10 минута * * 0,8 0,6 0,4 0,2 0,0 1 2 3 4 Рис. 13 Изменения величины оптической разности хода (1), упорядоченности жирных кислот липидов мембраны (2), плотности упаковки гемоглобина (3), доли стоматоцитов 2 порядка (4) в присутствии 40 нМ ИФР-1 для изолированных эритроцитов (М±se, *-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) Таким образом, в присутствии 13 нМ ИФР-1 изменяется морфология изолированных эритроцитов, а также конформация гемопорфирина гемоглобина с увеличением числа комплексов гемоглобина с оксидом азота (I типа). Вероятно, активация специфических рецепторов к ИФР-1, локализованных на поверхности эритроцита, стимулирует NO-синтазу, что приводит к увеличению комплексов гемоглобина с эндогенным оксидом азота. Высокие концентрации ИФР-1 приводят к уменьшению УЖК липидов, меняют форму (стоматоцитоз) эритроцитов с увеличением ОРХ. 2.2. Исследование роли рецепции инсулиноподобного фактора роста 1 в регуляции кислородтранспортной функции эритроцита в крови 21 Известно, что в крови ИФР-1 способен связываться со специфическими белками плазмы, модифицирующими его гормональную активность (Laron Z., 2001, Kengni et.al., 2007, Matta M., 2011). С учетом этого, в следующей серии экспериментов мы исследовали параметры эритроцитов в крови в присутствии высокой концентрации ИФР-1. Установлено, что с 5 минуты инкубации доля комплексов гемоглобина с кислородом возрастает на 15% с последующим снижением способности гемоглобина связывать лиганды. Эти эффекты обусловлены, вероятно, изменениями конформации гемопорфирина: пирролы гемопорфирина гемоглобина располагаются более симметрично, что облегчает приближение О2 к гему и увеличивает вероятность Т→R перехода гемоглобина. Установлено, что при добавлении ИФР-1 в цельную кровь обратимо увеличивается число стоматоцитов 1 (на 47%) и 2 порядка (в 2 раза), ОРХ и плотность упаковки молекул гемоглобина возрастает на 12% и 16%, соответственно. При этом изменяется структура цитоскелета: на 21% уменьшается амплитуда рельефа поверхности клеток, обусловленная структурами с размером менее 150 нм. При более продолжительной инкубации данные Параметры эритроцитов, усл.ед. эффекты нивелируется (Рис. 14). 1,7 1,6 1,5 1,4 1,3 1,2 1,1 1,0 0,9 0,8 0,7 0,6 Эритроциты в крови контрорль 65 нМ ИФР-1 5минута * * * 10минута * 30минута * * 1 2 3 4 5 * 4 5 Рис. 14 Изменения величины оптической разности хода (1), плотности упаковки гемоглобина (2), амплитуды рельефа поверхности (S1<150нм) (3), соотношения интенсивностей полос КРспектра I1355/I1355+I1375 (доля комплексов гемоглобина с кислородом) (4), I1355/I1552 22 (способность гемоглобина связывать лиганды) (5) эритроцитов в крови с 65 нМ ИФР-1 (М±se,*-результаты достоверно отличаются от контроля по t-критерию (p<0.05)) Вероятно, в крови под действием ИФР-1 эритроциты меняют свою форму, плотность упаковки гемоглобина и амплитуду рельефа поверхности в зависимости от длительности воздействия: при продолжительной инкубации изменения нивелируются. При этом конформация гемопорфирина и доля комплексов гемоглобина с кислородом не восстанавливается. Очевидно, что на уровне организма действие ИФР-1 может вызывать другие эффекты. Для проверки этого предположения, в следующей серии экспериментов мы исследовали некоторые параметры эритроцитов в крови пациентов с соматотропной недостаточностью, проходивших рГР-терапию. Табл. 1 Изменение комплекса молекулярно-клеточных параметров эритроцита в присутствии ИФР-1, полученные в различных сериях экспериментов Соотношение полос КР- Эритроциты 13 Кровь СТГ-недостаточность спектра нМ ИФР-1 65 нМ ИФР-1 после терапии I1375/I1355+I1375 − ↑ ↑ I1618/I1355+I1375 ↑ − − I1355/I1552 − ↓ ↓ Площадь эритроцита ↓ − ↓ ОРХ эритроцита ↑ ↑ ↑ «↑» или «↓» – увеличение или уменьшение показателя относительно контроля (p<0.05), «−» – изменения отсутствуют Установлено, что при увеличении содержания ИФР-1 в крови (в ~2,5 раза) после терапии рГР, кислородтранспортная функция и морфология эритроцитов характеризуется схожими с результатами получасовой инкубации крови с 65 нМ ИФР-1 изменениями (Табл.1). ЗАКЛЮЧЕНИЕ Итак, в ходе исследования были получены доказательства наличия последовательных изменений молекулярно-клеточных параметров эритроцита при действии пуринергических соединений (АТФ) и факторов роста (ИФР-1), влияющих на реализацию 23 кислородтранспортной функции клетки. При действии АТФ основным фактором, инициирующим изменения эритроцита, является вход и увеличение содержания внутриклеточного Са2+, который вызывает изменение формы клеток (эхиноцитоз) и некоторых свойств гемоглобина (увеличение числа комплексов с NO). Перераспределение Са2+ меняет структуру цитоскелета и вязкость мембраны эритроцитов, что, в свою очередь, влияет как на диффузию О2 и NO в клетку и способность гемоглобина эффективнее сбрасывать эти лиганды, так и на формирование более плотно упакованных комплексов молекул гемоглобина в клетке, за счет десорбции мембраносвязанного гемоглобина (Kelemen C., 2001, Веретяхин В.В., 2006, Hewinson J., 2007, Боровская М.К., 2010, Максимов Г.В., 2015). Мы показали, что при действии ИФР-1 площадь эритроцитов уменьшается с изменением сродства гемоглобина к NO. При увеличении концентрации ИФР-1 снижается вязкость мембраны эритроцита, вероятно, за счет активации фосфолипаз, а также увеличивается плотность упаковки молекул гемоглобина, что может менять скорость диффузии молекул газов в эритроцит и эффективность гемодинамики. Важно, что кислородтранспортная функция отдельного эритроцита зависит от компонентов цельной крови (плазменных белков, клеток, ферментов). При инкубации крови с АТФ увеличивается скорость образования молекулярных ассоциатов гемоглобина в цитоплазме эритроцита и доли комплексов гемоглобина с NO. В присутствии ИФР-1 в крови также увеличивается скорость образования гемоглобиновых ассоциатов, но возрастает доля комплексов с O2 в молекуле гемоглобина. Следовательно, при активации этих рецепторов эритроциты становятся компактнее и проникают в узкие капилляры, где NO расширяет сосуды, а О2 уменьшает гипоксию. Вероятно, активация других типов рецепторов, локализованных на поверхности эритроцита (инсулиновые, адренергические, ацетилхолиновые), также может модифицировать реализацию кислородтранспортной функции. ВЫВОДЫ 1. Установлено, что в изолированных эритроцитах при действии АТФ меняется конформация гемопорфирина: происходит деформация метиновых связей между пирролами, что повышает способность гемоглобина сбрасывать лиганды. При увеличении концентрации АТФ как в изолированных эритроцитах, так и в крови, пирролы гемопорфирина локализованы более симметрично, при этом доля комплексов гемоглобина с оксидом азота (I типа) возрастает. Изменения конформации гемопорфирина при активации ИФР-124 рецепторов приводят к увеличению доли комплексов гемоглобина с оксидом азота (I типа) в изолированных эритроцитах, а в цельной крови возрастает доля комплексов гемоглобина с кислородом и снижается способность гемоглобина связывать лиганды. 2. Показано, что при действии АТФ изменяется распределение молекул гемоглобина в цитоплазме эритроцита, формируются плотно упакованные ассоциаты молекул, причем, скорость данного процесса выше для эритроцитов, находящихся в крови. Действие ИФР-1 в большей мере приводит к образованию молекулярных ассоциатов в изолированных эритроцитах. 3. В присутствии АТФ содержание ионизированного внутриклеточного кальция в изолированных эритроцитах увеличивается. Активация входа кальция в изолированный эритроцит с помощью ионофора увеличивает оптическую разность хода клетки, а также меняет конформацию гемопорфирина, увеличивая долю комплексов гемоглобина с оксидом азота (I типа) и снижая способность гемоглобина сбрасывать лиганды. 4. При инкубации изолированных эритроцитов с 100 мкМ АТФ наблюдается увеличение упорядоченности жирнокислотных «хвостов» липидов мембраны, а также амплитуды рельефа поверхности, которая, однако, снижается при действии высоких концентраций АТФ как у изолированных эритроцитов, так и эритроцитов в крови. Высокие концентрации ИФР1 приводят к уменьшению упорядоченности жирнокислотных «хвостов» липидов мембраны изолированных эритроцитов, а у эритроцитов в крови обратимо уменьшают амплитуду рельефа поверхности, обусловленную структурами цитоскелета и мембранными белками размером менее 150 нм. 5. Увеличение концентрации ИФР-1 в крови доноров в ходе терапии соматотропных патологий приводит к изменениям морфологии эритроцитов и конформации гемоглобина. Список работ, опубликованных по теме диссертации Статьи в журналах, включенных в перечень ВАК: 1. С.С. Бочкарева (Коваленко), А.И. Юсипович, Е.Ю. Паршина, Г.В. Максимов Роль пуринергических рецепторов эритроцита в регуляции конформации и способности гемоглобина переносить кислород и оксид азота // Бюллетень экспериментальной биологии и медицины, 2015, 159 (2): 170-173 2. M. Pankratova, A. Baizhumanov, A. Yusipovich, M. Faassen, T. Shiryaeva, V. Peterkova, S. Bochkareva (Kovalenko), Т. Kazakova, G. Maksimov Imbalance in the blood antioxidant system in 25 growth hormone-deficient children before and after 1 year of recombinant growth hormone therapy // PeerJ, 2015, 3:. e1055 3. G. Maksimov, T. Sazontova, S. Bochkareva (Kovalenko), N. Brazhe, A. Semenova, E. Parshina, L. Kuzmicheva, V. Shutova, A. Yusipovich, O. Sosnovtseva, E. Gudilin, Yu. Arkhipenko Raman spectroscopy and silver nanoparticles in biomedical studies of hemoglobin // Moscow University Chemistry Bulletin, 2015, 70 (3): 158–163 4. М.В. Фаассен, М.С. Панкратова, Н.Н. Молитвословова, А.А. Байжуманов, С.С. Бочкарева (Коваленко), А.И. Юсипович, Г.В. Максимов, В.А. Петеркова Состояние антиоксидантной системы крови у пациентов с акромегалией // Проблемы эндокринологии, 2015, 61(2): 8–10 5. M. Faassen, М. Pankratova, T. Shiryaeva, E. Nagaeva, V. Peterkova, S. Bochkareva (Kovalenko), A. Baizhumanov, E. Parshina, A. Yusipovich, G. Maksimov The Level and Conformation of Blood Plasma Carotenoids in GH Deficient Children After 1 Year of GH Therapy // Hormone Research in Paediatrics, 2014, 82 (1): 244-245 6. М. Pankratova , M. Faassen, S. Bochkareva (Kovalenko), A. Yusipovich, A. Baizhumanov, T. Shiryaeva, G. Maksimov The Level and Conformation of Blood Plasma Carotenoids in Girls with Turner Syndrome After 1 Year of GH Therapy // Hormone Research in Paediatrics, 2014, 82 (1): 399-400 7. С.С. Бочкарева (Коваленко), Е.Ю. Паршина, А.И. Юсипович, Г.В. Максимов, А.Б. Рубин Изменение конформации гемопорфирина гемоглобина и связывания NO в эритроцитах при действии инсулиподобного фактора роста 1 // Биофизика, 2014, 59 (6): 1093-1096 6. Г.В. Максимов, В.А. Трофимов, Д.И. Сидоров, С.С. Бочкарева (Коваленко), В.В., Шутова, Е.А., Гудилин Использование серебряных наноструктурированных подложек в биомедицинских исследованиях // Технологии живых систем, 2014, 6: 13-19 9. M. Pankratova, M. Faassen, T. Shiryaeva, V. Peterkova, S. Bochkareva (Kovalenko), A. Baizhumanov, E. Parshina, A. Yusipovich, G. Maksimov Imbalance in the oxygen-transporting properties of erythrocytes and the blood antioxidant system in growth hormone deficient children before therapy and after one year of recombinant growth hormone therapy // Exp. Clin. Endocrinol. Diabetes, 2014, 122: LB21 10. М.С. Панкратова, А.И. Юсипович, М.В. Воронцова, С.С. Бочкарева (Коваленко), А.А. Байжуманов, Е.Ю. Паршина, Т.Ю. Ширяева, Г.В. Максимов, И.И. Дедов Особенности кислородного и антиоксидантного статуса крови на фоне заместительной терапии гормоном роста у детей с соматотропной недостаточностью // Проблемы эндокринологии, 2012, 58 (5): 10-15 26 Тезисы конференций: 1. С.С. Бочкарева (Коваленко), Е.Ю. Паршина, М.А. Силичева, Г.В. Максимов Влияние активации рецепторов на состояние гемоглобина эритроцитов. Материалы всероссийской научной конференции с международным участием "Перспективы развития химических и биологических технологий в 21-м веке", 2015, г. Саранск, с. 194–197 2. M. Faassen, M. Pankratova, T. Shiryaeva, E. Nagaeva, V. Peterkova, S. Bochkareva (Kovalenko), A. Baizhumanov, E. Parshina, A. Yusipovich, G. Maksimov The level and conformation of blood plasma carotenoids in gh deficient children after 1 year of gh therapy. Hormone Research in Paediatrics, 2014, Switzerland, Сборник тезисов, 82: 244–245 3. М. Vorontsova, М. Pankratova, S. Bochkareva (Kovalenko), A. Yusipovich, T. Shiryaeva, O. Chikulaeva, A. Baizhumanov, E. Parshina, G. Maksimov, V. Peterkova Oxygen-transporting properties of erythrocytes and the blood antioxidant system in children with growth hormone deficiency and girls with Turner syndrome //9th Joint Meeting of Paediatric Endocrinology, 2013, Milan, Сборник тезисов, p. 253 4. S. Bochkareva (Kovalenko), А. Yusipovich, М. Vorontsova, М. Pankratova, Т. Shiryaeva, Е. Nagaeva, А. Baizhumanov, Е. Parshina, V. Peterkova, G. Maksimov Effects of GH treatment on oxygen-transporting properties of erythrocytes and blood antioxidant system in girls with Turner syndrome // 9th Joint Meeting of Paediatric Endocrinology, 2013, Milan, Сборник тезисов, p. 253 5. С.С. Бочкарева (Коваленко) Оценка гипоксических эффектов и антиоксидантного статуса на фоне замещающей терапии у детей с соматотропной недостаточностью. Материалы Международного молодежного научного форума «ЛОМОНОСОВ-2012» / Отв. ред. А.И. Андреев, А.В. Андриянов, Е.А. Антипов, К.К. Андреев, М.В. Чистякова. [Электронный ресурс] — М.: МАКС Пресс, 2012, ISBN 978-5-317-04041-3 6. С.С. Бочкарева (Коваленко) Изменение способности гемоглобина переносить О2 и NO при активации пуринорецепторов эритроцитов. Материалы Международного молодежного научного форума «ЛОМОНОСОВ-2014» / Отв. ред. А.И. Андреев, А.В. Андриянов, Е.А. Антипов. [Электронный ресурс] — М.: МАКС Пресс, 2014. ISBN 978-5-317-04715-3 27