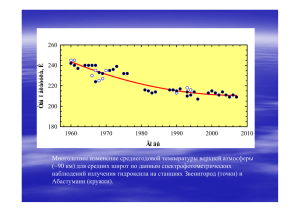
Физико-химические процессы в техносфере
advertisement

1. Информация из ФГОС, относящаяся к дисциплине 1.1. Вид деятельности выпускника Дисциплина охватывает круг вопросов, относящихся к виду деятельности выпускника: – экспертная, надзорная и инспекционно-аудиторская; – научно-исследовательская. 1.2. Задачи профессиональной деятельности выпускника В дисциплине рассматриваются указанные в ФГОС задачи профессиональной деятельности выпускника: – анализ опасностей техносферы, – участие в исследованиях воздействия антропогенных факторов и стихийных явлений на промышленные объекты. 1.3. Перечень компетенций, установленных ФГОС Освоение программы настоящей дисциплины позволит сформировать у обучающегося следующие компетенции: общекультурные: – способность к абстрактному и критическому мышлению, исследованию окружающей среды для выявления ее возможностей и ресурсов (ОК12); профессиональные: – способность использовать методы определения нормативных уровней допустимых негативных воздействий на человека и природную среду (ПК-14), – способность ориентироваться в основных проблемах техносферной безопасности (ПК-19), – способность принимать участие в научно-исследовательских разработках по профилю подготовки: систематизировать информацию по теме исследований, обрабатывать полученные данные (ПК-20). Перечень умений и знаний, установленных ФГОС Студент после освоения программы настоящей дисциплины должен: знать: – естественные процессы, протекающие в атмосфере, гидросфере, литосфере, – факторы, определяющие устойчивость биосферы, – характеристики возрастания антропогенного воздействия на природу, – методы анализа взаимодействия человека и его деятельности со средой обитания, – основные понятия, законы и модели химических систем, реакционную способность веществ; 2 уметь: – осуществлять в общем виде оценку антропогенного воздействия на окружающую среду с учетом специфики природно-климатических условий; владеть: – методами предсказания протекания возможных химических реакций и их кинетику. 2. Цели и задачи освоения программы дисциплины Цели дисциплины: – формирование целостного представления о процессах и явлениях физико-химического взаимодействия загрязнителей с компонентами окружающей среды (атмосферы, гидросферы, педосферы) и их прогнозирования. Задачи дисциплины: – изучить пути, скорости и закономерности физических явлений и химических процессов в окружающей среде, протекающих под воздействием естественных и антропогенных факторов; – дать представление о сложных физико-химических процессах миграции и трансформации естественных и антропогенных полютантов в различных компонентах биосферы и техносферы. 3. Место дисциплины в структуре ООП Для изучения дисциплины, необходимо освоение содержания дисциплин: химии, математики, физики, экологии, географии. Знания и умения, приобретаемые студентами после освоения содержания дисциплины, будут использоваться при изучении дисциплин: мониторинг среды обитания, химия окружающей среды, ноксология, экология техносферы. 4. Компетенции обучающегося, формируемые освоением дисциплины (результаты освоения дисциплины) В результате освоения программы настоящей дисциплины у обучающегося будут сформированы дополнительно следующие профессиональные компетенции: – способность ориентироваться в физико-химических процессах миграции и трансформации естественных и антропогенных соединений в различных компонентах биосферы, – способность объективно оценивать и прогнозировать естественные и под действием антропогенных факторов изменения в различных компонентах биосферы. 3 В результате освоения дисциплины обучающийся должен: уметь: – оценивать развитие негативной ситуации в среде обитания, вызванной трансформацией или миграцией загрязнителей, находить пути минимизации их негативного действия, – прогнозировать влияние негативных процессов на качество природных ресурсов и климат планеты; знать: – основные физические законы и явления, действующие в атмосфере, гидросфере, педосфере, сохраняющие их устойчивость, – состав, свойства, источники образования и стоки компонентов атмосферы, гидросферы, педосферы, – закономерности, условия и процессы (реакции) взаимодействия загрязнителей и их производных между собой, с компонентами окружающей среды и объектами техносферы, – пути миграции загрязнителей, этапы их трансформации и нейтрализации, – проблемы мирового загрязнения и пути трансграничного переноса загрязняющих веществ в техносфере; владеть: – расчетами концентраций компонентов среды обитания, – расчетами скоростей химических процессов, – навыками работы с учебно-методическим и информационным обеспечением дисциплины. 5. Основная структура дисциплины Таблица 1 – Структура дисциплины Вид учебной работы Общая трудоемкость дисциплины Аудиторные занятия, в том числе: лекции практические/семинарские занятия Самостоятельная работа Вид итоговой аттестации Трудоемкость, часов Всего Семестр 5 108 108 51 51 17 17 34 34 57 57 зачет зачет 6. Содержание дисциплины 6.1. Перечень основных разделов и тем дисциплины Введение. Техногенез – его эволюционное развитие к техносфере. Цели и задачи дисциплины «физико-химические процессы в техносфере». Раздел I. Физико-химические процессы в атмосфере. 1.1. Физические характеристики атмосферы. 4 1.2. Химия основных загрязнителей атмосферы, их влияние на климат планеты. 1.2.1. Общие сведения о кинетике реакций, фотохимических процессах и фотооксидантах – реакционно-способных частицах атмосферы. 1.2.2. Неорганические и органические компоненты атмосферы, их фотохимические реакции, источники и стоки. Опасность вторичного загрязнения атмосферы. Аэрозоли: химический состав, влияние на климат планеты. 1.2.3. Глобальные экологические проблемы биосферы: парниковый эффект, проблемы озонового слоя, кислотные дожди. Раздел II. Физико-химические процессы в гидросфере. 2.1. Физические характеристики мирового океана. Гидрологический режим океаносферы. Химический состав природных вод. 2.2. Антропогенное загрязнение вод мирового океана. Трансформация и опасность загрязнителей в гидросфере. Раздел III. Физико-химические процессы в педосфере. 3.1. Строение, химический состав земной коры и процессы ее трансформации. Планетарный почвенный покров. Геохимия загрязнителей. Раздел IV. Заключение. Миграция загрязнителей в биосфере. Законы жизнедеятельности биосферы - основа существования техносферы. 6.2. Краткое описание содержания теоретической части разделов и тем дисциплины ВВЕДЕНИЕ Техногенез – его эволюционное развитие к техносфере Техносфера – это пространство геосфер Земли, находящееся под воздействием производственной деятельности человека и занятое ее продуктами, это современная искусственно созданная человеком среда его обитания. Техносфера – это глобальная совокупность орудий, объектов, материальных процессов и продуктов общественного производства, привнесенная в результате активной деятельности, особенно в ХХ и в ХХI вв., человеком в природную среду – биосферу. В результате в биосфере уже частично искажены или полностью заменены течения некоторых процессов, присущих ей от природы. Современному этапу общественного развития предшествовала длительная история становления средств производства, техники и технологий – техногенез. Длительное время, человек и создаваемое им общество взаимодействовали только с естественной средой обитания. Развиваясь и совершенствуясь на протяжении тысяч лет человек до сих пор остается зависимым от состояния биосферы и изменений, происходящих в ней. Естественная среда, кроме позитивного влияния на человека, всегда обладала рядом негативных воздействий (опасностей), способствовавших потере здоровья и гибели людей. Человек, сохраняя жизнь своей популяции, всегда пытался защититься 5 и противостоять негативным действиям природных факторов. С появлением огня (около10 тыс. лет назад) человек переходит от собирательства и охоты к началу аграрной цивилизации, существенно повышая свои возможности в быту (появление очага и жилища) и в сфере деятельности (скотоводство и подсечно-огневое земледелие на землях, полученных за счет выжигания территорий лесов и лугов). В этот период проявляются первые техногенные негативные воздействия деятельности человека на природу. Этапу аграрной цивилизации (8 тыс. лет назад и до середины Х1Х в.) соответствует взаимодействие человека со средой обитания, основанное главным образом на принципах естественного развития природы и общества. Вместе с тем в этот период увеличилась численность населения Земли, возросла энерговооруженность человека, развивались и совершенствовались орудия труда, транспорт, связь; возникали города и поселки, что существенно улучшило условия обитания людей. В период аграрной цивилизации в биосфере появились и стали развиваться регионы техносферы, непрерывно нарастало антропогенное воздействие на природу и человека. В переходный период (с середины ХIХ в. до 30 годов ХХ столетия) существенно возросло техническое оснащение человека (паровые, бензиновые и электрические двигатели, гидроэлектростанции), которое непрерывно наращивалось и на этапе научно-технической революции (НТР) с 30-х годов ХХ в. до конца ХХ столетия. В годы НТР техническая оснащенность человека и общества достигла наивысшего уровня, а техногенные и антропогенные опасности стали определяющими во взаимодействии человека со средой обитания. Широкое развитие и применение в ХХ столетии получили химические и биохимические процессы, энергетические системы, электронные средства получения и передачи информации. Техносфера стала для человека основной средой обитания. Формирование техносферы существенно повысило комфортность и коммуникабельность человека, но привело к росту негативного техногенного влияния среды обитания на человека и природную среду. Целью изучения дисциплины «физико-химические процессы в техносфере» является формирование целостного представления о современном состоянии и физико-химических процессах в техносфере, о трансфрмации техногенных и антропогенных загрязнений в атмосфере, гидросфере, педосфере и влиянии этих процессов на качество природных ресурсов и климат планеты. Освоение дисциплины позволит сформировать представление о проблеме мирового загрязнения и научиться оценивать и прогнозировать развитие негативной ситуации в среде обитания. РАЗДЕЛ 1. ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ В АТМОСФЕРЕ 1.1. Физические характеристики атмосферы Атмосферой называется газовая оболочка Земли, вращающаяся вместе 6 с нею. Она составляет примерно 1/1000 массы гидросферы и около 1/10000 массы земной коры. Верхняя граница атмосферы лежит на высоте около 1000 км над уровнем моря; выше располагается так называемая корона земли, простирающаяся на расстояние 20 тыс. км. Более 99% массы атмосферы сосредоточено в нижнем слое толщиной 40 км (50% в слое толщиной 5,5 км). Состав и строение атмосферы. Отличительной чертой атмосферы является ее высокая подвижность (время вертикального перемещения в слое толщиной 11 км около 2,5 месяцев), а также постоянство состава главных компонентов и чрезвычайно высокая изменчивость множества малых примесей, содержание которых сильно варьируют как во времени, так и в различных частях атмосферы. В приземном слое на 99,9% по объему воздух состоит (%) из азота (78,084), кислорода (20,948), аргона (0,934) и углекислого газа (0,03). К постоянным компонентам относятся также водород (5·10-5) и инертные газы – гелий (5,24·10-4), неон (1,818·10-3), ксенон (8,7·10-6) и криптон (1,14·10-4). Присутствуют также метан (1,72·10-4), оксиды азота (3,04·10-5), серы (< 7·10-6). До высоты 20-30 км в атмосфере содержатся пары воды. Атмосфера имеет сложное строение. Она состоит из ряда оболочек (слоев), которые различаются в зависимости от высоты расположения прежде всего температурой, давлением и степенью ионизации молекул: это тропосфера, стратосфера, мезосфера, термосфера (ионосфера), экзосфера (межпланетное пространство). Отдельные слои атмосферы выделяют на основании хода температуры, неоднократно меняющего свой знак с высотой атмосферы. Границы зон разделены узкими переходными зонами, называемыми тропопаузами. Они строго не фиксируются. Свойства атмосферы. Давление в атмосфере равномерно уменьшается с высотой. Для описания поведения атмосферных газов в первом приближении может быть использовано уравнение состояния идеального газа (уравнение Бойля-Мариотта PV = RT). Если V=M, то давление (Р, Н/м2) связано с плотностью соотношением: Р = RT/М, где – плотность газа, кг/м ; R – универсальная газовая постоянная, равная 8,31 Дж/ (К.моль); T– температура, К; М – средняя молекулярная масса газа, кг/кмоль. 3 Солнечная радиация. Источником почти всей энергии на Земле служит Солнце. Солнечная постоянная – полный поток радиации, поступающей за 1 мин на 1 см2 площади, перпендикулярной к направлению солнечных лучей, за пределами атмосферы. Она равна 8,2 Дж/(см2мин). Основное количество энергии Солнца поступает в виде коротковолновой радиации. Земная атмосфера прозрачна для УФ-радиации в диапазоне 320-400 нм. При поглощении радиации в этом спектральном диапазоне подсти- 7 лающая поверхность (суша, поверхность океанов) нагревается и, как всякое нагретое тело, в свою очередь излучает в инфракрасном диапазоне. Интенсивность (I) уходящего излучения определяется законом Стефана – Больцмана для абсолютно черного тела: I = T4, где – универсальная постоянная Стефана, равна 5,67.10-8 Вт/(м2.К4). Тепловой баланс атмосферы и подстилающей поверхности. Равновесная температура Земли может быть рассчитана на основании величины солнечной постоянной, отражательной способности (альбедо) и закона Стефана – Больцмана. Поглощенная земной поверхностью энергия равна: Eп = r3 J (1-A), где J – интенсивность приходящего солнечного излучения; r – радиус Земли; А – доля отраженного излучения (альбедо). Излучаемая энергия равна: Eи = 4 r3 T4 Так как имеет место термическое равновесие Eп = Eи, то T = [J (1-A)/4]1/4 Равновесная температура нашей планеты, вычисленная по последнему уравнению, составляет 254 К, что на 34 К ниже реального значения. Расхождение объясняется тем, что это выражение не учитывает влияния атмосферы на тепловой баланс Земли (излучаемая Землей энергия, рассчитанная в приближении абсолютно черного тела, имеет намного меньшую интенсивность, чем приходящая от Солнца). Из 1050 ккал энергии, поступающей ежегодно на единицу площади 2 (1см ) на верхней границе атмосферы, 275 ккал отражается облаками и 75 ккал - подстилающей поверхностью (главным образом ледяными шапками континентов и плавающими льдами). В самой атмосфере молекулами различных газов и частицами аэрозолей поглощается энергия, эквивалентная 250 ккал. Значительная часть коротковолновой радиации [450 ккал/(см2 в год)] достигает подстилающей поверхности и поглощается ею. Выделившаяся в результате этого энергия переизлучается в атмосферу в форме более длинноволновой ИК-радиации, а также расходуется на испарение воды и конвективное движение масс воздуха. Общая циркуляция атмосферы. Неравномерность нагревания земной поверхности, зависящая от угла падения солнечных лучей, является основной причиной градиента температуры между высокоширотными (полярными) и экваториальными областями. Наличие такого градиента, а также вращение Земли служат причиной циркуляции атмосферы - сложной системы воздушных течений. Некоторые из них сравнительно устойчивы, тогда как другие постоянно меняют свое направление. Роль циркуляционных процессов в формировании климатической системы Земли очень велика: благодаря им сглаживаются контрасты температуры, осуществляется перенос водяного пара с океанов на континенты, а также усредняется состав основных компонентов воздуха. В экваториальных широтах воздушные массы перемещаются в вертикальном направлении. На больших высотах они поворачивают к полюсам 8 и потом вновь опускаются в субтропических широтах. Таким образом, в обоих полушариях формируются замкнутые циркуляционные (пассатные) ячейки, разделенные в районе экватора так называемой внутритропической зоной конвергенции. Ширина ее составляет несколько сотен километров, в течение года она перемещается в полушарие, в котором в настоящее время лето. Эта зона характеризуется ослаблением ветра и усилением конвекции и служит препятствием обмену воздушными массами между полушариями. Пассаты – это устойчивые воздушные течения. В умеренных широтах преобладают течения с запада на восток, включающие крупные вихри – циклоны и антициклоны. В стратосфере возникают струйные течения со скоростями ветра до 100-150 м/с. Ширина таких течений составляет несколько сотен километров. Они переносят огромные массы воздуха. В нижних слоях стратосферы существуют течения в направлении от экватора к полюсам – это как бы стратосферное продолжение пассатных ячеек циркуляции. В высоких широтах обоих полушарий происходит вращение атмосферы вокруг полюсов в направлении с запада на восток. Над Антарктидой в зимний период формируется мощный циркумполярный вихрь, изолирующий южную полярную стратосферу и препятствующий поступлению воздуха из более низких широт. Под устойчивостью атмосферы понимают стремление и способность смещенной в вертикальном направлении ячейки вернуться в первоначальное положение. Ионосфера – это часть верхней атмосферы, расположена выше 50 км. Верхней границей ионосферы является магнитосфера Земли. Ионосфера представляет собой природное образование разряженной слабоионизированной плазмы (атомные и молекулярные ионы), находящейся в магнитном поле Земли и подвергающейся воздействию ионизирующего излучения Солнца. Благодаря ионосфере возможно распространение радиоволн на далекие расстояния. Образование ионосферы происходит за счет двух конкурирующих процессов ионизации частиц до ионов и их рекомбинации: днем – под действием коротковолнового излучения Солнца, ночью – галактических космических лучей, а также корпускулярных потоков (энергия электронов 30-40 кэВ). Движение потоков заряженных частиц в ионосфере приводят к возникновению турбулентных неоднородностей электронной концентрации. Движение ионизированных масс и турбулентность ионосферы влияют на распространение радиоволн. Изучает ионосферу наука – аэрономия. Геомагнитное поле Земли и радиационные пояса. Выше ионосферы расположена магнитосфера Земли или геомагнитное поле (заполнено плазмой), которое экранирует поверхность Земли от потоков космических лучей и является геомагнитной ловушкой для заряженных частиц, источником которых являются космические лучи, солнечный ветер (особенно во время солнечных бурь). Она заполнена частицами высоких энергий, обра9 зующими радиационные пояса Земли. Частицы, захваченные в геомагнитную ловушку, совершают колебательные движения из одного полушария в другое, двигаясь вдоль силовых линий, одновременно прецессируя вокруг них и дрейфуя по долготе из-за неоднородности геомагнитного поля. Время колебаний частиц составляет от 10-3 до 10-1с. 1.2. Химия основных загрязнителей атмосферы, их влияние на климат планеты 1.2.1. Общие сведения о кинетике реакций, фотохимических процессах и фотооксидантах – реакционно-способных частицах атмосферы Химическая кинетика дает ценную информацию о числе молекул или иных частиц, участвующих в реакции, и о промежуточных стадиях процесса, т. е. сведения, без которых невозможно судить о механизме реакций. Основное ее положение заключается в том, что скорость реакции пропорциональна произведению концентраций реагентов. Запишем уравнение реакции в виде aA + bB =cC +dD тогда скорости прямой (V1) и обратной (V2) реакций будут равны V1 = k1 [A]a [B]b V2 = k2 [C]c [D]d Коэффициенты k1 и k2 в этих уравнениях называются константами скорости. При химическом равновесии отношение произведения молярных концентраций, получившихся веществ, к произведению молярных концентраций исходных веществ представляет собой постоянную величину, называемую константой равновесия. Она показывает во сколько раз скорость прямой реакции больше скорости обратной реакции k2 / k1 = [A]a [B]b/ [C]c [D]d Показатель степени, в которую возводится концентрация реагента, называется порядком реакции по данному реагенту. Сумма показателей степеней (a +b) называется суммарным порядком реакции. В зависимости от значения этой суммы различают моно-, би- и тримолекулярные реакции. Мономолекулярная реакция разложения АВ → А + В описывается уравнением первого порядка V = k1[AB] = -d[AB]/dt Обратной бимолекулярной реакции А + В → АВ соответствует кинетическое уравнение второго порядка V = k2[A] [B] = -d[A]/dt = -d[B]/dt. Скорость химической реакции зависит от температуры. Один из основных законов химической кинетики – уравнение Аррениуса – связывает константу скорости с температурой Т k = Ae-E/RT, где R – универсальная газовая постоянная [8,314 Дж/(моль · К)]; А и E – константы реакции. Первая из них называется предэкспоненциальным множителем; размерность ее такая же, как у константы скорости. Ее называют также частотным фактором, так как она показывает число столкновений в 1 см3 за 1 с при концентрации 1 моль/см3. 10 Константа Е называется энергией активации (Дж/моль) реакции. Молекулы вступают в реакцию, только если их энергия равна Е или превышает ее. Энергия активации – это избыток энергии, который необходим молекулам реагентов для прохождения реакции. Активация молекул осуществляется благодаря бимолекулярным столкновениям, которые тем чаще, чем выше температура. Реакции, в которых активация частиц осуществляется в результате поглощения кванта света, называются фотохимическими. Поглощая энергию УФ-излучения, молекулы могут переходить в возбужденное (синглетное) состояние, подвергаться диссоциации и ионизации. Возбужденное состояние молекул. Образовавшаяся в результате поглощения кванта света частица имеет избыточную электронную энергию и как следствие высокую реакционную способность. Фотоны или кванты обладают энергией Е = hν, где h – постоянная Планка, ν – частота световой волны. Молекула будет поглощать только те кванты, энергия которых соответствует разнице между двумя ее собственными дискретными энергетическими уровнями, то есть должно выполняться равенство hν = ЕК – Е0 (ЕК – возбужденный уровень, Е0– основной уровень). Почти все устойчивые органические молекулы имеют четное число электронов. Электроны попарно занимают низшие энергетические орбиты молекулы таким образом, что все электронные спины спарены (все электроны образуют пары с противоположными спинами). Молекула, в которой все спины спарены, не обладает суммарным магнитным моментом и находится в основном энергетическом состоянии (S0 – синглетное состояние). Когда молекула поглощает видимый или ультрафиолетовый свет, один из электронов возбуждается и переходит с заполненной орбитали на свободную с более высокой энергией без изменен6ия знака спина. Это состояние называется первым возбужденным синглетным состоянием (S1). Каждому возбужденному синглетному состоянию соответствует триплетное состояние (Т1), отличающееся тем, что у возбужденного электрона меняется знак спина на противоположный. Молекулы веществ из возбужденного состояния могут переходить в основное состояние. Переход с изменением спина электрона, сопровождающийся испусканием кванта энергии, называется флюоресценцией, а без изменения спина – фосфоресценцией (люминисценцией). С точки зрения энергетики, наиболее выгодно устойчивое состояние S0. Состояние S1 обладает наибольшим избытком энергии и соответственно менее стабильно, а состояние Т1 занимает промежуточное положение. Когда в результате фотооблучения молекула оказывается в состоянии Т1, реализуется возможность протекания фотохимической реакции. Помимо дезактивации с испусканием кванта света, возбужденные частицы могут дезактивироваться в результате перехода энергии электронного возбуждения в энергию колебаний атомов. В большинстве случаев возбуждение молекул приводит к гомолитическому разрыву тех или иных хи11 мических связей с образованием частиц – свободных радикалов (высокореакционных частиц), имеющих по одному неспаренному электрону Х:Y X• + Y• гомолитический свободные разрыв радикалы При гетеролитическом разрыве (гетеролиз) ковалентной связи могут образовываться электрофильные (положительно заряженные) и нуклеофильные (отрицательно заряженные) частицы Х:Y X+ Yгетеролитический электрофил (е) нуклеофил (n) разрыв Фотооксиданты – реакционноспособные частицы атмосферы Аэробная атмосфера земли обладает огромным окислительным потенциалом, определяющим скорости окисления не только естественных, но и антропогенных компонентов. При этом ключевая роль принадлежит не молекулярному кислороду, а кислородсодержащим частицам, таким как радикал гидроксила, пероксидный радикал, атомарный кислород, озон, которые называют фотооксидантами, так как они образуются в реакциях, инициируемых солнечной энергией. От их наличия и состава зависит окислительно-восстановительный потенциал атмосферы. Молекула кислорода представляет собой бирадикал с неспаренными электронами. Энергия диссоциации молекулярного (триплетного) кислорода (3О2) на атомы составляет 496 кДж/моль. Эта высокая величина служит кинетическим фактором относительной химической инертности кислорода, что является одной из причин нахождения кислорода в свободном состоянии в атмосфере. Молекулярный синглетный кислород (1О2). Квант энергии молекулярный кислород может получать как из солнечного потока, так и заимствовать у сенсибилизатора, образуя энергетически активную синглетную форму молекулярного кислорода 3 О2+h 1О2 Если происходит процесс образования молекулярного синглетного кислорода в биологических системах, то это может приводить к повреждению структуры биомембран, к гемолизу эритроцитов, инактивации ферментов, появлению загара и др. В стратосфере он образуется при фотолизе озона одновременно с атомарным кислородом О3+h 1О2+ О Атомарный кислород (О) [О(1D), O(3P) – его различные возбужденные состояния], в атмосферных процессах имеет гораздо более важное значение, так как участвует в образовании и разложении озона как в стратосфере, так и в тропосфере. Гидроксильный радикал (НО•). Нитриты, находящиеся в воздухе в составе аэрозолей или на поверхности твердых частиц (пыли), за счет фотохимической реакции могут быть источником образования очень сильного окислителя гидроксильного радикала 12 НОNО + h NО + НО• Гидроксильный радикал HO обладает высокой реакционной активностью и способствует очищению атмосферы, играя роль детергента, превращающего газы в растворимые вещества, которые легко удаляются из атмосферы с осадками. Гидропероксидный радикал (НОО•) в тропосфере может образовываться за счет реакции НО•+Н2О2 НО2• +Н2О. Гидропероксид (Н2О2) это слабая кислота, которая в щелочной и нейтральной средах диссоциирует на протон и супероксидный радикал Н-О-О-Н О•2 + 2Н Супероксид-радикал (О•2) может образовываться при переносе электрона на кислород. Это очень активная и высокотоксичная частица. Таким образом в атмосфере присутствует шесть активных форм кислорода: озон O3, атомарный кислород О, гидроксильный радикал НО•, гидропероксидный радикал НО2•, супероксидный радикал О•2 и синглетный кислород 1О2. Тропосферный озон. Из всех упомянутых фотооксидантов в наибольших количествах в атмосфере Земли присутствует озон. Поэтому он определяющим образом влияет на общую окислительную способность. По происхождению тропосферный озон может быть экзогенным или эндогенным. Свыше 90% молекул озона образуется в стратосфере, главным образом над экваториальным и тропическим поясом, откуда он переносится по направлению к полюсам. В нижней атмосфере образование озона происходит в загрязненной оксидами азота среде: NО2 + h NО + O(3P) O(3P) + О2 + М О3+М*. Влияние фотооксидантов на живые организмы Фотооксиданты оказывают на живые организмы прямое и косвенное воздействие. Первое из них связано с поглощением и химическим взаимодействием этих токсикантов с биомолекулами тканей. Сильнейшим из фотооксидантов является озон. Биохимическое действие озона обусловлено его высокой реакционной способностью по отношению к липопротеидам клеточных мембран и многих энзимов, имеющих в составе молекул двойные углерод-углеродные связи и сульфгидрильные группировки —SН. Повреждая мембраны, он влияет на скорость поглощения диоксида углерода из атмосферы листвой растений, поражает ткани легких животных. В клетках образуются свободные радикалы, легко вступающие в реакции с элементами биомолекул, при этом происходят процессы, аналогичные наблюдаемым под действием проникающей радиации. Длительное воздействие озона при концентрациях, типичных для воздуха многих городов мира (около 200 млрд -1), вызывает быстрое старение клеток животных. Озон оказывает негативное воздействие на многие полимерные материалы, в том числе резину, хлопчатобумажные ткани. Он взаимодействует и со многими красителями на основе синтетических ор13 ганических соединений, используемыми в текстильной промышленности, с масляными красками и др. В результате изделия из этих материалов быстро теряют свою прочность, ткани постепенно изменяют свой цвет, появляется угроза утраты многих ценнейших произведений искусства, таких как картины и фрески. Преждевременное старение резины и тканей приносит огромные убытки. 1.2.2. Неорганические и органические компоненты атмосферы, их фотохимические реакции, источники и стоки Диоксид углерода (СО2). В жизнедеятельности биосферы огромную роль играет углекислый газ. Биосфера за счет взаимодействия автотрофов, (используют СО2 в процессе фотосинтеза) и гетеротрофов уже на протяжении многих тысяч лет поддерживает постоянный баланс между кислородом и углекислым газом. Содержание углекислого газа в атмосфере принято считать в пределах 0,03%. Метан атмосферы (СН4) – основной органический компонент атмосферы Земли. Он химически инертен и поэтому содержится в атмосфере в наибольших количествах. Содержание его в значительной степени определяет окислительные свойства атмосферы и, тем самым, судьбу многих других малых газовых составляющих. Метан присутствует во всей толще тропосферы и стратосферы. Наибольшие вариации концентраций отмечены над континентами, над территориями, в недрах которых имеются крупные залежи ископаемого топлива – каменного угля, нефти и природного газа. В Южном полушарии концентрации СН4 оказываются на 8-10 % ниже, чем в Северном. В стратосфере с высотой содержание метана быстро убывает. Внутригодовые вариации метана проявляются с наиболее выраженным минимумом в летнее время. Наблюдаются тенденции увеличения содержания метана в атмосфере. Метан поступает в атмосферу из разных источников: природных, антропогенных и квазиприродных. Природные источники. В природных условиях метан образуется высокоспециализированными анаэробными микроорганизмами – метаногенами. Субстратами для метаногенов служат уксусная кислота, метанол, метиламин, метилмеркаптан и смесь СО2 + Н2., например, СН3SН+Н2 СН4+Н2S; СО2+4Н2 СН4+2Н2О. Наиболее активно микробиологический синтез СН4 протекает в богатых органическим веществом и бедных кислородом донных отложениях пресноводных водоемов, морей и переувлажненных почвах. Основная часть метана не достигает дневной поверхности вследствие поглощения аэробными метанокисляющими бактериями метанотрофами («бактериальный фильтр»). Совокупность микробиологического образования и окисления метана называют циклом Зенгена по имени микробиолога, впервые описавшего эти процессы. Наибольшая часть метана выделяется в атмосферу на континентальных экосистемах: из переувлажненных почв, мигрируя через корневую систему и стебли сосудистых растений – осоки, ка14 мыша и т. п. В качестве потенциально важного источника атмосферного метана в последние годы рассматриваются также так называемые метановые газогидраты (клатраты). По некоторым оценкам, общее содержание метана в морских газогидратах составляет 10 Тт. Квазиприродные источники метана сопряжены главным образом с сельскохозяйственным производством, например в результате деятельности микроорганизмов-метаногенов в почвах, занятых под выращивание риса, а также обитающих в пищеварительном тракте сельскохозяйственных животных и некоторых видов насекомых-фитофагов. Антропогенные источники. Заметный вклад в глобальный поток СН4 вносят свалки твердых бытовых отходов, предприятия по переработке бытовых стоков и отходов животноводства, а также иловые площадкинакопители осадков сточных вод. Антропогенная эмиссия метана связана и с добычей ископаемого топлива – угля, нефти и природного газа, а также с процессами горения как ископаемого топлива, так и сырой биомассы (степные, лесные пожары, выхлопы автомобилей). Расчет показывает, что на долю чисто природных источников СН4 приходится только 30% средней величины глобальной эмиссии, тогда как вклад квазиприродных и антропогенных составляет 43% и 27%, соответственно. Стоки метана. Стоки метана определяются двумя процессами: поглощением почвами с последующей микробиологической ассимиляцией метанотрофами и окислением в атмосфере в химических реакциях, инициируемых, главным образом, радикалами гидроксила. Общая реакция окисления метана «в чистом воздухе» приводит к образованию углекислого газа и пероксида водорода СН4 + 2НО + 2НО2• + О2 СО2 + 2Н2О2 + Н2О В присутствии оксидов азота (в загрязненном воздухе) общий результат окисления метана сильно изменяется: накапливаются озон и радикалы гидроксила - окислительный потенциал атмосферы увеличивается СН4 + 10О2 СО2 + 5О3 + Н2О + 2НО• Поскольку радикалы гидроксила образуются под действием солнечного света, окисление метана наиболее интенсивно происходит в летнее время. Этим объясняется летний минимум внутригодового хода концентраций СН4 в тропосфере. Большая часть (около 70%) эмиссии метана сейчас находится под прямым или косвенным контролем человека. Монооксид углерода атмосферы. Единственная реакция, в которую включается атмосферный СО – это взаимодействие его с радикалом гидроксила. В результате образуется СО2, однако выход других продуктов зависит от условий протекания реакции. В «чистой» атмосфере (содержание NО на уровне 10-20 трлн-1), общий итог процесса заключается в стоке радикалов СО + НО• + НО2• СО2 + H2О2. Оксид азота(1) атмосферы. В атмосферном воздухе всегда есть ок15 сид азота(1) (N2О). Естественное образование и поступление его в атмосферу, так же как и NО, NО2, происходит, главным образом, за счет процессов, связанных с грозовыми явлениями. Антропогенные источники N2О связаны главным образом с высокотемпературным окислением молекулярного азота в процессе горения различных видов топлива. Можно предполагать также, что широкое использование азотных (нитратных и аммонийных) удобрений влияет на потоки N2О из возделываемых почв. Изменениям его содержания в тропосфере соответствует небольшой, но устойчивый положительный тренд. Современный поток N2О в атмосферу оценивается как 9,0–40,5 МтN/год. Вследствие высокой химической инертности и малой растворимости в воде среднее время жизни оксида азота(1) в тропосфере равно 120–150 годам. Поэтому эта малая газовая составляющая равномерно распределена во всей толще тропосферы. Предполагается, что существует небольшой сток N2О в почву, где этот оксид поглощается некоторыми видами микроорганизмов. Однако в качестве главного стока из тропосферы рассматривают перенос в стратосферу и последующую фотолитическую диссоциацию в средних ее слоях под действием солнечной радиации с длиной волны менее 200 нм N2O + h NO + N. N2O + h N2+ O(3P).. Фторхлоруглеводороды. Считается, что фторхлоруглеводороды – исключительно антропогенные примеси атмосферы. Однако значительные концентрации фреона-11(СFС13) и фреона-12 (СF2Сl2) и некоторых других соединений этого класса были зарегистрированы в газовых выбросах действующих вулканов и в газах гидротермальных источников в сейсмически активных районах. Размеры природной эмиссии фторхлоруглеводородов до настоящего времени не определены, но, безусловно, они заметно уступают антропогенным выбросам, наиболее быстрый рост которых пришелся на 1950– 1970-е г. и связан с производством фреонов. В настоящее время считается, что практически единственным стоком галогенуглеродов служит перенос в стратосферу, где они подвергаются фотолитическому разложению СFС13 + h СFС12 +С1•. Органические компоненты атмосферы. В глобальных масштабах главный источник Сорг – это биота. Выделение органических соединений в окружающую среду, в том числе в атмосферу, характерно для всех живых организмов. Из различных источников (включая микробиологическую продукцию метана) в атмосферу ежегодно поступает 1,5–2 Гт органических соединений. Наибольшие количества Сорг выделяются растительностью континентов в виде изопрена С5Н8 и монотерпенов С10Н16. Изопрен – главный органический компонент, выделяемый многими лиственными растениями (дуб, осина, ива, тополь и др.), а терпены – преобладающие компоненты 16 летучих выделений хвойных растений. Среди компонентов, образующих «фитогенный фон» атмосферы, можно назвать многие реакционноспособные углеводороды С2–С15 (алканы и алкены), ароматические соединения и их производные: карбонильные соединения, спирты, сложные эфиры и др.; кислород-, азот- и серосодержащие органические соединения. Последние могут образовываться непосредственно в тропосфере в результате окисления углеводородов. Основная часть этих соединений в каскадных реакциях окисляется в пограничном слое атмосферы. Окисление в загрязненной оксидами азота атмосфере приводит к образованию очень токсичных вторичных загрязняющих компонентов - озона, фенолов и их производных, высоко реакционноспособных алкилрадикалов, алкилнитратов (RONO2), пероксиацилнитратов (ПАН) (RС(О)ООNО2), различных пероксидных соединений, нитрозаминов и т. д. Совместное действие ПАН, пероксида водорода и алкилпероксидов служит причиной интенсивного поражения растительности и наносит большой ущерб как естественным экосистемам, так и агрофитоценозам. Атмосферной химии производных углеводородов сейчас уделяется большое внимание. Аэрозоли – коллоидная система атмосферы Под атмосферным аэрозолем понимают коллоидную систему, образованную взвешенными в водной фазе частицами вещества с размерами, превышающими молекулярные (радиусом более 10-9 м), в дисперсной среде, представленной воздухом. То есть атмосфера Земли представляет собой гигантскую коллоидную систему с развитой межфазной поверхностью раздела и высоким значением удельной свободной энергии. Химический состав и распределение частиц аэрозоля в атмосфере зависят как от деятельности источников атмосферного аэрозоля, так и от особенностей атмосферного переноса в тех или иных регионах земного шара. В тропосфере с высотой содержание аэрозолей уменьшается. Полное обновление аэрозоля происходит примерно 100 раз в год. Тропосферный аэрозоль. По происхождению и химическому составу различают ряд аэрозолей. Океанический аэрозоль (1500 Мт/год) образуется главным образом при разрушении пузырьков воздуха на гребнях волн. В качестве превалирующего компонента содержит NаС1 со значительной примесью таких элементов как Pb, Cu, Mn, Fe, Cd, Hg, Ag, Zn. Терригенный аэрозоль (750 Мт/год) возникает при выветривании почвы и горных пород и поднятии пыли и песка пустынь, которые переносятся на тысячи километров в виде струеобразных пылевых облаков, вытягивающихся на несколько сотен километров и имеющих ширину 30–120 км. Терригенный аэрозоль содержит минералы на основе силикатов и алюмосиликатов со значительной примесью магнетита, карбоната кальция, атомы тяжелых металлов (V, Cr, Mn, Ni, Cu, Pb, Ti, Zn) и переменные количества относительно высокомолекулярных биогенных органических соединений 17 фитогенной природы, которые могут играть роль поверхностно-активных веществ ПАВ. Вулканический аэрозоль (50 Мт/год) по химическому составу близок к наиболее распространенным магматическим породам – базальтам, андезито-базальтам и андезитам. В составе пепла, особенно самых мелких его фракций, значительны примеси тяжелых металлов (в %): V, Cu, Со, Ni, W, Hg, Zn, As, Se, Sb и др. Вулканический пепел (частицы размером от 1 мкм до 0,01 мкм), образуют "скрытую массу" пепла и участвует в крупномасштабном атмосферном переносе. Изверженные породы обладают высокой каталитической активностью, сравнимой с активностью промышленных катализаторов Фишера – Тропша. Разрушение метеорного материала дает около 1Мгт/год аэрозоля. Антропогенный аэрозоль (340 Мгт/год). В число антропогенных источников включают промышленные предприятия, транспорт и различные виды деятельности, связанные со сжиганием биомассы: инициируемые человеком степные и лесные пожары, использование растительности для отопления и уничтожение огнем отходов сельскохозяйственного производства. Вторичный аэрозоль сельских и городских районов. Появление аэрозольных частиц в атмосфере может быть обусловлено не только их выбросом различными поверхностными источниками, но и образованием в результате определенных химических и физико-химических процессов из газообразных предшественников. Вторичных аэрозолей различают два: это летний (лосс-анджелесский) и зимний (лондонский) смог. Лондонский смог возникает в крупных городах при неблагоприятных погодных условиях (маловетрие), когда дым и загрязняющие вещества не могут подняться вверх и не рассеиваются. Такой смог в 1952 г. в Лондоне с 2 по 9 декабря привел к гибели более 4 тыс. человек. Лосс-анджелесский или фотохимический смог также опасен. Он возникает летом при интенсивном воздействии солнечной радиации на воздух, перенасыщенный выхлопными газами. При полном безветрии в атмосфере происходят сложные фотохимические реакции с образованием новых токсичных загрязнителей, (озона, нитриты, перекиси, альдегиды и др.). Стратосферный аэрозоль. Стратосфера Земли содержит переменные количества вещества в конденсированной фазе. Наиболее интенсивное поступление аэрозольных компонентов происходит в результате взрывных извержений вулканов. При этом формируются стратосферные вулканические облака, плотность, ширина, протяженность и химический состав которых изменяются во времени. В стратосфере вулканический диоксид серы окисляется до триоксида под действием солнечной энергии и подвергается нуклеации с образованием серной кислоты. В реакциях с участием диоксида азота происходит также образование нитрозилсерных кислот NOHSO4 и NOHS2O7. На высоте 18–20 км над уровнем моря всегда присутствует слой сернокислотного аэрозоля (капли концентрированной серной кислоты, твердые гранулы 18 сульфатов аммония) – слой Юнге. Сернокислотный аэрозоль – постоянная составляющая стратосферы Земли, определяющая в основном степень ее гетерогенности. Свойства аэрозолей. Интерес к химическому составу и физикохимическим свойствам аэрозолей связан с их участием в ряде важнейших процессов, протекающих в атмосфере. В их числе формирование радиационного режима планеты. Аэрозоли, в зависимости от размера и состава частиц, вносят существенный вклад в отражение, рассеяние и поглощение коротковолновой радиации Солнца и восходящего потока теплового излучения подстилающей поверхности. Поэтому изменение содержания взвешенных частиц в атмосфере может вызывать значительные климатические изменения. Химические процессы с участием атмосферного аэрозоля. Аэрозоли играют важную роль и в формировании гидрологического режима атмосферы. В их присутствии конденсация молекул Н2О из пара или кристаллизация воды происходит при относительной невысокой влажности. На поверхности аэрозольных частиц происходит конденсация многих других компонентов атмосферы - соединений тяжелых металлов, неорганических и органических газов и паров малолетучих соединений, которые вместе с аэрозолем попадают на подстилающую поверхность (канцерогенные полиядерные ароматические углеводороды, полихлорированные соединения различных классов – пестициды, бифенилы, дибензол-диоксины и дибензофураны). При трансграничном переносе на поверхности аэрозольных частиц во времени происходит изменение нерастворимых в воде соединений многих тяжелых металлов: за счет постепенного накопления на аэрозольных частицах кислот металлы переходят в раствор, в наиболее токсичную ионную форму. При этом оказываются на значительных расстояниях от источника выброса. В мелких фракциях аэрозолей они способны проникать глубоко в дыхательный тракт и, далее, в кровеносную систему, что очень опасно для человека. На поверхности аэрозолей могут протекать различные темновые и фотохимические реакций, скорости которых во многом определяются каталитическими свойствами поверхности. 1.2.3. Глобальные проблемы биосферы Парниковый эффект, его природа и влияние на климат В системе «атмосфера – подстилающая поверхность» циркулирует большее количество энергии, чем приходит от Солнца. Это происходит изза так называемого парникового эффекта, обусловленного присутствием в воздухе молекул, поглощающих восходящее ИК-излучение. Главным поглотителем теплового излучения Солнца и земной поверхности служит вода, присутствующая в атмосфере в виде паров и облаков. Молекулы воды почти полностью поглощают радиацию с длинами волн менее 7,6 мкм и с длинами волн более 17 мкм. Между этими границами, а также в диапазоне 3,5–4,5 мкм, находятся «окна прозрачности» в спектре поглощения водяного пара. Через них проходит менее 7% излу19 чаемой земной поверхностью радиации. Эти «окна» сужаются из-за присутствия в атмосфере молекул СО2, имеющих интенсивную полосу поглощения, закрывающую область 13,7–16,7 мкм. За период 1860–1990 г. средняя глобальная температура атмосферы увеличилась на 0,6 К, и эта тенденция сохраняется до настоящего времени. Многие исследователи считают это потепление следствием усиления парникового эффекта, главным образом, за счет накопления в атмосферном воздухе диоксида углерода. Современный положительный тренд концентраций СО2 и появление в атмосфере «избыточного» СО2 однозначно связывают с хозяйственной деятельностью человека, которая приводит к возрастающему потреблению (сжиганию) ископаемого топлива – угля, нефти и газа. Другой крупный антропогенный источник диоксида углерода – это изменение растительного и почвенного покрова континентов за счет вырубки, выжигания лесов, распашки целинных земель и общей интенсификация земледелия, приводящей к более быстрому извлечению углерода из гумуса почв, снижению продуктивности фотосинтеза. Роль парниковых газов могут выполнять любые газовые компоненты, поглощающие в «окне прозрачности» и обладающие достаточным временем жизни и концентрацией: метан, закись азота, фторхлоруглероды, атмосферные аэрозоли, причем их вклад в парниковый эффект значительно больше, чем СО2. Для многих из них наблюдается положительный временной тренд концентраций. Однако существует иная точка зрения, согласно которой наблюдаемые особенности изменения температуры находят достаточно убедительное объяснение в рамках циркуляционной гипотезы. Сторонники этой гипотезы указывают на существование периодов значительно более сильно выраженных (на 1,5–2 К) потеплений в историческом прошлом (VIII–XII вв., первая половина XVI и XVIII вв.), которые едва ли могут объясняться антропогенным воздействием. Климатологи считают значимым изменение средней глобальной температуры уже на 0,1 К, если оно сохраняется длительное время. Неконтролируемое увеличение содержания в атмосфере парниковых газов неизбежно приведет к существенным перестройкам в климатической системе Земли, влекущим за собой серьезные последствия. Проблемы озонового слоя Земли Озон постоянно образуется и разлагается в атмосфере в ходе естественных фото- и термохимических реакций. В среднем скорости его образования и разрушения уравновешены в неком циклическом процессе, который в 1930 г впервые описал Чепменом в форме следующих уравнений: О2 + h О(1D) + O(3P) O(3P)+ О2 + М О3 + М* О3 + h O2+ O(3P) О3 + O(3P) 2О2+ 392 кДж 20 Стратосферный озон регулирует поток УФ-квантов, задерживая наиболее опасную часть радиации Солнца с длинами волн менее 285 нм и значительно ослабляя излучение в УФ- диапазоне (285–315 нм). Кроме того, экзотермическое разложение озона приводит препятствует выхолаживанию нижней атмосферы за счет конвективного переноса теплоты. Глобальное распределение общего содержания озона характеризуется пространственно-временной асимметрией. В стратосфере Северного полушария содержится больше озона, чем Южного. В вертикальном направлении наибольшие концентрации озона приходятся на высоты от 15 до 40 км с максимумом при 24–27 км над экватором и 13–15 км над полярными областями обоих полушарий. Из внешних факторов, на величину общего содержания озона, более всего влияют вариации солнечной активности. В ходе 11-летнего цикла поток солнечной радиации в УФ-диапазоне существенно изменяется, что сказывается на скорости образования озона и увеличении его количества. В 1985 г. Дж. Фарман и соавт. сообщили о наблюдаемой ими сезонной убыли общего содержания озона над антарктической научной станцией Хали-Бей. Стратосферный озон в циклических процессах может разрушаться активными частицами различных химических компонентов: НО•, NО, Cl•, Вr•. Однако эти источники не создают в стратосфере концентраций, достаточных для заметного влияния на озоносферу, даже несмотря на высокую эффективность (особенно хлорного) циклов. Внимание было привлечено к хлорфторуглеродам (ХФУ) СFС1з и СF2Сl2 как к источникам хлора для этих реакций. Впервые ХФУ (хладагенты) были синтезированы в конце XIX в. Свартсом и запатентованы в начале 1930-х гг. фирмой Дюпон под названием фреонов-11 и 12 и производились в больших количествах. ХФУ, инертные в условиях тропосферы (время жизни составляет десятилетия), постепенно переносятся воздушными течениями в верхнюю атмосферу, где под действием излучения с λ=214 нм разлагаются с образованием радикала хлора СFСl3 +h .СFС1•2 + Сl• СF2С12 + h .СF2Cl• + Сl• и далее включаются в хлорный цикл разрушения озона Cl• + Оз СlO• + О2 СlO• + O(3P). Сl• + О2. Скорость взаимодействия радикалов хлора с озоном на три-четыре порядка выше, чем с активным кислородом или пероксидным радикалом. В результате цепной реакции один атом хлора способен разрушить до 100 тыс. молекул озона. Безопасные для человека они оказались опасными для озонового слоя. В отношении «озоновой дыры» над Антарктидой в настоящее время сложилось представление о том, что она возникает вследствие уникальных особенностей динамики и физико-химических процессов, отличающих стратосферу Антарктиды от высоких слоев атмосферы в других регионах 21 планеты. Однако разрушение (утончение) озонового слоя стали наблюдать над многими территориями, особенно хорошо развитых промышленных стран. Поэтому обнаружение феномена антарктической "озоновой дыры" решающим образом повлияло на принятие международных соглашений об ограничении и последующем полном прекращении производства, использования и замены ХФУ на хлорфторуглеводороды и фторуглеводороды, с подобными потребительскими свойствами, но не представляющие такой серьезной опасности для озоносферы. Кислотные дожди Одной из важных экологических проблем, с которой связывают окисление природной среды считают кислотные дожди. Производственная деятельность человека не сопровождается прямым выбросом в атмосферу сколько-нибудь значительных количеств кислот. Однако во второй половине последнего столетия резко возрос поток в атмосферу газов, выступающих в качестве прямых предшественников сильных кислот, прежде всего, оксидов серы и азота. Кроме того, увеличилась скорость образования радикалов (НО2•, RО2• и др.), являющихся ускорителями естественных процессов окисления. Все это значительно влияет на состояние среды атмосферы. «Кислотными» принято называть атмосферные осадки с водородным показателем ниже 5,6 (это рН дождевой воды). Реально водородный показатель дождевой воды, отобранной в разных районах мира, лежит в пределах 2 рН 9. Пробы дождевой воды, отобранные в Европейской части в 30-40-х годах имели рН 5,5. В настоящее время в Западной и Центральной Европе обычны дожди с рН < 5, причем до 60-65% их кислотности определяется содержанием серной и до 30-35% - азотной кислоты. В качестве основных предшественников серной кислоты и кислых сульфатов атмосферы рассматриваются выбросы диоксида серы и биогенная сера в составе диметилсульфоксида (ДМСО), высокие эмиссии последней наблюдаются при микробиологическом разложении остатков пищи в мусоронакопителях и, особенно, на свалках бытовых отходов. Здесь же выделяются и другие дурнопахнущие соединения серы: метил-, этил- и пропилмеркаптаны, диметилдисульфид, сероуглерод. Предшественниками азотной кислоты в атмосфере являются аммиак и оксиды азота(II) и (IV) (NО и NО2). Аммиак образуется главным образом при разложении биогенных азотсодержащих соединений – белков и мочевины. Источником NОx является производство электроэнергии и теплоты, химические предприятия, транспорт, лесные и степные пожары. Значительный вклад в кислотность атмосферных осадков вносят низшие карбоновые кислоты, которые появляются в атмосфере почти исключительно в результате окисления органических соединений. Окисление предшественников кислот происходит под действием радикальных частиц СНзОО•, НОО• и НО•, которые генерируются в газовой фазе атмосферы на свету SО2 + НО• + Н2О Н2S04 + НО2• 22 NО + НОО• NО2 + НО•. NО2 + НО• НNО3. Растворенные в атмосфере воды кислотообразующие компоненты выпадают с каплями дождя. Этот процесс реализуется в случае организации достаточно крупных агрегативных частиц с диаметром более 10 мкм. Другой канал стока кислотных компонентов - это сухое осаждение и сухое поглощение подстилающей поверхностью, за счет процессов адсорбции, абсорбции или хемосорбции. Интенсивность такого стока кислотных компонентов зависит от конкретных свойств подстилающей поверхности. В распространении кислотных осадков большую роль играет трансграничный перенос. В процессе перемещения воздушных масс за время переноса около 50 ч происходит постепенное окисление SO2 и NО до SO3 и NО2, которые при обводнении будут давать сильные (серную и азотную) кислоты. При этом рН осадков может составить 4,15. Эти кислые осадки выпадут далеко от источников их предшественников, а в условиях Европы - часто за пределами национальных границ стран, на территории которых происходит выброс этих предшественников. Экологические последствия кислотных осаждений. Негативные эффекты в окружающей среде, вызываемые кислотными осаждениями и фотооксидантами, заметно переплетаются и взаимно усиливаются. Закисление атмосферного воздуха приводит к деградация лесных экосистем, кислотным сдвиги в почвенных ценозах, нарушению равновесия в пресноводных экосистемах, разрушению материалов и строений, в том числе составляющих культурное наследие человечества памятников ваяния и зодчества, наконец, это прямое токсическое воздействие на людей. Все это выводит изменение окислительных свойств атмосферы в ряд приоритетных проблем эколого-химических исследований и природоохранных мероприятий. Общие потери продукции растениеводства в Западной и Центральной Европе за год составляют 1093 тыс. т, а потери лесного хозяйства – 584 тыс. м3 древесины. РАЗДЕЛ 2. ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ В ГИДРОСФЕРЕ 2.1. Физические характеристики мирового океана. Гидрологический режим океаносферы. Химический состав природных вод Под гидросферой Земли понимают прерывистую водную оболочку, образованную совокупностью океанов, морей и поверхностных вод суши (рек, озер, болот). Гидросфера включает также подземные воды, лед, снег высокогорных и полярных районов. Основная часть воды гидросферы (93%) сосредоточена в морях и океанах (океаносфере); второе место приходится на долю подземных вод (5%), и около 2% объема гидросферы образовано льдом и снегом. Поверхностные воды континентов и островов составляют всего 0,03% общего объема гидросферы. Общий объем воды, находящейся в свободном состоянии, оценивается в 1,4 млрд куб м. Мировой океан – непрерывная водная оболочка Земли, окружающая континенты и острова, занимает около 70,8% земной поверхности. Океа23 нические воды распределены между полушариями неравномерно: в Северном они покрывают 66%, а в Южном – 81% поверхности. По географическим особенностям Мировой океан делят на четыре части - четыре океана: Тихий (50% по занимаемой площади), Атлантический (25%), Индийский (21%), Северный Ледовитый океан (4%). Несмотря на обширную площадь Мирового океана, он остается лишь тонкой пленкой на поверхности Земли. Дно океана фактически не является впадиной, оно выпуклое, а не вогнутое. Чтобы оно было вогнутое, нужны глубины в 800 км и более. То, что мы называем гидросферой, в масштабах Земли представляет собой оболочку, которая на глобусе была бы не толще наклеенной на него бумаги. Гидрологический режим океаносферы складывается из теплового и водного баланса и общей циркуляции вод. Удельная теплоемкость воды в четыре раза выше теплоемкости воздуха, поэтому океаны служат крупнейшим аккумулятором поступающей к Земле солнечной радиации. Получаемая океаносферой энергия частично отражается, а остаток расходуется на испарение (около 80 %), турбулентный обмен с атмосферой и на теплообмен между поверхностными и глубинными слоями. Общепланетарная роль турбулентного обмена с атмосферой состоит в сглаживании контрастов климата за счет того, что в низких широтах на континенты поступает относительно холодный воздух, а в высоких широтах с океанов на сушу приходят более теплые воздушные массы. Среднегодовая температура поверхностных вод равна 17,5 °С, но в зависимости от широты составляет от 2,9 до 27 °С. Подавляющая часть солнечной радиации (около 94%) поглощается верхним слоем воды толщиной всего лишь 1 м, поэтому с глубиной температура понижается. Наиболее заметное уменьшение температуры происходит до глубины примерно 400 м; в слое 400–1500 м наблюдается менее крутое уменьшение (до 3–7 °С), а ниже 1500 м температура воды почти не изменяется и равна 4 °С. Водный баланс складывается из расхода воды при испарении и поступления ее с осадками и речным стоком. Океанические воды находятся в непрерывном движении, что связано с различными факторами: вращением Земли и Луны, атмосферной циркуляцией, землетрясениями и извержениями подводных вулканов и т. п. Масштабы их различны. Так приливные явления охватывают всю массу воды от поверхности до дна; а, например, ветровые волны затрагивают лишь верхний слой до глубины 50–60 м. Благодаря этим движениям происходит выравнивание гидрологических и гидрохимических характеристик океанической воды. В сравнении с атмосферой, круговорот в океаносфере происходит гораздо медленнее: время полного перемешивания воды оценивается примерно в 1600 лет. Химический состав природных вод Морская вода представляет собой сложный комплекс минеральных и органических компонентов и растворенных газов. Химический состав воды определяется совокупностью геохимических и биологических процес24 сов. Солевой состав. Вода поверхностного континентального стока постоянно привносит в океаны минеральные компоненты. В результате в океане накопилось огромное количество солей – 4,7 107 Гт. Основные из них NaCl, MgCl2, MgSO4, CaSO4, K2SO4, CaCO3., а также элементы Вr, F, В и Sr. По составу минеральных компонентов океанические воды очень однородны. В открытых частях океанов массовое содержание солей в среднем составляет 34,7 %0 (32,0–37,5 %о). Между основными химическими элементами морской воды существует довольно строгая связь, выражающаяся законом Дитмара (1884): в воде открытых районов океана соотношения между главными компонентами основного солевого состава постоянны и не зависят от их абсолютных концентраций. Растворенные газы. Содержание растворенных газов (определяется законом Генри) в разных частях Мирового океана значительно варьирует, и зависит от деятельности внутренних источников (продукции и потребления газов морской биотой), температуры и процессов межфазного распределения. Концентрации газов, активно участвующих в биотических процессах (СО2, О2, СH4, Н2S), часто значительно отклоняются от равновесных. Диоксид углерода при растворении в воде образует угольную кислоту, содержание которой составляет около 1% от равновесной концентрации СО2. Содержание карбонатных компонентов может быть выражено в виде суммы ΣCО2 = [СО2 + Н2СО3] + [НСО3-] + [СО32-]. Продукты диссоциации и взаимодействия с некоторыми другими компонентами воды создают буферную карбонатную систему со слабощелочной (рН 7,6-9,0) реакцией. Источником неорганического углерода для океаносферы служит речной сток, приносящий карбонаты и силикаты. Поведение последних зависит от содержания в морской воде СО2. При достаточно высокой концентрации диоксида углерода карбонаты и силикаты кальция растворяются с образованием гидрокарбонатов СаС03 + С02 + Н20 Са2+ + 2НС03- Са(НС03)2; СаSi03 + С02+ Н20 Si02+НС03-+Са2++Н0-. Из приведенных уравнений видно, что Мировой океан может служить буферной системой, регулирующей содержание СО2 в атмосфере. Метан. Из других соединений углерода в наибольших количествах в морской воде содержится метан. В открытых районах океана поверхностные воды содержат метан в концентрациях близких (несколько ниже) к равновесным, тогда как во внутренних морях и водах прибрежных районов часто наблюдается превышение равновесных концентраций на 30–80%. На больших глубинах в насыщенных сероводородом водах концентрации метана на несколько порядков выше равновесных. Однако в самых верхних горизонтах концентрации падают до значений ниже равновесных, вследствие биохимического окисления поднимающегося из зоны анаэробного синтеза метана метанотрофными микроорганизмами. Органическое вещество морской воды. Кроме метана в Мировом 25 океане содержатся переменные количества многих других органических соединений. По своему происхождению они делятся на автохтонные, образовавшиеся непосредственно в океане, главным образом, в результате биологических процессов, и аллохтонные (от греч. аллос – чужой), поступающие в океаносферу из других источников, включая антропогенные. Основным источником органического вещества морской воды служат автотрофные (фото- и хемосинтезирующие) организмы - фитопланктон и некоторые виды бактерий. В совокупности они образуют начальное звено трофической цепи Мирового океана. Общая первичная продукция фитопланктона оценивается величиной 44 Гт С/год, что составляет примерно 32% от продукции органического углерода (Сорг) растительным покровом континентов (141,1 Гт С/год). В ходе этого процесса из морской воды извлекаются огромные количества растворенного СО2 и выделяется свободный кислород. Органическое вещество подразделяют на растворенное, содержащееся в составе взвесей и в составе донных отложений. Общее содержание органического углерода, накопленного в донных отложениях за время послеледникового периода (голоцена), составляет примерно 2,2•103 Гт. Возвращение этого углерода в глобальный круговорот может происходить только через многие миллионы лет. Поверхностные пресные воды в отличие от морской, содержат солей не более 1%. Запасы пресной воды сосредоточены в реках, озерах, в подземных горизонтах и составляют менее 1% от мирового объема вод, причем 2/3 ее сосредоточено в ледниках Антарктиды, Гренландии, айсбергов и относятся к потенциальным ресурсам. Уникальное хранилище пресной воды оз. Байкал. Он содержит воды в 11 раз больше, чем во всех реках мира – 23 тыс. куб. км, причем пресную воду самого высокого качества. Озеро образовалось в тектонической впадине, которая продолжает расти. Пресная вода в природе никогда не бывает химически чистым веществом. Она универсальный естественный растворитель, поэтому содержит множество других веществ и газов (O2, CO2, N2), катионы Na+, K+, Mg+, Ca+; анионы Cl-, SO32-, HCO3-), взвешенные частицы. Подземная гидросфера включает воды, находящиеся в верхней части земной коры: в порах, трещинах, пещерах, пустотах и др. Они могут находиться в жидком, твердом и газообразном состоянии. Подземные воды имеют различную температуру, отвечающую температуре ее вместилищ. Если же она находится вблизи магматических очагов, то при выходе на поверхность Земли представляет собой горячие источники и гейзеры. Проходя сквозь горные минеральные породы, вода частично их растворяет, в результате чего содержание минеральных веществ (солей калия, натрия, железа и др.) и газов (сероводорода, углекислого газа) в таких водах значительно повышается. Многие из таких минеральных вод используются как лечебные. 26 2.2. Антропогенное загрязнение вод мирового океана. Трансформация и опасность загрязнителей в гидросфере Антропогенное загрязнение вод мирового океана. В водные экосистемы поступают загрязняющие вещества как природного, так и антропогенного происхождения. Загрязняющие вещества природного происхождения поступают из почв и горных пород в результате микробиологического выщелачивания минералов с паводковыми и дождевыми водами, а также при осаждении из атмосферы пылевых частиц и аэрозолей. Значительный вклад в загрязнение водных экосистем вносит деятельность человека. Основной причиной современной деградации природных вод Земли является антропогенное загрязнение. Его источниками служат: – сточные воды промышленных предприятий (предприятия энергетики, горнодобывающая и перерабатывающая химическая промышленность); – сточные воды коммунального хозяйства городов и населенных пунктов (они составляют 20% стоков); – стоки систем орошения, поверхностные стоки с с/х полей; – атмосферные выпадения загрязнителей на поверхность водоемов, ливневые стоки, которые приносят техногенные терраполлютанты. В поверхностных водах континентов обнаружены многие тысячи органических соединений. Часть из них относится к категории автохтонных, появляющихся в воде в результате естественных биологических процессов. Эти вещества легко подвергаются биодеградации; их присутствие не ухудшает качества вод и не представляет опасности для живых организмов, гидробионтов и обитателей суши. Однако огромное множество органических компонентов поверхностных вод относится к числу загрязняющих. Органические соединения аллохтонного происхождения составляют группу приоритетных токсикантов. Около 60% приоритетных загрязняющих компонентов относится к хлор- и бромсодержащим соединениям. Они отличаются высокой персистентностью и липофильностью, поэтому происходит их накопление в водных экосистемах и биоаккумулирование. В воде рек густонаселенных районов постоянными примесями сейчас являются нефтепродукты, алкилфенолы, жирные кислоты и их эфиры, эфиры фталевой кислоты и диэтиловые эфиры двухосновных алифатических карбоновых кислот (пластификаторы и стабилизаторы пластмасс и резиновых изделий). Токсичность некоторых органических примесей проявляется поразному в зависимости от содержания в воде гумусовых соединений, которые образуют ассоциаты с этими соединениями и содержание в воде свободно растворенных ПАУ уменьшается. Кроме химического загрязнения водоемов определенное значение имеют также механическое, термическое и биологическое загрязнения. Таким образом, антропогенное загрязнение гидросферы приобрело в настоящее время глобальный характер и существенно уменьшило доступные эксплуатационные ресурсы пресной воды на планете. Биосфера защищает свое естественное состояние за счет глобального 27 круговорота воды – испарения – конденсации – выпадения осадков. В процессе круговорота происходит очистка воды. Поведение загрязняющих веществ в водной среде и химические процессы в природных водах. В условиях активной антропогенной деятельности загрязнение природных вод тяжелыми металлами стало особой проблемой. В эту группу «тяжелых металлов» кроме свинца, ртути и кадмия сейчас включают и другие элементы: серебро, олово, сурьма, барий, талий, алюминий, мышьяк и др., которые токсичны во всех своих формах в щелочных, кислых, и нейтральных растворах. Химические реакции в гидросфере. Наиболее важными химическими процессами, протекающими в водной среде с металлами являются: окиcление, восстановление, гидролиз и комплексообразование. Окисление. В окислении и восстановлении лидирующая роль в водных экосистемах принадлежит энзиматическим реакциям, протекающим в клетках водных микроорганизмов (микробиозонтоса). В условиях нормального содержания кислорода в воде металлы окисляются до максимальной степени окисления, которые последние плохо растворимы в воде и могут выпадать в осадок, снижая, таким образом, токсичность и загрязненность воды. В отсутствии кислорода протекают биохимические процессы, которые снижают окислительный потенциал системы и протекает обратная реакция, в результате чего резко возрастает токсичность вод. Гидролиз. Растворение солей металлов чаще всего сопровождается гидролизом. Это химическое взаимодействие ионов соли с ионами водорода или гидроксилами воды, что приводит к сдвигу химического равновесия – изменению концентрации ионов. Комплексообразование. Гидролитические процессы приводят к образованию моно- и полиядерных гидроксокомплексов типа [Ме(ОН)]+, [Ме(ОН)2], [Ме2ОН)]3+, [Ме2(OH6]2-. Лигандами в комплексах могут быть не только анионы гидроксила, но и молекулы воды [Ме(H2О)6]2+ или другие доступные в данной среде анионы [Ме(НСО3)+, [Ме(СО3)], [Ме(H2O)5Cl]+. Интенсивность этих процессов связывания ионов металлов зависит от общей концентрации атомов металлов в воде, рН среды и конкурирующих процессов. Это процесс приводит к увеличению растворимости металлов. В качестве комплексообразователей могут выступать растворенные в воде органические соединения - гуминовые и фульвокислоты, аминокислоты и белковоподобные вещества и углеводы. Ионы металлов могут быть включены в состав неорганических полифункциональных сорбентов – взвесей и коллоидов. В результате ряда химических и микробиологических процессов ртуть, свинец, олово, сурьма, мышьяк, селен в водных экосистемах подвергаются полному или частичному метилированию. В частности, двухвалентные ионы ртути превращаются в ионы метилртути СН3Hg и в гидрофобную и летучую диметилртуть (СH3)2Hg. Из-за способности легко преодолевать различные физиологические барьеры (плацентарный, гемато28 энцефалический и другие гистогематические барьеры), эти формы ртути наиболее опасны для животных. Эвтрофирование водных экосистем Несмотря на остроту проблемы загрязнения поверхностных вод химическими соединениями-токсикантами, основную угрозу для водных экосистем несет все же антропогенное эвтрофирование. Обычно выделяют три трофических состояния: олиготрофное, трофное и эвтрофное. В этой последовательности отражается увеличение содержания в экосистеме биогенных элементов и повышение биопродуктивности. Даже естественное эвтрофирование со временем неизбежно приводит к гибели водоема. Однако этот процесс может занимать десятки тысяч лет и более. Хозяйственная деятельность резко ускоряет процесс. Связано это с накоплением в водных экосистемах биогенных элементов – азота, фосфора, серы, железа, калия, кремния и др. Решающую роль в эвтрофировании играет, очевидно, фосфор, главными доступными для водных растений его формами этого стали полифосфатные ионы, например трифосфаты (РзО105-), одним из источников которых являются синтетические моющие средства. Последствием эвтрофирования водоемов является возникновение анаэробных зон (заморы), «цветение» воды, исчезновение многих биологических видов, включая ценных промысловых рыб. РАЗДЕЛ III. ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ В ПЕДОСФЕРЕ 3.1. Строение, химический состав земной коры и процессы ее трансформации Самая верхняя из твердых оболочек нашей планеты носит название земной коры; вместе с верхней мантией она образует литосферу. Земная кора, образующая верхнюю часть литосферы, слагается в основном из восьми химических элементов: кислорода, железа, кремния, магния, алюминия, кальция, натрия, калия. Половина всей массы коры приходится на кислород, который содержится в ней в связанных состояниях, в основном в виде оксидов металлов. В земной коре обнаружено около трех тысяч видов минералов, однако, примерно на 90% ее масса состоит из силикатов и алюмосиликатов. Для характеристики распространенности химических элементов в земной коре используют понятие кларка – среднего значения относительного содержания химических элементов. Различия в кларках химических элементов очень велики. Условно элементы делят на две группы: главные, с содержанием не менее 0,1% (самостоятельные химические соединения – минералы) и рассеянные – менее 0,1%. Особенность распределения рассеянных элементов в земной коре заключается в их способности образовывать скопления (месторождения), в которых их содержания в сотни и тысячи раз превышают кларковые. Среднее содержание рассеянного химического элемента в данном регионе формирует его геохимический фон. Участки с повышенной, по сравнению с региональной, концентрацией элемента называют геохимическими 29 аномалиями. Часто они связаны с залежами руд, окруженными ореолами рассеяния, как главных рудообразующих элементов, так и элементовспутников. Важной составляющей литосферы являются подземные воды. Вода присутствует в земной толще как в свободном виде, так и в связанной форме, а также в различных агрегатных состояниях: в виде паров, жидкости и льда. Подземные воды представляют собой сложную физикохимическую систему, находящуюся в динамическом равновесии с вмещающими породами. Основной объем подземной гидросферы приходится на долю соленых (минерализация до 35 г/л) и рассольных хлоридных вод (до 500–600 г/л), а также солоноватых вод (до 10 г/л). Среди них различают гидрокарбонатные, сульфатные и хлоридные воды. По мере увеличения глубины залегания в подземных водах увеличивается концентрация газов глубинного генезиса (СО2, Не, СН4 и др.). В литосфере Земли кроме растворенных в подземных водах содержатся большие количества других газообразных компонентов. Это свободные газы микротрещин и пор, а так же сорбированные минералами и горными породами С02, СН4, N20, Н2, НС1, HF, Н2S. Процессы трансформации земной коры под действием внешних и внутренних факторов Земная кора постоянно подвергается воздействиям как внутреннего (эндогенного), так и внешнего (экзогенного) характера. Движущей силой эндогенных процессов является внутренняя энергия Земли, под действием которой происходит перемещение огромных масс вещества, фазовые переходы, циркуляция тепловых потоков и электрических токов. Глубинные эндогенные процессы определяют, в частности, тектонику земной коры вертикальные и горизонтальные перемещения отдельных ее участков и блоков. Внешние, экзогенные факторы, воздействующие на земную кору, - это лунно-суточные приливные движения, проявляющиеся в изменении уровня подземных вод; это взаимодействие с ионосферой Земли, индуцирующее электрические токи в глубинных слоях планеты; это процессы выветривания горных пород, изменение рельефа реками, движущимися ледниками и т. д. Поверхность континентов покрыта продуктами гипергенеза горных пород. Это минералы глин – каолинит, монтмориллонит, метагалаузит, гидрослюды. Эта внешняя оболочка литосферы суши мощностью от десятков сантиметров до десятков и даже сотен метров служит главным источником рассеянных химических элементов, циркулирующих в биосфере. Такое преобразование сопровождалось высвобождением (выщелачиванием) рассеянных химических элементов и их переходом в гидросферу. Химическое выщелачивание обусловлено тем, что стекающие со склонов вулканов и содержащие минеральные кислоты (H2SO4, НСl, HF) воды уносят с собою большие количества рассеянных элементов. Заметную роль в разрушении некоторых типов минералов на дневной поверхно30 сти играют фотохимические процессы: минералы многих тяжелых металлов образованы их сульфидами, являющимися полупроводниками n-типа, которые легко подвергаются разрушению под действием солнечного света. Под действием света на поверхности таких минералов возникают носители зарядов - фотоэлектроны и дырки. Фотохимическое разрушение сульфидов может быть описано в общем виде следующими реакциями МеS + hMeS((е-, h+) МеS + 2h+* Ме2 + S° МеS + 2е- Ме° + S2-. Биологическое выщелачивание рассеянных элементов и включение их в миграционные процессы происходит при активном участии живых организмов. Более других древесные растения, извлекают с помощью корневой системы из глубин рудные элементы, включая тяжелые металлы. Последующее разложение лиственного опада и мертвой древесины приводит к обогащению поверхностного слоя почвы этими элементами. Следовательно, можно говорить о функционировании своеобразного геохимического, а точнее биогеохимического насоса, благодаря которому на поверхности зачастую образуются геохимические аномалии. Кроме того, в результате разложения растительного опада образуются водорастворимые кислые метаболиты и гумусовые кислоты, которые легко выщелачивают слабосорбированные на дефектах кристаллов элементы, разрушают различные минералы, растворяют различные соли. Их способность растворять сульфиды тяжелых металлов изменяется в ряду Ni < Zn < Cu < Со < Mn. Иной порядок изменения растворимости в присутствии гумусовых соединений карбонатов этих же металлов: Mn < Cu< Zn < Ni < Co. Микробиологическое выщелачивание. Скорость его примерно в 1000 раз превышает скорость химического разрушения минералов и горных пород. Этот процесс осуществляется высокоспециализированными тионовыми бактериями рода Thiobacillus, которые, используя в качестве источника энергии реакцию окисления серы, разрушая железосодержащие сульфидные минералы (пирит Fe2S, халькопирит CuFeS2, арсенопирит FeAsS). Антропогенные факторы. Мощным экзогенным фактором, воздействующим на земную кору, стала в настоящее время деятельность человека, связанная с добычей полезных ископаемых (нефти, газа, угля, руд) и воды для питьевого водоснабжения. Следствием этого являются индуцированные землетрясения с магнитудой до 7–8 баллов. Образование депрессионных воронок наблюдается под крупными городами как в результате увеличения механической нагрузки на подстилающие породы, так и вследствие интенсивного использования подземных вод для нужд населения и промышленных предприятий. Особенно сильное влияние на геодинамические и гидрологические процессы оказывают подземные ядерные взрывы. Планетарный почвенный покров В наибольшей степени человеческая деятельность влияет на состояние самого верхнего горизонта твердой Земли - ее педосферы (почвенный покров). Почва рассматривается как особое природное тело, играющее 31 ключевую роль в глобальных биогеохимических процессах. По отношению к литосфере она служит защитным слоем, замедляющим эрозию. С другой стороны, в ней наиболее активно происходит изменение минералогического и гранулометрического состава подстилающих горных пород. Через почву осуществляется газовый обмен между атмосферой и земной корой, атмосферой и подземной частью гидросферы. Огромное значение почвенных растворов в формировании состава природных вод было отмечено еще В. И. Вернадским. Минералогический состав почвы, во многом определяющий ее плодородие, варьирует в широких пределах. Подавляющее большинство элементов находится в ней в окисленном состоянии. В состав твердой части почвы входят также переменные количества органического вещества, основная часть которого представлена сложным комплексом гумуса – гуминовых и фульвокислот и их комплексов с металлами. Гуминовые и фульвокислоты образуются при микробиологическом (биохимическом) разложении растительных остатков. В силу высокой гетерогенности почв в них формируются многочисленные экологические ниши для самых разнообразных организмов. Поэтому живое население почв характеризуется наибольшей плотностью, а сама почва как биокосное образование – высочайшей биогеохимической энергией. Переработка и деструкция растительных остатков происходит главным образом в верхних горизонтах почвы. В этой переработке участвуют многочисленные беспозвоночные (почвенная мезофауна) и микроорганизмы. В почвенной среде одновременно протекают разнообразные процессы взаимодействия между твердыми и газообразными фазами почвы, живым веществом и почвенным раствором, от которых зависит доминирующая форма содержания элемента и характер его распределения между фазами. Знание доминирующей реакции и формы соединения позволяет прогнозировать миграцию как природных, так и техногенных элементов между компонентами биосферы. Химические свойства элементов играют ведущую роль при миграции в земной коре, причем важное значение имеет растворимость соединений главных элементов литосферы. Таким образом, педосфера предстает как полифункциональная и интерактивная система. В отличие от других внешних геосфер (атмосферы и гидросферы), она не обладает свойствами быстрого рассеяния попадающих извне загрязняющих компонентов. Кроме того, формирование ее занимает тысячи и десятки тысяч лет. Поэтому почвы относятся к очень уязвимым и практически невозобновимым ресурсам нашей планеты. Геохимия загрязнителей и деградация наземных экосистем Сильнейшее влияние на химический состав почв оказывает современное сельское хозяйство, широко использующее удобрения и пестициды. При этом количество веществ, вовлекаемых в круговорот в процессе сельскохозяйственной деятельности, измеряется величинами того же порядка, что и в процессе индустриального производства: ежегодно на поля посту32 пает около 40 млн т удобрений и 4 млн т ядохимикатов. Удобрения - органические и минеральные вещества, содержащие элементы питания растений (в основном N, Р, К), – порождают экологическую тревогу там, где их применение не сбалансировано или выполняется с нарушением показаний и регламента. Большую опасность удобрения могут представлять для водных экосистем, когда при неправильном хранении или использовании, они в больших количествах попадают в водоемы. В этом случае их рассматривают как поллютанты. Наличие нитратов в продуктах опасно, так как в организме избыточные нитраты не успевают выводиться или расходоваться на синтез биомолекул (белков, аминокислот), а превращаются в токсичные нитриты. Верхняя граница нормы нитратов на одного человека в день, установленная Всемирной организацией здравоохранения, равна 325 мг. Пестициды в силу обстоятельств находят широкое применение, среди них особенно инсектициды и гербициды. Они являются сильно действующими биологически активными веществами и представляют серьезную опасность для биосферы и человека. Несмотря на то, что активно разрабатываются новые экологически безопасные методы борьбы с вредителями сельского хозяйства, без пестицидов человек пока не может обойтись. Только у нас в стране они помогают сохранить 18–20 % урожая. Наиболее стабильны в природе (в течение нескольких лет) хлорорганические пестициды. Они способны благодаря своей высокой персистентности накапливаться в пищевых цепях. Селективное поглощение n,n'дихлордифенилтрихлорэтана (ДДТ) и родственных ему соединений (альдрина, линдана и др.) гидробионтами из воды приводит к тому, что организмы, находящиеся на конце пищевой цепи, могут накопить пестициды в очень высокой концентрации, что очень опасно для человека. К антропогенным факторам, приводящим к нарушению и деградации почвенного покрова, в первую очередь относятся кислотные осаждения и выпадение из атмосферы загрязняющих компонентов. Деградация почв происходит также при прямом хозяйственно-бытовом воздействии, таком как ее вспашка, выпас скота, строительство, складирование мусора и т. п. Немалый урон наносится им в результате военных действий и учений. Производственная деятельность человека сопровождается мощным разрушением почвенного слоя: это огромные площади, занятые городами, горнопромышленными разработками, расширение селитебных зон, промышленного и гидротехнического строительства, кроме того, огромный ущерб наносит загрязнение почв, связанное с загрязнением атмосферы и вод. Так, например, за период с 1870 по 1970 г. на земную поверхность осело 20 млрд т шлаков и 3 млрд т золы. В результате бессистемного использования земель за всю историю цивилизации около 2 млрд га продуктивных земель превратилось в пустыни. К особо опасным последствиям отрицательного воздействия человека на почвы относится их ускоренная эрозия. Естественная эрозия протекает очень медленно, и процессы вымывания и выдувания почв уравновешиваются естественным почвообразованием. При ускоренной эрозии разруше33 ние почвы происходит во много раз быстрее естественных процессов ее восстановления. Таким образом, почвы это ценнейшие природные ресурсы, возникшие в естественных условиях, в результате взаимодействия биотических и абиотических компонентов среды. Обрабатываемые пахотные земли сформировались за счет многовекового труда людей. Качество почв зависит от длительности возделывания земли и культуры землепользования. Пополняя в почве запас веществ, вынесенных с урожаем, соблюдая последовательность культур в севооборотах, обрабатывая почву, человек способен сохранять и повышать ее плодородие. РАЗДЕЛ IV. МИГРАЦИЯ ЗАГРЯЗНИТЕЛЕЙ В БИОСФЕРЕ. ЗАКОНЫ ЖИЗНЕДЕЯТЕЛЬНОСТИ БИОСФЕРЫ - ОСНОВА СУЩЕСТВОВАНИЯ ТЕХНОСФЕРЫ. Миграция загрязнителей в атмосфере. Благодаря циркуляционным процессам в тропосфере, глобальным вертикальным и горизонтальным перемещения в стратосфере осуществляется не только тепловой обмен, круговорот воды, но и усредняется состав основных компонентов воздуха, трансграничный перенос пылевых частиц и загрязнений, то есть оказывается глубокое влияние на климатические условия планеты и жизнедеятельность организмов. Миграция загрязнителей гидросфере. Химические свойства элементов и соединений играют ведущую роль в водной миграции и миграции в земной коре, при этом важное значение имеет растворимость соединений главных элементов литосферы. Выделяют три формы, в которых атомы тяжелых металлов мигрируют в водных средах: истинно растворенная, взвешенная и коллоидная. Их существование определяется совокупностью различных факторов и процессов (химических и биотических, гидрологических и гидродинамических). Биодоступность и токсичность тяжелых металлов зависит от их формы существования. Наибольшая токсичность в отношении пресноводных гидробионтов присуща свободным (точнее, гидратированным) ионам металлов и их гидроксокомплексам, а также элементорганическим соединениям. Это связано с легкостью их проникновения через клеточные мембраны. В природных поверхностных водах высокой цветности в качестве основных миграционных форм выступают комплексы с гумусовыми компонентами. В жесткой воде образуются в меньшей степени доступные живым организмам карбонатные комплексы. Миграция загрязнителей в почве. Почва – открытая подсистема в геохимическом ландшафте, потоки вещества и энергии в которой связаны с приземной атмосферой и растительностью, с поверхностными и почвенно-грунтовыми водами. Почвы регулируют процессы миграции веществ в ландшафтах. Химическая обстановка гипергенной миграции элементов, в первую очередь, характеризуется значениями рН и окислительновосстановительного потенциала (Еh) среды миграции. Почвы регулируют процессы миграции веществ в ландшафтах, прояв34 ляя буферность в отношении загрязняющих веществ; кислые почвы могут нейтрализовать щелочные соединения, карбонатные – нейтрализовать кислые выпадения. Благодаря наличию карбоксильных групп, фенольных гидроксилов и аминогрупп кислоты почвенного гумуса способны к реакциям ионного обмена, в ходе которых образуются растворимые и нерастворимые соединения – гуматы и хелаты. Комплексные соединения ионов рассеянных элементов и фульвокислот относительно хорошо растворимы и поэтому легко включаются в водную миграцию. Химические свойства элементов играют ведущую роль при миграции в земной коре, причем важное значение имеет растворимость соединений главных элементов литосферы. Химические соединения с ионными связями в водных растворах диссоциируют и тогда мигрируют в форме ионов. Соединения с ковалентными связями, хотя и хорошо растворимы в воде, слабо диссоциируют в водных растворах и мигрируют в виде комплексных ионов: [CO32-], [SO42-], [PO44-], [ SiO43-], [HCO3-]. С ионами группы переходных элементов анионы поверхностных вод образуют комплексные соединения, что способствует повышению растворимости большинства металлов, это играет важную роль в геохимической миграции тяжелых металлов, в том числе свинца, ртути, кадмия, олова. Так, например, растворимость ртути значительно возрастает вследствие образования устойчивых комплексов HgC142-, HgOHCl0, ртутьорганических комплексов. Химическая обстановка гипергенной миграции элементов, в первую очередь, характеризуется значениями рН и окислительновосстановительного потенциала (Еh) среды миграции. Важную роль в процессах геохимической миграции химических элементов играют алюмосиликатные и органические коллоиды, имеющие отрицательный заряд и обладающие значительной способностью к сорбции катионов калия, бария, никеля, кобальта, меди, цинка, магния, золота, вольфрама, аммония, натрия. Коллоиды гидроксидов железа адсорбируют анионы фосфорной кислоты, ванадия, мышьяка. Таким образом, в обмене веществом между геосферами земли значительную роль играют процессы миграции. Если в миграционные процессы включаются антропогенные загрязняющие вещества – токсиканты, то они способны оказать сильное негативное влияние на биотическую составляющую природной среды. Их интенсивное поступление влечет за собой исчезновение популяций организмов и даже целых видов, что обычно оказывается первым этапом глубокой перестройки и последующей необратимой деградации экосистем. Знание доминирующей реакции и формы загрязняющего вещества позволяет прогнозировать миграцию как природных, так и техногенных элементов между компонентами биосферы. ГЛАВНЫЕ ПОСТУЛАТЫ И ЗАКОНЫ ДЕЯТЕЛЬНОСТИ БИОСФЕРЫ И РАЗВИТИЯ ТЕХНОСФЕРЫ Поверхность планеты – верхний слой земной коры, гидросферу, ниж35 ний слой атмосферы объединяют под названием географическая оболочка. Именно она стала местом возникновения жизни и эволюции разнообразных ее форм, получив название биосфера. По Вернадскому (1914) биосфера – это системное образование, геологическая оболочка Земли, звено космического масштаба. Это глобальная экосистема – область жизни, включающая все организмы и их остатки, следы их жизнедеятельности и среду их обитания, которая возникла около 4 млрд лет тому назад. Существование биосферы обеспечивается ее свойствами и подчиняется фундаментальным законам диалектики и естествознания, то есть определенным закономерностям, которые формулируются в виде постулатов. В мире действует закон всеобщей связи вещей и явлений в природе и обществе, который в экологии известен как принцип целостности (холизм). В живой природе тотальность (всеобщность, целостность) связей проявляется ярко. Живые системы, объединенные материальным единством жизни (физическое и химическое единство живого вещества), отличаются разнообразными и интенсивными превращениями вещества, энергии и информации. Они образуют сложные экологические сети взаимодействий. Множественность связей, которые просматриваются на уровне микромезо-, макроэкосистем, на уровне биосферы выглядят грандиозно: это глобальные потоки энергии и круговороты вещества, ветры, океанические течения, реки, трансконтинентальные и трансокеанические миграции птиц и рыб, переносы семян и спор, деятельность человека и влияние антропогенных факторов. И все это связывает пространственно удаленные природные комплексы и придает биосфере признаки единой коммуникативной системы. Совершенно естественно, что возмущение в одной части этой сложной системы неизбежно вызовет изменения в других ее частях, которые должны привести к нейтрализации исходного воздействия или при превышении его порога к еще большей деформации системы. В экологии эту зависимость называют законом цепных реакций. Закон всеобщей связи вещей и явлений утверждает: «Любая система может развиваться только за счет использования материально-энергетических возможностей окружающей ее среды. Абсолютно изолированное саморазвитие невозможно». Отсюда следует, что любая система может реализоваться только за счет использования материально-энергетических и информационных возможностей окружающей ее среды – изолированное развитие невозможно. Значительное увеличение каких-либо организмов или возникновение каких-либо систем за относительно короткий промежуток времени может происходить только за счет уменьшения числа других организмов или каких-либо ресурсов. В биосфере действует универсальный закон сохранения массы вещества, который отражает одно из важных требований рационального природопользования. В целом в биосфере существует равенство скоростей синтеза и распада и реализуется высокая степень замкнутости круговорота 36 веществ. Деятельность человека приводит к нарушению этой замкнутости. В биосфере появились высокие концентрации веществ, синтезированных человеком (ксенобиотиков), чуждых химизму живых организмов. Часть антропогенных веществ доступна для усвоения различным формам организмов, но большинство не включаются в метаболизм природой, и в результате оказывают вредное воздействие на окружающую среду. Формирование техносферы происходит за счет потенциальных возможностей биосферы в соответствии с законами развития последней и, в первую очередь, с законом сохранения энергии и массы вещества. Развитие регионов техносферы происходит, как правило, высокими темпами, в режиме разрушения биоты. Во многих случаях биота оказывается полностью вытесненной (промышленные площадки, заводские территории, полигоны, аэродромы и т.д.), а в городах – сохраняется лишь в виде отдельных очагов (скверов, газонов, садов, парков и т.д.). В современных городах под постройками и транспортом находится до 80%, а на долю зон отдыха и зеленых насаждений приходится не более 20% территории города Такое соотношение очень опасно, поскольку устойчивые процессы в биосфере сохраняются при отклонениях менее 1% от положения равновесия. Отклонения в содержании веществ и передачи энергии, равные 1%, соответствуют началу выхода системы из устойчивого состояния, а при отклонениях более 10% системы попадают в ситуацию саморазрушения. Принято считать, что неустойчивые процессы в биосфере возникают в соответствии с «правилами 1 и 10%» (точка Пастера). Для длительного сохранения биоты в зоне города необходимо, чтобы доля застройки и транспортных магистралей не превышала 50%. Неукротимая мощь развивающейся техносферы, ее производственная и энергетическая оснащенность представляет серьезную угрозу для биосферы, для условий существования человека. Согласованное развитие общества (техносферы) с интересами природной среды, законами биосферы становится жизненно необходимым. 6.3. Краткое описание практических занятий 6.3.1. Перечень практических занятий 1. Расчет плотности воздуха и перепада давления с высотой в атмосфере. 2. Влияние альбедо на тепловой баланс атмосферы. 3. Расчет времени разрушения оксидов азота в атмосфере. 4. Расчет выбросов газообразных веществ при аварийных ситуациях. 5. Расчет числа молекул токсичных веществ в воздухе рабочей зоны при возникновении внештатных ситуаций. 6. Расчет числа частиц пыли в воздухе рабочей зоны в штатном режиме работы предприятия. 7. Расчет площади осаждения аэрозолей. 37 8. Расчет скорости образования и гибели атомарного и опасности фреонов для озонового слоя. 9. Защита рефератов. 10. Расчет состава природных и сточных вод. 11. Оценка кислотно-основного равновесия в природных водоемах. 12. Определение окислительно-восстановительных свойств природных и сточных вод. 13. Защита рефератов. 14. Расчет гранулометрического состава 15. Расчет содержания соединений азота в почвах. 16. Защита рефератов. 17. Определение порозности, аэрируемости, содержания кислорода в почвах. Общие требования к отчетным материалам практических занятий По каждому практическому занятию оформляется отчет по форме: 1. 2. 3. 4. 5. 6. Отчет по практическому занятию (указываются порядковый номер работы и название работы) Цель и задачи работы (условия задания). Краткое теоретическое обоснование расчетов (выполняется как самостоятельная работа дома по материалам [1] и нормативным документам). Расчеты. Результаты расчетов, представленные в виде графиков и таблиц. Выводы по работе. Письменные ответы на контрольные вопросы (самостоятельная работа). 6.4.2. Методические указания по выполнению заданий на практических занятиях На практических занятиях студент после получения задания должен ознакомиться с теоретической частью работы, разобрать алгоритм решения задания, решить заданную задачу и оформить отчет. Практическое занятие 1. Расчет плотности воздуха и перепада давления с высотой в атмосфере. Цель занятия: научиться использовать газовые законы, освоить расчеты определения давления в атмосфере. Задание Рассчитать плотность воздуха на высоте: 20 и 30 км используя рис. 3.2 [1] и алгоритм решения задания, представленный ниже. Определить перепад давления в слое 20–30 км. Алгоритм решения задания Задача Рассчитать плотность воздуха на высоте 10 км, используя рис. 3.2 [1]. Решение 38 Плотность воздуха (, кг/м3) рассчитывается из формулы Р = RT/М, откуда следует, что = РМ/ RT, где Р – давление на высоте 10 км, согласно условию задачи оно равно 4 10 Па (из рис. 3.2. [1]); М – молекулярная масса воздуха – 29 кг/кмоль; R – универсальная газовая постоянная, равная 8,31·103 Дж/кмоль.К; Т – температура по Кельвину, она равна 220 К (рис. 3.2. [1]). = 29·104 / 8,31 103·220 К = 29·104/ 1828,2·103 = 0,158 кг/м3 Ответ: плотность воздуха на высоте 10 км составляет 0,158 кг/ м3. Практическое занятие 2. Оценка влияния альбедо на тепловой баланс атмосферы. Цель работы: Научиться оценивать влияние парниковых газов на тепловой баланс системы «поверхность Земли – атмосфера». Задание Какой была бы средняя глобальная температура Земли в случае, если бы единственным источником тепла являлось излучение Солнца, при наличии «парниковых» газов в атмосфере, изменяющих альбедо на 2%. Для выполнения задания использовать данные и алгоритм решения задания, представленный ниже. Алгоритм решения задания Задача Какой была бы средняя глобальная температура Земли в случае, если бы единственным источником тепла являлось излучение Солнца, при отсутствии «парниковых» газов в атмосфере? Решение В условиях постоянства средней глобальной температуры должен соблюдаться баланс между потоками энергии – поступающими от Солнца и излучаемыми Землей в космическое пространство: Qпр = Qрасх, где Qпр – количество энергии поступающее от Солнца (приход);Qрас – количество энергии, излучаемое Землей (расход). Количество энергии, поступающее на планету, можно определить по уравнению: Qпр = I Sпр(1-А), где I – интенсивность Солнечного излучения, поступающего на Землю, солнечная постоянная (1378 Вт/м2); Sпр площадь проекции поверхности Земли, обращенной к Солнцу (Sпр = R33); R3 – средний радиус Земли (6367 км ); А – альбедо Земли – коэффициент, характеризующий долю излучения, отраженного поверхностью Земли (0,33). Количество энергии, излучаемое планетой, по закону СтефанаБольцмана составит: Qрас = S3 σ Т4, где S3 – площадь поверхности Земли (S3 = 4 R23); σ – постоянная Стефана- Больцмана (5,67 10-8 Вт(/м2 К4);Т – средняя глобальная температура, К. Подставим выражения для значений приходящей и излучаемой энергии в уравнение радиационного баланса: I R23(1-А) = 4 R23 σ Т4; Выразим значение температуры Земли: Т = [I (1-А) / 4 σ ]1/4; 39 Т = [1378(1 - 0,33) / (4 х 5,67. 10-8) ]1/4 = 252 (К). Ответ: если солнечное излучение принять за единственный источник поступления энергии, то в случае отсутствия «париковых» газов в атмосфере средняя глобальная температура на Земле составляла бы 252 К или (252 – 273) -21 0С. Практическое занятие 3. Расчет времени разрушения оксидов азота в атмосфере (практическая работа 8 [1]). Цель работы: Научиться рассчитывать время полувыведения оксидов азота, поступающих в атмосферу при технологических процессах производства тепловой энергии. Задание Рассчитать время полувыведения оксидов азота, поступающих в воздух при сжигании в котельной 20 т каменного угля в сутки используя задание практической работы 8 ([1], стр. 93 и алгоритм решения задачи на стр. 91. В отчете сравнить скорости окисления оксида азота озоном и кислородом. Практическое занятие 4. Расчет выбросов газообразных веществ при аварийных ситуациях (практическая работа 3 [1]). Цель работы: Научиться рассчитывать превышение ПДК газообразных веществ при аварийных ситуациях на предприятиях. Задание Рассчитать превышение ПДК при аварийном разливе одинаковых объемов серной и азотной кислоты. Для решения использовать условия и алгоритм решения задачи практической работы 3 ([1], стр. 60). Исходные данные по ПДК и парциальному давлению веществ принять по справочным данным и ГН 2.2.5.1313-03. В отчете сделать вывод о наиболее опасной аварийной ситуации. Практическое занятие 5. Расчет числа молекул токсичных веществ в воздухе рабочей зоны (практическая работа 4 [1]). Цель работы: Освоить методику расчета числа молекул токсичных веществ в воздухе рабочей зоны при возникновении нештатных ситуаций (выбросы с превышением ПДКм.р.). Задание Рассчитать число молекул сероводорода и метилмеркаптана в воздухе рабочей зоны. Для решения использовать условия и алгоритм решения задачи практической работы 4 ([1] стр. 62). Сведения о ПДК веществ взять из ГН 2.2.5.1313-03. В отчете представить расчеты и сделать вывод - количество молекул какого вещества в воздухе рабочей зоны максимально при заданных условиях. Практическое занятие 6. Расчет числа частиц пыли в воздухе рабочей зоны в штатном режиме работы предприятия (практическая работа 1 [1]). Цель работы: Освоить методику расчета содержания аэрозолей в воздухе рабочей зоны при соблюдении нормативных требований (в штат40 ном режиме). Задание Определить сколько частиц угольной и бумажной пыли присутствует в одном кубическом сантиметре воздуха рабочей зоны при концентрации, равной ПДК. Для решения использовать условия и алгоритм решения задачи практической работы 1 ([1] стр. 56). Сведения о ПДК веществ взять из табл. 3 ([1], стр. 243). В отчете представить расчеты и обосновать при каком технологическом процессе количество частиц пыли в воздухе рабочей зоны максимально при заданных условиях. Практическое занятие 7. Расчет площади осаждения аэрозолей (практическая работа 2 [1]). Цель работы: Научиться рассчитывать площадь загрязнения (осаждения) аэрозолями разных видов. Задание Рассчитать площадь осаждения аэрозолей древесной и мучной пыли на стенках контейнера, используя условия и алгоритм решения задачи практической работы 2 ([1], стр. 58). В отчете сделать вывод, какая пыль при осаждении будет занимать большую площадь. Практическое занятие 8. Расчет скорости образования и гибели атомарного кислорода и опасности фреонов для озонового слоя (практическая работа 6 [1]). Цель работы: научиться рассчитывать скорости образования и гибели атомарного кислорода и оценивать опасность фреонов для озонового слоя Земли. Задание Рассчитать во сколько раз скорость связывания атомарного кислорода в реакции синтеза озона выше, чем в реакции разрушения озона при температуре 20 0С. Для решения задачи использовать условия и алгоритм решения задачи практической работы 6 ([1], стр. 83). В отчете сравнить скорости процессов образования и разрушения озона и влияние на эти процессы температуры атмосферы. Практическое занятие 9. Защита рефератов Практическое занятие 10. Расчет состава природных и сточных вод (практическая работа 11 [1]). Цель работы: Освоить методы расчета состава природных и сточных вод. Задание Рассчитать содержание хлористого магния в 1 кг морской воды, отобранной у берегов Черного моря, если ее хлорность составляет в первом случае 15%, во втором - 18%. Для решения использовать алгоритм решения задачи практической работы 11 ([1], стр. 156). В отчете сделать вывод, как влияет хлорность на содержание хлористого магния в морской воде. Практическое занятие 11. Оценка кислотно-основного равновесия в природных водоема (практическая работа 12 [1]). 41 Цель работы: Научиться рассчитывать кислотность и щелочность природных вод. Задание Рассчитать, какое значение рН будет иметь дождевая вода, находящаяся в равновесии с атмосферным воздухом, содержащим 0,04% (объем.) углекислого газа, 1,3 млрд-1 диоксида серы и 0,5 млрд-1 аммиака. Для решения использовать условия и алгоритм решения задачи практической работы 12 ([1], стр. 161). В отчете представить результаты расчетов. Сравнить изменения рН дождевой воды в зависимости от содержания компонентов, используя результаты задачи практической работы 12 ([1], стр. 161). Практическое занятие 12. Оценка окислительновосстановительных свойств природных и сточных вод (практическая работа 13 [1]). Цель работы: Научиться рассчитывать расходы кислорода на окисление органических веществ в природных водах. Задание Рассчитать, какое количество органических веществ, которое может быть окислено за счет растворенного в воде кислорода, содержащегося в 1 л природной воды при температуре 300С. Для решения использовать условия и алгоритм решения задачи практической работы 13 ([1], стр. 168). Используя результаты задачи практической работы 13 ([1], стр. 168), в отчете сделать вывод о том, как влияет температура на количество окисленных в воде органических веществ. Практическое занятие 13. Защита рефератов Практическое занятие 14. Расчет гранулометрического состава почвы (практическая работа 17 [1]). Цель работы: Научиться рассчитывать гранулометрический состав почвы. Задание Рассчитать гранулометрический состав почвы, содержащей 50% песка, 20% пыли, 10% глины. Для решения задачи использовать условия и алгоритм решения задачи практической работы 17 ([1], стр. 229). В отчете представить результаты расчетов и описание гранулометрического состава почвы. Практическое занятие 15. Расчет содержания соединений азота в почвах (практическая работа 20 [1]). Цель работы: Научиться рассчитывать формы азота в почвах. Задание Рассчитать количество нитратов в верхнем слое почвенного горизонта (3000 г/га) в килограммах на гектар, если концентрация ионов NO3- в экстракте составила 8 мг/л. Для решения задачи использовать условия и алгоритм решения задачи практической работы 20 ([1], стр. 238). В отчете представить результаты расчетов количества ионов в почвенном растворе 42 и в верхнем слое почвы. Практическое занятие 16. Защита рефератов Практическое занятие 17. Расчет аэрируемости и содержания кислорода в почвах (практическая работа 18 [1]). Цель работы: Научиться рассчитывать содержание кислорода в воздухе почв. Задание Рассчитать объем кислорода в 1 м3 почвы и массу кислорода в почве в г/м3, если объем пор почвы составляет 0,5 см3/см3, используя условия и алгоритм решения задачи 3 практической работы 18 ([1], стр. 233). В отчете сделать вывод о том, как изменяется количество кислорода в почве в зависимости от ее порозности. 6.5. Краткое описание видов самостоятельной работы 6.5.1. Общий перечень видов самостоятельной работы 1. Подготовка к промежуточному и итоговому контролю (контрольная работа, тесты). 2. Освоение теоретического материала к практическим работам, решение домашних задач, письменные ответы на контрольные вопросы, оформление отчетов. 3. Написание реферата и доклада, разработка презентации к реферату. 6.5.2. Методические рекомендации для выполнения каждого задания самостоятельной работы 1. Подготовка к промежуточному контролю (контрольная работа, тесты). Цель работы: полноценное усвоение материала дисциплины, развитие способностей студентов к самообучению и повышению своего профессионального уровня, контроль освоения материала дисциплины. Основные рекомендации по выполнению работы. Студент должен самостоятельно повторить пройденный теоретический материал, физикохимические законы и расчетные формулы, используя свой конспект лекций и основную литературу [1, 2]. Приобретенные в результате самоподготовки знания оцениваются по итогам написания тестов и контрольных работ. Примеры тестов 1. Аэрозоль это коллоидные системы, в которых дисперсионной средой служит: а) водные пары атмосферы; б) воздух; в) азот атмосферы; г) кислород атмосферы. 2. Химические частицы с неспаренными электронами на внешних орбиталях: а) ионы; б) катионы; в) свободные радикалы; г) анионы. 3. Слой атмосферы, в котором протекает большинство метеорологических процессов и физико-химических превращений: а) озоновый слой; б) стратосфера; в) ионосфера; г) тропосфера. 4. Имиссия это: а) ввод вредных веществ в организмы или растения; б) 43 ввод вредных веществ в окружающую среду; в) вывод вредных веществ из окружающей среды; г) изменение качества среды. Примеры контрольных работ Задание 1 1. Свойства атмосферы, солнечная постоянная, тепловой баланс атмосферы. 2. Понятия об аэрозолях. 3. Химический состав природных и океанических вод. Задание 2 1. Константы скорости химических реакций, порядок реакций. 2. Парниковый эффект. 3. Трансформация и опасность загрязнителей в гидросфере. Задание 3 1. Роль фреонов в разрушении озонового слоя. Заменители фреонов. 2. Поведение тяжелых металлов в водной среде. 3. Антропогенное загрязнение почвенной среды. Задание 4 1. Циркуляция атмосферы и ее устойчивость. 2. Общие сведения о фотохимических процессах. 3. Планетарный почвенный покров. Задание 5 1. Ионосфера и магнитное поле Земли. 2. Процессы трансформации земной коры под действием внешних и внутренних факторов. 3. Химические реакции в гидросфере и их последствия. 2. Решение домашних задач, оформление отчетов Цель самостоятельного решения задач – формирование и закрепление у студентов умения и практических навыков количественно оценивать и прогнозировать состояние окружающей среды с использованием знаний физических законов, действующих в техносфере. Студент должен самостоятельно ознакомиться с теоретическим материалом каждой темы практических работ [1], кратко его конспектировать, решить типовые задачи, предложенные преподавателем. По каждой задаче сделать расчеты, построить графики (если есть в задании), выполнить анализ полученных результатов, сделать обобщения и выводы согласно поставленным целям, оформить отчет по форме (представлена выше), кратко письменно ответить на контрольные вопросы и защитить работу перед преподавателем. Задание 1 Студент должен освоить теоретический материал, представленный в [1, стр. 7–14], и решить задачу, в которой необходимо определить перепад давления в атмосфере в слоях 30–50, 60–80 80–90 км. Для решения исполь44 зовать формулу: Р = - gH = - gMPH /(RT), где g – ускорение свободного падения 9,81 м/с2 , Н – высота, км, и алгоритм решения задачи практической работы 1. В отчете сделать вывод о том, как влияет высота на изменение давления воздуха в атмосфере. Построить кривую изменения давления в атмосферном слое в зависимости от высоты. Письменно ответить на контрольные вопросы, выполнить задания. Контрольные вопросы 1. Какими параметрами определяется состояние газа? 2. Какой газ называется идеальным? 3. Какая физическая величина называется давлением? 4. Напишите формулу закона Менделеева–Клайперона. 5. Как определяется плотность газа? 6. Когда процесс, происходящий с газом, считается изобарическим, изохорическим, изотермическим? 7. Как изменяется давление и число молекул газов в атмосфере с высотой? Задание 2 Студент должен освоить теоретический материал [1, стр. 7–14] , решить следующую задачу. На сколько градусов может измениться средняя глобальная температура атмосферы, если при прочих равных условиях (использовать условия задачи практической работы 2) в результате антропогенной деятельности (при наличии парниковых газов) среднее значение альбедо Земли: а) уменьшится на 10%; б) уменьшится на 20%? В отчете сделать вывод, как влияет наличие парниковых газов на изменение отражения Землей тепловой энергии. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Как распределяется в атмосфере солнечная радиация? 2. Что такое солнечная постоянная? 3. Сформулируйте закон Стефана–Больцмана. 4. Что такое «альбедо»? Какая часть электромагнитных волн отражается от подстилающей поверхности Земли? Задание 3 Студент должен освоить теоретический материал [1, стр. 14–20 и 90– 91], выполнить задание практической работы 8 [1, стр. 93], используя алгоритм решения задачи на стр. 91. Для расчета количества оксидов азота, образующихся при сжигании угля, принять условия и задание практической работы 7. В отчете сравнить, какой уголь более безопасный по воздействию на атмосферу. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Какие реакции называют фотохимическими? 2. Напишите уравнение, отражающее скорость химической реакции. 45 3. Напишите уравнение, отражающее константу скорости химической реакции. 4. По какому признаку определяется порядок реакции? Задание 4 Студент должен освоить теоретический материал [1, стр. 26–32, 60– 61], выполнить задание практической работы 3 [1, стр. 60], используя алгоритм решения задачи на стр. 60. Исходные данные по ПДК и парциальному давлению веществ принять по справочным данным и ГН 2.2.5.131303. В отчете рассчитать превышение ПДК и сравнить вещества по возможным последствиям для здоровья человека, сделать выводы пролив какой химической жидкости является наиболее опасным, какие меры необходимо предпринять в первую очередь при аварийной ситуации. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Какие химические вещества, кроме доминирующих, содержатся в атмосфере? 2. Назовите естественные и антропогенные источники поступления неорганических компонентов в атмосферу. 3. Почему опасно присутствие оксидов серы в атмосфере? 4. В каких реакциях принимают участие оксиды азота и чем они опасны для атмосферы? Задание 5 Студент должен освоить теоретический материал [1, стр. 26–32], выполнить задание практической работы 4 [1, стр. 63], используя алгоритм решения задачи на стр. 62. Исходные данные по ПДК среднесуточной и максимально разовой веществ принять по справочным данным и ГН 2.2.5.1313-03. В отчете сделать вывод количество молекул какого вещества максимально при заданных условиях. Оценить опасность загрязнителей, предложить меры по ее ликвидации. Письменно ответить на вопросы. Контрольные вопросы. 1. Дайте определение ПДКс.с. и ПДКм.р.. 2. Перечислите ряд природных органических соединений, присутствующих в тропосфере. 3. Почему опасны смоги? Задание 6 Студент должен освоить теоретический материал [1, стр. 33 – 37], выполнить задание практической работы 1 [1, стр. 57], используя алгоритм решения задачи на стр. 56. Для определения ПДКм.р. использовать нормативные документы и ГН 2.2.5.1313-03, представленные в таблице 3 [1, стр. 243]. При решении задания принять сферическую форму частиц, плотность и размеры частиц определить по таблице 3. В отчете сделать вывод, какой из технологических процессов при штатном режиме обеспечивает большую запыленность воздуха. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Что такое атмосферный аэрозоль? 46 2. В каких условиях образуется аэрозоль? Чем он опасен для человека? 3. Что такое фотохимический смог? Задание 7 Студент должен освоить теоретический материал [1, стр. 33 – 37], выполнить задание практической работы 2 [1, стр. 59], используя алгоритм решения задачи на стр. 58. В отчете представить результаты расчетов и сделать вывод, какая из пылей занимает больший объем и является более опасной. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Каков химический и физико-химический состав аэрозолей? 2. Чем опасен терригенный аэрозоль? Задание 8 Студент должен освоить теоретический материал [1, стр. 21–32], выполнить задание практической работы 6 [1, стр. 84], используя алгоритм решения задачи на стр. 83. Для решения задачи по справочной литературе найти характеристики фреонов Ф-11 и Ф-152. Рассчитать скорость образования и гибели озона в присутствии фреонов. В отчете представить результаты расчетов и сделать вывод о влиянии фреонов на скорость образования и гибели озона. Определить, какой из фреонов наиболее опасный. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Где располагается озоновый слой? 2. Какова его функция в биосфере? 3. Распишите цикл Чепмена. 4. В каких естественных реакциях разрушается озон? 5. Почему хлорный цикл опасен ля озонового слоя? 6. Дайте оценку явлению «озоновая дыра» Задание 10 Студент должен освоить теоретический материал [1, стр. 105–109, 156], выполнить задание практической работы 11 [1, стр. 157], используя алгоритм решения задачи на стр. 156. Для решения задачи использовать концентрации ионов, приведенные на стр. 156–157. В отчете представить результаты расчетов и сделать вывод о содержании в воде ионов натрия и хлористого натрия. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Какие проблемы гидросферы относят к глобальным? 2. Какие ионы и в каком количестве следует ожидать в атмосферных осадках: а) на побережье океана, б) в районах интенсивной вулканической деятельности? 3. Сформулируйте закон Дитмара. Для решения каких задач он используется? 4. Какие катионы и анионы, содержащиеся в природных водах, называют главными? 47 Задание 11 Студент должен освоить теоретический материал [1, стр. 111–114, 158–160], выполнить задание практической работы 12 [1, стр. 163], используя алгоритм решения задачи на стр. 161. В отчете представить результаты расчетов и ответы на контрольные вопросы. Контрольные вопросы 1. Какое значение рH должны иметь атмосферные осадки, если примеси в атмосфере представлены только диоксидом углерода? 2. Как может измениться рH атмосферных осадков, если в воздухе появятся аммиак, диоксид серы? 3. Какие уравнения используются для описания карбонатной системы при равновесии с карбонатом кальция и воздухом, содержащим диоксид углерода? Задание 12 Студент должен освоить теоретический материал [1, стр. 114–133, 167]; выполнить задание практической работы 13 [1, стр. 169], используя алгоритм решения задачи на стр. 168. В отчете представить результаты расчетов и оценить количественную возможность окисления органических соединений природной водой водоема при заданных условиях. Дать письменные ответы на контрольные вопросы. Контрольные вопросы 1. Перечислите особенности протекания окислительновосстановительных процессов в природных водах. 2. Что такое стратификация природных водоемов? Что является ее причиной? 3. Чем отличаются олиготрофные и автотрофные водоемы в период стратификации? 4. Как меняется с глубиной содержание кислорода в воде открытого океана? Задание 14 Студент должен освоить теоретический материал [1, стр. 188–191, 229];, выполнить задания практической работы 17 [1, стр. 230], используя алгоритм решения задачи на стр. 229. В отчете представить результаты расчетов, описание гранулометрического состава почв, подвергнутых воздействию кислых дождей и ответы на контрольные вопросы. Контрольные вопросы 1. Какими параметрами характеризуются физические свойства почвы? 2. Дайте характеристику гранулометрическому методу анализа. 3. Как можно определить гранулометрический состав почв? Задание 15 Студент должен освоить теоретический материал [1, стр. 195, 196, 237, 238], выполнить задание практической работы 20 [1, стр. 240], используя алгоритм решения задачи на стр. 238. В отчете представить результаты расчетов содержания нитратов в верхнем слое почвы поля, используемого для выращивания сельскохозяйственных культур и поля, используемого 48 для посева трав. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Для чего нужен азот растениям? 2. Почему нитраты в больших количествах становятся опасными для человека? Задание 17 Студент должен освоить теоретический материал [1, стр. 188–191, 231–233], выполнить задания практической работы 18 [1, стр. 231, 233, 234], используя алгоритм решения задачи на стр. 231. В отчете представить результаты расчетов аэрируемости, содержания кислорода в почвах, а также степени порозности с использованием номограммы. Письменно ответить на контрольные вопросы. Контрольные вопросы 1. Что такое порозность почв? 2. По каким размерам подразделяются поры? 3. Напишите формулу, по которой можно рассчитать порозность почвы. 4. Каким показателем характеризуют степень аэрации почвы? 5. Как выполняется расчет степени аэрации почвы? 3. Написание реферата и доклада, разработка презентации к реферату. Цель работы над рефератом – приобретение студентом навыков самостоятельной работы библиографического поиска необходимой литературы с применением фондов библиотеки и систем поиска Интернет-ресурсов, аналитической работы с книгой, периодической литературой с последующей систематизацией изученного материала. Студент выбирает одну из представленных ниже тем или самостоятельно формулирует заинтересовавшую его тему. Тему, содержание и план реферата – согласовывает с преподавателем. Для поиска материала к реферату использует библиографический фонд библиотеки, периодическую литературу, базу Интернет. В реферате студент должен грамотно, логично и обоснованно изложить основные идеи по выбранной теме, содержащиеся в нескольких источниках (не менее 3), сгруппировать их по точкам зрения. Реферат должен быть оформлен в соответствие со стандартом ИрГТУ (СТО ИрГТУ. 005-2009). Объем реферата 15–20 страниц машинописного текста. Он должен содержать титульный лист с указанием темы, ФИО автора, кафедры и группы; оглавление, введение, основной текст, заключение, список использованной литературы. Текст доклада – это краткое содержание реферата. Объем доклада 3–4 страницы машинописного текста, произношение которого должно занимать не более 10 мин. Презентация к докладу оформляется в Роwer Роint и должна содержать тематический (графики, формулы, цифры, выборки из таблиц и др.) и 49 иллюстративный материал, соответствующий теме реферата. Слайд презентации может быть снабжен содержательным текстом, объем которого не должен быть доминирующим. Презентация должна соответствовать тексту доклада. Студент должен выступить с докладом, проиллюстрированным презентацией, перед студентами группы. Обсуждение доклада происходит в диалоговом режиме между студентами, студентами и преподавателем, но без его доминирования. Оценивается качество реферата (его структура, полнота, новизна, количество используемых источников, самостоятельность при его написании, степень оригинальности и инновационности предложенных решений, обобщений и выводов), а также уровень доклада (акцентированость, последовательность, убедительность, использование специальной терминологии). Возможные темы реферативной работы 1.Биофильность и технофильность химических элементов. 2. Поведение загрязнителей (ксенобиотиков) как сложный процесс химического взаимодействия их с компонентами окружающей среды. 3. Тепловой баланс атмосферы. Изменение климата – следствие «парникового эффекта». 4. Защитные свойства атмосферы. 5. Фотохимические процессы в атмосфере и техносфере. 6. Реакционные частицы атмосферы, их активизация в техносфере. 7. Воздействие фотооксидантов на живые организмы и материалы. 8. Влияние загрязняющих веществ на метеорологические условия в глобальном масштабе. 9. Вода – один из значимых минералов планеты. 10. Комплексообразование в гидросфере. Лигандный состав природных вод. 11. Поверхностно-активные вещества – опасные загрязнители вод. Тенденция их замены в моющих средствах веществами, подверженными биоразложению в окружающей среде. 12. Микроорганизмы в окислительно–восстановительных процессах в почве. 13. Биотический перенос загрязнителей. 6.5.3. Учебно-методическое обеспечение самостоятельной работы 1. Тимофеева С. С., Медведева С А. «Физико-химические процессы в техносфере». Практикум. – Иркутск : Изд-во ИрГТУ, 2005. 252 с. 6.5.4. Применяемые образовательные технологии При реализации программы дисциплины будут использованы образовательные технологии, представленные в таблице 2. 50 Таблица 2 - Применяемые образовательные технологии Технологии Слайд - материалы Работа в команде Исследовательский метод Виды занятий Практические Лекции + СРС + + + Кроме того, будет использовано: – чтение лекций с традиционными и мультимедийными средствами; – расчеты на практических занятиях, интерактивное выполнение заданий; – участие в конференциях, подготовка докладов и презентаций; – самостоятельная работа с применением фондов библиотеки и Интернет-ресурсов. 7. Контрольно-измерительные материалы и оценочные средства для текущего контроля успеваемости, промежуточной аттестации по итогам освоения дисциплины 7.1. Краткое описание контрольных мероприятий, применяемых контрольно-измерительных технологий и средств: – опрос и оценка работы на практических занятиях; – собеседование по контрольным работам; – тестирование по содержанию прочитанных лекций; – оценка доклада по теме аналитической работы (реферата); – аттестация по итогам освоения дисциплины – зачет. 7.2. Описание критериев оценки уровня освоения учебной программы. Студент аттестуется (получает зачет) при наличии оценок отлично, хорошо, удовлетворительно. Отлично: 1. Ответ самостоятельный, определения терминов чѐткие и правильные. 2. Полно раскрыто содержание всех заданных вопросов в объѐме программы. 3. Даны четкие и правильные ответы на дополнительные вопросы курса, не относящиеся к билету. Хорошо: 1. Ответ самостоятельный, в основном правильно даны определения терминов и понятий. 2. Материал изложен неполно. Допущены небольшие неточности при ответе и использовании терминов. 3. Неуверенные ответы на дополнительные вопросы преподавателя. 51 Удовлетворительно: 1. Определения и понятия даны не чѐтко. 2. Усвоено основное содержание материала, но изложено фрагментарно. 3. Не даны ответы на дополнительные вопросы преподавателя. Неудовлетворительно: 1. Допущены грубые ошибки в определениях. 2. Основное содержание учебного материала не раскрыто. 3. Не даны ответы на дополнительные вопросы преподавателя. 7.3. Контрольно измерительные материалы для итоговой аттестации по дисциплине Типовые вопросы итогового контроля знаний – зачета. 1.Геосферы Земли. Строение, свойства, дифференциация вещества, планетарный метаболизм. 2. Строение и состав атмосферы. Солнечная радиация, солнечная постоянная, закон Стефана–Больцмана. Тепловой баланс атмосферы и подстилающей поверхности. 3. О химической кинетике реакций. Определение скорости и порядка химических реакций. 4. Общие понятия о фотохимических процессах и возбужденном состоянии молекул. 5. Химические процессы и реакции в атмосфере. Фотодиссоциация. Ионизация. Реакционноспособные частицы атмосферы. Реакции ионов в атмосфере. 6. Стратосферный озон. Цикл Чепмена. Каталитические циклы разрушения стратосферного озона. Озоновый щит и озоновая дыра. 7. Стратосферный аэрозоль. Особенности его образования. Причины формирования слоя Юнге. Химические процессы с участием аэрозолей. 8. Природа и проблема парникового эффекта. Парниковые газы. Окно прозрачности. Возможные последствия парникового эффекта. 9. Органические компоненты нижней атмосферы: углеводороды и их производные, терпены, изопрен. Химические реакции органических соединений в атмосфере. 10. Гидрологический режим гидросферы. Химический состав пресной и океанической воды. Закон Дитмара. Газовый состав океанических вод. 11. Строение и формирование земной коры. Теория неомобилизма. Химический состав земной коры. 12. Процессы трансформации земной коры под действием внешних и внутренних факторов. Формирование гумусового слоя. 13. Поведение тяжелых металлов в водной среде: миграция в виде истинно растворенной формы, взвешенных и коллоидных частиц Образование элементорганической формы тяжелых металлов. 14. Законы деятельности биосферы и развития техносферы. Тотальность связей в природе и техносфере. 52 8. Рекомендуемое информационное обеспечение дисциплины 8.1. Основная учебная литература 1. Тимофеева С.С., Медведева С.А. «Физико-химические процессы в техносфере». Практикум. – Иркутск : Изд-во ИрГТУ. 2005 – 252 с. 2. Медведева С.А. Физико-химические процессы в техносфере. Конспект лекций (электронный вариант). 8.2. Дополнительная учебная и справочная литература. 3. Трифонов К.И., Девисилов В.А. Физико-химические процессы в техносфере. Учебник. – М. : ФОРУМ: ИНФРА – М, 2007. – 240 с. 4. Голдовская Л.Ф. Химия окружающей среды. – М. : Мир; БИНО. Лаборатория знаний. 2007. 5. Фелленберг Г. Загрязнение природной среды. Введение в экологическую химию. М. : Мир. 1997. 6. Лозановская И.Н., Орлов Д.С., Садовникова Л.К. Экология и охрана биосферы при химическом загрязнении. М. : Высшая школа. 1998. 7. Волчатова И.В., Медведева С.А. Использование грибов для удаления древесных остатков в условиях урбанизированных экосистем. /Успехи медицинской микологии. Т. 7. – М. : Национальная академия микологии. 2006. с. 234–235. Журналы «Безопасность в техносфере», «Безопасность жизнедеятельности». 9.3. Электронные образовательные ресурсы: 9.3.1. Ресурсы ИрГТУ, доступные в библиотеке университета или в локальной сети университета. Тимофеева С.С., Медведева С.А. «Физико-химические процессы в техносфере». Практикум. – Иркутск : Изд-во ИрГТУ. 2005 – 252 с. (электронный вариант). 9.3.2. Ресурсы сети Интернет 1. http://www.air-protection.ru/ 2. http://www.edu.ru/modules.php.page_id 3. http://www.climatechange.igce.ru 5. http:// www.vernadsky.ru/res-Internet.htm 6. Воробьева Л. Б., Степанова С. А. «Физико-химические процессы в техносфере». 2006. (электронный учебник) .http://www.edu.ru/modules.php/ 9.3.3. Рекомендуемые специализированные программные средства Унифицированная программа расчета величин приземных концентраций вредных веществ в атмосферном воздухе «Эколог». 10. Материально-техническое обеспечение дисциплины Оборудование лекционных аудиторий и аудиторий для практических 53