Использование закономерностей выгорания углей для описания
реклама
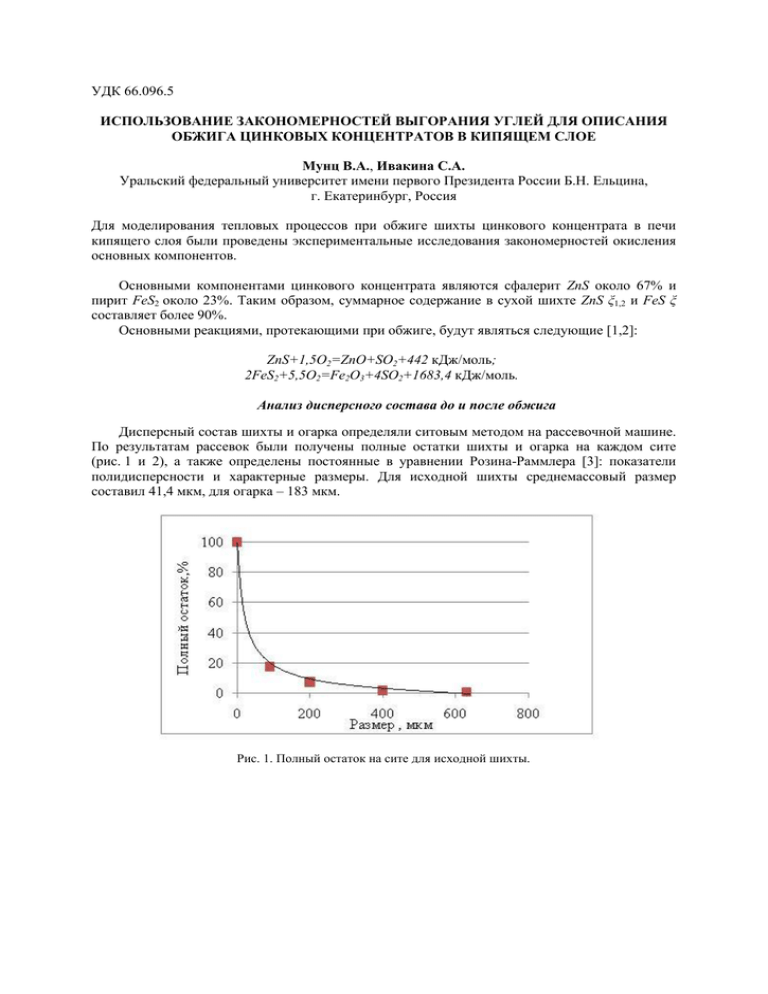
УДК 66.096.5 ИСПОЛЬЗОВАНИЕ ЗАКОНОМЕРНОСТЕЙ ВЫГОРАНИЯ УГЛЕЙ ДЛЯ ОПИСАНИЯ ОБЖИГА ЦИНКОВЫХ КОНЦЕНТРАТОВ В КИПЯЩЕМ СЛОЕ Мунц В.А., Ивакина С.А. Уральский федеральный университет имени первого Президента России Б.Н. Ельцина, г. Екатеринбург, Россия Для моделирования тепловых процессов при обжиге шихты цинкового концентрата в печи кипящего слоя были проведены экспериментальные исследования закономерностей окисления основных компонентов. Основными компонентами цинкового концентрата являются сфалерит ZnS около 67% и пирит FeS2 около 23%. Таким образом, суммарное содержание в сухой шихте ZnS ξ1,2 и FeS ξ составляет более 90%. Основными реакциями, протекающими при обжиге, будут являться следующие [1,2]: ZnS+1,5O2=ZnO+SO2+442 кДж/моль; 2FeS2+5,5O2=Fe2O3+4SO2+1683,4 кДж/моль. Анализ дисперсного состава до и после обжига Дисперсный состав шихты и огарка определяли ситовым методом на рассевочной машине. По результатам рассевок были получены полные остатки шихты и огарка на каждом сите (рис. 1 и 2), а также определены постоянные в уравнении Розина-Раммлера [3]: показатели полидисперсности и характерные размеры. Для исходной шихты среднемассовый размер составил 41,4 мкм, для огарка – 183 мкм. Рис. 1. Полный остаток на сите для исходной шихты. Рис. 2. Рассевка оставшихся в обжиговой печи фракций. При известной скорости газов в печи кипящего слоя 0,83 м/с были рассчитаны диаметры витания частиц δв для исходной шихты и огарка, которые составили соответственно 133 и 118 мкм [3]. Из рисунка 1 следует, что более 80% загружаемого концентрата имеет диаметр меньше диаметра витания и частицы данных размеров будут вынесены из слоя. Таким образом, укрупнение среднего размера частиц слоя (до 200 мкм) по сравнению с исходным дисперсным составом шихты (41,4 мкм) обусловлено выносом мелких фракций. Определение кинетических констант реагирования Для изучения кинетики окисления цинкового концентрата (шихты) в кипящем слое были проведены эксперименты на шихте и ее основных компонентах - сфалерите (ZnS = 67 %) и пирите (FeS2 = 23,5 %). Эксперименты выполнялись при различных температурах на приборе синхронного термического анализа NETZSCH STA 449 F3, совмещенного с масс-спектрометрической системой QMS 403C, предназначенной для качественного и количественного анализа компонентов газовой смеси, выделяющейся в процессе термохимической конверсии. В тигель помещали навеску массой m = 10 мг. Нагрев навески происходил в среде аргона, при достижении требуемой температуры подавался воздух. Непрерывно измерялась масса навески и относительная концентрация газовых компонентов. В экспериментах использовали навески узких фракций: 0-200, 200-400, 400-630 мкм, при этом средний размер частиц в навеске составлял: δ = 100, 300 и 515 мкм. Обжиг навески сульфида цинка проводили при температурах 700, 800 и 900 оС в среде воздуха, а также воздуха, обогащенного кислородом (О2 = 28%). Убыль массы навески сфалерита в зависимости от времени при t = 900 оС представлена на рис. 3. В период прогрева навески в среде аргона происходит незначительное уменьшение массы за счет выхода влаги и реагирования сульфида цинка с кислородом, который находится в порах вещества. При подаче воздуха происходит резкое, практически линейное, уменьшение массы навески за счет протекания реакции окисления. В этот же момент масс-спектрометр фиксирует образование SO2. Как показали эксперименты, массовое количество сульфида цинка, реагирующего в единицу времени, кг/с, не зависит от диаметра частиц в навеске, а зависит только от температуры обжига. Это свидетельствует о протекании реакции во всем объеме частицы. Фотографии (рис. 4) навесок сульфида цинка, шихты и пирита доказывают, что частицы имеют развитую пористую поверхность как до, так и после обжига. Рис. 3. Изменение массы навески сфалерита при t = 900 оС. Рис. 4. Огарок цинкового концентрата. Выражение для изменения массы реагирующего сульфида цинка в кг/с формально может быть записано как dm ZnS m0 d m m0 K C (1) O2 , кг/с. d d Тогда, эффективная константа скорости химического реагирования может быть определена по экспериментальным данным как: m d m / m0 (2) K 0 . CO2 d Здесь следует отметить, что размерность эффективной константы K м3/с, и фактически она представляет собой произведение константы скорости химического реагирования на полную поверхность реагирования S0 в м2. Коэффициенты, входящие в (1) представляют собой коэффициент, учитывающий количество исходного вещества, вступившего в реакцию, к ZnS 97, 434 видимому изменению массы 6, 065 , и стехиометрический S O 16 коэффициент реакции окисления сфалерита ZnS 1, 5O 2 97, 434 1, 5 32 2, 99. Эксперименты показали, что значения эффективной константы скорости химического реагирования в среде воздуха с концентрацией кислорода 21% и обогащенного кислородом до 28% практически совпадают. Это позволяет сделать вывод, что реакция ZnS 1,5O2 имеет первый порядок по кислороду. На рисунке 5 приведено сопоставление констант скорости реагирования сульфида цинка, пирита и шихты. Константа скорости окисления пирита в 4 раза меньше константы скорости окисления сфалерита. Пропорционально содержанию пирита в шихте уменьшается константа скорости окисления шихты по сравнению со скоростью окисления сфалерита. Рис. 5. Сопоставление констант скорости реагирования: линии - расчет по аппроксимациям, точки – эксперимент. Определение константы скорости химического реагирования В экспериментах определена скорость химического реагирования сульфида цинка в виде (1) и была получена эффективная константа скорости реагирования K, м3/с. Пусть K k S 0 это произведение константы скорости реакции k в м/с на полную поверхность реагирования S0 в м2. Если считать что поверхность реагирования пропорциональна массе m0 = S0/ψ, то получим коэффициент пропорциональности ψ, имеющий размерность м2/кг, т.е. это удельная поверхность в м2/кг. Тогда уравнение (1) может быть записано в виде: dm d m0 d m m0 d KC O2 km0 CO2 , кг/с. Удельная поверхность Si в м2/м3связана с глубиной проникновения ε соотношением Si 1 . Если глубину проникновения принять равной радиусу наибольшей частицы (при 900 °С наблюдается падение K с увеличением диаметра), то при ε = 515/2 = 257,5 мкм или ε = 2,575·10-6 м, а Si = 3883 м2/м3. При плотности сульфида цинка равной ρ = 4095 кг/м3 величина ψ = Si/ρ = 3883/4095 = 0,948 м2/кг. При плотности шихты 4360 кг/м3 величина коэффициента ψ = Si/ρ = 3883/4360 = 0,89 м2/кг. Оценим скорость химического реагирования, выраженную в м/с. Пусть при t = 950°C в соответствии с экспериментальными данными для шихты K = 7·10-7 м3/с, тогда k K 7 10 7 0, 0787 м/с. При концентрации кислорода при 950 °С равной 6 0,89 10 10 СО2 = 0,21·1,429·273/1223 = 0,067 кг/м3 поток кислорода к поверхности частицы за счет m0 протекания реакции равен j k CO 0, 0787 0, 067 0, 0053 кг/(м2с). 2 Коэффициент диффузии кислорода в азоте: D 0,16 10 4 1,9 273 T 0,16 10 1,9 4 1223 273 0, 276 10 3 м2/с. Тогда коэффициент диффузионного массообмена равен: d Sh D 2 0, 255 10 3 1, 07 м/с, 3 0, 515 10 т.е. коэффициент диффузионного массообмена на порядок выше константы скорости химического реагирования. Газообразование в кипящем слое при обжиге сульфида цинка Пусть массовая концентрация частиц в слое сг имеет размерность кг/м3. Тогда уравнение изменения концентрации кислорода по высоте слоя можно представить в виде: dCO k mCO , кг/с. 2 dx 3 Здесь V – объём слоя, м ; m – масса частиц в объёме слоя. Разделив правую и левую часть на объём слоя, получим: Vw w 2 dCO 2 k CO c г , кг/(м3с), 2 dx где сг = m/V – концентрация частиц сульфида цинка в объёме слоя. Начальная концентрация кислорода на входе в слой равна С0 концентрации кислорода в дутье. В общем случае, она больше 21%. Интегрируя от х = 0 до текущего значения, получим распределение концентрации кислорода по высоте слоя в зависимости от концентрации сульфида цинка в объёме слоя сг: CO C0 exp 2 k cг x , кг/м3. w При конечной высоте слоя H концентрация кислорода на выходе из слоя будет равна: C K C0 exp k cг H w . Данное выражение может быть преобразовано к следующему виду: CK exp C0 k cг H w Коэффициент избытка воздуха связан с начальной и конечной концентрацией кислорода следующим соотношением: C K 1 1 . C 0 (3) Используя (3), получим выражение для определения коэффициента избытка воздуха на выходе из слоя в зависимости от режимных параметров и высоты слоя Н: 1 1 exp k cг H w (4) Рис. 6. Расчетная зависимость коэффициента подачи окислителя от концентрации горючих веществ в кипящем слое. На рисунке 6 представлены результаты расчетов по выражению (4) при следующих условиях: температура слоя 950 °С, высота слоя 1,6 м, скорость дутья 0,83 м/с, константа скорости химического реагирования k = 0,074 м/с, коэффициент ψ = 0,89 м2/кг. По данным микрорентгеновского анализа материала слоя содержание горючих веществ в нем составляет 1,5-3 %, а измеренный коэффициент подачи окислителя находится в диапазоне от 1,1 до 1,3. Расход воздуха G, подаваемого на горение, может быть записан либо через скорость воздуха u, приведенную к нормальным условиям, и площадь сечения топки F, либо через величину теоретически необходимого количества V0 воздуха и его избыток [4]: 0 G uF BV . Из данного равенства можно выразить расход топлива, выгорающего на 1 м2 сечения топки, в зависимости от концентрации сульфида цинка в слое: B u 0 u 0 1 exp k cг H , кг/(м2с). F V V w На рисунке 7 представлена зависимость расхода выгорающего в обжиговой печи топлива от средней концентрации горючих веществ в кипящем слое. Из расчетов следует, что расход выгорающего топлива равен расходу подаваемого топлива при средней концентрации горючих веществ в кипящем слое около 1%. Рис. 7. Зависимость расхода выгорающей шихты от средней концентрации горючих веществ в кипящем слое Выводы: 1. Экспериментально определено, что реакция окисления сульфида цинка имеет первый порядок по кислороду. 2. Экспериментально определены величины энергии активации и предэкспоненциальные множители реакций окисления сульфида цинка и пирита при их окислении кислородом. 3. Экспериментально показано, что реакции окисления пирита и сульфида цинка кислородом идет во внутрекинетиической области, когда реагирует весь объём частицы. 4. Показано, что скорость окисления шихты уменьшается по сравнению со скоростью окисления сфалерита пропорционально содержанию пирита в шихте. 5. Установлено, что укрупнение материала слоя по сравнению с исходной шихтой обусловлено выносом мелких фракций, доля которых в шихте доходит до 80%. 6. Расчетами показано, что концентрация горючих веществ в кипящем слое в среднем составляет около 2%, т.е. выгорание практически полное Литература 1. Смирнов, Юрий Михайлович. Гидрометаллургия цинка: Учеб. пособие / Ленингр. горн. ин-т им. Г.В. Плеханова .— Л. : ЛГИ, 1978 .— 95 с. 2. Термические константы веществ. /Под ред. В.П. Глушко, ВИНИТИ. -М.:, 1965-1981. Вып. I-X. 3. Теория горения и топочные устройства. Под ред. Д.М. Хзмаляна. Учеб.пособие для студентов высш. учеб. заведений. М., «Энергия», 1976. 4. Мунц В.А., Баскаков А.П., Ашихмин А.А. Расчет газообразования при горении твердого топлива в кипящем слое. // ИФЖ, 1988, т. 54, № 3, с. 432-438.

