ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ
реклама

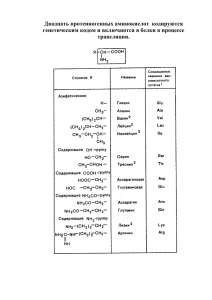
УДК 543.552:543.645 ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ НЕКОТОРЫХ АМИНОКИСЛОТ МЕТОДОМ ВОЛЬТАМПЕРОМЕТРИИ Е.И. Короткова2, Е.В. Дорожко1, М.В. Букель1, О.А. Воронова1, Е.В. Дьяконова2, Е.В. Петрова1, А.С. Щербакова1 2 1 ГОУ ВПО Национальный исследовательский Томский политехнический университет Филиал ФГУП “НПО “Микроген” Минздравсоцразвития России в г. Томск, “НПО “Вирион” E;mail: [email protected] INVESTIGATION OF ANTIOXIDANT PROPERTIES OF SOME AMINO ACIDES BY VOLTAMMETRY Е.I. Korotkova1, Е.V. Dorozhko1, M.V. Bukel1, O.A. Voronova1, Е.V. Dyakonova2, E.V. Petrova1, A.S. Shcherbakova1 2 1 Tomsk National Research Polytechnic University “Virion” – Tomsk Branch of the Federal State Unitary Company “Microgen” Scientific Industrial Сompany for Immunobiological Medicines” of the Ministry of Health and Social Development of the Russian Federation Проведено исследование антиоксидантной активности некоторых аминокислот методом вольтамперометрии. Предложен наиболее вероятный механизм взаимодействия изученных аминокислот с активными формами кислорода. Проведена оценка антиоксидантной активности исследуемых аминокислот по отношению к процессу электровосстановления кислорода. Для сравнения полученных результатов применен международный критерий антиоксидантной активности, выраженный в единицах ORAC. Ключевые слова: вольтамперометрия, антиоксидантная активность, аминокислота. Study of antioxidant properties of some amino acids was carried out by voltammetry. The influence of these substances on the electrochemical oxygen reduction and its kinetic was also studied. As a result, antioxidant activity coefficients interaction between reactive oxygen species and aminoasides and oxygen radical absorbance capacity (ORAC) coefficients were evaluation by voltammetry. Key words: voltammetry, antioxidant activity, amino acid. Введение Окислительные процессы в организме, усиливающиеся под действием различных неблагоприятных факторов, являются одними из основных механизмов возник- 62 новения синдрома окислительного стресса. Активные формы кислорода (АФК) играют определяющую роль в развитии свободнорадикальных патологий, которые сопровождаются перекисным окислением липидов, мута- Е.И. Короткова и соавт. ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ... генными изменениями белков и нарушением клеточного метаболизма [2]. Биоантиоксиданты создают систему антиоксидантной защиты, регулирующую избыточный уровень АФК в клетках живых организмов. Поэтому оценка состояния антиоксидантного статуса организма представляется весьма перспективным направлением в современных медицинских исследованиях с целью диагностики и дальнейшей коррекции свободнорадикальных патологий. Однако антиоксидантные свойства сложных биологических жидкостей нельзя объяснить без учета механизма антиоксидантного действия каждого компонента или группы компонентов [5]. Система антиоксидантной защиты клеток представлена различными ферментами и низкомолекулярными антиоксидантами. Ранее нами проводились исследования свойств ферментов антиоксидантной природы [6] и тиоловых соединений [3]. Другим важнейшим классом низкомолекулярных органических веществ в биологических системах являются аминокислоты. В настоящее время антиоксидантные свойства этих веществ изучены весьма поверхностно, и их роль в процессах, сопутствующих окислительному стрессу, остается не совсем ясной. Цель работы: исследование антиоксидантных свойств ряда водорастворимых аминокислот по отношению к процессу электровосстановления кислорода методом вольтамперометрии. ческом анализаторе “Антиоксидант” (ООО НПП “Полиант”, Томск) с подключенной к нему электрохимической ячейкой, состоящей из индикаторного стеклоуглеродного электрода и хлорид-серебряного электрода сравнения, опущенных в раствор фонового электролита (фосфатный буфер, рН=6,86). Методика измерения подробно изложена в [7]. Результаты и обсуждение В биологических системах АФК являются побочными продуктами важнейших метаболических реакций с участием молекулярного кислорода, поэтому представляет большой интерес изучение влияние аминокислот на процесс восстановления кислорода. Для исследования антиоксидантных свойств аминокислот использовалась модельная реакция электровосстановления кислорода (ЭВ О2), по механизму, аналогичному восстановлению кислорода в живых клетках и тканях: ko ⎯⎯ → О2˙− О2 + е– ←⎯ ⎯ ⎯⎯ → HO2˙ О2˙− + Н+ ←⎯ ⎯ ⎯⎯ → Н2О2 HO2˙ + Н+ + е− ←⎯ ⎯ ⎯⎯ → 2Н2О Н2О2 + 2Н+ + 2е− ←⎯ ⎯ Материал и методы В работе использовались 11 аминокислот производства фирмы ICN (США), рисунок 1. Восемь из них являются протеиногенными аминокислотами, участвующими в образовании природных белков (глицин, аланин, валин, лейцин, серин, треонин, лизин, гистидин). Одна аминокислота (орнитин) содержится в тканях животных и человека и играет важную роль в биосинтезе мочевины. Две остальные (норлейцин и норвалин) в природных объектах не встречается, а используется в экспериментальных исследованиях структуры и функции белков, а также для синтеза биологически активных пептидов. Концентрация всех изучаемых аминокислот составляла 2,5⋅10–4 моль/л. Методика эксперимента заключалась в съемке вольтамперограмм катодного восстановления кислорода без добавления и с последующим добавлением исследуемых веществ в раствор фонового электролита в диапазоне потенциалов от 0 до –1,0 В. Измерения проводились на автоматизированном вольтамперометри- Рис. 1. Структурные формулы исследуемых аминокислот: 1 – глицин, 2 – ланин, 3 – валин, 4 – лейцин, 5 – серин, 6 – треонин, 7 – лизин, 8 – гистидин, 9 – норлейцин, 10 – норвалин, 11 – орнитин 63 Сибирский медицинский журнал, 2011, Том 26, № 2, Выпуск 2 Рис. 2. Вольтамперограммы процесса ЭВ О2 в отсутствии (1) и в присутствии глицина С = 1,0⋅10–4 моль/л (2); С = 2,0⋅10–4 моль/л (3); С = 2,5⋅10–4 моль/л (4) При добавлении исследуемых аминокислот наблюдалось уменьшение величины катодного тока ЭВ О2. Следует отметить, что на стеклоуглеродном электроде при четырехэлектронном механизме ЭВ О2, наблюдается одна волна восстановления кислорода. На рисунке 2 представлены вольтамперограммы ЭВ О2 при добавлении в раствор фонового электролита. Аналогичные изменения ЭВ О2 наблюдались и для других водорастворимых аминокислот. Ингибирование катодных волн ЭВ О2, свидетельствует о взаимодействии исследуемых веществ с продуктами восстановления кислорода. Также наблюдается сдвиг потенциала волны ЭВ О2 в положительную область потенциалов (рис. 2, кривые 2–4), что дает право сделать вывод об облегчении процесса ЭВ О2 при добавлении аминокислот в раствор фонового электролита. Такой характер изменения катодных волн позволяет предположить, что в данном случае вероятный ЕС механизм ингибирования процесса ЭВ О2 в присутствии аминокислоты включает последующую химическую реакцию взаимодействия антиоксиданта с активными кислородными радикалами по следующему механизму: В связи с тем, что исследуемые аминокислоты содержат две функциональные группы – карбоксильную и аминную, исследовано влияние каждого из функциональных фрагментов на процесс ЭВ О2. Роль аминогруппы моделировали н-бутиламином, а карбоксильной группы – бензойной кислотой. Как видно из рисунка 3, при добавлении бензойной кислоты в раствор фонового электролита наблюдалось незначительное понижение тока ЭВ О2 со сдвигом по- 64 Рис. 3. Вольтамперограммы процесса ЭВ О2 в отсутствии (1) и в присутствии бензойной кислоты С = 2,5⋅10–4 моль/л (2); н-бутиламина С = 2,5⋅10–4 моль/л (3) тенциала в положительную область (кривая 2), тогда как добавление н-бутиламина привило к существенному уменьшения тока ЭВ О2 со сдвигом потенциала (кривая 3), что соизмеримо с действием самой аминокислоты. Таким образом, можно предположить, что в водных средах активным центром исследуемых аминокислот в процессах их взаимодействия с АФК является, в первую очередь, аминогруппа. Аналогичная зависимость наблюдались в работе при исследовании антиоксидантной активности аминокислот и белков полярографическим методом [1]. Для оценки антиоксиданной активности аминокислот использовался кинетический критерий отражающий количество активных кислородных радикалов, прореагировавших с антиоксидантом за единицу времени, К (мкмоль/л мин): K = C0/t (1 – I/I0), где I – ток электровосстановления кислорода в присутствии исследуемых веществ в растворе, мкА; I0 – ток электровосстановления кислорода в отсутствии исследуемых веществ в растворе, мкА; С0 – исходная концентрация кислорода в растворе, мкмоль/л; t – время протекания реакции, мин. Также для оценки антиоксидантной активности исследуемых аминокислот использовался общеизвестный критерий ORAC, отражающий способность поглощать кислородные радикалы, отнесенный к стандартному антиоксиданту (тролоксовый эквивалент): E = (I0 – Iв-ва) / (I0 – Iст), где I0 – ток электровосстановления кислорода в отсутствии исследуемых веществ в растворе, мк,; Iв-ва – ток электровосстановления кислорода в присутствии исследуемых веществ в растворе, мкА; Iст – ток электровосстановления кислорода в присутствии стандартного вещества в растворе, мкА. Е.И. Короткова и соавт. ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ... Таблица Коэффициенты антиоксидантной активности некоторых аминокислот взаимодействия аминокислот с АФК и активным центром исследуемых аминокислот в процессах их взаимодействия с АФК. Работа выполнена при финансовой поддержке гранта РФФИ №10-08-00306а и ФЦП Министерства науки и образования ГК №02.512.11.2282. Аминокислот К, мкмоль/л мин К*, (ORAC) Гистидин Глицин Орнитин Валин Норвалин Треонин Лизин Серин Аланин Лейцин Норлейцин 7,00±0,35 6,24±0,32 6.24±0,33 5,92±0,24 5.90±0,25 5,64±0,26 4,26±0,20 4,25±0,22 4.33±0,32 4.18±0,27 3.66±0,21 4,00±0,12 4,20±0,20 4,16±0,22 3,95±0,15 3,93±0,18 3,76±0,15 2,83±0,14 2,84±0,08 2,88±0,11 2,79±0,09 2,44±0,13 Примечание: n=3; p=0,95. В таблице представлены результаты количественной оценки антиоксидантной активности исследуемых аминокислот, измеренной по двум критериям. Наиболее активными аминокислотами по отношению к процессу ЭВ О2 оказались гистидин и глицин, что хорошо согласуется с литературными данными [1, 4]. Лейцин и норлейцин проявили минимальную антиоксидантную активность относительно процесса ЭВ О2. Заключение Таким образом, использование вольтамперометрического метода позволило наиболее полно исследовать антиоксидантные свойства ряда аминокислот, выявить наиболее активные соединения, сравнить полученные результаты, используя международный критерий ORAC. Кроме того, сделаны предположения о вероятном механизме Литература 1. Бумбер А.А., Корниенко И.В., Профатилова И.А. и др. Полярографический метод в изучении антиоксидантной активности аминокислот и белков // Журнал общей химии. – 2001. – Т. 71. – № 8. – С. 1387–1390. 2. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. – М. : Наука, 1972. – 252 с. 3. Дорожко Е.В., Короткова Е.И. Исследование антиоксидантных свойств биологически активных серусодержащих соединений вольтамперометрическим и спектрофотометрическим методами // Хим.-фарм. журнал. – 2010. – № 10. – С. 53–56. 4. Корниенко И.В., Клецкий М.Е., Оленович Л.П. и др. Механизм антиоксидантного действия полипептидов. Экспериментальное и теоретическое изучение // Биотехнология. – 2001. – № 2. – С. 83–88. 5. Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при патологических состояниях : пособие для врачей. – М. : Медицина, 2001. – 78 с. 6. Липских О.И., Короткова Е.И., Бакибаев А.А.. Метод вольтамперометрии в исследование каталитических свойств каталазы и супероксиддисмутазы // Изв. вузов. Химия и хим. технология. – 2008. – Т. 51, Вып. 5. – С. 48–50. 7. Korotkova E.I., Avramchik O.A., Angelov T.M. et al. Investigation of antioxidant activity and lipophilicity parameters of some preservatives // Electrochim. Acta. – 2005. – Vol. 51. – P. 324– 332. Поступила 29.02.2011 65