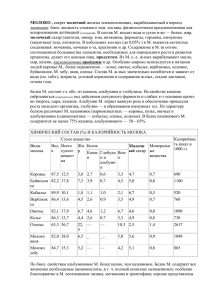
Диссертация Масленниковой С.М
реклама

Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Кемеровский технологический институт пищевой промышленности» На правах рукописи МАСЛЕННИКОВА СВЕТЛАНА МИХАЙЛОВНА ИССЛЕДОВАНИЕ И РАЗРАБОТКА ТЕХНОЛОГИИ ВЗБИТЫХ МОЛОЧНЫХ ДЕСЕРТОВ НА ОСНОВЕ ГИДРОЛИЗАТА КАЗЕИНА Специальность 05.18. 04 – технология мясных, молочных и рыбных продуктов и холодильного производства ДИССЕРТАЦИЯ на соискание ученой степени кандидата технических наук Научный руководитель: доктор технических наук, доцент М.Г. Курбанова Кемерово 2015 2 Оглавление Введение ………………………………………………………………………….4 Глава 1. Литературный обзор………………………………………………….9 1.1. Характеристика казеина и способы получения казеинсодержащих продуктов…………………………………………………………………….9 1.2. Свойства и значение протеолитических ферментов ……………………..25 1.3. Аспекты индустрии спортивного питания ………………………………..35 Заключение по обзору литературы……………………………………………..42 Глава 2. Методология проведения исследований………………………….44 2.1. Организация проведения исследований…………………………………...44 2.2. Объект исследований……………………………………………………….46 2.3. Методы исследований ……………………………………………………...47 Глава 3. Результаты исследований и их обсуждения ……………………..55 3.1. Сравнительная оценка химического состава и биологической ценности концентратов молочных белков ………………………………………....55 3.2. Изучение закономерности ступенчатого гидролиза казеина ……………63 3.2.1.Определение рациональных параметров кислотного гидролиза казеина……………………………………………………………………..63 3.2.2. Определение рациональных параметров ферментативного гидролиза казеина……………………………………………………………………..71 3.3. Исследование пенообразующих характеристик гидролиза казеина. .......83 3.3.1. Влияние температуры взбивания на пенообразующие характеристики гидролиза казеина………………………………………………………...86 3.3.2. Влияние стабилизаторов на пенообразующие характеристики гидролиза казеина…………………………………………………..……..93 3.3.3. Влияние ягодных наполнителей на пенообразующие характеристики гидролиза казеина……………………………………………………….103 3 Глава 4. Практическая реализация результатов исследований ……….112 4.1. Разработка рецептур и технологий молочного десерта с ягодным наполнителем на основе гидролизата казеина………………………...112 4.2. Установление продолжительности хранения продукта………………...116 4.3. Расчет стоимости сырья и основных материалов для производства молочного десерта на основе гидролизата казеина…………………...118 Выводы ………………………………………………………………………...121 Список использованной литературы ……………………………………...123 4 ВВЕДЕНИЕ Актуальность работы. В настоящее время во всех развитых странах мира имеются выпуском крупные продуктов специализированные функционального фирмы назначения. занимающиеся Многие научные коллективы продолжают углубленные исследования по созданию новых и усовершенствованию существующих продуктов для питания детей, подростков, пожилых людей, спортсменов и других групп населения. Новые формы белковой пищи, это продукты питания, получаемые на основе различных фракций белка продовольственного сырья с применением научно-обоснованных способов переработки и имеющие определенный химический состав, структуру и свойства. Высокая пищевая и биологическая ценность гидролизатов казеина, их функциональные свойства и возможность использования в составе различных пищевых продуктов, обуславливают актуальность создания новых технологий их переработки. Исследование процесса пенообразования дает ценные сведения для различных областей науки, в том числе пищевой технологии. Свойство отдельных поверхностно активных веществ (ПАВ) давать стабильные пены высокой степени взбитости широко применяют в пищевой промышленности для создания продуктов питания со взбитой структурой, которые пользуются повышенным спросом благодаря оригинальному составу и, как правило, высокой пищевой ценности. В пищевой промышленности широко применяются природные амфолиты (белки, пептиды, нуклеиновые кислоты, модифицированные амфолиты, например, гидролизаты белковых веществ и другие). Основные преимущества амфолитных ПАВ: удовлетворительные санитарно-гигиенические свойства (низкая токсичность, высокая биоразлагаемость, возможность комбинации с другими ПАВ). Управление процессом пенообразования в многокомпонентных взбитых молочных продуктах лежит в основе получения готовых продуктов с заданными функциональными свойствами и структурно-механическими показателями, 5 от него зависят не только внешний вид, консистенция, но выход и качество продукта. Принимая данный факт во внимание, считаем целесообразным рассмотреть факторы, влияющие на пенообразующие характеристики взбитых молочных продуктов на основе гидролизата казеина. Использование гидролизатов казеина весьма актуально на фоне разработки новых видов продуктов специального назначения, поскольку они отличаются высоким содержанием таких незаменимых аминокислот, как лизин и метионин, особо учитываемых наряду с триптофаном при определении пищевой ценности продуктов. Степень проработки темы исследований. Научные основы и методологические подходы к решению проблемы проектирования состава сбалансированных пищевых продуктов исследованы и теоретически обобщены в работах Липатова H.H. и Рогова И.А. Вклад в исследование белковой системы молока внесли Горбатова К.К., Гаврилов Г.Б., Диланян З.Х., Дьяченко П.Ф., Евдокимов И.А., Крашенинин П.Ф., Круглик В.И., Крусь Г.Н., Майоров А.А., Остроумов Л.А., Просеков А.Ю., Уманский М.С., Храмцов А.Г., Шалыгина А.М. и другие отечественные и зарубежные ученые. Работа выполнена в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (№ 3722/22 по соглашению № 01201066895 от 30.12.2010). Цель и задачи исследования. Целью диссертационной работы является исследование и разработка технологии взбитых молочных десертов на основе гидролизата казеина. Для достижения поставленной цели определены и сформулированы основные задачи исследований: - исследовать закономерности ступенчатого гидролиза казеина; - определить рациональные параметры кислотного и ферментативного гидролиза казеина; 6 - изучить влияние биотехнологических факторов на состав и свойства полученного гидролизата; - исследовать пенообразующие свойства гидролизата казеина; - разработать рецептуры и технологии молочных взбитых десертов на основе гидролизата казеина; - оценка экономической эффективности нового вида продукции. Научная новизна работы. В ходе проведенных научных исследований изучена биотехнологическая и физико-химическая сущность комплексного кислотно-ферментативного гидролиза казеина. Подобраны рациональные условия комплексного гидролиза казеина, позволяющие получить максимальное расщепление молекул белка и высокую степень гидролиза, с наименьшими потерями аминокислот. Получены зависимости, описывающие динамику накопления распределение белков свободных и аминокислот, пептидов. молекулярно-массовое Исследованы пенообразующие характеристики гидролизата казеина, выявлено, что гидролизат казеина имеет не только высокую пенообразующую способность как амфолитные ПАВ, но и проявляют стабилизационные свойства. Показано, что структура пены формировалась в виде трехмерного нессиметричного матрикса, образуемого межфазными пленками. Разработаны технологические параметры производства молочных десертов на основе гидролизата казеина, исследован состав, свойства и показатели безопасности новых видов продукции. По содержанию токсичных элементов (тяжелых металлов, мышьяка, кадмия, ртути и др.), хлорорганических соединений и микотоксинов, молочные десерты на основе гидролизата казеина отвечают медико-биологическим требованиям и санитарным нормам качества продовольственного сырья. Теоретическая и практическая значимость работы. Исследованы закономерности комплексного гидролиза казеина неорганической кислотой и протеолитическими ферментами. Практическая ценность работы состоит в разработке технологии взбитых молочных десертов на основе гидролизата 7 казеина. Подана заявка на выдачу патента (№2014110831 от 20.03.2014 г «Способ получения функциональной добавки на основе гидрализата казеина»). В установленном порядке подготовлен комплект технических условий и технологических инструкций на новый вид продукта. Методология и методы исследования. Экспериментальные исследования проводили с учетом современной методологии исследования сложных явлений с помощью общепринятых, стандартных и оригинальных методов биохимического, физико-химического, структурно-механического анализа с использованием последних достижений науки и техники. Отбор проб и подготовку их к анализу проводили по ГОСТ 26809, ГОСТ 9225. Массовую долю сухих веществ определяли по ГОСТ 30648.3. Для количественного и качественного определения аминокислотного состава использовали систему на базе высокоэффективного жидкостного хроматографа (аминокислотный анализатор) AracusPMAGmbH. Содержание белка определяли на анализаторе общего азота (белка) «RAPIDNELEMENTAR», работающего по методу Дюма – сжигания пробы с регистрацией общего азота на детекторе теплопроводности. Для количественного определения массовой доли амминого азота использовали метод Лоури. Молекулярно-массовое распределение белков и пептидов в получаемых гидролизатах оценивали электрофоретическим способом в полиакриламидном геле (ПААГ) методом Лэмли. Массовую долю аммиака определяли методом капиллярного электрофореза с помощью системы «КАПЕЛЬ 105». Очистку гидролизата с целью удаления кислоты и аммиака проводили с помощью ротационного испарителя ИР-1ЛТ. Плотность газожидкостных дисперсных систем определяли путем прямого измерения объема пены и объема жидкости в ней (или ее массы). Микробиологические показатели определяли в соответствии с СанПиН 2.3.4.551, СанПиН 2.3.2.1078, ГОСТ 9225, ГОСТ 10444.12, ГОСТ 10444.11, ГОСТ Р 50480. Основные положения, выносимые на защиту: физико-химические и биотехнологические закономерности комплексного гидролиза казеина; 8 состав качественных и количественных характеристик полученного гидролизата казеина; физико-химические закономерности пенообразующих свойств гидролизата казеина; концепция создания рецептур и технологии взбитых молочных десертов на основе гидролизата казеина. Апробация работы. Основные положения диссертации доложены и получили одобрение на семинарах различного уровня, научно-практических конференциях, в том числе: на XII международной научно-практической конференции «Тенденции сельскохозяйственного производства в современной России» (г. Кемерово, 2013г.), международной научнопрактической конференции «Векторы развития современной науки» (г. Уфа, 2014г.), международной научно-практической конференции «Наука и образование в современной конкурентной среде» (г. Уфа, 2014г.), всероссийской научно-практической конференции «Инновации в пищевой промышленности: образование, наука, производство» (г. Благовещенск, 2014г). Публикации. По материалам диссертации опубликовано 10 печатных работ, в том числе две статьи в журналах, рекомендованных ВАК для публикации основных материалов диссертаций («Вестник Алтайского государственного аграрного университета», «Техника и технология пищевых производств»), в описании заявки на выдачу патента РФ. Структура и объем работы. Диссертационная работа состоит из следующих основных разделов: введение, аналитический обзор, организация, объекты и методы исследований, результаты исследований и их обсуждение, результаты и выводы, список использованных источников и приложения. Основное содержание работы изложено на 145 страницах машинописного текста, содержит 32 таблицы и 25 рисунков. Список литературы включает 196 наименования. 9 ГЛАВА 1 ЛИТЕРАТУРНЫЙ ОБЗОР 1.1 Характеристика казеина и способы получения казеинсодержащих продуктов Содержание белков в молоке колеблется от 2,9 до 4,0%. Белки, входящие в состав молока, разнообразны по строению, физико-химическим свойствам и биологическим функциям. Белки молока можно разделить на три группы. К первой, основной группе (78 – 85%) относится казеин, содержащий 4 фракции (S, -, χ- и γ-казеин) и их фрагменты (табл. 1). Вторая группа представлена сывороточными белками – -лактоглобулином, -лактальбумином, иммуноглобулинами и альбумином сыворотки крови. Кроме того, в нее входят протеозо-пептоны, лактоферрин и некоторые другие (так называемые минорные) белки. К третьей группе относят белки оболочек жировых шариков, ферменты, некоторые гормоны (пролактин) и др., составляющие всего около 1% всех белков молока [46, 60]. Таблица 1- Характеристика белков молока Фракция белка 1 Казеин αs1-казеин αs2-казеин β-казеин χ-казеин γ-казеин Сывороточные белки β-лактоглобулин α-лактальбумин сывороточный альбумин Содержа ние, % от общего количест ва белков 2 79 – 83 30 – 36 8 – 11 25 – 28 9 – 10 2–4 Диапазон колебания молекулярного веса, Да Среднее значение молекулярног о веса, Да Изоэлектриче ская точка, рН 3 4 5 22066 – 23722 25148 – 25388 23939 – 24089 19005 – 19037 11600 – 20500 23600 25200 24000 19000/19550 20500 4,91 – 5,35 5,19 – 5,39 5,11 – 5,85 5,37 – 6,07 5,8 – 6,0 17 – 21 9 – 10 2–4 18205 – 18363 14147 – 14175 18300 14000/14200 5,14 – 5,49 4,2 – 4,8 0,7 – 1,3 66267 – 69000 66300 4,71 – 5,13 10 Окончание таблицы 1 1 иммуноглобулины ИгG ИгА ИгМ протеозо-пептоны другие 2 1,9 – 3,3 1,4 – 3,3 0,2 – 0,7 0,1 – 0,7 2–4 < 2,5 3 153000 – 901000 150000 – 163000 400000 1000000 4100 – 40800 4 5 5,5 – 8,3 – 5,5 – 6,8 3,3 – 3,7 – Казеин – это группа гетерогенных фосфопротеидов, самостоятельно ассоциирующихся в мицеллы в присутствии кальция, цитратов и фосфатов. В коровьем молоке содержание казеина колеблется в пределах 2,6…3,4%. В целом в казеине содержится (в %): углерода – 53,1; водорода – 7,1; кислорода – 22,8; азота – 15,4; серы – 0,82; фосфора – 0,8. Для сравнения – в среднем все белки молока содержат 15,67% азота, что дает коэффициент пересчета 6,38 (100/15,67) при определении белка по методу Кьельдаля. В нормальном состоянии казеин обладает амфотерными свойствами. Казеин является гетерогенным белком, то есть при электрофорезе образует несколько фракций с разной подвижностью, составом и свойствами. Ранее дифференциацию казеинов проводили именно по величине электрофоретической подвижности в полиакриламидном или крахмальном геле, содержащем мочевину. Сейчас основой для классификации и идентификации казеинов служит первичная структура их полипептидных цепей. К настоящему времени выделено семь основных фракций. άS1-Казеин – главный компонент наиболее электрофоретически подвижной и чувствительной к ионам кальция фракции άS-казеинов. Фракцию можно выделить из ά-казеинового комплекса осаждением 0,4 М раствором СаС12 при рН 7 и температуре 40С. Помимо άS1-казеина она содержит минорные компоненты (άS0, 2, 3, 4, 5-казеины). άS1-Казеин отличается от других компонентов казеина повышенным содержанием лизина, аспарагиновой кислоты, тирозина, пониженным – лейцина, пролина, фенилаланина и отсутствием цистеина [49, 74]. 11 β-Казеин – фракция казеина, растворимая в 4,6 М растворе мочевины и нерастворимая в 3,3 М ее растворе. β-Казеин нечувствителен к ионам кальция при температуре 40С, но осаждается ими при 350С [129]. Он характеризуется повышенным содержанием валина, лейцина, пролина, пониженным – аланина, аспарагиновой кислоты и отсутствием цистеина; в полипептидной цепи имеет пять остатков фосфорной кислоты [3]. άS1- и βказеин чувствительны к ионам кальция, а χ-казеин – нет; под действием сычужного фермента в молоке осаждаются άS1-, β- и χ-казеин, а γ1-казеин не коагулирует и остается в сыворотке. χ-Казеин – фракция ά-казеинового комплекса, растворимая в 0,4 М растворе СаС12. χ-Казеин в отличие от других компонентов казеина содержит цистеин, значительные количества треонина, аланина, но мало метионина, глицина и только один остаток фосфорной кислоты. Он является фосфогликопротеидом, так как помимо фосфорной кислоты имеет углеводы – три- и тетрасахариды, состоящие из N-ацетилгалактозамина, галактозы и сиаловой кислоты. Углеводная часть присоединена О-гликозидной связью к треонину (остаток 133) макропептидного участка полипептидной цепи χказеина. В молоке содержатся два генетических варианта χ-казеина (А и В), которые имеют несколько компонентов, отличающихся содержанием углеводных цепей (от 1 до 5). χ-Казеин не осаждается ионами кальция и в мицеллах казеина выполняет защитную роль по отношению к чувствительным ά S1- и β-казеину. Под действием химозина молекула χказеина распадается на две части: гидрофобный пара-χ-казеин (фрагмент полипептидной цепи χ-казеина с 1-го по 105-й аминокислотный остаток) и гидрофильный гликомакропептид (фрагмент цепи от 106 до 169-го) [6, 11, 42, 176]. Гликомакропептиды имеют молекулярную массу 6000 – 8000, содержат много серина, треонина и глютаминовой кислоты, характеризуются высоким отрицательным зарядом, обладают физиологической активностью и при выработке белковых продуктов кислотно-сычужным способом переходят в сыворотку. 12 γ1-Казеин является главным компонентом фракции γ-казеинов, растворимой в 3,3 М растворе мочевины, но нерастворимой в 1,7 М растворе мочевины при рН 4,7 после добавления сульфата аммония. γ1-Казеин, имеющий молекулярную массу около 21000, и минорные компоненты фракции (γ2- и γ3-казеин с молекулярной массой около 12 000) представляют собой фрагменты полипептидной цепи β-казеина [146]. Нормальное свежее молоко содержит около 3% γ-казеинов, однако их количество повышается (до 10% и выше) в конце лактации, при заболевании животного маститом, а также в результате нарушения режима кормления животных (при дефиците в рационах протеина). Количество протеозопептонов может составлять 2 – 10% всех белков молока. Все (казеин фракции характеризуются рассматривается как белок, значительной термоустойчивостью денатурированный в нативном состоянии), распределением вдоль полипептидной цепи полярных и неполярных аминокислот и др. Казеин содержит 19 из 20 присутствующих в молоке аминокислот (табл. 2). Таблица 2 - Аминокислотный состав фракций казеина Наименование аминокислоты 1 Глицин Аланин Валин Лейцин Изолейцин Пролин Фенилаланин Цистеин + цистин Метионин Триптофан Аргинин Гистидин Лизин S1казеине 2 3,0 3,4 5,6 9,4 6,0 8,2 5,6 – 3,0 2,0 4,4 3,3 8,7 Содержание, %, в: βχ-казеине казеине 3 4 1,31 2,4 5,41 1,7 5,1 10,2 6,08 11,6 6,14 5,5 8,78 16,0 4,07 5,8 1,4 – 1,0 3,4 1,05 0,83 4,0 3,4 1,67 3,1 5,76 6,5 γ1-казеине 5 1,5 2,3 0,5 12,0 4,4 17,0 5,8 – 4,1 1,2 1,9 3,7 6,2 13 Окончание таблицы 2 1 Аспарагиновая кислота Глютаминовая кислота Серин Треонин Тирозин 2 8,44 23,6 6,4 2,5 7,4 3 7,3 17,35 6,09 6,64 7,4 4 4,9 23,2 6,8 5,1 3,2 5 4,0 22,9 5,5 4,4 3,7 Основная часть казеина (около 95%) в молоке содержится в виде крупных казеиновых мицелл размером от 30 до 300 нм, и лишь незначительная часть (около 5%) – в виде мономеров, полимеров фракций казеина и субмицелл, имеющих размер до 30 нм и не выделяющихся при ультрацентрифугировании. Последнюю форму казеина называют растворимым казеином. Его количество зависит от температуры и продолжительности хранения молока. В молоке казеин содержится в виде казеината кальция, соединенного с коллоидным фосфатом кальция, – в виде казеинаткальцийфосфатного комплекса (ККФК). С помощью электронно-микроскопических исследований установлено, что ККФК образует мицеллы почти сферической формы (рис. 1), состоящие из субмицелл и имеющие размер от 40 до 300 нм [29]. Состав ККФК молока непостоянен. Он зависит от стадии лактации, времени года, породы, индивидуальных особенностей животных и т.д. Субмицеллы связаны в мицеллах казеина ионами кальция и фосфата кальция. Пространство между субмицеллами заполнено раствором ионов солей молока всех видов, лактозы, ферментов. По своему составу этот раствор является неферментированной молочной сывороткой. В последнее время за ним закрепилось название «идеальная сыворотка» [62]. 14 Рисунок 1. Модель мицеллы казеина: А – субмицелла d=10 – 20 нм; В – казеинмакропептид; С – фосфат кальция; D –χ-казеин; Е – группы фосфата (ККФК). Казеин присутствует в молоке в коллоидной форме. Плотность казеина находится в пределах 1300…1450 кг/м3. Пористая структура позволяет проникать внутрь мицелл воде. Как показали исследования, мицеллярный казеин сильно гидратирован – содержит 2 – 3,7 г и более воды на 1 г белка, что значительно превосходит количество, характерное для гидратных оболочек обычных глобулярных белков с плотной компактной структурой. Следовательно, вода не только окружает мицеллу казеина в виде гидратной оболочки, но и заполняет большую часть ее объема, т.е. иммобилизуется мицеллой. Очищенный казеин, выделенный из молока кислотным способом, представляет собой аморфный порошок или гранулы белого цвета, без запаха и вкуса, практически не растворимый в воде и спирте, растворимый в слабых растворах щелочей, солей щелочных и щелочноземельных металлов и минеральных кислот. В растворе казеин имеет ряд свободных функциональных групп, которые обусловливают его заряд, характер взаимодействия с водой (гидрофильные свойства) и способность вступать в химические реакции. Гидрофобные фракции казеина, чувствительные к кальцию, расположены в центральной части субмицеллы. Гидрофильные 15 фракции обращены наружу, при этом дипольные молекулы воды и находящиеся в ней ионы образуют гидратную оболочку, которая и обеспечивает устойчивость коллоидного раствора. Кроме того, одноименный заряд частиц казеина препятствует их агломерации. Носителями отрицательных зарядов и кислых свойств казеина являются β- и γкарбоксильные группы аспаргиновой и глутаминовой кислот, а также гидроксильные группы фосфорной кислоты и карбоксильные группы сиаловой кислоты гликомакропептидов казеина. Носителями положительных зарядов и основных свойств являются εаминогруппы лизина, гуанидиновые группы аргинина и имидазольные группы гистидина. При рН свежего молока 6,6-6,7 казеин на поверхности мицелл имеет отрицательный заряд. Равенство положительных и отрицательных зарядов (изоэлектрическое состояние белка) наступает в кислой среде при рН 4,6-4,7 (табл. 3). При этом силы межмолекулярного притяжения (силы Ван-дер-Ваальса) начинают играть существенную роль в агломерации частиц казеина, которые, соединяясь, образуют пространственную структуру по всему объему молока. Таблица 3 - Свойства основных белков молока Содержание в Белок и обезжиренном молоке Молекулярная предлагаемое % от масса, Да сокращение общего г/100 мл количества 1 2 3 4 Казеин (Кн): 78...85 2,6...3,4 αs1-казеин (αs1- 34...43 1,2...1,5 22 068...23 724 Кн) αs2-казеин (αs2- 9...11 0,3...0,4 25 230 Кн) β-казеин (β - Кн) 26...31 0,9...1,1 23 944...24 023 κ-казеин (κ -Кн) 6...11 0,2...0,4 19 007...19 039 Сывороточные 15...22 0,4...0,7 белки: β-лактоглобулин 7...12 0,2...0,4 18 205...19 007 (β -Лг) α-лактальбумин 2...5 0,06...0,17 14 147...14 175 (α-Ла) Изоэлектрическая точка, рН 5 4,44...4,76 4,83...5,07 5,45...5,77 5,13 4,2...4,5 16 Окончание таблицы 3 1 Альбумин сыворотки крови (СА) Иммуноглобулин G1 (Ig G1) Иммуноглобулин G2 (Ig G2) Иммуноглобулин A (Ig A) Иммуноглобулин М (Ig M) 2 3 4 5 1,1 0,04 66 267 4,7...4,9 0,9...1,7 0,03...0,06 153 000...163 000 5,5...6,8 0,2...0,7 0,005...0,01 146 000... 154 000 7,5...8,3 0,2...0,7 0,005...0,01 385 000...417 000 – 0,1...0,7 0,005...0,01 960000...1 000 000 – 1 Да = 1 у.е. – это углеродная единица (равна 1/12 части массы изотопа углерода 12 C), которую в честь Джона Дальтона называют дальтоном и обозначают Da (Да); 1 Da = 1,6605410–27 кг. Массы больших молекул, например белков, в биохимии принято обозначать в дальтонах. Гидрофильные свойства казеина зависят от структуры, заряда молекул, рН среды, концентрации в ней солей, а также других факторов [94, 102]. Способность казеина связывать воду имеет большое практическое значение. От гидрофильных свойств казеина зависит устойчивость частиц белка в сыром, пастеризованном и стерилизованном молоке. Белки с высоким содержанием водородных связей и легко расщепляемых ковалентных связей особенно подвержены изменениям при нагревании. Визуально тепловые воздействия происходят незаметно. Однако по мере увеличения времени выдержки в процессе высокотемпературной тепловой обработки молока происходит взаимодействие денатурированного βлактоглобулина с казеиновыми мицеллами, в результате чего гидрофильные свойства казеина усиливаются. От интенсивности этого взаимодействия зависят структурно-механические сычужного сгустков, свойства образующихся при кислотного выработке и кислотно- кисломолочных продуктов и сыра. Казеинаткальцийфосфатный комплекс стабилен в свежем молоке. Он сохраняет свою устойчивость при механической и тепловой обработке молока. Чисто тепловая денатурация казеина наступает только при 17 температурах порядка 1300С в течение 2 – 88 мин. Такое тепловое воздействие изменяет состав и структуру ККФК. От него отщепляются засушенные гликомакропептиды, органический фосфор и кальций, на поверхности мицелл казеина осаждаются денатурированный - лактоглобулин, коллоидный фосфат Са и т.д. Перечисленные изменения вызывают как дезагрегацию, так и агрегацию мицелл казеина. В результате преобладания последнего увеличиваются размер частиц казеина и вязкость молока, также в процессе высокотемпературной обработки молока может происходить необратимая минерализация ККФК, а при выработке кисломолочных продуктов, казеина и сыра, наоборот, его деминерализация. При этом наблюдается нарушение мицеллярной и субмицеллярной структуры казеинаткальцийфосфатного комплекса. Данные, приведенные в табл. 4, показывают изменения, которые претерпевают белки в молоке при нагревании [15]. Таблица 4 - Процессы, происходящие в молочном сырье при тепловой обработке Изменения вторичные первичные 1 Последствия 2 Усиленное тепловое сил движение отдельных частиц Десорбция эвглобулина с гидрофобных поверхности жировых шариков 3 Уменьшение межмолекулярных взаимодействия Снижение вязкости и поверхностного натяжения Разрыв связей Ухудшение способности сливок к отстою Снижение окислительноДенатурация Разрыв водородных и восстановительного сывороточных белков в ковалентных связей с потенциала, ухудшение форме структурных незначительной энергией способности к изменений и флокуляции свертыванию Смещение равновесия Изменение растворимости, распределения между Уменьшение активности главным образом истинно и коллоидно- сычужного фермента фосфатов и цитратов растворимыми фазами 18 Окончание таблицы 4 1 2 3 Усиление диссоциации Изменение потенциальных диссоционного Снижение pH электролитов и воды равновесия Образование низкомолекулярных Изменение вкуса продуктов распада Разрыв ковалентных Отсутствие связей концевых групп Разрушение ферментов и ферментативных реакций, чувствительных к снижение содержания нагреванию витаминов витаминов Образование углеводноРазрыв и образование белковых соединений Изменения вкуса и цвета новых ковалентных связей вследствие реакции Майера Изменение структуры и размера мицелл казеина влияет на технологические свойства молока, например, на скорость получения сычужного сгустка. После тепловой обработки продолжительность сычужного свертывания молока увеличивается в несколько раз по сравнению с сычужным свертыванием сырого молока. Гидрофильные свойства казеина и продуктов его распада определяют водосвязывающую и влагоудерживающую способность сырной массы при созревании сыра [121]. Казеинсодержащие концентраты (КСК), как правило, получают из обезжиренного молока, пахты и молочной сыворотки или их смесей путем удаления воды и балластных веществ: лактозы, минеральных солей и БАВ – с одновременным концентрированием белка на уровне 15 – 85 %. Их широко используют для обогащения продуктов питания, в кормовых средствах, медицинских и технических целях. В зависимости от массовой доли сухих веществ казеинсодержащие концентраты подразделяют на жидкие, пастообразные и сухие. Пищевая ценность всех видов пищевых КСК определяется исключительно содержанием белка – казеина и сывороточных белков. 19 Систематизированный перечень видов молочно-белковых концентратов, в том числе и казеинсодержащих, с указанием массовой доли белка и сухих веществ представлен в таблице 5. Таблица 5 - Ассортиментная номенклатура казеинсодержащих концентратов Продукт Казеин-сырец Казеин пищевой Казеин для пищевых казеинатов Казеин технический: кислотный сычужный Казеинат натрия (из кислотного казеина) Казецит пищевой обычный Копреципитаты пищевые растворимые: низкокальциевый высококальциевый Концентрат молочно-белковый: сухой в блоках Массовая доля сухих веществ, % в том числе всего белка 35,0 32,0–35,0 88,0 82,0–84,0 88,0 82,0–84,0 Стандарт ТУ 10 РФ 1137-92 ГОСТ Р53667-2009 ТУ 49 1135-85 88,0 88,0 82,0–84,0 76,0–78,0 ГОСТ 17626-81 94,0 85,0–90,0 ТУ 9229-011-00419785-97 94,0 80,0–83,0 ТУ 10-02-02-789-24-90 94,0 94,0 80,0–85,0 75,0–78,0 ТУ 10-02-02-33-87 88,0 55,0 70,0 35,0 ТУ 10-02-02-789-51-91 Биопротектор 94,0 16,0-18,0 ТУ 9224-037-07532800-97 Биопротеин 95,0 62,0 ТУ 9224-036-07532800-97 Казеин-сырец, казеин пищевой, казеин для пищевых казеинатов, казеин технический и казеин сычужный относят к классу нерастворимых, содержащих только казеин, жидких и пастообразных молочно-белковых концентратов [96, 129]. Казеин получают из обезжиренного молока кислотной или сычужной коагуляцией белков молока с последующей обработкой и сушкой. Технологический процесс выработки различных видов казеина имеет много одинаковых технологических операций. Отличия заключаются в видах 20 коагулянтов белка и режимах технологических операций. Технологический процесс производства кислотного казеина направлен на получение продукта, установленного стандартами качества. При этом должны быть обеспечены оптимальные режимы работы оборудования с целью получения максимального выхода готового продукта при минимальных издержках. В настоящее время практически используется только схема непрерывного производства (рис. 2) [18, 44]. Рисунок 2. Схема производства казеина кислотного. 21 В зависимости от используемого коагулянта и располагаемого оборудования аппаратурное оформление технологического процесса может значительно различаться [12, 107]. Технологический процесс выглядит следующим образом. В смеситель подаются сквашенная сыворотка с кислотностью 200…250ºТ и обезжиренное молоко. Кислотность смеси поддерживают на уровне рН 4,5…4,6. Затем в паровом инжекторе смесь нагревают до температуры коагуляции и подают в выдерживатель. Выдерживатель представляет собой свернутую в цилиндрическую спираль трубу. Сечение и длина трубы подобраны таким образом, что для формирования зёрен казеина обеспечивается нахождение в ней образовавшегося сгустка с сывороткой в течение 1,5…2,0 мин. Далее суспензия казеиновых зёрен направляется в барабанный отделитель сыворотки, где происходит ее отделение. Сыворотка поступает через приемный резервуар в ёмкость для хранения [137]. Казеиновое зерно поступает на двукратную промывку, причем чистая вода используется лишь при второй промывке. В первой промывочной емкости зерно казеина промывается водой, использованной для вторичной промывки. Время промывки определяется конструктивно объемом промывных емкостей. Расход массы промывной воды по отношению к массе перерабатываемого обезжиренного молока составляет (80 ± 10)%. Из первой емкости по трубе самотеком через лотковый отделитель промывной воды казеиновый сгусток направляется во вторую промывочную ёмкость. Промывную воду перед спуском в канализацию пропускают через устройство для улавливания белковой пыли. Собранную белковую пыль после самопрессования используют вместе с казеином-сырцом. Во второй промывной емкости казеин промывается чистой водой при температуре 45±5ºC и рН 3,9±0,5, после чего продукт направляется в отделитель сгустка барабанного типа. Подготовку промывной воды, используемой для промывки казеинового зерна, производят на специальной установке, включенной в комплект линии. Отработанная промывная вода насосом направляется в 22 первую промывочную емкость. Казеиновое зерно после отделения воды направляется на ленточный пресс, где происходит дальнейшее обезвоживание зерен до массовой доли влаги в казеине-сырце (62 ± 3) %. Подача продукта на сушилку осуществляется норией из бункеранакопителя, оборудованного ворошителем. Перед сушкой казеин-сырец измельчают на грануляторе, входящем в комплект сушилки. Сушку казеина производят на сушилке непрерывного действия типа ВС-150-КПИ. Процесс осуществляют согласно техническому эксплуатации указанного описанию оборудования. и Крупные инструкции казеиновые по зерна пневмотранспортом подаются в бункер для фасовки. Мелкая фракция сухого казеина вместе с отходящим воздухом попадает в прямоточный пылеуловитель и собирается в отдельный мешок. Для получения казеина кислотного молотого помол зёрен проводится на соответствующем оборудовании дробильного типа [41, 77]. Несколько по-иному выглядит процесс производства казеина с использованием в качестве коагулянта неорганических минеральных кислот (соляной, серной или фосфорной) либо чистых органических кислот (молочной, уксусной, лимонной) и при наличии декантеров и рекуперативных теплообменников (рис. 3). Обезжиренное молоко поступает из емкости для его хранения в пластинчатый подогреватель и нагревается до температуры 25-30ºС. Процесс осаждения казеина начинается со смешивания обезжиренного молока с коагулянтом в коагуляционной емкости и достижения в ней активной кислотности рН 4,4-4,6. Величина рН регулируется автоматически путем добавления дозирующим насосом раствора соляной кислоты к воде. На приготовление раствора используется 10-12 г 10-процентной кислоты из расчета на 1 л обезжиренного молока. Далее полученная смесь подается в трубчатый подогреватель-коагулятор, где происходит формирование зерен при температуре 45-48ºС и выдержке 1-1,5 мин. Затем казеиновые зерна направляются в I декантер, где происходит отделение сыворотки [66]. 23 Рисунок 3. Схема технологической линии производства кислотного казеина непрерывным способом с использованием декантеров: 1 – емкость для хранения обезжиренного молока, 2 – теплообменник для подогрева обезжиренного молока, 3 – емкость для смешивания, 4 – теплообменник для подогрева смеси обезжиренного молока и коагулянта, 5 – декантеры, 6 – промывные емкости, 7 – теплообменник для пастеризации и нагрева промывной воды, 8 – гранулятор, 9 – сушилка кипящего слоя. После декантера казеиновые зерна поступают на трехкратную промывку с повторным использованием промывной воды. Сначала вода подается в третью емкость, оттуда – во вторую, затем – в первую. Воду для промывки подкисляют 1,0-1,5 г 10-процентной соляной кислоты на 1 л воды. В первой промывочной емкости зерна казеина промываются около 15 мин при температуре 70-73ºС и рН 3,9-4,4. Из первой промывочной емкости казеин направляется во вторую емкость через лотковый ситовый отделитель промывной воды. Поступающая во вторую емкость вода (рН 3,9-4,4) с помощью инжектора подогревается до температуры 85-90ºС, и казеиновые зерна пастеризуются при температуре 82-85ºС и выдержке 15 с. Если температура пастеризации не достигается, зерна возвращаются во вторую промывочную емкость для повторной пастеризации. Дополнительная пастеризация казеина в зерне применяется лишь в случае особой на то необходимости, иначе в этой емкости осуществляется простая промывка при умеренной температуре [78, 115]. 24 Из второй промывочной емкости казеин направляется в третью емкость через лотковый ситовый отделитель промывной воды, где он охлаждается водой с кислотностью рН 4,7-5,2 до температуры 32-35ºС. Из третьей емкости казеин поступает на II декантер, где происходит окончательное отделение влаги, после чего ее массовая доля в казеине-сырце составляет 48 ± 3% [62]. Вода из первой емкости после промывки направляется на очистку от частиц казеина в III декантер. Собранный казеин ссыпается во вторую емкость. Для более полного извлечения белковой пыли широко используются специальные сепараторы-очистители, которые обеспечивают дополнительную очистку от белка сыворотки и промывной воды. Казеиновые зерна после II декантера направляются в зерноформовочный аппарат. После аппарата зерна размером 2 – 5 мм подаются на сушку. Сушка производится при температуре кипящего слоя 4555ºС. Температура подаваемого воздуха – 110-130ºС. Высушенные мелкие казеиновые зерна попадают в циклон и пневмотранспортом подаются в бункер для хранения перед последующей фасовкой. Крупные казеиновые зерна попадают в мельницу-дробилку, где происходит их помол до 2-3 мм, затем они пневмотранспортом подаются в бункер для фасовки. Технология производства ферментированного казеина аналогична технологии производства кислотного казеина, однако в ней присутствуют некоторые отличия, обусловленные особенностями температурных режимов и величинами кислотности, характерными для производства этого продукта [135]. Казеинат натрия и казецит пищевой обычный, копреципитаты пищевые растворимые, концентрат молочно-белковый сухой – класс растворимых, содержащих казеин и сывороточные белки сухих молочно-белковых концентратов [20, 46]. Казеинаты можно рассматривать как химические соединения казеина и щелочных (натрий, калий) или щелочноземельных (кальций) металлов[50]. 25 Казеинаты можно получать как из свежеосажденного кислотного казеинового сгустка, так и из сухого кислотного казеина. Образующиеся натриевые и калиевые казеинаты имеют повышенную по сравнению с исходным казеином водосвязывающую способность, почти полностью растворяются при щелочных и нейтральных значениях рН и низкой концентрации кальция, но теряют растворимость при рН 3,5 – 5,0, что сдерживает их применение в жидких кислых продуктах. Казеинаты кальция образуют в воде белковые суспензии. Казеинаты натрия обладают высокой вязкостью, отличными гелеобразующими, эмульгирующими и пенообразующими свойствами. Казеинаты широко используются в качестве белковых добавок для обогащения молочных (плавленые сыры, детские и диетические продукты и др.), мясных, рыбных, зерновых продуктов, а также в качестве стабилизаторов структуры мороженого, смесей для взбивания, пудингов, кремов, сметаны, йогурта, сгущенного молока и др. [76]. Сырьем для получения казеинатов служит обезжиренное молоко, превращение которого в казеинаты проходит через стадию получения казеина. Таким образом, на качество и состав казеинатов влияют не только способы их получения, но и условия производства казеина (температура осаждения, условия обработки полученного сгустка, промывка и др.). Так как качество казеинатов определяется в основном содержанием растворимого белка, то при их производстве необходимо придерживаться оптимальных режимов выделения казеина из обезжиренного молока. Современной технологией предусматриваются два способа производства казеинатов: двухстадийный и одностадийный. Первый способ заключается в предварительном получении из обезжиренного молока сухого казеина, а из него по мере необходимости – пищевых казеинатов. Одностадийный способ позволяет получать казеинаты из свежеосажденного казеина, т.е. казеина-сырца. В нашей стране казеинаты вырабатываются преимущественно по двухстадийной технологии, что объясняется значительной сезонностью производства в молочной отрасли и перегрузкой 26 распылительных сушилок, которые летом используются для выработки СОМ [78]. В качестве растворителей при получении казеинатов используются растворы гидроокисей различных щелочных металлов или их солей, что обусловливается предназначением готового продукта. В нашей стране в основном получают распространено казеинат производство натрия. казеинатов В других калия, странах кальция, широко аммония. Большинство типов казеинатов имеют растворимость около 100%, лишь казеинаты кальция при растворении в воде образуют коллоидную суспензию. Для уменьшения времени растворения частиц перед добавлением щелочи сгусток казеина обрабатывают на коллоидной мельнице. Из-за способности частиц казеина к термопластической агломерации температура помола не должна превышать 45ºС. Дозируя щелочь в поток, важно тщательно контролировать уровень рН, доводя до величины 6,7. Для уменьшения вязкости получаемого раствора после достижения требуемого уровня рН его температуру необходимо как можно быстрее поднять до 6075ºС. Время растворения свежеосажденного сгустка составляет 30-60 минут. Сушка казеинатов чаще всего производится на распылительных сушилках. Для устойчивой их работы вязкость продукта, подаваемого на сушку, не должна превышать значений, соответствующих массовой доле сухих веществ в растворе казеината натрия, – 18-20%. Для уменьшения вязкости раствора казеината его температуру непосредственно перед сушкой можно повысить до 90-95ºС [89, 127]. Объем выработки продукта, который сдерживается в основном производительностью сушильного оборудования, может быть существенно повышен, если раствор казеината натрия подвергнуть ферментации. Это позволяет поднять массовую долю сухих веществ в нем до 24-25% без роста вязкости. Для этого был разработан непрерывный способ получения ферментированного казеината и создано соответствующее оборудование. 27 Одной из растворимых форм казеина является казецит (цитратный казеинат, содержащий соли лимонной кислоты – цитраты), который используется для обогащения детских продуктов питания белком. Казецит характеризуется сбалансированностью по таким минеральным веществам, как калий, натрий, магний при оптимальном соотношении кальция и фосфора, а способствуют также содержит усвоению анионы организмом лимонной солей кислоты, кальция. Это которые позволяет использовать казециты при производстве молочных продуктов для лечебного питания детей. Технологические операции получения казецитов осуществляются в последовательности: приемка и подготовка сырья, осаждение казеина, тепловая обработка казеинового зерна, промывка казеина, обезвоживание и измельчение сгустка, растворение казеина-сырца в растворе солей цитратов, сушка раствора казецита, упаковка [90]. Технология казеинатов кальция имеет две важные особенности. Первая – растворы казеината кальция склонны к дестабилизации при нагревании, особенно при уровне рН ниже 6. Вторая – для растворения казеинового сгустка в растворе гидроксида кальция необходимо гораздо больше времени, чем в растворе гидроксида натрия. Поэтому для ускорения процесса казеин сначала полностью растворяют в растворе аммиака, а затем добавляют гидроксид кальция в растворе сахарозы. Раствор казеината кальция сушат на барабанной сушилке, при этом аммиак покидает продукт. К недостаткам производства казеинатов можно отнести использование в технологическом процессе в больших количествах химических реагентов, что снижает пищевую ценность белков. Несмотря на это, продукты находят очень широкое распространение во всех отраслях пищевой промышленности. Относительно других казеинатов известно, что казеинаты алюминия в качестве эмульгатора применяются в мясных продуктах. Они, наряду с казеинатами серебра, меди, железа и висмута, находят применение в медицине. Казеинаты магния, железа и меди используются при производстве 28 продуктов детского и диетического питания в качестве пищевых добавок, обогащающих продукты микроэлементами [94]. Одним из путей расширения возможностей использования белков молока является развитие производства копреципитатов. Копреципитаты представляют собой продукты, выделенные из обезжиренного молока (или его смеси с пахтой или молочной сывороткой), нагретого до температуры не ниже 90ºС, путём совместного термокальциевого или термокислотного осаждения казеина и сывороточных белков. Процесс их производства обладает наиболее высокой степенью извлечения белковых компонентов (до 95-97%) и поэтому экономически наиболее целесообразен. В зависимости от способа коагуляции белков и вида коагулянта (кислота, хлорид кальция) молочно-белковые копреципитаты различаются по содержанию кальция. Обычно их разделяют на три основные группы: с высоким содержанием кальция – более 2% в сухом веществе, средним – от 1 до 2%, низким – менее 1%. Содержание кальция непосредственно связано с наиболее важными свойствами копреципитатов: кислотностью, растворимостью, а также вязкостью их растворов, определяющими сферы их применения [101]. В результате модификаций и внесения различных химических и биологических добавок готовятся продукты с увеличенной влагоемкостью, дисперсностью, растворимостью. При этом используются такие вещества, как диглицирины, лецитин, каррагенин, альгинат. Получен также продукт с резко пониженной способностью к набуханию за счет дополнительного введения извести СаО и карбоната кальция СаСО3. Копреципитат, получаемый после осаждения белков молока, может быть высушен сразу или растворен при использовании изолирующих кальций агентов – гидроокиси натрия, триполифосфата и др. Таким образом, используя термокальциевый (совместное воздействие температуры и кальция), термокислотный (совместное воздействие температуры и кислоты) 29 и комбинированный методы выделения белков, различные модификации при растворении полученных сгустков, а также разнообразные изолирующие агенты при сушке, можно получить ряд белковых продуктов с различными функциональными свойствами. Растворимые копреципитаты получают как из копреципитата-сырца, так и из сухого копреципитата нерастворимого [104]. Технологические операции получения копреципитатов осуществляют в последовательности: подготовка копреципитата и удаление приготовление смеси сырья и сыворотки, копреципитата с коагулянтов, промывка и гидроокисью осаждение прессование, натрия или триполифосфатом натрия, подготовка раствора к сушке, сушка, упаковка. Разновидностями копреципитатов являются белок молочный пищевой и белок сухой молочный пищевой. Белок молочный пищевой вырабатывают из пастеризованного обезжиренного молока путем осаждения молочного белка хлористым кальцием или закваской молочнокислых лактококков. Его выпускают следующих видов: белок молочный пищевой свежий и белок молочный пищевой консервированный (соленый, замороженный соленый, замороженный несоленый) [6, 138]. Белок сухой молочный пищевой производят из обезжиренного молока путем осаждения белка хлористым кальцием и диспергирования его обезжиренным пастеризованным молоком либо смесью обезжиренного молока и пахты. Полученную суспензию сушат на распылительных сушилках. Концентрат натурального казеина (КНК) вырабатывают из обезжиренного молока с использованием полисахаридов. В качестве полисахарида используют пектин яблочный сухой. Выпускают концентраты натурального казеина в жидком и сухом видах. Сухие продукты «Био-Тон» выпускаются следующих видов: биопротектор, биопротектор экстра, биопротеин и биопротеин экстра. Продукты вырабатывают из обезжиренного молока путем выделения белков с 30 применением высокоэтерифицированного яблочного пектина. После разделения системы на концентрат натурального казеина и концентрат сывороточно-полисахаридный производят их сушку. Концентрат натурального казеина, высушенного распылительным способом, назвали биопротеином, а высушенного сублимационной сушкой – биопротеином экстра [141]. Концентрат сывороточно-полисахаридный обогащают обезжиренным молоком, сгущают и высушивают. Концентрат, высушенный распылительным способом, получил название биопротектор, а высушенный сублимацией – биопротектор экстра [143]. 1.2 Свойства и значение протеолитических ферментов Ферменты – органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и называются катализаторами. Ферменты (от лат. fermentum – брожение, закваска) иногда называют энзимами (от греч. en – внутри, zyme – закваска). Другими словами, это биокатализаторы, которые составляют функциональный аппарат клеток растительного, микробного и животного происхождения и характеризуются исключительно высокими специфичностью и молекулярной активностью. Все живые клетки содержат очень большой набор ферментов, от каталитической активности которых зависит функционирование клеток. Практически каждая из множества разнообразных реакций, протекающих в клетке, требует участия специфического фермента. Изучением химических свойств ферментов и катализируемых ими реакций занимается особая, очень важная область биохимии – энзимология [4]. Роль ферментов колоссальна. В настоящее время в биологических объектах обнаружено несколько тысяч индивидуальных ферментов, а несколько сотен из них выделено и изучено. Биологические катализаторы по 31 ряду признаков резко отличаются от неорганических катализаторов. Большинство ферментов является растворимыми глобулярными белками, поэтому и обладает всеми их свойствами. Сюда относятся термолабильность ферментов, зависимость их действия от значения рН среды, специфичность, подверженность влиянию активаторов и ингибиторов [18]. Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоком значении к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата. Скорость ферментативного катализа на несколько порядков выше (от 103 до 109), также ферменты катализируют реакции в мягких условиях – при обычном давлении, невысокой температуре и при значениях рН среды в большинстве случаев близких к нейтральной, то есть совпадающих с физиологическими значениями рН живой клетки. Кроме того, для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность [32, 134]. Поскольку фермент является белком и содержит различные ионизирующие группы, изменение рН среды влияет на состояние ионизации этих групп, а следовательно, и на заряд белковой молекулы, от величины которого зависит взаимодействие фермента с субстратом. Таким образом, рН среды влияет на стабильность структуры фермента и превращение комплекса ферментсубстрат. Специфичность – одно из наиболее выдающихся свойств ферментов. Данное свойство ферментов объясняется в первую очередь совпадением пространственных конфигураций субстрата и субстратного центра фермента. Ферменты могут обладать абсолютной, относительной, стереохимической специфичностью. Влияние на ферменты активаторов и ингибиторов впервые было изучено А.Я. Данилевским. Ингибиторы тормозят действие ферментов. Механизм ингибирующего действия сводится к двум типам торможения 32 (необратимое и обратимое). Будучи выделены из организма, ферменты не утрачивают способности осуществлять каталитическую функцию, на чем основано их применение в различных областях промышленности [28]. По химическому строению одни ферменты представляют собой простые белки – однокомпонентные, состоящие из полипептидных цепей аминокислот, другие – сложные, двухкомпонентные. Сложные белки состоят из белкового компонента – апофермента и термостойкого компонента небелковой природы – кофактора. При этом оба компонента лишены ферментативной активности, и только образованный ими комплекс – холофермент приобретает свойства биокатализатора. Тип связи между апоферментом и кофактором различен. В некоторых случаях они существуют отдельно и связываются только во время реакции – в этом случае кофактор называют коферментом. В других случаях апофермент и кофактор связаны постоянно, иногда прочно, ковалентными связями, и при этом кофактор называют простетической группой. Фермент, как любой белок, имеет трехмерную структуру. От первичной и третичной структур белковой молекулы фермента в основном зависит каталитическая активность. Ферменты могут ускорять как прямую, так и обратную реакцию. Выяснение механизмов действия ферментов во всех деталях – дело будущего, однако некоторые важные их особенности уже установлены. Каждый фермент имеет один или несколько активных центров, с которыми и связывается субстрат. Эти центры высокоспецифичны, т.е. «узнают» только «свой» субстрат или близкородственные соединения. Активный центр формируют особые ориентированные химические относительно группы друг друга в молекуле фермента, определенным образом. Происходящая так легко потеря ферментативной активности связана именно с изменением взаимной ориентации этих групп. Молекула субстрата, связанного с ферментом, претерпевает изменения, в результате которых разрываются одни и образуются другие химические связи. Чтобы этот 33 процесс произошел, необходима энергия; роль фермента состоит в снижении энергетического барьера, который нужно преодолеть субстрату для превращения в продукт. Как именно обеспечивается такое снижение – до конца не установлено [73, 112]. Ферменты часто катализируют реакции, протекающие с участием двух или большего числа субстратов, приводящие к образованию большого числа продуктов. Важнейшим фактором, определяющим скорость ферментативной реакции, является концентрация реагирующих веществ – субстрата и фермента. При протекании ферментативной реакции может иметь место ингибирование фермента избытком субстрата, а также регулирование активности фермента путем ингибирующего или активирующего воздействия на него продуктов реакции [2, 151]. По современной классификации протеолитические ферменты относятся к классу гидролаз и образуют подкласс пептид-гидролаз, или протеаз. Протеазы обычно подразделяются на пептидазы (экзопептидазы) и протеиназы (эндопептидазы). Однако четкого разделения по этому признаку нет, так как установлено, что протеиназы (пепсин, трипсин, папаин и другие) гидролизуют пептидные связи не только в белках, но и различных полипептидах. За последние годы значительно изменились представления о протеолитических ферментах. Согласно классификации Бергмана, подкласс пептид-гидролаз делится на две группы: эндопептидазы и экзопептидазы, которые отличаются специфичностью действия на субстрат. Эндопептидазы гидролизуют пептидные аминокислоты. связи, Эндопептидазы последовательно (пепсин, ренин, отщепляя концевые папаин, трипсин, химотрипсин, эластаза и др.) могут действовать на центральные участки пептидной связи и расщеплять молекулу белка на более мелкие фрагменты. Экзопептидазы (карбоксипептидаза, аминопептидаза, дипептидаза и др.) не могут гидролизовать пептидные связи, находящиеся в середине цепи, и действуют, последовательно аминокислоты [1]. отщепляя одну за другой концевые 34 Аминопептидазы содержатся в тканях животных, растений и в микроорганизмах в внутриклеточными растворенном или связанном структурами состоянии. с мембранами Молекулярная и масса аминопептидаз из различных источников варьируется от 19 тыс. до 400 тыс. В большинстве случаев аминопептидазы содержат от 2 до 12 субъединиц. Многие аминопептидазы содержат от 1 до 12 атомов металла (обычно Mn 2+, Mg2+, Ca2+ или Со2+), некоторые – остатки углеводов (гексоз, глюкозаминов, сиаловых кислот). В кишечном соке открыты два фермента – аланинаминопептидаза, катализирующая преимущественно гидролиз пептидной связи, в образовании которой участвует N-концевой аланин, и лейцинаминопептидаза, обладающая строгой субстратной специфичностью и гидролизующая пептидные связи, образованные любой N-концевой аминокислотой. Аминопептидазы играют важную роль в метаболизме белков, осуществляя заключительную стадию их расщепления, а также в процессах превращения полипептидных предшественников в зрелые белки. Применяются для исследования первичной структуры пептидов [11]. Карбоксипептидазы – ферменты класса гидролаз, катализирующие гидролитическое отщепление С-концевых аминокислотных остатков в молекуле белков и пептидов. Наиболее изучены два типа карбоксипептидаз, которые различаются по специфичности: тип А (молекулярная масса 34,4 тыс., состоит из 307 аминокислотных остатков) – отщепляет от пептидов все С-аминокислотные остатки, за исключением аргинина, лизина, пролина и гидроксипролина, и тип В (молекулярная масса 34 тыс., состоит из 300 аминокислотных остатков) – отщепляет только С-концевые остатки аргинина и лизина. Оба фермента проявляют максимальную каталитическую активность при рН 7,5. Установлены их пространственная и первичная структуры. Активный центр ферментов имеет форму кармана, в полости которого находится атом Zn. В активный центр входят также остатки глутаминовой кислоты, тирозина и аргинина. Функция последнего в механизме катализа – связывание С-концевой карбоксильной группы. 35 Необратимые ингибиторы обеих карбоксипептидаз – вещества, образующие комплексные соединения с металлами (например, 1,10-фенантролин, 8гидроксихинолин. Карбоксипептидазы типа А и В продуцируются в виде проферментов поджелудочной железой человека и животных. В двенадцатиперстной кишке под действием трипсина проферменты образуют активные формы карбоксипептидаз [55, 113, 145]. Известна также карбоксипептидаза типа С, которая отщепляет от Сконца любые остатки аминокислот. Она выделена из плодов и листьев цитрусовых. В плазме крови человека функционирует карбоксипептидаза типа N (ее каталитическая активность оптимальна при рН 7), сходная по субстратной специфичности с карбоксипептидазой типа В. Этот фермент катализирует отщепление С-концевого аргинина от находящегося в крови пептида брадикинина, в результате чего этот пептид теряет способность понижать кровяное давление. Карбоксипептидазы используют для определения последовательности С-концевых аминокислот в белках и пептидах [42]. Одним из хорошо изученных и основных протеолитических ферментов пищеварительного тракта является пепсин. Пепсин вырабатывается в главных клетках слизистой оболочки желудка в неактивной форме – в виде пепсиногена. Превращение пепсиногена в активный пепсин происходит в желудочном содержимом, однако молекулярный механизм этого превращения в деталях еще не выяснен. Наиболее вероятным считается предположение, что этот процесс является последовательным и протекает в несколько этапов аутокаталитического в присутствии действия соляной самого кислоты пепсина. по механизму Молекулярная масса пепсиногена составляет приблизительно 40 400, а пепсина – 32 700, поэтому превращение первого во второй связано с отщеплением пептидных фрагментов. Следует отметить, что в отличие от других протеиназ пепсин отличается высокой устойчивостью в сильнокислой среде и характеризуется низким значением изоэлектрической точки [55]. Протеолитическая 36 активность пепсина наблюдается при рН < 6, достигая максимума при pH = 1,5-2,0. При этом один грамм пепсина за два часа может расщеплять около 50 кг яичного альбумина, створаживать около 100 000 л молока, растворять приблизительно 2000 л желатины. Оптимальная каталитическая активность при гидролизе белков – при рН около 2 [46]. Реннин (химозин) – фермент из класса гидролаз, который вырабатывается в желудочных железах млекопитающих, в том числе человека. У жвачных животных вырабатывается железами сычуга (4-го отдела желудка), отсюда одно из его тривиальных названий – сычужный фермент. По структуре реннин близок к пепсину: также состоит из одной полипептидной цепи, представленной в основном кислыми аминокислотами с молекулярной массой 40 000. Вырабатывается главными клетками желудка в форме неактивного профермента прореннина (прохимозина). Активируется катионами водорода (соляной кислотой желудочного сока) в присутствии ионов кальция при pH менее 5 с отщеплением 42-членного пептида. В кислой среде относительно стабилен, при pH более 7 теряет активность. Оптимальная кислотность среды для природного реннина – 3-4, для синтетического – 4-5. Ингибируется пепстатином, продуцируемым стрептомицетами [47]. Трипсин – расщепляющий пептиды и белки фермент класса гидролаз, а также обладает эстеразной (гидролиз сложных эфиров) активностью. Синтезируется предшественника в поджелудочной (профермента) железе трипсиногена. в виде Молекула неактивного трипсина (молекулярная масса около 24 000) состоит из 223 аминокислотных остатков, образующих одну полипептидную цепь, и содержит 6 дисульфидных связей. Его изоэлектрическая точка лежит при pH 10,8, а оптимум каталитической активности – при pH 7,8-8,0. Относится трипсин к группе так называемых сериновых и содержит в активном центре остатки серина и гистидина. Трипсин легко подвергается самоперевариванию (автолизу), что приводит к 37 загрязнению препаратов трипсина неактивными продуктами [45, 76]. Химотрипсин катализирует гидролиз пептидных связей, удаленных от концов белковой цепи (эндопептидаза). С наибольшей скоростью катализирует гидролиз связей, образованных карбоксильными группами гидрофобных аминокислот. Гидролизует также сложные эфиры и амиды, образованные этими аминокислотами. В поджелудочной железе синтезируется ряд химотрипсинов (α-, β- и πхимотрипсины) из двух предшественников – химотрипсиногена А и химотрипсиногена В. Полностью раскрыта последовательность аминокислот химотрипсиногена А, во многом сходная с последовательностью аминокислот трипсина. Молекулярная масса его составляет примерно 25 000. Он состоит из одной полипептидной цепи, содержащей 246 аминокислотных остатков. Максимальная каталитическая активность химотрипсина проявляется при рН 7,8 – 9,0 [12, 56]. В поджелудочной железе синтезируется еще одна эндопептидаза – эластаза – в виде проэластазы. Превращение профермента в эластазу в тонкой кишке катализируется трипсином. Название фермент получил от субстрата эластина, который он гидролизует. Эластин содержится в соединительной ткани и характеризуется наличием большого числа остатков глицина и серина. Эластаза обладает широкой субстратной специфичностью, но предпочтительнее гидролизует пептидные связи, образованные аминокислотами с небольшими гидрофобными радикалами, в частности глицином, аланином и серином. Интересно, что ни трипсин, ни химотрипсин не гидролизуют пептидные связи молекулы эластина, хотя все три фермента, включая эластазу, последовательностей содержат и сходные одинаковые места участки положения аминокислотных дисульфидных мостиков, а также имеют в активном центре один и тот же ключевой остаток серина. Высказано предположение, что все три эндопептидазы поджелудочной железы: трипсин, химотрипсин и эластаза, – возможно, имеют один и тот же общий предшественник и что специфичность активного 38 фермента в основном определяется конформационными изменениями профермента в процессе активирования [48]. Специфичность определяется в большинства основном протеолитических структурой ферментов аминокислотного остатка, расположенного рядом с расщепляемой связью. Ферменты трипсинового типа катализируют гидролиз связей, образованных карбоксильной группой основных аминокислот (остатками лизина и аргинина). Для многих ферментов (химотрипсин, пепсин, субтилизины и др.) важно наличие вблизи расщепляемой связи объемистых гидрофобных остатков (фенилаланина, тирозина, триптофана и лейцина). Протеолитические ферменты типа эластазы (фермент поджелудочной железы) гидролизуют связи, образованные аминокислотными остатками с небольшой боковой группой (например, остатками аланина и серина). Место расщепления зависит от расположения пептидной связи в пространстве структуре субстрата – легче всего гидролизуются связи на р-изгибах цепи, которые расположены на поверхности молекулы. Многие протеолитические ферменты прочно ассоциированы с клеточными мембранами и поэтому действуют только на определенные белки (так называемая компартментализация). В зависимости от локализации фермента протеолиз происходит при различных рН. Так, протеолитические ферменты желудка (пепсин, гастриксин) функционируют при рН 1,5-2, лизосомные ферменты – при рН 4-5, а протеолитические ферменты сыворотки крови, тонкого кишечника и другие – при нейтральных или слабощелочных значениях рН. Протеолитические ферменты играют важную роль во многих процессах, происходящих в организме, например, при оплодотворении, биосинтезе белка, свертывании крови и фибринолизе, гормональной регуляции. Во многих этих случаях фермент расщепляет в субстрате лишь одну или несколько связей (ограниченный протеолиз). Активность протеолитических ферментов регулируется на посттрансляционной стадии 39 путем активации их неактивных предшественников (зимогенов), а также действием природных ингибиторов ферментов. Нарушения механизмов регуляции активности протеолитических ферментов – причина многих тяжелых заболеваний (мышечной дистрофии, аутоиммунных заболеваний, эмфиземы легких, панкреатитов и др.) [1]. Протеолитические ферменты применяют в медицине, например, для коррекции нарушений пищеварения, заживления ран и ожогов и др. Пепсин, трипсин, химотрипсин, липазу и амилазу применяют непосредственно для лечения заболеваний ЖКТ и др. Ферменты также используют для получения смесей аминокислот, в производстве гормональных препаратов и некоторых антибиотиков, в пищевой и кожевенной промышленности, производстве моющих средств. В пивоваренной и спиртовой промышленности применяют ферменты амилазы, ускоряющие реакцию осахаривания крахмала. 1.3 Аспекты индустрии спортивного питания Основным и постоянным проявлением жизнедеятельности организма является обмен веществ, благодаря которому обеспечивается самообновление и самовосстановление морфологических структур. При использовании напряженных тренировочных и соревновательных нагрузок, характерных для современного спорта, питание становится главным фактором восстановления [112]. Питание должно полностью покрывать расход энергии, вызываемый всей жизнедеятельностью организма. Суточная энергетическая ценность пищи должна соответствовать суточному расходу энергии. При этом необходимо учитывать, что энергозатраты при физических нагрузках зависят от интенсивности и объема выполняемой работы, уровня мастерства спортсмена, климатогеографических условий проведения соревнований и тренировок и др. При окислении 1 г углеводов в организме высвобождается в среднем 15,7 кДж (3,75 ккал), 1 г белка – 16,7 кДж (4 ккал), 1 г жира – 38,3 кДж (9,3 ккал) [13, 114, 120]. 40 Принцип определенных сбалансированного количественных питания требует соблюдения отношений между отдельными незаменимыми факторами пищи: белками, жирами, углеводами, витаминами и минеральными веществами. Для белков, жиров и углеводов соотношение должно составлять 1:0,8:4. Кроме того, нужно соблюдать соотношение между разными по происхождению и составу белками, жирами и углеводами, а также между различными витаминами и минеральными компонентами пищи [10, 31]. Выбор адекватных форм питания (продуктов, пищевых веществ и их комбинаций) и приемов пищи проводится с учетом содержания микроцикла тренировки, интенсивных нагрузок, подготовки к соревнованиям и восстановительной направленности. Тренировочные занятия, сопровождающиеся максимальным напряжением мышц и развитием силы, требуют преимущественно белкового питания и витаминов группы В и Е. Пища должна содержать повышенное количество полноценных и легкоусвояемых белков животного происхождения, одними из которых являются белки молока [6, 26, 167, 241]. Спортивное питание представляет собой ассортимент продуктов питания, разработанных специально для людей, активно занимающихся спортом, на основе научных достижений в области физиологии и диетологии [22, 64, 112]. Продукты спортивного питания подразделяются на так называемые специализированные категории товаров для достижения индивидуальных целей: похудение – сжигание жира; увеличение силовых показателей и выносливости; набор мышечной массы – увеличение веса; восстановление после интенсивных нагрузок различного характера; нормализация обмена веществ и функций организма; поддержание достигнутых результатов. Казеин и сывороточные белки являются основной структурой для производства спортивного питания. 41 Наиболее сбалансированным видом белка по аминокислотному профилю и степени биологической ценности является молочный белок, так как он в течение длительного времени (до 6-7 часов) равномерно переваривается. В первую очередь – низкомолекулярные белки, а потом высокомолекулярный казеин. При использовании в диетических целях и для восстановления мышц после физической нагрузки высокой и средней интенсивности такое свойство молочного белка особенно важно. Скорость усвоения белка является основным отличием этих фракций. Гидролизаты сывороточного белка (они же известны как пептиды сывороточного белка) представляют собой самое чистое белковое соединение, которое получается путем химического процесса/реакции – гидролиза. Крупные цепи белковых молекул расщепляют на составляющие мельчайшие белковые фрагменты – пептиды и аминокислоты [45]. Скорость усваивания белковых пептидов и аминокислот настолько высока, что первый аминокислотный всплеск в крови можно диагностировать уже через 15-20 минут после приема этой белковой формы [15, 116]. Отличительным свойством гидролизатов является микроструктура: сухая смесь гидролизата белков подобна «пыли», которая легко растворяется в жидкости. Существуют белковые продукты, содержащие очень высокое количество гидролизата белка, например, новый белковый продукт MuscleTech. Недостатком этой белковой формы является дорогое получение. Из-за дороговизны и высокой энергоемкости в производстве гидролизат сывороточного белка добавляют как одну из основ в комплексные белковые продукты. Выбор необходимого типа продуктов для спортивного питания зависит от поставленных целей. Если необходимо набрать мышечную массу, то употребляют биологически активные добавки, относящиеся к категориям гейнеров, протеинов и т.п. Гейнеры в первую очередь необходимы людям, твёрдо решившим набрать мышечный вес, занимаясь силовым тренингом, или поправиться, поскольку углеводы являются лучшим топливом для 42 физических нагрузок в тренажёрном зале, а белок – незаменимый строительный материал для роста мускулатуры и набора мышечной массы. Белки используются клетками организма как основной материал для строительства тканей и усваиваются клетками организма с помощью биохимического сигнала «еда», подаваемого гормоном инсулином. Инсулин рефлекторно вырабатывается поджелудочной железой при попадании в пищеварительный тракт углеводов. Соотношение поступления белков и углеводов в организме не должно превышать одной четверти белков по отношению к углеводам, при этих условиях количество выработанного инсулина хватит для усвоения белка. Оптимальное количество белка, потребляемого обычным человеком в день, должно составлять примерно 0,7 г на килограмм сухого веса, тогда как общее количество белка, которое должен потреблять атлет, примерно, в 1,5-2 раза больше [25]. Протеинсодержащие продукты являются самой популярной спортивной добавкой среди бодибилдеров и спортсменов многих других направлений. Протеиновые комплексы представляют собой пищевую добавку с высоким содержанием белка, концентрация которого достигает 70 – 95%. Эффект протеина заключается в том, что, перевариваясь в организме, протеин распадается на аминокислоты, из которых как раз синтезируются белковые молекулы организма, в том числе и мышечная ткань. Аминокислоты из протеина предотвращают разрушение мышц во время усиленных тренировок и способствуют их активному росту. На сегодняшний день сывороточный протеин является самой популярной протеиновой добавкой для набора массы, поскольку лучше других белковых продуктов снабжает организм такими незаменимыми аминокислотами, как лейцин, изолейцин и валин, которые участвуют в синтезе мышечного белка после тяжёлых физических нагрузок и обладают выраженными иммунными свойствами [116]. По технологии производства и концентрации белка сывороточный протеин можно разделить на два вида: концентрат сывороточного протеина и изолят протеина, которые отличаются между собой концентрацией белка и, 43 соответственно, своей стоимостью. В концентрате содержание белка доходит до 80%, а в изоляте – до 90-95%. Среди протеинов, предназначенных для роста мышц, также необходимо отметить казеин, яичный протеин, которые на протяжении долгого времени могут подпитывать организм аминокислотами. Среди вегетарианцев очень популярен соевый протеин, который по многим параметрам не уступает другим протеинам [49, 104]. Первое, о чем нужно помнить при покупке спортивного питания, – это то, что существует всего два продукта, эффективность которых действительно доказана: протеинсодержащие продукты. Протеинсодержащие смеси бывают двух видов – «быстрые» и «медленные». Быстрые лучше всего употреблять до и после тренировки, а также в течение дня. Медленные – перед сном, чтобы обеспечить мышцы ночным питанием. Спектр предлагаемой продукции на рынке белкового питания постоянно растет. Чтобы выбрать для себя единственно верное решение, прежде всего необходимо определить принципы, которые помогут выявить качественный, безопасный и полезный продукт [111]. ЗАКЛЮЧЕНИЕ ПО ОБЗОРУ ЛИТЕРАТУРЫ Анализ литературного поиска позволил сделать следующие заключения. Белковые концентраты можно рассматривать как химические соединения казеина и щелочных (натрий, калий) или щелочноземельных (кальций) металлов. Рациональное использование белковых веществ молока имеет большое значение. Это объясняется их высокой биологической ценностью, индифферентностью вкуса, безвредностью и функциональными свойствами. Имеющиеся ресурсы белков молока используются в питании в недостаточной степени. В настоящее время важной задачей пищевой промышленности является удовлетворение всех категорий населения высококачественными, биологически полноценными и безопасными продуктами питания. 44 Для решения этой проблемы и сокращения дефицита в продовольствии незаменимых пищевых веществ предполагается в качестве перспективного и экономически выгодного направления производство функциональных продуктов питания. В связи с этим актуальными в настоящее время являются исследования по сбалансированного разработке состава, специализированных обладающих продуктов лечебно-профилактическими свойствами, с учетом физиологических потребностей различных групп населения. Проведенный литературный анализ показывает, что главные принципы питания – сбалансированность и достижение определенной цели. Стремление к полезному и сбалансированному питанию является неотъемлемой частью современной тенденции к заботе о своем здоровье. Продукты функционального питания содержат повышенные по сравнению с обычными пищевыми компонентами количества основных питательных веществ, витаминов, энергосберегающих субстратов. Они одновременно выполняют роль поставщиков питательных веществ и оказывают профилактическое действие. В состав этих продуктов могут входить: балластные вещества, аминокислоты, пептиды, протеины, витамины, молочнокислые бактерии, жирные ненасыщенные кислоты, минералы, жизненно важные вещества из растений и антиоксиданты. Накопленные к настоящему времени данные по исследованию структуры питания современного человека показывают, что недостаточное потребление незаменимых компонентов пищи – широко распространенное явление. Этот факт обусловлен объективными закономерностями, оказывающими определяющее влияние на структуру пищевого рациона во всех экономически развитых странах. 45 ГЛАВА 2. МЕТОДОЛОГИЯ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЙ В настоящей главе рассмотрены вопросы, касающиеся организации выполнения работы, объектов и методов исследования. 2.1 Организация проведения исследований Теоретические и экспериментальные исследования выполнены в соответствии с поставленными задачами на кафедре «Бионанотехнология» Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Кемеровский технологический институт пищевой промышленности». Общая схема проведения исследований приведена на рисунке 2.1. Весь цикл исследований состоял из нескольких логически взаимосвязанных этапов. Первый этап диссертационной работы посвящен анализу результатов отечественных и зарубежных исследований по направлению диссертационной работы. Представлены подробная характеристика фракций казеина и их свойства, ассортиментная номенклатура казеинсодержащих концентратов и приведены технологические схемы их производства. Описаны свойства протеолитических ферментов, их роль и специфичность. Отражены основные аспекты производства продуктов функционального питания, сформулированы цель и задачи собственных исследований. На втором этапе проводили сравнительную характеристику состава и свойств молочно-белковых концентратов. На третьем этапе исследовали закономерности ступенчатого гидролиза казеина кислотным и ферментативным способами. На 1-ой ступени исследовали химический гидролиз казеина в присутствии серной кислоты до получения средних и коротких пептидов. Варьируя параметры биотехнологического процесса, выбирали параметры проведения процесса гидролиза казеина, обеспечивающие максимальное сохранение аминокислот. После нейтрализации кислот щелочью и регулирования рН-среды. На 2-ой 46 ступени проводили ферментативный гидролиз казеина энзиматическими системами. Исследовали состав и свойства систем, полученных в результате гидролиза - степень гидролиза и аминокислотный состав. Исследование и разработка технологии взбитых молочных десертов на основе гидролизата казеина Анализ отечественной и зарубежной литературы, формулировка цели и задач исследований Сравнительная оценка химического состава и биологической ценности концентратов молока -физико-химический состав казеина -массовая доля влаги -массовая доля белка -массовая доля жира -аминокислотный состав фракций Изучение закономерностей ступенчатого гидролиза казеина -параметры ступенчатого гидролиза -аминокислотный состав -свойства гидролизатов -малекулярно-массовое распределение белков и пептидов Исследование пенообразующих характеристик гидролизата казеина -температура взбивания -доза стабилизаторов -относительное распределение пузырьков газа -устойчивость пены -доза ягодных наполнителей Разработка технологии молочных взбитых десертов на основе гидролизата казеина -технологические параметры -органолептические характеристики -состав и физико-химические показатели -показатели безопасности -сроки хранения Практическая реализация результатов исследований Рисунок 2.1 - Общая схема проведения исследований 47 На четвертом этапе проводили исследования влияния коллоидов на пенообразующие свойства молочно-протеиновых основ, под которыми понимали гидролизаты казеина с различной массовой долей сухих веществ в присутствии стабилизаторов консистенции и растительных наполнителей. Результаты, полученные в ходе выполнения предыдущих этапов работы, использовали для разработки рецептур и обоснования технологического регламента выработки взбитых молочных десертов. Варьируя соотношение ингредиентов рецептуры, получали взбитые продукты с требуемыми составом и органолептическими показателями. На следующем этапе изучали химический состав, анализировали пищевую и биологическую ценность разработанных молочных продуктов на основе гидролизатов казеина, устанавливали продолжительность их хранения. Заключительный этап работы связан с практической реализацией результатов, а именно – разрабатывали нормативную документацию, проводили промышленную апробацию технологии, оценивали ожидаемую эффективность выработки. 2.2. Объекты исследований На разных этапах работы объектами исследований являлись: - казеин пищевой по ГОСТ 31689; - кислота серная по ГОСТ 4204; - натр едкий по ГОСТ 4328; - кальция гидроокись по ГОСТ 9262; - вода питьевая по ГОСТ Р 51232; - натрий лимоннокислый трехзамещенный 5,5-водный пищевой (цитрат натрия) по ГОСТ 312274; - коммерческие ферментные препараты: бромелин 60 ед., карбоксипептидаза А 1980 ед., лейцинаминопептидаза 24,0 ед. (фирмы Sigma); 48 - ягодное пюре; - стабилизаторы: желатин марки 11 по ГОСТ 11293, агар по ГОСТ 16280, пектин яблочный ВЯ-1 по ГОСТ 291-86; - сахар – песок по ГОСТ 21-94; - остальные использованные отечественные и импортные реактивы имели степень чистоты не ниже х. ч; - лабораторные, пилотные и промышленные образцы продукции. 2.3. Методы исследований При выполнении диссертационной работы использовали стандартные, общепринятые и оригинальные методы исследований, к которым можно отнести физико-химические (кислотный хроматографию, электрофорез, и ферментативный спектроскопию), гидролиз, биохимические, микробиологические, органолептические и другие. Отбор проб и подготовку их к анализу проводили по ГОСТ 26809 «Молоко и молочные продукты. Правила приемки, методы отбора и подготовка проб к анализу», ГОСТ Р 53430 «Молоко и продукты переработки молока. Методы микробиологического анализа», ГОСТ 26929 «Сырье и продукты пищевые. Подготовка проб. Минерализация для определения содержания токсичных элементов». Кислотный гидролиз проводили трижды перегнанной 6Н серной кислотой в герметичных условиях в режиме вакуума, при остаточном давлении 6 Па и температуре 110±5 0С в течение (2–6)±0,05 ч. После гидролиза ампулу охлаждали, вскрывали, содержимое переносили в небольшую коническую или круглодонную колбу. Серную кислоту упаривали досуха на ротационном испарителе при температуре 40–65 0C. Для удаления серной кислоты добавляли в колбу 1,5 мл воды и снова упаривали. Последнюю операцию проводили дважды [35]. Ферментативный гидролиз проводили статическим методом в 49 термостате с перемешиванием при температуре 50±2 оптимальных для используемого ферментного 0 С и рН-7,5, препарата (комплекса ферментов), а также согласно рекомендациям фирмы-изготовителя. Гидролиз вели при продолжительности (2–6)±0,05 ч, соотношении концентрации фермента к концентрации субстрата-белка 1:25, 1:50, 1:100. рН-статирование осуществляли добавлением 1Н раствора гидроокиси натрия. По окончании процесса ферментный препарат в составе гидролизата инактивировали нагреванием до температуры 95±5 0С в течение 5-10 мин [30]. Удаление аммиака проводили с помощью ротационного испарителя ИР1ЛТ, предназначенного для проведения работ, связанных с быстрым удалением растворителей из растворов или суспензий органических и неорганических соединений путем пленочного испарения при нормальном или пониженном давлении и контролируемой температуре [34,102]. Активную кислотность определяли по активности ионов водорода с помощью потенциометрического анализатора. Для этого в химический стакан наливали анализируемый образец и опускали электрод. При этом электроды анализатора не касались стенок и дна стакана. Через 10 сек. снимали показания по шкале прибора. Для количественного и качественного определения аминокислотного состава использовали систему на базе высокоэффективного жидкостного хроматографа (аминокислотный анализатор) Aracus PMA GmbH. Метод основан на постколоночной дериватизации и заключается в разделении аминокислот на ионообменной колонке при ступенчатом градиенте pH и последующей реакции с нингидрином в реакторе. Обнаружение окрашенных производных аминокислот проводится при помощи спектрофотометрического детектора на длинах волн 570 и 440 нм. Содержание белка определяли на анализаторе общего азота (белка) «RAPID N ELEMENTAR», работающего по методу Дюма сжигания пробы с регистрацией общего азота на детекторе теплопроводности. Для определения белка на анализаторе пробу капсулировали, при этом точность анализа 50 составила 0,5%. Содержание общего белка рассчитывали умножением общего азота на пересчетный коэффициент для белков молока, составляющий 6,38 [131]. Для количественного определения массовой доли аминного азота использовали метод Лоури. В данном методе сочетаются две реакции. Первая – биуретовая реакция. Во второй реакции (реакция Фолина) задействован реактив Фолина - Чокальтеу. В ней образуются окрашенные в синий цвет комплексы фосфорно-вольфрамовой и фосфорно-молибденовой кислоты под действием тирозина и триптофана, входящих в состав белков [108]. Степень гидролиза определяли как отношение аминного азота к общему азоту [106]. Молекулярно-массовое распределение белков и пептидов в получаемых гидролизатах оценивали электрофоретическим способом в полиакриламидном геле (ПААГ) методом Лэмли. Для этого подготавливали пластинки для полимеризации ПААГ, а резервуары камеры для электрофореза заполняли электродным буферным раствором (0,066 M Трис, 0,19 M глицин, 0,1% ДСН). В каждую лунку образовавшегося геля вносили анализируемый, предварительно подготовленный образец [32, 41]. Пробподготовка заключалась в следующем. В пробирки типа эпиндорф вносили 20 мкл. белка; 10 мкл. буфера для образцов; 10 мкл. дистиллированной воды. После чего образец перемешивали на вортоксе и кипятили 5 мин. После чего включали прибор и наблюдали за разделением белков. Электрофорез проводили при силе тока 50±0,1 мА и 75±0,2 мА. После проведения электрофоретического исследования гель промывали и окрашивали тремя реагентами: фиксирующим раствором (10 мин при 80±20С), раствором для «отмывки» (10 мин при 80±20С) и окрашивающим раствором (10 мин при 80±20С). На последней стадии проводили обесвечивание геля в дистиллированной воде при температуре 25±2 0С. Просмотр и фотографирование гелей проводили на УФ- трансиллюминаторе TCP-20M («Vilber Lourmat», США) при длине волны излучения - 312 нм. Сохранение и обработку данных осуществляли с 51 помощью гель - документирующей системы Vitran-Photo. Массовую долю аммиака определяли электрофореза с помощью системы разработанной в научно-образовательном методом «КАПЕЛЬ центре капиллярного 105» по методике, при ФГБОУ ВПО «КемТИПП». Определение жирорастворимых витаминов проводили методом обращенно-фазной высокоэффективной жидкостной хромотографией на хроматографе «Милихром» со спектрофотометрическим детектором и спектральным диапазоном 190-360 нм. Сущность метода заключается в экстрации витаминов из анализируемой пробы экстрагентом. Массовую долю макро- и микроэлементов определяли методом атомно-абсорбционной спектрофотометрии. Принцип метода основан на способности диссоциированных атомов элементов поглощать свет в узкой области спектра. Исследования проводили на приборе «Hitachi» (Япония) по приложенной инструкции. Органолептические свойства исследуемых образцов определяли в следующей последовательности: - внешний вид: характеризовали общее зрительное впечатление о продукте (характер поверхности, однородность, форма, наличие посторонних примесей); - цвет: устанавливали цвет для разработанного продукта, а также отклонения от цвета; - запах: определяли аромат, «букет», а также устанавливали наличие посторонних запахов; - консистенция: учитывали однородность, присутствие твердых частиц; - вкус: определяли, типичен ли вкус для данного вида продукта. 52 Таблица 2.1 - Органолептические показатели качества определяли по тридцати балльной шкале Показатели качества Коэффици ент значимост и Шкала оценки, баллы Число высшая степеней Удовлетвомаксимальная отлично хорошо качества рительно оценка Вкус и аромат 3 3 9 9-7 6-4 3-1 Структура и консистенция 4 3 12 12-9 8-5 4-1 2 3 6 6-5 4-3 2-1 1 3 3 3 2 1 10 - 30 30-24 20-14 10-4 Цвет и внешний вид Форма Общая оценка Микробиологические показатели оценивали путем подсчета колоний, выросших на чашках Петри с питательными средами [135]. В качестве питательных сред использовали мясо-пептонный агар, картофельный и солодовый агары. Для определения общей обсемененности готового продукта готовили его водный раствор в соотношении 1:100, 1:1000 и 1:10000. Из каждого приготовленного раствора делали высевы на шести чашках Петри. Для этого стерильной пипеткой у пламени горелки отбирали 0,3 мл ферментного раствора и переносили на поверхность агара. После этого засеянные чашки Петри инкубировали в течение 48 ч. при температуре 37±20С. Общую бактериальную обсемененность исследуемых образцов рассчитывали, как среднее арифметическое число колоний микроорганизмов на 1 г препарата для всех разведений. Определение общего количества дрожжей и плесневых грибов проводили в соответствии с ГОСТ 10444.12 путем посева в чашки Петри на сусло-агар. Для определения бактерий группы кишечной палочки использовали метод накопления путем посева на среде Кесслера с последующей идентификацией на среде Эндо согласно ГОСТ 9225. 53 Определение сальмонелл проводили по ГОСТ Р 50480 путем посева на накопительную среду Кауфмана с последующим посевом на среде Эндо. В образцах исследуемого объекта определяли: общее количество мезофильных аэробов и факультативно-анаэробных микроорганизмов, содержание группы бактерий кишечной палочки, анаэробных спорогенных сульфитредуцирующих клостридий, сальмонелл. Определение содержания токсичных элементов, пестицидов, антибиотиков и радионуклидов: - свинца – по ГОСТ Р 51301 «Продукты пищевые и продовольственное сырье. Инверсионно-вольтамперометрические методы определения содержания токсичных элементов (кадмия, свинца, меди и цинка)», ГОСТ 26932 «Сырье и продукты пищевые. Методы определения свинца», ГОСТ 30178 «Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов», ГОСТ 30538 «Продукты пищевые. Методика определения токсичных элементов атомно-эмиссионным методом» и МУК 4.1.986 «Методика выполнения измерений массовой доли свинца и кадмия в пищевых продуктах и продовольственном сырье методом электротермической атомно-абсорбционной спектрометрии. Методические указания»; - мышьяка – по ГОСТ Р 51766 «Сырье и продукты пищевые. Атомноабсорбционный метод определения мышьяка»; - кадмия – по ГОСТ Р 51301 «Продукты пищевые и продовольственное сырье. Инверсионно-вольтамперометрические методы определения содержания токсичных элементов (кадмия, свинца, меди и цинка)», ГОСТ 26933 «Сырье и продукты пищевые. Методы определения кадмия», ГОСТ 30178 «Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов», ГОСТ 30538 «Продукты пищевые. Методика определения токсичных элементов атомно-эмиссионным методом» и МУК 4.1.986 «Методика выполнения измерений массовой доли свинца и кадмия в пищевых продуктах и продовольственном сырье методом 54 электротермической атомно-абсорбционной спектрометрии. Методические указания»; - ртути – по ГОСТ 26927 «Сырье и продукты пищевые. Методы определения ртути» и МУ 5178 «Методические указания по определению ртути в пищевых продуктах». Для определения показателей радиологической безопасности – удельная (объемная) активность цезия-137 и стронция-90 использовали МУК 2.6.1.7171-98 «Радиационный контроль. Стронций-90 и Цезий-137. Пищевые продукты. Отбор проб, анализ и гигиеническая оценка». Экспериментальные данные обрабатывали методом математической статистики на ЭВМ. Для дальнейшей обработки применяли пакет программ WinStat или Statistica 5.0. Устойчивость пен определяли с момента окончания процесса пенообразования до полного разрушения пен над зеркалом пенообразователя [21, 46, 93, 107]. Под кратностью пены понимаем отношение объема пены и рабочего раствора, до газонасыщения, выраженное в %. Под коэффициентом устойчивости понимаем период полураспада пены, выраженный в минутах. Дисперсность ПМ, размер и количество воздушных пузырьков определяли методом замораживанием микрофотографирования образцов в атмосфере с жидкого предварительным азота. Обработку результатов проводили по методикам, изложенным в [8, 27, 33, 36]. Микрофотографии ПМ и пенных пленок получены на приборе NЕOFOT-21 в проходящем или отраженном свете в зависимости от свойств фотографируемых систем [80]. Подготовку проб к анализу осуществляли по методикам, изложенным в [43, 71]. Под критерием продолжительности процесса понимали такую его длительность, при которой (заданных) показателей [91]. изучаемый объект достигал наилучших 55 ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ 3.1. Сравнительная оценка химического состава и биологической ценности концентратов молочных белков В зависимости от конкретной технологии производства и природы агентов, вызывающих коагуляцию и образование казеинового сгустка, из обезжиренного молока получают следующие основные виды молочнобелковых концентратов: – сычужный казеин, получаемый ферментативной коагуляцией белка в обезжиренном молоке с последующей промывкой и сушкой; – кислотный казеин, получаемый подкислением обезжиренного молока кислотами до изоэлектрической точки, нагревом, промывкой и сушкой; – казеинаты, например, казеинат натрия, получаемый из кислотного казеина путем его растворения в растворе гидроксида натрия с последующей сушкой; – казецит, получаемый из казеина-сырца путем его растворения в солях цитратов с последующей сушкой; – концентрат натурального казеина (жидкий и сухой), получаемый из обезжиренного молока с использованием полисахаридов; – сывороточный белковый концентрат, получаемый методом ультрафильтрации; – белок сывороточный растворимый сухой, получаемый методом обработки подсырной сыворотки ультрафильтрацией и диафильтрацией с последующей сушкой; – микропартикулированный (т.е. представленный в виде микрочастиц) белок – это натуральный ингредиент, сформированный микрочастицами, диаметр каждой из которых составляет около одной тысячной миллиметра. Каждая микрочастица состоит из множества миллионов цельных молекул белка [4, 12, 23], вырабатывается из концентрата сывороточного белка (КСБ) 56 без вспомогательных средств; – копреципитаты, получаемые нагреванием обезжиренного молока до высокой температуры с последующим осаждением комплекса казеина с сывороточными белками хлоридом кальция или кислотой. Исследования направлены на анализ и сравнительную оценку химического состава и биологической ценности казеина с целью дальнейшего использования в качестве сырья для получения гидролизата; результаты исследований, проведенных в трехкратной последовательности в сравнении с ГОСТ 31689, представлены в таблице 3.1. Таблица 3.1 - Физико-химический состав казеина (n=3) Наименование показателя Массовая доля влаги, %, не более Массовая доля жира, %, не более Массовая доля жира в сухом веществе, %, не более Массовая доля белка, %, не менее Массовая доля золы, %, не менее Массовая доля золы (включая Р2О5), %, не более Массовая доля лактозы, %, не более Свободная кислотность, оТ, не более Индекс растворимости (объем осадка на 1 г белка, см3), не более Норма для казеина пищевого согласно ГОСТ 31689 кислотного сычужного 12,0 12,0 1,5 2,0 Содержание по факту 10,00 ± 0,45 1,30 ± 0,06 1,7 2,3 1,50 ± 0,08 90,0 - 84,0 7,0 91,80 ± 0,60 - 2,5 - 2,30 ± 0,02 1,0 1,0 0,90 ± 0,04 80 60 69,00 ± 2,00 0,4 1,2 0,30 ± 0,03 Как следует из результатов исследований, представленных в таблице 3,1, массовая доля общего белка в испытуемых образцах составила 91,8 ± 0,60%, лактозы 0,9 ± 0,04%, жира 1,3 ± 0,06%, свободная кислотность составила 69,0 ± 2,00 °Т, следовательно, исследуемый образец казеина по физико-химическим показателям отвечал требованиям нормативной документации и относится к пищевому казеину, полученному кислотным способом коагуляции. Очищенный казеин, выделенный из молока кислотным способом, 57 представляет собой аморфный порошок или гранулы белого цвета, без запаха и вкуса, практически не растворимый в воде и спирте, растворимый в слабых растворах щелочей, солей щелочных и щелочноземельных металлов и минеральных кислот. В нормальном состоянии казеин обладает амфотерными свойствами. Его можно разделить на фракции, которые несколько различаются по составу и свойствам. Казеин содержит 19 из 20 присутствующих в молоке аминокислот [68]. Казеин является гетерогенным белком, то есть при электрофорезе образует несколько фракций с разной подвижностью. Все фракции характеризовались значительной термоустойчивостью (казеин рассматривали как белок, денатурированный в нативном состоянии), с распределением вдоль полипептидной цепи полярных и неполярных аминокислот и др. (рисунок 3.1, таблица 3.2). кДа γказеи н β-казеин αs1казеин χказеин αs2казеин др. фракции 10 15 18 21 23 24 25 26 Рисунок 3.1. Электрофорез в полиакриламидном геле фракционного состава казеина. Объединение казеинов проводили в полиакриламидном геле по величине электрофоретической подвижности, άS1-казеин – главный компонент наиболее электрофоретически подвижной и чувствительной к ионам кальция фракции άS-казеинов. 58 Среди основных фракций казеина S-казеины занимали наибольшее количество от общего белка и составляли в сумме порядка 45%, при этом молекулярная масса S-фракции в исследуемом образце казеина составляла от 22,07 до 25,40 кДа. Молекулярная масса -казеинов составляла около 24 кДа, их содержание в среднем составило 28% от общего количества белка. На долю χ- и γ-казеинов пришлось от 10 до 4%, соответственно, остальное количество белков составляли их фрагменты. Наибольший разбег в размерах молекулярной массы имели белки, принадлежавшие к γ-казеину, – от 11 до 20,5 кДа. Фракция χ-казеина имела молекулярную массу около 19 кДа. С целью получения более полной информации о составе казеина в исходном образце определяли его аминокислотный состав по фракциям (таблица 3.2, рисунки 3.2 – 3.5). Из ά-казеинового комплекса άS-фракцию можно выделить путем осаждения 0,4 М раствором СаС12 при рН 7 и температуре 4оС. Помимо άS1-казеина она содержит минорные компоненты (άS0, 2, 3, 4, 5-казеины). Массовая доля общего азота в ά-казеиновом комплексе составила в сумме 7,53 ± 0,31%. Анализ рисунка 3.2 и таблицы 3.2 показал, что фракции άS-казеинов отличались от других фракций казеина повышенным содержанием таких незаменимых аминокислот, как лизин – 8,62 ± 0,52%, изолейцин – 6,03 ± 0,30%, а также заменимых аминокислот: тирозин – 5,33 ± 0,29%, глутаминовая и аспарагиновая кислоты – 21,30 ± 0,81 и 6,22 ± 0,25% соответственно. В исследуемых образцах казеина άS-фракции содержали пониженное количество незаменимых аминокислот, таких как треонин и триптофан – 2,27 ± 0,11 и 2,08 ± 0,12% соответственно. Из числа заменимых аминокислот, содержащихся в άS-казеинах, в наименьшем количестве находились аланин, глицин и гистидин – 3,11 ± 0,20, 3,12 ± 0,22 и 3,01 ± 0,21 % соответственно. 59 Таблица 3.2 - Характеристика казеиновых фракций в казеине Наименование показателя Фракции казеина αs1αs2казеин казеин β-казеин χ-казеин Содержание от общего 37,06 ± 10,97 28,96 ± 11,99 ± количества белка, % 1,1 ± 0,32 0,86 0,36 Молекулярная масса, кДа 22,0725,1523,9419,0123,63 25,40 24,09 19,04 Массовая доля общего 5,81 ± 1,72 ± 4,54 ± 0,26 1,88 ± 0,17 азота, % 0,55 0,07 Незаменимые аминокислоты, %, в том числе: 5,49 ± 0,27 8,14 ± 0,41 5,82 ± 0,32 валин 6,13 ± 0,30 5,65 ± 0,33 5,44 ± 0,31 изолейцин лейцин 8,31 ± 0,49 8,58 ± 0,48 6,88 ± 0,35 8,52 ± 0,34 5,44 ± 0,39 6,71 ± 0,23 3,06 ± 0,21 3,38 ± 0,17 1,06 ± 0,06 2,31 ± 0,11 5,55 ± 0,32 6,34 ± 0,33 2,08 ± 0,11 0,96 ± 0,05 1,08 ± 0,03 5,33 ± 0,26 5,24 ± 0,24 4,86 ± 0,36 Заменимые аминокислоты, %, в том числе: 3,11 ± 0,20 1,85 ± 0,05 5,44 ± 0,23 аланин 4,24 ± 0,21 3,34 ± 0,17 4,61 ± 0,34 аргинин 6,22 ± 0,25 3,46 ± 0,35 7,58 ± 0,42 аспарагиновая кислота 3,12 ± 0,22 3,15 ± 0,23 1,67 ± 0,05 гистидин 3,01 ± 0,21 2,22 ± 0,14 1,81 ± 0,04 глицин 21,25 ± 16,18 ± 21,30 ± 0,81 глутаминовая кислота 0,74 0,21 13,14 ± 7,05 ± 0,49 8,78 ± 0,43 пролин 0,19 5,51 ± 0,45 5,35 ± 0,34 6,89 ± 0,36 серин 5,03 ± 0,29 3,20 ± 0,22 7,45 ± 0,42 тирозин 1,40 ± цистеин + цистин 0,04Всего 100 ± 0,36 100 ± 0,41 100 ± 0,33 лизин метионин треонин триптофан фенилаланин В растворе мочевины концентрацией γ-казеин 3,01 ± 0,12 11,6020,50 0,47 ± 0,08 0,55 ± 0,03 4,45 ± 0,35 11,01 ± 0,56 7,24 ± 0,25 4,23 ± 0,32 4,55 ± 0,33 1,11 ± 0,04 5,93 ± 0,27 2,53 ± 0,09 1,80 ± 0,07 4,11 ± 0,12 3,53 ± 0,11 1,53 ± 0,08 22,45 ± 0,65 15,66 ± 0,23 5,55 ± 0,22 3,77 ± 0,24 100 ± 0,21 4,6 М β- фракция казеина, растворима, однако она не растворима в этом же растворе, но с концентрацией 3,3 М. β-Казеин нечувствителен к ионам кальция при температуре 4°С, но осаждается ими при 35°С [70, 128]. Данные, представленные в таблице 3.2 и на рисунке 3.3, свидетельствуют о том, что фракция β-казеина в исследуемых образцах казеина характеризовалась повышенным содержанием таких незаменимых аминокислот, как валин – 60 8,21 ± 0,41% и лейцин – 8,62 ± 0,48%. mV 880 35.727' Leu 800 37.789' Tyr 720 25.173' Pro 19.738' 240 52.420' Lys 60.915' Arg 45.035' 34.850' Ile 17.648' Thr 16.536' Ser 320 27.798' Gly 21.715' Glu 28.760' Ala 400 33.305' Met 31.685' Cys 46.403' 480 54.563' NH4 560 44.159' His 41.242' Phe 640 160 1 2 80 3 4 20 5 6 7 24 8 28 9 10 11 12 32 36 13 40 14 44 15 16 48 52 17 56 min 60 Рисунок 3.2. Хроматографический профиль аминокислотного состава άSказеинов: 1 – триптофан; 2 – метионин; 3 – треонин; 4 – аргинин; 5 – глицин; 6 – гистидин; 7 – тирозин; 8 – валин; 9 – изолейцин; 10 – серин; 11 – лизин; 12 – глутаминовая кислота; 13 – лейцин; 14 – пролин; 15 – аспарагиновая кислота; 16 – аланин; 17 – фенилаланин. 35. 691' Leu mV 800 37. 753' Tyr 720 54. 591' NH4 52. 462' Lys 60. 962' Arg 45. 028' 34. 810' Il e 25. 083' Pro 27. 768' Gl y 21. 724' 19. 738' Gl u 12. 844' Asp 240 17. 642' Thr 16. 523' Ser 320 160 28. 716' Al a 400 33. 276' Met 480 46. 404' 31. 653' C ys 560 44. 166' Hi s 41. 203' Phe 640 80 0 1 2 3 15 4 20 5 25 6 7 8 9 30 10 11 35 12 40 13 45 14 15 50 16 55 17 60 mi n Рисунок 3.3. Хроматографический профиль аминокислотного состава βказеина: 1 – триптофан; 2 – глицин; 3 – гистидин; 4 – аланин; 5 – тирозин; 6 – аргинин; 7 – аспарагиновая кислота; 8 – фенилаланин; 9 – метионин; 10 – пролин; 11 – глутаминовая кислота; 12 – изолейцин; 13 – валин; 14 – лизин; 15 – лейцин; 16 – треонин; 17 – серин. 61 mV 880 35. 727' Leu 800 37. 789' Tyr 720 44. 159' Hi s 41. 242' Phe 560 25. 173' Pro 19. 738' 16. 536' Ser 240 52. 420' Lys 46. 403' 60. 915' Arg 45. 035' 34. 850' Il e 17. 648' Thr 320 27. 798' Gl y 21. 715' Gl u 28. 760' Al a 400 33. 305' Met 31. 685' C ys 480 54. 563' NH4 640 160 1 2 80 3 4 5 20 6 7 24 8 9 10 11 12 28 32 36 13 40 14 15 44 16 17 48 52 18 56 60 mi n Рисунок 3.4. Хроматографический профиль аминокислотного состава χказеина: 1 – триптофан; 2 – глицин; 3 – гистидин; 4 – аланин; 5 – тирозин; 6 – аргинин; 7 – аспарагиновая кислота; 8 – фенилаланин; 9 – метионин; 10 – пролин; 11 – глутаминовая кислота; 12 – изолейцин; 13 – валин; 14 – лизин; 15 – лейцин; 16 – треонин; 17 – серин; 18 – цистеин. 35. 691' Leu mV 800 37. 753' Tyr 720 54. 591' NH4 52. 462' Lys 60. 962' Arg 45. 028' 34. 810' Il e 25. 083' Pro 27. 768' Gl y 21. 724' 19. 738' Gl u 12. 844' Asp 240 17. 642' Thr 16. 523' Ser 320 160 28. 716' Al a 400 33. 276' Met 480 46. 404' 31. 653' C ys 560 44. 166' Hi s 41. 203' Phe 640 80 0 1 2 3 15 4 20 5 6 25 7 8 9 10 11 12 30 35 13 40 14 45 15 50 16 55 17 60 mi n Рисунок 3.5. Хроматографический профиль аминокислотного состава γказеина: 1 – триптофан; 2 – глицин; 3 – валин; 4 – аланин; 5 – тирозин; 6 – аргинин; 7 – аспарагиновая кислота; 8 – фенилаланин; 9 – метионин; 10 – пролин; 11 – глутаминовая кислота; 12 – изолейцин; 13 – серин; 14 – лейцин; 15 – лизин; 16 – треонин; 17 – гистидин. 62 Наряду с этим в β-фракции казеина наблюдалось низкое содержание триптофана, аланина и глицина. Так же как в άS-казеинах, в β-фракции отсутствовала заменимая аминокислота – цистеин; в полипептидной цепи имеет пять остатков фосфорной кислоты. ά-Фракция казеина превосходила βказеин по таким незаменимым аминокислотам, как изолейцин, лизин и триптофан на 0,48, 3,09 и 1,17% соответственно. Как показал анализ экспериментальных данных, представленных на рисунке 3.4 и в таблице 3.2, χ-казеин в отличие от других компонентов казеина содержит цистеин в количестве 1,40 ± 0,04%, а также значительное количество треонина – 6,24 ± 0,33% и аланина – 5,44 ± 0,23%, содержание которых превышало άS-фракцию казеина в 2,7 и 1,7 раза соответственно. Однако в этой фракции казеина отмечалось меньшее содержание метионина – 1,07 ± 0,06%, гистидина 1,67 ± 0,05% и глицина 1,81 ± 0,04%. В полипептидной цепи имеется только один остаток фосфорной кислоты. Массовая доля общего азота в χ-казеиновом комплексе составила 1,88 ± 0,17%. χ-Казеин – фракция ά-казеинового комплекса, растворимая в 0,4 М растворе СаС12. γ1-Казеин, имеет молекулярную массу около 20 кДа, а минорные компоненты этой фракции (γ2- и γ3-казеин с молекулярной массой около 11,6 кДа) составляют фрагменты полипептидной цепи β-казеина. Эта фракция характеризовалась наименьшим содержанием валина – 0,54 ± 0,03% и аргинина – 1,90 ± 0,07%. Также необходимо отметить, что в этой фракции, по сравнению с остальными, содержалось наибольшее количество пролина – 17,01 ± 0,23% и лейцина – 12,01 ± 0,56%. Во всех фракциях казеина отмечалось высокое содержание глутаминовой кислоты. Обобщая результаты исследований фракционного и аминокислотного состава казеина, стоит отметить, что в целом опытные результаты согласуются с теоретическими данными, представленными разными учеными [5, 97]. Концентрат казеина с массовой долей общего белка 91,8 ± 0,60% и влаги 10,0 ± 0,45% содержит достаточное количество аминокислот, в том числе и 63 незаменимых, и является хорошим сырьем для его гидролиза с целью получения доступных коротких пептидов и аминокислот. 3.2. Изучение закономерностей ступенчатого гидролиза казеина В пищевой промышленности гидролизаты белков можно использовать используются как готовые продукты, а также как полуфабрикаты или функциональные добавки при производстве пищевых продуктов различного предназначения. В последнее время значимость белковых гидролизатов на рынке спортивного питания, а также пищевых продуктов постоянно возрастает. Можно предполагать, что эта тенденция сохранится и в будущем. Белковые гидролизаты широко специализированных используют продуктов за рубежом детского Существует множество способов применения и для производства спортивного питания. и производства молочно- белковых концентратов, одним из таких способов является гидролиз белков. 3.2.1. Определение рациональных параметров кислотного гидролиза казеина Жесткими условиями обладают химические методы, используемые для гидролиза молочных белков. Процесс химического гидролиза белков молока может продолжаться от 3 до 24 час и зависит от концентрации используемой кислоты и температурных условий. Особенность кислотного гидролиза заключается в том, что достигается значительная глубина расщепления белка и исключается возможность бактериального загрязнения полученного гидролизата [139]. В процессе протекания кислотного гидролиза при вышеуказанных условиях происходит значительное искажение белковых структурных единиц и наблюдается полное разрушение триптофана. Однако, в то же время 64 подвергаются рацемизации и разрушению (образование стереоизомеров, не усваивающихся организмом), хотя и в меньшей степени, оксикислоты, дикарбоновые кислоты и пролин [145]. С целью достижения наибольшей степени гидролиза при минимальном разрушении аминокислот на следующем этапе работы изучали закономерности ступенчатого гидролиза казеина. На первой ступени изучали кислотный гидролиз казеина серной кислотой с целью определения минимального времени гидролиза и максимального эффекта накопления аминного азота. Эксперимент проводился в пяти повторностях. Для проведения гидролиза использовали казеин пищевой, с массовой долей белка 91,8 ± 0,60% и влаги 10,0 ± 0,45%. Кислотный гидролиз проводили в присутствии 6 Н серной кислоты в герметичных условиях, при температуре 110 ± 5оС, в течение (2 – 6) ± 0,05 ч. Соотношение белок/серная кислота варьировалось в пределах 1:15, 1:20 и 1:25. Состав полученных в результате кислотного гидролиза белковых гидролизатов представлен в таблице 3.3. Таблица 3.3 - Состав гидролизатов казеина, полученных в результате кислотного гидролиза (n=5) Массовая доля, % Соотношение белок/серная кислота 1:15 1:20 1:25 Продолжительность процесса 2,00 ± 0,05 ч. общего азота 14,38 ± 0,51 аммиака 0,009 ± 0,001 0,019 ± 0,001 0,033 ± 0,001 аминного азота 0,051 ± 0,002 0,086 ± 0,003 0,122 ± 0,008 Продолжительность процесса 4,00 ± 0,05 ч. общего азота 14,38 ± 0,51 аммиака 0,026 ± 0,004 0,046 ± 0,001 0,087 ± 0,005 аминного азота 0,079 ± 0,04 0,129 ± 0,008 0,261 ± 0,03 Продолжительность процесса 6,00 ± 0,05 ч. общего азота 14,38 ± 0,51 аммиака 0,056 ± 0,025 0,084 ± 0,007 0,138 ± 0,02 аминного азота 0,214 ± 0,12 0,757 ± 0,014 1,031 ± 0,07 Массовая доля общего азота в исходном образце казеина составляла 65 14,38 ± 0,51%. Анализ данных, представленных в таблице 3.3, показал, что с увеличением продолжительности гидролиза происходит накопление аминного азота и аммиака во всех исследуемых образцах, причем с увеличением продолжительности гидролиза интенсивнее протекают процессы. При соотношении белок : кислота 1:15 за 2,00 ± 0,05 ч. гидролиза массовая доля аммиака и аминного азота составила 0,009±0,001 и 0,051±0,002% соответственно, а через 6,00±0,05 ч. протекания реакции при аналогичных условиях эти показатели увеличились на 84 и 76% соответственно. При увеличении количества серной кислоты до 20 частей к одной части исходного белка выход аммиака и аминного азота за 6,00±0,05 ч. увеличивался на 77 и 88% и составил 0,084±0,007 и 0,757±0,014% соответственно. Аналогичная тенденция наблюдалась при гидролизе казеина в соотношении белок: кислота 1:25. Максимальное накопление аминного азота наблюдалось в испытуемых образцах, подвергшихся 6 ч. гидролизу казеина при соотношении белок : кислота 1:25. На данном этапе интерес представляло накопление аминного азота, поэтому, анализируя полученные результаты, можно констатировать тот факт, что при соотношении гидролизного субстрата белок:кислота 1:15, 1:20 и 1:25 при продолжительности процесса с 2,00±0,05 до 4,00±0,05 ч. накопление азота увеличивалось на 35, 33 и 53% соответственно, а с 4,00 ± 0,05 до 6,00±0,05 ч. – на 63, 82 и 74%. Таким образом, 4,00±0,05 ч. для более полного накопления аминного азота недостаточно, а увеличение количества серной кислоты до 25 частей при продолжительности реакции 6,00±0,05 ч. не приводит к увеличению выхода аминного азота. Учитывая вышеизложенное, рациональными параметрами гидролиза явилось соотношение белок:кислота 1:20 при использовании 6Н серной кислоты в герметичных условиях, при температуре 110±5°С и продолжительности процесса 6,00±0,05 ч. 66 На следующем этапе исследований определяли степень гидролиза, СГ, % результаты исследований представлены на рисунке 3.6. Продолжительность гидролиза, ч Рисунок 3.6. Степень гидролиза при обработке казеина 6 Н серной кислотой (1-я ступень) в течение 2, 4 и 6 ч. при соотношении белок:кислота: - – 1:15, – 1:20, – 1:25. Анализ рисунка 3.6 показал, что с увеличением продолжительности реакции степень гидролиза возрастала. Наибольшая степень гидролиза наблюдалась при соотношении белок:кислота 1:25 и составляла 17,18±1,16, 27,51±1,12 и 41,02±1,19% при 2, 4 и 6,00±0,05 ч. соответственно. При соотношении белок :кислота 1:20 степень гидролиза казеина составляла 12,56 ±0,83, 24,43±1,37 и 38,79±1,17% при аналогичной продолжительности реакции. Необходимо незначительно при отметить, соотношении что степень гидролиза белок:кислота 1:20 отличалась и 1:25 и продолжительности процесса 6,0 ±0,05 ч. и составляла около 40%. Однако из литературных данных известно, что при кислотном гидролизе под действием концентрированных неорганических кислот доля разрушения таких аминокислот, как серин, треонин, цистин, тирозин и фенилаланин, превышает желаемые результаты. В этой связи в ходе 67 постановки ряда экспериментов остановились на соотношении белок:серная кислота 1:20 и продолжительности процесса 6±0,05 ч. При этом степень гидролиза казеина достигала 39,19±1,17%. Для дальнейшего более глубокого анализа гидролиза казеина в присутствии распределение серной в кислоты зависимости определяли от молекулярно-массовое соотношения белок/кислота и продолжительности реакции электрофоретическим методом в ПААГ. Результаты исследований представлены на рисунке 3.7 и в таблице 3.4. кДа М 1: 15 1: 20 1: 25 М 28,0 25,0 23,0 20,0 18,0 10,0 5,0 1,0 М 1 2 3 1 2 3 1 2 3 М Рисунок 3.7. Электрофорез в полиакриламидном геле кислотного гидролиза казеина (окрашивание кумасси бриллиантовым синим G-250) при соотношениях белок/кислота 1:15 – 1:25 и продолжительности реакции: 1 – 2,00 ± 0,05, 2 – 4,00 ± 0,05, 3 – 6,00 ± 0,05 ч. 68 Таблица 3.4 - Молекулярно-массовое распределение белков и пептидов в кислотном гидролизате казеина (n=5) Относительное содержание, % при соотношении белок/серная кислота 1:15 1:20 1:25 Молекулярная масса, кДа Продолжительность процесса 2,00 ± 0,05 ч. более 20,00 33,01 ± 1,16 29,55 ± 1,47 от 10,00 до 20,00 42,44 ± 1,16 39,21 ± 1,35 от 5,00 до 10,00 20,24 ± 0,59 18,46 ± 0,94 менее 5,00 4,31 ± 0,21 12,78 ± 0,76 Продолжительность процесса 4,00 ± 0,05 ч. более 20,00 24,24 ± 0,99 16,24 ± 0,86 от 10,00 до 20,00 29,19 ± 2,74 31,19 ± 2,04 от 5,00 до 10,00 27,95 ± 1,96 28,55 ± 2,30 менее 5,00 18,62 ± 0,34 24,02 ± 1,79 Продолжительность процесса 6,00 ± 0,05 ч. более 20,00 18,17 ± 0,57 13,43 ± 0,53 от 10,00 до 20,00 25,06 ± 1,25 22,66 ± 1,03 от 5,00 до 10,00 34,58 ± 2,70 25,03 ± 1,78 менее 5,00 22,19 ± 1,07 38,88 ± 1,85 26,01 ± 1,21 32,93 ± 2,02 23,18 ± 1,16 17,88 ± 0,45 15,45 ± 0,73 27,20 ± 1,20 30,84 ± 2,93 26,51 ± 2,14 8,32 ± 0,41 17,11 ± 0,68 34,01 ± 1,63 40,56 ± 1,36 Увеличение продолжительности гидролиза приводило к снижению количества пептидов с молекулярной массой более 20 кДа и составило 8,32±0,41% при 6,00±0,05 ч. гидролизе и соотношением белок:кислота 1:25. Это объясняется атакой кислоты полипептидной цепи и одновременным накоплением более мелких азотсодержащих молекул по молекулярной массе. В связи с этим возрастало содержание пептидов с молекулярной массой менее 5 кДа, которое при 4,00±0,05 ч. гидролизе составило 26,51±2,14%, а по истечении 6,00±0,05 ч. гидролиза их количество возросло в 1,53 раза. С повышением концентрации химического агента с 15 до 20 отмечалось увеличение степени гидролиза, что приводило к нарастанию количества пептидов продолжительности с молекулярной гидролиза 6,00±0,05 массой ч. менее содержание 5 кДа. При пептидов молекулярной массой менее 5 кДа возросло с 22,19±1,07% до 38,88±1,85%. с 69 Дальнейшие исследования по изучению кислотного гидролиза казеина, проводимого при соотношении белка и 6Н серной кислоты 1:20, были направлены на изучение динамики накопления свободных аминокислот в процессе реакции при продолжительности 6,00 ± 0,05 ч. (рисунок 3.8, таблица 3.5). 35. 806' Leu mV 1100 1000 800 45. 593' H i s 38. 093' Tyr 900 61. 546' A r g 50. 138' 63. 931' 56. 093' N H 4 51. 887' 52. 306' 54. 991' 53. 027' Lys 46. 906' 44. 712' 34. 868' Il e 27. 780' G l y 25. 133' Pr o 21. 706' 19. 718' G l u 16. 515' Ser 12. 818' 200 10. 690' A sp 300 17. 618' Thr 400 41. 731' Phe 31. 643' C ys 28. 741' A l a 500 33. 286' Met 600 69. 591' 700 100 0 15 1 20 2 3 4 25 5 6 30 7 8 35 40 9 10 11 12 13 45 14 50 15 55 16 60 mi n 17 Рисунок 3.8. Хроматографический профиль накопления свободных аминокислот, полученных в результате гидролиза 6 Н серной кислотой при температуре 110 ± 5оС и соотношении 1:20 в течение 6,00 ± 0,05 ч.: 1 – аспарагиновая кислота; 2 – серин; 3 – треонин; 4 – глутаминовая кислота; 5 – пролин; 6 – глицин; 7 – аланин; 8 – цистеин; 9 – метионин; 10 – изолейцин; 11 – лейцин; 12 – тирозин; 13 – фенилаланин; 14 – гистидин; 15 – лизин; 16 – аммиак; 17 – аргинин. 70 Таблица 3.5 - Накопление аминокислот в кислотном гидролизате казеина при продолжительности гидролиза 6,00±0,05 ч. и соотношении белок/кислота 1:20 (n=5) Наименование аминокислоты Незаменимые аминокислоты: валин изолейцин лейцин лизин метионин треонин триптофан фенилаланин Заменимые аминокислоты: аланин аргинин аспарагиновая кислота гистидин глицин глутаминовая кислота пролин серин тирозин цистеин Всего Массовая доля, % в исходном казеине в гидролизате 6,47 ± 0,39 5,48 ± 0,33 8,27 ± 0,50 7,37 ± 0,44 2,52 ± 0,15 4,40 ± 0,26 1,08 ± 0,06 4,49 ± 0,27 2,54 ± 0,15 2,15 ± 0,13 3,25 ± 0,19 2,90 ± 0,17 0,99 ± 0,06 1,73 ± 0,10 0,43 ± 0,02 1,76 ± 0,10 2,70 ± 0,16 3,69 ± 0,22 6,38 ± 0,38 2,79 ± 0,16 2,43 ± 0,14 20,14 ± 1,20 10,16 ± 0,61 5,66 ± 0,34 5,66 ± 0,34 0,31 ± 0,01 100,00 ± 1,00 1,06 ± 0,06 1,45 ± 0,08 2,51 ± 0,15 1,19 ± 0,06 0,95 ± 0,05 7,81 ± 0,47 3,91 ± 0,24 2,22 ± 0,13 2,22 ± 0,13 0,12 ± 0,01 39,19 ± 3,17 Анализ данных, представленных на хроматографическом профиле и в таблице 3.5, свидетельствует о том, что подобранная концентрация серной кислоты достаточна для того, чтобы атаковать полипептидную цепь молекулы казеина. Кроме того, при проведении исследований пристальное внимание было уделено изменению массовой доли аминокислот, которые, по литературным данным, быстрее всего подвергаются разрушению в процессе кислотного гидролиза, а именно: треонину, фенилаланину, серину, тирозину и цистину. Учитывая тот факт, что подобранная нами кислота обеспечивает более жесткие условия проведения процесса гидролиза, являясь по своей 71 структуре двухосновной, вышеупомянутых в аминокислот полученных при данных гидролизатах параметрах разрушение реакции не происходило. При подобранных условиях накопление всех аминокислот в гидролизате казеина составляло в пределах 38-39% от их содержания в исходном казеине. Таким образом, соотношение субстрат:кислота 1:20 является оптимальным для проведения гидролиза казеина кислотным способом, позволяющим максимально сохранить аминокислоты от потенциальной опасности разрушения аминокислоты в течение 6,00±0,05 ч. 3.2.2. Определение рациональных параметров ферментативного гидролиза казеина Для более полного гидролиза казеина следующий этап исследований направлен на подбор рациональных параметров для проведения ферментативного гидролиза с целью полного высвобождения аминокислот в более мягких условиях. При гидролизе казеина в присутствии энзимов не наблюдается разрушения аминокислот и тем самым биологическая ценность полученных гидролизатов не снижается, что позволяет перевести белковый материал в хорошо растворимые пептидно-аминокислотные смеси [26]. Учитывая преимущества ферментативного гидролиза казеина, мы сможем получить гидролизаты на основе казеина с сохранённым составом всех необходимых аминокислот. Но при выполнении ферментативного гидролиза важно учитывать четыре фактора: - величину степени гидролиза, которая ведет к образованию более коротких пептидов в продукте, а следовательно, к низкой аллергенности; - низкое содержание свободных аминокислот, определяющих низкую осмолитическую характеристику, что считается предпочтительным, если продукт вводят в пищевые продукты; - сниженную горечь; 72 - высокий выход [32]. По окончании кислотного гидролиза казеина, проведенного на первой ступени, полученный гидролизат нейтрализовали гидроксидом кальция (Ca(OH)2) при температуре, не превышающей 80°С, до рН, оптимальной для действия ферментного комплекса, состоящего из эндо- и экзопептидаз, – 7,5. После нейтрализации кислоты путем добавления щёлочи необходимо удалить образующиеся соединения, для этого гидролизаты отфильтровывали от кристаллов двухводного гипса. Применение комплекса состоящего из экзо- и эндопептидаз, является щадящим и рациональным способом гидролиза белков по сравнению с кислотным гидролизом. В качестве эндопептидазы использовали бромелайн (КФ 3.4.22.32(33)), экзопептидаз – карбоксипептидазу А (КФ 3.4.17.1) и лейцинаминопептидазу (КФ 3.4.1.1) при равноколичественном соотношении 1:1:1. Гидролиз вели при температуре 50 ± 2°С в течение (2 – 6) ± 0,05 ч. Бромелайн (КФ 3.4.22.32(33)) – протеолитический растительный фермент, смесь протеаз, полученная из растений семейства бромелиевые, в том числе из ананаса, расщепляющих белки. Бромелайн представляет собой смесь высокомолекулярных гликопротеинов, в активном центре которых находится аминокислота цистеин. Молекула исходного бромелайна содержит 242 аминокислотных остатка. По действию сходен с пепсином и трипсином, растворим в воде. Бромелайн активен как в кислой, так и в щелочной среде: рН оптимум для цельного экстракта бромелайна – 4,5 – 9,8; рН оптимум для фракций, составляющих более 50% экстракта, – 4,5 – 5,5; рН оптимум для наиболее активной фракции бромелайна – около 7,0. Температурный оптимум – 3035°C, инактивация фермента происходит при 65°C. В качестве экзопептидаз использовали карбоксипептидазу А и аминопептидазы. Карбоксипептидаза А (КФ 3.4.17.1) представляет собой белок, состоящий из 307 аминокислотных остатков, с молекулярной массой 73 около 344000 кДа. Карбоксипептидаза А отщепляет все С-аминокислотные остатки от пептидов, за исключением лизина, аргинина, пролина и гидроксипролина, катализируя в основном ароматические и алифатические аминокислоты. В качестве аминопептидаз использовали лейцинаминопептидазу. Лейцинаминопептидаза (КФ 3.4.1.1) не обладает строгой субстратной специфичностью и гидролизует пептидные связи, образованные любой Nконцевой аминокислотой. Оба фермента осуществляют ступенчатое отщепление аминокислот от N-конца полипептидной цепи. Из литературных данных известно, что оптимальными параметрами работы карбоксипептидазы А и аминопептидаз являются температура 50±2°С и рН 7,5±0,05. Учитывая, что на первом этапе степень гидролиза достигла 39,19 ± 3,17%, дальнейшие исследования были направлены на изучение степени гидролиза в присутствии энзиматического комплекса при различном фермент-субстратном соотношении – 1:50, 1:100 и 1:150. Результаты исследований представлены в таблице 3.6 и на рисунке 3.9. Таблица 3.6 - Степень гидролиза казеина в присутствии энзиматического комплекса (n=5) Продолжительность гидролиза, ч. СГ, %, при фермент-субстратном соотношении 1:50 1:100 1:150 39,19 ± 3,17 0 2,00 ± 0,05 59,77 ± 2,68 54,65 ± 2,18 48,66 ± 2,43 4,00 ± 0,05 89,11 ± 3,85 81,47 ± 2,85 74,44 ± 2,82 6,00 ± 0,05 98,34 ± 2,15 92,85 ± 3,31 86,75 ± 3,47 В ходе проведенных исследований установлено, что за 2,00 ± 0,05 ч. степень гидролиза при фермент-субстратном соотношении 1:50, 1:100 и 1:150 повысилась на 20,58, 15,46 и 9,47%, соответственно. Через 4,00±0,05 ч. 74 протекания реакции в полипептидной цепи накопилось значительное количество коротких пептидов и аминокислот, при этом степень гидролиза составила 89,11±3,85, 81,47±2,85 и 74,44±2,82% при фермент-субстратном СГ, % соотношении 1:50, 1:100 и 1:150 соответственно. Продолжительность гидролиза, ч Рисунок 3.9. Степень гидролиза при обработке казеина ферментативным комплексом (на 2-й ступени) в течение 2, 4 и 6 ч. при соотношении фермент:субстрат: - – 1:50, – 1:100, – 1:150. При увеличении продолжительности процесса до 6,00±0,05 ч. степень гидролиза достигла максимальных значений при фермент-субстратном соотношении 1:50 и 1:100 и составила 98,34±2,15 и 92,85±3,31%. При снижении концентрации субстрата наблюдалось снижение скорости реакции и одновременно полипептидной незначительное цепи. Возможно, увеличение это связано степени с гидролиза конкурентным ингибированием субстрата. Ступенчатый гидролиз позволил сократить количество ферментного комплекса и продолжительность реакции на 12-14 ч. в зависимости от желаемых результатов. Далее определили молекулярно-массовое распределение с помощью электрофоретического метода Лэмли в зависимости от соотношений «фермент:субстрат» (таблица 3.7 и рисунок 3.10). различных 75 Таблица 3.7 - Молекулярно-массовое распределение белков и пептидов в процессе кислотно-ферментативного гидролиза казеина (n=5) Молекулярная масса, кДа Относительное содержание, % при фермент-субстратном соотношении 1:50 1:100 1:150 Продолжительность процесса 2,00 ± 0,05 ч. более 20,00 3,43 ± 0,13 6,44 ± 0,25 от 10,00 до 20,00 8,36 ± 0,33 10,66 ± 0,53 от 5,00 до 10,00 29,09 ± 1,16 27,05 ± 1,08 менее 5,00 59,12 ± 2,36 55,85 ± 2,79 Продолжительность процесса 4,00 ± 0,05 ч. более 20,00 от 10,00 до 20,00 2,21 ± 0,09 7,23 ± 0,29 от 5,00 до 10,00 7,78 ± 0,32 10,70 ± 0,62 менее 5,00 90,01 ± 3,61 82,07 ± 2,85 Продолжительность процесса 6,00 ± 0,05 ч. более 20,00 от 10,00 до 20,00 от 5,00 до 10,00 1,33 ± 0,05 6,79 ± 0,22 менее 5,00 98,67 ± 2,15 93,21 ± 3,71 9,78 ± 0,53 17,66 ± 0,71 23,90 ± 0,95 48,66 ± 1,94 1,22 ± 0,04 10,26 ± 0,56 13,48 ± 0,54 75,04 ± 2,25 5,77 ± 0,07 7,18 ± 0,29 87,05 ± 3,47 Данные, представленные в таблице 3.7, указывают на тот фактор, что продолжительность процесса позволяет не только вовлекать новые молекулы белка но и влиять на увеличение массовой доли свободных аминокислот в гидролизате, с тем же распределением пептидных продуктов реакции, получаемых за счет действия комплекса систем, в состав которых входили эндо- и экзопептидазы. При продолжительности процесса 4,00±0,05 ч гидролизаты казеина характеризовались достаточным накоплением пептидов с молекулярной массой менее 5 кДа. Их количество при фермент- субстратном соотношении 1:50, 1:100 и 1:150 составило 90,01±3,61, 82,07±2,85 и 75,04±2,25%, соответственно. При увеличении продолжительности гидролиза наблюдалось накопление низкомолекулярных пептидов. Учитывая, что гидролиз казеина энзиматическим комплексом проходил 76 на второй ступени, накопление максимального количества свободных аминокислот и пептидов достигалось при продолжительности реакции в течение 6,00±0,05 ч. и составило 98,67±2,15, 93,21±3,71 и 87,05±3,47% при фермент-субстратном соотношении 1:50, 1:100 и 1:150 соответственно. кДа М 1:50 1:100 1:150 М 28,0 25,0 23,0 20,0 18,0 10,0 5,0 0,5 М 1 2 3 1 2 3 1 2 3 М Рисунок 3.10. Электрофорез в полиакриламидном геле гидролиза казеина (окрашивание кумасси бриллиантовым синим G-250) при фермент- субстратном соотношении 1:50 – 1:150 и продолжительности реакции: 1 – 2,00±0,05, 2 – 4,00±0,05, 3 – 6,00±0,05 ч. Данные, полученные в ходе проведения исследований, свидетельствуют о том, что гидролизаты казеина, полученные в результате ступенчатого гидролиза характеризуются преимущественно накоплением 77 пептидов с молекулярной массой менее 0,5 кДа и одновременным отсутствием молекул казеина в нетрансформированной форме. Данный факт не противоречит литературным данным и декларируемым свойствам исследуемых ферментных препаратов, входящих в состав комплекса энзиматических систем. Специфичность эндо- и экзопептидаз позволяет предсказывать количество и характер пептидных фракций в процессе гидролиза казеина. Увеличение концентрации казеина (при фермент-субстратном соотношении 1:100 или 1:50) приводило к снижению скорости реакции и незначительном увеличении степени гидролиза полипептидной цепи – это связано с конкурентным ингибированием субстрата, однако в наших условиях процесс гидролиза имел необходимую и достаточную направленность. Динамика накопления свободных аминокислот в процессе ступенчатого гидролиза, проводимого при различных условиях, представлена в таблице 3.8 и на рисунках 3.11 – 3.14. Анализ экспериментальных исследований показал, что при обработке субстрата на второй ступени энзиматической системой массовая доля свободных аминокислот за 4,00±0,05 ч. при соотношении фермент-субстрат 1:100 и 1:150 в гидролизате составила 81,47±2,85% и 74,44±2,25%. Увеличение продолжительности процесса на второй ступени на 2,00±0,05 ч. позволило накопить свободные аминокислоты в гидролизате на 11,38 и 12,31%. Во время проведения гидролиза отмечалось наибольшее накопление в гидролизатах таких незаменимых аминокислот, как лейцин, лизин, валин, треонин и фенилаланин. 78 Таблица 3.8 - Динамика накопления аминокислот в гидролизате казеина, полученном при ступенчатом гидролизе, проводимом при различных условиях (n=5) Наименование аминокислоты 1 в исходном казеине 2 валин 6,47 ± 0,39 изолейцин 5,48 ± 0,33 лейцин 8,27 ± 0,50 лизин 7,37 ± 0,44 метионин 2,52 ± 0,15 треонин 4,40 ± 0,26 триптофан 1,08 ± 0,06 фенилаланин 4,49 ± 0,27 Массовая доля аминокислоты, % При продолжительности ферментативного гидролиза в кислотном (на 2-й ступени) гидролизате 4,00 ± 0,05 ч. 6,00 ± 0,05 ч. 4,00 ± 0,05 ч. 6,00 ± 0,05 ч. (на 1-й соотношение соотношение ступени) фермент:казен 1:100 фермент:казеин 1:150 3 4 5 6 7 Незаменимые аминокислоты: 5,30 ± 0,26 5,95 ± 0,24 4,81 ± 0,24 5,63 ± 0,22 2,54 ± 0,15 4,44 ± 0,17 5,09 ± 0,20 4,11 ± 0,16 4,75 ± 0,23 2,15 ± 0,13 6,78 ± 0,27 7,71 ± 0,31 6,20 ± 0,25 7,19 ± 0,36 3,25 ± 0,19 5,96 ± 0,24 6,84 ± 0,27 5,48 ± 0,22 6,41 ± 0,25 2,90 ± 0,17 2,04 ± 0,08 2,31 ± 0,11 1,89 ± 0,09 2,16 ± 0,08 0,99 ± 0,06 3,61 ± 0,14 4,08 ± 0,20 3,21 ± 0,13 3,82 ± 0,15 1,73 ± 0,10 0,88 ± 0,03 0,97 ± 0,04 0,80 ± 0,03 0,94 ± 0,05 0,43 ± 0,02 3,68 ± 0,18 3,99 ± 0,16 3,37 ± 0,13 3,91 ± 0,16 1,76 ± 0,10 79 1 2 аланин 2,70 ± 0,16 аргинин 3,69 ± 0,22 аспарагиновая кислота 6,38 ± 0,38 гистидин 2,79 ± 0,16 глицин 2,43 ± 0,14 глутаминовая кислота 20,14 ± 1,20 пролин 10,16 ± 0,61 серин 5,66 ± 0,34 тирозин 5,66 ± 0,34 цистеин 0,31 ± 0,01 Всего 100,00 ± 1,00 3 4 Заменимые аминокислоты: 2,21 ± 0,11 1,06 ± 0,06 3,03 ± 0,12 1,45 ± 0,08 5,24 ± 0,26 2,51 ± 0,15 2,26 ± 0,09 1,19 ± 0,06 1,99 ± 0,08 0,95 ± 0,05 16,53 ± 0,66 7,81 ± 0,47 8,33 ± 0,33 3,91 ± 0,24 4,58 ± 0,23 2,22 ± 0,13 4,46 ± 0,17 2,22 ± 0,13 0,25 ± 0,02 0,12 ± 0,01 39,19 ± 3,17 81,47 ± 2,85 5 Окончание таблицы 3.8 6 7 2,51 ± 0,15 2,00 ± 0,08 2,35 ± 0,14 3,42 ± 0,13 2,75 ± 0,11 3,21 ± 0,16 5,82 ± 0,23 4,34 ± 0,24 5,53 ± 0,22 2,59 ± 0,10 2,03 ± 0,08 2,42 ± 0,12 2,36 ± 0,08 1,82 ± 0,07 2,11 ± 0,11 18,79 ± 0,75 15,38 ± 0,61 17,65 ± 0,71 9,54 ± 0,45 7,56 ± 0,30 8,81 ± 0,35 5,25 ± 0,21 4,21 ± 0,17 4,93 ± 0,20 5,36 ± 0,20 4,25 ± 0,17 4,91 ± 0,28 0,27 ± 0,01 0,23 ± 0,01 0,26 ± 0,01 92,85 ± 3,71 74,44 ± 2,25 86,75 ± 3,47 80 mV 53.008' Lys 61.913' Arg 55.150' NH4 44.650' 45.175' 41.084' Phe 37.621' Tyr 33.120' Met 43.393' 16 0 24.842' Pro 10.679' Asp 24 0 17.622' 14.899' Se r 15.930' Thr 32 0 26.733' Gly 27.729' Ala 19.553' Glu 40 0 34.596' Ile 31.379' Cys 48 0 46.546' 56 0 44.143' His 35.536' Le u 64 0 80 0 -80 1 2 3 15 4 5 6 20 25 7 8 9 10 11 12 30 35 13 14 40 15 16 45 50 55 17 min 60 35.706' Le u Рисунок 3.11. Хроматографический профиль свободных аминокислот, полученных в результате ступенчатого гидролиза казеина обработкой ферментативным комплексом (на 2-й ступени) при фермент-субстратном соотношении 1:100 в течение 4,00 ± 0,05 ч.: 1 – аспарагиновая кислота; 2 – серин; 3 – треонин; 4 – глутаминовая кислота; 5 – пролин; 6 – глицин; 7 – аланин; 8 – цистеин; 9 – метионин; 10 – изолейцин; 11 – лейцин; 12 – тирозин; 13 – фенилаланин; 14 – гистидин; 15 – лизин; 16 – аммиак; 17 – аргинин. mV 11 00 44.162' His 61.127' Arg 54.681' NH4 64.737' 49.014' 39.000' 43.337' 46.393' 34.835' Ile 21.693' Glu 41.245' Phe 31.681' Cys 20 0 26.273' Pro 12.784' Asp 30 0 13.941' 40 0 19.743' 16.493' Se r 50 0 17.631' Thr 60 0 33.277' Met 27.760' Gly 28.735' Ala 70 0 37.781' Tyr 90 0 80 0 52.567' Lys 10 00 10 0 0 1 15 2 3 4 5 20 25 6 7 8 9 10 30 35 11 12 40 13 14 45 50 15 16 55 60 17 min Рисунок 3.12. Хроматографический профиль свободных аминокислот, полученных в результате ступенчатого гидролиза казеина обработкой ферментативным комплексом (на 2-й ступени) при фермент-субстратном соотношении 1:100 в течение 6,00 ± 0,05 ч.: 1 – аспарагиновая кислота; 2 – серин; 3 – треонин; 4 – глутаминовая кислота; 5 – пролин; 6 – глицин; 7 – аланин; 8 – цистеин; 9 – метионин; 10 – изолейцин; 11 – лейцин; 12 – тирозин; 13 – фенилаланин; 14 – гистидин; 15 – лизин; 16 – аммиак; 17 – аргинин. 81 12 0 60 1 2 3 4 61.773' Arg 52.927' Lys 45.128' 41.036' Phe 37.591' Tyr 33.093' Met 43.311' 24.888' Pro 15.958' Thr 17.653' 18 0 14.927' Se r 24 0 26.713' Gly 27.708' Ala 19.578' Glu 30 0 34.569' Ile 31.355' Cys 36 0 55.062' NH4 42 0 46.514' 48 0 44.097' His 35.503' Le u mV 54 0 5 6 7 8 9 10 11 12 13 14 15 16 17 0 -6 0 20 25 30 35 40 45 50 55 min 60 44.084' His Рисунок 3.13. Хроматографический профиль свободных аминокислот, полученных в результате ступенчатого гидролиза казеина обработкой ферментативным комплексом (на 2-й ступени) при фермент-субстратном соотношении 1:150 в течение 4,00 ± 0,05 ч.: 1 – аспарагиновая кислота; 2 – серин; 3 – треонин; 4 – глутаминовая кислота; 5 – пролин; 6 – глицин; 7 – аланин; 8 – цистеин; 9 – метионин; 10 – изолейцин; 11 – лейцин; 12 – тирозин; 13 – фенилаланин; 14 – гистидин; 15 – лизин; 16 – аммиак; 17 – аргинин. mV 35.425' Le u 63 0 56 0 49 0 61.477' Arg 54.883' NH4 52.736' Lys 46.487' 45.100' 43.267' 34.508' Ile 33.057' Met 31.347' Cys 26.650' Gly 27.655' Ala 28.525' Va l 19.488' Glu 17.538' 14 0 15.907' Thr 13.137' Asp 21 0 14.888' Se r 28 0 25.273' Pro 35 0 40.900' Phe 37.487' Tyr 42 0 70 0 1 2 3 -7 0 15 4 5 20 25 6 7 8 9 10 11 30 35 12 40 13 14 45 15 16 50 55 17 60 min Рисунок 3.14. Хроматографический профиль свободных аминокислот, полученных в результате ступенчатого гидролиза казеина обработкой ферментативным комплексом (на 2-й ступени) при фермент-субстратном соотношении 1:150 в течение 6,00 ± 0,05 ч.: 1 – аспарагиновая кислота; 2 – серин; 3 – треонин; 4 – глутаминовая кислота; 5 – пролин; 6 – глицин; 7 – аланин; 8 – цистеин; 9 – метионин; 10 – изолейцин; 11 – лейцин; 12 – тирозин; 13 – фенилаланин; 14 – гистидин; 15 – лизин; 16 – аммиак; 17 – аргинин. 82 Подводя итоги проведенных исследований, изучив основные результаты экспериментальных исследований образцов казеина, определили рациональные параметры ступенчатого гидролиза казеина и характеристики полученных гидролизатов (таблица 3.9). Таблица 3.9 - Рациональные параметры ступенчатого гидролиза казеина и характеристика полученных гидролизатов Основные операции ступенчатого гидролиза казеина Рациональные параметры 1-я ступень – кислотный гидролиз: концентрация серной кислоты, Н соотношение белок:серная кислота, частей температура гидролиза, °С продолжительность, ч. нейтрализация серной кислоты введение гидроксида кальция при температуре, °С, не более доведение до рН, ед. очистка кислотного гидролизата удаление кристаллов двухводного гипса, фильтрование через колонку: размер анионита и высота слоя, мм 2-я ступень – ферментативный гидролиз: энзиматическая система (папаин:карбоксипептидаза А:лейцинаминопептидаза) соотношение фермент:субстрат температура гидролиза, °С продолжительность, ч. инактивация ферментов обработка острым паром, °С продолжительность, с. Характеристика гидролизата казеина Степень кислотного гидролиза на 1-й ступени, % Степень ферментативного гидролиза на 2-й ступени, % Массовая доля незаменимых аминокислот, %: Валин Изолейцин Лейцин 6 1:20 110 ± 5 6,00 ± 0,5 80 7,0-7,5 0,8 – 1,0 700 – 750 1:1:1 1:100 50 ± 2 6,00 ± 0,5 90 ± 5 15 ± 5 39,19 ± 3,17 92,85 ± 3,71 5,95 ± 0,24 5,09 ± 0,20 7,71 ± 0,31 83 Окончание таблицы 3.9 Лизин Метионин Треонин Триптофан Фенилаланин Массовая доля заменимых аминокислот, % Аланин Аргинин аспарагиновая кислота Гистидин Глицин глутаминовая кислота Пролин Серин Тирозин Цистеин 6,84 ± 0,27 2,31 ± 0,11 4,08 ± 0,20 0,97 ± 0,04 3,99 ± 0,16 2,51 ± 0,15 3,42 ± 0,13 5,82 ± 0,23 2,59 ± 0,10 2,36 ± 0,08 18,79 ± 0,75 9,54 ± 0,45 5,25 ± 0,21 5,36 ± 0,20 0,27 ± 0,01 Таким образом, для щадящего (без разрушения) высвобождения 92,85± 3,71% аминокислот определены следующие режимы гидролиза казеина: на 1й ступени – в присутствии 6Н серной кислоты в соотношении белок/кислота 1:20 при температуре 110±5°С и продолжительности процесса 6 ч., с последующей нейтрализацией гидроксидом кальция и фильтрацией; на 2-й ступени – при участии комплекса энзимов в соотношении «фермент:субстрат» 1:100, рН-7 и температуре 50±2°С в течение 6 ч. Продолжительность как фактор процесса позволяет не только вовлекать в процесс новые молекулы белка с тем же распределением пептидных продуктов реакции, но и влиять на увеличение массовой доли свободных аминокислот в гидролизате, получаемых за счет действия энзиматических систем, в состав которых входят эндо- и экзопептидазы. 3.3 Исследование пенообразующих характеристик гидролизата казеина В последнее время внимание многих специалистов пищевой промышленности все чаще обращается к молочным белкам, в частности к 84 молочным белковым концентратам. Их высокая пищевая и биологическая ценность, функционально-технологические свойства и возможность использования в составе различных пищевых продуктов обуславливают актуальность создания новых технологий их переработки. Молочно-белковые концентраты, в том числе гидролиза казеина, являются перспективным сырьем при производстве взбитых десертов с пенообразной консистенцией, поскольку обладают способностью при взбивании образовывать устойчивые пены и позволяют создавать формы продуктов, удовлетворяющие потребительский спрос. Такие продукты обладают рядом ценных для организма человека свойств, которые обуславливают их функциональную направленность заболеваниями [99, 100, 128]. Например, сердечно-сосудистой атеросклеротических образований у людей, системы, происходит страдающих в результате сужение кровеносных сосудов, что приводит к нарушению снабжения органов и тканей кислородом. Наряду с традиционными методами лечения и профилактики данного вида заболеваний рекомендуется включать в ежедневный рацион продукты, обогащенные кислородом. Также содержащийся в продукте кислород активизирует моторные, ферментативные и секреторные функции желудочно-кишечного тракта, нормализует микрофлору кишечника, ускоряет метаболические процессы. Соблюдение различных диет, которые требуют перехода людей на малокалорийный режим питания, сопровождается постоянным чувством легкого голода. Более того, при недоедании в организме накапливаются продукты обмена веществ, и чем больше ограничения в питании, тем больше таких продуктов скапливается в организме. В этом случае взбитые продукты на основе гидролизатов казеина, содержащие комплекс аминокислот, позволят подавить катаболизм и чувство голода, а также помогут организму сжечь недоокисленные продукты. В то же время люди, занимающиеся спортом как на профессиональном, так и на любительском уровне, вводят в свой рацион различные виды 85 белковой пищи или добавки на основе протеинов и аминокислотных комплексов. Преимущество аминокислотных комплексов перед протеинами заключается в том, что протеины являются «сырьем» для синтеза белка, и организму предстоит самому выработать аминокислоты. Аминокислотные комплексы, к которым можно отнести и гидролизат казеина, – это уже готовые «кирпичики», предназначенные для строительства мышечной массы за счет стимуляции синтеза инсулина и активации белка, которые (комплексы) (слово вставлено для облегчения понимания, но если очень коряво – можно и без него) регулируют клеточный рост и деление, а также влияют на рост, восстановление, синтез гормонов и ферментов. Принимая аминокислотные комплексы, спортсмены получают энергию: имея особый механизм метаболизма, аминокислоты дают во время тренировки больше энергии, чем углеводы. Необходимо также отметить тот факт, что аминокислоты отличаются важным эффектом – экспрессией лептина (гормона, подавляющего аппетит) в жировых тканях, тем самым снижают количество жира, а также обладают антикатаболическим воздействием на организм [117]. С учетом вышеизложенного дальнейшие исследования направлены на изучение пенообразующих характеристик гидролизатов казеина с целью создания технологии взбитых десертов на их основе. Основным процессом при производстве взбитых продуктов является газонасыщение. На данном этапе формируются основные характеристики продукта, которые в дальнейшем влияют на качественную оценку потребителем. К основным показателям качества взбитых продуктов относятся следующие свойства: дисперсность, однородность, устойчивость (стабильность) и консистенция (структурно-механические свойства). Устойчивость и консистенция во многом определяются как физикохимическими свойствами исходных компонентов, так и способом их обработки. 86 Гидролизаты казеина являются перспективным сырьем для использования в технологии получения десертов с пенообразной структурой. Возможность оптимального их использования для стабилизации межфазных слоев молочных пенообразных масс обусловлена последовательностью расположения в них аминокислот, эта особенность определяет функциональные характеристики гидролизатов казеина. 3.3.1. Влияние температуры взбивания на пенообразующие характеристики гидролизата казеина Температура является одним из важнейших факторов, которые оказывают влияние на различные качества продуктов, в том числе и на пенообразующие свойства. На данном этапе изучали влияние температуры на пенообразующие свойства гидролизатов казеина. Для взбивания готовили исследуемые образцы смеси с массовой долей гидролизатов казеина (10,00 – 25,00) ± 0,02% с учетом рекомендаций по применению аминокислотных комплексов, к которым можно условно отнести и гидролизаты казеина. В ходе исследований использовали следующие технологические параметры обработки в роторно-пульсационном аппарате: величина зазора между ротором и статором – 0,3±0,2 мм, частота вращения ротора – 3000 об./мин., продолжительность воздействия – 3 мин. с варьированием температурных режимов взбивания (4,00 – 28,00) ± 1°С. Коэффициент кратности полученных взбитых масс на основе гидролизатов казеина фиксировали через 20 минут. Результаты исследований представлены в таблице 3.10 и на рисунке 3.15. Данные, полученные экспериментальным путем, свидетельствовали о том, что низкие положительные температуры, 4,00±1°С, оказывали положительное влияние на кратность пены смесей гидролизатов казеина. 87 Таблица 3.10 - Влияние температуры взбивания на кратность пен (n=5) Температура, °С 4,00 ± 1 12,00 ± 1 20,00 ± 1 28,00 ± 1 Кратность пены, %, при массовой доле гидролизата казеина, % 10,00 ± 0,02 15,00 ± 0,02 20,00 ± 0,02 25,00 ± 0,02 395 ± 15,80 431 ± 17,24 460 ± 18,24 485 ± 19,40 370 ± 14,81 415 ± 16,60 427 ± 17,08 452 ± 18,08 338 ± 12,32 395 ± 15,80 403 ± 16,12 420 ± 16,80 270 ± 10,80 367 ± 14,68 385 ± 15,40 405 ± 16,20 Максимальные значения кратности пены при этом температурном режиме наблюдались во всех образцах казеина и составляли от 395±5,80 до 485±19,40%, при этом с повышением массовой доли гидролизата казеина в исследуемых образцах смеси кратность пены возрастала. Увеличение температуры взбивания на 8,00°С в образцах смеси гидролизата казеина с массовой долей аминокислотного комплекса 10,00±0,02% приводило к снижению кратности пены на 6,33, 14,43 и 31,64%. В образцах смеси гидролизата казеина с массовой долей 15,00±0,02% повышение температуры взбивания до 12,00±1, 20,00±1 и 28,00±1°С понизило кратность пены на 3,71, 8,35 и 14,85% соответственно. Аналогичные изменения кратности пены происходили и в образцах смеси гидролизата казеина с массой долей аминокислот 20,00±0,02 и 25,00±0,02%. Полученные системы при температурах выше 4,00±1°С характеризовались высокой нестабильностью, о чем свидетельствуют таблица 3.11 и рисунок 3.16. Таблица 3.11 - Влияние температуры взбивания на устойчивость пен (n=5) Температура, °С Устойчивость пены, мин., при массовой доле гидролизата казеина, % 10,00 ± 0,02 15,00 ± 0,02 20,00 ± 0,02 25,00 ± 0,02 4,00 ± 1 255 ± 10,21 306 ± 12,24 377 ± 15,08 450 ± 17,91 12,00 ± 1 186 ± 7,44 218 ± 8,72 269 ± 10,76 321 ± 12,84 20,00 ± 1 118 ± 4,75 134 ± 5,36 166 ± 6,64 180 ± 7,21 28,00 ± 1 75 ± 3,44 112 ± 4,48 147 ± 5,88 165 ± 6,63 Кратность пены, % Кратность пены, % Кратность пены, % 88 а) 10,00 ± 0,02 б) 15,00 ± 0,02 в) 20,00 ± 0,02 89 Кратность пены, % г) 25,00 ± 0,02 Рисунок 3.15. Влияние температуры взбивания на кратность пен смеси с массовой долей гидролизата казеина: а) 10,00 ± 0,02%; б) 15,00 ± 0,02%; в) 20,00 ± 0,02%; г) 25,00 ± 0,02%. Анализируя результаты исследований, представленных в таблице 3.11, необходимо отметить, что увеличение во взбиваемой смеси массовой доли гидролизата казеина с 10,00±0,02 до 25±0,02% приводило к получению мелкодисперсных пен, которые обладали большими показателями устойчивости, составившими 255±10,21, 306±12,24, 377±15,08 и 450±17,91 мин. соответственно. Наименьшей устойчивостью, 75 ± 3,44 мин., обладали пены, полученные в результате взбивания образцов смеси с массовой долей гидролизата казеина 10,00±0,02% при температуре 28,00±1°С, при этом пены имели различные по размеру пузырьки газа, с преобладанием крупных, в которых со временем происходило самопроизвольное утончение пленок пены, что в конечном итоге приводило их к разрыву. Устойчивость пены, мин Устойчивость пены, мин Устойчивость пены, мин 90 а) 10,00 ± 0,02 б) 15,00±0,02 в) 20,00 ± 0,02 91 Устойчивость пены, мин г) 25,00± 0,02 Рисунок 3.16. Влияние температуры взбивания на устойчивость пен смеси с массовой долей гидролизата казеина: а) 10,00 ± 0,02%; б) 15,00 ± 0,02%; в) 20,00 ± 0,02%; г) 25,00 ± 0,02%. Максимальной устойчивостью обладали пены, полученные в результате взбивания смесей с массовой долей аминокислот 20,00 и 25,00 ± 0,02% при низкой положительной температуре 4,00 ± 1°С. При этом полученные пены обладали кремообразной мелкодисперсной консистенцией с относительно равномерно распределенными по всей массе мелкоячеистыми пузырьками газа. Для более подробного изучения полученных при взбивании систем дальнейшие исследования были направлены на определение относительного распределения пузырьков газа в зависимости от массовой доли гидролизата казеина при выбранной температуре. Результаты полученных исследований представлены в таблице 3.12 и на рисунке 3.17. 92 Таблица 3.12 - Относительное распределение пузырьков газа в зависимости от массовой доли гидролизата казеина в смеси при температуре взбивания 4,00 ± 1°С (n=5) Относительное распределение пузырьков газа, % Средний диаметр при массовой доле гидролизата казеина, % пузырьков газа, мкм 10,00 ± 0,02 15,00 ± 0,02 20,00 ± 0,02 25,00 ± 0,02 менее 1000 10,00 ± 0,38 30,00 ± 1,53 71,00 ± 3,05 75,00 ± 3,82 1001 – 3000 15,00 ± 0,66 35,00 ± 1,68 22,50 ± 1,08 21,00 ± 0,84 3001 – 5000 30,00 ± 1,26 15,00 ± 1,07 5,00 ± 0,21 3,00 ± 0,13 более 5001 45,00 ± 2,29 20,00 ± 0,73 1,50 ± 0,04 1,00 ± 0,05 а) б) в) г) Рисунок 3.17. Микрофотографии структуры пен взбитых гидролизатов казеина с массовой долей: а) 10,00 ± 0,02%; б) 15,00 ± 0,02%; в) 20,00 ± 0,02%; г) 25,00 ± 0,02% – при температуре взбивания 4,00 ± 1°С. 93 Анализ микроснимков и проведенных исследований показал, что смеси с массовой долей гидролизата казеина 10,00±0,02% и 15,00±0,02% при взбивании образовывали пены с распределением пузырьков газа с размером более 5001 мкм 45,00±2,29 и 20,00±0,73%. Содержание средних и мелких пузырьков в пене с размерами от 1000 до 3000 мкм и менее 1000 мкм составило 15,00±0,66 и 10,00±0,38% для смеси с массовой долей гидролизата казеина 10,00±0,02%, соответственно 35,00±1,68 и 30,00± ,53% – для смеси с массовой долей гидролизата казеина 15,00±0,02%. Увеличение массовой доли аминокислотного комплекса в смеси до (20,00 – 25,00)±0,02% мелкоячеистыми позволяло пузырьками, получить относительное дисперсные распределение пены с которых составило 71,00±3,05 и 75,00±3,82%. Таким образом, на основе проведенных исследований можно сделать вывод о том, что содержание в смеси 20,00±0,02% гидролизат казеина достаточно для получения кремообразной, мелкодисперсной консистенции с относительно равномерно распределенными по всей массе мелкоячеистыми пузырьками газа. Низкие положительные температуры благоприятно влияют на пенообразующие свойства гидролизат казеина, однако для обеспечения абсолютной устойчивости пен и создания продуктов со взбитой структурой необходимо использование стабилизаторов – структурообразователей консистенции. 3.3.2 Влияние стабилизаторов на пенообразующие характеристики гидролизата казеина Для изучения влияния стабилизаторов на пенообразование гидролизата казеина, а также для исследования стабилизации межфазных структур, полученных в результате взбивания, проводили серию опытов, используя различные виды коллоидов. В качестве стабилизаторов использовали натуральные вещества 94 животного (желатин) и растительного (пектин и агар) происхождения, а также комплексный стабилизатор Гелеон 141 С-Д, в состав которого входят вышеперечисленные натуральные гидроколлоиды. Желатин – это биополимер, полученный из коллагена, содержащегося в костях, хрящах и сухожилиях убойных животных. Готовый сухой желатин – без вкуса, запаха, прозрачный, почти бесцветный или слегка желтый. В холодной воде и разбавленных кислотах сильно набухает, но не растворяется. Набухший желатин при нагревании растворяется, образуя клейкий раствор, который застывает в студень. Решающим фактором для применения желатина в пищевой промышленности являются его технологические свойства, и чуть меньшее значение имеет его пищевая ценность. При производстве изделий широко используются два основных свойства желатина: во-первых, это студнеобразующая способность жидких растворов желатина в результате их охлаждения, и во-вторых, пенообразующая способность желатина и дальнейшая стабилизация пены. Пектины представляют собой группу высокомолекулярных полисахаридов, входящих в состав клеточных стенок и межклеточных образований совместно с целлюлозой, гемицеллюлозой и лигнином, используются в пищевой промышленности и общественном питании как студнеобразователи (при производстве кондитерских изделий, фруктовых напитков, соков, молочных продуктов и т.д.). В последнее время пектины широко применяются в производстве детского, диетического и лечебнопрофилактического питания, поскольку некоторые их формы обладают способностью связывать и выводить из организма отдельные токсичные вещества. Пектины получают из свекловичного жома, яблочных выжимок, кожуры цитрусовых, корзинок подсолнечника, клубней топинамбура, некоторых отходов сельскохозяйственного производства. Агар и агароиды получают из наиболее дорогих морских водорослей (анфельция, гелидиум, грацилярия, эухеум), обладают сильными желирующими свойствами. Агар и агароиды нерастворимы в холодной воде, 95 но полностью растворяются только при температурах от 95 до 100 °С. Горячий раствор является прозрачным и ограниченно вязким, а при охлаждении до температуры 35-40°С становится чистым и крепким гелем, который является термообратимым и при нагревании до 85-95°С опять становится жидким раствором. Агароиды образуют студни с более слабой водоудерживающей способностью, чем агар, поэтому он имеет пониженную стойкость к высыханию и засахариванию. Температура застудневания у студней, приготовленных на агароиде, значительно выше, чем у студней, приготовленных с применением агара. Студни, приготовленные на основе агар-агара, в отличие от всех других студнеобразователей, характеризуются стекловидным изломом. Он успешно применяется при производстве кондитерских изделий (мармелад, зефир, жевательные конфеты, пастила, начинки, суфле), диетических продуктов (джем, конфитюр), фармацевтических продуктов. Применение агара в пищевой промышленности не лимитировано, а его количество, добавляемое в пищевые продукты, обусловлено рецептурами и стандартами на эти продукты. Эта добавка содержит ноль калорий, поэтому продукты, приготовленные с применением агароидов, рекомендуются людям, придерживающимся диеты, так как он абсолютно не усваивается, разбухает в кишечнике и создает ощущение сытости, а обманутый желудок работает быстрее. К тому же выводит из организма токсины и шлаки, удаляет вредные вещества из печени, улучшая ее работу [100, 118]. Состав стабилизатора Гелеон 141 С-Д богат натуральными гидроколлоидами, такими как пектин, агар и желатин, которые в комплексе позволяют стабилизировать консистенцию продукта, формируют нежную желеобразную структуру десертов и пудингов, не разжижающуюся при комнатной температуре. Комплексный стабилизатор уменьшает тенденцию к синерезису, что позволяет сохранить структуру продукта неизменной после расфасовки и в процессе транспортирования, а также всего срока хранения. Натуральный экстракт сливок, входящий в состав стабилизатора, маскирует 96 возможные нежелательные привкусы и придает десертам и пудингам сливочную ноту во вкусе. Известно, что коллоидные растворы данных веществ способны образовывать пены, что свидетельствует об их влиянии на поверхностное натяжение, вязкость, плотность и другие характеристики, которые оказывают влияние на формирование дисперсий. Полагали, что максимальная пенообразующая способность коллоидов достигается в определенном интервале концентраций структурообразователей. Поэтому основной целью опытов, проводимых на данном этапе, явилось определение рациональных концентраций стабилизаторов, позволяющих получить пены из смеси гидролизатов казеина в условиях использования интенсивных гидромеханических воздействий. Кратность пены, полученной в результате взбивания смеси с массовой долей гидролизатов казеина 20,00±0,02% при температуре 4,00±1°С в присутствии различных стабилизаторов, представлена на рисунке 3.18 и в таблице 3.13. Доза структурообразователя, % а) 97 Рисунок 3.18. Кратность пен смеси с массовой долей гидролизата казеина 20,00 ± 0,02% при температуре 4, 00 ± 1°С, в присутствии стабилизаторов: а) желатина; б) пектина; в) агара; г) Гелеон 141 С-Д 98 Таблица 3.13 - Кратность пен смеси с массовой долей гидролизата казеина 20,00 ± 0,02% при температуре 4,00 ± 1°С, в присутствии стабилизаторов (n=5) Вид стабилизатора Желатин Пектин Агар Гелеон 141 С-Д Доза стабилизатора, % 0,50 ± 0,01 1,00 ± 0,01 1,50 ± 0,02 2,00 ± 0,02 2,50 ± 0,03 0,50 ± 0,01 1,00 ± 0,01 1,50 ± 0,02 2,00 ± 0,02 2,50 ± 0,03 0,20 ± 0,01 0,40 ± 0,01 0,60 ± 0,01 0,80 ± 0,01 1,00 ± 0,01 0,50 ± 0,01 1,00 ± 0,01 1,50 ± 0,02 2,00 ± 0,02 2,50 ± 0,03 Кратность пены, % 543 ± 16,28 580 ± 17,43 617 ± 18,54 620 ± 18,61 615 ± 18,45 526 ± 15,78 545 ± 16,35 578 ± 17,34 575 ± 17,25 560 ± 16,81 541 ± 16,53 583 ± 17,49 622 ± 18,66 624 ± 18,70 617 ± 18,51 568 ± 17,04 605 ± 18,15 620 ± 18,40 650 ± 18,75 655 ± 18,65 При введении желатина в смесь кратность пены повысилась в целом на 18 – 35% в зависимости от его дозы. Необходимо отметить, что при дозе желатина (1,5 – 2,0) ± 0,01% получались пены с максимальной кратностью 617 ± 18,54 и 620 ± 18,61% для данного коллоида. Дальнейшее увеличение дозы желатина приводило к понижению кратности пены. В целом можно констатировать, что использование желатина позволяло регулировать пенообразующие свойства гидролизата казеина. Введение стабилизатора пектина в смесь гидролизата казеина привело к получению пен, обладающих меньшей кратностью по сравнению с желатином. Оптимальная доза пектина, при которой пенообразующая способность достигала своего пика – 578 ± 17,34 – 575 ± 17,25%, составила (1,5 – 2,0) ± 0,01%. 99 Лучших результатов пенообразования удалось добиться введением в смесь гидролизата казеина агара, который вводили в меньших дозах, чем остальные стабилизаторы, учитывая его свойства. Анализируя полученные данные, пришли к выводу, что агар определенным образом влиял на пенообразующие свойства гидролизата казеина: введение (0,60 – 0,80) ± 0,01% агара приводило к повышению кратности пены до 622±18,66 – 624 ± 18,70%, что в среднем на 47% выше, чем при использовании пектина. В результате анализа экспериментальных данных установлено, что введение стабилизаторов повысило кратность пены во всех исследуемых образцах. Максимальными пенообразующими характеристиками обладали образцы смеси гидролизата структурообразователя казеина, стабилизатор содержащие Гелеон 141 в С-Д. качестве При дозе стабилизатора (2,00 – 2,50)±0,01% кратность пены составила 650 ± 18,75 – 655±18,65%. Используя перспективности полученные применения данные, стабилизатора можно Гелеон заключить 141 С-Д о для производства взбитых десертов на основе гидролизата казеина. Дальнейшие исследования направлены на определение устойчивости образования межфазных пленок, полученных в результате газонасыщения смеси гидролизата казеина при выбранных концентрациях стабилизатора структуры (таблица 3.14, рисунок 3.19). При объяснении устойчивости пены следует иметь в виду особое строение этой системы. Именно благодаря своеобразной структуре пены возникают значительные затруднения в стекании жидкости в пленках пены, что очень сильно сказывается на устойчивости всей системы. Каркас пены состоит из приблизительно плоских жидких пленок, являющихся стенками отдельных ячеек. Там, где сходятся три пленки, образуются ребра пузырька, в которых жидкость имеет вогнутую поверхность. По законам капиллярности, в каналах жидкость имеет пониженное давление, что вызывает отсасывание ее из плоских частей каркаса пены в вогнутые. Это течение способствует самопроизвольному утончению пленок пены, что в конечном итоге приводит их к разрыву [30, 122]. 100 Таблица 3.14 - Влияние стабилизаторов на устойчивость пен (n=5) Вид стабилизатора Желатин Пектин Агар Гелеон 141 С-Д Доза стабилизатора, % 0,50 ± 0,01 1,00 ± 0,01 1,50 ± 0,02 2,00 ± 0,02 2,50 ± 0,03 0,50 ± 0,01 1,00 ± 0,01 1,50 ± 0,02 2,00 ± 0,02 2,50 ± 0,03 0,20 ± 0,01 0,40 ± 0,01 0,60 ± 0,01 0,80 ± 0,01 1,00 ± 0,01 0,50 ± 0,01 1,00 ± 0,01 1,50 ± 0,02 2,00 ± 0,02 2,50 ± 0,03 Устойчивость пены, мин. 560 ± 16,80 600 ± 18,00 620 ± 18,60 660 ± 19,80 670 ± 20,10 460 ± 13,80 510 ± 15,30 580 ± 17,40 610 ± 18,30 630 ± 18,90 660 ± 19,80 720 ± 21,60 790 ± 23,70 820 ± 24,60 870 ± 26,10 711 ± 21,30 765 ± 22,90 826 ± 24,70 892 ± 26,70 900 ± 27,00 Все исследуемые стабилизаторы структуры (структурообразователи) повышали коэффициент устойчивости пен, причем отмечался экспоненциальный рост данного показателя с увеличением содержания используемого стабилизатора структуры. Для стабилизаторов желатин и пектин при подобранной оптимальной дозе (1,5 – 2,0)±0,01%, при которой пены обладали высокой кратностью – 617±18,54 – 620±18,61% и 578±17,34 – 575 ± 17,25 % соответственно для каждого коллоида, их устойчивость составляла от 620±18,60 до 660±19,80 мин. для желатина и от 580±17,40 до 610±18,30 мин. для пектина. 101 Рисунок 3.18. Устойчивость пен смеси с массовой долей гидролизата казеина 20,00 ± 0,02% при температуре 4,00 ± 1°С в присутствии стабилизаторов: а) желатина; б) пектина; в) агара; г) Гелеон 141 С-Д. Оценивая показатели коэффициента устойчивости образования межфазных пленок, можно констатировать, что желатин в концентрации более 1,00% формировал трехмерный матрикс, в котором процессы коалесценции сведены к минимуму. При введении агара образовывались более прочные системы, что не противоречит характеристикам этого гидроколлоида. Устойчивость пены составила 790 ± 23,70 – 820 ± 24,60 мин. при дозе агара (0,60 – 0,80) ± 0,01%, а коэффициент устойчивости матрикса пенной массы превышал 24 часа, независимо от дозы стабилизатора. Комплекс всех вышеописанных коллоидов, входящих в стабилизатор Гелеон 141 С-Д, улучшил показания устойчивости пен при подобранной дозе 102 (2,00 – 2,50) ± 0,01% и соответствовал максимальным их значениям – 892 ± 26,70 – 900 ± 27,00 мин., что, по-видимому, можно объяснить равномерным его диспергированием на образующихся межфазных пенных пленках. При этом пены имели нежную, диспергированную по всей массе консистенцию. Сочетание в стабилизаторе желатина и агара придавало пенам глянцевую поверхность. В комплексе данные компоненты позволяли стабилизировать консистенцию, уменьшали тенденцию к разрыву пузырьков пены и сохраняли структуру пены неизмененной в процессе хранения. Анализ всех полученных результатов позволил остановиться на стабилизаторе Гелеон 141 С-Д в количестве (2,00 – 2,50) ± 0,01% как на перспективном структурообразователе для производства взбитых десертов на основе гидролизата казеина. Следующим этапом исследований явилось определение относительного распределения пузырьков газа в пене в зависимости от массовой доли выбранного стабилизатора Гелеон 141 С-Д (2,00 – 2,50) ± 0,01% при выбранных раннее режимах: температуре взбивания 4,00 ± 1°С, массовая доля гидролизата казеина 20,00 ± 0,02% (таблица 3.15 и рисунок 3.20). Таблица 3.15 - Относительное распределение пузырьков газа в присутствии стабилизатора Гелеон 141 С-Д (n=5) Средний диаметр пузырьков газа, мкм менее 1000 1001 – 3000 3001 – 5000 более 5001 Относительное распределение пузырьков газа, % при массовой доле стабилизатора, % 0 2,00 ± 0,01 2,50 ± 0,01 71,00 ± 3,05 65,00 ± 1,95 68,00 ± 2,71 22,50 ± 1,08 27,00 ± 1,08 26,00 ± 1,04 5,00 ± 0,21 7,00 ± 0,26 6,00 ± 0,25 1,50 ± 0,04 - 103 Из приведенных результатов видно, что внесение стабилизатора структуры позволило получить структуры с пузырьками газа более крупных размеров, что, вероятно, связано с увеличением вязкости и повышением затрат мощности на единицу обрабатываемой смеси. Комплексный стабилизатор консистенции позволил получить стабильную пенообразную структуру при максимальной концентрации стабилизатора структуры 2,5%, при этом не наблюдалось разрушения пены во время хранения. А) б) Рисунок 3.20. Микрофотографии структуры пен взбитых гидролизатов казеина в присутствии стабилизатора Гелеон 141 С-Д с массовой долей: а) 2,00 ± 0,01%; б) 2,50 ± 0,01% при температуре взбивания 4,00 ± 1°С. 3.3.3 Влияние ягодных наполнителей на пенообразующие характеристики гидролизата казеина Использование ягодных наполнителей в рецептурах молочной продукции позволяет не только расширить ассортимент, регулировать органолептические и структурные характеристики, но и значительно повысить биологическую и пищевую ценность новых продуктов. Следует 104 также учитывать, что ягодное сырье богато витаминами, макро- и микроэлементами, а также балластными веществами, улучшающими перистальтику желудочно-кишечного тракта. Для дальнейших исследований были выбраны продукты переработки местной ягоды – черной смородины. Смородина, произрастающая в западносибирском регионе, широко распространена в питании населения благодаря доступности и богатому химическому составу. Популярность этих ягод объясняется их особыми вкусовыми качествами, широким спектром лечебных свойств. Для получения полуфабриката ягодного пюре сырье перебирали, удаляли испорченное и недозрелое, тщательно промывали и прогревали до размягчения на пару или в кастрюле-скороварке. Затем остужали до 45-50°С и протирали через шнековую соковыжималку. При необходимости протирали дважды. Раскладывали в банки вместимостью 0,5 л, прикрывали крышками и пастеризовали 20 мин. при температуре 90-95°С. Полученный полуфабрикат использовали в дальнейшем. Перед переработкой ягоды прогревали на пару до готовности, поскольку воздействие пара обеспечивает лучшую сохранность основных пищевых веществ. Затем ягоды отжимали на шнековой соковыжималке или протирали через сито и полученные сок или пюре уваривали. Основные показатели свежей смородины и продуктов ее переработки представлены в таблице 3.16. Установлено, что углеводы занимают основную долю в сухих веществах ягод черной смородины. Углеводный состав ягод схож между собой, однако имеются некоторые отличия. Балластные полисахариды являются фактором роста симбиотической микрофлоры желудочно-кишечного тракта человека. 105 Таблица 3.16. Химический состав свежих ягод смородины и продуктов её переработки (n=5) Наименование вещества Вода, г Углеводы, г в том числе: моно- и дисахариды Полисахариды Органические кислоты Золы Свежие ягоды смородины 84,2 ± 2,52 11,72 ± 0,35 Содержание Продукты переработки ягод черной смородины пюре Сок 67,60 ± 2,02 83,10 ± 2,48 28,40 ± 0,85 20,60 ± 0,61 6,62 ± 0,19 24,90 ± 0,74 5,10 ± 0,15 3,50 ± 0,10 2,67 ± 0,08 1,00 ± 0,02 0,96 ± 0,02 0,70 ± 0,02 Макро-, микроэлементы Na (натрий), мг 35,00 ± 1,05 35,00 ± 1,05 K (калий), мг 370,00 ± 11,01 370,00 ± 11,01 Ca (кальций), мг 35,00 ± 1,05 35,00 ± 1,05 Mg (магний), мг 24,00 ± 0,72 24,00 ± 0,72 Р (фосфор), мг 37,00 ± 1,11 37,00 ± 1,11 Fe (железо), мг 1,20 ± 0,03 1,20 ± 0,03 J (йод), мкг 157,00 ± 4,71 Cu (медь), мкг 157,00 ± 4,71 157,00 ± 4,71 Zn (цинк), мкг 197,00 ± 5,91 197,00 ± 5,91 F (фтор), мкг 18,00 ± 0,54 18,00 ± 0,54 Mn (марганец), мкг 175,00 ± 5,25 175,00 ± 5,25 Витамины β-каротин, мг 0,14 ± 0,003 0,14 ± 0,003 Е, мг 0,67 ± 0,02 0,67 ± 0,02 С, мг 235,0 ± 7,05 211,5 ± 6,34 Тиамин, мг 0,05 ± 0,001 0,05 ± 0,001 Рибофлавин, мг 0,04 ± 0,001 0,03 ± 0,001 Ниацин, мг 0,24 ± 0,005 0,24 ± 0,005 Биотин, мг 2,65 ± 0,08 2,65 ± 0,08 Пантотеновая кислота, мг 0,32 ± 0,009 0,32 ± 0,009 Фолацин, мкг 5,00 ± 0,15 5,00 ± 0,15 Энергетическая 44,50 ± 1,33 110,00 ± 3,31 ценность, ккал 18,70 ± 0,56 1,90 ± 0,06 1,40 ± 0,04 0,67 ± 0,02 35,00 ± 1,05 370,00 ± 11,01 35,00 ± 1,05 24,00 ± 0,72 37,00 ± 1,11 1,20 ± 0,03 157,00 ± 4,71 197,00 ± 5,91 18,00 ± 0,54 175,00 ± 5,25 0,10 ± 0,001 0,50 ± 0,001 207,00 ± 6,21 0,06 ± 0,001 0,05 ± 0,001 0,24 ± 0,005 2,65 ± 0,08 0,32 ± 0,009 5,00 ± 0,15 62,00 ± 1,86 Однако, помимо отмеченных функций, углеводы в продуктах питания могут выполнять технологические функции (например, изменять консистенцию или придавать специальные свойства), которые зависят от 106 состава углеводных компонентов. Пищевое значение ягод определяется значительным содержанием в них сахаров, кислот, минеральных веществ, а также каротина и витамина С. Анализ химического состава свежих ягод смородины и продуктов её переработки позволил констатировать тот факт, что вследствие технологической обработки ягод при приготовлении ягодного пюре и сока содержание водорастворимого витамина уменьшается на 10%. Также необходимо отметить, что в результате тепловой обработки и других необходимых технологических операций, при которых происходит распад протопектина и переход его в растворимую форму, было отмечено некоторое увеличение содержания растворимых пектиновых веществ в пюре. Влияние ягодных наполнителей в виде пюре и сока на пенообразующие свойства смеси гидролизатов казеина в присутствии стабилизатора консистенции представлены в таблице 3.17 и на рисунке 3.21. Таблица 3.17. Влияние ягодных наполнителей на кратность и устойчивость пен (n=5) Массовая доля пюре, % Кратность пены, % 10,0 ± 0,5 20,0 ± 0,5 30,0 ± 0,5 40,0 ± 0,5 50,0 ± 0,5 610 ± 18,30 570 ± 17,10 510 ± 15,30 420 ± 12,60 350 ± 10,50 Устойчивость пены, мин. 940 ± 28,20 955 ± 28,65 950 ± 28,55 917 ± 27,31 901 ± 26,40 625,00 ± 18,55 580,00 ± 17,41 525,00 ± 15,75 460,00 ± 13,80 395,00 ± 11,85 897,00 ± 26,91 885,00 ± 26,55 865,00 ± 25,95 810,00 ± 24,30 780,00 ± 23,40 Массовая доля сока, % 5,0 ± 0,5 10,0 ± 0,5 15,0 ± 0,5 20,0 ± 0,5 25,0 ± 0,5 При использовании пюре в качестве ягодного наполнителя наблюдалось снижение кратности пен во всех исследуемых образцах. 107 а) б) Рисунок 3.21. Пенообразующие характеристики гидролизата казеина в присутствии ягодных наполнителей: а) пюре из смородины; б) сока из смородины. 108 При введении в образцы смеси гидролизата казеина 10% смородинового пюре кратность пен уменьшалась на 6,23 ± 0,25%; 20% – на 12,97 ± 0,51%; 30% – на 22,13 ± 0,88%; 40% и 50% пюре – на 35,11 ± 1,41% и 46,51 ± 1,39% соответственно. Данный факт во многом обусловлен увеличением вязкости пенных масс под воздействием сухих веществ внесенного пюре. Наряду с этим отмечалось увеличение устойчивости пен и получение абсолютной стабильности систем при введении в смесь гидролизата казеина дополнительным 20% влиянием смородинового пектиновых пюре, веществ, это объясняется содержащихся в наполнителе. Взбивание смеси гидролизата казеина в присутствии сока приводило к снижению пенообразующих характеристик в целом. Так, введение сока в количестве (15,0 – 25,0) ± 0,5% снизило кратность пены в 1,24 – 1,67 раза. При этом наблюдалось понижение их устойчивости, поскольку в соке из ягод смородины содержание массовой доли сухих веществ меньше на 15,50 ± 0,46%. Снижение устойчивости пен до 50% привело к переходу в подпенную жидкость до 27,6% общего количества клеточных стенок при использовании пюре. Наряду с пенообразующими свойствами полученных взбитых смесей гидролизатов казеина в присутствии ягодных наполнителей определяли их органолептические показатели по тридцатибалльной шкале, представленной в таблице 3.18. Таблица 3.18 - Балльная шкала органолептической оценки Шкала оценки, баллы Показатели качества Вкус и аромат Структура и консистенция Цвет и внешний вид Форма Общая оценка Коэффициен т значимости Число степеней качества 3 3 высшая максимал ьная оценка 9 4 3 2 1 10 отлично хорош о Удовлетв орительно 9-7 6-4 3-1 12 12-9 8-5 4-1 3 6 6-5 4-3 2-1 3 - 3 30 3 30-24 2 20-14 1 10-4 109 На следующем этапе исследований были изучены органолептические характеристики взбитых десертов на основе гидролизата казеина. Результаты исследований представлены в таблице 3.19. Анализ органолептических характеристик пенных десертов показал, что максимальную оценку, 28 и 29 баллов, получили образцы с массовой долей смородинового пюре и сока 20,0 ± 0,5% и 15,0 ± 0,5%, соответственно. Эти образцы характеризовались стабильной структурой, состоящей из мелких пузырьков, равномерно распределенных по всей массе. Поверхность слегка желированная, глянцевая. Консистенция стабильная, устойчивая, хорошо сохраняющая форму. Образцы с содержанием пюре из смородины 10,0 ± 0,5% набрали 22 балла, однако имели маловыраженный вкус и аромат. При массовой доле пюре 30,0 ± 0,5% взбитые смеси гидролизата казеина также набрали высокую оценку по органолептическим показателям – 26 баллов, однако во время хранения наблюдалось незначительное оседание пены. Дальнейшее увеличение дозы пюре до (40,0 – 50,0) ± 0,5 % в испытуемых образцах приводило к изменению цвета и наличию включений из частиц смородинового пюре, ощущаемых на вкус. Введения 5,0 ± 0,5 и 10,0 ± 0,5% сока недостаточно для придания образцам полного вкуса и аромата смородины, но характеризовалось стабильной пеной, состоящей из мелкодисперсных пузырьков, хорошо сохраняющих форму во время хранения. Увеличение дозы сока до 20,0 ± 0,5 и 25,0 ± 0,5% приводило к получению малостабильных систем с распределением средних и крупных пузырьков по всей массе. Форма пен неустойчивая, наблюдался отстой подпенной жидкости во время хранения. Общая оценка органолептических характеристик исследуемых образцов при указанной дозе сока из смородины составила 19 и 15 баллов. 110 Таблица 3.19. Органолептическая оценка взбитых десертов на основе гидролизата казеина в присутствии ягодных наполнителей (n=3) Массовая доля наполнителя, % Вкус и аромат Балл Структура и консистенция Балл Цвет и внешний вид Балл Форма Балл Общая оценка 3 22 3 28 2 26 2 14 2 13 Десерт с пюре из ягод смородины 10,0 ± 0,5 20,0 ± 0,5 30,0 ± 0,5 40,0 ± 0,5 50,0 ± 0,5 Мало выраженный смородиновый Умеренно выраженный смородиновый, приятный Выраженный смородиновый, приятный Ярко выраженный смородиновый, ощущение частиц пюре Чрезмерно выраженный смородиновый, приторный, ощущение частиц пюре 5 8 9 4 3 Мелкодисперсная пена с распределением мелких пузырьков по всей массе, желированная, стабильная Мелкодисперсная пена с распределением мелких пузырьков по всей массе, слегка желированная, стабильная Мелкодисперсная система, с распределением мелких и средних пузырьков по всей массе, слегка желированная, в меру стабильная Дисперсная система с распределением мелких и средних пузырьков, желированная, малостабильная Дисперсная система с распределением средних и крупных пузырьков, желированная, малостабильная 12 12 10 5 5 Светло-бордовый, неравномерный по всей массе, с вкраплением частиц пюре Ярко-бордовый, равномерный по всей массе, с вкраплением частиц пюре Ярко-бордовый, равномерный по всей массе, с вкраплением частиц пюре Бордовый, равномерный по всей массе, с включениями частиц пюре Темно-бордовый, равномерный по всей массе, с включениями частиц пюре 2 5 5 3 3 Устойчивая, хорошо сохраняющая форму Устойчивая, хорошо сохраняющая форму Относительно устойчивая, сохраняющая форму Относительно устойчивая, сохраняющая форму Относительно устойчивая, сохраняющая форму 111 Окончание таблицы 3.19 Десерт с соком из ягод смородины 5,0 ± 0,5 10,0 ± 0,5 Невыраженный смородиновый Мало выраженный смородиновый 4 6 Смородиновый, приятный 15,0 ± 0,5 20,0 ± 0,5 25,0 ± 0,5 9 Ярко выраженный смородиновый, приятный Чрезмерно выраженный смородиновый 7 5 Мелкодисперсная пена с распределением мелких пузырьков по всей массе, желированная, стабильная Мелкодисперсная пена с распределением мелких и наличием средних пузырьков по всей массе, желированная, стабильная Мелкодисперсная пена с распределением мелких и включением средних пузырьков по всей массе, желированная, стабильная Дисперсная система с распределением средних и крупных пузырьков, желированная, малостабильная Дисперсная система с распределением средних и крупных пузырьков, желированная, нестабильная 12 Розовый, равномерный по всей массе 4 11 Светло-бордовый, равномерный по всей массе 11 Ярко-бордовый, равномерный по всей массе 6 Ярко-бордовый, равномерный по всей массе 5 4 Темно-бордовый, равномерный по всей массе 5 5 6 Устойчивая, хорошо сохраняющая форму Устойчивая, хорошо сохраняющая форму Устойчивая, хорошо сохраняющая форму Неустойчивая, с отстоем подпенной жидкости во время хранения Неустойчивая, с отстоем подпенной жидкости во время хранения 3 23 3 25 3 29 1 19 1 15 112 ГЛАВА 4. ПРАКТИЧЕСКАЯ РЕАЛИЗАЦИЯ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ 4.1. Разработка рецептур и технологий взбитых молочных десертов с ягодным наполнителем на основе гидролизатов казеина Современный ритм жизни вызывает сильное напряжение психологических и физических возможностей человека, что часто приводит к перенапряжению и нарушению нормального функционирования организма. В результате у человека, снижается иммунитет, развиваются аутоиммунные заболевания, и если не соблюдается восстановительный режим, организм быстро входит в стрессовое состояние. Значительная часть населения, проживающая в сельской местности и небольших городах со слабо развитой городской инфраструктурой и частным жилым сектором, и в повседневной жизни также подвергается высоким физическим нагрузкам [111]. В таких условиях организму для обеспечения восстановления организма требуется помощь в дифференцированном управлении физиологическими процессами. В результате проведенных исследований установлено влияние различных параметров на ступенчатый гидролиз казеина и формирование газодисперсной системы на основе гидролизата казеина. Полученные данные позволяют создать новые виды продуктов, как общего, так и специального назначения, отвечающие потребностям организма при физических и умственных нагрузках. На завершающем этапе работы решались следующие задачи: - разработка рецептур и технологии взбитых десертов на основе гидролизата казеина; - исследование показателей безопасности новых десертов на основе гидролизата казеина; - расчет экономической эффективности производства новых видов 113 продукции. Взбитые молочные десерты на основе гидролизата казеина рекомендуется вырабатывать по рецептурам, представленным в таблице 4.1. Таблица 4.1 – Рецептуры взбитых молочных десертов на основе гидролизата казеина Наименование сырья Расход сырья, г кг при использовании пюре из смородины сока из смородины в сухих в сухих в натуре в натуре в-вах в-вах Основа с массовой долей гидролизата 63,0 20,6 67,5 20,6 казеина 20% Стабилизатор «Гелеон 2,0 2,70 2,5 2,72 141 С-Д» Пюре из смородины 20,0 6,48 Сок из смородины 15,0 1,8 6,15*+8,85 15 8,2*+6,8 15 Сахароза Всего 100 44,78 100 40,12 Примечание* – Количество сахара на приготовление ягодного полуфабриката (пюре и сока). На основании проведенных исследований разработаны рецептуры десерта на основе гидролизата казеина с ягодным соком и пюре. Технологический процесс осуществляется в последовательности, приведенной на рисунке 4.1. Первый этап – производство гидролизата казеина состоит из основных операций: подготовка основного и вспомогательного сырья к гидролизу гидролиз казеина 1 ст.-кислотный: соотношение белок:кислота 1:20 Т= 110±5 0С, 6 ч. нейтрализация кислоты Т<75±5 0С, рН=7,0-7,5 очистка от двухводного гипса через колонку: размер анионита 0,8 -1,0 мм, высота слоя700-750 мм 2 ст.-ферментативный: соотношение фермент:субстрат 1:100 Т= 50±2 0С, 6 ч.) инактивация ферментов обработкой острым паром Т=90±50С, 15±5 с УВТ-обработка, 1300С±20С охлаждение, 200С 114 Второй этап - включает следующие операции: приемка, оценка качества компонентов согласно рецептуре подготовка компонентов для молочных десертов согласно рецептурам внесение стабилизатора Гелеон 141С-Д , 2-2,5 % внесение наполнителей: сок смородины - 15 %, пюре смородины -20% смешивание компонентов, охлаждение смеси до температуры Т=4,00±10С взбивание при температуре Т=4,00±10С, фасование, упакование, хранение Рисунок 4.1 – Технологическая схема взбитых молочных десертов на основе гидролизата казеина Технологический регламент производства состоит из двух этапов. Первый этап – производство гидролизата состоит из основных операций: подготовка основного и вспомогательного сырья к гидролизу; кислотный гидролиз, нейтрализация и очистка гидролизата, ферментативный гидролиз УВТ-обработка, фасование и упаковывание полуфабриката. Второй этап включает следующие операций: приемка, оценка качества компонентов; подготовка компонентов для создания основы взбитых молочных десертов; смешивание компонентов согласно рецептурам, внесение основы в колбу кислородного коктейлера в соотношении ¾; перемешивание; подключение коктейлера к источнику кислорода (концентратор кислорода, баллон с понижающим редуктором); остановка процесса пенообразования (производится прекращением подачи кислорода в коктейлер). Насыщение кислородом взбитых молочных десертов зависит от нескольких факторов, производительности установки, времени барботажа, качества смеси и пенообразователя, а также от количества подаваемой смеси и др. факторов. По органолептическим показателям разработанный десерт на основе гидролизата казеина соответствует представленного в таблице 4.2 результатам сенсорного анализа, 115 Таблица 4.2 - Органолептические показатели взбитых молочных десертов на основе гидролизата казеина Наименование Норма показателя Внешний вид и Нетекущий продукт, сохраняющий форму в упаковке с консистенция консистенцией пены слегка желированной и глянцевой поверхностью Вкус и запах Сладко-кислый с выраженным вкусом и ароматом наполнителя Цвет Светло-бордовый, равномерный по всей массе Физико-химические характеристики разработанного взбитых молочных десертов на основе гидролизата казеина представлены в таблице 4.3 Таблица 4.3 - Физико-химические характеристики и энергетическая ценность взбитых молочных десертов на основе гидролизата казеина Физико-химические показатели десертов Содержание с пюре из смородины 20,00 с соком из смородины 20,00 Массовая доля углеводов, %, не менее 28,40 20,60 Массовая доля сухих веществ, %, 44,78 40,12 Массовая доля жира, % не менее 0,05 0,05 186,42 157,70 Массовая доля белка, %, не менее Энергетическая ценность, ккал/100 г Наиболее важным, с точки зрения обеспечения безопасности, является контроль микробиологических характеристик. Нормируемые микробиологические характеристики взбитых молочных десертов на основе гидролизата казеина (с учетом требований, установленных в документе «Гигиенические требования к безопасности и пищевой ценности пищевых 116 продуктов», СанПиН 2.3.2.1078-01, п. 1.2.2.3) приведены в таблице 4.4. Таблица 4.4 - Нормируемые микробиологические показатели взбитых молочных десертов на основе гидролизатоа казеина Наименование показателя Норма Фактически БГКП в 0,01 г не допускается не обнаружены S. aureus, в 0,1 г не допускается не обнаружены Дрожжи, КОЕ/г, не более 100 не обнаружены Плесени, КОЕ/г, не более 50 не обнаружены не допускается не обнаружены Микробиологические показатели: Патогенные, в т.ч. сальмонеллы в 25 г Дальнейшие исследования направлены на исследования микробиологических характеристик взбитых молочных десертов на основе гидролизата казеина в процессе хранения при температуре 4+2оС. 4.2 Установление продолжительности хранения продукта Анализ полученных результатов показал, что по содержанию санитарно-показательных и патогенных микроорганизмов исследуемые образцы отличаются микроорганизмы высокой (бактерии надежностью, группы кишечной поскольку палочки, искомые золотистый стафилококк, сальмонеллы) в нормируемых массах продукта не обнаружены. Иная картина установлена при определении плесеней и дрожжей, которые были обнаружены в продукте, причем на восьмые сутки содержание последних составило 23 и 28 КОЕ/г соответственно. Из этого можно заключить, что гарантийный срок хранения с учетом 1,5 срочного (регламентированного Роспотребнадзором) составляет 5 суток. 117 Таблица 4.5 - Микробиологические показатели взбитых молочных десертов на основе гидролизата казеина Продолжи тельность бактерии хранения, группы сутки кишечной палочки в 0,01 г 1 0 (фон) 2 не обнаружены 1 не обнаружены 2 не обнаружены 4 не обнаружены 5 не обнаружены 6 7 8 не обнаружены не обнаружены не обнаружены Микробиологические показатели патогенные St. aureus в 1 дрожжи, микроорганиз г КОЕ/г мы, в т.ч. L. monocytogenes и бактерии рода сальмонелла в 25 г 3 5 6 не не не обнаружены обнаружены обнаруже ны не не не обнаружены обнаружены обнаруже ны не не не обнаружены обнаружены обнаруже ны не не не обнаружены обнаружены обнаруже ны не не не обнаружены обнаружены обнаруже ны не не 3 обнаружены обнаружены не не 11 обнаружены обнаружены не не 23 обнаружены обнаружены плесен и, КОЕ/г 7 не обнару жены не обнару жены не обнару жены не обнару жены не обнару жены 5 15 28 По окончанию сроков хранения взбитых молочных десертов на основе гидролизата казеина хранившихся в полимерной пластиковой упаковке, изучали показатели безопасности дополнительно контролировали органолептические показатели. Результаты исследований приведены в таблице 4.6. 118 Таблица 4.6 – Показатели безопасности взбитого молочного десерта на основе гидролизата казеина по окончании сроков хранения Токсичные Норма, Фактическое Нормативная документация элементы мг/кг значение на метод испытаний Кадмий 0,1 менее 0,005 ГОСТ Р 51301-99 Свинец 0,3 0,02 ГОСТ Р 51301-99 Мышьяк 0,2 менее 0,04 ГОСТ Р 51301-99 Ртуть 0,02 менее 0,0002 Методические указания 5178-90 По результатам исследований выявлено, что миграции токсичных элементов в продукт не отмечается, контролируемые потенциально опасные химические вещества содержатся в продукте в концентрациях, более чем на порядок не превышающих установленных нормативов. Помимо перечисленных веществ содержание радионуклидов цезия-137 (норматив не более 50 Бк/кг) и стронция-90 (норматив не более 25 Бк/кг) в продукте не установлена. 4.3. Расчет стоимости сырья и основных материалов для производства молочного десерта на основе гидролизата казеина Расчет экономической эффективности производства молочных десертов проводилось по нормативным расценкам нам 01.09. 2014г. Использование ягодных наполнителей в рецептурах молочной продукции позволяет не только расширить ассортимент, регулировать органолептические и структурные характеристики, но и значительно повысить биологическую и пищевую ценность новых продуктов. Смородина, произрастающая в западносибирском регионе, широко распространена в питании населения благодаря доступности и богатому химическому составу. Популярность этих ягод объясняется их особыми вкусовыми качествами, широким спектром лечебных свойств. 119 Сегодня все большую популярность получают молочные продукты с использованием полифункциональных добавок. Развитие малых торговых точек в крупных гипермаркетах и торговых центрах, а так же магазинов спортивного и здорового питания дает возможность расширить целевую аудиторию покупателей. Таблица 4.7 – Стоимость основного сырья для производства молочного десерта с использованием продуктов переработки ягод смородины. Наименование компонента Основа с массовой долей гидролизата казеина 20% Стабилизатор «Гелеон 141 С-Д» Смородина Сахароза Стоимость 1 кг. сырья, руб. Расходы сырья на 100 кг. продукции, кг сок смородины 76,2 67,5 5143,5 210,5 2,5 525,0 135,5 15,0 203,3 160,0 15,0 240,0 Итого Основа с массовой долей гидролизата казеина 20% Стабилизатор «Гелеон 141 С-Д» Смородина Сахароза Итого Стоимость сырья на 100 кг. продукции, руб. 6111,8 пюре смородины 76,2 20,6 1569,7 210,5 2,7 568,3 135,5 6,48 87,8 160,0 15,0 240,0 2465,8 При проведенном расчете видно, что сумма затрат на сырье меньше при технологии взбитого молочного десерта с использованием пюре смородины. 120 Таблица 4. 8 – Структура себестоимости молочного десерта (на 100 кг.) Статьи расходов Сырье и основные материалы Удельный вес, % 87,6 Затраты тыс. руб. с соком с пюре 6111,8 2465,8 Вспомогательные материалы и упаковка 1,2 73,34 29,5 Энергозатраты Заработная плата с отчислениями 4,2 1,8 256,6 110,0 203,5 104,4 Маркетинговые издержки 0,5 30,5 22,3 Амортизация 1,8 110,0 94,4 Общие производственные затраты 2,9 177, 2 171,5 Итого полная себестоимость 100 6769,4 5771,4 33,84 29,8 Цена за ед. продукции (0,33 л) Анализ таблицы показал, что наибольшей удельный вес в структуре затрат, занимает сырье. Поэтому себестоимость готовой продукции в наибольшей степени зависит от стоимости сырья. Доля постоянных затрат увеличивает цену продукции. 121 ВЫВОДЫ 1. Рациональными параметрами ступенчатого гидролиза казеина явились: на 1 этапе использование в качестве химического агента 6 Н серной кислоты при соотношении казеин:кислота 1:20, температурный режим 110±5 °С в течение 6 ч. На втором этапе использование комплекса ферментов, в состав которых входят эндо- и экзопептидазы: бролин, карбоксипептидаза А и лейцинаминопептидаза в соотношении «фермент-субстрат» 1:100, рН-7 и температура 50±1°С в течение 6 ч. 2. В ходе проведения ступенчатого гидролиза динамика накопления свободных аминокислот в гидролизате составила: на первой ступени при кислотном гидролизе 39,19±3,17%, на второй ступени при ферментативном гидролизе 92,85±3,71%. По содержанию токсичных элементов (тяжелых металлов, мышьяка, кадмия, ртути и др.), хлорорганических соединений и микотоксинов гидролизаты казеина отвечали медико-биологическим требованиям и санитарным нормам качества продовольственного сырья. 3. Исследовано изменение пенообразующих свойств молочных основ с содержанием гидролизата казеина от 10,00 до 25,00 %, в зависимости от температурных режимов, доз стабилизирующих веществ и ягодных наполнителей. Кратность пены при использовании 20,00% пюре и 15,00% сока смородины составила 570,00±17,10 и 525,00±15,75 %, устойчивость 955±28,65 и 865,00± 25,95 мин., соответственно, в присутствии стабилизатора Гелеон 141 С-Д в количестве 2,00-2,50%. 4. На основании проведенных исследований разработаны регламент и технологические схемы получения молочных взбитых десертов на основе гидролизата казеина. Первый этап - производство гидролизата, включает подготовку основного и вспомогательного сырья к гидролизу; кислотный гидролиз, нейтрализацию и очистку гидролизата, ферментативный гидролиз УВТ-обработку, фасование и упаковывание полуфабриката. Второй этап включает следующие операции: подготовка и 122 смешивание компонентов для создания основы взбитых молочных десертов; внесение основы в колбу кислородного коктейлера в соотношении ¾; перемешивание и взбивание. 5. Рассчитаны основные технико-экономические показатели по производству молочных взбитых десертов на основе гидроолизата казеина, которые показывают целесообразность проекта, себестоимость десертов с соком и пюре из смородины составила 6769,4 и 5771,4 рублей за 100 кг готового продукта; разработана техническая документация; результаты работы апробированы и внедрены на перерабатывающих предприятиях. 123 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1. Алексеева, Н.Ю. Современная номенклатура белков молока / Н.Ю. Алексеева // Молочная промышленность. – 1983. – № 4. – С. 27–31. 2. Алексеева, Н.Ю. Современные достижения в области химии белков молока / Н.Ю. Алексеева, Ю.В. Павлова, Н.И. Шишкин // Обзорная информация. Серия «Молочная промышленность». – М.: АгроНИИТЭИММП, 1988. – 32 с. 3. Аналитические методы белковой химии: сборник статей / под ред. В.Н. Ореховича. – М.: Изд-во Иностранная литература, 1963. – 643 с. 4. Антипова, Л.В. Прикладная биотехнология / Л.В. Антипова, И.А. Глотова, А.И. Жаренов. – Воронеж, 2000. – 332 с. 5. Антонов, В.К. Химия протеолиза / В.К. Антонов. – М.: Наука, 1983. – 367 с. 6. Арбатская, Н.И. Молочно-белковые концентраты – казециты для детского и диетического питания / Н.И. Арбатская, Л.Н. Анохина. – М.: ЦНИИТЭИмясомолпром, 1985. – 27 с. 7. Асатиани, В.С. Биохимический анализ: в 2 ч. / В.С. Асатиани. – 2-е изд., перераб. и доп. – Тбилиси: Грузмедгиз, 1955. – Ч. 2. – 475 с. 8. Асатиани, В.С. Методы биохимических исследований: руководство для врачей-лаборантов и биохимиков / В.С. Асатиани. – М.: Медгиз, 1956. – 471 с. 9. Бабич, О.О. Исследование и разработка технологии молочного белкового эквивалента для специализированных продуктов питания: дис. … канд. техн. наук: 05.18.04 / Бабич Ольга Олеговна. – Кемерово, 2009. – 148 с. 10. Барашнев, Ю.И. Наследственные болезни обмена веществ у детей / Ю.И. Барашнев, Ю.И. Вельтищев. – Л.: Медицина, 1978. – 320 с. 11. Беккер, М.Е. Введение в биотехнологию / М.Е. Беккер ; пер. с латыш. – М.: Пищевая промышленность, 1978. – 231 с. 124 12. Бендер, М. Биоорганическая химия ферментативного катализа / М. Бендер, Р. Бергерон, М. Комияма ; пер. с англ. – М.: Мир, 1987. – 352 с. 13. Березов, Т.В. Биоорганическая химия / Т.В. Березов, Б.Ф. Коровин. – М.: Медицина, 1990. – 380 с. 14. Биологически активные пептиды из белков молока / О.В. Козлова, И.С Разумникова, О.О. Бабич, А.Ю. Просеков // Молочная промышленность. – 2010. – № 9. – С. 68–69. 15. Биотехнология. Принципы и применение / под ред. И. Хиггинса, Д. Беста, Дж. Джонса ; пер. с англ. – М.: Мир, 1988. – 480 с. 16. Биотехнология: учеб. пособие для вузов: в 8 кн. / И.В. Береэнн, А.А. Клёсов, В.К. Швядас [и др] ; под ред. Н. С. Егорова, В. Д. Самуилова. – М.: Высшая школа, 1987. – Кн. 8: Инженерная энзимология. – 143 с. 17. Большаков, О.В. Государственная политика в области здорового питания / О.В. Большаков // Молочная промышленность. – 1999. – № 6. – С. 5–6. 18. Борисенко, Л.А. Экспериментальное обоснование технологических параметров получения гидролизата сывороточных белков молока / Л.А. Борисенко, А.Д. Лодыгин, А.В. Адоньев // Сборник научных трудов СевКавГТУ. Серия «Продовольствие». – 2005. – № 1. – С. 59–61. 19. Боровик, Т.Э. Аллергия к сое у детей раннего возраста / Т.Э. Боровик, Т.Э. Ревякина, Н.В. Обухова // Педиатрия. – 2000. – № 2. – С. 51–55. 20. Боровик, Т.Э. Использование специализированных продуктов на основе гидролизатов белка в питании детей с пищевой аллергией. Аллергология / Т.Э. Боровик, Е.А. Рославцева, И.В. Гмошинский // Педиатрия. – 2001. – № 2. – С. 38–42. 21. Боровик, Т.Э. Специализированные смеси в профилактике и лечении пищевой аллергии у детей. Consilium medicum / Т.Э. Боровик // Педиатрия. – 2008. – № 1. – С. 64–68. 22. Буянова, И.В. Технология цельномолочных продуктов / И.В. Буянова. – Кемерово, 2004. –116 с. 125 23. Быков, В.А. Биотехнология. Производство белковых веществ / В.А. Быков, М.Н. Манаков, В.И. Панфилов. – М.: Высшая школа, 1987. – 140 с. 24. Вельтищев, Ю.Е. Обмен веществ у детей / Ю.Е. Вельтищев, Ю.А. Князев, А.А. Ананенко. – М.: Изд-во Медицина, 1983. – 464 с. 25. Вельтищев, Ю.Е. Наследственные болезни обмена веществ / Ю.Е. Вельтищев, Л.З. Казанцева, А.Н. Семячкина. – М.: Наследственная патология человека, 1992. – 101 с. 26. Влияние белков молока и полученных на их основе ферментативных гидролизатов на неспецифическую состояние некоторых резистентность к систем, пищевым обеспечивающих аллергизирующим воздействиям / Н.А. Маликова [и др.] // Вопросы питания. – 1993. – № 1. – С. 26–30. 27. Воробьев, М.М. Кинетика ферментативного гидролиза полипептидов и гидрофобные эффекты: дис. … д-ра хим. наук: 02.00.04 / Воробьёв Михаил Михайлович. – М., 2009. – 273 с. 28. Гаврилов, Г.Б. Реологические свойства сывороточных белковых концентратов / Г.Б. Гаврилов // Молочная промышленность. – 2006. – № 4. – С. 82. 29. Гаврилов, Г.Б. Исследование и разработка технологий функциональных 30. компонентов и пищевых продуктов на основе переработки молочной сыворотки мембранными методами: автореф. дис. … д-ра техн. наук: 05.18.04: защищена 26.10.06 / Гаврилов Гавриил Борисович. – Кемерово, 2006. – 44 с. 31. Гаврилова, Н.Б. Основные направления производства комбинированных молочных продуктов // Обзорная информация. Серия «Молочная промышленность». – М.: АгроНИИТЭИММП, 1994. – 49 с. 32. Гаврилова, Н.Б. Биотехнологические основы производства комбинированных кисломолочных продуктов: автореф. дис. … д-ра техн. наук: 05.18.04: защищена 15.01.96 / Гаврилова Наталья Борисовна. – Кемерово, 1996. – 39 с. 126 33. Гаврилова, Н.Б. Биотехнология комбинированных молочных продуктов: монография. – Омск: Вариант - Сибирь, 2004. – 224 с. 34. Галстян, А.Г. Развитие научных основ и практические решения совершенствования технологий, повышения качества и расширения ассортимента молочных консервов: автореф. дис. … д-ра техн. наук. – М., 2009. – 50 с. 35. Галстян, А.Г. Краткий справочник специалиста молочно-консервного производства / А.Г. Галстян, И.А. Радаева, С.Н. Туровская. – М.: Изд-во ООО «Ритм», 2011. – 152 с. 36. Галь, Э. Электрофорез и разделении биологических макромолекул / Э. Гааль, Г. Медьеши, Л. Верецкеи ; пер. с англ. – М.: Мир, 1982. – 448 с. 37. Гаурович, Ф. Химия и функции белков / Ф. Гаурович. – М.: Мир, 1965. – 530 с. 38. Глик, Б. Молекулярная биотехнология. Принципы и применение / Б. Глик, Дж. Пастернак ; пер. с англ. – М.: Мир, 2002. – 589 с. 39. Геворкян, Г.Р. Разработка методических подходов к оценке функционально-технологических свойств соевых белковых препаратов, в том числе полученных биотехнологическими методами: автореф. дис. … канд. техн. наук: 05.18.04: защищена 18.01.2007 / Геворкян Гайк Рубенович. – М., 2006. – 24 с. 40. Гигиенические требования безопасности и пищевой ценности пищевых продуктов: СанПиН 2.3.2.1078–01. – М.: Минздрав РФ, 2002. – 164 с. 41. Горбатова, К.К. Физико-химические и биохимические основы производства молочных продуктов / К.К. Горбатова. – М.: ГИОРД, 2003. – 352 с. 42. ГОСТ Р 52738 – 2007. Молоко и молочные продукты. Термины и определения [Текст]. – Введ. 2009 –01 –01. – М.: Стандартинформ, 2008. – 31 с. 43. ГОСТ 25179 – 90. Молоко. Методы определения белка [Текст]. – Взамен ГОСТ 25179 – 82 ; введ. 1991 – 01 – 01. – М.: Стандартинформ, 2009. – 6 с. 127 44. ГОСТ 26809 – 86. Молоко и молочные продукты. Правила приемки, методы отбора и подготовка проб к анализу [Текст]. – Взамен ГОСТ 3622– 68; введ. 1987 – 01 – 01. – М.: Стандартинформ, 2009. – 10 с. 45. Готтшалк, А. Казеины овцы, козы и человека. Гликопротеины. – М.: Мир, 1969. – Т. 2. – 300 с. 46. Грачева, И.М. Технология ферментных препаратов / И.М. Грачева. – М.: Агропромиздат, 1987. – 391 с. 47. Громова, Л.В. Влияние пептидов, входящих в состав гидролизатов казеина, на всасывание глюкозы и воды в тонкой кишке крыс / Л.В. Громова, М.Л. Иоффе // Физиологический журнал им. И.М.Сеченова. – 1993. – Т. 79, № 6. – С. 73–79. 48. Дамиш, В. Влияние кратковременной тепловой обработки казеина на кинетику его гидролиза промышленным сычужным ферментом / В. Дамиш, А. Жбиковская // XXI Международный молочный конгресс. Краткие сообщения. – М.: ЦНИИТЭИмясомолпром, 1982. – Т. 1, Кн. 2. – С. 120. 49. Данилов, М.Б. Получение пребиотической пищевой добавки из молочной сыворотки // Хранение и переработка сельхозсырья. – 2001. – № 9. – С. 30–31. 50. Данилов, М.Б. Теоретические и практические основы производства пробиотических продуктов с использованием -галактозидазы и эубиотиков / М.Б. Данилов. – Улан-Удэ, 2003. – 130 с. 51. Диетотерапия наследственных нарушений аминокислотного обмена / Е.П. Рыбакова, Т.В. Бушуева, К.С. Ладодо [и др.] // Вопросы детской диетологии. – 2005. – Т. 3, № 1. – С. 11–17. 52. Диксон, М. Ферменты: в 3 т. / М. Диксон, Э.Уэбб ; пер. с англ. – М.: Мир, 1982. – Т. 1. – 392 с. 53. Диксон, М. Ферменты: в 3 т. / М. Диксон, Э.Уэбб ; пер. с англ. – М.: Мир, 1982. – Т. 3. – 392 с. 54. Досон, Р. Справочник биохимика / Р. Досон, Д. Эллиот, Х. Элиот. – М.: Мир, 1991. – 544 с. 128 55. Дуденков, А.Я. Биохимия молока и молочных продуктов / А.Я. Дуденков, Ю.А. Дуденков. – М.: Пищевая промышленность, 1972. – 160 с. 56. Дьяченко, П.Ф. Исследование белков молока / П.Ф. Дьяченко // Труды ВНИМИ. – 1959. – Вып. 19. – С. 28–32. 57. Дэвени, Т. Аминокислоты, пептиды и белки / Т. Дэвени, Я. Гергей ; пер. с англ. – М.: Мир, 1976. – 364 с. 58. Дюга, Г. Биоорганическаи химия. Химические подходы к механизму действия ферментов / Г. Дюга, К. Пенни ; пер. с англ. – М.: Мир, 1983. – 512 с. 59. Землянухин, А.А. Практикум по биохимии / А.А. Землянухин. – Воронеж, 1975. – 140 с. 60. Зорин, С.Н. Получение ферментативного гидролизата белков молочной сыворотки, модифицированного по аминокислотному составу / С.Н. Зорин, В.И. Круглик // Питание здорового и больного человека: материалы конференции. – СПб., 2006. – С. 47–49. 61. Инихов, Г.С. Методы анализа молока и молочных продуктов / Г.С. Инихов, Н.П. Брио. – М.: Пищевая промышленность, 1971. – 424 с. 62. Ишмаметьева, М.В. Молочные продукты функционального питания / М.В. Ишмаметьева, Г.А. Донская // Пища. Экология. Человек: сборник трудов 6 международной научно-технической конференции МГУПБ. – М., 2003. – С. 71–72. 63. Калинин, Ф.Л. Справочник по биохимии / Ф.Л. Калинин, В.П. Лобов, В.Н. Жидков. – Киев: Наукова Думка, 1971. – 780 с. 64. Комиссаренко, С.В. Физико-химические и биологические свойства белков молока // Вопросы питания. – 1983. – № 1. – С. 6–11. 65. Короткий И.А. Исследование процессов выделения белков и лактозы из молочной сыворотки/ И.А. Короткий, П.А. Гунько, Т.З. Валиахметов // Техника и технология пищевых производств. – 2014. – № 1 (32). – С. 44–48. 66. Короткий, И.А. Исследование и разработка технологий замораживания и низкотемпературного хранения плодово-ягодного сырья Сибирского 129 региона: дис. … д-ра техн. наук: 05.18.04 / Короткий Игорь Алексеевич. – Кемерово, 2009. – 410 с. 67. Короткий И.А. Исследование процессов криоконцентрирования молочной сыворотки/ И.А. Короткий, П.А. Гунько, Д.Е. Федоров // Вестник КрасГАУ. – 2014. – Вып. 1. – С. 148–153. 68. Короткий, И.А. Применение метода двух температурно-временных интервалов для определения теплофизических характеристик пищевых продуктов и материалов / И.А.Короткий, Е.В. Короткая // Известия вузов. Пищевая технология. – 2008. – 2/3. – С. 109–111. 69. Короткая, Е.В. Криоконсервирование бактериальных препаратов молочной промышленности: монография / Е.В. Короткая, А.Ю. Просеков. – Кемерово, 2010. – 160 с. 70. Короткая, Е.В. Биосенсоры на основе коллодиевых пленок: монография / Е.В. Короткая. – Кемерово, 2011. –131 с. 71. Короткая, Е.В. Исследование влияния режимов замораживания и низкотемпературного хранения на качественные показатели молочнокислых заквасок / Е.В. Короткая, И. А. Короткий, Е.А. Ибрагимова // Вестник КрасГАУ. – 2011. – Вып. 7. – С. 196–200. 72. Короткая, Е.В., Коллоидно-химические аспекты и методы контроля качества пищевых продуктов / Е.В. Короткая, Н. В. Розаленок. – Кемерово, 2008. – 66 с. 73. Костюченко, А.Л. Энтеральное искусственное питание в интенсивной медицине / А.Л. Костюченко, Э.Д. Костин, А.А. Курыгин. – СПб., 1996. – 330 c. 74. Кочеткова, А.А. Функциональные ингредиенты и концепция здорового питания / А.А. Кочеткова, И.Н. Нестерова // Вопросы питания. – 2002. – № 2. – С. 4–7. 75. Крашенинин, П.Ф. Технология детских и диетических молочных продуктов: справочник / П.Ф. Крашенинин, Л.Н. Иванова, Г.П. Шаманова. – Агропромиздат, 1988. – 231 с. 130 76. Крашенинин, П.Ф. Сухие концентраты и гидролизаты молочных белков / П.Ф. Крашенинин, Г.Ю. Сажинов, В.И. Круглик // Молочная промышленность. – 1993. – № 3. – С. 4. 77. Крашенинин, П.Ф. Молочно-белковые концентраты – ценный компонент продуктов детского и диетического питания / П.Ф. Крашенинин, В.И. Круглик // Совершенствование технологии и улучшение показателей молочных продуктов детского и диетического питания: сборник научных трудов. – М., 1988. – С. 17–21. 78. Кремер, Л.К. Влияние тепловой обработки на белки обезжиренного молока / Л.К. Кремер, А.Р. Мaтесон, Ж. Берри // XXI Международный молочный конгресс. Краткие сообщения. – М.: ЦНИИТЭИмясомолпром, 1982. – Т. 1, Кн. 2. – С. 155. 79. Круглик, В.И. Белковые гидролизаты: теоретическое обоснование и практическая реализация технологий гидролизатов молочных белков и специализированных продуктов с их использованием: дис. … д-ра техн. наук: 05.18.04 / В.И. Круглик. – Кемерово, 2008. – 344 с. 80. Крусь, Г.Н. Методы исследования молока и молочных продуктов / Г.Н. Крусь, А.М. Шалыгина, З.В. Волокитина ; под общ. ред. А.М. Шалыгиной. – М.: Колос, 2000. – 368 с. 81. Курбанова, М.Г. Исследование и разработка полифункциональных добавок на основе гидролизатов казеина и практическая реализация технологий пищевых продуктов с их использованием: дис. … д-ра техн. наук: 05.18.04 / Курбанова Марина Геннадьевна. – Кемерово, 2012. – 369 с. 82. Ладодо, К.С. Руководство по лечебному питанию детей / К.С. Ладодо. – М.: Медицина, 2000. – 384 с. 83. Ладодо, К.С. Специализированные продукты питания для детей с различной патологией / К.С. Ладодо, Г.Ю. Сажинов. – М., 2000. – 200 с. 84. Липатов, Н.Н. Информационно-алгоритмические и терминологические аспекты совершенствования качества многокомпонентных продуктов питания специального назначения / Н.Н. Липатов, О.И. Башкиров, Л.В. 131 Нескромная // Хранение и переработка сельхозсырья. – 2002. – № 9. – С. 25– 28. 85. Лисин, П.А. Компьютерные технологии в рецептурных расчетах молочных продуктов / П.А. Лисин. – М.: ДеЛипринт, 2007. – 102 с. 86. Лисин, П.А. Современное технологическое оборудование для тепловой обработки молока и молочных продуктов: пастеризационные установки, подогреватели, охладители, заквасочники / П.А. Лисин, К.К. Полянский, Н.А.Миллер. – М.: Изд-во «ГИОРД», 2011. – 136 с. 87. Лупинская, С.М Изучение влияния технологических факторов на извлечение экстрактивных веществ из листьев крапивы / C.М. Лупинская, Е.В. Байматова // Хранение и переработка сельхозсырья. – 2004. – № 7. – С. 57–59. 88. Лупинская, С.М. Научное обоснование и разработка технологии молочных продуктов с использованием дикорастущего сырья Сибирского региона / С.М. Лупинская: автореф. дис. … д-ра техн. наук. – Кемерово, 2010. 89. Лупинская, С.М. Подготовка дикорастущего сырья при получении функциональных молочных продуктов / С.М. Лупинская // Техника и технология пищевых производств. – 2010. – № 3. – С. 13–17. 90. Лупинская, С.М. Технологические аспекты производства сывороточных напитков с использованием дикорастущего сырья Сибирского региона: монография. – Кемерово, 2009. – 196 с. 91. Медицинская генетика: учебно-методическое пособие для студентов, врачей-интернов, ординаторов, педиатров / А.Ф. Бабцева, Н.В. Климова, О.С. Юткина, В.И. Лабзин, Г.А. Ермаков. – Благовещенск: Амурская государственная медицинская академия, 2002. – 76 с. 92. Модификация белков молока сельскохозяйственных животных с использованием трансгенеза: биотехнологические возможности, проблемы и перспективы / Л.С. Попов, С.Г. Кадулин, И.Л. Гольдман [и др.] // Биотехнология. – 2000. – № 5. – С. 3–18. 132 93. Мосолов, В.В. Протеолитические ферменты / В.В. Мосолов. – М.: Наука, 1971. – 414 с. 94. Мохно, Г.Н. Переработка молока / Г.Н. Мохно. – Улан-Удэ: Изд-во ВСГТУ, 2000. – 440 с. 95. Мощинский, П. Получение знзиматических гидролизатов казеина, обедненных фенилаланином / П. Мощинский, Я. Идзяк // Прикладная биохимия и микробиология. – 1993. – Т. 29, № 3. – С. 398–403. 96. Мушкамбаров, Н.Н. Молекулярная биология: учебное пособие для студентов медицинских вузов / Н.Н. Мушкамбаров, С.Л.Кузнецов. – М.: ООО «Медицинское информационное агентство», 2003. – 544 с. 97. Научно-технические основы биотехнологии молочных продуктов нового поколения: учебное пособие / А.Г. Храмцов, Б.М. Синельников, И.А. Евдокимов [и др.]. – Ставрополь, 2002. – 118 с. 98. Неклюдов, А.Д. Получение белковых гидролизатов с заданными свойствами / А.Д. Неклюдов, С.М. Навашин // Прикладная биохимия и микробиология. – 1985. – Т. 21, № 1. – С. 3–17. 99. Нечаев, А.П. Пищевая химия / А.П. Нечаев, С.Е. Траубенберг, А.А. Кочеткова. – СПб.: ГИОРД, 2001. – 592 с. 100. Новые специализированные продукты в диетотерапии больных с наследственными нарушениями обмена / Т.В. Бушуева, К.С. Ладодо, Е.П.Рыбакова [и др.] // Вопросы питания. – 1998. – № 2. – С. 12–14. 101. Нормы физиологических потребностей в пищевых веществах и энергии для различных групп населения СССР. – М., 1991. – 25 с. 102. Овчинников, А. И. Биохимия молока и молочных продуктов / А.И. Овчинников, К.К. Горбатова. – Л.: ЛГУ, 1974. – 256 с. 103. Осинцев, А.М. Развитие фундаментального подхода к технологии молочных продуктов: монография. – Кемерово, 2004. – 152 с. 104. Осинцев, А.М. Оценка влияния дисперсности казеиновых мицелл на их коагуляцию // Продукты питания и рациональное использование 133 сырьевых ресурсов: сборник научных трудов. – Кемерово, 2001. – Вып. 3. – С. 13. 105. Осинцев, А.М. Развитие фундаментального подхода к технологии молочных продуктов / Кемеровский технологический институт пищевой промышленности. – Кемерово, 2004. – 152 с. 106. Осинцев, А.М. Теоретическое и экспериментальное исследование процессов, лежащих в основе свертывания молока / Кемеровский технологический институт пищевой промышленности. – Кемерово, 2003. – 120 с. 107. Остроумов, Л.А. Анализ научных и практических аспектов использования молока и его производных в технологии функциональных продуктов питания / Л.А. Остроумов, А.Ю. Просеков // Федеральный и региональный аспекты политики здорового питания: материалы международного симпозиума / под ред. акад. В.А. Тутельяна, проф. В.М. Позняковского. – Новосибирск: Сиб. унив. изд-во, 2002. – С. 88–92. 108. Остроумов, Л.А. Новые подходы к проектированию комбинированных молочных продуктов / Л.А. Остроумов, С.Г. Козлов // Продукты питания и рациональное использование сырьевых ресурсов: сб. науч. работ. – Кемерово, 2007. – С. 24–25. 109. Остроумов, Л.А. Исследование и разработка методологии создания многокомпонентных пищевых продуктов на молочной основе с использованием компьютерного моделирования / Л.А. Остроумов, Л.М. Захарова, И.А. Смирнова // Технология и техника пищевых производств. – 2004. – № 3. – С. 115–118. 110. Остроумова, Т.Л. Влияние белковых веществ на пенообразующие свойства молока / Т.Л. Остроумова, А.Ю. Просеков // Известия высших учебных заведений. Пищевая технология. – 2007. - № 2. – С. 43- 46. 111. Остроумова, Т.Л. Роль дисперсионной среды в формировании молочной пены / Т.Л. Остроумова, А.Ю. Просеков // Известия высших учебных заведений. Пищевая технология. – 2007. - № 1. – С. 51–52. 134 112. Пасько, О. В. Эффективные ассоциации пробиотических культур для ферментированных продуктов / О.В. Пасько // Молочная промышленность. 113. – 2010. – № 8. – С.74–75. 114. Пасько, О.В. Биотехнология молокосодержащих продуктов для функционального питания / О.В. Пасько // Переработка молока. – 2008. – № 9. – С. 12–16. 115. Пасько, О.В. Научное и практическое обоснование технологии ферментированных молочных и молокосодержащих продуктов на основе биотехнологических систем: монография / О. В. Пасько, Н. Б. Гаврилова. – Омск: Изд-во ОмЭИ; ОмГАУ, 2009. – 256 с. 116. Пасько, О.В. Научное и экспериментальное обоснование технологии ферментированных молочных и молокосодержащих продуктов: автореф. дис. д-ра техн. наук. – Кемерово, 2011. – 43 с. 117. Пивненко, Т.Н. Ферментативные способы приготовления белковых гидролизатов с использованием препаратов различной специфичности / Т.Н. Пивненко, Л.М. Эпштейн, Ю.М. Позднякова // Вопросы питания. – 1997. – № 5. – С. 34–38. 118. Повышение эффективности производства и использования молочнобелковых концентратов. / О.И. Конева // Труды ВНИИ молочной промышленности, 1985. – 71 с. 119. Покровский, А.А. Атакуемость белков пищевых продуктов протеолитическими ферментами in vitro / А.А. Покровский, И.Д. Ертанов // Вопросы питания. – 1965. – № 3. – С. 38–44. 120. Покровский, А.А. Физиолого-биохимические основы разработки продуктов детского питания / А.А. Покровский. – М.: Медицина, 1991. – 171 с. 121. Попов, A.M. Научное обоснование и реализация технологических процессов производства сухих концентратов напитков с использованием молочной сыворотки: автореф. дис. … д-ра техн. наук: 05.18.04 / Попов Анатолий Михайлович. – Кемерово, 2003. 47 с. 135 122. Попов, A.M. Физико-химические свойства концентрированных структурированных напитков на основе молочной сыворотки с добавлением злаковых культур / A.M. Попов, A.A. Попов, В.В. Гурин // Пиво и напитки. 2007. – № 1. – С. 20–23. 123. Производство продуктов детского питания: учебник / Л.Г. Андреенко, Ц. Блаттни, К. Галачка [и др.] ; под ред. П.Ф. Крашенинина [и др.]. – М.: Агропромиздат, 1989. – 336 с. 124. Принципы диагностики и лечения наследственных нарушений обмена веществ / С. Цедербаум, Д. Доннелл ; под ред. Н. Лавина. – М.: Практика, 1999. 125. Проектирование специальных молочных продуктов для детей / О.И. Башкиров, С.В. Симоненко, Т.А. Антипов [и др.] // Молочная промышленность. – 2007. – № 6. – С. 48–51. 126. Практикум по биохимии: учебное пособие / под ред. С.Е. Северина, Г.А. Соловьевой. – 2-е изд., перераб. и доп. – М.: Изд-во МГУ, 1989. – 509 с. 127. Практическая химия белка / под ред. А. Дарбре ; пер. с англ. – М.: Мир, 1989. – 623 с. 128. Продукты специализированного лечебного питания / И.А. Рогов, Э.С. Токаев, Т.С. Попова [и др.] // Обзорная информация. Серия «Молочная промышленность». – М.: АгроНИИТЭИММП, 1991. – 36 с. 129. Просеков, А.Ю. Современные аспекты производства продуктов питания / А.Ю. Просеков. – Кемерово: Кузбассвузиздат – АСТШ Университеты России, 2005. – 370 с. 130. Просеков, А.Ю. Влияние ферментации заквасочной микрофлорой на некоторые свойства молочного белково-углеводного сырья / А.Ю. Просеков, М.Г. Курбанова, С.Г. Козлов // Хранение и переработка сельхозсырья. – 2004. – № 9. – С. 31–33. 131. Просеков, А.Ю. Молочно - белковые концентраты в продуктах с пенообразной структурой / А.Ю. Просеков, С.А. Иванова, В.С. Сметанин // Молочная промышленность. – 2011. – № 5. – С. 64–65. 136 132. Просеков А.Ю. Научные основы производства продуктов питания: учеб. пособие / А.Ю. Просеков. – Кемерово, 2005. – Ч. 1. – 156 с. 133. Просеков А.Ю. Научные основы производства продуктов питания: учеб. пособие / А.Ю. Просеков. – Кемерово, 2005. – Ч. 2. – 84 с. 134. Просеков, А.Ю. Теория и практика формирования молочных пенообразных систем / А.Ю. Просеков, Т.Л. Остроумова. – М., 2005. – 234 с. 135. Просеков, А.Ю. Пенообразующие свойства обезжиренного молока при роторно – пульсазионной обработке / А.Ю. Просеков, Е.В. Строева, Т.Л. Остроумова // Молочная промышленность. – 2005. – № 6. – С. 67–73. 136. Просеков, А.Ю. Влияние технических характеристик роторно – пульсационного аппарата на структуру взбитого продукта / А.Ю. Просеков, Е.В. Строева, Т.Л. Остроумова // Хранение и переработка сельхозсырья. – 2005. – № 5. – С. 46–53. 137. Просеков, А.Ю. Гелеобразные напитки на основе гидролизной сыворотки / А.Ю. Просеков, С.Г. Козлова, И.И. Муругова // Пиво и напитки. – 2004. – № 4. – С. 76–82. 138. Просеков А.Ю. Применение белков молока в качестве сырья для производства пищевых капсул / А.Ю. Просеков, М.Г. Курбанова, С.А. Равнюшкин // Вестник Российской академии сельскохозяйственных наук.– 2009. – Вып. 5. – С. 79–81. 139. Просеков А.Ю. Теоретическое обоснование и технологические принципы формирования молочных пенообразных дисперсных систем: автореф. дис. … д-ра техн. наук: 05.18.04 / А.Ю. Просеков. – Кемерово, 2004. – 42 с. 140. Равнюшкин, С.Ю. Основные направления создания белковых молочных продуктов / С.Ю. Равнюшкин, И.Ю. Трифонов, Т.Л. Остроумова // Достижения науки и техники – развитию Кузбасса: материалы V межрегиональной научно-практической конференции (28 февраля). – Кемерово. – Часть 1. – С. 47–48. 137 141. Сажинов, Г.Ю. Разработка технологии гидролизатов молочных белков для продуктов лечебного питания: автореф. дис. … канд. техн. наук: 05.18.04 / Сажинов Георгий Юрьевич. – Вологда-Молочное, 1991. – 20 с. 142. Северин, С.Е. Практикум по биохимии / С.Е. Северин, Г.А. Соловьева. – М.: Изд-во МГУ, 1989. – 509 с. 143. Скурихин, И.М. Руководство по методам анализа качества и безопасности пищевых продуктов / И.М. Скурихин, В.А. Тутельян. – М.: Медицина, 1998. – 342 с. 144. Современные методы в биохимии / под ред. В. Н. Ореховича. – М.: Медицина, 1977. – 392 с. 145. Состав и свойства молока как сырья для молочной промышленности: справочник / Н.Ю. Алексеева, В.П. Аристова, А.П. Патратий [и др.] ; под ред. Я.И. Костина. – М.: Агропромиздат, 1986. – 239 с. 146. Специализированные продукты питания для детей с различной патологией: каталог / под ред. К.С. Ладодо, Г.Ю. Сажинова. – М.: Минсельхозпрод РФ, 2000. – 200 с. 147. Стан, Е.Я. Казеины коровьего молока как источник «пищевых гормонов» // Сборник научных трудов Института питания АМН СССР. – 1986. – Т. 7. – С. 81–86. 148. Степанов, В.М. Молекулярная биология. Структура и функции белков: учебник для студентов вузов / под ред. А.С. Спирина. – М.: Высшая школа, 1996. – 335 с. 149. Степанова, Л.И. Справочник технолога молочного производства. Технология и рецептуры / А.И. Степанова. – СПб.: ГИОРД, 1999. – Т. 1: Цельномолочные продукты. – 384 с. 150. Технология молока и молочных продуктов / Г.В. Твердохлеб, З.Х. Диланян [и др.]. – М.: Агропромиздат, 1991. – 463 с. 151. Телишевская, Л.Я. Белковые гидролизаты. Получение, состав, применение / под ред. А.Н. Панина. – М.: Аграрная наука, 2000. – 295 с. 138 152. Тепел, А. Химия и физика молока / А. Тепел. – М.: Пищевая промышленность, 1979. – 323 с. 153. Терещук, Л.В. Твердые растительные масла в производстве молочно- жировых эмульсий / Л.В. Терещук, Н.В. Печеник, А.В. Каменских // Продукты питания и рациональное использование сырьевых ресурсов: Сборник научных работ. – Кемерово: Изд -во КемТИПП, 2004. – Выпуск 7. – С. 61–63. 154. Тиняков, Г.Г. Микроструктура молока и молочных продуктов / Г.Г. Тиняков, В.Г. Тиняков. – М.: Пищевая промышленность, 1972. – 264 с. 155. Травина, О.В. Руководство по биохимическим исследованиям / О.В. Травина. – М.: Медгиз, 1955. – С. 250–255. 156. Толстогузов, В.Б. Новые формы белковой пищи (технологические проблемы и перспективы производства) / В.Б. Толстозубов. – М.: Агропромиздат, 1987. – 303 с. 157. Толстогузов, В.Б. Физико-химические аспекты переработки белков в пищевые продукты / В.Б. Толстогузов, Е.Е. Браудо, В.Я. Гринберг // Успехи химии. – 1985. – Т. 44. – С. 250–300. 158. Тур, А.Ф. Справочник по диетике детей раннего возраста / А.Ф. Тур. – Л.: Медицина, 1971. – 288 с. 159. Фершт, Э. Структура и механизм действия ферментов / Э. Фершт. – М.: Мир, 1980. – 256 с. 160. Филиппович, Ю.Б. Биохимия белка и нуклеиновых кислот: учеб. пособие для студентов и педагогов институтов по химии и биол. спец. / Ю.Б. Филиппович. – М.: Просвещение, 1978. – 192 с. 161. Фрицше, Р. Профилактика аллергии к белкам коровьего молока путем индукции пищевой толерантности гипоаллергенными детскими смесями / Р. Фрицше // Вопросы современной педиатрии. – 2003. – № 3. – С. 21–24. 162. Функциональные продукты на основе молока и его производных / Л.А. Остроумов, А.М. Попов, М.А. Постолова [и др.] // Пищевая промышленность. – 2003. – № 9. – С. 18–23. 139 163. Харитонов, В.Д. Получение, свойства и применение молочно- белковых и растительных концентратов / В.Д. Харитонов, Е.Н. Соколова. – М.: Агропромиздат, 1991. – 187 с. 164. Химический состав пищевых продуктов / под ред. И.М. Скурихина, М.Н. Волгарева. – 2-е изд., перераб. – М.: Агропромиздат, 1987. – Кн. 2. Справочные таблицы содержания жирных кислот, витаминов, макро- и микроэлементов, органических кислот и углеводов. – 360 с. 165. Химия пищи: в 2 кн. / И.А. Рогов, Л.В. Антипова, Н.И. Дунченко [и др]. – М.: Колос, 2000. – Кн 1: Белки: структура, функции, роль в питании. – 384 с. 166. Храмцов, А.Г. Научно-технические основы биотехнологии молочных продуктов нового поколения / А.Г. Храмцов, Б.М. Синельников, И.А. Евдокимов. – Ставрополь: СКГТУ, 2002. – 118 с. 167. Чернавский, Д.С. Белок - машина. Биологические макромолекулярные конструкции / Д.С. Чернавский, Н.М. Чернавская. – М.: Изд-во МГУ, 1999. – 256 с. 168. Черников, М.П. Протеолиз и биологическая ценность белков. Казеины как собственно пищевые белки. – М.: Медицина, 1975. – 231 с. 169. Шабалов, Н.П. Детские болезни: учебник: в 2 т. – 5-е изд. – СПб.: Питер, 2002. – Т. 2. – 736 с. 170. Шаззо, Р.И. Функциональные продукты питания / Р.И. Шаззо, Г.И. Касьянов. – М.: Колосс, 2000. – 248 с. 171. Шаманова, Г.П. Производство продуктов детского питания на молочной основе / Г.П. Шаманова. – М.: Агропромиздат, 1987. – 272 с. 172. Шацкая, Н.Г. Технология гидролизатов молочных белков и их использование в производстве продуктов диетического питания детей и взрослых / Н.Г. Шацкая, П.Ф. Крашенинин, В.Н. Сергеев // Обзорная информация. Серия «Молочная промышленность». – М.: АгроНИИТЭИММП, 1988. – С. 52. 173. Щетинин, М.П. Кисломолочные напитки смешанного брожения / М.П. 140 Щетинин, З.Р. Ходырева, А.В. Томас // Кисломолочные напитки смешанного Брожения. – 2013. – № 2. – С. 70–72. 174. Шуваев, В.А. Опыт применения нетрадиционных подходов / В.А. Шуваев, С.М. Кунижев // Биотехнология: учеб. пособие. – Ставрополь, 2002. – 242 с. 175. Шульц, Г.Е. Принципы структурной организации белков / Г.Е. Шульц, Р.Х. Ширмер. – М.: Мир, 1982. – 354 с. 176. Якубке, Х.-Д. Аминокислоты, пептиды, белки / Х.-Д. Якубке, Х. Ешкайт ; пер. с нем. – М.: Мир, 1985. – 456 с. 177. Gibney, M.J. Nutrition, diet and health. – London, 1986. – P. 105-108. 178. Gibson G.R. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics / G.R. Gibson, M.B. Roberfroid // J. Nutritional. – 1995. – № 1401. – P. 12. 179. Gibson, G.R., Fuller R. Aspects of in vitro and in vivo research approaches directed toward identifying probiotics and prebiotics for human use // J. Nutrition, 2000. – Vol. 130. – P. 391–395. 180. Kebary, K.M.K. Production partial purification and stability of antimicrobial substances produced by bifidobacterium bifidum // Egypt J. of Dairy Sci. –1995. – V. 23. – № 2. – P. 151–166. 181. Marshall ,V.M. Starter cultures employed in the manufacture of biofermented milk / V.M. Marshall, A.Y. Tamime // Int. J. Dairy Technol. –1997. – № 1. – P. 35–41. 182. Mizota, T. Functional and nutritional foods containing bifidogenic factors / Bulletin of IDF No 313, 1996. – P. 10–22. 183. Playne, M.J., Crittenden R. Commercially available oligosaccharides / Bulletin of IDF No 313, 1996. – P. 10–22. 184. Potter, D. Positive nutrition –making it happen. Food ingredients Europe. Conference Processing, 1995. – 80 p. 141 185. Rasic,T.L. and Kurmann J.A. Bifidobacteria and their role // Microbiological Nutritional –physiological, medical and technological aspects and bibliography basel, Boston, Stytgart, 1983. – p. 295. 186. Renner,E. Nutritional aspects of fermented milk products // Cultured Dairy Products Journal. –1986. – V. 21. – № 6. – P. 6–14. 187. Roberfroid , M.B. Prebiotics and probiotics: are they functional foods? // Clin. Nutr. – 2000. – P. 82–87. 188. Rowe, M.T. Bacteriological quality of raw milk effect on the quality of dairy products // Agr. North. Iren. – 1985. – V. 60 – P. 178–210. 189. Sandine, W. E., Muralidhara K.S., Elliker P.R. and Endland D.S. Lactis acid bacteria in food and health. // J. Milk food technol. – 1972. – Vol. 35, № 12.– P. 670–691. 190. Souihgate, D. A. T. Dietary fiber: analysis and food sources // The American Journal of Clinical Nutrition. – 1978. – Vol. 31, № 10. – P. 107–110. 191. Tamime, A.Y. Microbiological and technological aspects of milks fermented by bifidobacteria / A.Y Tamime, V.M. Marshall, R.K. Robinson // Journal of Dairy Research. – 1995. – V. 62. – P. 151–187. 192. Holm F. Health and diet // World Food Ingredient, 2003. – № 2. – P. 52–55. 193. Lenoir-Wiujnkoop, Hopkins M. The Intestinal Microflora. Understanding the symbiosis. Danone Vitapole. John Libbey Eurotext, 2003, 48 p.110. Wyers,R. Prebiotics research // World Food Ingredient, 2003. – № 12. – P. 58–59. 194. Wyers , R. Spreading probiotics // World Food Ingredient, 2004. – № 3. – P. 26–27. 195. Wyers, R. Prebiotics in action // World Food Ingredient, 2004. № 10. – P. 74-77. 196. Van Loo. Functional food properties of non-digestible oligosaccharides: a consensus report from the HVDO project // Br. J. Nutr. –1999. – P. 121–132.