И К А Р
реклама

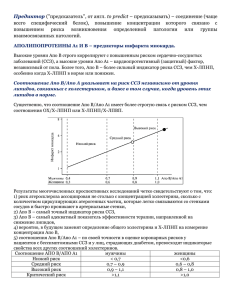
К А РД И О Л О Г И Я Триметазидин в метаболической терапии сердечно–сосудистых заболеваний Профессор 1 МГМУ имени И.М. Сеченова стория применения миокардиальных цитопротекторов насчитывает не один десяток лет. Однако интерес к концепции метаболической защиты миокарда (так называемой «кардиоцитопротекции») не ослабевает и по сей день. В настоящее время внимание к этому виду терапии обусловлено получением на протяжении последних нескольких лет новых данных о влиянии миокардиальных цитопротекторов на течение стабильной стенокардии и качество жизни пациентов с этой сердечно–сосудистой патологией. Традиционная медикаментозная терапия ишемической болезни сердца (ИБС) направлена на уменьшение потребности миокарда в кислороде или на увеличение его доставки посредством вазодилатации. Метаболическая терапия нацелена на увеличение эффективности утилизации кислорода миокардом в условиях ишемии. По определению, метаболические препараты (в чистом виде) не влияют на показатели гемодинамики, основной мишенью является кардиомиоцит (КМЦ) [1,2]. Установлено, что ишемия миокарда на клеточном уровне характеризуется снижением окисления глюкозы и повышением использования свободных жирных кислот (СЖК). Этот процесс приводит к дальнейшему ухудшению энергетического метаболизма сердца и повышению чувствительности миокарда к ишемическому воздействию. Ишемия миокарда (ИМ) представляет собой метаболическое повреждение, характеризующееся нарушением ионного гомеостаза, прогрессирующим снижением содержания высокоэнергетических фосфатов, накоплением потенциально токсических продуктов метаболизма, таких как лактат, ионы Н+, свободные кислородные радикалы, а также ионов натрия и кальция, что приводит к морфологическому повреждению и в конечном итоге – к гибели клетки. Для адекватного поддержания сократительной функции миокард нуждается в постоянном надежном и достаточном снабжении энергией. В основе энергообеспечения миокарда лежит окислительное фосфорилирование двух основных субстратов: СЖК и глюкозы. Кроме того, в качестве источников образования энергии в КМЦ могут быть использованы лактат, кетоновые тела, аминокислоты [3,4]. СЖК проникают через клеточную мембрану, причем скорость их захвата КМЦ определяется прежде всего концентрацией в крови, которая может значительно варьировать в пределах от 0,1 до 1,5 ммоль/л. При попадании в цитозоль СЖК частично эстерифицируются с формированием триглицеридов, которые депонируются внутри клетки или ацилируются и превращаются в активную форму – ацилкоэнзим А (ацил–КоА). При взаимодействии его с белком–пере- И 718 Л.М. Житникова носчиком карнитином образуется ацилкарнитин, который транспортируется в митохондрии. Там ацилкарнитин расщепляется, карнитин возвращается в цитозоль, а ацил–КоА подвергается β–окислению, в результате которого образуется ацетил–коэнзим А (ацетил–КоА). Глюкоза проникает через клеточную мембрану КМЦ с помощью специального белка–переносчика – GLUT4. В цитозоле КМЦ глюкоза и лактат в процессе анаэробного гликолиза превращаются в пируват. При этом из одной молекулы глюкозы образуются 4 молекулы аденозинтрифосфата (АТФ), однако 2 из них расходуются в процессе реакции. Поэтому анаэробный гликолиз может обеспечить не более 2% общего количества АТФ, в норме потребляемого миокардом. Пируват, синтезирующийся из глюкозы и лактата в цитозоле, поступает в митохондрии, где при участии фермента пируватдегидрогеназы превращается в ацетил–КоА, который составляет общий пул с ацетил–КоА, образующимся из СЖК. Далее ацетил–КоА поступает в цикл Кребса, где окисляется с участием кислорода до CO2 с образованием АТФ. АТФ с помощью фермента–переносчика адениннуклеотидтранслоказы перемещается из митохондрий в цитозоль, где используется в различных метаболических реакциях [5]. Продукты β–окисления СЖК – восстановленный никотинамидадениндинуклеотид (НАД•Н) и ацетил–КоА являются естественными ингибиторами пируватдегидрогеназы и, соответственно, препятствуют окислению глюкозы. Поэтому при возрастании содержания СЖК в плазме и их усиленном поступлении в КМЦ параллельно со снижением активности упомянутого фермента уменьшается утилизация глюкозы миокардом. В условиях нормального кровоснабжения миокарда основным источником его энергообеспечения является утилизация СЖК. При этом образуется 80–90% всего АТФ, потребляемого сердечной мышцей. Данный факт обусловлен тем, что утилизация СЖК дает максимальный выход энергии на единицу субстрата. Так, при полном окислении одной молекулы пальмитиновой кислоты образуется 134, а стеариновой – 147 молекул АТФ, в то время как при аэробном окислении одной молекулы глюкозы – 32 молекулы АТФ, а при анаэробном гликолизе – только 2 [6]. Хотя при использовании СЖК как субстрата эффективность энергообеспечения миокарда на 30% больше, чем при использовании глюкозы, утилизация СЖК сопряжена с более высоким потреблением кислорода, в связи с чем при ишемии предпочтительным субстратом окисления становится глюкоза. В результате дефицита кислорода в КМЦ происходит накопление промежуточных продуктов обмена СЖК – ацилкарнитина, ацил–КоА, НАД•Н, угнетается пиру- РМЖ № 14, 2012 К А РД И О Л О Г И Я ватдегидрогеназа, соответственно, устраняется возможность утилизации пирувата, в результате чего он практически полностью превращается в лактат. Лактат накапливается в цитозоле вместе с Н+, что приводит к снижению внутриклеточного рН и нарушению функции КМЦ. Помимо этого, промежуточные продукты обмена СЖК угнетают адениннуклеотидтранслоказу митохондрий и затрудняют перенос макроэргических фосфатов через их мембрану, содействуя снижению энергодефицита КМЦ и дальнейшей активации гликолиза. Выраженность этих процессов увеличивается по мере возрастания тяжести ишемии, что способствует возникновению тяжелого ацидоза, который сочетается с развитием вначале функциональных нарушений, а затем и с гибелью клеток миокарда вследствие повреждения клеточных мембран. К основным механизмам повреждающего действия СЖК относятся [5]: 1) ингибирование утилизации глюкозы; 2) разобщение окисления и фосфорилирования в электронно–транспортной цепочке митохондрий; 3) изменение свойств мембранных ферментов с уменьшением проницаемости мембран и контактов между отдельными КМЦ; 4) угнетение функций митохондрий и скорости синтеза АТФ; 5) повышение проницаемости мембран для ионов кальция и ассоциированного с ним усиления β–адренергического ответа миокарда. Кроме того, СЖК обладают аритмогенным действием и способствуют возникновению фибрилляции желудочков. Таким образом, вследствие снижения коронарного кровотока нарушается процесс образования энергии в миокарде и ее запасы уменьшаются. Аэробный метаболизм прекращается при падении коронарного кровотока ниже 0,56 мл/мин/кг. При усугублении ишемии миокарда основным механизмом синтеза АТФ становится анаэробный гликолиз с образованием АТФ и лактата. Формирующийся тканевый лактатацидоз вызывает разобщение окислительного фосфорилирования и перегрузку КМЦ ионами кальция, активирует фосфолипазу А2 с последующим инициированием процессов перекисного окисления липидов и повреждением мембранных структур. При отсутствии ранней реперфузии вначале обратимые нарушения метаболизма неизбежно приобретают необратимый характер и приводят к гибели клеток [7]. Изменения метаболизма миокарда во время ишемии и реперфузии открывают широкую возможность для медикаментозного воздействия. Современные подходы включают стимуляцию внутриклеточного обмена глюкозы, а также подавление метаболизма СЖК (табл. 1). Современный терапевтический подход, направленный на оптимизацию энергетического метаболизма миокарда, основан на увеличении окисления глюкозы в КМЦ путем ингибирования окисления СЖК. Таким действием обладают миокардиальные цитопротекторы, антиангинальный эффект которых связан не с гемодинамическим действием, а с непосредственным влиянием на КМЦ, что способствует их выживаемости в условиях ишемии. Уже в 90–х годах XX века возник интерес к препаратам, которые относят к корректорам метаболизма, или цитопротекторам, в частности к лекарственному средству триметазидин (производное пиперазина – 1–(2,3,4–триметоксибензил) пиперазина дигидрохлорида) с антигипоксантной и антиоксидантной фармакологической эффективностью. Он легко проникает через клеточные мембраны, так как находится в неионизированном состоянии при физиологических значениях рН. Биодоступность триметазидина – 90%, так как после приема внутрь он практически полностью абсорбируется из желудочно–кишечного тракта, легко проникает через гистогематические барьеры, связь с белками плазмы крови – 16%, выводится почками (около 60% – в неизмененном виде). Триметазидин блокирует окисление СЖК, подавляя активность 3–кетоацил–КоА–тиолазы (3–КАТ), тем самым уменьшает образование ацетил–КоА и НАД•Н, способствует разблокированию пируватдегидрогеназы и переключению энергетического метаболизма миокарда на утилизацию глюкозы путем более «рентабельного» получения энергии – гликолиза (анаэробное расщепление глюкозы до лактата) и окислительного декарбоксилирования (аэробное окисление Таблица 1. Подходы к оптимизации энергетического метаболизма миокарда в условиях ишемии Фармакологический подход Увеличение снабжения сердца глюкозой глюкозоинсулинокалиевая смесь Уменьшение потребления сердцем СЖК глюкозоинсулинокалиевая смесь никотиновая кислота β–блокаторы Стимуляция окисления глюкозы дихлорацетат L–карнитин Уменьшение окисления СЖК триметазидин ранолазин этомоксир оксфенисин Механизм действия Увеличение потребления глюкозы и синтеза гликогена Подавление высвобождения СЖК адипозоцитами Подавление высвобождения СЖК адипозоцитами и уменьшение образования в печени липопротеидов очень низкой плотности Подавление высвобождения СЖК адипозоцитами Увеличение активности ПДК Снижение уровня ацетил–коэнзима А Подавление β–окисления СЖК Подавление β–окисления СЖК Подавление КПК Подавление КПК Цит. по: Р.М. Шахнович, 2001. № 14, 2012 [Eur. Heart J. Supplements. Vol. 1. August -1999] РМЖ 719 К А РД И О Л О Г И Я в цикле Кребса) [8]. Избыток СЖК, поступающих в КМЦ, в этих условиях направляется на синтез фосфолипидов, что обусловливает мембранопротекторные свойства триметазидина. Основные метаболические эффекты триметазидина включают: 1) угнетение окисления СЖК; 2) усиление окисления глюкозы и повышение синтеза АТФ; 3) нормализацию трансмембранных ионных потоков; 4) уменьшение образования свободных радикалов, недоокисленных продуктов обмена; 5) уменьшение внутриклеточного ацидоза. Эти эффекты обеспечивают способность триметазидина улучшать обмен мембранных фосфолипидов, снижать пассивную проницаемость мембран, а также повышать их устойчивость к гипоксическому повреждению в условиях гибернации миокарда. По сравнению с классическими гемодинамическими агентами метаболические препараты не имеют прямого гемодинамического, инотропного или хронотропного эффектов, а защищают от ишемии миокарда и оказывают антиангинальный эффект путем увеличения метаболизма глюкозы за счет ингибирования β–окисления СЖК [9]. Назначение больным триметазидина имеет ряд преимуществ. Путем снижения окисления СЖК триметазидин стимулирует использование глюкозы, восстанавливая связь между гликолизом и окислением углеводов, что приводит к образованию АТФ с меньшим потреблением кислорода. Более того, путем стимуляции обмена фосфолипидной мембраны во время ишемии и реперфузии триметазидин переориентирует СЖК в сторону фосфолипидов, увеличивая толерантность клеток к ишемическому и реперфузионному повреждению. Антиишемические свойства триметазидина не зависят от изменений гемодинамики и ассоциированы с большим восстановлением механической функции после ишемии [10,11]. Триметазидин непосредственно влияет не только на КМЦ, но и на нейроны головного мозга, оптимизирует их метаболизм и функцию. Триметазидин рекомендован Европейским обществом кардиологов (ЕОК) в 1997 г. в качестве препарата для метаболической терапии при стабильной стенокардии напряжения, эти рекомендации ЕОК подтверждены в 2006 г. [12]. В Национальных рекомендациях по кардиопрофилактике 2011 г. в разделе «21.6. Препараты метаболического действия» отмечено, что особенностью ведения больных с сердечно–сосудистыми заболеваниями (ССЗ) в РФ является широкое назначение препаратов метаболического действия. В настоящее время используются этилметилгидроксипиридина сукцинат, имеющий мембранопротекторный и антигипоксический эффекты; триметазидин, обладающий антиангинальным эффектом [13,14]; мельдоний, обладающий антиангинальным и вазопротекторным эффектами [15,16], а также способностью улучшать когнитивные функции. Антиоксидантные препараты регулируют метаболические процессы в миокарде и сосудистой стенке. Могут применяться в составе комплексной терапии ИБС и других 720 ССЗ. Способность перечисленных препаратов метаболического действия улучшать отдаленный прогноз у пациентов с ИБС и ССЗ не доказана [17]. Однако рядом клинических исследований было подтверждено антиишемическое действие триметазидина как при монотерапии, так и в комбинации с другими антиангинальными средствами у пациентов с ИБС за счет увеличения коронарного резерва, уменьшения последствий ишемии, вызванной физической или эмоциональной нагрузкой, в том числе «спящего» миокарда, снижения частоты приступов стенокардии, значимого улучшения сократительной функции миокарда, повышения толерантности к физической нагрузке [9,18,19]. По результатам изучения антиангинальной эффективности триметазидина при неэффективности терапии нитратами, антагонистами кальция или β–блокаторами выявлены уменьшение количества и общей продолжительности болевых и безболевых эпизодов ишемии миокарда, улучшение перфузии миокарда, увеличение продолжительности пробы с физической нагрузкой до достижения депрессии сегмента ST на 1 мм, снижение потребности в нитроглицерине для сублингвального приема, улучшение качества жизни пациентов [20–24]. Триметазидин проявляет свойства антиоксиданта в профилактике «синдрома реперфузии» в ранние сроки ОИМ (уменьшает распространение зоны инфаркта, снижает частоту фатальных аритмий, купирует сердечную недостаточность [25]; увеличивает пиковое потребление VO2, что сопровождается более низкой частотой повторных госпитализаций и кардиогенной смертности [26,27]; снижает механическую и эндотелиальную дисфункцию путем устранения ацидоза и высокой концентрации внутриклеточного кальция, характерных для ишемии, гипоксии и перерастяжения КМЦ, наблюдающихся при стенокардии и сердечной недостаточности (СН), что обеспечивает защиту миокарда от некроза и апоптоза ) [18,19,28]. При сочетании ИБС с сахарным диабетом действие триметазидина было более выраженным, чем у больных со стенокардией и нормальным углеводным обменом, что проявлялось значительным улучшением переносимости физической нагрузки и снижением частоты приступов стенокардии [29]. В исследовании ПАРАЛЛЕЛЬ [30] у пациентов старше 60 лет, страдающих сахарным диабетом или перенесших инсульт, добавление триметазидина МВ к β–адреноблокатору обеспечило более выраженный антиангинальный эффект, чем добавление изосорбида динитрата. Многочисленные исследования эффективности медицинской реабилитации пациентов с ИБС и хронической сердечной недостаточностью (ХСН) указывают, что комбинация триметазидина с дозированными физическими нагрузками способствует более эффективному восстановлению насосной деятельности сердца, улучшению качества и прогноза жизни [1,2,18,19,31]. В настоящее время доказана антиишемическая и антиангинальная эффективность триметазидина МВ [2,13,32,33]. Кокрановский метаанализ, включающий 23 клинических исследования и 1378 пациентов с ИБС, принимавших триметазидин МВ, показал значительное сни- РМЖ № 14, 2012 К А РД И О Л О Г И Я жение еженедельных эпизодов стенокардии, улучшение времени физической нагрузки до появления на ЭКГ депрессии сегмента ST на 1 мм и более по сравнению с плацебо [13,32,33]. Определенные надежды в лечении больных с ишемическими расстройствами, особенно если они затрагивают несколько сосудистых бассейнов, связаны с применением собственно антиишемических средств, действующих на уровне тканей, хотя и не влияющих непосредственно на их кровоснабжение, в частности триметазидина (Тримектал). На сегодняшний день Тримектал уже зарекомендовал себя в отечественных клиниках как эффективное лекарственное средство для лечения пациентов с ССЗ, одним из звеньев патогенеза которых является ишемия миокарда. Пилотное многоцентровое открытое исследование ТРИМИ (ТРИмектал в лечении больных Множественной Ишемической патологией) выполнено с целью выяснения роли препарата Тримектал (триметазидин) в терапии больных с множественной ишемией (в сердце, мозге, нижних конечностях) в отношении быстрого уменьшения ишемических симптомов и улучшения качества жизни [34]. В исследование включались мужчины и женщины в возрасте 40–75 лет, страдавшие как минимум тремя из четырех проявлений ишемии, связанной с атеросклерозом магистральных артерий, снабжающих сердце, нижние конечности, мозг. Такими проявлениями считали стабильную стенокардию напряжения (СТ) 2–3 функционального класса (ФК) согласно классификации Канадской ассоциации кардиологов, сердечную недостаточность (СН) 2–3 ФК согласно классификации Нью–Йоркской кардиологической ассоциации, перемежающуюся хромоту (ПХ) в форме 2А или 2Б стадий (ст.) артериальной недостаточности нижних конечностей по Фонтену, дисциркуляторную энцефалопатию (ДЭ) 1–3 ст. по классификации Г.А. Максудова. При этом обязательным условием включения больного в исследование было наличие у него стенокардии (не ниже 2 ФК) и сердечной недостаточности (не ниже 2 ФК), несмотря на адекватное лечение. К стандартной антиангинальной терапии открыто добавлялся Тримектал (триметазидин – по 20 мг трижды в сутки). После этого больной на протяжении 6 нед. наблюдался не менее двух раз (через 2 нед. от начала лечения препаратом и спустя еще 4 нед.). Стенокардия напряжения исходно отмечена у всех 46 завершивших обследование больных, причем ее тяжесть соответствовала 2–3 ФК, а в среднем по группе составляла 2,5±0,5 ФК. К концу 6–й нед. лечения препаратом Тримектал тяжесть СТ уменьшилась умеренно – до 2,3±0,6 (1–3 ФК), тем не менее дисперcионный анализ (F=0,02) свидетельствовал о положительном эффекте лечения в целом по группе по сравнению с исходным состоянием. Индексы динамики стенокардии составили, по мнению врачей, в среднем соответственно: 2,8±0,5 (в отдельных случаях от 1 до 3), а по оценке пациента – 2,8±0,4 (от 2 до 3). К А РД И О Л О Г И Я Кроме того, к концу 6–й нед. терапии триметазидином уменьшился функциональный класс СН – в среднем до 2,0±0,5 (0–3) (pu – 0,0002), увеличилась дистанция ходьбы за 6 минут – 286±86 м (pu – 0,00001), благоприятным стал индекс динамики СН – как по мнению врача (он был от 2 до 3, в среднем 2,9±0,3), так и по мнению самого больного (от 2 до 3, в среднем 2,8±0,4). Дисциркуляторной энцефалопатией, выраженной в той или иной мере, страдало абсолютное большинство 39 (85%) пациентов, вошедших в исследование. К концу приема препарата головные боли уменьшились у 12 из 39 больных (31%), причем в 5 случаях (13%) головная боль, исходно частая и интенсивная, на фоне лечения стала редкой и умеренной. Головокружения уменьшились у 8 из 30 (27%) страдавших ими пациентов; причем в 5 случаях (17%) они стали возникать лишь изредка. Из 39 больных у троих (все – с умеренной симптоматикой ДЭ) отмечено полное исчезновение симптомов энцефалопатии. Индексы динамики ДЭ составили, по мнению врачей, соответственно: 2,7±0,5 (2–3), а по оценке пациента – 2,8±0,5 (2–4). Перемежающейся хромотой страдали 23, то есть половина всех вошедших в настоящее исследование больных. Дистанция ходьбы до появления болей в ногах в начале исследования в среднем составляла 220±81 м. На фоне лечения – к 6–й нед., существенно не изменились ни класс перемежающейся хромоты, ни дистанция ходьбы до появления болей в ногах – в среднем 223,6±91 м. В результате лечения препаратом Тримектал доля больных с уменьшением выраженности совокупности ишемических расстройств, судя по снижению класса ишемического расстройства и/или по мнению врача или больного, составила 89%. По мнению врачей, улучшение наступило в 85%, а по мнению больных – в 87% случаев. ФК ишемического расстройства уменьшился у 22 (48%) пациентов, причем у 15 человек это касалось лишь одного, а у 7 человек – двух ишемических синдромов. Следует отметить, что у 5 больных (11% от общего их числа) отмечено увеличение выраженности совокупности ишемических расстройств в результате лечения на протяжении 6 нед. (то есть ухудшение, судя по нарастанию класса ишемического расстройства и/или ухудшение по мнению врача или больного). Исследование ТРИМИ показало, что лечение препаратом Тримектал приводит к значительному улучшению качества жизни больных, об этом свидетельствовало уменьшение выраженности совокупности ишемических расстройств (кардиальных и экстракардиальных) у больных с распространенными и клинически выраженными проявлениями атеросклероза и их суммарного балла (исходно – 50–35, после лечения 38–29, p<0,001). Следует подчеркнуть дополнительные преимущества изучавшегося препарата – он хорошо переносится, в том числе в составе разнообразных лекарственных комбинаций. В исследовании, проведенном Е.Г Клочевой и соавт., изучалась клиническая эффективность Тримектала у больных смешанной хронической недостаточностью мозгового кровообращения (ХНМК). Обследовано 30 больных с ХНМК: ДЭ I стадии – 12 человек и II стадии 722 – 18 человек, в возрасте от 46 до 69 лет (средний возраст 57,3±0,8), из них 21 женщина, 9 мужчин [35]. К стандартной терапии основного заболевания был добавлен Тримектал (триметазидин) – 1 капсула (20 мг) три раза в сутки в течение 60 дней. В начале лечения большинство пациентов предъявляли жалобы на головную боль (93,3%), головокружение (92,8%), неустойчивость при ходьбе (66,6%), общую слабость (70%), нарушение сна (60%), снижение памяти (53,3%), эмоционально–волевые расстройства (73,3%): снижение работоспособности, повышенная раздражительность, утомляемость, слезливость. Субъективная оценка 10 клинических симптомов (головная боль, головокружение, неустойчивость при ходьбе, нарушение сна, общая слабость, снижение памяти, снижение работоспособности, повышенная раздражительность, утомляемость, слезливость) производилась по 6–балльной рейтинговой шкале со стандартизированными критериями оценки выраженности каждого симптома: симптом отсутствует – 0; незначительные проявления – 1; легкие проявления – 2; умеренно выраженные проявления – 3; выраженные проявления – 4; грубые проявления – 5. Оценка каждого показателя не превышала умеренной выраженности симптома. Сравнительный показатель Δ (дельта) отражал уменьшение или увеличение выраженности того или иного симптома до и после лечения. В конце лечения достоверно уменьшились такие проявления, как головная боль, общая слабость, нарушение сна, снижение работоспособности, утомляемость (p<0,01). При анализе динамики неврологических симптомов к концу лечения отмечались исчезновение нистагма (40%), регресс оральных симптомов (33,3%), уменьшение выраженности мозжечковой и пирамидной симптоматики (36,6%). Оценка когнитивных функций по шкале MMSE при первичном осмотре составила в среднем 24,8±1,8 балла, что соответствовало легким когнитивным нарушениям. Достоверных изменений этого показателя у обследуемых пациентов на фоне лечения Тримекталом не отмечено. В оценочных показателях допплерографии отмечалась тенденция к их нормализации. Контрольное дуплексное исследование состояния брахиоцефальных артерий через 60 дней приема Тримектала подтвердило позитивную динамику (80%) и свидетельствовало об уменьшении признаков дисциркуляции. Нормализация периферического сопротивления отмечена у 14 (53,8%) из 28, скоростных показателей – у 17 (60,7%), улучшение венозного оттока – у 12 (42,8%) больных. Содержание окисленной формы аскорбиновой кислоты на фоне приема Тримектала нарастало к 60–му дню (0,66±0,01 мг%), оставаясь все же ниже нормы. Исследование концентрации глутатиона в крови выявило интересную зависимость: на протяжении периода приема препарата (исходно – 36,50±0,98 мг% при норме 27,50±0,68 мг%) снижалась концентрация восстановленной формы – 35,7±0,53 мг% – к 30 дню, к 60 дню, приближаясь к норме 35,0±0,47 мг%. Динамика концентрации окисленной форм глутатиона (исходно – 4,20±0,27 мг% при норме 6,60±0,28 мг%) РМЖ № 14, 2012 К А РД И О Л О Г И Я показала достоверное (p<0,01) снижение концентрации ниже нормы через 30 дней – 3,94±0,11 мг% и через 60 дней – 3,63±0,17 мг%. Оценка эффективности лечения больных с ДЭ Тримекталом исследователем и пациентом через 60 дней по 5–балльной шкале позволила охарактеризовать полученный эффект как: небольшое улучшение – в 10%; заметное улучшение – в 80%; исчезновение симптомов (регресс большинства симптомов) – в 10%; ухудшения, как и «без эффекта» не отмечено ни в одном случае. Таким образом, лечение больных ДЭ I, II стадий Тримекталом в течение 8 нед. хорошо переносилось пациентами. Клинический эффект сопровождался положительной динамикой субъективных и неврологических симптомов, у 57% больных отмечалась стабильная нормализация цифр АД на фоне сочетанной с Тримекталом гипотензивной терапии. Препарат способствовал восстановлению гемодинамики с регрессом артериальной и венозной дисциркуляции. Полученные данные позволяют рекомендовать Тримектал с целью лечения и профилактики развития ХНМК. Опыт применения Тримектала у больных с кохлеовестибулярными синдромами продемонстрировал отчетливый положительный клинический эффект: уменьшилась выраженность головокружения, обусловленного ишемическими кохлеовестибулярными синдромами центрального и периферического характера. При этом субъективные ощущения больных подкреплялись положительной динамикой состояния вестибулярной функции, выявляемой при повторном отоневрологическом обследовании. Благоприятное терапевтическое действие препарата, наиболее вероятно, обусловлено улучшением микроциркуляции внутреннего уха на фоне стабилизации параметров центральной гемодинамики. Полученный исследователями опыт позволяет рекомендовать Тримектал для широкого применения у больных с головокружениями сосудистого генеза в госпитальной и амбулаторной практике [36]. В настоящее время препарат Тримектал выпускается в МВ–форме: таблетки с модифицированным высвобождением, покрытые пленочной оболочкой. Одна таблетка Тримектал МВ содержит 35 мг триметазидина дигидрохлорида. Удобство этой формы для больных состоит в том, что Тримектал МВ принимается внутрь по 1 таблетке 2 раза в сутки (утром и вечером), во время приема пищи. Это весьма важное обстоятельство для пожилых пациентов и пациентов, принимающих несколько препаратов по поводу имеющихся у них хронических заболеваний. Показания к применению препарата Тримектал МВ: – ИБС: профилактика приступов стенокардии (в составе комплексной терапии); – кохлеовестибулярные нарушения ишемической природы, такие как головокружение, шум в ушах, нарушение слуха; – хориоретинальные сосудистые нарушения с ишемическими компонентами. Тримектал МВ может быть назначен на любом этапе лечения стенокардии в составе комбинированной тера№ 14, 2012 пии для усиления антиишемической активности других антиангинальных препаратов. Целесообразно и оправдано более широкое применение Тримектала МВ в кардиологической и терапевтической практике, что определяется как его высокой кардиоцитопротективной эффективностью, так и фармакоэкономической составляющей. Литература 1. Аронов Д.М., Лупанов В.П. Атеросклероз и коронарная болезнь сердца. – 2–е изд., перераб. – М.: ТРИАДА–Х, 2009. 2. Лупанов В.П. Триметазидин МВ у больных с ишемической болезнью сердца (обзор) // Consilium Medicum. – 2010. – Т.12, №1. 3. Opie L., King L. Glucose and glycogen utilyzation in myocardial ischemia change in metabolism and consequence for myocyte // Mol. Cell. Biochem. – 1998. – Vol.180. – P. 3–26. 4. Stanley W., Lopaschuk G., Hall J. et al. Regulation of myocardial carbohydrate metabolism under normal and ischemic conditions // Cardiovasc. Res. – 1997. – Vol. 33. – P. 243–257. 5. Серкова В.К. Метаболическая кардиоцитопротекция в терапии больных ишемической болезнью сердца: роль парциальных ингибиторов окисления жирных кислот // Рациональная фармакотерапия. – 2008. – №1(6). – С. 48–56. 6. Energy substrate metabolism as target for pharmacotherapy in ischemic and reperfused heart muscle // Heart and Metabolism. – 1998. – Vol. 1. – P. 5–9. 7. Шахнович Р.М. Оптимизация энергетического метаболизма у больных ишемической болезнью сердца // РМЖ. – 2001. – № 15. – С. 622–628. 8. Kantor P., Lucien A., Kozak R. et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long–chain 3–ketoacyl coenzyme A thiolase // Circulation Res. – 2000. –Vol. 17. – P. 580–588. 9. Belardinelli R. Ischemic heart disease and left ventricular dysfunction: the role of trimetazidine // Ital. Heart J. – 2004. – Vol. 5 (Suppl. 2). – P. 23–28. 10. Lopaschuk G.D. Optimizing cardiac energy metabolism: how can fatty acid and carbohydrate metabolism be manipulated? // Coron. Artery Dis. – 2001. – Vol. 12 (Suppl. 1). – P. 8–11. 11. Stanley W.C. et al. Metabolic therapy in the treatment of ischemic heart disease: the pharmacology of trimetazidine // Fundam. Clin. Pharmacol. – 2003. – Vol. 17. – P.133–145. 12. Fox K. et al. Guidelines on the management of stable angina pectoris – executive summary. The Task Force on the Management of stable angina pectoris of the European Society of Cardiology // Eur. Heart. J. – 2006. – Vol. 27. – P. 1341–1381. 13. Marzilli M., Klein W.W. Efficacy and tolerability of trimetazidine in stable angina: a meta–analysis of randomized, double–blind, controlled trials // Coron. Artery Dis.– 2003. –Vol. 14. – P. 171–179. 14. Cross H.R. Trimetazidine for stable angina pectoris // Expert Opin. Pharmacother. – 2001. – Vol. 2. – P. 857–875. 15. Кутишенко Н.П., Дмитриева Н.А., Лукина Ю.В. и др. Влияние Милдроната на эффективность антиангинальной терапии больных стабильной стенокардией напряжения // Рациональная фармакотерапия в кардиологии. – 2005. – № 2. 16. Сергиенко И.В., Кухарчук В.В., С.А. Габрусенко С.А. и др. Оценка влияния комбинированной терапии милдронатом на липидный спектр, факторы воспаления и функцию эндотелия у больных ишемической болезнью сердца // РФК. – 2007. – № 3. – С.10–14. 17. Национальные рекомендации по кардиоваскулярной профилактике // Кардиоваскулярная терапия и профилактика. – 2011. – Т. 10 (6). Приложение 2. 18. Васюк Ю.А., Куликов К.Г., Кудряков О.Н., Крикунова О.В. Митохондриальная дисфункция в патогенезе острого инфаркта миокарда: принципы диагностики и терапии миокардиальными цитопротекторами // Российские медицинские вести. – 2008. – № 2, Т. XIII. – С. 36 – 41. 19. Кухарчук В.И., Сергиенко И.И., Гобрусенко С.А. и др. Влияние метаболической терапии на параметры центральной гемодинамики у больных с недостаточностью кровообращения // Врач. – 2007. – №10. – С. 56–62. 20. McClellan K.J., Plosker G.L. Trimetazidine. A review of its use in stable angina pectoris and other coronary conditions // Drug. – 1999. – Vol. 58 (1). – P. 143–57. 21. Жиляев Е.В., Уржамова Т.В., Глазунов А.В. и др. Клинические аспекты применения триметазидина (Предуктала) в качестве антиангинального препарата // Тер. архив. – 2004. – № 8. – С. 20–23. 22. Detry J.M., Leclercq P.J. Trimetazidine European Multicenter Study versus propranolol in stable angina pectoris: contribution of Holter electrocardiographic ambulatory monitoring // Am. J. Cardiol. – 1995. – Vol. 76 (6). – P. 8B–11. 23. Chazov E.I., Lepakchin V.K., Zharova E.A. et al. Trimetazidine in Angina Combination Therapy – the TACT study: trimetazidine versus conventional treatment in patients with stable angina pectoris in a randomized, placebo–controlled, multicenter study // Am. J. Ther. – 2005. – Vol. 12 (1). – P. 35–42. Полный список литературы Вы можете найти на сайте http://www.rmj.ru РМЖ 723