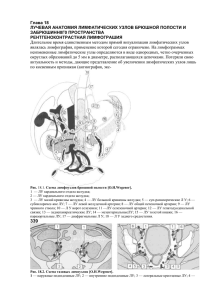
Государственное бюджетное образовательное учреждение « Первый Санкт-Петербургский Государственный медицинский университет
реклама

Государственное бюджетное образовательное учреждение « Первый Санкт-Петербургский Государственный медицинский университет имени академика И.П. Павлова» На правах рукописи БЕЛЯЕВ Михаил Алексеевич РОЛЬ РЕНТГЕНОВСКОЙ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ В ПРОГНОЗИРОВАНИИ РИСКА ЛАТЕРАЛЬНОГО МЕТАСТАЗИРОВАНИЯ ПРИ РАКЕ ПРЯМОЙ КИШКИ Специальности: 14.01.12 - онкология 14.01.13 - лучевая диагностика, лучевая терапия ДИССЕРТАЦИЯ на соискание учѐной степени кандидата медицинских наук Научные руководители: доктор медицинских наук Семиглазов Владислав Владимирович профессор, доктор медицинских наук Канаев Сергей Васильевич Санкт-Петербург 2015 ОГЛАВЛЕНИЕ ПЕРЕЧЕНЬ ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ И ТЕРМИНОВ…..3 ВВЕДЕНИЕ……………………………………………………………………….4 Глава 1. ЛАТЕРАЛЬНОЕ МЕТАСТАЗИРОВАНИЕ КАК ПРИЧИНА МЕСТНЫХ РЕЦИДИВОВ РАКА ПРЯМОЙ КИШКИ (ОБЗОР ЛИТЕРАТУРЫ)……………………………………………………...10 1.1. Современное состояние проблемы рецидивов рака прямой кишки………………………………………………………..…………….10 1.2. Анатомические особенности кровоснабжения и лимфооттока прямой кишки…………………………….……………………………...11 1.3. Частота регионарного метастазирования при раке прямой кишки…………………………………………………………………...…23 1.4. Различные подходы к классификации, стадированию и стратегии лечения местно-распространенного рака прямой кишки……………...26 1.5. Современные методы оценки регионарного метастазирования при раке прямой кишки………………………………………………….36 1.6. Выводы по обзору литературы………………………………………....43 Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1. Дизайн исследования………………………………………………….46 2.2. Характеристика пациентов контрольной группы исследования…………………………………………………………..48 2.2.1. Методология обследования пациентов контрольной группы …50 2.2.1.1. Технические параметры при проведении КТА пациентам контрольной группы………………………………………...50 2.2.1.2. Методика наглядного отображения результатов обследования пациентов контрольной группы……………52 2.3. Характеристика пациентов основной группы исследования………52 2.3.1. Методология обследования пациентов контрольной группы …52 2.3.1.1. Технические параметры при проведении МРТ пациентам основной группы…………………………………………….55 2.3.1.2. Форма отчета при выполнении МРТ пациентам основной группы………………………………………………………..55 2.3.1.3. Технические параметры при проведении КТА пациентам основной группы……………………………….56 2.3.1.4. Методика наглядного отображения результатов обследования пациентов основной группы……………….57 2.4. Методы статистической обработки материала……………………...58 Глава 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Результаты исследований пациентов контрольной группы………………………………………………………………….60 3.2. Результаты обследования пациентов основной группы…………….69 3.2.1. Результаты МРТ-исследований пациентов основной группы……........................................................................................69 3.2.2. Результаты КТА - исследования пациентам основной группы………………………………………………………………80 3.3. Анализ группы пациентов с метастазами в регионарные лимфатические узлы в зависимости от особенностей кровоснабжения прямой кишки…………………………………………………………………..82 Глава 4. КОМПЛЕКСНАЯ МОДЕЛЬ ОЦЕНКИ РИСКА ЛАТЕРАЛЬНОГО МЕТАСТАЗИРОВАНИЯ КИШКИ…………..............88 ЗАКЛЮЧЕНИЕ………………………………………………………………...90 ВЫВОДЫ………………………………………………………………………..93 ПРАКТИЧЕСКИЕ РЕКОММЕНДАЦИИ…………………………………..96 СПИСОК ЛИТЕРАТУРЫ…………………………………………………….97 ПРИЛОЖЕНИЯ………………………………………………………………109 ПЕРЕЧЕНЬ ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ И ТЕРМИНОВ КТ – компьютерная томография КТА – компьютерная томография в ангиорежиме ЛЛД – латеральная лимфатическая диссекция ЛЛУ – латеральный лимфатический узел ЛУ – лимфатический узел МРТ – магнитно-резонансная томография ПСПбГМУ – Первый Санкт-Петрбургский государственный медицинский университет имени академика И.П. Павлова РПК - рак прямой кишки РЭА – раковый эмбриональный антиген СПА - средняя прямокишечная артерия ТМЭ – тотальная мезоректумэктомия ХЛТ – химиолучевая терапия FSE - Fast Spin Echo MIP - Max Intensitive Point VRT - Volume Rendering Technique ВВЕДЕНИЕ Актуальность темы исследования Проблема профилактики, диагностики и лечения местных рецидивов рака прямой кишки после перенесенного первичного лечения является одной из самых актуальных в современной онкоколопроктологии. Несмотря на мультидисциплинарный подход к данному заболеванию, а также высокие требования к хирургической технике, частота местных рецидивов при данном заболевании остается достаточно высокой и достигает 25% после проведения комбинированного лечения и 40% после выполнения только хирургического лечения (Roeder F., 2007, Ze-Yu Wu, 2007). Одной из основных причин возникновения местных рецидивов является метастазирование в регионарные лимфатические узлы. Крайне дискутабельным является вопрос воздействия на латеральную группу лимфатических узлов – на лимфатические узлы вдоль внутренних подвздошных артерий и ее ветвей, лимфатические узлы области запирательной ямки, с целью профилактики и лечения латерального метастазирования при местно-распространенном раке прямой кишки. Согласно проведенному в Японии исследованию на 1272 пациентах, страдающих раком прямой кишки, в 14,9% (n=117) из них обнаружены латеральные метастазы (Sugihara K., 2006). Вопрос о способах воздействия на латеральные пути лимфооттока до настоящего времени остается нерешенным, лечебная тактика относительно метастазов в латеральные лимфатические узлы разительно отличается в странах Азии и Еропе. В Японии и других азиатских странах основным методом профилактики метастатического поражения латеральных лимфатических узлов является расширенная тазовая лимфодиссекция (JSCCR, 2009). В противоположность данному подходу, в США и европейский странах национальные руководства рекомендуют проведение неоадъювантной химиолучевой терапии для данной категории больных (NCCN, 2013). Как известно, правильная диагностика и точное стадирование опухолевого процесса являются залогом успеха в последующем лечении, обеспечивая более длительную общую и безрецидивную выживаемость. Существующие методы дооперационного стадирования опухолевого процесса прямой кишки не обладают должной чувствительностью и специфичностью в отношении оценки регионарного метастазирования в целом и поражения латеральной группы лимфатических узлов в частности. Данный факт свидетельствует о необходимости поиска новых методов диагностики, выявлении факторов риска и неблагоприятного прогноза в отношении латерального метастазирования при раке прямой кишки, а также более дифференцированному определению показаний неоадъювантной к подходу к выбору расширению химиолучевой терапии лечебной показаний и/или к тактики, проведению расширению объема предполагаемого оперативного вмешательства. Цель исследования Улучшить результаты диагностики рака прямой кишки путѐм выявления неблагоприятных прогностических факторов латерального метастазирования. Задачи исследования: 1. Изучить вариантную анатомию средней прямокишечной артерии у пациентов без опухолевых заболеваний органов малого таза и прямой кишки и у больных, страдающих раком прямой кишки с помощью рентгеновской компьютерной томографии. 2. На основании данных магнитно-резонансной томографии определить частоту и локализацию регионарных метастазов у больных раком прямой кишки с учѐтом индивидуальных особенностей кровоснабжения органа. 3. Провести анализ факторов, влияющих на частоту развития латерального метастазирования. 4. Предложить комплексную модель оценки неблагоприятного прогноза в отношении метастазирования в латеральные лимфатические узлы при раке прямой кишки. Научная новизна работы Используя компьютерную томографию в ангиорежиме, проведено детальное изучение анатомическая кровоснабжения вариабельность средней прямой кишки, прямокишечной подтверждена артерии на пациентах, страдающих раком прямой кишки в различных ее стадиях и при различных локализациях и на пациентах, не страдающих опухолевыми заболеваниями органов малого таза и прямой кишки. Впервые изучена взаимосвязь между наличием индивидуальных анатомических особенностей и вариабельности кровоснабжения прямой кишки и возникновением метастатического поражения по различным путям лимфооттока от прямой кишки. Предложена комплексная модель оценки риска возникновения латерального метастазирования при раке прямой кишки, имеющая высокую оценку степени чувствительности и специфичности. Практическая значимость работы Применение такой неинвазивной методики как компьютерная томографии в ангиорежиме с прицельным изучением сосудов прямой кишки, прогнозирование риска развития латерального метастазирования в дополнение к стандартным методикам обследования больных раком прямой кишки позволит прогнозировать вероятность развития возникновения латерального метастазирования у пациентов при отсутствии клинически пораженных лимфатических узлов и индивидуализировать подход к выбору лечебной тактики. Апробация работы Результаты исследования доложены и обсуждены на: - I Международной междисциплинарной научно-практической конференции «Оптимальные алгоритмы томографии в абдоминальной онкологии» (Санкт-Петербург, 19 февраля 2015 года); - 76 Ежегодной итоговой научно-практической конференции студентов и молодых ученых ПСПбГМУ им. акад. И.П. Павлова «Актуальные вопросы экспериментальной и клинической медицины – 2015» (Санкт-Петербург, апрель 2015 года). Публикации по теме исследования По теме диссертации опубликовано печатных работ, 4 из которых в реферируемых ВАК журналах. Реализация результатов исследования: Результаты исследования внедрены и активно используются в практической работе при выборе тактики как хирургического, так и комбинированного методов лечения больных различными стадиями рака прямой кишки в отделении онкологии №1 НИИ хирургии и неотложной медицины Первого Санкт-Петербургского Государственного медицинского университета им. академика И.П. Павлова. Положения, выносимые на защиту: 1. Для изучения индивидуальных анатомической вариабельности средней прямокишечной артерии целесообразно выполнение рентгеновской компьютерной томографии; 2. Средняя прямокишечная артерия является непостоянным сосудом, преимущественно локализующимся с одной стороны и отходящим отдельной ветвью от внутренней подвздошной артерии. Наличие средней прямокишечной артерии, а также варианты ее ветвления не зависят от таких факторов как пол, возраст пациента, а также наличия или отсутствие опухолевого заболевания прямой кишки или малого таза, являясь вариантом индивидуального развития человека; 3. Частота поражения латеральных лимфатических узлов статистически достоверно коррелирует с наличием средней прямокишечной артерии; 4. К неблагоприятным прогностическим факторам возникновения латеральных метастазов следует относить локализацию опухоли в нижнеампулярном отделе, наличие средней прямокишечной артерии, поражение лимфатических узлов мезоректальной клетчатки, повышенный уровень ракового эмбрионального антигена, высокую степень местного распространения опухоли. 5. Предложенная модель оценки риска латерального метастазирования с использованием выделенных показателей обладает высокой степенью чувствительности, специфичности и диагностической точности. Объем и структура диссертации: Работа изложена на страницах машинописного текста, состоит из введения, обзора литературы, главы методов и материалов, двух глав результатов собственных исследований, заключения, выводов, практических рекоммендаций, списка используемой литературы. Библиографический указатель включает отечественных и иностранных авторов. Работа иллюстрирована приложениями. публикации, в том числе рисунками, таблицами и 2 ГЛАВА 1 ЛАТЕРАЛЬНОЕ МЕТАСТАЗИРОВАНИЕ КАК ПРИЧИНА МЕСТНЫХ РЕЦИДИВОВ РАКА ПРЯМОЙ КИШКИ (ОБЗОР ЛИТЕРАТУРЫ) 1.1. Современное состояние проблемы местных рецидивов рака прямой кишки В структуре онкологической заболеваемости рак прямой кишки занимает 6-е место (5,2%) среди мужчин и 7-е место (4,7%) среди женщин (Каприн А.Д., 2015). В 2012 г. в России зарегистрировано более 26000 больных раком прямой кишки. Прирост абсолютного числа заболевших с 2007-2012 годы составил 10,6% у мужчин и 9,4% у женщин. (Давыдов М.И., 2014). Одна из основных проблем в лечении рака прямой кишки – проблема возникновения местных рецидивов. В ранних 90х годах в литературе упоминается частота рецидивирования при раке прямой кишки от 21% до 46% (Dahl O., 1990; Marsh PJ, 1994). За последние годы отмечается значительное улучшение прогноза лечения больных раком прямой кишки. Это связано в первую очередь, как с появлением современных методов диагностики, так и с применением комбинированных методов лечения, широким внедрением в лечение неоадъвантного лечения, химиолучевой терапии (ХЛТ). Так, проведение неоадъювантной ХЛТ, использование принципов тотальной мезоректумэктомии (ТМЭ) и высокой перевязки нижней брыжеечной артерии в хирургии рака прямой кишки, по мнению некоторых авторов, позволяет добиться показателей 5-летней выживаемости от 64,2% до 87,8% (Sauer R., 2004; Peeters K.C., 2007; Ortiz H., 2013). По мнению авторов, при медиане наблюдения более 5 лет, частота возникновения местных рецидивов варьирует от 4,5 до 8%. При этом без активного лечения данных больных их продолжительность жизни не превышает 8 месяцев, а в случае проведения симптоматического лечения – не более 14 месяцев (Farouk R., 1997; Wong C.S., 1998). Средний интервал между возникновением первичной опухоли и выявлением местного рецидива заболевания в среднем составляет от 12 до 44 месяцев (Tanis P.J., 2013). Лимфогенное метастазирование является одной из основных причин возникновения местных рецидивов рака прямой кишки. Поражение лимфатических узлов является неблагоприятным фактором прогноза. По данным некоторых авторов, при наличии поражения регионарных лимфатических узлов, пятилетняя выживаемость при раке прямой кишки составляет не более 45%, тогда как отсутствие их поражения дает возможность говорить о 70% выживаемости и более (Moriya Y., 1997). 1.2. Анатомические особенности кровоснабжения и лимфооттока прямой кишки. Кровоснабжение прямой кишки осуществляется пятью основными сосудами, имеющими различное происхождение (Одарюк Т.С. с соавт., 2005). Наиболее выраженной из них является непарная верхняя прямокишечная артерия, которая является конечной ветвью нижней брыжеечной артерии после отхождения сигмовидных артерий. Она разделяется на передне-левую и задне-правую ветви. Правые и левые средние прямокишечные артерии (СПА) отходят от внутренней подвздошной артерии и заканчиваются по боковой поверхности прямой кишки. Также описываются нижние прямокишечные артерии, ветви внутренних половых артерий, кровоснабжающие анальный канал и сфинктер. Кроме того, имеются тонкие ректальные ветви срединной крестцовой артерии, выходящей из задней поверхности аорты над ее бифуркацией, спускаясь вдоль поясничных позвонков, крестца и копчика, кровоснабжающие прямую кишку сзади. В анатомических атласах и отечественных учебниках анатомии СПА описывается как постоянный сосуд, являющийся ветвью переднего ствола внутренней подвздошной артерии (реже – ветвью внутренней половой артерии), идущий к латеральной стенке ампулы прямой кишки, анастомозирующий с верхней и нижней прямокишечной артериями (Синельников Р.Д., 1979; Гайворонский И.В., 2001). В изученной отечественной и зарубежной литературе, встречаются упоминания об индивидуальных особенностях кровоснабжения прямой кишки и, в частности, имеющейся вариабельности как наличия или отсутствия средней прямокишечной артерии, так и вариантах ее ответвления. По данным А.Ф. Рылюк, СПА наблюдается лишь в 10% наблюдений и может отходить как непосредственно от внутренней подвздошной артерии, так и от других ее стволов (Рылюк А.Ф., 1997) В американской иллюстрированной анатомической энциклопедии вариабельной анатомии человека авторы говорят о непостоянстве средней прямокишечной артерии (Bergman RA, 2006). В результате 45 наблюдений было установлено, что в 33% случаях (n=15) артерия возникала от переднего ствола внутренней подвздошной артерии, в 22% (n=10) шла самостоятельно от внутренней подвздошной артерии, в 13,3% случаях (n=6) имела общее происхождение с внутренней половой артерией, в 8,9% наблюдениях (n=4) отходила вместе с запирательной артерией, в 2 случаях – с нижней мочепузырной артерией, в 2 случаях - вместе с маточной артерией, и в 1 случае – с верхней мочепузырной артерией. В 2 наблюдениях СПА отходила самостоятельно от заднего ствола внутренней подвздошной артерии. Также имелось 1 наблюдение с двумя СПА одновременно, первая из которых отходила от переднего ствола внутренней подвздошной артерии, вторая – от заднего ствола вместе с латеральной сакральной артерией. Также указывается на варианты рассыпчатого типа средней прямокишечной артерии. В том случае, когда артерий больше, чем одна, они отходили непосредственно от внутренней подвздошной и/или нижней мочепузырной артерии, либо от внутренней подвздошной и/или внутренней половой артерии. В анатомических исследованиях на трупах, посвященных изучению кровоснабжения прямой кишки, было показано наличие СПА лишь в небольшом проценте случаев. В Швейцарском исследовании от 1978 года было проведено 42 аутопсии, при которых лишь в 12% случаев было установлено наличие средней прямокишечной артерии, как с двух сторон, так и с одной (Ayoub S.F., 1978). В исследовании L.J. Didio c соавт. по результатам 30 вскрытий умерших обоего пола (15 женщин и 15 мужчин) установлено наличие средней прямокишечной артерии в 56,7% случаев, как билатерально (36,7%), так и в унилатеральном варианте (20%) (Didio L.J., 1986). В 40% случаев средняя прямокишечная артерия брала свое начало от внутренней половой артерии, в 26% от нижней ягодичной артерии, в 16% от внутренней подвздошной артерии и в редких случаях от других артерий таза. Примерно такие же результаты (50% встречаемости средней прямокишечной артерии) представлены в исследовании от 1996 года (Shafik A, 1996). При исследовании 28 трупов, средняя прямокишечная артерия была выявлена в 17 случаях, причем во всех 17 случаях она присутствовала только с одной стороны. В иллюстрированной энциклопедии университета Айовы США, посвященной анатомическим вариациям человека, авторы также говорят о вариабельности средней прямокишечной артерии (Bergman R.A., 2006). По приведенным авторами данным, в результате 45 наблюдений, в 15 случаях (33%) артерия возникает от переднего ствола внутренней подвздошной артерии, в 10 (22%) идет самостоятельно от внутренней подвздошной артерии, в 6 случаях (13,3%) имеет общее происхождение с внутренней половой артерией, в 4 наблюдениях (8,9%) отходит вместе с запирательной, в 2 случаях – с нижней мочепузырной артерией, в 2случаях - вместе с маточной артерией и в 1 случае – с верхней мочепузырной артерией. В 2 наблюдениях СПА отходила самостоятельно от заднего ствола внутренней подвздошной артерии. Также имелось 1 наблюдение с двумя СПА одновременно, первая из которых отходила от переднего ствола внутренней подвздошной артерии, вторая – от заднего ствола вместе с латеральной сакральной артерией. Также указывается на варианты рассыпчатого типа средней прямокишечной артерии. В том случае, когда артерий больше, чем одна, они отходят непосредственно от внутренней подвздошной и/или нижней мочепузырной артерии, либо от внутренней подвздошной и/или внутренней половой артерии. М.С. Ольшанским с соавт. проводился анализ ангиографических данных пациентов при проведении селективной химиоэмболизации верхней и средней прямокишечных артерий с целью улучшения онкологических результатов в лечении местно-распространенного рака прямой кишки (Ольшанский М.С., 2013). 11 пациентам автор выполнил селективную ангиографию прямокишечных артерий, 35 больным проведен ретроспективный анализ данных ангиографии подвздошных артерий. Была изучена анатомическая вариабельность СПА. По представленным данным, средняя прямокишечная артерия более чем в половине случаев, в 52% случаев (n=18) была слабо выражена или отсутствовала, умеренно или хорошо была развита лишь в 48% случаев (n=17). Более чем в половине случаев левая артерия была намного крупнее правой. Также авторами был установлен вариант ветвления средней прямокишечной артерии как ветви нижней ягодичной артерии. В португальском исследовании, проведенном в период с 2010 по 2012 годы, исследовали анатомию средней прямокишечной артерии, используя компьютерную томографию в ангиорежиме и прямую ангиографию (T.Bilhim, 2013). Было проведено ретроспективное исследование, включающее 167 пациентов с гиперплазией предстательной железы, перенесших селективную тазовую эмболизацию. Всем пациентам перед эмболизацией была выполнена прямая ангиография и КТ-ангиография для оценки кровоснабжения таза. Средняя прямокишечная артерия была обнаружена у 60 пациентов (в 35,9% случаев), из которых у 20 пациентов она обнаружена билатерально (12%), у 24 пациентов (30%) – отдельным от соседних артерий стволом, и в 56 случаях (70%) имела общее происхождение с простатическими артериями (простато-прямокишечный ствол). Наиболее частым вариантом артерия происхождения артерии была внутренняя половая (60%, n=48), нижняя ягодичная артерия (21,3%, n=17), общий ягодично-половой ствол (16,2%, n = 13). У 2 пациентов средняя прямокишечная артерия происходила от запирательной артерии (2,5%). Анастомозирование с верхней прямокишечной и нижней брыжеечной артерией было установлено в 87,5% случаев (n=70). Средняя прямокишечная артерия не определялась ни при прямой ангиографии, ни при КТ-ангиографии у 107 пациентов, при этом кровоснабжение прямой кишки осуществлялось из бассейна верхней прямокишечной артерии, в то время как анальный канал кровоснабжался от нижней прямокишечной артерии (промежностной части внутренней половой артерии). Данное исследование является единственным трудом, описывающим анатомию средней прямокишечной артерии на основании рентгенологических исследований. Авторы акцентируют внимание на то, что не проводили сравнение чувствительности ангиографии и КТ-ангиографии и методикой анатомической препаровки СПА при кадаверных исследованиях, что в свою очередь могло бы быть полезным с целью выработки определенного протокола изучения индивидуальных особенностей кровоснабжения прямой кишки и роли средней прямокишечной артерии в кровоснабжении прямой кишки. Результаты исследования подтверждали предыдущие исследования на трупах и доказали, что средняя прямокишечная артерия обладает вариабельностью ветвления и не является коллатеральной ветвью нижней брыжеечной артерии. Одной из причин вариабельности средней прямокишечной артерии S.Bell с соавторами считают вариантную сосудистую анатомию прямой кишки, и в частности, наличие или отсутствие средней прямокишечной артерии, сопровождающей латеральные пути лимфооттока (Bell S., 2009). Авторы считают вопрос о переменности средней прямокишечной артерии спорным и задают вопрос, является ли данная артерия непостоянным сосудом или в силу малых своих размеров ее наличие не всегда возможно определить. Исследование лимфооттока прямой кишки было начато в конце XIX века. Группа околопрямокишечных, или папраректальных, узлов впервые была открыта D. Gerota (Gerota D., 1895). Согласно современной номенклатуре они обозначаются как аноректальные (Колесников Л.Л., 2003), а также носят имя автора и называются узлами Герота. Количество аноректальных узлов, по данным разных авторов, варьирует от 1-21, чаще всего наблюдается вариация от 5-8, расположенных в виде одиночных узлов, цепочек и рядов, либо их скоплений из 2-3 узлов (Шуркус В.Э. с соавт., 2008). Группа внутренних подвздошных лимфатических узлов стала известна годами позже, после опубликования работ D. Gerota (1895), P. Kroemer (1904), В.В. Гинзбурга (1959) и др. Данные ЛУ зарегистрированы как залегающие вблизи начала пупочной, нижней пузырной, маточной и средней прямокишечной артерий. По данным Э.В. Швецова, количество внутренних подвздошных узлов варьирует от 4-22 у взрослых людей, их размеры также различаются многообразием - от 2х3 до 12х23 мм (Швецов Э.В. с соавт., 1979). Автор также указывает на непостоянство наличия средних прямокишечных узлов – до 48% случаев. Изучению генеза и развития лимфатической системы органов малого таза посвящены многие труды ученых с начала XX века. Так, например Sabin считала, что происхождение первичной лимфатической системы человека таза имеет венозное происхождение (Sabin F.R., 1909). Ferber-Shmidt,Tondury und Kubik считали, что лимфатические мешки развиваются не из вен, а из интерстициальных щелей в мезенхиме. По мнению Бобрика И.И., проблема в изучении генеза лимфатической системы заключается в отсутствии достоверных критериев, которые бы позволили дифференцировать эмбриональные вены и лимфатические закладки друг от друга. Шуркус В.Э. с соавт., на основе многочисленных эмбрионатомических исследований подробно отобразившие механизмы эмбриогенеза лимфатической системы органов малого таза, считают, что лимфатические закладки имеют как венозное, так и мезенхимальное происхождение в виде экскавации в эмбриональной соединительной ткани, остающейся на месте разрушающихся эмбриональных вен. По мнению авторов, уже на 11 неделе у плода в бассейне внутренних подвздошных артерий начинают свое формирование околопрямокишечные, запирательные и медиальные внутренние подвздошные узлы. К 12,5-13,5 неделе ЛУ, являющиеся незрелыми узлами первой фазы дифференцировки, увеличиваются в размерах и представляются объединенными в гетероморфно организованное лимфатическое сплетение в виде лимфатических капилляров и посткапилляров. Выбор оптимальных путей лимфооттока, редукция части капилляров и формирование дефинитивных вариантов анатомической организации подвздошных лимфопроводящих путей происходит в результате процесса магистрализации в период с 13-14 по 19-20 неделю развития плода. Авторы вводят термин «магистрализация» - процесс, в ходе которого происходит уменьшение густоты лимфатических сплетений, уменьшения количества анастомозов между ними, ход лимфатических сосудов приобретает направленный характер, вследствие чего возникают многочисленные варианты оттока от тазовых органов и приобретаются определенные типы магистрализации, носящие двусторонние, правосторонние или левосторонние анатомические особенности (Шуркус В.Э. с соавт., 2006). В своей работе авторы говорят о зарегистрированных 16% случаев наличия лимфатических сосудов перекрестного направления, идущих от правых внутренних подвздошных к общим подвздошным лимфатическим узлам левой стороны, 4% наблюдений путей лимфооттока от левых внутренних подвздошных к правым общим подвздошным узлам, а также имеющихся 2% наблюдений сообщения лимфатических узлов внутренних подвздошных групп и поясничных групп лимфатических узлов. Многообразие путей лимфооттока, отведение лимфы от органов малого таза не только в вышерасположенные общие подвздошные лимфатические узлы, но и в латеральном и в нисходящем направлении, Шуркус В.Э. с соавторами объясняют фактом слияния внутреннего и наружнего подвздошных лимфатических мешков с наружными подвздошными и субаортальными лимфатическими мешками в процессе эмбриогенеза в зоне слияния наружной и внутренней подвздошных вен и бифуркации общей подвздошной артерии. Касаемо лимфоттока от прямой кишки, T. Jonnesco описывал верхний отдел прямой кишки как терминальную часть сигмовидной кишки, опустившейся в таз. Нижняя часть прямой кишки, по его мнению, топографоанатомически являлась тазово-промежностной, оканчивающейся анусом (Jonnesco T., 1892). Он считал, что прямая кишка имеет две основные лимфатические сети, границей между которыми является средняя поперечная складка прямой кишки. Отдельно автор выделял латеральные и нисходящие лимфатические коллекторы, являющиеся путями метастазирования от отделов, расположенных ниже данной границы, то есть в случае локализации опухоли в нижне- и среднеампулярном отделах прямой кишки. Восходящий коллектор, по данным автора, отвечает за лимфоотток от всех отделов прямой кишки. Было также описано, что лимфатические стволы прямой кишки сопровождают нижнюю, среднюю и верхнюю прямокишечные артерии. Позже F. Villemin опубликовал труды, посвященные изучению лимфодренажа прямой кишки и анального канала. Он разделил прямую кишку на верхний и нижний отделы и выдвинул концепцию, что хотя проксимальная часть прямой кишки и является топографически тазовой, ее иннервация и васкуляризация относится к брюшной полости (Villemin F, 1925). Наиболее подробно основные зоны регионарного метастазирования рака прямой кишки впервые были описаны W. E. Miles в начале XX века (Miles WE., 1925). Им была предложена модель трех основных направлений опухолевого процесса: восходящий, латеральный и нисходящий пути метастазирования. Восходящий путь имеет направление вдоль верхней прямокишечной артерий к нижней брыжеечной артерии, поражая верхние ректальные и нижние брыжеечные узлы. Латеральное распространение осуществляется вдоль средних ректальных, запирательных, внутренних подвздошных и общих подвздошных узлов. При нисходящем пути метастазирование осуществляется в паховые лимфатические узлы. Чаще всего при раке верхнеампулярного отдела прямой кишки метастазирование происходит по восходящему пути вдоль верхней прямокишечной и нижней брыжеечной артерии, при раке нижне- и среднеампулярных отделов – в латеральные лимфатические узлы, при раке анального канала – в паховые лимфатические узлы В настоящий момент лимфоотток от прямой кишки представляется разделенным на интрамуральный, промежуточный и экстрамуральный (Т.С. Одарюк, 2005). Интрамуральная сеть прямой кишки в свою очередь подразделяется на подслизистую и межмышечную. Подслизистая сеть распространяется кверху до тазового отдела прямой кишки, книзу до ануса, переходит в лимфатические узлы подкожно-жировой клетчатки и анастомозирует с межмышечной сетью, распространяющуюся в том же направлении и объединяющейся с лимфатической системой наружнего сфинктера. Интрамуральная сеть лимфатических узлов объединяется с промежуточной, куда опухолевые клетки из первичного очага попадают в первую очередь. В дальнейшем лимфоотток осуществляется по экстрамуральным путям. Экстрамуральный путь лимфоотока обладает наиболее выраженной сетью лимфатических сосудов, тесно связан с параректальными лимфатическими узлами, имеющимися вокруг прямой кишки по всей ее поверхности, располагающимися между ветвями верхней прямокишечной артерии. Дальнейший лимфоотток осуществляется по трем основным направлениям – восходящему, латеральному и нисходящему путям, описанным ранее W.E. Miles. Таким образом, в зависимости от локализации в системе лимфооттока, лимфатические узлы принято разделять на узлы первого, второго и третьего порядков. Узлами первого порядка для всех трех направлений лимфооттока всегда являются лимфатические узы мезоректума (узлы Герота, или параректальные восходящем лимфатические пути лимфооттока узлы). Узлы второго располагаются порядка по ходу при верхней прямокишечной артерии, третьего порядка – вдоль нижней брыжеечной артерии (рис.1.1) Рисунок 1.1. Восходящий путь лимфооттока от прямой кишки (Одарюк Т.С., 2005): Параректальные I. лимфатические узлы (узлы Герота); II. Лимфатические узлы вдоль верхней прямокишечной артерии; III. вдоль Лимфатические нижней узлы брыжеечной артерии Восходящий путь лимфооттока характерен для опухолей верхне- и среднеампулярного отдела прямой кишки, но часто наблюдается и при нижних локализациях. При нисходящем пути лимфооттока узлами второго порядка являются узлы вдоль дистальной части внутренних подвздошных артерий, третьего порядка – паховые лимфатические узлы (рис. 1.2). Нисходящий путь характерен для низколокализованных опухолей прямой кишки, чаще при раке анального канала. Рисунок 1.2. Нисходящий путь лимфооттока от прямой кишки (Одарюк Т.С., 2005): Параректальные I. лимфатические узлы (узлы Герота); II. Лимфатические вдоль дистальной внутренних узлы части подвздошных артерий; III. Паховые лимфатические Латеральный нижнеампулярного лимфотток отдела узлы наблюдается при прямой кишки, так опухолях и при как опухолях среднеапулярного отдела, но чаще характерен для «низких» опухолей. Узлами второго порядка при данном пути являются лимфатические узлы по ходу внутренних подвздошных артерий, узлами третьего порядка – узлы области запирательной ямки, вдоль запирательной артерии (рис. 1.3) Рисунок 1.3. Латеральный путь лимфооттока от прямой кишки (Одарюк Т.С., 2005): Параректальные I. лимфатические узлы (узлы Герота); II. Лимфатические узлы вдоль внутренних подвздошных артерий; III. Лимфатические области узлы запирательной ямки В 90-х годах XX века J.B. Arnaud, исследуя пути лимфооттока при раке прямой кишки, указал на «непостоянство и добавочность» латерального лимфооттока, который встречался лишь в 50% случаев (Arnaud J.B., 1990). Автор предположил, что латеральное метастазирование встречается лишь в случае возникновения обструкции по восходящему пути лимфооттока. Ш.Б. Кулиев, проводя прямую лимфографию внутренней подвздошной группы лимфатических узлов, отметил, что у каждого четвертого пациента внутренние подвздошные узлы не определялись на лимфограммах, в 15,7% случаев запирательные и другие ЛУ данной группы не определялись во время оперативного вмешательства, а у 25% пациентов они определялись при оперативном вмешательстве, но лимфографии (Кулиев Ш.Б., 1969). не контрастировались во время Таким образом, анатомических и несмотря на большой анатомо-эмбриологических объем проведенных исследований, природа развития лимфатической системы органов малого таза в целом и прямой кишки, в частности, до настоящего времени окончательно не изучена. Доказан лишь факт тесной взаимосвязи лимфатической и кровеносной систем в процессе эмбриогенеза. Установлены основные пути лимфодренажа от различных отделов прямой кишки и доказана топографоанатомическая вариабельность как лимфатического, так и кровеносного русел прямой кишки. 1.3. Частота регионарного метастазирования при раке прямой кишки По данным Y. Moriya, при раке прямой кишки метастазирование по восходящему пути наблюдается в 61% случаев, по латеральному и восходящему путям – в 30% наблюдения, и только по латеральному пути в 8% случаев (Moriya Y., 1997). В работе J. Hida метастазирование по восходящему пути встречается в 87% наблюдений, нисходящему – 1-2%, по латеральному латеральному пути лимфооттока встречается лишь в 11% случаев (Hida J., 1996). В.М. Кулушев, проведя исследования на 404 пациентах, страдающих раком прямой кишки различных локализаций, установил, что при злокачественном поражении ректосимоидного отдела толстой кишки у 30% больных наблюдается поражение лимфатических узлов восходящего пути, в 20% - мезоректальных лимфатических узлов, у 10% - ЛУ вдоль нижней брыжеечной артерии. При опухолях верхнеампулярного отдела у 28,6% имелись метастазы в мезоректальные ЛУ, метастазирование вдоль верхней прямокишечной артерии встречалось в 10,7% случаев, у 3,6% имелись метастазы вдоль нижней брыжеечной артерии. Лишь у пациентов средне- и нижнеампулярным раком прямой кишки наблюдались латеральные метастазы. При запирательные среднеампулярном ЛУ латеральной раке группы наблюдались – в 6,2% пораженные случаев. При нижнеампулярном раке в 9,4% случаях встречались пораженные ЛЛУ вдоль средней прямокишечной артерии, в 7,8% - запирательные ЛУ. Мезоректальные лимфатические узлы наблюдались как при средне-, так и при нижнеампулярной локализации опухоли – у 21,9% и 25% больных, соответственно. При этом, метастазирование по восходящему пути наблюдалось как при опухолях среднеампулярного отдела (31,3%), так и при нижнеампулярной локализации рака (32,8%), а метастазирование в паховые ЛУ встречались в 1,6% при среднеампулярной локализации и в 10,9 % при нижнеампулярном раке. Таким образом, автором было показано, что метастазирование в мезоректальные лимфатические узлы встречается при всех локализациях рака, являясь первым этапом лимфооттока, и что при средне- и нижнеампулярной локализации опухоли лимфоотток осуществляется по всем путям лимфооттока, включая как восходящий и латеральный, так и нисходящий путь регионарного метастазирования. По данным Morita с соавторами метастазирование по латеральному пути выявлено в 15% низкого рака прямой кишки (Morita T., 2003). Kim с соавторами (Kim T.H., 2008) считал поражение латеральных лимфатических узлов одной из основных причин возникновения локорегионарных рецидивов. В исследовании, представленном авторами, из 366 пациентов, получивших химиолучевую терапию с последующим оперативным вмешательством и ТМЭ, появление локорегионарных рецидивов отмечено у 29 пациентов (7,9%), из которых патоморфологически рецидивы были доказаны у 13 из 29 пациентов (44,8 %), а остальные были обнаружены сочетанием как радиологических методов исследования, так и на основании клинических данных. Из 29 больных с локорегионарными рецидивами, 6 пациентов (20,7 %) имели центральные тазовые рецидивы, 24 пациента (82,7 %) имели латеральные тазовые рецидивы, из которых 1 пациент имел одновременно как центральный, так и латеральный тазовый рецидив. Из 24 пациентов, имеющих тазовый рецидив, 10 пациентов (41,6%) не имели отдаленных метастазов, и 14 пациентов (58,3 %) имели одновременные отдаленные метастазы. Медиана времени до возникновения центрального тазового рецидива, латерального тазового рецидива и отдаленных метастазов составил 24,3 месяца (диапазон от 14 – 53,4 месяцев), 18,5 месяцев (диапазон от 8-41,9 месяцев), и 16,7 месяцев (диапазон от 6 53,4 месяцев), соответственно. Kobayashi c соавторами (Sugihara K., 2006, Kobayashi H., 2009) провели исследования на 1272 больных раком прямой кишки. Среди 784 пациентов (62%), перенесших латеральную лимфодиссекцию, 117 (14,9%) имели латеральные метастазы. Частота метастазирования в латеральные лимфатические узлы в соответствии с глубиной опухолевой инвазии была 5,4% у pT1; 8,2% у рТ2; 16,5% у рТ3 и 37,2% у пациентов с патологической Т4 стадией. Также по мнению авторов среди таких факторов латерального метастазирования, как локализация опухоли и глубина инвазии, фактором высокого риска является и наличие метастазов в параректальных лимфатических узлах. Почти в половине случаев (47%) установлено поражение периферических подвздошных лимфатических узлов, в 38% обтураторных, в 26% случаев поражались центральные подвздошные лимфатические узлы и в 7,7% - лимфатические узлы других локализаций. И. И. Алиев провел исследование на 281 больном, страдающих раком прямой кишки и получивших хирургическое лечение (Алиев И.И., 2004). 74 из них оперативное лечение было дополнено расширенной лимфодиссекцией. Для улучшения визуализации лимфатических узлов применялся водорастворимый контраст India-Ink (CH-40) и Lymphazurin 1% (isosulfan blue), введенные в опухоль интраоперационно. При изучении лимфооттока было установлено, что лимфатические сосуды и узлы, осуществляющие отток от прямой кишки, сопровождали артериальные сосуды. Лимфоотток от анального канала прямой кишки осуществлялся вдоль нижней прямокишечной артерии, далее сопровождал внутреннюю половую артерию. Лимфатические сосуды и сосуды располагались по ходу артериального русла. Наибольшее разнообразие лимфатических коллекторов наблюдалось при нижнеампулярном отделе прямой кишки и в анальном канале. Слизистая анального канала имела отток лимфы по сосудам вдоль нижней прямокишечной артерии, вдоль внутренней половой артерии, а также по ходу средних прямокишечных артерий к переднему стволу внутренних подвздошных артерий. Лимфоотток от нижнеампулярного отдела происходил по восходящему пути и вдоль средней прямокишечной артерии. Отток лимфы от средне- и верхнеампулярного отделов происходил в основном по восходящему пути лимфооотока. Метастазы в регионарные лимфатические узлы были обнаружены у 110 (39,1%) оперированных больных. У пациентов с опухолями нижнеампулярного отдела прямой кишки регионарное поражение наблюдалось в 37% случаев. Среди пациентов группы латеральной лимфодиссекции, метастазы в латеральную группу лимфатических узлов гистологически верифицированы в 10,8% случаев. 1.4. Различные подходы к классификации, стадированию и стратегии лечения местно-распространенного рака прямой кишки За последние два десятилетия хирургические результаты лечения рака прямой кишки значительно улучшились благодаря внедрению принципа тотальной мезоректумэктомии анатомическое удаление (ТМЭ). Методика подразумевает лимфатических путей и узлов в пределах мезоректума и базируется на той концепции, что клетки рака прямой кишки достаточно редко проникают за пределы мезоректума (Wiig J.N., 1998; Heald R.J., 1992). Данная концепция под названием «Holy Plane» (англ. «Священная Плоскость») была подробно описана профессором R.J. Heald в конце 80-х годов XX века (Heald R.J, 1988). Принятая хирургическая тактика позволила значительно уменьшить риск возникновения местных рецидивов рака прямой кишки и стала «золотым стандартом» в хирургическом лечении рака прямой кишки (Wibe A., 2004). Выполнение высокой перевязки нижней брыжеечной артерии обеспечивает удаление лимфатических узлов, следующих по восходящему пути лимфооттока, что способствует более точной оценке статуса регионарных лимфатических узлов вдоль нижней брыжеечной артерии и, в свою очередь, более тщательному стадированию опухолевого процесса (Titu L.V., 2008). Указанные хирургические приемы не вызывают сомнений, общеприняты во всем мире и являются «золотым стандартом» в хирургическом лечении рака прямой кишки. Вопроса о способах воздействия на латеральные пути лимфооттока до настоящего времени остается нерешенным, ибо лечебная тактика относительно метастазов в латеральные лимфатические узлы разительно отличается в Японии и западных странах. В западных странах исследования, проведенные в 50х годах M.R. Deddish и Sauer (Deddish M.R.,1950, Sauer I., 1952), показали необходимость удаления тканей вокруг внутренней подвздошной артерии, а также диссекции запирательных лимфатических узлов и ЛУ у основания нижней брыжеечной артерии. Однако через 10 лет M.W. Stern с соавт. доложили о более длительном времени операции, большей кровопотере, об увеличении частоты дизурических и сексуальных расстройств, возникающих при выполнении латеральной лимфодиссекции (Stern M.W., 1959). При этом не было отмечено улучшения общей выживаемости. Данная работа привела к изменению подхода к выполнению латеральной диссекции и послужила поводом к почти полному отказу от ее выполнения в западных странах. Седьмая редакция руководства по стадированию рака Американского Объединенного Комитета Рака (AJCC), лежащая в основе международной классификации TNM-7, определяет внутренние подвздошные лимфатические узлы региональными к прямой кишке, но не выделяет данную группу лимфатических узлов в отдельную, латеральную, группу. Согласно мнению авторов данного руководства, прогностически значимым фактором является не локализация пораженных регионарных лимфатических узлов, а их количество (AJCC Cancer Staging Manual, 7th ed.). Рекомендации NCCN рекомендуют по возможности удалять или выполнять биопсию клинически подозрительных узлов за пределами области резекции. Однако расширенная лимфодиссекция не показана в случае отсутствия клинически подозрительных узлов. Руководящие принципы NCCN не рекомендует выполнять профилактическую лимфодиссекцию латеральных лимфатических узлов (NCCN, 2013). Европейское Европейского руководство общества по лечению медицинской рака онкологии прямой ESMO кишки объединяет лимфатические узлы вдоль внутренней подвздошной, запирательной и нижней прямокишечной артерий в группу латеральных лимфатических узлов и рекомендует включение в поля облучения латеральных лимфатических узлов в комплексном лечении местно-распространенного рака прямой кишки. Исключением могут являться лишь высоко расположенные опухоли прямой кишки (9-12 см от анального канала) ввиду низкой частоты поражения «латеральных» лимфатических верхнеампулярном отделе узлов независимо при от расположении категории Т, опухоли а в также незначительной частотой их поражения при категории T1-2 опухолей нижне- и среднеампулярного отделов. В рекомендациях также говорится о недостаточно полноценном изучении рисков поражения «латеральных» лимфатических узлов на пациентах западной популяции больных, в связи с чем авторы ссылаются на проведенные исследования в странах Азии. В основе японской классификации, наиболее точно отражающей степень регионарного поражения, лежит модель, основанная на путях регионарного метастазирования и подразумевает учет не только количества лимфатических узлов, вовлеченных в опухолевый процесс, но и степень удаленности лимфатических узлов от первичного опухолевого очага (Yamakoshi H., 1997). Согласно данной классификации, выделяют 3 стадии для восходящего и латерального метастазирования: 1) при восходящем пути: N1 – поражение лимфатических узлов вдоль верхней прямокишечной артерии и параректальных лимфатических узлов (узлы Герота); N2 – поражение промежуточных лимфатических узлов вдоль основного ствола нижней брыжеечной артерии; N3 – поражение главных или апикальных лимфатических узлов расположенных в месте ответвления нижней брыжеечной артерии от аорты. 2) при латеральном пути лимфооттока: N1 – поражение лимфатических узлов вдоль средней и верхней прямокишечной артерии; N2 – поражение латеральных узлов по ходу внутренней подвздошной артерии; N3 – поражение лимфатических узлов вдоль запирательной артерии. Данная классификация, предложенная японскими специалистами, направлена на точное планирование предстоящего объема оперативного вмешательства с учетом групп лимфатических узлов, подлежащих удалению при выполнении расширенной латеральной лимфодиссекции, общепринятой в Японии. Объем лимфодиссекции в соответствии с локализацией лимфатических узлов подразделяется на 4 вида (D0-D3): 1) D0 - неполное удаление узлов N1; 2) D1 – полное удаление узлов N1; 3) D2 – полное удаление узлов N1 и N2; 4) D3 - удаление парааортальных и паракавальных лимфатических узлов до нижнего края поперечной ободочной кишки, а также заключается в удалении всей жировой ткани, содержащей лимфатические узлы и лимфатические сосуды вокруг крупных абдоминальных и тазовых сосудов (то есть вдоль аорты ниже нижнего горизонтальной ветви двенадцатиперстной кишки, нижней брыжеечной артерии, верхней прямокишечной артерии, общих подвздошных и внутренних подвздошных артерий с их ветвями). Удаление лимфатических узлов вдоль наружных подвздошных артерий и паховых областей показано лишь в случае их явного метастатического поражения. Согласно японскому руководству по лечению колоректального рака JSCCR, лимфодиссекции D3 выполняется при опухолях категории Т3 и более вне зависимости от N-стадии, а также при клинических признаках поражения региональных лимфатических узлов вне зависимости от степени местного распространения опухоли (JSCCR, 2010). Выполнение тотальной мезоректумэктомии также является стандартным методом лечения прямой кишки. рака Данный объем оперативного вмешательства в Японии снизил частоту тазовых рецидивов на 50% и улучшил показатели 5-летней выживаемости на 8-9 % (Sugihara K., 2006). До настоящего времени существует множество противоречивых мнений относительно необходимости выполнения расширенной лимфодиссекции. Расширенная лимфодиссекция, выполняемая опытными хирургами, обеспечивает лучший местный контроль по сравнению со стандартной ТМЭ (Kusters et al., 2009). Кроме того, почти 45% выживаемости достигается путем выполнения расширенной лимфодиссекции в случае поражения латеральных лимфатических узлов даже без предоперационной химиолучевой терапии, что способствует снижению частоты развития местных рецидивов. Схожие данные были представлены и многими отечественными исследователями. По данным Ильина К.С. и Синенченко Г.И. с соавт., 5летняя выживаемость при выполнении аорто-подвздошно-тазовой диссекции составляет 63,3%, что при выполнении стандартного оперативного вмешательства не превышает 47,4% (Ильин К.С., 2007; Синенченко Г.И. с соавт., 2007). Одной из основных причин отказа от выполнения расширенной латеральной лимфодиссекции в западных странах является то, что при выполнении данного оперативного вмешательства, по мнению многих авторов, наблюдается большой процент случаев возникающих расстройств мочеиспускания, половых расстройства (Nagawa H, 2001, Georgiou P.,2009), а также тот факт, что ЛЛД сопровождается большей кровопотерей и большей продолжительностью операции. Hojo с соавторами доложили о проведенном исследовании на 160 пациентах, перенесших оперативное вмешательство и латеральную лимфодиссекцию по поводу рака нижнеампулярного отдела прямой кишки, и показали уменьшение частоты рецидивов при данной тактике до 6,5% при стадии Duke B и до 25% при стадии Dukes C по сравнению с 25% и 45%, соответственно, после стандартного оперативного вмешательства (Hojo K., 1989). Однако автор также доложил и о том, что, несмотря на лучшие онкологические результаты после выполнения расширенной лимфодиссекции, дизурические и половые расстройства наблюдались у 4045% по сравнению с 8-10% при выполнении стандартных оперативных вмешательств. Moriya с соавторами также, как и их западные предшественники доложили о том, что расширенная хирургия неизбежно приводит к более длительному времени операции, большей кровопотере, высокой частоте мочеполовых расстройств (Moriya, 1989). По причине повреждения тазовых нервных сплетений, возникающих при выполнении латеральной лимфодиссекции, дизурические расстройства возникали у 30-70% пациентов, половая дисфункция обнаруживалась в 80-100% случаев, что существенно ухудшало качество жизни таких больных. При этом F.Michelassi считал, что мочеполовые расстройства после выполнения расширенных лимфодиссекций, встречаются намного реже, лишь в 18% наблюдений. Sugihara c соавт. доложили о том, что нервосохраняющая хирургия может снизить частоту мочеполовых расстройств без негативного влияния на онкологические результаты. В их работе было доложено об отличной или хорошей выделительной функции в 98% случаев, у 68 % больных не наблюдалось эякуляторных расстройств, а у 90% не было проблем с эрекцией после перенесенной нервосохранной операции. После данной работы оперативное лечение с нервосохраняющей расширенной лимфодиссекцией стало стандартом лечения местно-распространенного рака прямой кишки в Японии. В 2011 году группа авторов из Японии доложила об успешном выполнении видеоассистированной резекции прямой кишки + ТМЭ расширенной лимфодиссекцией неоадъювантной химиолучевой 14 больным терапии (Konishi после T, и перенесенной 2011). Средняя кровопотеря составила 25 мл, средняя продолжительность оперативного вмешательства 413 (277-596) минут. Среднее количество удаленных лимфатических узлов на 1 больного составило 23. В восьми случаях в удаленных латеральных лимфатических узлах наблюдались метастатические изменения. В течение последующего наблюдения (8-43 месяцев) все 14 пациентов были живы, данных за рецидив заболевания обнаружено не было. По мнению А.А. Троицкого, выполнение расширен- ной латеральной лимфаденэктомии не приводит к значимому увеличению частоты развития послеоперационных осложнений, которые в работе составили не более 46,7% в основной группе против 30,0% в контрольной группе (Троицкий А.А., 2007). При этом выполнение расширенной лимфодиссекции сопровождалось увеличением количества больных с образованием лимфоцеле в полости малого таза, а также повышением частоты развития спаечной кишечной непроходимости в отдаленных результатах. Также автор отметил, что расширенная лимфодиссекция сопровождается большей кровопотерей по сравнению со стандартной операцией и незначительному увеличению продолжительности оперативного вмешательства. Выполнение нервосберегающей операции при выполнении расширенной лимфодиссекции позволяет снизить уровень мочеполо- вых расстройств при операциях по поводу рака прямой кишки до 30%, причем максимально полное сохранение элементов вегетативной нервной системы таза ведет к лучшим функциональным результатам. П.В. Царьков с соавт, настаивающие на выполнении расширенных лимфодиссекций с применением нервосберегащей предотвращения частоты мочеполовых расстройств, техники для сравнили в своем исследовании непосредственные и отдаленные результаты хирургического лечения пациентов, страдающих раком прямой кишки, с применением нервосберегающей техники и без нее (Царьков П.В. с соавт., 2002). Было показано полное восстановление мочеиспускания у пациентов группы нервосберегающих операций и лучшие результаты эректильной и эякуляторной функции по сравнению с теми больным, которым была выполнена стандартная расширенная лимфодиссекция. Группа исследователей Кореи ретроспективно проанализировали результаты лечения 2263 больных раком нижне- и среднеампулярного отдела прямой кишки (H.K. Oh et al., 2014). В исследование вошли 66 пациентов, перенесших хирургическую операцию с латеральной лимфодиссекцией после проведенной неоадъювантной химиотерапии. факторы риска развития Авторы рассматривали латеральных рецидивов в соответствии с уменьшением размеров латеральных лимфатических узлов в ответ на химиолучевую терапию. Сохраняющиеся латеральные лимфатические узлы более чем 5 мм диаметром после химиолучевой терапии расценивались как метастатические, в то время как ЛУ, ответившие на химиолучевую терапию менее 5 мм в диаметре. Мультивариантный анализ показал, что диаметр латерального лимфатического узла по короткой оси, измеряемый до ХЛТ и после нее, является значительным и независимым фактором риска возникновения метастазирования в латеральных лимфатических узлах. Медиана наблюдения за пациентами составила 39,3 (3,5–87,2) месяца. Прогрессирование заболевания наблюдалось у 23 пациентов (34,8%), включая системное прогрессирование у 14 (21,2%), локальный рецидив и системное прогрессирование у 6 (9,1%), только местный рецидив у 3 больных (4,5%). Рецидивы возникали реже у пациентов с латеральными узлами, ответившими на химиолучевую терапию, чем у больных, у которых латеральные лимфатические узлы не отреагировали на лечение (20% (6 из 30) против 47,2% (17 из 36). 5-летняя общая выживаемость и 5 – летняя безрецидивная выживаемость были ниже у пациентов со стойкими положительными латеральными узлами (44,6% против 77,1% и 33,7% против 72,5%, соответственно). Проведенное исследование показало, что риск метастазирования в латеральные лимфатические узлы был значительно выше, а онкологические результаты значимо хуже у пациентов с сохраняющимся увеличением лимфатических узлов после проведенной неоадъювантной химиолучевой терапии. Также в исследовании было показано, что только размер лимфатического узла, определяемый после ХЛТ, является предиктором возникновения латеральных метастазов. В то же время такие показатели как степень дифференцировки опухоли, величина Т и N, пол, уровень РЭА, по мнению исследователей, не дают возможности оценить факторы риска метастазирования в латеральные узлы после проведенной ХЛТ. На основании этих данных, авторы предлагают изменить показания к расширенной лимфодиссекции, основываясь на размерах латеральных лимфатических узлов, рассчитанных по данным МРТ после неоадъювантной ХЛТ. В Японском мета-анализе, представленном в 2013 году, были описаны результаты лечения 944 пациентов раком прямой кишки, перенесших радикальное лечение с 1975 по 2004 годы (Kinugasa T., 2013). Пациентам при наличии МРТ-признаков поражения латеральных лимфатических узлов было проведено оперативное вмешательство с латеральной лимфодиссекцией. У 645 пациента опухоль располагалась выше уровня тазовой брюшины, у остальных 349 – ниже тазовой брюшины. Латеральная группа лимфатических узлов была разделена на две группы – первую группу составили лимфатические узлы вдоль внутренней подвздошной артерии, вторая была представлена запирательными лимфатическими узлами. Было установлено, что при локализации опухоли выше тазовой брюшины частота поражения латеральных лимфатических узлов в два раза меньше, чем при низких опухолях (7,5% из 126 пациентов и 14,5% из 324 больных, соответственно). Также в исследовании показано, что лишь у 17,3% больных с опухолями ниже тазовой брюшины и глубиной поражения Т3-Т4 имелось метастатическое поражение латеральных лимфатических узлов. Также отмечалось поражение латеральных лимфатических узлов без метастатического поражения лимфатических узлов мезоректума у 13 пациентов, что составило 5,9% из 450 пациентов (в 8 случаях в узлах вдоль внутренней подвздошной артерии и в 5 случаях – в лимфатических узлах запирательной группы). Метастатическое поражение мезоректальных лимфатических узлов является неблагоприятным прогностическим фактором поражения латеральных лимфатических узлов. У 25% больных метастатическим поражением мезоректальной клетчатки было выявлено поражение латеральных лимфатических узлов. Авторы настаивают на детальном предоперационном стадировании опухолевого процесса с целенаправленным выявлением пораженных латеральных лимфатических узлов на основании данных магнитно-резонансной томографии. Исследователи говорят о необходимости выполнения либо селективной, либо билатеральной тазовой лимфодиссекции в случае обнаружения пораженных латеральных лимфатических узлов, а также при наличии поражения мезоректальных лимфатических узлов в случае локализации опухоли ниже тазовой брюшины. Сторонником наиболее агрессивной лечебной тактики в лечении рака прямой кишки является T. Konishi, который с целью предотвращения развития местных рецидивов у пациентов с явными метастатическими изменениями в латеральных лимфатических узлах считает перспективной задачей выполнение как предоперационной химиолучевой терапии, так и выполнение оперативного вмешательства расширенной лимфодиссекцией (Konishi T., 2010). с ТМЭ, дополненного 1.5. Современные методы визуализации регионарных лимфатических узлов при раке прямой кишки К сожалению, до настоящего времени не существует методики, однозначно позволяющей выявить поражение регионарных лимфатических узлов при раке прямой кишки. Одним из основных критериев, позволяющих косвенно судить о метастатическом поражении лимфатического узла, является его размер. Общепринято полагать, что верхней границей нормы является 10 мм в наибольшем измерении. В то же время, размеры лимфатических сосудов не всегда является критерием их вовлеченности в опухолевый процесс или интактности (Al-Sukhni E., 2012). Mukesh G. Harisinghani с соавт. в современном атласе лимфатической системы указывает следующие критерии поражения лимфатических узлов (Mukesh G. Harisinghani, 2013): 1) округлая форма - лимфатические узлы овоидной формы чаще всего обладают доброкачественностью в противоположность лимфатическим узлам округлой формы, которые чаще бывают злокачественными (Mukesh G. Harisinghani, 2013); 2) неравномерная интенсивность сигнала на T2 – взвешенных изображениях при МРТ, свидетельствующая об опухолевой инфильтрации лимфатического узла; 3) наличие центра пониженной плотности в лимфатическом узле при компьютерной томографии, свидетельствующие о некротических изменениях. Автор также считает размеры лимфатических узлов недостоверным критерием их пораженности, говоря о том что для разных областей понятие пораженного лимфатического узла может быть разным. По мнению исследователя, размер внутренних подвздошных лимфатических узлов более 10 мм в диаметре говорит об их поражении, в то время как 15 мм для паховых лимфатических узлов чаще всего будет являться вариантом нормы. Исследованием зависимости размеров лимфатических узлов и вероятности их метастатического поражения при раке прямой кишки занимались H.Kotanagi с соавторами (H.Kotanagi et al., 1993). Работа была проведена на 46 пациентах, общее количество исследованных узлов составило 1064. При патоморфологическом исследовании лимфатических узлов, в 13% случаев (133 лимфатических узлах) были выявлены опухолевые клетки. Параректальные узлы размерами более 10 мм в диаметре в большинстве случаев были метастатическими, однако в 50% случаев пораженные узлы были менее 5 мм в диаметре. По данным приведенного исследования, индикатором размер его лимфатического метастатического узла не поражения. являлся надежным Лимфатические узлы размером менее 5 мм в диаметре может быть опухоль - положительными, а более крупные могут быть реактивно изменены. В исследованиях было показано, что в лимфатические узлы менее 5 мм в диаметре были метастатически пораженными в 15% случаев (Brown G.,2003; Kim J.H.,2004). Для оценки местного распространения опухоли используется эндоректальное ультразвуковое исследование прямой кишки (ЭРУЗИ). Несмотря на то, что данное исследование имеет явное преимущество в оценке степени инвазии стенки прямой кишки по сравнению с компьютерной томографией и МРТ (с достоверностью 80-95% по сравнению с 65-75% по данным КТ и 75-85% МРТ), точность в оценке статуса регионарных лимфатических узлов данной методики уступает. W. Hong с соавторами указывает на высокую достоверность ЭРУЗИ (94%) в отношении категории Т. Что касается диагностики поражения регионарных лимфатических узлов, данные остаются неутешительными – 45% (W.Hong, 1998). Кроме того, в представленных наблюдениях речь идет лишь о параректальных, но не экстрамезоректальных лимфатических узлах. По данным ЭРУЗИ, лимфатические узлы принято трактовать пораженными в случае выявления округлых или овальных гипоэхогенных образований в параректальной клетчатке с пониженным сигналом (Hulsmans FH, 1992). Наличия микрометастаза в лимфатическом узле не изменяет его сонографических характеристик. Если судить о поражении лимфатического узла, основываясь только на его размеры, вероятность наличия в нем метастатических изменений составляет 50-70%, вероятность поражения лимфатического узла менее 4 мм в диаметре составляет менее 20% (Beynon J,1989). Значительным недостатком метода ЭРУЗИ в 14% является невозможность ее выполнения в случае опухолевого стеноза (Saitoh N, 1986). По данным M. Rodrigez с соавт., выполнившему ЭРУЗИ 43 пациентам с ректальным раком, точность методики составила 79% в оценки степени инвазии опухоли, в определении статуса регионарных лимфатических улов – 74,4%. Авторы также указывают на предоперационную химиолучевую терапию как на фактор, ухудшающий визуализацию вследствие постлучевого фиброза (M.Rodrigez, 1999). Puli с соавт. в стадировании опухолевого процесса по данным 35 источников на 2732 пациентах относительно категории использование ЭРУЗИ оценки N показал, что является важной диагностической методикой для метастазирования в регионарные лимфатические узлы с чувствительностью 73,2% и специфичностью 75,8% (Puli et al., 2009). Gali с соавт. на основании изучения 10 статей на 642 пациентах установил чувствительность от 63% до 82% Dighe с соавт. провел анализ 15 исследований по категории N на 907 пациентах с с использованием компьютерной томографии. Чувствительность исследования в оценке статуса регионарных лимфатических узлов находилась в диапазоне от 59 до 80%, специфичность исследования была от 66 до 86%. . Al-Sukhni изучил эффективность применения МРТ для стадирования опухолевого процесса в отношении категории N (Al-Sukhni, 2012). Проведенный системный анализ на основании 12 исследований на 986 пациентах по категории N показал чувствительность методики от 69% до 84%, специфичность от 59% до 81%. По данным Lu с соавт., в результате 8 исследований, проведенных на 326 пациентах, чувствительность позитронно-эмиссионного исследования относительно статуса регионарного поражения при раке прямой кишки, составила 42,9%, специфичность 87,9% (Lu et al., 2012). Kim с соавт. на небольшой группе больных, 30 пациентах, страдающих раком прямой кишки, показал схожие результаты, используя позитронноэмиссионную компьютерную и рентгеновскую компьютерную томографию (ПЭТ/ КТ). Чувствительность методики не превышала 61%, специфичность 83%. Было проведено сравнение МРТ и ЭРУЗИ в оценке степени инвазии опухоли и регионарного поражения. В оценке степени инвазии обе методики показали высокую достоверность что касается идентификации лимфатического поражения как первый, так и второй методы были эффективными лишь у трети больных (H. Shafer, 1996). Таким образом, все вышеуказанные методики (ЭРУЗИ, КТ, МРТ) в оценке статуса регионарных лимфатических узлов в стадировании рака прямой кишки являются схожими по точности, при этом все они обладают низкой чувствительностью в определении пораженных узлов (верхняя граница доверительных интервалов менее 70%). (табл. 1.1) Таблица 1.1 Сравнительная оценка инструментальных методик в определении статуса регионарных лимфатических узлов Чувствительность ЭРУЗИ КТ МРТ 73.2% 70% 77% (70.6 - 75.6%) (59 – 80%) (69 - 84%) 75.8% 78% 71% (73.5 - 78.0%) (66 - 86%) (59 - 81%) Специфичность ПЭТ/КТ 61% 83% По мнению Ю.Б. Лишманова с соавт., применение ПЭТ с 18F-ФДГ для оценки регионарного метастазирования при раке прямой кишки не оправдано ввиду выраженной зависимости результата исследования от топографоанатомического расположения лимфатических узлов (Лишманов Ю.Б., 2010). По сведениям авторов, причиной неудовлетворительных результатов является малое количество опухолевых клеток в пораженном лимфатическом узле и, соответственно, сохранение его в неувеличенном размере (до 5 мм в диаметре). Второй причиной является расположение параректальных лимфатических узлов в непосредственной близости к первичной опухоли и редкое сливание узлов в конгломераты, что также затрудняет визуализацию. Согласно результатам специфичность авторов, исследования несмотря (96%), на достаточно чувствительность высокую методики не превышает 26%. D.J. Kim с коллегами провели сравнительный анализ МРТ и ПЭТ/КТ в диагностике регионарного метастазирования в предоперационном стадировании рака прямой кишки (Kim DJ, 2011). Исследование было проведено на 30 пациентах, которым были выполнены оба исследования, как МРТ с высоким разрешением, так и ПЭТ/КТ. Критерием поражения лимфатических узлов было их увеличение более чем на 8 мм по короткой оси, нечеткость контуров и неоднородность сигнала. Диагностическая ценность МРТ составила 94% чувствительности, 67% в специфичности. Положительная прогностическая ценность выявлена в 81%, отрицательная в 89%. Были получены 4 ложноположительных результата и 1 ложноотрицательный, полученный, скорее всего по причине наличия в лимфатическом узле микрометастазов. Чувствительность, специфичность, положительная и отрицательная прогностические ценности ПЭТ / КТ были 61%, 83%, 84%, 58% и 70%, соответственно. При применении ПЭТ/КТ были установлены 7 случаев ложноотрицательных результатов, 2 пациента были ложноположительными. чувствительностью Сочетание 94%, МРТ и специфичностью ПЭТ / 83%, КТ обладало положительная прогностическая ценность 89%, отрицательная прогностическая ценность 91%, и общая точность 90%, соответственно. В исследовании было показано, что МРТ в прогнозировании статуса лимфатических узлов является более чувствительной методикой, а ПЭТ/КТ обладает большей специфичностью. Сочетание обеих этих методик приводит к повышению чувствительности и специфичности методик в отношении визуализации регионарных лимфатических узлов. Е.В. Пережогин провел сравнительный анализ значимости КТ и ЭРУЗИ относительно категории T и N в предоперационном стадировании рака прямой кишки (Пережогин Е.В., 2004). В случае отсутствия признаков поражения регионарных лимфатических узлов, значимость ЭРУЗИ была связана лишь с их размерами. Гистологическое подтверждение метастатического поражения наблюдалось лишь при условии размеров лимфатических от 12-14 мм. Чувствительность метода составила около 80% при условии поражения 3 и более лимфатических узлов. По данным КТ, метастатический характер лимфатических узлов подтверждался в 88,2% случаев. Точность методики также зависела от размера узлов и количества. При одиночных и небольших размеров узлах значимость методики была существенно ниже. Автор полагает, что лишь комбинация обеих методик имеет существенное значение в дооперационном стадировании рака прямой кишки. С целью изучения путей лимфооттока при раке прямой кишки С.В. Канаев с соавт. провели лимфосцинтиграфию на 51 пациенте (Канаев С.В., 1988). Метастатическое поражение лимфатических узлов было доказано при патоморфологическом исследовании у 73% пациентов, их отсутствие – в 94% случаев, при этом специфичность методики составила 65%, чувствительность – 96%. Результаты применения радионуклидного метода были показаны при применении эндоскопической лимфосцинтиграфии (С.He, 1999). Авторы использовали в своей работе декстран, меченный (99m) Tc, вводя препарат паратуморозно под слизистую прямой кишки. При помощи гамма-камеры оценивалось распределение контрастного вещества. Чувствительность метода составила 97,1%, специфичность 25%. В четверти наблюдались ложноположительные случаев результаты, ложноотрицательные непрямой магнитно-резонансной отмечены в 8,3% случаев. Методика предоперационной лимфографии таза (Рутковский Е.А., 2004), основанная на принципе избирательного накопления парамагнетика в лимфоидной ткани, по данным авторов, позволила установить правильный диагноз метастатического поражения регионарных лимфатических узлов в 75% случаев. Отсутствие метастазов было подтверждено в 83% случаев. Авторы высказали предположение о том, что по изменению направления оттока лимфы, выявленного при магнитно-резонансной лимфографии, можно судить о его блоке по восходящему пути, и может служить показанием к выполнению расширенной лимфодиссекции. Последние годы в иностранных периодических источниках отмечается появление немногочисленных работ, посвященных успешному применению гибридной однофотонной эмиссионной и рентгеновской компьютерной томографии (ОФЭКТ/КТ) с целью поиска «сторожевых», или «сигнальных», лимфатических узлов в диагностике регионарного поражения при раке прямой кишки (Wang Y.N. с соавт., 2011). Данные работы немногочисленны и основаны на небольшом количестве пациентов с ранними опухолями прямой кишки. Несмотря на значительный прорыв в лучевой диагностике рака прямой кишки за последние годы, общепринятые методы исследования, хотя и обладают достаточно высокой степенью чувствительности и специфичности, не превышают 85% достоверности. Выполнение ЭРУЗИ, а также МРТ, принятой за «золотой стандарт» во всем мире, направлены в большей степени на оценку степени местного распространения. КТ выполняется в большей мере для исключения отдаленного метастазирования и имеет погрешности в определении степени регионарного метастазирования. 1.6. Выводы по обзору литературы Таким образом, несмотря на значительные успехи в лечении местно- распространенного рака прямой кишки, проблема местных рецидивов остается актуальной. Одним из наиболее важных прогностических факторов развития местных рецидивов при раке прямой кишки является метастазирование в регионарные лимфатические узлы. В течение многих лет необходимость выполнения тотальной мезоректумэктомии и высокой перевязки нижней брыжеечной артерии с целью воздействия на лимфатические узлы параректальной области и лимфатические узлы, следующие по восходящему пути лимфооттока вдоль нижней брыжеечной артерии, не вызывает сомнения. Однако вопрос воздействия на латеральную группу лимфатических узлов до настоящего времени является до конца не решенным и спорным. Европейский и американский подходы заключается в проведении предоперационной химиолучевой терапии, японские специалисты настаивают на выполнении расширенной латеральной лимфодиссекции. Несмотря на схожие отдаленные результаты, как первый, так и второй подходы имеют как недостатки, так и преимущества друг перед другом. Общепринято полагать, что выполнение латеральной лимфодиссекции является более агрессивным подходом в хирургическом лечении рака прямой кишки и неизбежно приводит к повышению частоты дизурических и половых расстройств, сопровождается большей интраоперационной кровопотерей и большей длительностью операции, в то время как химиолучевое лечение приводит к постлучевым осложнениям и нередко бывает неэффективным в отношении латеральной группы лимфатических узлов, что может являться причиной возникновения латеральных рецидивов. Кроме того, существующие методы дооперационного стадирования опухолевого процесса прямой кишки, такие как МРТ, КТ и ЭРУЗИ, не обладают должной чувствительностью и специфичностью в отношении оценки регионарного метастазирования в целом и поражения латеральной группы лимфатических узлов в частности. Данный факт свидетельствует о необходимости поиска новых методов диагностики, выявлении факторов риска и неблагоприятного метастазирования при прогноза раке прямой в отношении кишки, а латерального также более дифференцированному подходу к выбору лечебной тактики. Проведенный анализ литературы показал, что артерии прямой кишки, вдоль которых проходят основные пути лимфооттока, обладают вариабельностью. Отсутствие или наличие средней прямокишечной артерии, вдоль которой осуществляется лимфодренаж по латеральному пути лимфоооттока, может являться прогностическим фактором отсутствия или наличия латерального метастазирования. Кроме того, существующие общепризнанные методы стадирования опухолевого процесса прямой кишки, такие как КТ, МРТ и ЭРУЗИ, не обладают должной чувствительностью и специфичностью в отношении оценки степени поражения регионарного метастазирования в целом и поражения латеральной группы лимфатических узлов в частности. Данный факт свидетельствует о необходимости поиска новых методов диагностики, выявлении факторов риска и неблагоприятного прогноза в отношении латерального метастазирования при раке прямой кишки, а также более дифференцированного подхода к выбору лечебной тактики. Несмотря на существующие пробелы в знаниях об эмбриогенезе лимфатической системы органов малого таза и прямой кишки, рядом авторов достоверно доказано тесная взаимосвязь лимфатической и кровеносной систем малого таза. Проведенный анализ литературы показал, что как лимфоотток, так и кровоснабжение прямой кишки имеет индивидуальные особенности. Поиск методик оценки кровоснабжения прямой кишки и изучение индивидуальных анатомических особенностей может позволить прогнозировать возможность метастазирования в латеральные группы лимфатических узлов и позволит получить возможность более тщательно дифференцировать подход к хирургическому и комбинированному лечению местно-распространенного рака прямой кишки. ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Задачи исследования Характеристика больных Изучить вариантную анатомию средней прямокишечной артерии Пациенты без опухолевых заболеваний органов малого таза, не страдающие раком прямой кишки, без выраженного системного атеросклероза (контрольная группа) Пациенты с гистологически верифицированным раком прямой кишки (основная группа) Кол-во Методы исследований больных 150 Рентгеновская компьютерная томография в ангиорежиме 175 Рентгеновская компьютерная томография в ангиорежиме Определить частоту и локализацию регионарных метастазов у больных раком прямой кишки с учѐтом индивидуальных особенностей кровоснабжения органа Пациенты с гистологически верифицированным раком прямой кишки (основная группа) 175 Магнитнорезонансная томография органов малого таза Провести анализ факторов, влияющих на частоту развития латерального метастазирования. Пациенты с гистологически верифицированным раком прямой кишки и установленными латеральными метастазами 37 Статистические методы Разработать комплексную модели оценки риска латерального метастазирования Пациенты с гистологически верифицированным раком прямой кишки (основная группа) 175 Логистическая регрессия 2.1. Материалы и методы, примененные в исследовании, представлены в табл. 2.1. 2.2. Характеристика пациентов С этой целью были сформированы две группы больных – контрольная и основная. В контрольную группу больных (n=150 вошли пациенты, получавщие лечение в клинике факультетской хирургии ПСПБГМУ им. акад. И.П. Павлова в период с 2013 по 2015 годы. В основную группу больных (n=175) были включены только пациенты страдающие раком верхне-, нижне- и среднеампулярного отделов прямой кишки, получавшие лечение в ГБОУ ПСПБГМУ им. акад. И.П. Павлова в период с 2013 по 2015 годы и в ФГБУ «НИИ онкологии им. Н.Н. Петрова» в период с 2014 по 2015 годы. Критерием включения пациентов в контрольную группу явилось: - отсутствие онкологических заболеваний органов малого таза и прямой кишки; - отстутвие оперативных вмешательств на органах малого таза в анамнезе; - отсутствие проведения химиолучевой терапии на область малого таза; - отсутствие клинических и лабораторных признаков атеросклеротических изменений; - отсутствие противопоказаний к рентгенологическим исследованиям с применением внутривенного контрастирования. Большую часть пациентов, включенных в контрольную группу исследования, составили пациенты со злокачественными заболеваниями желудка и ободочной кишки – 36,7% (n=55) и 31,3% (n=47), соответственно (табл. 2.1). Все пациенты были информированы о цели и объеме предстоящего исследования. Предпосылкой к исследованию явилось либо исключение новообразований органов малого таза (как первичных, так и метастатических) , либо необходимость выполнения исследования с целью дообследования больного, либо добровольное желание пациента участвовать в исследовании. Каждым больным было подписано информированное согласие. Таблица 2.1 Нозологические формы пациентов контрольной группы (n=150) Нозологическая форма Абс. число % Рак желудка 55 36,7% Рак молочной железы 24 16,0% Рак поджелудочной железы 3 2,0% Рак ободочной кишки 47 31,3% Неопухолевые заболевания брюшной 21 14,0% полости В половой принадлежности контрольной группы больных преобладали мужчины – 58,7% (n=88), пациенты пожилого и старческого возраста составили 67,3% (n=101) (таб. 2.2). Таблица 2.2 Распределение пациентов контрольной группы по возрасту и полу Возраст Пол Контрольная группа больных (n=150) Абс.число % 20-40 41-60 61-75 76-90 Итого м 9 ж 5 м 19 ж 16 м 31 ж 26 м 29 ж 15 м 88 ж 62 14 35 57 44 150 6,0 3,3 12,7 10,7 20,7 17,3 19,3 10,0 58,7 41,3 9,3 23,4 38,0 29,3 100 Методология обследования пациентов контрольной группы Всем пациентам помимо стандартного лабораторно-инструментального набора исследований выполнялась компьютерная томография органов малого таза. Режимы и параметры выполнения рентгеновской компьютерной томографии с прицельным изучением сосудов таза: - стандартный протокол «Pelvis»; - внутривенным болюсное контрастирование препаратами Омнипак 350 или Ультравист 370 (1 мл контрастного вещества/1 кг массы тела исследуемого); - скорость введения 3-5 мл в секунду; - толщина среза 1,25 мм в артериальную фазу с построением многоплоскостных реконструкций (MPR) в сагиттальной, фронтальной и аксиальной плоскостях, а также используя режимы MIP (Max Intensitive Point) с толщиной среза 20 мм и объемные изображения VRT (Volume Rendering Technique). - венозной фаза – отсроченное сканирование через 40 секунд (толщина среза 2,5 мм для уменьшения дозы облучения). Методика наглядного отображения результатов обследования пациентов контрольной группы Результаты, полученные после проведения КТА пациентам основной группы, отображались на разработанной схеме картирования вариантов кровоснабжения прямой кишки (приложение 2). 2.3. Характеристика пациентов основной группы В основную группу больных (n=175) были включены только пациенты страдающие раком верхне-, нижне- и среднеампулярного отделов прямой кишки, получавшие лечение в ГБОУ ПСПБГМУ им. акад. И.П. Павлова в период с 2013 по 2015 годы и в ФГБУ «НИИ онкологии им. Н.Н. Петрова» в период с 2014 по 2015 годы. Критерием включения пациентов в основную группу явилось: - гистологически верифицированная аденокарцинома прямой кишки; - первичная опухоль, отсутствие вмешательств (как хирургических, так и лучевых) на органах малого таза; - отсутствие противопоказаний к выполнению МРТ органов малого таза; - отсутствие противопоказаний к выполнению КТ с применением внутривенного контрастирования. Все пациенты были информированы о цели и объеме предстоящего исследования, каждым больным было подписано информированное согласие. Основная группа больных по половому и возрастному соотношению была схожа с контрольной группой. Соотношение пациентов по полу было схожим, незначительно преобладали мужчины – 50,3% (n=88) и 49,7% (n=87), соответственно. Большую часть основной группы составили пациенты пожилого и старческого возраста – 65,1%% (n=114). Распределение пациентов основной группы по возрасту и полу представлено в таблице 2.3. Таблица 2.3 Распределение пациентов основной группы в зависимости от пола и возрастной группы Возраст Основная группа больных (n=175) Пол 20-40 41-60 61-75 76-90 Итого Среди Абс.число м 7 ж 5 м 21 ж 28 м 37 ж 24 м 23 ж 30 м 88 ж 87 пациентов % 4,0 12 2,9 12,0 49 16,0 21,2 61 13,7 13,1 53 17,1 50,3 175 основной группы 49,7 преобладали 6,9 28,0 34,9 30,2 100 больные с локализацией опухоли в нижнеампулярном отделе – 44,6% (n=78) и средней степени дифференцировки – 48% (n=84), встречаемость низко- и высокодифференцируемых опухолей была примерно одинаковой – 22,3% (n=39) и 29,7% (n=52), соответственно. 58,9% (n=103) пациентов основной группы страдали местнораспространенными опухолями. Доля пациентов с признаками отдаленных метастазов составила 33,1% (n=58). Всем пациентам основной группы выполнялся анализ крови на раковый эмбриональный антиген (РЭА). Повышение онкомаркера РЭА отмечено в большинстве случаев – 64,0% (n=112) (таб. 2.4). Таблица 2.4 Распределение пациентов основной группы по уровню локализации опухоли, степени дифференцировки, стадии и уровню онкомаркера РЭА Критерии Основная группа (n=175) Абс. Число % верхнеампулярный отдел 36 20,6 среднеампулярный отдел 61 34,8 нижнеампулярный отдел 78 44,6 G1 39 22,3 G2 84 48,0 G3 52 29,7 T1-2 72 41,1 T3-4 103 58,9 N0 77 44,0 N1-3 98 56,0 M0 117 66,9 M1 58 33,1 < 3,5 нг/мл 63 36,0 > 3,5 нг/мл 112 64,0 Локализация опухоли: Степень дифференцировки: Степень инвазии опухоли: Степень лимфатической инвазии: Наличие отдаленных метастазов: Уровень онкомаркера РЭА: Стадирование опухолей осуществлялось в соответствии с седьмым изданием международной классификации «TNM» (UICC, седьмое издание, 2011). Технические параметры при проведении МРТ пациентам основной группы. Режимы и параметры выполнения рентгеновской компьютерной томографии с прицельным изучением сосудов таза: - Т2-взвешенные изображения в сагиттальной и аксиальной плоскостях - толщина среза 5мм, расстоянием между срезами 0 мм - поле обзора (FOV) 27х27 см, - Т2-взвешенные изображения высокого разрешения (high resolution), выполненные перпендикулярно длинной оси кишки на уровне опухоли и 5 см проксимальнее, с толщиной среза 3мм и расстоянием между срезами 0 мм, полем обзора (FOV) 18х18см; - для низко расположенных опухолей использовались Т2- взвешенные изображения высокого разрешения в корональной плоскости, выполненные вдоль оси анального канала для оценки глубины опухолевой инвазии и состояния сфинктерного аппарата; для оценки лимфатических узлов – диффузионно - взвешенные изображения. Форма отчета при выполнении МРТ пациентам основной группы Описание результатов исследования осуществлялось в соответствии с формой протокола МРТ-исследования прямой кишки, разработанного группой авторов Канадского общества рака, которая была переведена и адаптирована под исследование. Протокол включал в себя детальное описание опухолевого процесса по следующим параметрам: - локализация опухоли; - категория T, отношение к мезоректальной фасции, экстрамуральная глубина инвазии, экстрамуральная сосудистая инвазия; - мезоректальные лимфатические узлы и опухолевые депозиты с учетом расстояния до мезоректальной фасции и их локализации - экстрамезоректальные лимфатические узлы (в случае обнаружения подозрительных лимфатических узлов отражалась их локализация). Критериями поражения лимфатических узлов являлись: - неравномерность контуров, - диффузная интенсивнось сигнала и/или увеличение размера узла более чем на 10 мм по короткой оси. Форма отчета представлена в приложении 1. Методика наглядного отображения результатов обследования пациентов основной группы Результаты, полученные после проведения МРТ и КТА пациентам основной группы, отображались на разработанной схеме картирования локализации опухоли, пораженных лимфатических узлов, вариантов кровоснабжения прямой кишки (приложение 2). 2.4. Методы статистической обработки материала. Полученные в процессе выполнения работы клинические результаты обрабатывались c использованием программной системы STATISTICA for Windows (версия 9), а также Microsoft Office 2010 (Word, Excel). Сопоставление частотных характеристик (пол, диагноз, категории T, N, M, степень дифференцировки опухоли, наличие средней прямокишечной артерии и т.д.) качественных показателей проводилось с помощью комплекса непараметрических методов 2, 2 с поправкой Йетса (для малых групп), критерия Фишера. Сравнение количественных параметров (возраст, уровень онкомаркера РЭА) в исследуемых группах осуществлялось с использованием критериев Манна-Уитни, медианного хи-квадрат и модуля ANOVA (Боровиков В. П., 2001; Реброва О.В., 2002). Доверительные интервалы принципиально важных показателей в выводах рассчитывались на основе углового преобразования Фишера. Для прогнозирования риска появления латеральных метастазов после выявления показателей, достоверно связанных с метастазированием по латеральному пути лимфооттока, комплексная модель была разработана на основе логистической регрессии. Критерием статистической достоверности получаемых выводов мы считали общепринятую в медицине величину p<0,05 (Юнкеров В.И., Григорьев С.Г, 2005). Устойчивый вывод о наличии или отсутствии достоверных различий мы формулировали тогда, когда мы имели одинаковые по сути результаты по всему комплексу применявшихся критериев. ГЛАВА 3 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ 3.1 Результаты исследований пациентов контрольной группы При анализе проведенной компьютерной томографии с внутривенным контрастированием в ангиорежиме пациентов контрольной группы средняя прямокишечная артерия наблюдалась у 34,1% пациентов (n=51), преимущественно у мужчин, чем у женщин – 20,1%(n=30) и 14,0% (n=21) (табл.3.1). Таблица 3.1 Распределение больных с визуализированной СПА в зависимости от возраста и пола Возраст Контрольная группа больных (n=150) Пол Абс.число 20-40 41-60 61-75 76-90 Итого м 4 ж 3 м 10 ж 7 м 9 ж 6 м 7 ж 5 м 30 ж 21 % 7 17 15 12 51 2,7 2,0 6,7 4,7 6,0 4,0 4,7 3,3 20,1 14,0 4,7 11,3 10,0 8,0 34,0% При изучении соотношения больных с визуализированной СПА и пациентов с ее отсутствием в конкретных нозологических группах, распределение больных было примерно поровну. Не наблюдалось зависимости наличия СПА от имеющейся патологии – при преобладании больных, страдающих раком желудка и раком ободочной кишки 37,2% (n=55) и 29,4% (n=47), большая часть пациентов с обнаруженной СПА относилась к данной подгруппе больных. Факторы пола, возраста и диагноза не являлись прогностически значимым критерием наличия или отсутствия СПА (p≥0,05). Распределение пациентов, у которых была визуализирована средняя прямокишечная артерия по нозологическим формам, было следующим (табл.3.2): Таблица 3.2 Распределение больных с визуализированной СПА (n=51) в зависимости нозологической формы Нозологическ Абс.число % больных с Количество % больных с ая форма Обследован обнаруженной пациентов с обнаруженной ных больных СПА от общего обнаруженно числа й СПА СПА от конкретной пациентов нозологическо группы й формы Рак желудка 55 37,2 19 34,5 Рак молочной 24 15,7 8 33,3 3 2,0 1 33,3 47 29,4 15 31,9 21 15,7 8 38,0 железы Рак поджелудочно й железы Рак ободочной кишки Неопухолевые заболевания брюшной полости Всего: 150 100 100 51 При подробном изучении анатомических особенностей ветвления СПА было установлено, что имеется анатомическая вариабельность ее отхождения. Почти в половине случаев СПА являлась отдельной ветвью переднего ствола внутренней подвздошной артерии – 49,9% (n=25), реже всего СПА отходила в виде тонкой ветви от запирательной артерии – 17.6% (n=9). Билатеральной локализации СПА как ветви запирательной артерии не определялось. Среди пациентов, у которых была обнаружена средняя прямокишечная артерия, билатеральное ее расположение установлено лишь в 25,3% (n=13). СПА была визуализирована с левой стороны чаще, чем справа – 41,2% (n=21) и 33,3% (n=17), соответственно (табл. 3.3) Таблица 3.3 Распределение больных с визуализированной СПА (n=51) в зависимости от варианта отхождения Варианты отхождения Билатерально Абс. число % Унилатерально Унилатерально справа Абс. число Всего слева % Абс. число % Абс. число % Отдельная ветвь переднего ствола 8 15,7 7 13,7 10 19,6 25 49,0 5 9,8 6 11,8 6 11,8 17 33,3 внутренней подвздошной артерии Ветвь внутренней половой артерии Ветвь запирательной 0 0 4 7,8 5 9,8 9 17,6 13 25,3 17 33,3 21 41,2 51 100 артерии Всего: На рис.3.1 представлена вариантная анатомия кровоснабжения прямой кишки по данным компьютерной томографии органов малого таза с контрастным усилением на планарных изображениях (корональные срезы) в режиме MIP. Рис. 3.1. Компьютерная томография малого таза в ангиорежиме, режим MIP: средняя прямокишечная артерия (белая стрелка) унилатерально справа, отходит отдельной ветвью от внутренней подвздошной артерии дистальнее отхождения правой запирательной артерии (черная стрелка) На рис.3.3 представлена вариантная анатомия кровоснабжения прямой кишки по данным компьютерной томографии органов малого таза с контрастным усилением на планарных изображениях (корональный и сагиттальный срезы), а также в режиме VRT. Б А В Рис.3.3. Компьютерная томография малого таза в ангиорежиме, MIP: А – корональная проекция: средняя прямокишечная артерия (белая стрелка) отходит отдельной ветвью от внутренней половой артерии унилатерально справа, дистальнее отхождения правой запирательной артерии; Б – тот же вариант, сагиттальный проекция; В – тот же вариант, режим VRT (внутренняя половая артерия отмечена пунктирной стрелкой, средняя прямокишечная - белой стрелкой). Схематично основные варианты ответвления средней прямокишечной артерии представлены на рис. 3.1 А Б В Рисунок 3.1. Основные варианты отхождения средней прямокишечной арте рии (схематично): А – от внутренней половой артерии; Б – от запирательной артерии; В – отдельной ветвью от переднего ствола внутренней подвздошной артерии; 1 - общая подвздошная артерия; 2 - наружная подвздошная артерия; 3 - внутренняя подвздошная артерия; 4 - верхняя ягодичная артерия; 5 запирательная артерия; 6 - нижняя мочепузырная артерия; 7- средняя прямокишечная артерия; 8 - внутренняя половая артерия; 9 - нижняя прямокишечная артерия. Режим перестройки изображения VRT позволял в ряде случаев более точно определить место отхождения СПА по отношению к ветвям внутренней подвздошной и внутренней половой артерии, чем на обычных, планарных изображениях в режиме MIP. В 9,8% случаев (n=5) наблюдалось анастомозирование ветвей внутренней половой или средней прямокишечной артерии с одной из ветвей верхней прямокишечной артерии (рис.3.4) Рис.3.4. Компьютерная томография органов малого таза: А – режим MIP, корональная проекция: средняя прямокишечная артерия (черная стрелка) визуализируется конечной ветвью от внутренней половой артерии (черная стрелка) унилатерально справа. Определяется анастомозирование ветви верхней прямокишечной артерии с внутренней половой выше отхождения средней прямокишечной (белая стрелка); Б – тот же вариант, режим VRT; В схематичное изображение анастомозирования средней прямокишечной артерии с одной из ветвей верхней прямокишечной артерии (9) Тщательное изучение сосудистой архитектоники СПА на основе выполненной компьютерной томографии в разных плоскостях ряде случаев позволяло выявить СПА, представленной не одной, а несколькими ветвями. На рисунке 3.4 представлена сосудистая анатомия СПА, визуализированная в различных плоскостях. Наличие дополнительной, меньшей по диаметру, «задней» ветви СПА можно определить лишь на аксиальном срезе. А Б Рис.3.5. Пациентка К., 72 лет. Компьютерная томография органов малого таза, режим MIP: А – корональная проекция: средняя прямокишечная артерия (белые стрелки) визуализируется единственной конечной ветвью от внутренней половой артерии. Б – аксиальная проекция, наличие дополнительной «задней» ветви средней прямокишечной артерии (черная стрелка) В ряде случаев, когда наблюдалось отсутствие СПА с обеих сторон, кровоснабжение всех отделов прямой кишки осуществлялось за счет верхней прямокишечной артерии, чьи ветви были представлены выраженной сетью артериальных сосудов, кровоснабжающих не только проксимальные ее отделы, но и средне-, и нижнеампулярные отделы прямой кишки (рис. 3.6). А Б Рис. 3.6. А - Компьютерная томография органов малого таза, режим MIP: отсутствие средней прямокишечной артерии, визуализируется выраженная сеть верхней прямокишечной артерии (белые стрелки), кровоснабжающей дистальные отделы прямой кишки; Б – схематичное изображение выраженной сети верхней прямокишечной артерии: 1 - общая подвздошная артерия; 2 - наружная подвздошная артерия; 3 - внутренняя подвздошная артерия; 4 - верхняя ягодичная артерия; 5 - запирательная артерия; 6 – верхняя прямокишечная артерия; 7- нижняя мочепузырная артерия; 8 внутренняя половая артерия; 9 - нижняя прямокишечная артерия. Анализ контрольной группы больных показал, что кровоснабжение прямой кишки обладает анатомической вариабельностью. Наличие СПА обнаружено лишь в 34,1% (n=51) больных. Лишь в 25,3% случаев (n=13) выявления СПА, артерия имеет билатеральное расположение, чаще всего наблюдается ее присутствие с одной, либо с другой стороны. Также наблюдаются и различные варианты ее отхождения от внутренней подвздошной артерии и ее ветвей. Возраст, пол, а также диагноз пациентов не являлся прогностически значимым показателем наличия или отсутствия СПА. Распределение больных с визуализированной СПА от общего количества исследуемых с конкретным заболеванием было примерно одинаковым. Выполнение компьютерной томографии органов малого таза в ангиорежиме в заданных параметрах позволяло установить анатомическую вариабельность как кровоснабжения прямой кишки в целом, так и варианты ветвления, отхождения и анастомозирования СПА в частности. Изучение вариабельности ветвления СПА, используя режимы MIP, VRT, с оценкой результата в нескольких проекциях (корональной, аксиальной и сагиттальной) в ряде случаев позволяло визуализировать дополнительные ветви СПА, не обнаруживаемые при оценке лишь в одной проекции. 3.2. Результаты обследования пациентов основной группы 3.2.1. Результаты МРТ-исследований пациентов основной группы По данным проведенной магнитно-резонансной томографии, клиническое поражение регионарных лимфатических узлов установлено у 56% (n=98) больных. Частота встречаемости метастазов в регионарные ЛУ при локализации опухоли в нижнеампулярном отделе была значительно выше, чем при других локализациях. Мезоректальные лимфатические узлы были поражены в 48% случаев (n=45) при нижнеампулярном раке прямой кишки и в 12,2% (n=13) и 19,4% (n=24) при верхне- и среднеампулярной локализации опухоли, соответственно. Метастазирование по восходящему пути лимфооттока наблюдалось в основном у пациентов с верхнеампулярным раком – в 9,2% (n=9) вдоль нижней брыжеечной артерии и в 5,1% (n=5) вдоль верхней прямокишечной артерии. Возникновения метастазов по восходящему пути лимфооттока у больных с нижне- и среднеампулярным раком прямой кишки установлено в 7,1% (n=7,1%). Частота встречаемости латерального метастазирования также была существенно выше в случаях нижнеампулярного рака и составила 31,6% (n=31). При среднеампулярном раке метастазы латерального пути встречались лишь в 6,1% (n=6) случаев. Не наблюдалось больных с пораженнной латеральной группой ЛУ в случаях верхнеампулярного рака. Установлен лишь один случай метастазирования в паховые лимфатические узлы – выявлены у больной с нижнеампулярным раком прямой кишки в сочетании с поражением мезоректальной группы ЛУ и ЛУ по восходящему пути метастазирования. В случаях латерального метастазирования наиболее частым вариантом являлись пораженные лимфатические узлы по ходу внутренней подвздошной артерии – 27,6% (n=27) и 5,1% (n=5) у больных с нижне- и среднеампулярным раком, соответственно. Распределение пациентов основной группы с клинически пораженными при МРТ регионарными лимфатическими узлами (n=98) в зависимости от локализации первичной опухоли и степени ее местного распространения представлено в табл. 2.5., 2.6. Таблица 3.4 Распределение пациентов основной группы с клинически поражеными регионарными лимфатическими узлами в зависимости от локализации первичной опухоли (n=98) Локализация опухоли, отдел Локализация лимфатических узлов В/амп Ср/амп Абс. число % 45 45,9 2,0 3 3,1 1 1,0 1 1,0 - 9 9,2 28 28,6 - - 1 1,0 7 7,1 - - 4 4,1 15 15,3 - в запирательном пространстве - - 1 1,0 6 6,1 Паховые лимфатические узлы - - - - 1 1,0 Мезоректальные лимфатические узлы Лимфатические узлы вдоль нижней брыжеечной артерии Абс. число % Абс. число 13 13,3 24 8 8,2 2 4 4,1 - Н/амп % Лимфатические узлы вдоль верхней прямокишечной артерии Латеральные лимфатические узлы всего: Из них: - дистальная часть внутренней подвздошной артерии - по ходу внутренней подвздошной артерии При изучении МРТ-исследований пациентов с клинически пораженными регионарными лимфатическими узлами было установленно, что метастазы только по латеральному пути лимфооттока наблюдаются крайне редко. Было установлены множественные сочетания поражения лимфатических узлов разных путей лимфооттока. Схематичное распределение групп пораженных ЛУ и их сочетания изображены на рисунке 3.7. Рисунок 3.7- распределение групп пораженных ЛУ При локализации первичной опухоли в верхнеампулярном отделе прямой кишки, преимущественно поражались лимфатические узлы – в 13,3% (n=13) наблюдений, мезоректальные а также ЛУ по восходящему пути лимфооттока – вдоль нижней брыжеечной и ветвей верхней прямокишечной артерий – суммарно 12,2% (n=12). При этом почти в половине случаев – 6% (n=61) отмечались изменения как мезоректальных ЛУ, так и ЛУ по восходящему пути лимфооттока (табл. 3.5.) Таблица 3.5 Сочетание поражения различных групп лимфатических узлов у пациентов с верхнеампулярным раком прямой кишки (n=19) Локализация пораженных ЛУ Только мезоректальные ЛУ ЛУ только восходящего пути лимфооттока Восх. ЛУ + мезоректальные ЛУ Кол-во пациентов % от всех пациентов c N+ Кол-во пациентов % от всех пациентов c N+ Кол-во пациентов % от всех пациентов c N+ 7 7,1 6 6,1 6 6,1 Метастазирования в латеральные лимфатические узлы при опухолях верхнеампулярного отдела прямой кишки не наблюдалось ни у одного пациента. Также как и при опухолях верхнеампулярного отдела, частота метастазирования в мезоректальные лимфатические узлы при раке средне- и нижнеампулярного отделов была намного выше и составила 70,4% (n=69) встречаемости от общего количества пациентов с регионарными метастатическими изменениями. Чаще всего всего при поражении латеральных лимфатических узлов наблюдалось также поражение и мезоректальных лимфатических узлов. При локализации опухоли в нижне- и среднеампулярном отделах прямой кишки частота латерального метастазированияв сочетании с поражением мезоректальных ЛУ составила 28,6% (n=28), при этом метастазирование только в латеральные лимфатические узлы – 9,1% (n=9) (табл. 2.8). Таблица 3.6 Сочетание различных групп лимфатических узлову пациентов со средне- и нижнеампулярным раком прямой кишки (n=78) Локализация пораженных ЛУ Мезоректальн Только Локализа ые + мезоректальны ция латеральные е ЛУ первично ЛУ й % от % от опухоли Кол-во всех Кол-во всех Мезоректальн ые + восх. путь Только латеральные ЛУ Кол-во пациен тов % от всех пациен тов c N+ Кол-во пациен тов % от всех пациен тов c N+ пациен тов пациен тов c N+ пациен тов пациен тов c N+ Ср/амп. отдел 14 14,3 7 7,1 3 3,06 2 2,0 Нижн/ам п. отдел 20 20,4 21 21,4 4 4,1 7 7,1 При этом при опухолях средне- и нижнеампулярных отделов прямой кишки были в 7,7% случаев (n=7) сочетание поражение мезоректальных лимфатических узлов и ЛУ по восходящему пути лимфооттока – вдоль верхних прямокишечных атерий и нижней брыжеечной артерии, что является абберантным явлением. Во всех случаях поражения ЛУ по восходящему пути лимфооттока при «низких опухолях», имели место быть высокая степень местного распространения и протяженность первичной опухоли, а также имеющиеся анатомические особенности данных пациентов, о которых будет упомянуто далее. В 1% (n=1) случае наблюдалось поражение паховых лимфатических узлов, установленном при нижнеампулярном раке прямой кишки, при этом наблюдалось сочетание поражения мезоректальной и паховых групп ЛУ. Схематично отображение распределения пациентов с поражением регионарных лимфатических узлов отображено на рисунке 3.7 Параректальные + ЛУ восходящего пути ЛУ восходящего пути Параректальные+латеральные ЛУ Латеральные ЛУ Параректальные лимфатические узлы Верхн/амп. рак Ср/амп. рак Нижн/амп. рак Рисунок 3.7 – Распределение пациентов основной группы с поражением регионарных ЛУ в зависимости от локализации ЛУ Большей частью поражение регионарных лимфатических узлов наблюдалось при местно-распространенных опухолях категорий T3-T4. У пациенов с местно-распространенным раком наиболее часто определялось наблюдалось в поражение мезоректальных лимфатических узлов и 70,4% (n=69) случаев. Латеральное метастазирование у пациентов c T3-T4 опухолями наблюдалось у 31,6% (n=31). При ранних опухолях чаще всего, в 13,3% (n=13) случаев наблюдалось метастазирование в мезоректальные литмфатические узлы. Латеральное метастазирование диагностировано лишь у 6,1% (n=6) пациентов с ранними опухолями прямой кишки. В сравнении с количеством пациентов с ранними и местнораспространенными опухолями было установлено, что метастатическое поражение регионарных ЛУ у больных с опухолями категории T1-T2 (n=72) наблюдалось лишь в 33,3% (n=24), в то время как на долю пациентов с T3-T4 (n=103) пришлось до 72,8% (n=75) больных с регионарным поражением ЛУ (табл. 3.7). Таблица 3.7 Распределение пациентов основной группы с клинически поражеными регионарными лимфатическими узлами в зависимости от степени местного распространения Степень местного распространения опухоли Локализация лимфатических узлов T1-2 13,3 Абс. число 69 70,4 5 5,1 14 14,3 6 6,1 31 31,6 2 2,0 8 8,2 4 4,1 16 16,3 - в запирательном пространстве - - 7 7,1 Паховые лимфатические узлы - - 1 1,0 Мезоректальные лимфатические узлы Лимфатические узлы по восходящему пути лимфооттока Латеральные лимфатические узлы всего: Абс. число 13 T3-4 % % Из них: - дистальная часть внутренней подвздошной артерии - вдоль внутренней подвздошной артерии При оценке латерального метастазирования установлено, что билатеральное поражение лимфатических узлов встречалось лишь у 16,2% (n=6) пациентов, также преимущественно вдоль внутренней подвздошной артерии - в 10,8% (n=4) случаев. Более частым вариантом являлось поражение латеральных лимфатических узлов в виде метастазов с одной стороны, ЛЛУ с левой стороны наблюдались чаще, чем справа – 48,6% (n=18) и 35,2% (n=13), соответственно. Чаще всего метастатически пораженными латеральными узлами являлись лимфатические узлы вдоль внутренних подвздошных артерий, преимущественно с левой стороны – 27,0% (n=10), поражение латеральной группы лифатических узлов вдоль правой подвздошной артерии наблюдалось в 19,0% (n=7) случаев (табл. 3.8) Таблица 3.8 Результаты распределения пациентов с клинически пораженными латеральными лимфатическими узлами по стороне поражения Пациенты с клинически пораженными латеральными лимфатическими узлами (n=37) Билатерально Локализация латеральных лимфатических узлов Абс. % число Унилатерально Унилатерально справа слева Абс. % число Абс. % число дистальная часть внутренней подвздошной артерии (вдоль средней 0 0 3 8,1 3 8,1 4 10,8 7 19,0 10 27,0 2 5,4 3 8,1 5 13,5 прямокишечной артерии) по ходу внутренней подвздошной артерии в запирательном пространстве Всего: 6 16,2 13 35,2 18 48,6 При подробном изучении пациентов с поражением регионарных лимфатических узлов было установлено, что наиболее частым вариантом поражения являются метастазы в мезоректальные лимфатические узлы, являющиеся первыми на пути лимфооттока от опухоли. Поражение мезоректальных лимфатических узлов наблюдалось у 82 пациентов. Прослеживалась закономерность степени местного распространения опухоли и наличия мезоректальных лимфатических узлов. Частота латерального метастазирования в группе T1-T2 была значительно ниже, чем среди больных с местно-распространенным раком прямой кишки. Частота встречаемости регионарного метастазирования в мезоректальную группу лимфатических узлов была выше в группе больных метсно-распространенного рака, категории T3-T4. Среди пациентов с положительными мезоректальными лимфатическими узлами преобладали больные с опухолями категории T4 и T3, их частота составила 45,1% (n=37) и 39,0% (n=32), соответственно, и в меньшей степени T2 и T1 – 14,6% (n=12) и 1,2% (n=1), соответственно (рис. 3.9) 1% 15% 45% T1 = 1 пациент T2 = 12 пациентов 39% T3 = 32 пациентов T4 = 37 пациентов Рис. 3.9. – распределение пациентов с клинически пораженными мезоректальными лимфатическим узлами по степени местного распространения опухоли У пациентов с клинически определяемыми метастазами в латеральные лимфатические узлы в 83,8% (n=31) случаев определялось поражение мезоректальных лимфатических узлов, при этом у 16,2% (n=6) пациентов определялись латеральные ЛУ без поражения мезоректальной группы ЛУ. Билатеральное поражение латеральной группы лимфатических узлов наблюдалось редко и составило 16,2% (n=6) от общего числа случаев латерального поражения. Унилатеральное поражение латеральных лимфатических узлов встречалось в 48,6% (n=18) случаев c левой стороны и в 35,2% (n=13) справа. У пациентов с клинически определяемыми метастазами в латеральные лимфатические узлы в 83,8% (n=31) случаев определялось поражение мезоректальных лимфатических узлов, при этом у 16,2% (n=6) пациентов определялись латеральные ЛУ без поражения мезоректальной группы ЛУ. 3.2.2. Результаты КТА – исследования пациентам основной группы При анализе ангиографических исследований пациентов основной группы установлено, что СПА наблюдалась у 30,3% пациентов (n=53), преимущественно у мужчин, чем у женщин – 16,6%(n=29) и 13,7 % (n=24). Пациентов среднего и пожилого возраста со СПА было в два раза больше чем больных молодого и старческого возраста – 20% (n=35) и 10,3% (n=18) (табл.3.9). Таблица 3.9. Распределение больных основной группы с визуализированной СПА в зависимости от возраста и пола Возраст Контрольная группа больных (n=175) Пол Абс.число 20-40 41-60 61-75 76-90 Итого м 4 ж 3 м 9 ж 7 м 11 ж 8 м 5 ж 6 м 29 ж 24 % 7 16 19 11 53 2,3 1,7 5,1 4,0 6,3 4,6 2,9 3,4 16,6 13,7 4,0 9,1 10,9 6,3 30,3 Среди пациентов основной группы, у которых была обнаружена СПА, билатеральное ее расположение установлено наблюдалось реже всего, лишь в 17,0% (n=9) наблюдений, левостороннее расположение СПА наблюдалось чаще, чем правостороннее унилатеральное – 47,2% (n=21) и 35,3% (n=17), соответственно. Варианты ответвления СПА и распределение больных с визуализированной артерией представлено в таблице 3.10. Таблица 3.10 Распределение больных с визуализированной СПА в зависимости от варианта отхождения Пациенты с наличием средней прямокишечной артерии (n=53) Билатеральн Унилатерально Унилатерально о Варианты отхождения Абс. число справа % Абс. число Всего слева % Абс. число % Абс. число % Отдельная ветвь переднего ствола внутренней 5 9,4 9 17,0 13 24,6 27 50,9 3 5,7 5 9,4 6 11,3 14 26,4 1 1,9 5 9,4 6 11,3 12 22,7 9 17,0 19 35,8 25 47,2 53 100 подвздошной артерии Конечная ветвь внутренней половой артерии Ветвь запирательной артерии Всего: Анализ основной группы больных показал, что кровоснабжение прямой кишки у больных, страдающих раком прямой кишки также обладает анатомической вариабельностью. Возраст, пол, пациентов не являлся прогностически значимым показателем наличия или отсутствия СПА. Распределение пациентов контрольной и основных групп было примерно одинаковым. Частота возникновения СПА в каждой возрастной и половой группе у пациентов основной и контрольной групп была примерно одинаковой. Наличие диагноза РПК не являлось прогностически значимым фактором выявления СПА (p>0,05). 3.3. Анализ группы пациентов с метастазами в регионарные лимфатические узлы в зависимости от особенностей кровоснабжения прямой кишки Поражение лимфатических узлов по восходящему пути метастазирования (вдоль верхней прямокишечной и нижнебрыжеечной артерии, n=19) в большинстве своем наблюдалось в случаях верхнеампулярного рака прямой кишки. Пациенты с верхнеампулярной локализацией опухоли и метастазированием в ЛУ по восходящему пути составили 63,2% (n=12). Среди больных с метастазами по восходящему пути лимфооттока лишь у 1 больного первичная опухоль имела категорию T2, что составило 5,3%. Большинство больных страдали опухолями T4 – 63,2% (n=12) и T3 -31,6% (n=6). Пациентов с ранними опухолями T1 метастазов по восходящему пути лимфооттока обнаружено не было. Верхняя визуализирована прямокишечная у всех артерия больных при основной выполнении группы КТА независимо от локализации опухоли, являясь постоянным сосудом. Основным прогностическим фактором, влияющим на распространение метастазов по восходящему пути лимфооттока, являлась локализация опухоли в верхнеампулярном отделе и выраженное местное распространение первичной опухоли категории T3-T4. Однако, если локализация опухоли в верхнеампулярном и среднеампулярном отделе и лифмогенное метастазирование по восходящему пути лимфооттока не вызывает вопросов, то локализация опухоли в средне- и нижнеампулярных отделах и возникновение метастазов по данному пути вызывает интерес. При локализации опухолей в средне- и нижнеампулярных отделах, метастазирование по восходящему пути возникало в 15,8% (n=3) и 21,1% (n=4), соответственно. Почти все больные средне- и нижнеампулярным раком и метастазированием по восходящему пути имели значительное распространение и протяженность опухолевых изменений категории T4N23M1, у всех больных наблюдалось поражение мезоректальных лимфатических узлов. Ни у одного из пациентов с нижнеампулярным раком прямой кишки и метастазированием по восходящему пути лимфооттока не были визуализированы средние прямокишечные артерии. У единственного пациента со среднеампулярным раком прямой кишки и наличием СПА унилатерально справа наблюдалось анастомозирование ветви СПА с ветвью верхней прямокишечной артерии. При этом верхние прямокишечные артерии были выражены, имели большую протяженность, кровоснабжая и дистальные отделы прямой кишки в том числе (рис. 3.8) Рис. 3.8 – КТА (аксиальный и сагиттальный срезы). Метастазирование в регионарные лимфатические узлы по восходящему пути метасталирования. Сплошная черная стрелка – пораженные ЛУ, контурная стрелка – протяженные верхние прямокишечные артерии, кровоснабжающие дистальные отделы прямой кишки. Таким образом, наиболее значимым прогностическим фактором развития метастазов по восходящему пути метастазирования при «низких» опухолях являлось отсутствие средних прямокишечных артерий и выраженная протяженность ветвей верхние прямокишечной артерии наряду с выраженным местным распространением опухоли. Среди больных с определяемыми латеральными метастазами, наличие СПА доказано рентгенологически у 91,9% больных (n=34) на стороне поражения. На рисунке 3.10 представлен вариант наличия СПА унилатерально слева и латеральный определяемый по МРТ латеральный ЛУ на той же стороне. А Б Б Рис. 3.10 А – МРТ малого таза: белой стрелкой отмечено поражение латерального лимфатического узла вдоль внутренней подвздошной артерии; слева; Б – КТА малого таза, тот же пациент, белой стрелкой отмечена визуализированная левая средняя прямокишечная артерия. На рисунке 3.11 представлено поражение латеральной группы больных в области правой запирательной ямки, обнаруженное при МРТ и визуализированные СПА с обеих сторон. А Б Рис. 3.11 А – МРТ малого таза: белой стрелкой отмечено поражение латеральных лимфатических узлов области запирательной ямки; Б – КТА органов малого таза – черными стрелками отмечено наличие СПА с обеих сторон. Лишь у троих пациентов, в 8,1% случаев, наблюдалось отсутствие СПА при наличии латеральных ЛУ. Не отмечено зависимости латерального метастазирования от таких факторов как степень местного распространения и дифференцировка опухоли. В данной группе больных преобладали опухоли категории T3 – 48,6% (n=18), при этом пациенты с опухолями T4 наблюдались в 2 раза реже – 24,3% (n=9), почти столько же, сколько новообразований T2 – 27,0% (n=10). Ранних опухолей T1 не наблюдалось среди больных, имеющих метастазы в латеральные ЛУ. Низкодифференцированный рак также не являлся превалирующим среди больных с ЛЛУ. Большинство опухолей данной группы больных имело умеренную дифференцировку, 18% (n=10), низко- и высокодифференцированный рак наблюдался в 27% (n=10) и 24,3% (n=9) случаев. Почти у всех больных с наличием пораженных ЛЛУ наблюдалось повышение РЭА больше 3,5 нг/мл, исключением являлись лишь 2 пациентов. Среди пациентов основной группы с визуализированной СПА (n=53), метастазирование в латеральные лимфатические узлы встречалось у 64,2% (n=34) больных. При этом среди пациентов с наличием СПА, но отсутствием ЛЛУ, 6 пациентов страдали опухолями верхнеампулярного отделов, 11 больных с опухолями в среднеампулярном отделах. Лишь у 2 больных опухоль локализовалась в нижнеампулярном отделе прямой кишки и являлась ранней, категории T1N0M0. ГЛАВА 4 КОМПЛЕКСНАЯ МОДЕЛЬ ОЦЕНКИ РИСКА ЛАТЕРАЛЬНОГО МЕТАСТАЗИРОВАНИЯ Для прогнозирования риска появления латеральных метастазов была разработана комплексная модель на основе логистической регрессии. В процессе статистического анализа были выявлены показатели, достоверно связанные с метастазированием по латеральному пути лимфооттока, и по своей сути являющиеся предикторами, факторами риска возникновения латеральных метастазов. Данными показателями явились: - локализация опухоли; - степень местного распространения опухоли; - уровень онкомаркера РЭА; - поражение мезоректальных лимфатических узлов; - наличие средней прямокишечной артерии, визуализированной при КТА. Они имели следующие оценки (табл. 4.1): Табл. 4.1. Факторы риска латерального метастазирования и их оценки Латеральное метастазирование Прогностический фактор нет Всего есть Кол-во % Кол-во % Верхн/амп отдел 36 100,00% 0 0,00% 36 Средн/амп отдел 52 85,25% 9 14,75% 61 Нижн/амп отдел 50 64,10% 28 35,90% 78 Локализация опухоли: Поражение мезоректальных лимфатических узлов: Нет 84 90,32% 9 9,68% 93 Есть 54 65,85% 28 34,15% 82 Повышение онкомаркера РЭА РЭА <3,5 62 98,41% 1 1,59% 63 РЭА >3,5 75 67,57% 36 32,43% 111 Наличие средней прямокишечной артерии нет 119 97,54% 3 2,46% 122 есть 19 35,85% 34 64,15% 53 Степень местного распространения опухоли Т=1 22 100,00% 0 0,00% 22 Т=2 44 88,00% 6 12,00% 50 Т=4 32 74,42% 11 25,58% 43 Т=3 40 66,67% 20 33,33% 60 Из представленной таблицы видно, что благоприятными факторами, то есть предикторами низкого прогноза латерального метастазирования явились локализация опухоли в верхнеампулярном отделе, отсутствие поражения мезоректальных лимфатических узлов, уровень РЭА крови< 3,5, отсутствие средней прямокишечной артерии при КТА, степень местного распространения опухоли T1. Факторами-предикторами латерального метастазирования, очередь, явились: локализация опухоли в нижне- и среднеампулярном отделе; поражение мезоректальных лимфатических узлов; повышение РЭА в крови > 3,5 Ед/мл наличие средней прямокишечной артерии; степень местного распространения опухоли T3-T4 в свою Табл. 4.2 Факторы риска латерального метастазирования и их значения для модели № 1. 2. 3. Код для Оценка модели риска (OR) в верхнеампулярном отделе 1 1 в среднеампулярном отделе 2 13,21 в нижнеампулярном отделе 3 41,20 0 1 1 4,84 0 1 1 29,76 0 1 1 70,98 T1 0 1 T2 1 6,57 T3/T4 2 19,55 Фактор Локализация опухоли Поражение мезоректальных лимфатических узлов Уровень РЭА Значение Отсутствуют пораженные латеральные лимфатические узлы Имеются пораженные мезоректальные лимфатические узлы Уровень РЭА < 3,5 Уровень РЭА > 3,5 СПА отсутствует 4. Наличие/отсутствие СПА СПА визуализируется 5 Степень местного распространения опухоли На рисунке 4.1 наглядно показаны OR для различных значений выявленных факторов. T3 19.55 T2 6.57 РЭА > 3,5 Ед/мл 29.76 Наличие СПА 70.98 Средн/амп. отдел 13.21 Нижн/амп. отдел 41.2 0 10 20 30 40 50 60 70 80 OR Рис.4.1. Отношения рисков возникновения латеральных метастазов С данным перечнем факторов на основе логистической регрессии была получена модель оценки модели данного риска появления латеральных метастазов. Для типа главным является расчет характеристик логистического уравнения Ψ. Определены следующие коэффициенты уравнения для оптимальной модели (табл. 4.2): Табл. 4.2. Факторы риска и полученные коэффициенты уравнения для расчета характеристик логистической функции Параметр Локализация опухоли Обозначен Прогности Обозначени ия ческая е коэффицие значимост в формуле нтов в ь (ранг) формуле Коэффици ент уравнения Х1 22,69 1 А1 Наличие СПА 2 Х4 А4 26,03 3 Х5 А5 1,10 Поражение мезоректальных лимфатических узлов 4 Х2 А2 1,24 Уровень РЭА 5 Х3 А3 21,23 В В -94,85 Степень местного распространения опухоли Константа где Ψ = А1*Х1 + А2*Х2 + А3*Х3 + А4*Х4 + А5*Х5 + В Подставив коэффициенты из таблицы, можно получитьΨ для оценки риска появления латеральных метастазов: Ψ = 22,69*X1 + 1,24*X2 + 21,23*X3 + 26,03*X4+1,10*X5 - 94,85 Сами ранги (прогностическая значимость) в расчете риска появления латеральных метастазов не принимают участия. Они показывают, в каком порядке каждый параметр стоит по значимости (важности) риска. Прогностическая значимость - это «побочный» результат построения модели. Каждый из коэффициентов регрессии описывает размер вклада соответствующего фактора. Положительный коэффициент регрессии означает, что данный фактор увеличивает общий риск (т.е. повышает вероятность анализируемого исхода), в то время как отрицательный коэффициент означает, что этот фактор уменьшает риск. Величина коэффициентов регрессии определяет влияние на совокупный риск, а также в случае разномасштабных, т.е. измеряемых в разных единицах переменных, «выравнивает масштаб». В нашем случае, чем больше все выявленные факторы, тем выше риск. Переход Ψ через значение «0» сопровождался следующими оценками частоты появления латеральных метастазов (табл. 4.3). Табл. 4.3. Оценка частоты появления латеральных метастазов Латератерального Латеральное метастазирования метастазирование нет есть Ψ <=0 134 97,81% Ψ>0 3 137 34 37 Р 2,19% 3 8,11% Всего Всего 91,89% 138 78,74% Мы получили высокую P<0,001 37 21,26% 175 100,00% оценку качества полученной модели:хи- квадрат = 141,86; P<0,001, OR=506,2 (97,8 – 2620,1). Построенная модель имеет свойства: - чувствительность = 91,9% - специфичность = 97,8% - диагностическая точность = 96,6% Для получения вероятности возникновения латеральных метастазов, необходимо использовать логистическую кривую (Рис. 4.2). Основываясь на сути уравнения логистической регрессии, можно сказать, что комплексная оценка риска появления латеральных метастазов зависит от значений всех, входящих в данное уравнение показателей, т.е. неблагоприятные уровни одних параметров могут быть компенсированы «ресурсом» других. Для того, чтобы воспользоваться моделью и точно оценить риск, необходимо по данным конкретного больного рассчитать Ψ (ось абцисс), а затем по логистической кривой y = exp(ψ) / (1 + exp(ψ)),определить вероятность риска появления латеральных метастазов (ось ординат). Рис. 4.2. Логистическая кривая Так как логистическая кривая стандартна, то можно использовать ключевые значения Ψ для оценки риска: Ψ< -2,94 – риск менее 5 % Ψ< 0 – риск менее 50% Ψ> 0 – риск более 50% Ψ> 2,94 – риск более 95% ВЫВОДЫ Таким образом, в результате проведенного исследования, установлены достоверные факторы риска, связанные с возникновением латерального метастазирования. Были получены коэффициенты для расчета характеристик предложенной логистической функции, используя которые возможно оценивать риски и вероятность метастазирования у конкретного больного. возникновения латерального ЗАКЛЮЧЕНИЕ Несмотря на мультидисциплинарный подход к лечению рака прямой, частота местного рецидивирования при данном заболевании остается достаточно высокой. Лимфогенное метастазирование представляет одну из важнейших причин возникновения Существующие методы местных рецидивов дооперационного рака прямой стадирования кишки. опухолевого процесса прямой кишки не обладают должной чувствительностью и специфичностью в отношении оценки регионарного метастазирования, что свидетельствует о необходимости поиска новых методов диагностики, выявлении факторов риска и неблагоприятного прогноза в отношении латерального метастазирования при раке прямой кишки, а также более дифференцированному подходу к выбору лечебной тактики при раке прямой кишки. В ходе изучения ангиографических данных пациентов контрольной и основных групп было установлено, что имеется анатомическая вариабельность кровоснабжения прямой кишки, являющаяся вариантом развития организма человека, не зависящая ни от возраста, ни от пола, ни от наличия или отсутствия злокачественного поражения прямой кишки. Изучая анатомические особенности кровоснабжения прямой кишки пациентов контрольной и основных групп (n=325), средняя прямокишечная артерия выявлена у 104 чел (32%), что согласуется с данными литературы. При этом полное ее отсутствие выявлено у 68% (n=221) больных, одностороннее справа – в 11,08% (n=36), одностороннее слева – у 14,15% (n=46), двустороннее – лишь в 6,77% (n=22) случаев. Частота выявляемости СПА у пациентов, страдающих раком прямой кишки, достоверно (P>>0,05) не отличается от таковой в контрольной группе как в целом по наличию, так и по вариантам и сторонам ветвления. Имеется разнообразие вариантов ее отхождения от внутренней подвздошной артерии и ее ветвей. Основными вариантами отхождения средней прямокишечной артерии были: отдельной ветвью внутренней подвздошной артерии – 50% (n=52), ветвью внутренней половой артерии – 29,8% (n=31). С меньшей частотой встречался вариант СПА как ветвь запирательной артерии – 20,2% (n=21). При сравнении результатов магнитно-резонансной томографии прямой кишки и ангиографических данных больных, страдающих злокачественными новообразованиями прямой кишки в разных их стадиях и степенях дифференцировки, применяя компьютерную томографию в ангиорежиме, было установлено, что сосудистая анатомия прямой кишки имеет важное прогностическое значение в определении рисков метастазирования по различным путям лимфооттока. Так, например фактор наличия выраженной сети и большой протяженности верхней прямокишечной артерии при отсутствии средних прямокишечных артерий являлся объяснением наличия метастазов по восходящему пути у больных с нижнеампулярным раком прямой кишки, несмотря на выраженное местное распространение опухолевого процесса. Восходящий путь метастазирования наблюдался у пациентов с T4 в 63,2% (n=12) случаев и больных с опухолями T3-31,6% (n=6). Фактор отсутствия средней прямокишечной артерии объяснял отсутствие поражения метастазов латеральной группы лимфатических узлов у пациентов с местно- распространенными опухолями и наличием метастазов по восходящему пути лимфооттока при нижне- и среднеампулярной локализации рака, возникший в 7,1% (n=7) случаях. Визуализация сосудистых анастомозов между ветвями верхней прямокишечной артерии и средней прямокишечной артерии объясняла также наличие лимфатических узлов по восходящему пути лимфооттока у больного со среднеампулярным раком прямой кишки. При сравнении результатов МРТ и КТА пациентов раком прямой кишки было установлено, что пораженные латеральные лимфатические узлы наблюдались у большей части пациентов с визуализированной средней прямокишечной артерией. Наличие СПА у пациентов, страдающих раком прямой кишки, согласовалось с частотой латерального метастазирования (p<0,05). Установлена следующая частота латерального метастазирования: левостороннее поражение латеральной группы лимфатических узлов в 32,08% (n=17), правостороннее в 22,64% (n=12), двустороннее в 9,43% (n=5). Наличие СПА доказано рентгенологически у 91,9% больных (n=34) на стороне поражения ЛЛУ. Отсутствие лимфатических узлов при наличии артерии как правило наблюдалось при незначительном местном распространении опухоли нижнеи среднеампулярного отделов или о локализации рака в верхнеампулярном отделе, при котором лимфоотток в латеральные лимфатические узлы является редким явлением. В ряде случаев наблюдалось поражение лимфатических узлов латеральной группы даже при незначительном местном распространении опухоли и отсутствии мезоректального регионарного поражения. Углубленный статистический анализ показал, что наличие средней прямокишечной артерии является значимым фактором в прогнозе регионарного метастазирования в латеральную группу лимфатических узлов наряду с такими факторами как степень местного распространения опухоли, поражение мезоректальных лимфатических узлов, локализация опухоли в нижнеампулярном отделе, уровень онкомаркера РЭА. Было установлено, что отдельные факторы прогноза в расчете риска появления латеральных метастазов не принимают участия. Они лишь показывают, в каком порядке каждый параметр стоит по значимости (важности) риска. коэффициенты В результате регрессии, статической которые обработки описывают соответствующего фактора в общую оценку риска. размер получены вклада Комплексная оценка риска появления латеральных метастазов зависит от значений всех, входящих в данное уравнение показателей, т.е. неблагоприятные значения одних параметров могут быть компенсированы «ресурсом» других. Применение модель логистической регрессии с использованием выделенных показателей возникновения латеральных позволяет прогнозировать метастазов с вероятность чувстительностью 91,9%, специфичностью 97,8% и диагностической точностью 96,6%. Таким образом, внутривенным выполнение контрастированием дополнительным неинвазивным компьютерной в ангиорежиме методом томографии может обследования с являться больных, страдающих раком прямой кишки в дополнение к общепризнанным методам диагностики, таким ка МРТ и ЭРУЗИ в оценке регионарного метастатического поражения и выявить важный прогностический фактор в комплексной оценке прогнозирования риска латерального метастазирования. В случае лимфатических отсутствия узлов, клинически неблагоприятный пораженных прогноз латеральных может определять показания к проведению неоадъювантной лучевой терапии ввиду высокого риска латерального метастазирования и наличия микрометастазов в латеральных лимфатических узлах, не определяемых при помощи магнитнорезонансной томографии, несмотря на незначительное местное распространение опухоли и, тем самым, улучшить результаты лечения данной категории больных. ВЫВОДЫ 1. Кровоснабжение прямой кишки обладает анатомической вариабельностью. У пациентов без патологии органов малого таза (контрольная группа) средняя прямокишечная артерия наблюдалась у 34,1% пациентов (n=51). В 49,0% (n=25) она являлась отдельной ветвью переднего ствола внутренней подвздошной артерии, в 33,4% (n=17) ветвью внутренней половой артерии, в 17,6% (n=9) - отходила в виде тонкой ветви от запирательной артерии. Средняя прямокишечная артерия была визуализирована слева чаще, чем справа – 41,2% (n=21) и 33,3% (n=17), соответственно. Двусторонняя локализация СПА отмечена в 25,3% (n=13) случаев. Факторы пола, возраста и диагноза не являлись прогностически значимым критериями наличия или отсутствия СПА (p<<0,05). 2. У больных раком прямой кишки (основная группа) СПА обнаружена у 30,3% пациентов (n=53), при этом двустороннее еѐ расположение наблюдалось в 17,0% (n=9) наблюдений, левостороннее расположение СПА встретилось чаще, чем правостороннее – 47,2% (n=25) и 35,8% (n=19), соответственно. В 50,9% (n=27) СПА являлась отдельной ветвью переднего ствола внутренней подвздошной артерии, 26,4% (n=14) ветвью внутренней половой артерии, в 22,7% (n=12) - отходила в виде тонкой ветви от запирательной артерии. Достоверных различий в вариантной анатомии СПА у пациентов контрольной и основной групп не выявлено (P>>0,05). Факторы возраста, пола, а также факт наличия или отсутствие опухолевого поражения прямой кишки являются прогностически не значимыми (p≥0,05). 3. Метастазы в латеральную группу лимфатических узлов клинически выявлены у 21,1% (n=37) больных основной группы. Левостороннее поражение определялось в 32,08% (n=17) случаев, правостороннее - в 22,64% (n=12) и двустороннее - в 9,43% (n=5). Наличие СПА доказано при помощи рентгеновской компьютерной томографии у 91,9% больных (n=34) на стороне поражения латеральных лимфатических узлов (p<0,05). 4. Частота латерального метастазирования статистически достоверно связана со следующими факторами: локализация опухоли, поражение мезоректальных лимфатических узлов, уровнем ракового эмбрионального антигена, наличием средней прямокишечной артерии на стороне поражения латеральных лимфатических узлов, степенью местного распространения опухоли. 5. Разработанная модель оценки риска латерального метастазирования на основе логистической регрессии с использованием выделенных показателей обладает чувствительностью 91,9%, специфичностью – 97,8% и диагностической точностью 96,6%. ПРАКТИЧЕСКИЕ РЕКОММЕНДАЦИИ 1. С целью изучения анатомической вариабельности средней прямокишечной артерии рекомендовано выполнять рентгеновскую компьютерную томографию с внутривенным контрастированием с построением многоплоскостных реконструкций в сагиттальной, фронтальной, и аксиальной и других, оптимальных для визуализации артерий, плоскостях. 2. Для улучшения визуализации, а также более детальной оценки вариантов ветвления ветвей внутренней подвздошной и верхней прямокишечной артерий рекомендовано использование режима проекции максимальной интенсивности MIP (Max Intensitive Point) с толщиной среза 20 мм и объемные изображения VRT (Volume Rendering Technique) артерий таза. 3. При высоких значениях риска латерального метастазирования следует обсудить вопрос о расширении показаний к проведению неоадъювантной химиолучевой терапии или расширению объема оперативного вмешательства – выполнению латеральной лимфодиссекции при раке прямой кишки. 4. В случае ранних опухолей прямой кишки при планировании трансанальной эндоскопической микрохирургической операции (ТЭМ) целесообразно метастазирования проведение по оценки предложенной риска методике. латерального При высоких показателях вероятности латерального метастазирования следует рассмотреть вопрос о выполнении стандартного объема оперативного вмешательства. СПИСОК ЛИТЕРАТУРЫ 1. Бобрик И.И., Шевченко Е.А., Черкасов В.Г. Развитие кровеносных и лимфатических сосудов. – Киев: Здоров’я, 1991. 2. Гайворонский И.В. Нормальная анатомия человека. В 2 томах. – СПб.: СпецЛит, 2000. – кол-во страниц. 3. Гинзбург В.В. Лимфатическая система нижних конечностей. – Л.: Медгиз, 1959. 4. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2014 г. // Вестник РОНЦ им. Н. Н. Блохина РАМН. – 2014. - Т. 21, №2. – С. 52-53. 5. Ильин К.С. Роль и место аорто-подвздошно-газовой лимфодиссекции в хирургическом лечении больных раком прямой кишки: автореферат диссертации на соискание ученой степени к.м.н. – СПб., 2007. – 25 с. 6. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, 2015. – 250 с. 7. Кулиев Ш.Б. Лимфография, флебография, эндолимфатическая и внутриартериальная злокачественных химиотерапия новообразований: в диагностике автореферат и лечении диссертации на соискание ученой степени д.м.н. - Баку, 1969. – 40 с. 8. Кулушев В.М. Рецидивы рака прямой кишки после хирургического и комбинированного лечения (факторы риска и пути профилактики): автореферат диссертации на соискание ученой степени к.м.н. – М., 2010. – 24 с. 9. Международная анатомическая терминология / Колесникова. — М.: Медицина, 2003. — 424 с. Под ред. Л.Л. 10. Одарюк Т.С., Воробьев Г.И., Шелыгин Ю.А. Хирургия рака прямой кишки. – М.: ООО «Дедалус», 2005. – 256 с. 11. Ольшанский М.С., Коротких Н.Н., Пономарева Е.Н., Казарезов О.В. Эндоваскулярное лечение местно-распространенного рака прямой кишки с учетом особенностей ее кровоснабжения (обзор литературы и собственные наблюдения) // Онкологическая колопроктология. – 2013. №1(8). – С. 29-34 12. Пережогин Е.В. Дооперационное стадирование рака прямой кишки и выбор объема радикальных вмешательств: автореферат диссертации на соискание ученой степени д.м.н. – СПб., 2004.- С. 31-32. 13. Рылюк брюшной А.Ф. Топографическая полости. 2-е изд. анатомия и Минск: - хирургия органов Вышэйшая школа, 1997. - 319 с. 14. Синельников Р.Д. Атлас анатомии человека: в 3 томах. – М.: Медицина, 1978. – кол-во страниц. 15.Троицкий А.А. Расширенная латеральная лимфаденэктомия в лечении рака нижнеампулярного отдела прямой кишки: автореферат диссертации на соискание ученой степени к.м.н. – М., 2007. – 22 с. 16. Швецов Э.В., Сапин М.Р. Варианты анатомии лимфатических сосудов, соединяющих паховые лимфатические узлы // Архив анатомии, гистологии и эмбриологии. – 1979. – Т. 76, №3. – С. 51-57. 17. Шуркус В.Э., Шуркус лимфопроводящих клинической и путей Е.А. // К развитию Проблемы профилактической подвздошных экспериментальной, лимфологии: Материалы Сибирского съезда лимфологов с международным участием I 10-12 октября 2006 г. / под ред. Ю. И. Бородина. – Новосибирск: ООО «Редакционно-издательский центр», 2006. – С. 370-372. 18. Шуркус В.Э., Шуркус Е.А., Роман Л.Д. Генез, топография и связи лимфатических узлов пахового и подвздошного лимфоколлекторов (теоретические и практические аспекты). – СПб., 2008. – 236 с. 19. Al-Sukhni E., Messenger D.E., Charles Victor J., McLeod R.S., Kennedy E.D. Do MRI reports contain adequate preoperative staging information for end users to make appropriate treatment decisions for rectal cancer? // Ann Surg Oncol. – 2013. - Vol. 20, №4. – Р. 1148-1155. 20. Arnaud J.B., Bergamaschi R., Schloegel M., Ollier J.C., Haegele P., Grob J.C., Adloff M. Progress in the assessment of lymphatic spread in rectal cancer. Rectal endoscopic lymphoscintigraphy // Dis Colon Rectum. – 1990. - № 33. – Р. 398–401. 21. Ayoub S. Arterial supply to the human rectum // Acta Anat. – 1978. - Vol. 100. – Р. 317–327. 22. Bell S., Sasaki J., Sinclair G., Chapuis P.H., Bokey E.L. Understanding the anatomy of lymphatic drainage and the use of blue-dye mapping to determine the extent of lymphadenectomy in rectal cancer surgery: unresolved issues // Colorectal Dis. – 2009. - Vol. 11, №5. – Р. 443-449. 23. Bergman R.A., Afifi A.K., Miyauchi R. Illustrated Encyclopedia of Human Anatomic Variation: Opus II: Cardiovascular System: Arteries: Pelvis (Middle Rectal Artery). Anatomy atlases, a digital library of anatomy information http://www.anatomyatlases.org/AnatomicVariants/Cardiovascular/Text/Arter ies/RectalMiddle.shtml 24. Beynon J., Mortensen N.J., Foy D.M., Channer J.L., Rigby H., Virjee J. http://www.ncbi.nlm.nih.gov/pubmed/2655811 // Br J Surg. – 1989. - Vol.76, №3. – Р. 276-279. 25. Bilhim T., Pereira J.A., Tinto H.R., Fernandes L., Duarte M., O'Neill J.E., Pisco J.M. Middle rectal artery: myth or reality? Retrospective study with CT angiography and digital subtraction angiography // Surg Radiol Anat. - 2013. - Vol. 35, №6. – Р. 517-522 26. Blair J.B., Holyoke E.A., Best R.R. A note on the lymphatics of the middle and lower rectum and anus // Anat Rec. – 1950. - №108. – Р. 635–643. 27. Brown G., Radcliffe A.G., Newcombe R.G., Dallimore N.S., Bourne M.W., Williams G.T. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging // Br J Surg. – 2003. Vol. 90, №3. – Р. 355-364. 28. Bucci L., Salfi R., Meraviglia F., Mazzeo F. Rectal lymphoscintigraphy // Dis Colon Rectum. – 1984. - №27. – Р. 370–375. 29.Chevallier J.M. Le rectum pelvien et le canal anal. In: Anatomie humaine, tome 1. - Paris: Flammarion Médecine-Sciences, 1998. - Р. 314-335. 30.Dahl O., Horn A., Morild I., Halvorsen J.F., Odland G., Reinertsen S., Reisaeter A., Kavli H., Thunold J. Low-dose preoperative radiation postpones recurrences in operable rectal cancer. Results of a randomized multicenter trial in western Norway // Cancer. – 1990. - Vol. 66, № 11. - P. 2286-2294. 31. Deddish M.R. Therapeutic trends and management in advanced carcinoma of the colon and rectum // N Y State J Med. – 1950. - Vol. 50, №17. – Р. 2047-2049. 32. DiDio L.J., Diaz-Franco C., Schemainda R., Bezerra A.J. Morphology of the middle rectal arteries. A study of 30 cadaveric dissections // Surg Radiol Anat. – 1986. - Vol. 8, №4. – Р. 229-236. 33.Dighe S., Purkayastha S., Swift I. et al. Diagnostic precision of CT in local staging of colon cancers: a meta-analysis //Clin Radiol. – 2010. - Vol. 65, №9. – Р.708-719. 34.Edge S.B., Byrd D.R., Compton C.C. et al. AJCC Cancer Staging Manual. 7th ed. New York. - NY: Springer, 2010. 35.Farouk R., Nelson H., Gunderson L.L. Aggressive multimodality treatment for locally advanced irresectable rectal cancer // Br J Surg. – 1997. - Vol. 84, №6. – Р. 741-749. 36. Ferber-Shmidt L. Entwicklung der inguinalen Lymphknoten // Zchr. mikr. – anat. Forsch. – 1957. – Bd. 63. – S. 94-130. 37. Gall T.M., Markar S.R., Jackson D. et al. Mini- probe ultrasonography for the staging of colon cancer. A systematic review and meta- analysis // Colorectal Dis. – 2013. – Vol 5, №10. – P. 1034-1039. 38. Georgiou P., Tan E., Gouvas N., Antoniou A., Brown G., Nicholls R.J., Tekkis P. Extended lymphadenectomy versus conventional surgery for rectal cancer: a meta-analysis // Lancet Oncol. – 2009. – №10. – Р. 1053–1062. 39. Gerota D. Die Lymphgefasse des Rectums und des Anus. Archiv fur Anatomie und Physiologie // Ann Abt. - 1895. – Р. 240–256. 40. Heald R.J. The 'Holy Plane' of rectal surgery // J R Soc Med. – 1988. - Vol. 81, №9. – Р. 503-508. 41.Heald R.J., Karanjia N.D. Results of radical surgery for rectal cancer // World J Surg. – 1992. - Vol. 16, №5. – Р. 848-857. 42. Hida J., Yasutomi M., Fujimoto K., Ieda S., Machidera N., Kubo R., Shindo K. Analysis of regional lymph node metastases from rectal carcinoma by the clearing method. Justification of the use of sigmoid in J-pouch construction after low anterior resection // Dis Colon Rectum. – 1996. - Vol. 39, №11. – Р. 1282-1285. 43.Hulsmans F.H., Bosma A., Mulder P.J., Reeders J.W. Tytgat Perirectal lymph nodes in rectal cancer: in vitro correlation of sonographic parameters and histopathologic findings // GNRadiology. – 1992. - Vol. 184, №2. – Р. 553-560. 44. Japanese Society for Cancer of the Colon and Rectum. Japanese Classification of Colorectal Carcinoma. 2nd English ed. Tokyo, Japan: Kanehara&Co; 2009. 45. Jonnesco T. Le Côlon Pelvien Pendant la vie Intra-Utérine. - Thèse. Lemale et Cie, Havre, 1892. 46.Kaplan W.D. Iliopelvic lymphoscintigraphy // Semin Nucl Med. - 1983. №13: 42–53. 47.Kim D.J., Kim J.H., Ryu Y.H., Jeon T.J., Yu J.S., Chung J.J. Nodal staging of rectal cancer: high-resolution pelvic MRI versus ¹⁸F-FDGPET // CT. J Comput Assist Tomogr. – 2011. - Vol. 35, №5. – Р. 531-534. 48. Kim J.H., Beets G.L., Kim M.J., Kessels A.G., Beets-Tan R.G. Highresolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? // Eur J Radiol. – 2004. - Vol. 52, №1. – Р. 78-83. 49. Kim T.H., Jeong S.Y., Choi D.H., Kim D.Y., Jung K.H., Moon S.H., Chang H.J., Lim S.B., Choi H.S., Park J.G. Lateral lymph node metastasis is a major cause of locoregional recurrence in rectal cancer treated with preoperative chemoradiotherapy and curative resection // Ann Surg Oncol. – 2008. - Vol. 15, №3. – Р. 729-737. 50. Kinugasa T., Akagi Y., Ochi T., Ishibashi Y., Tanaka N., Oka Y., Mizobe T., Yuge K., Fujino S., Kibe S., Shirouzu K. Lateral lymph-node dissection for rectal cancer: meta-analysis of all 944 cases undergoing surgery during 1975-2004 // Anticancer Res. – 2013. - Vol. 33, №7. – Р. 2921-2927. 51. Kobayashi H., Mochizuki H., Kato T., Mori T., Kameoka S., Shirouzu K., Sugihara K. Outcomes of surgery alone for lower rectal cancer with and without pelvic sidewall dissection // Dis Colon Rectum. – 2009. - Vol. 52, №4. – Р. 567-576. 52. Konishi T., Kuroyanagi H., Oya M., Ueno M., Fujimoto Y., Akiyoshi T., Yoshimatsu H., Watanabe T., Yamaguchi T., Muto T. Multimedia article. Lateral lymph node dissection with preoperative chemoradiation for locally advanced lower rectal cancer through a laparoscopic approach // Surg Endosc. – 2011. - Vol. 25, №7. – Р. 2358-2359. 53. Konishi T., Watanabe T., Nagawa H., Oya M., Ueno M., Kuroyanagi H., Fujimoto Y., Akiyoshi T., Yamaguchi T., Muto T. Preoperative chemoradiation and extended pelvic lymphadenectomy for rectal cancer: Two distinct principles // World J Gastrointest Surg. – 2010. - Vol. 2, №4. – Р. 95-100. 54.Kotanagi H., Fukuoka T., Shibata Y., Yoshioka T., Aizawa O., Saito Y., Tur G.E., Koyama K. The size of regional lymph nodes does not correlate with the presence or absence of metastasis in lymph nodes in rectal cancer // J Surg Oncol. – 1993. - Vol. 54, №4. – Р. 252-254. 55. Kroemer P. Die Lymphorgane der weiblichen Genitalien und ihre Veranderungen bei malignen Erkrankungendes Uterus //Arch. Gynak. – 1904. - №73. – Р. 57-158. 56.Kuru M. Cancer of the rectum. J Jpn Surg Soc 1940; 41: 832–77. 57. Kusters M., Beets G.L., van de Velde C.J., Beets-Tan R.G., Marijnen C.A., Rutten H.J., Putter H., Moriya Y. A comparison between the treatment of low rectal cancer in Japan and the Netherlands, focusing on the patterns of local recurrence // Ann Surg. – 2009. - №249. – Р. 229–235. 58.Marcille M (1902) Lymphatiques et Ganglions Ileopelviens. Thèse de Paris. Université de Paris, Paris. 59.Marsh P.J., James R.D., Schofield P.F. Adjuvant preoperative radiotherapy for locally advanced rectal carcinoma. Results of a prospective, randomized trial // Dis Colon Rectum. - 1994. - Vol. 37, №12. - P. 1205-1214. 60. Miles W.E. The spread of cancer of the rectum // Lancet. – 1925. - № 205. – Р. 1218–1219. 61.Miscusi G, Masoni L, Dell’Anna A, Montori A. Normal lymphatic drainage of the rectum and anal Coloproctology 1987; 3: 171–4. canal revealed by lymphoscintigraphy. 62.Mori T, Takahashi K, Yasuno M. Radical resection with autonomic nerve preservation and lymph node dissection techniques in lower rectal cancer surgery and its results: the impact of lateral lymph node dissection. Langenbecks Arch Surg 1998; 383: 409–1 63. Morita T., Murata A., Koyama M., Totsuka E., Sasaki M. Current status of autonomic nerve-preserving surgery for mid and lower rectal cancers: Japanese experience with lateral node dissection // Dis Colon Rectum. – 2003. - Vol. 46, №10 Suppl. – Р. 78-88. 64.Moriya Y., Hojo K., Sawada T., Koyama Y. Significance of lateral node dissection for advanced rectal carcinoma at or below the peritoneal reflection // Dis Colon Rectum. – 1989. - Vol. 32, №4. – Р. 307-315. 65. Moriya Y., Sugihara K., Akasu T., Fujita S. Importance of extended lymphadenectomy with lateral node dissection for advanced lower rectal cancer // World J Surg. – 1997. - Vol. 21, №7. – Р. 728-732. 66.Nagawa H., Muto T., Sunouchi K., Higuchi Y., Tsurita G., Watanabe T., Sawada T. Randomized, controlled trial of lateral node dissection vs. nervepreserving resection in patients with rectal cancer after preoperative radiotherapy // Dis Colon Rectum. – 2001. - №44. – Р. 1274–1280. 67.National Comprehensive Cancer Network (NCCN) Clinical practice guidelines in oncology (NCCN Guidelines TM). Rectal Cancer. Version 4. 2013 68. Oh H.K., Kang S.B., Lee S.M. et al. Neoadjuvant chemoradiotherapy Affects the Indications for Lateral Pelvic Node Dissection in Mid/Low Rectal Cancer with Clinically Suspected Lateral Node Involvement: A Multicenter Retrospective Cohort Study // Ann Surg Oncol. – 2014. - №7. – P. 821-823 69.Ortiz H., Wibe A., Ciga M.A., Lujan J., Codina A., Biondo S. Spanish Rectal Cancer Project. Impact of a multidisciplinary team training programme on rectal cancer outcomes in Spain // Colorectal Dis. – 2013. - Vol. 15, №5. – Р. 544-551. 70.Peeters K.C., Marijnen C.A., Nagtegaal I.D., Kranenbarg E.K., Putter H., Wiggers T., Rutten H., Pahlman L., Glimelius B., Leer J.W., Van de Velde C.J. Dutch Colorectal Cancer Group. The TME trial after a median follow-up of 6 years: increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma // Ann Surg. – 2007. Vol. 246, №5. – Р. 693-701. 71.Puli S.R., Reddy J.B., Bechtold M.L. et al. Accuracy of endoscopic ultrasound to diagnose nodal invasion by rectal cancers: a meta-analysis and systematic review // Ann Surg Oncol. – 2009. – Vol. 16 №5. – P. 1255-1265. 72.Quadros CA, Falcão MF, Carvalho ME, Ladeia PA, Lopes A. Metastases to retroperitoneal or lateral pelvic lymph nodes indicated unfavorable survival and high pelvic recurrence rates in a cohort of 102 patients with low rectal adenocarcinoma. J Surg Oncol. 2012 Nov;106(6):653-8. doi: 10.1002/jso.23144. Epub 2012 Apr 25. 73.Quénu E. Vaisseaux lymphatiques de l’Anus. Bullet de la Société anatom de Paris 1893; 5: 399–409. 74.Rodriguez M., Segovia C., Lopez J.A. et al. The accuracy of endorectal ultrasound in the preoperative staging of rectal cancer // Eur. Radiol. - 1999. Vol. 9, №4. - P. 399-400. 75. Rodriguez M., Segovia C., Lopez J.A., Echevarria J.J., Martinez A. The accuracy of endorectal ultrasound in the preoperative staging of rectal cancer // Eur. Radiol. - 1999. – номер выпуска. - P. 399-400. 76. Sabin F. R. The lymphatic system in human embryos, with a consideration of the morphology of the system as wholy // Amer. J. Anat. – 1909. – V. 9. – P. 9-43. 77. Saitoh N., Okui K., Sarashina H., Suzuki M., Arai T., Nunomura M. Evaluation of echographic diagnosis of rectal cancer using intrarectal ultrasonic examination // Dis Colon Rectum. – 1986. - Vol. 29, №4. – Р. 234242. 78. Sauer I., Bacon H.E. A new approach for excision of carcinoma of the lower portion of the rectum and anal canal // Surg Gynecol Obstet. – 1952. Vol. 95, №2. – Р. 229-242. 79.Sauer R., Becker H., Hohenberger W., Rödel C., Wittekind C., Fietkau R., Martus P., Tschmelitsch J., Hager E., Hess C. F., Karstens J. H., Liersch T., Schmidberger H., Raab R. German Rectal Cancer Study Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer // N Engl J Med. - 2004. - Vol. 351, №17. – Р. 1731-1740. 80. Shafik A., Mostafa H. Study of the arterial pattern of the rectum and its clinical application // Acta Anat (Basel). – 1996. - Vol. 157, №1. – Р. 80-86. 81. Sugihara K., Kobayashi H., Kato T., Mori T., Mochizuki H., Kameoka S., Shirouzu K., Muto T. Indication and benefit of pelvic sidewall dissection for rectal cancer // Dis Colon Rectum. – 2006. - Vol. 49, №11. – Р. 1663-1672. 82.Sugihara K., Moriya Y., Akasu T., Fujita S. Pelvic autonomic nerve preservation for patients with rectal carcinoma. Oncologic and functional outcome // Cancer. – 1996. - Vol. 78, №9. – Р. 1871-1880. 83.Syk E, Torkzad MR, Blomqvist L, Ljungqvist O, Glimelius B. Radiological findings do not support lateral residual tumour as a major cause of local recurrence of rectal cancer. Br J Surg. 2006 Jan;93(1):113-9. 84. Tanis P.J., Doeksen A., van Lanschot J.J. Intentionally curative treatment of locally recurrent rectal cancer: a systematic review // Can J Surg. – 2013. Vol. 56, №2. – Р. 135-144. 85. Titu L.V., Tweedle E., Rooney P.S. High tie of the inferior mesenteric artery in curative surgery for left colonic and rectal cancers: a systematic review // Dig Surg.- 2008.- 25(2).- P.148-157 86.TNM: Классификация злокачественных опухолей. / Под ред. Л.Х. Собинина и др.; пер. с англ. и науч. ред. А.И. Щѐголева, Е.А. Дубовой, К.А. Павлова. — М.: Логосфера, 2011. — 276 с. — Перевод изд. TNM Classification of Malignant Tumours, 7th ed. 87. Tondury G. und Kubik St. Zur Ontogenese des Lymphatischen System // Handbuch der Allgemeinen Pathologie. Bd. III/6. Lymphgefassystem. Lymph Vessels system. – Berlin, Heidelberg, New York: Springer-Verlag, 1997. – P. 164-180. 88. Villemin F., Huard P., Montagné M. Recherches anatomiques sur les lymphatiques du rec¬tum et de l’anus. Leurs applications dans le traitment chirurgical du cancer // Rev de chir. – 1925. - №63. – Р. 39–80. 89. Wang Hong; Chen Jin; Wu Ming. Эндоректальное ультразвуковое исследование у больных раком прямой кишки // Nanjing daxue xuebao. 1998. - №2. - P. 204-206. 90. Wibe A., Syse A., Andersen E., Tretli S., Myrvold H.E., Søreide O. Norwegian Rectal Cancer Group. Oncological outcomes after total mesorectal excision for cure for cancer of the lower rectum: anterior vs. abdominoperineal resection // Dis Colon Reсtum. – 2004. - Vol. 47, №1. – Р. 48-58. 91. Wiig J.N., Carlsen E., Søreide O. Mesorectal excision for rectal cancer: a view from Europe // Semin Surg Oncol. – 1998. - Vol. 15, №2. – Р. 78-86. 92.Wong C.S., Cummings B.J., Brierley J.D., Catton C.N., McLean M., Catton P., Hao Y. Treatment of locally recurrent rectal carcinoma - results and prognostic factors // Int J Radiat Oncol Biol Phys. – 1998. - Vol. 40, №2. – Р. 427-435. 93. Yamakoshi H., Ike H., Oki S., Hara M., Shimada H. Metastasis of rectal cancer to lymph nodes and tissues around the autonomic nerves spared for urinary and sexual function // Dis Colon Rectum. – 1997. - Vol. 40, №9. – Р. 1079-1084. ПРИЛОЖЕНИЯ Приложение 1. Приложение 2. Отчет МРТ исследования 1. МРТ протокол Общее качество снимков: Хорошее Удовлетворительное 2. Расположение опухоли Расположение опухоли (расстояние до ануса): Не информативно Низкое (0–5,0 см) Среднее (5,1–10,0 см) Высокое (10,1–15,0 см) Расстояние от нижнего края опухоли до ануса: __________см Расстояние от нижнего края опухоли до верхнего края сфинктора: __________см Отношение к передней складки брюшины: Выше На уровне Ниже Невозможно оценить 3. Характеристика опухоли Распростронение/расположение (усл. циферблат) по окружности ___________ Краниокаудальный размер: __________см Муцинозная: Нет Да 4. Т-категория а) Т-категория: Т1 или Т2 Т2/ранняя Т3 (включая наличие спикул параректальной клетчатки) Т3 Т3/возможно Т4 Т4 Укажите структуры в которые возможно врастание опухоли(из списка): _____________________ Органы мочеполовой системы Мочевой пузырь Правый/левый мочеточник Простата Матка Влагалище M. levatol ani M. pubococcygeus M. ileococcygeus M. coccygeus Стенки таза M. obturatorius internus M. piriformis Кости/сосуды Крестец (указать уровень поражения) Правые/левые внутренние подвздошные сосуды Правые/левые наружные подвздошные сосуды Другие Передняя складка брюшины б) Для низких опухолей прямой кишки (0-5см): Нижних край опухоли на уровне или ниже верхней границы M. puborectalis: Нет Да При варианте «Да», укажите структуру с наибольшим опухолевым прорастанием: Возможно ограничение подслизистым слоем. Нет явных признаков поражения внутреннего сфинктера (Т1) Ограничение внутренним сфинктером. Нет вовлечения межсфинктерной клетчатки или наружного сфинктера (ранняя Т2) Прорастание через внутренний сфинктер и межсфинктерной клетчатки. Возможное или явное поражение наружного сфинктера (поздняя Т2) Прорастание через наружный сфинктер и окружающие мягкие ткани. Нет прорастания в органы. Прорастание через наружный сфинктер с возможным поражением соседних органов (простата, влагалище и т.д.) (Т3/Т4) Прорастание через наружный сфинктер с достоверным прорастанием в соседние органы (простата, влагалище и т.д.) (Т4) 5. Расстояние до мезоректальной фасции и внестеночная глубина прорастания а) Кратчайшее расстояние от границы опухоли до мезоректальной фасции __________см ( или Невозможно или оценить Неприменимо, т.к. поражена перитонизированная часть кишки или Т4а б) Внестеночная глубина прорастания __________см в) Имеются ли опухолевые спикулы в непосредственной близости с мезоректальной фасцией Нет Да г) Имеются ли другие компоненты опухоли непосредственной близости с мезоректальной фасцией Нет Да Укажите расстояние __________см и располажение ________(по часам условного циферблата)ъ 6. Внестеночное прорастание в сосуды Отсутствует Сомнительное 7. Мезоректальные лимфатические узлы и опухолевые метастазы Имеются ли подозрительные мезоректальные узлы и/или метастазы опухоли? (неровная граница, сигнал разной интенсивности, размер ≥ 8 мм) Если «Да»: Присутствует Нет Да Кратчайшее расстояние от подозрительного мезоректального узла/метастаза опухоли до мезоректальной фасции __________см Укажите располажение лимфаического узла/метастаза ближайшего к мезоректальной фасции: На уровне опухоли, на ______ часах Выше опухоли, на ______ часах Ниже опухоли, на ______ часах 8. Другие лимфатические узлы Нет Да Имеются ли подозрительные лимфатические узлы (кроме мезаректальных) (неровная граница, сигнал разной интенсивности, размер ≥ 1 см) Укажите локализацию: Вдоль нижней брыжеечной артерии Вдоль верхней прямокишечной артерии Вдоль дистальной части внутренней подвздошной артерии справа Вдоль дистальной части внутренней подвздошной артерии слева Вдоль внутренней подвздошной артерии справа Вдоль внутренней подвздошной артерии слева В запирательном пространстве справа В запирательном пространстве слева Паховые лимфатические узлы справа Паховые лимфатические узлы слева Если имеются, отметить с учетом локализации, количества и размеров