Диагностика вируса шарки сливы на косточковых культурах
реклама

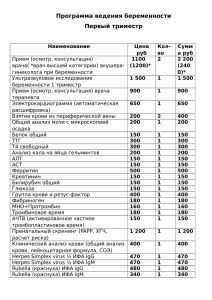
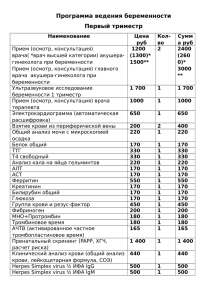
КАРАНТИН 57 %, кэ и др. В индивидуальных са$ дах можно применять фьюри, 10 %, вэ, фуфанон, 57 %, кэ, кеми$ фос, 57 %, кэ, искру М, 52,5 %, кэ, инта$вир, впр и др. в соответствии с Государственным каталогом пести$ цидов и агрохимикатов, разрешен$ ных к применению на территории Российской Федерации на данный период. Эти пестициды эффективны также против других вредителей сада. В первой декаде мая в боль$ шинстве случаев также наблюдается интенсивный лёт бабочек плодожор$ ки, но в это время продолжается цве$ тение садов и обработки исключены. Интенсивный лёт бабочек II гене$ рации начинается с третьей декады июня и продолжается по первую де$ каду августа, значит, с конца июня и в июле можно также применять пес$ тициды, но не позднее, чем за 20– 40 дней до съема плодов. При низкой численности восточной плодожорки (менее 3 бабочек на 1 ловушку в сутки) можно вывесить в саду клеевые феромонные ловушки из расчета 50 ловушек на 1 га в про$ изводственных садах или 2 ловушки на 100 м2 в ЛПХ в целях борьбы. Кле$ евые вкладыши в ловушках меняют по мере их заполнения насекомыми. Период интенсивного лёта восточ$ ной плодожорки III генерации более растянут по сравнению со второй из$за понижения температуры воз$ духа. Почти во все годы наблюдений наиболее интенсивный лёт бабочек III генерации приходился на I и II де$ кады сентября. В это время для за$ щиты урожая зимних сортов плодо$ вых и после уборки более ранних сортов можно снова применить пе$ стициды, которые снизят повреж$ денность плодов и уменьшат зиму$ ющий запас вредителя. Таким образом, для организации успешной борьбы с восточной пло$ дожоркой необходимо знать, имеет$ ся ли этот вредитель в вашем саду, какова его численность и периоды лёта бабочек. Ответы на эти вопро$ сы можно получить с помощью феро$ монных ловушек, которые вывешива$ ют в саду на деревьях на высоте 1,5– 2 м из расчета 1 ловушка на 2–5 га. УДК 578.85/86.083.2:577.152 Диагностика вируса шарки сливы на косточковых культурах П.А. ПОХОДЕНКО, младший научный сотрудник Всероссийского селекционно* технологического института садоводства и питомниководства М.Т. УПАДЫШЕВ, заведующий отделом защиты растений Потивирус шарки сливы (PPV), вы$ зывающий существенное снижение урожая косточковых культур и ухуд$ шающий товарные качества плодов (Вердеревская, Маринеску, 1985), относится к ограниченно распрост$ раненным на территории Российс$ кой Федерации карантинным орга$ низмам. Ключевым элементом любой тех$ нологии получения безвирусных кло$ нов является диагностика латентной вирусной инфекции. Важным шагом в направлении совершенствования диагностики стало внедрение в прак$ тику метода иммуноферментного анализа – ИФА (Clark, Adams, 1977). Данный метод позволяет в краткие сроки (2–3 дня) в лабораторных ус$ ловиях осуществлять тестирование нескольких сотен образцов. Однако получение диагностичес$ ких сывороток возможно далеко не ко всем вирусам и фитоплазмам пло$ довых культур, а сам метод ИФА име$ ет недостаточную чувствительность при выявлении вирусов в конце веге$ тации и в состоянии покоя растений, в тканях коры и древесины, а также в культурах in vitro. Как правило, ис$ пользование метода ИФА ограничи$ вается двумя месяцами после нача$ ла вегетации растений. Указанных недостатков лишены методы молекулярной диагностики с использованием полимеразной цепной реакции (ПЦР), являющиеся в настоящее время наиболее совре$ менными технологиями определе$ ния патогенов (Olmos et al., 2002). К преимуществам ПЦР$теста относят$ ся чрезвычайно высокие специфич$ ность и чувствительность. Проведе$ ние анализа возможно в течение всего одного дня. ПЦР$тесты для диагностики раз$ личных патогенов плодовых культур (вирусы, вироиды, фитоплазмы, бактерии, грибы и др.) активно раз$ рабатываются и внедряются во всем мире (Candresse et al., 1995; Kummert et al., 2004). Однако в Рос$ сии было проведено крайне ограни$ ченное число исследований по мо$ лекулярной диагностике вирусов плодовых культур (Филимонова и др., 2000, Добржанская и др., 2001), вследствие чего ПЦР$тесты по$пре$ жнему редко применяются в вирусо$ логической практике. Эксперименты проводили на базе лаборатории вирусологии ВСТИСП. Объектом служил вирус шарки сли$ вы. В серологических тестах приме$ няли сэндвич$вариант иммунофер$ ментного анализа (DAS – ELISA) по методике М. Кларка и А. Адамса (1977) с использованием диагности$ ческих наборов на основе поликло$ нальных антител из НИИ садовод$ ства Молдовы и фирмы «Bio$Rad» (США). Регистрацию результатов проводили на планшетном фотомет$ ре «Stat Fax 2100» при длине волны 405 нм. Оценку зараженности об$ разцов осуществляли в соответ$ ствии с «Методическими указания$ ми по экспресс$диагностике виру$ сов на ягодных культурах» (2002). Молекулярную диагностику прово$ дили методом ОТ$ПЦР с праймера$ ми и реакционными смесями, разра$ ботанными в ООО «Агродиагности$ ка». Амплификацию выполняли на программируемом термостате «Тер$ цик», а регистрацию результатов осу$ 25 КАРАНТИН Таблица 1 Результаты тестирования разных органов сливы и вишни войлочной методами ИФА и ПЦР в осенний период на вирус шарки Изоляты Слива Вишня войлочная Листья ИФА ПЦР – + + + Почки ИФА ПЦР – – – + ществляли на трансиллюминаторе Vilber Lourmat TCP – 20.МС с выводом изображений электрофореграмм ПЦР$продуктов на компьютер. Известно, что осенью и в период покоя косточковых культур частицы вируса PPV не удается обнаружить даже методом электронной микро$ скопии (Калашян, 1973). В наших эк$ спериментах при тестировании ме$ тодом ИФА разных органов растения (листья, почки, кора, древесина) в осенний период сероположительный результат наблюдался в листьях изо$ лята вишни войлочной (табл. 1). При тестировании методом ИФА коры изолятов вишни войлочной и сливы результат был сероотрица$ тельным. Низкий титр вируса и не$ равномерное (локальное) распреде$ ление его в тканях являются основ$ ными причинами отрицательных ре$ зультатов ИФА в этих образцах. Выделение вируса и его диагнос$ тика методом ПЦР были успешными в листьях и древесине вишни вой$ лочной и сливы, в почках вишни вой$ лочной, в коре сливы. Вирус не вы$ являлся в почках сливы и в коре виш$ ни войлочной, что, вероятно, связа$ но с методом выделения РНК из тка$ ней растения. В целом вирус PPV выделялся и диагностировался ме$ Kора ИФА ПЦР – + – – Древесина ИФА ПЦР – + – + Ò à áë è ö à 2 Ð å çó ë ü òà òû òå ñ òè ð î âà í è ÿ ñ ë è âû ( in v it ro è ï î ñ ë å à ä à ï òà ö è è ) ì å òî ä à ì è È Ô À è Ï Ö Ð í à âè ð ó ñ ø à ð ê è Ñ î ð ò (ê ë î í ) Ô è î ë å òî âà ÿ (êëîí 1) Ô è î ë å òî âà ÿ (êëîí 2) Ó òð î Ð åíêëîä òà ì áî âñ ê è é Ð àñòåí è ÿ Ð àñòåí è ÿ ï îñin v itro ëå àäàï òàö è è ÈÔÀ ÏÖÐ ÈÔÀ ÏÖÐ + + + + + + + + + + + тодом ПЦР наиболее успешно в дре$ весине и листьях обеих культур. Сле$ довательно, древесина наиболее пригодна для тестирования расте$ ний в период покоя, а метод выде$ ления РНК, используемый нами, мо$ жет быть рекомендован в работе с листьями и древесиной. При оздоровлении растений от вирусов с использованием метода культуры тканей важное значение имеет чувствительность метода ди$ агностики. Часто метод ИФА не по$ зволяет выявлять вирусы в проби$ рочных растениях, поскольку кон$ центрация вирусов в них, как прави$ ло, низкая. Это затрудняет коррект$ ную диагностику вирусов in vitro и выбраковку зараженных растений, ПЦРAанализ растений сливы разных сортов на вирус шарки Растения после адаптации: 1 – Фиолетовая (клон 1); 2 – Фиолетовая (клон 2); 3 – Утро; 4 – Ренклод тамбовский. Растения in vitro: 6 – Утро, 7 – Фиолетовая, 8 – Ренклод тамбовский. Образцы различного происхождения: 9 – слива изолят (кора), 10 – слива изолят (древесина). (К–) отрицательный контроль, (К+) положительный контроль; а – фрагмент кДНК, соответствующий внутреннему контролю размером 560 пар нуклеотидов; б – фрагмент кДНК размером 268 п.н. 26 что в конечном итоге приводит к уве$ личению затрат времени, материа$ лов и финансовых ресурсов при про$ ведении технологического процес$ са оздоровления. После адаптации пробирочных растений к нестериль$ ным условиям происходит накопле$ ние вирусов в тканях растений, что обеспечивает их успешную диагно$ стику методом ИФА. Поэтому нами был проведен срав$ нительный анализ результатов выяв$ ления вирусов в пробирочных расте$ ниях и растениях после адаптации методами ИФА и ПЦР. При тестирова$ нии пробирочных растений методом ИФА вирус шарки сливы не выявлял$ ся, что связано с низкой концентраци$ ей вируса в растении (табл. 2). Вместе с тем в растениях после адаптации вирус диагностировался методом ИФА у сортов Фиолетовая (клон 2), Утро, Ренклод тамбовский. Вирус PPV не выявлялся методом ИФА в клоне 1 сорта Фиолетовая, что также объясняется низкой кон$ центрацией вируса в растении. С применением ПЦР$анализа удалось детектировать вирус шарки сливы как в растениях in vitro (рисунок), так и в растениях после адаптации в от$ личие от ИФА. Следовательно, метод ПЦР при те$ стировании растений in vitro оказал$ ся предпочтительнее по сравнению с ИФА. Аналогичные результаты, подтверждающие его высокую эф$ фективность при тестировании про$ бирочных растений сливы на вирус шарки, получены и другими исследо$ вателями (Добржанская и др., 2001). Таким образом, в период покоя ко$ сточковых культур метод ПЦР позво$ ляет с высокой степенью достовер$ ности осуществлять их тестирование на вирус PPV в древесине растений, тогда как чувствительность метода ИФА в данный период часто бывает недостаточной для выявления вирус$ ной инфекции. С применением ПЦР$ анализа удалось успешно диагности$ ровать вирус шарки сливы как в рас$ тениях in vitro, так и в растениях пос$ ле адаптации. Метод ИФА при тести$ ровании растений in vitro оказался менее чувствительным, чем ПЦР.