Диагностика бруцеллёза методом полимеразной цепной
advertisement

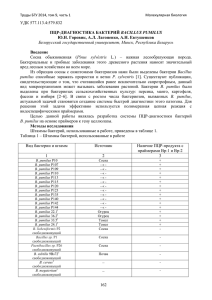
ВЕТЕРИНАРНЫЕ НАУКИ Как известно, молозиво имеет повышенную плотность в силу большего содержания в единице объёма сухих веществ, жира, белков, солей и т.д. Изменения плотности молозива в первых удоях практически одинаковы у животных обеих групп как по величине показателя, так и по динамике его изменения, что подтверждает имеющиеся данные [6]. Титруемая кислотность молозива обусловливается солями фосфорной и лимонной кислот, белковыми веществами, имеющими кислый характер, а также растворённым в молозиве диоксидом углерода. Исследованиями установлена достаточно высокая кислотность молозива в первом удое. Так, у животных II гр. она была на уровне 45,51±2,28 °Т, I гр. – 52,51±2,19 °Т соответственно. Во втором удое кислотность понижается у голштинов на 7° Тернера, а у чёрно-пёстрого скота – на 9,43 °Т. В третьем удое кислотность уменьшилась на 6–8 °Т, в четвёртом и пятом – на 4–5 °Т. Минеральные вещества имеют важное физиологическое и технологическое значение при переработке молока. В молозиве находятся все элементы, обеспечивающие минеральный обмен в организме, нормальный рост и развитие животного. В первых удоях молозива отмечается повышенное содержание основных элементов, что подтверждает имеющиеся в литературе данные [7]. Установлено, что у новотельных коров I гр. в пробах первого удоя содержалось 47,10±1,96 мМ/л неорганического кальция и 47,84±1,83 мМ/л неорганического фосфора. У животных II гр. в первом удое молозива содержалось кальция 44,58±1,38 и фосфора – 42,69±2,14 мг/%. Наиболее заметное уменьшение кальция и фосфора отмечено в пробах четвёртого удоя – соответственно до 34,32±1,21 и 35,95±1,73 мМ/л. Выводы. Анализ физико-химических свойств молозива новотельных коров показал, что многие параметры, характеризующие их, были близки или тождественны по динамике в первых пяти удоях у животных обеих групп. Однако местный скот имел преимущества по концентрации общего белка, кальция и фосфора, молочного сахара. Литература 1. Шпис А.А. Молочная продуктивность и технологические свойства молока коров различных генотипов // Вступление Казахстана в ВТО: проблемы и перспективы: матер. междунар. науч.-практич. конф. Кустанай, 2006. С. 323–327. 2. Гертман А.М., Бертазин А.Б. Биологические особенности и молочная продуктивность чёрно-пёстрых и помесей коров стада Челябинского агроинженерного университета // Актуальные проблемы интенсификации животноводства и подготовка специалистов: матер. науч.-практич. конф. Троицк: Изд-во УГАВМ, 1993. С. 93–96. 3. Алешкина С.В., Сарапкин В.Г. Зависимость молочной продуктивности и долголетия коров чёрно-пёстрой породы от возраста первого отёла // Селекция, кормление, содержание сельскохозяйственных животных и технология производства продуктов животноводства: сб. науч. труд. ВНИИплем. М.: Изд-во ВНИИПЖ, 2007. В. 20. С. 57–61. 4. Мостовая В.В. Иммунобиологический статус и адаптационные возможности нетелей разных генотипов: автореф. дисс. … канд. биол. наук. Оренбург, 2008. 5. Прусов М.А. Химический состав молока у первотёлок чёрно-пёстрой породы // Особенности племенной работы с сельскохозяйственными животными: сб. научн. тр. М., 1991. С. 73–81. 6. Горелик О.В., Лыкасова Н.И. Влияние генотипа на молочную продуктивность коров // Технологические проблемы производства продукции животноводства: сб. науч. трудов. Троицк: Изд-во УГАВМ, 2002. С. 14. 7. Горбатова К.К. Биохимия молока и молочных продуктов: учеб. для вузов. СПб.: Гиорд, 2001. 314 с. Диагностика бруцеллёза методом полимеразной цепной реакции (ПЦР) К. Ж. Кушалиев, д.в.н., профессор, Р. Г. Зулхарнаева, соискатель, Западно-Казахстанский АТУ; Н. А. Сивожелезова, д.с.-х.н., профессор, Оренбургский ГАУ Бруцеллёз животных широко распространён в Казахстане, наносит огромный ущерб животноводству и представляет большую угрозу здоровью людей. Предотвращение эпизоотии позволяет поддерживать и развивать необходимые межхозяйственные, межрегиональные и государственные связи, а успешная борьба с болезнями животных, опасных для человека, обеспечивает охрану здоровья населения страны [1, 2]. Цель исследований – провести анализ на бруцеллёз методом ПЦР. Объекты, методы и результаты исследований. Работа выполнялась на базе НИИ (лаборатории биотехнологии инженерного профиля) ЗападноКазахстанского АТУ. Использовали следующие реактивы и расходные материалы: агароза (ДиаэМ, Россия); бромид димидия (RT193993, ICN, США); бром феноловый синий (B5525, Sigma, Германия); диоксинуклеозидтрифосфаты – смесь dАТР, dТТР, dСТР, dGТР (2 мм), R0241 (Ферментас, Литва; Сибэнзим, Россия); таq-полимераза (5 ед/мкл) (Синтол, Россия); тригидроксиметиламинометан (Трис, USB, Великобритания); этиловый спирт (Россия). Применяли оборудование: автоматические дозаторы переменного объёма (0,1–20 м, 20–200 м, 109 ВЕТЕРИНАРНЫЕ НАУКИ 200–1000 м); анализатор-термоциклир (амплификатор) для детекции нуклеиновых кислот методом ПЦР iCycler IQ5; бокс абактериальной воздушной защиты БАВп-01-«Ламинар-С»-1,2(01); бокс для проведения GWH работ UVC/T-M-AR; гельдокументирующая система Geldoc XR system PC; источник тока PowerPac basic; центрифуга Heraeus Pico 17. Выделение ДНК проводили при помощи коммерческого набора «Амплисенс» «ДНКсорб-Б». Вначале лизирующий раствор прогрели при температуре 65 °С до полного растворения кристаллов. К сыворотке крови животных добавили 300 мкл лизирующего раствора, тщательно перемешивали смесь на вортексе и прогревали 5 мин при температуре 65 °С, затем ещё раз перемешивали на вортексе. В каждую пробирку вносили 25 мкл суспензии сорбента, перемешивали и оставляли на 2 мин для осаждения сорбента. Затем повторно проводили перемешивание на вортексе и оставляли на 5 мин для осаждения сорбента. Сорбент осаждали на микроцентрифуге при 5 тыс. об./мин в течение 30 с и отбирали супернатант из каждой пробирки отдельным наконечником. Вносили по 300 мкл раствора для отмывки № 1, тщательно перемешивали смесь на вортексе и вновь осаждали в прежнем режиме. Вносили по 500 мкл раствора для отмывки № 2, ресуспендировали на вортексе, осаждали микроцентрифугированием 10000 об./мин в течение 30 сек и удаляли супертанант. Повторяли процедуру отмывки раствором № 2. Элюцию проводили при помощи 50 мкл ТЕ-буфера. Качество выделения ДНК определяли при помощи метода электрофореза в агарозном геле. При подключении к источнику тока отрицательно заряженная ДНК начинает двигаться в геле от катода к аноду. При этом более короткие молекулы ДНК движутся быстрее, чем длинные. На скорость движения ДНК в геле влияют концентрация агарозы, напряжённость электрического поля, температура, состав электрофорезного буфера. Все молекулы одного размера движутся с одинаковой скоростью. Краситель встраивается плоскостными группами в молекулы ДНК [3, 4]. После окончания электрофореза, продолжающегося около 10–20 мин при напряжении тока 90–120 В, гель помещали в камеру трансиллюминатора, излучающего свет в ультрафиолетовом диапазоне (254–310 нм). Энергия ультрафиолета, поглощаемая ДНК в области 260 нм, передаётся на краситель, заставляя его флуоресцировать в оранжево-красной области видимого спектра (590 нм) [5]. Подбор праймеров осуществляли на основе имеющихся литературных данных по изучению Brucella spp и данных секвенирования ДНК вакцин. В результате обработки литературных материалов были подобраны две пары праймеров для видового определения возбудителей заболевания бруцеллёза. На основе компьютерного анализа при помощи пакета программ Vector NTI проанализировали подобранные две пары праймеров. В результате анализа первая подобранная пара праймеров 24-1 (TGCAGCTCACGGATAATTTG) и 24-2 (ACACCTTGTCCACGCTCAC) строго специфична для B. аbortus. Вторая пара 25-1 (ATCTGGTTCTTTCGGGTGTG) и 25-2 (CATCACCAAGAACCGTGTTG) – является маркерной для определения видов B. аbortus, B. melitensis и B. suis. Праймеры были заказаны и синтезированы в компании «Бигль» (СанктПетербург). Оптимизация условий проведения полимеразной цепной реакции проведена с учётом имеющихся литературных данных по изучению Brucella spp и проведению ПЦР. Была разработана программа амплификации коллекции ДНК микроорганизмов рода Brucella, состоящая из 42 циклов. Она включает в себя несколько этапов: 1-й этап «денатурации» при 95 °С в течение 3 мин; 2-ой этап – «отжига» при 63 °С в течение 1 мин; 3-й этап – «элонгации», или «синтеза», при 72 °С в течение 1 мин. Реакционная смесь состояла из следующих компонентов: праймеров по 0,1 мкл; буфера для проведения ПЦР реакции по 2,0 мкл; MgCl 1.5 M по 1,2 мкл; смеси дизоксинуклеотидтрифосфатов dNTP в количестве 0,4 мкл и тaq-полимераза по 0,4 мкл на реакцию. В оптимизированную реакционную смесь мы добавляли по 1 мкл ДНК, полученной из сыворотки крови животных; по 0,1 мкл праймеров 24-1 (TGCAGCTCACGGATAATTTG) и 24-2 (ACACCTTGTCCACGCTCAC). В результате исследования ПЦР-продуктов методом электрофореза в агарозном геле мы получили специфические отчётливые полосы, означавшие, что ДНК бруцеллы содержится в сыворотке крови животных. 110 Литература 1. Vierstraete Andy // Principle of the PCR. University of Ghent, March 2001. 2. Фёдоров Н.А., Суханов Ю.С., Асади Мобархан А.Х. и др. Полимеразная цепная реакция (ПЦР): метод. пос. М., 1996. С. 33. 3. Сайдулдин Т.С., Уразбекова Д.С. Диагностика бруцеллеза крупного рогатого скота // Вестник сельскохозяйственной науки Казахстана. 2000. № 8. С. 37–39. 4. Wardeska B., Jaszczak K., Pierzchaza M., Parada R., Korczak M. Divergent selection for skeletal malformations in chickens alters polymorphism at microsatellite loci // J. Appl. Genet. 45(1). 2004. Pp. 61–71. 5. Wardeska B., Olszewski R., Jaszczak K., Zieba G., Pierzchaza M., Wicinska K. Relationship between microsatellite marker alleles on chromosomes 1-5 originating from the Rhode Island Red and Green-legged Partrigenous breeds and egg production and quality traits in F2 mapping population // J. Appl. Genet. 43(3). 2002. Pp. 319–329.