ИССЛЕДОВАНИЕ ОКИСЛЕНИЯ ТЕХНИЧЕСКОГО УГЛЕРОДА
реклама
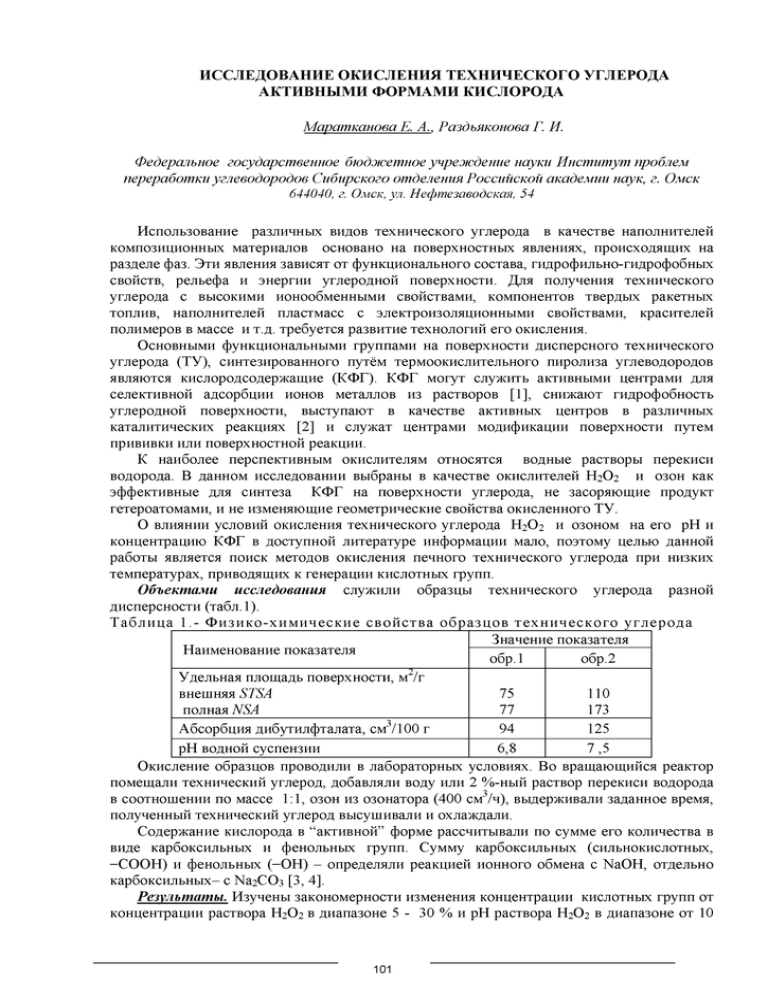
ИССЛЕДОВА Н ИЕ О К И С Л ЕН И Я ТЕХ Н И ЧЕСКО ГО УГЛЕРОДА А К ТИ В Н Ы М И Ф О РМ А М И КИ СЛО РО Д А М арат канова Е. А., Раздьяконова Г. И. Федеральное государственное бюдж етное учреж дение науки И нст ит ут проблем переработ ки углеводородов Сибирского от деления Российской академии наук, г. Омск 644040, г. Омск, ул. Нефтезаводская, 54 И сп ол ьзован и е разл ич ны х видов техн и ческого угл ерод а в качестве наполни телей ком п ози ц и он н ы х м атериалов осн овано н а п оверхностны х явлениях, п рои сходящ их на разд ел е фаз. Э ти явл ен и я зави сят от ф ун кц ион альн ого состава, ги дроф и л ьн о-ги д роф об н ы х свойств, рел ьеф а и эн ер ги и углерод ной поверхности. Д ля п олучени я техн и ческого угл ер о д а с вы соки м и ион ооб м ен н ы м и свойствам и, ком пон ентов твер д ы х ракетн ы х топлив, напол н и телей пластм асс с эл ек трои зол яц и он н ы м и свойствам и, краси телей поли м еров в м ассе и т.д. тр еб уется разви ти е техн о л о ги й его окисления. О сновн ы м и ф ункц ион альн ы м и группам и на поверхн ости дисп ерсн ого техн и ческого угл ер о д а (ТУ ), си нтези рован н ого путём тер м ооки сл и тельн ого п и ролиза углеводородов явл яю тся кислород сод ерж ащ ие (К Ф Г). К Ф Г м огут служ ить активны м и центрам и для селекти вной адсорбци и ионов м еталлов из растворов [1], сн иж аю т ги дроф обн ость у гл ерод н ой поверхности, вы ступ аю т в качестве активны х центров в различны х каталити ческих реакц и ях [2] и служ ат центрам и м одиф и каци и п оверхн ости путем п ри вивки или п о в ерхн остн ой реакции. К н аиболее п е рсп екти вн ы м оки сли тел ям относятся водны е растворы перекиси водорода. В д ан н ом иссл ед ован и и вы бран ы в качестве окисли телей H 2O 2 и озон как эф ф ек ти вн ы е для си нтеза К Ф Г н а п оверхн ости углерода, не засоряю щ и е продукт гетероатом ам и, и не изм ен яю щ ие геом етри ческие свой ства окисленного ТУ. О влияни и услови й окисления техн и ческого угл ер о д а H 2O 2 и озоном на его рН и конц ентрац ию К Ф Г в д о ступ н ой л и тературе ин ф орм ац и и мало, поэтом у целью данн ой работы явл яется п ои ск м етодов оки слен и я печного техн и ческого угл ер о д а при низких тем пературах, п ри водящ их к ген ерац ии кислотн ы х групп. О бъект ам и исследования служ или об разцы техн и ческого угл ер о д а разн ой д и сп ерсн ости (табл.1). Т а б л и ц а 1 .- Ф и з и к о - х и м и ч е с к и е с в о й с т в а о б р а з ц о в т е х н и ч е с к о г о у г л е р о д а З н ачен и е показателя Н аи м ен ован и е показателя обр.2 обр.1 У д ел ьн ая пл ощ ад ь поверхности, м /г вн еш н яя STSA полная NSA 75 77 110 173 А бсорб ц и я дибутилф талата, см /100 г 94 125 рН водной суспензии 6,8 7 ,5 О кислен ие образцов п роводи ли в лабораторн ы х условиях. В о вращ аю щ и й ся реактор п ом ещ али техн и ч ески й углерод, д об авл ял и воду или 2 % -н ы й раствор п ереки си водорода в соотн ош ен и и по м ассе 1:1, озон из озонатора (400 см /ч), вы д ерж и вал и зад ан н о е время, п олученн ы й техн и чески й углерод вы суш и вал и и охлаж дали. С од ерж ан ие ки слород а в “ акти вн ой ” ф орм е рассчи ты вали по сум м е его колич ества в виде карбокси льн ы х и ф ен ольн ы х групп. С ум м у карб окси льн ы х (сильнокислотны х, -C O O H ) и ф ен ольн ы х (-O H ) - оп ределяли р еакц и ей ион ного обм ена с N aO H , отдельн о к а р б о к с и л ь н ы х - с N a 2C O 3 [3, 4]. Р езульт ат ы . И зучен ы закон ом ерн ости изм ен ени я конц ен трац и и кислотн ы х групп от конц ен трац и и раствора H 2O 2 в д иап азоне 5 - 30 % и рН р аствора H 2O 2 в д иап азоне от 10 101 до 2. П оказано, что наиб ольш ая конц ентрац ия п ротон огенн ы х групп достигается в си льн оки сл отн ом д иап азоне при рН 30 % -ного раствора H 2O 2 (рис. 1). Концентрация раствора Н20 2 . » 40 - - 30 Ч % . " > “S i5 20 Л! Ш ‘■'U - , ’ 6,5 ' S X о. ' ,Jj**4* v 45 3.5 | 0 1 2 3 4 5 6 7 6 9 10 11 pH раствора Н202 -------► " ------- ------- ■ _ • 5.5 • . • 2.5 20 40 Время, мин Рис. 1. В л и ян и е конц ентрац ии и рН раствора Н 2О 2 на генерацию протон оген н ы х групп на поверхности техн и ческого угл ерод а обр.2 при его окислении. ♦ 60 -------А- Рис. 2 Д и н ам и к а изм ен ени я рН сусп ензи и образца техн и ческого угл ерод а (Т У ) N 326 при воздей ствии активны х ф орм кислорода H 2O2 (1), О ^ в водной среде (2) и О3 в растворе H 2O2 (3) Т аким образом , подбирая услови я окисления - рН и конц ентрац ию перекиси водорода, м ож но получать разн ови д н ости ф ункц ион ал изированны х видов техн и ческого углерода. О днако, и спользовани е кон ц ентри рованн ы х растворов перекиси водорода довол ьн о слож но при п ракти ческом прим енении, а разб авл ен н ая H 2O 2 н еэф ф ективн а (рис.2). П оэтом у д ля уси лен и я д ействия H 2O 2, д об авили к ней другой кислород сод ерж ащ и й окислитель. И з литературы известно, что см есь окисли телей активнее каж дого из них, что об ъясн яется об разован ием активны х ф орм кислорода. П ри во зд ей стви и их на техн и чески й углерод м ож но ож идать ускорен ия гетерогенной реакции. Д л я проверки этого п редп олож ени я изучен о и зм ен ени е рН сусп ензи и техн и ческого угл ер о д а в среде 2 % -н ой перекиси водорода, в которую проп ускали озон с расход ом 400 см 3/ч .П р и ген ерац ии кислотн ы х групп рН водной сусп ензи и техн и ческого углерода п он иж ается до 2,5-3,5 ед. Д ей ствительно, окисление разд ельно перекисью вод ород а или озоном п ри вод ит к сниж ению рН водной сусп ензи и техн и ческого угл ерод а на 0,3 и 2 ед. соответственно, а доб авл ен и е озона к перекиси вод ород а - на 3 ед., что косвенно под тверж д ает п редп олож ени е об об разован и и более акти вн ы х ф орм ки слород а в см еси окислителей, и указы вает на эф ф ек ти вн о сть их прим енения. За клю чение. Т аким образом , окисление техн и ческого угл ерод а 30-20% растворам и п ерекиси вод ород а в си льн окислотной среде п ри вод и т к ген ерац ии кислотн ы х групп. Н о зн ачи тельн о эф ф ек ти вн ее окисление см есью кислород сод ерж ащ и х окислителей. С овм естн ое д ействие перекиси вод ород а и озона сущ ественно, на 3 ед, сн иж ает рН водной сусп ензи и техн и ческого углерода. Работа выполнена при финансовой поддержке Министерства промышленности и торговли Российской Федерации в рамках Федеральной целевой программы №2 контракта и государственного № 12208.1007999.13.012. Литература: 1. L.R. Radovic, C. Moreno-Castilla, J. Rivera-Utrilla // In: Radovic LR, editor. Chemistry and physics o f carbon. - New York: Marcel Dekker, 2000. - V. 27. -Р. 227-405. 2. Rodri'guez-Reinoso, F. Carbon. - 1998. - №3, V.36. - P. 159-175. 3. Черонис Н.Д., М а Г.С. Микро- и полумикрометоды органического функционального анализа. М.: Химия, 1973. 463 с. 4. Boehm H.P. // Carbon. 2002. V. 40. P. 145. 102