групп (рис. 2). Обращает на себя внимание тот факт, что... активных тучных клеток выше, чем в контрольной группе.
реклама

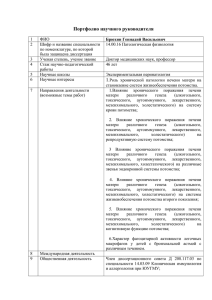
групп (рис. 2). Обращает на себя внимание тот факт, что у подопытных крысят процент активных тучных клеток выше, чем в контрольной группе. к 70 о 90 • I 60 —И § 50 к 40 контроль — -•• ' •••» 3 1° опыт] • опыт 2 § 20 § 80 • 70 • 60 • § 50 • 40 • а 30 • 1§ 1 d\ 30 15 45 60 20 10 • 0• Возраст, сутки 15 30 45 60 Возраст, сутки а б Рис. 2. Динамика изменения популяции неактивных (а) и активных (б) тучных клеток у экспериментальных животных Таким образом, у потомства животных с экспериментальным поражением печени установлено увеличение числа тучных клеток в тимусе и изменение их популяционного состава в сторону увеличения числа тучных клеток с высокой степенью гранулярного насыщения и высокой степенью дегрануляции, что свидетельствует, на наш взгляд, об увеличении функциональной активности мастоцитов. Список литературы 1. Арташян, О. С. Изучение функциональной активности тучных клеток при иммобилизационном стрессе / О. С. Арташян, Б. Г. Юшков, Е. А. Мухлынина // Цитология. 2006. Т. 48, № 8. С. 665-668. 2. Линднер, Д. П. Морфометрический анализ популяции тучных клеток / Д. П. Линднер [и др.] // Архив патологии. 1976. Т. 38, № 8. С. 3-14. 3. Фрейдлин, И. С. Клетки иммунной системы / И. С. Фрейдлин, А. А. Тотолян СПб • Наука, 2001. 390 с. 4. Key role of mast cells and their major secretory products in inflammatory bowel disease // World J. Gastroenterology. 2004. Feb. 1. Vol. 10, № 3. P. 309-318. Д. Р. Жданова, О. В. Николина, К. В. Никушкина МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ ПОТОМСТВА САМОК КРЫС С ХРОНИЧЕСКИМ ЭКСПЕРИМЕНТАЛЬНЫМ ПОРАЖЕНИЕМ ПЕЧЕНИ Изучены морфофутционалъные особенности щитовидной железы потомства самок крыс с хроническим экспериментальным поражением печени. Выявлено повышение функциональной активности щитовидной железы, о чем свидетелъствувЫС тЫтиР ЧШОвUduaMem ТаТоТпГ ° ° P«»d*Pтирощтов, на фоне повышения концентрации тироксина. ОбО 68 * - у 1 наблюдающееся 3 а Ш Ш а ю т б о л е з н и *»*'Аие в координации и регуляции деятельности всех других систем организма, позволяя последнему адекватно реагировать на постоянно изменяющиеся условия внешней и внутренней среды. Основную массу щитовидной железы образует собственно тиреоидная паренхима, функция которой заключается в синтезе, накоплении и выделении тиреоидных гормонов — трийодтиронина и тетрайодтиронина (тироксина). Тиреоидные гормоны являются одними из ведущих стимуляторов метаболизма, они необходимы для обеспечения процессов роста и развития организма, дифференцировки тканей, регуляции обмена веществ и энергии, поддержания определенного уровня активности функциональных систем организма, развития адаптационных реакций [1-4; 10]. В связи с этим целью данного исследования явилось изучение морфофункционального состояния щитовидной железы потомства самок крыс с хроническим экспериментальным поражением печени матери. Материал и методы. В эксперименте были использованы белые лабораторные крысы (самки) и их потомство на 15-е (подсосный период) и 45-е (период полового созревания) сутки. Экспериментальные животные были разделены на две группы. Первую составило потомство интактных животных, вторую — животных с хроническим экспериментальным поражением печени. Модель хронического поражения печени создавали путем внутрипеченочного введения 0,2 мл фильтрата 6-дневной культуры E.coli и последующим введением через сутки в хвостовую вену того же фильтрата E.coli в количестве 0,3 мл/кг массы тела. Возникающие при этом морфологические изменения, согласно данным литературы, соответствуют таковым при гепатите А [8]. Поражение гепатобилиарной системы экспериментальных животных верифицировали с помощью морфологических, биохимических и иммунологических методов исследования. Серийные гистологические срезы толщиной 5-6 мкм окрашивали гематоксилиномэозином. С помощью морфометрической программы Motic Images Plus, 2,0 подсчитывали среднюю высоту тироцитов и средний диаметр ядер тироцитов щитовидной железы. В сыворотке крови с помощью иммуноферментного твердофазного метода [7] определяли концентрацию тиреотропного гормона (ТТГ) гипофиза и гормона щитовидной железы —тироксина. Статистическая обработка проводилась с помощью непараметрического критерия Манна-Уитни. Результаты исследования. В щитовидной железе животных обеих групп с возрастом происходит снижение высоты тироцитов, однако в опытной группе данный показатель выше контрольного на всех сроках исследования (табл. 1). Исследование среднего диаметра ядер тироцитов выявило аналогичную закономерность: с возрастом происходит постепенное снижение изучаемого показателя в обеих группах, причем данный показатель также выше в опытной группе (табл. 1). Таблица 1 Высота тироцитов и диаметр ядер тироцитов фолликулов щитовидной железы экспериментальных животных Диаметр ядер тироцитов, мкм Высота тироцитов, мкм Диаметр ядер тироцитов, мкм Контрольная Опытная Различия значимы по сравнению с данными в контроле при Р<0,05. •--"» . * д •» — 3— — I | I I I — 69 Установлено, что у животных опытной группы с возрастом происходит снижение уровня ТТГ, в то время как у интактных крысят, напротив, выявлено увеличение концентрации ТТГ к периоду полового созревания. При этом содержание ТТГ у подопытных животных на всех сроках исследования снижено по сравнению с контролем (табл. 2). Анализ содержания гормона тироксина показал, что у подопытных крысят с возрастом имеет место постепенное снижение концентрации тироксина, в то время как у интактных животных уровень концентрации данного гормона не только не снижается, а даже имеет тенденцию к увеличению. При этом у подопытных животных концентрация тироксина превышает таковую в контроле, особенно на 15-е сутки (табл. 2). Таблица 2 Уровень ТТГ и тироксина в сыворотке крови экспериментальных животных Группа животных Контрольная Опытная 15-е сутки Тироксин, ТТГ, мкМЕ/мл мкМЕ/мл 19,255±0,41 0,148±0,05 27,832±3,46* 0,113±0,03 45-е сутки ТТГ, мкМЕ/мл 0,180±0,09 0,007±0,01* Тироксин, мкМЕ/мл 19,655±1,85 20,472±1,71 * Различия значимы по сравнению с данными в контроле при Р<0,05. Обсуждение полученных данных. Таким образом, анализ полученных результатов позволяет сделать заключение о том, что у самок крыс с хроническим экспериментальным поражением печени, аналогичным гепатиту А, рождается потомство с усилением функционального состояния щитовидной железы, о чем свидетельствует, прежде всего, повышение концентрации йодсодержащего гормона щитовидной железы — тироксина и увеличение средней высоты тироцитов и среднего диаметра ядер тироцитов. Однако изменение секреторной активности щитовидной железы животных опытной группы не обусловлено нарушением регулирующего влияния со стороны аденогипофиза, поскольку уровень ТТГ в этой группе животных снижен по сравнению с контролем. Данная клиническая картина характерна для так называемой «функциональной автономии» щитовидной железы, при которой клетки органа выходят из-под контроля гипофиза и синтезируют гормоны в избыточном количестве. Причиной автономии может быть все, что приводит к независимой от ТТГ активации тиреоидных клеток, и прежде всего стимуляция тироцитов внутриклеточными активаторами роста [6; 8; 9]. Возможно, подобная стимуляция тиреоидных клеток определяется необходимостью более интенсивной регуляции метаболических процессов организма животных опытной группы, поскольку патология печени вызывает в организме беременной самки нарушение различных видов метаболизма и как следствие — компенсаторно-приспособительные реакции в организме развивающегося потомства, сохраняющиеся и в постнатальном периоде. Список литературы P „ Jn^T S ff а Я СИСТШа И г о м е о с т а з / Б- В. Алешин // Гомеостаз / под ред. П. Д. Горизонтова. М.: Медицина, 1981. М. ^ д а ц Г н а , Ю83. 4 70 S S ^ ГИШТаЛаМуС И щитови Д н а я ^ л е з а / Б. В. Алешин, В. И. Губский. А ЭНДОКРИНОЛОГИЯ /М - И - Балаболкин. М.: Медицина, 1989. И ' 5. Брюхин, Г. В. Особенности формирования ГЗТ у потомства самок с хроническим поражением печени при действии иммобилизационного стресса / Г. В. Брюхин, Г. И. Михайлова// Физиолог, журн. 1998. № 5-6. С. 18-20. 6. Быков, В. Л. Гистофизиология щитовидной железы в постнатальном онтогенезе / В. Л. Быков // Архив анатомии, гистологии и эмбриологии. 1979. Т. LXXVI, № з. С. 80-92. 7. Карпищенко, А. И. Медицинские лабораторные технологии и диагностика / А. И. Карпищенко. СПб.: Интермедика, 1999. 8. Саков, Б. А. Моделирование воспалительного процесса в печени / Б. А. Саков [и др.] // Моделирование, методы изучения и экспериментальная терапия патологических процессов. М., 1967. Ч. 1. 9. Свириденко, Н. Функциональная автономия щитовидной железы / Н. Свириденко //Врач. 2002. №7. С. 21-23. 10. Семененя, И. А. Функциональное значение щитовидной железы / И. А. Семененя. Успехи физиол. наук. 2004. Т. 35, № 2. С. 41-56. О. М. Малышева, Е. Н. Пашнина МАСТОЦИТЫ КАК ОДИН ИЗ ПОКАЗАТЕЛЕЙ МИКРООКРУЖЕНИЯ СЕЛЕЗЁНКИ ПОТОМСТВА САМОК КРЫС С ЭКСПЕРИМЕНТАЛЬНЫМ ПОРАЖЕНИЕМ ПЕЧЕНИ Проведено изучение количественного и качественного популяционного состава тучных клеток селезенки потомства самок крыс с экспериментальным D-галактозаминовым поражением печени. Установлено уменьшение числа тучных клеток, увеличение их функциональной активности, о чем свидетельствует увеличение индекса гранулярного насыщения и дегрануляции. Микроокружение селезенки играет важную роль в становлении ее функциональной активности [5-7]. Структурными компонентами внутриселезеночного микроокружения являются волокнистые (коллагеновые, эластические, ретикулярные волокна) и клеточные элементы (гранулоциты, макрофаги, плазмоциты, ретикулоциты, мастоциты). Цель нашего исследования заключалась в изучении количественного и качественного состава мастоцитов как одного из показателей специфического внутриорганного микроокружения селезенки потомства самок крыс с экспериментальным хроническим поражением печени различного генеза. Материалы и методы исследования. Объектом исследования явилось потомство самок крыс с экспериментальным поражением печени в различные сроки постнатального онтогенеза (на 1, 15, 30-й и 45-й дни жизни) согласно общепринятому подразделению возрастных периодов [2]. Все экспериментальные животные были разделены на две группы: подопытную (животные от самок с экспериментальным поражением печени) и контрольную (животные от интактных родителей). Модель экспериментального поражения печени создавали путем введения взрослым половозрелым животным гепатотропного яда D(+) - галактозамина гидрохлорида однократно, внутрибрюшинно, по общепринятой методике согласно данным литературы (Н. П. Сугробова и др., 1992). Эта модель поРажения печени соответствует вирусному гепатиту В человека. С помощью морфологических (дистрофия гепатоцитов, гиперплазия клеток Купфера и другие), биохимических