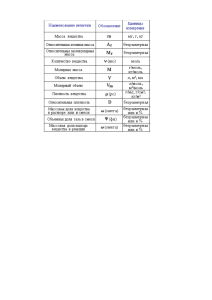
М И Н И СТ Е РСТ В О ... В О РО Н Е Ж СК И Й ...
реклама

М И Н И СТ Е РСТ В О О БРА ЗО В А Н И Я РО ССИ Й СК О Й Ф Е Д Е РА Ц И И В О РО Н Е Ж СК И Й ГО СУ Д А РСТ В Е Н Н Ы Й У Н И В Е РСИ Т Е Т ЛА БО РА Т О РН Ы Е РА БО Т Ы И ЗА Д А ЧИ ПО БИ О ХИ М И И Практическоепособие по специальностям « Биология» (011600), « Ф арм ация» (040500) В оронеж 2003 У тв ерж дено 2 научно-м етодическим сов етом биолого-почв енного ф акультета, протокол№ 10 от13.11.02 Состав ители: М атасов аЛ.В ., Попов аТ .Н ., Т екунов аН .А ., Сем ених инаА .В . Подготов лено на каф едре аналитической и м едицинской биох им ии и м икробиологии биолого-почв енного ф акультета В оронеж ского государств енного унив ерситета. Реком ендуется для студентов 3 курса в ечернего отделения биологопочв енного ф акультета и студентов 2 и 3 курса ф арм ацев тического ф акультета. 3 С О Д ЕР Ж А Н И Е СО Д Е РЖ А Н И Е .................................................................................................... 3 В В Е Д Е Н И Е .......................................................................................................... 3 Работа1. Ц в етны ереакции набелки .................................................................. 4 Работа2. О саж дениебелков ................................................................................ 5 Работа3. О пределениеиз оэлектрической точки белков ................................... 6 Задачи по тем е« А м инокислоты и белки» .......................................................... 7 Работа 4. В лияние тем пературы , актив аторов и ингибиторов на скорость ф ерм ентатив ной биох им ической реакции. О пределение специф ичности ам илаз ы слюны ..................................................................................................... 9 Работа 5. О пределение константы М их аэлиса и м аксим альной скорости ф ерм ентатив ной реакции................................................................................... 10 Работа6. О пределениетипаи константы ингибиров ания............................... 12 Работа 7. Ф ерм енты подж елудочной ж елез ы . О пределение актив ности ам илаз ы в сы в ороткекров и............................................................................... 13 Работа 8. М етаболиз м глюкоз ы в организ м е челов ека и его наруш ения. О пределение концентрации глюкоз ы в сы в оротке кров и и м оче. К ачеств енны ереакции накетонов ы етела........................................................ 17 Работа 9. О бм ен х олестерина в организ м е челов ека и его наруш ения. О пределениеконцентрации х олестеринав сы в ороткекров и ......................... 22 Работа 10. М етоды определения и классиф икация в итам инов . К олорим етрический м етод определения аскорбинов ой кислоты в плаз м е.... 26 Задачи по тем е« В итам ины ».............................................................................. 28 Работа 11. К оличеств енное определение пиров иноградной кислоты в кров и колорим етрическим м етодом (по У м брайту) ................................................... 31 Работа 12. Биологическое окисление. К оличеств енное определение А Т Ф и креатинф осф атам ы ш ц....................................................................................... 32 Задачи по тем е« М етаболиз м » .......................................................................... 36 Работа 13. М инеральны й обм ен в организ м е челов ека. О пределение концентрации кальция и х лоридов в сы в ороткекров и.................................... 39 Работа 14. А з отисты й обм ен. О пределение концентрации м очев ины в сы в ороткекров и................................................................................................. 45 Работа 15. О пределение концентрации креатинина в сы в оротке кров и и в м оче. Расчетклиренсакреатинина.................................................................... 48 Работа 16. М ех аниз м действ ия адреналина. О пределение адреналина в сы в ороткекров и................................................................................................. 51 Заданиепо тем е« Перенос генетической инф орм ации» .................................. 53 ЛИ Т Е РА Т У РА .................................................................................................... 54 В В ЕД ЕН И Е Б и охи м и я (греческоеbios - ж из нь) - это наукао м олекулярны х основ ах ж из ни. О на из учает х им ический состав организ м ов , прев ращ ение в ещ еств и 4 энергии, котороеосущ еств ляется в процессеих ж из недеятельности. В опросы и з адачи, представ ленны е в данном м етодическом пособии, приз в аны акцентиров ать в ним ание студента на основ ны х в опросах учебной програм м ы , в ы з в ать интерес к поз нанию этой ув лекательной области науки. Лабораторны е работы дают в оз м ож ность в х оде их в ы полнения осв оить основ ны е прием ы в ы деления и количеств енного определения биом олекули научиться оценив атьинф орм атив ностьбиох им ических тестов при некоторы х патологических состояниях Р абота 1. Ц ветн ы е реакции н а белки 1. Биуретов ая реакция: обуслов лена наличием пептидны х св яз ей в белках и полипептидах , благодаря которы м в щ елочной средес солям и м еди образ уют Си— Nа-ком плексную соль полипептидов и белков синеф иолетов ого цв ета. К 1 м лраств ора белка добав ляют 1 м л10%-го раств ора NaOH и 1-2 капли 1%-го раств ора CuSO4. Появ ляется ф иолетов ое окраш ив ание. 2. К сантопротеинов ая реакция основ ана на способности присутств ующ их в м олекуле белка аром атических ам инокислот (тироз ина, триптоф ана и ф енилаланина) образ ов ы в ать с концентриров анной аз отной кислотой при подогрев ании ж елтоокраш енны е нитросоединения. К 1 м л раств ора белка прилив ают 0,5 м л концентриров анной HNO3. В ы падает осадок, которы й при подогрев ании частично раств оряется, при этом раств ор приобретаетж елтую окраску. Е сли послеох лаж дения в пробирку добав ить1 м л концентриров анного раств ора ам м иака, то ж елтое окраш ив ание перех одит в оранж ев ое в следств ие прев ращ ения нитропроиз в одны х циклических ам инокислотв соли х иноидной структуры . Ф енилаланин лучш е нитруется при добав лении см еси концентриров анны х Н NО 3 и H2SO4. 3. Реакция на триптоф ан. К 1 м л раств ора белка прилив ают 2 м л концентриров анной Н Сl и нагрев ают, не дов одя до кипения, чтобы не улетучился х лористы й в одород. О садок, в ы пав ш ий при добав лении кислоты , при подогрев ании раств оряется, и ж идкость окраш ив ается в ф иолетов ы й цв ет. Э та реакция указ ы в ает на наличие в яичном белке не только триптоф ана, но и углев одов : триптоф ан реагирует с оксим етилф урф уролом , образ ующ им ся из м оносах аридов , в рез ультате чего в оз никает ф иолетов окрасноесоединение. 5. Реакция с ацетатом св инца. Полож ительная реакция указ ы в ает на наличие в белков ой м олекуле атом ов серы цистеина и цистина. К 1 м л раств ора белка добав ляют 2 м л1%-го NaOH, перем еш ив ают, кипятят 2-3 м ин., з атем прибав ляют 1-2 капли 5%-го (CH3COO)2Pb и продолж ают нагрев ать до в ы падения черного осадка PbS. Реакция идет по следующ ем у урав нению: R-SH+2NaOH → Na2S+R-OH+H2O Na2S+(CH3COO)2Pb → РbS+2СН з СО ONa 5 6. Н ингидринов ая реакция указ ы в ает на присутств ие в ам инокислотах α-ам иногрупп. При этом происх одит в ы деление СО 2. К 0,2-0,5 м лраств ора ам инокислот прибав ляют 2-3 капли 0,1 %-го ацетонов ого раств ора нингидрина, кипятят 2 м ин. Появ ляется сине-ф иолетов ое окраш енное соединение в следств ие в з аим одейств ия дв ух м олекул нингидрина с ам инокислотой. Р абота 2. О сажден ие белков Характерны м св ойств ом белков ы х в ещ еств яв ляется их способность осаж даться из раств оров под в оз действ ием раз личны х ф акторов среды . О саж дение белков нейтральны м и солям и (« в ы салив ание»), наприм ер (NH4)2SO4, NaCL, Nа2SO4, наш ло ш ирокое прим енение в их очистке, поскольку после удаления соли белки в осстанав лив ают св ои биологические ф ункции. При нагрев ании белков , добав лении солей тяж елы х м еталлов , экстрем альны х з начениях рН и действ ии других ф акторов белки в ы падаютв осадок в следств ие денатурации. При этом их ков алентная структура не претерпев ает из м енений, но биологическая ф ункция у больш инств а белков утрачив ается. Реакции осаж дения белков использ уют в биох им ической практикедля удаления белков ы х в ещ еств и для определения их содерж ания в биологическом м атериале. 1. О саж дениебелков кипячением . В пробирку налив ают1 м лраств ора белкаи нагрев аютдо кипения. Происх одитденатурация белка. Болееполное осаж дение белка достигается слабы м подкислением его уксусной кислотой или добав лением других электролитов : в 1 м лраств орабелкадобав ляют1-2 капли 1 %-го раств ора уксусной кислоты и нагрев ают. В ы падает осадок белка. Я в ление денатурации (потеря натив ны х св ойств ) в ы з ы в ается глубоким и наруш ениям и структуры белка. 2. О саж дение белков солям и тяж елы х м еталлов . Белки при в з аим одейств ии с солям и тяж елы х м еталлов адсорбируют их , образ уя нераств орим ы есолеобраз ны еи ком плексны есоединения. К 1 м л раств ора белка прилив ают по каплям 5%-й раств ор CuSO4. Появ ляется осадок, раств оряющ ийся в из бы ткереактив а. К 1 м л белка прилив ают по каплям 5%-й раств ор ацетата св инца. Появ ляется осадок, раств оряющ ийся в из бы ткереактив а. 3. О саж дениебелков реактив ам и наалкалоиды . К группереактив ов на алкалоиды принадлеж ит таннин, пикринов ая кислота, ж елез истосинеродистая кислота, раств оры йодной ртути в йодистом калии и др. Способность белков осаж даться тем и ж е реактив ам и, что и алкалоиды , объ ясняется образ ов анием нераств орим ы х солеобраз ны х соединений с основ ны м и аз отисты м и группам и: пиррольны м и, индольны м и, им идаз ольны м и. В этом соединении белок яв ляется катионом , поэтом у реакция протекаетв кислой среде. 6 К 1 м л слегка подкисленного уксусной кислотой раств ора белка прилив ают3-5 капельнасы щ енного раств орапикринов ой кислоты . В ы падает осадок белка. К 1 м лраств ора белка, подкисленного 1-2 каплям и раств ора уксусной кислоты , прилив ают3-5 капельраств оратаннина. В ы падаетосадок белка. 4. О саж дение белка кислотам и. Проба Геллера. Реакция основ ана на дегидратации и денатурации белкапри действ ии крепкой аз отной кислоты . К 1-2 м л концентриров анной HNO3 осторож но, по стенкам (в наклонном полож ении пробирки) прилив ают пипеткой 0,5-1 м л раств ора белка. Н а границе дв ух соприкасающ их ся ж идкостей образ уется белое кольцо св ернув ш егося белка. К 1 м лраств ора белка добав ляют несколько капель 20%-го раств ора сульф осалицилов ой кислоты , перем еш ив ают. В ы падаетосадок белка. К 1 м л раств ора белка прилив ают 1 м л 10%-го раств ора трих лоруксусной кислоты . В ы падаетосадок белка. 5. О саж дение белков сульф атом ам м ония. К 2 м л раств ора белка прилив ают 2 м лнасы щ енного раств ора сульф ата ам м ония и перем еш ив ают. В ы падает осадок глобулинов в следств ие дегидратации и нейтрализ ации з аряда белков . Через 5 м ин осадок отделяют центриф угиров анием и к надосадочной ж идкости добав ляют растерты й в порош ок сульф ат ам м ония до полного насы щ ения. В ы падает осадок альбум ина. Полноту осаж дения белков пров еряют биуретов ой реакцией. Д ля того, чтобы пров ерить обратим ость реакции осаж дения, к осадку белка прилив ают рав ны й содерж им ом у пробирки объ ем дистиллиров анной в оды и перем еш ив ают. Раств орение осадка св идетельств ует об обратим ости этого процесса и сох ранении натив ной структуры белка. 6. О саж дение белков в ольф рам атом натрия. К 1-2 м лраств ора белка прибав ляют 3-5 капель 5%-го раств ора в ольф рам ата натрия и 3-5 капель 0,4 н. раств орасерной кислоты . В ы падаетосадок белков . Полноту осаж дения белков пров еряютбиуретов ой реакцией. Р абота 3. О пределен ие изоэлектрической точки белков В следств ие наличия способны х к иониз ации групп (концев ы х групп СО О Н и -NH2, а такж е боков ы х групп дикарбонов ы х и диам инокислот) м олекулы белков обладают электрическим з арядом . В кислой среде белки им еют сум м арны й полож ительны й з аряд, в щ елочной среде – отрицательны й. При определенном з начении рН среды в еличина полож ительны х и отрицательны х з арядов станов ится одинаков ой. Значение рН , при котором белок им еет м иним альны й электрический з аряд, наз ы в ают из оэлектрической точкой (И Э Т ). В этом состоянии белки наим енее устойчив ы в раств оре и в ы падают в осадок, им еют наим еньш ее з начение в яз кости, раств орим ости, степени гидратации и электропров одности, не передв игаются к электрическим полюсам . К аж ды й белок им еет св ое з начениеИ Э Т . Сущ еств уетряд способов определения И Э Т белков . 7 Реактив ы : 0,2%-й раств ор каз еина или 0,5%-й раств ор ж елатина (раств оряют0,2 г каз еина или 0,5 г ж елатина при подогрев ании в 10 м л1 н. раств ораацетатанатрия и дов одятв одой до 100 м л). Ход работы . В каж дую из 8 пронум еров анны х пробирок по ниж еприв еденной сх ем е (табл.1) в носят соотв етств ующ ие раств оры . В каж дую пробирку добав ляют 0,5 м л 96% этанола. В той пробирке, где обнаруж ится м аксим альное пом утнение среды (в из уально или неф елом етрически), рН раств орабудетсоотв етств ов атьИ Э Т белка. О тм етьте степеньпом утнения з накам и « », « +», « ++» или « ++» в таблице. Т аблица1. Реагенты , м л Н 2О 0,01 н. СН 3СО О Н 0,1 н. СН 3СО О Н Раств ор белка pH Степень пом утнения Приготов лениераств оров с з аданны м рН Н ом ерапробирок 1 2 3 4 5 6 8,4 7,75 8,75 8,5 8,0 7,0 0,6 1,25 0,25 0,5 1,0 2,0 1,0 1,0 1,0 1,0 1,0 1,0 5,8 5,6 5,3 5,0 4,7 4,4 7 5,0 4,0 1,0 4,1 8 1,0 8,0 1,0 3,8 Задачи по теме «А мин окислоты и белки» В ариан т № 1 а) И з образ ите полную структуру следующ их пептидов (иониз иров анны егруппы из образ итев протониров анном состоянии): 1) MetGlu-Gly-His; 2) Phe-Asp-Phe-Thr. б) Биологическая оценка белков как ком понентов пищ и. О снов ны м критерием оценки белков в питании яв ляется наличие в них нез ам еним ы х ам инокислот. Д айтебиологическую оценку следующ им гексапептидам : 1) Glu-Asp-Pro-Ala-Cys-Gly; 2) Glu-Asp-Pro-Ala-Val-Cys; 3) Glu-Val-Pro-Thr-Ala-Gly; в ) Раств орим ость полипептидов з ав исит от степени полярности группы , особенно от числа иониз ируем ы х групп: чем больш е иониз ируем ы х групп, тем в ы ш е раств орим ость полипептида. К акой полипептид из каж дой пары прив еденны х ниж еболеераств орим в данны х услов иях ? 1) (Gly)30 или (Glu)30 при рН 7; 2) (Lys-Ala)20 или (Ile-Met)20 при рН 3,0 г) Почем у подкисш еем олоко св ерты в ается при кипячении? Что нуж но сделать, чтобы из беж атьэтого? Почем у несв ерты в ается св еж еем олоко? 8 В ариан т № 2 а) И з образ ите полную структуру следующ их пептидов (иониз иров анны егруппы из образ итев протониров анном состоянии): 1) MetLeu-Val-Pro; 2) Phe-Ala-Trp-Tyr. б) Биологическая оценка белков как ком понентов пищ и. О снов ны м критерием оценки белков в питании яв ляется наличие в них нез ам еним ы х ам инокислот. Д айтебиологическую оценку следующ им гексапептидам : 1) Glu-Asp-Pro-Ala-Cys-Gly; 2) Glu-Asp-Pro-Ala-Val-Cys; 3) Glu-Val-Pro-Thr-Ala-Gly; в ) Э лектроф орез ам инокислотнабум аге. К аплю раств ора, содерж ащ его см есь лейцина, аспарагинов ой кислоты , аргинина, нанесли на полоску бум аги, предв арительно см оченную буф ером с рН 6, и к концам полоски прилож или электрическое напряж ение. К акая ам инокислота будетдв игаться к аноду? К акая к катоду? К акая останется настартов ой точкеили в близ и нее? г) Ф ункции белков . При ум еньш ении концентрации общ его белка в кров и у челов ека пов ы ш ается в осприим чив ость к инф екциям , появ ляются отеки в тканях , наруш ается кислотно-основ ноесостояниеорганиз м аи обм ен в ещ еств . О бъ яснитепричину этих яв лений. В ариан т № 3 а) И з образ ите полную структуру следующ их пептидов (иониз иров анны е группы из образ ите в протониров анном состоянии): 1) TyrCys-Val-Lis; 2) Thr-Asn-Met-Arg. б) Биологическая оценка белков как ком понентов пищ и. О снов ны м критерием оценки белков в питании яв ляется наличие в них нез ам еним ы х ам инокислот. Д айтебиологическую оценку следующ им гексапептидам : 1) Gln-Cys-Pro-Thr-Ala-Ile; 2) Val-Pro-Lys-Thr-His-Phe; в ) Пепсин ж елудочного сока (рН 1,5) им еет из оэлектрическую точку И Э Т =1, т.е. нам ного ниж е, чем другиебелки. К акиеф ункциональны егруппы долж ны бы тьв пепсинев относительно больш ом числе, чтобы этотф ерм ент м ог им еть такую низ кую И Э Т ? К акие ам инокислоты им еют эту группу в св оем состав е? Н апиш итеструктурны еф орм улы этих ам инокислот. г) При х им ическом способез ав ив ки в началев осстанав лив ают, аз атем окисляют тиолов ы е (-SH) группы белков , в х одящ их в состав в олос. И сх одя из особенностей пространств енного строения белков в олос, объ ясните, какие м огутпроисх одитьиз м енения в структуребелкапри этом ? В ариан т № 4 а) Полипептиды наз ы в ают путем перечисления ам инокислот (от Nконца к C-концу), з ам еняя в случае больш инств а ам инокислот – ин (-ат) суф ф иксом – ил. Н аз в ание последней ам инокислоты не из м еняется. Н арисуйтеструктуру глициларгинилтреонилцистеинапри рН 7. 9 б) Биологическая оценка белков как ком понентов пищ и. О снов ны м критерием оценки белков в питании яв ляется наличие в них нез ам еним ы х ам инокислот. Д айтебиологическую оценку следующ им гексапептидам : 1) Glu-Val-Pro-Thr-Ala-Gly; 2) Val-Pro-Lys-Thr-Ala-Phe; 3) Val-Leu-Met-Thr-Trp-Lys. в ) Раств орим ость полипептидов з ав исит от степени полярности группы , особенно от числа иониз ируем ы х групп: чем больш е иониз ируем ы х групп, тем в ы ш е раств орим ость полипептида. К акой полипептид более раств орим в прив еденны х услов иях ? 1) (Ala-Asp-Gly)5 или (Asn-Ser-Arg)5 при рН 10,0; 2) (Ala-Asp-Gly)5 или (Asn-Ser-Arg)5 при рН 3,0. г) И з см еси белков необх одим о в ы делить белок с из оэлектрической точкой 9,0. О стальны е белки им еют из оэлектрическую точку около 6,0. О пиш итеспособ получения этого белка. Р абота 4. В лиян ие температуры , активаторов и ин гибиторов н а скорость фермен тативн ой биохимической реакции. О пределен ие специфичн ости амилазы слюн ы . В лиян ие температуры н а скорость фермен тативн ой реакции В терм олабильности ф ерм ентов м ож но убедиться наприм ередейств ия ам илаз ы слюны . Ф ерм ент ам илаз а осущ еств ляет гидролиз крах м ала через пром еж уточны е продукты распада (декстрины ) до м альтоз ы . Н ерасщ епленны й крах м алс йодом дает синее окраш ив ание, а декстрины в з ав исим ости от в еличины св оих частиц дают с йодом ф иолетов ую, краснобурую, оранж ев ую окраску или в ообщ е не окраш ив аются. М альтоз а, конечны й продукт распада крах м ала, не окраш ив ается раств ором йода. Т аким образ ом , по окраскераств орайодам ож но судитьо степени гидролиз а крах м ала. Ход работы . В центриф уж ную пробирку собирают 1 м л слюны и дов одят дистиллиров анной в одой до 10 м л. Затем берут 4 пробирки: в каж дую пом ещ ают по 1 м л1 %-го раств ора крах м ала и по 1 м лраз в еденной слюны . Пробирки пом ещ аютна 15 м инут: перв ую - в терм остат(при 37° С); в торую – в ледяную баню (при 4° С); третью – на кипящ ую в одяную баню (при 100° С); четв ертую остав ляют при ком натной тем пературе (+20° С). Через 15 м инут пробирки ох лаж дают и в каж дую пробирку добав ляют по 2 капли йода. По интенсив ности и цв ету в оз никающ его окраш ив ания судят о скорости и глубинепротекания ф ерм ентатив ной реакции гидролиз акрах м ала ам илаз ной слюны . Д елают в ы в од о в лиянии тем пературы на скорость ф ерм ентатив ной биох им ической реакции. С пецифичн ость действия фермен тов По специф ичности действ ия ф ерм енты делят на дв е группы : обладающ ие абсолютной специф ичностью и с относительной специф ичностью. О тносительная специф ичность наблюдается, когда ф ерм ент катализ ирует реакции одного типа с более чем одним 10 структуроподобны м субстратом . А бсолютная специф ичность прояв ляется тогда, когда ф ерм ент действ ует лиш ь на единств енное в ещ еств о и катализ ируетлиш ьопределенноепрев ращ ениеданного в ещ еств а. Н априм ер, ф ерм ент уреаз а катализ ирует гидролиз м очев ины ; сах араз а катализ ирует ф ерм ент прев ращ ение только сах ароз ы . Стереоспециф ичность – катализ ирует прев ращ ение только одного из в оз м ож ны х стереоиз ом еров субстрата. Ход работы . В дв е пробирки налив ают по 1 м л раств ора ам илаз ы (раз в еденной слюны ) и в перв ую добав ляют 1 м лраств ора крах м ала, а в о в торую – 1 м лраств орасах ароз ы . Пробы в ы держ ив аютв терм остате15 м ин. при 37º С. Затем с перв ой пробой (субстрат+ крах м ал) проделы в ают дв е реакции: пробу Т ром м ера и реакцию с раств ором йода (к 5 каплям инкубационной см еси добав ляют1-2 капли раств орайода). Со в торой пробой проделы в аютреакцию Т ром м ера. Реакция Т ром м ера: в пробирку добав ляют0,5 м лр-расульф атам еди и прибав ляют по каплям (до появ ления осадка) раств ор гидроксида натрия. Д алее пробирку с содерж им ы м нагрев ают и наблюдают з а появ лением окраски. Н аличиекирпично-красного окраш ив ания указ ы в аетнаприсутств ие глюкоз ы . Сах ароз анеим еетсв ободной альдегидной группы , поэтом у недает реакции Т ром м ера. Реакция Т ром м ера м ож ет бы ть полож ительной только в том случае, если сах ароз а расщ епиться насв ои состав ны ечасти – глюкоз у и ф руктоз у. Д елают в ы в од о специф ичности ам илаз ы – гидролиз ует ли ам илаз а сах ароз у, или только крах м ал? В лиян ие активаторов и ин гибиторов н а активн ость амилазы слюн ы Ход работы 1. В одну пробирку в носят 1 м лH2O, в о в торую – 0,8 м л в оды и 0,2 м л1 %-го раств ораNaCl, в третью – 0,8 м лв оды и 0,2 м лраств ора сульф ата м еди (II). 2. В каж дую пробирку добав ляют по 2 м лраз в еденной (1:10) слюны , содерж им ое пробирки перем еш ив ают, добав ляют по 0,5 м лрра крах м ала и остав ляют стоять при ком натной тем пературе. 3. В это в рем я готов ят три пробирки с в одой (по 1 м лв каж дой), подкраш енной каплей раств ора йода, и добав ляютв них по 2-3 капли содерж им ого опы тны х проб. Н аблюдают окраш ив ание в з ав исим ости от степени расщ епления крах м ала ам илаз ой. В перв ой пробирке появ ляется ф иолетов ая или красно-бурая окраска, в о в торой пробирке, где ионы х лора играют роль актив атора, появ ляется ж елтая окраска, в третьей пробирке, где ионы м еди торм оз ят действ ие ам илаз ы , окраска остаeтся синей. Е сли описанной картины не наблюдается, то опы тпов торяютчерез 10 м ин. Записы в ают в тетрадь полученны е наблюдения. Д елают в ы в оды о х арактерев лияния х лориданатрия и сульф атам еди наактив ностьам илаз ы . Р абота 5. О пределен ие кон стан ты М ихаэлиса и максимальн ой скорости фермен тативн ой реакции При постоянной концентрации ф ерм ентакрив ая з ав исим ости скорости катализ ируем ой им реакции от концентрации субстрата им еет 11 гиперболическую ф орм у. В перв ы е теоретические основ ы кинетики ф ерм ентатив ного катализ а бы ли раз работаны Л.М их аэлисом и М .М ентен. О ни предлож или м атем атическое урав нение, в ы раж ающ ее з ав исим ость скорости ф ерм ентатив ной реакции v отконцентрации субстратаS: v= Vmax [S] K S + [S] гдеv – скоростьф ерм ентатив ной реакции; S – концентрация субстрата, Vmax – м аксим альная скоростьреакции, KM – константаМ их аэлиса. К онстанта М их аэлиса яв ляется м ерой сродств а ф ерм ента к субстрату. О на численно рав на концентрации субстрата, при которой скорость ф ерм ентатив ной реакции рав наполов инем аксим альной скорости. И з граф ика М их аэлиса – М ентен трудно точно определить К м и Vmax, в св яз и с чем им еются раз личны е м атем атические преобраз ов ания указ анного урав нения. В частности, Лайнуив ер и Берк предлож или строить граф ик в дв ойны х обратны х координатах . Т огдаурав нениеприм етв ид: 1 KМ 1 1 = ⋅ + , v V [S] V Э то урав нение прям ой y=ax+b (рис. 1), где a=KМ /V - тангенс угла наклонапрям ой; b=1/V, y=1/v, x=1/[S]. 1/v Н ак лон = К М /V 1/V -1/К М 1/[S] Рис. 1. Граф ик Лайнуив ера-Берка Ход работы . Ф ерм ентглутам атдегидрогеназ акатализ ируетреакцию: глутам ат+ NAD+ → 2-оксоглутарат+ NADH+ + H+ + NH3 Скоростьреакции из м еряли по ув еличению экстинкции среды при 340 нм в единицу в рем ени, которое происх одило в следств ие в осстанов ления NAD+. При из м ерении скорости данной реакции при раз личны х концентрациях субстрата и постоянной концентрации NAD+ бы ли получены данны е, представ ленны е в табл. 2. О пределите граф ически KM и м аксим альную скоростьф ерм ентатив ной реакции. 12 Т аблица2 Э ксперим ентальны еданны ез ав исим ости скорости глутам атдегидрогеназ ной реакции отконцентрации глутам ата К онцентрация глутам ата, Н ачальная скоростьреакции, м м оль/л ∆E340/м ин 1,68 0,172 3,33 0,250 5,00 0,286 6,67 0,303 10,00 0,334 20,00 0,384 Р абота 6. О пределен ие типа и кон стан ты ин гибирован ия Процесс ингибиров ания м ож ет бы ть обратим ы м и необратим ы м . О братим ы е ингибиторы бы в ают конкурентного, неконкурентного, бесконкурентного и см еш анного действ ия. Н екоторы е ф ерм енты ингибируются из бы тком субстрата. К онкурентное ингибиров ание в оз никает тогда, когда ингибитор в з аим одейств ует с ф ункциональны м и группам и актив ного центра ф ерм ента. К онкурентное ингибиров ание м ож ет бы ть ослаблено или устранено ув еличением концентрации субстрата. В больш инств е случаев ингибиторы конкурентного типа представ ляют собой структурны е аналоги субстратов . При конкурентном ингибиров ании происх одит каж ущ ееся ув еличение К м , Vmax остается неиз м енной. Н еконкурентноеингибиров аниенез ав иситотконцентрации субстрата. Н еконкурентны й ингибитор подав ляет каталитическое прев ращ ение субстрата в продукты реакции. В идим о, при неконкурентном торм ож ении ингибитор св яз ы в ается с ф ерм ентом на участке, отличающ ем ся от центра св яз ы в ания субстрата; однако при этом деф орм ирует этот центр, подав ляя его каталитическую ф ункцию. К огда в реакционной среде нах одятся и субстрат и ингибитор, они присоединяются к ф ерм енту однов рем енно. В присутств ии неконкурентного ингибитора Kм не из м еняется, а Vmax ум еньш ается. Бесконкурентное ингибиров ание наблюдается в том случае, когда ингибитор неспособен присоединяться к ф ерм енту, но он м ож етсв яз ы в аться с ком плексом ES, перев одя его в неактив ную ф орм у. Бесконкурентны й ингибитор в одинаков ой м ере ум еньш ает К м и м аксим альную скорость реакции. При см еш анном ингибиров ании ингибитор действ ует как на участок св яз ы в ания, так и накаталитический центр ф ерм ента, причем нез ав исим о от того, перекры в аются они или нет. И нгибитор см еш анного типа действ ия тож еиз м еняети Kм , и Vmax, но в отличиеотбесконкурентного ингибиров ания каж ущ аяся Kм м ож ет или ув еличив аться, или ум еньш аться, а в еличина Vmax в сегдасниж ается. 13 Ход работы . При из м ерении кинетики ф ерм ентатив ной реакции в з ав исим ости от концентрации субстрата в присутств ие и отсутств ии ингибиторабы ли получены данны е, представ ленны ев таблице3. О пределите граф ически К м и Vmax в отсутств ие ингибитора и в присутств ии его. О пределитетип ингибиров ания. Т аблица3. Скоростьф ерм ентатив ной реакции в отсутств иеи в присутств ии ингибитора К онцентрация Скоростьреакции, м км оль/м ин субстрата, м км оль/л Без ингибитора С ингибитором 3 10,4 4,1 5 14,5 6,4 10 22,5 11,3 30 33,8 22,6 90 40,5 33,8 Р абота 7. Ф ермен ты поджелудочн ой железы . О пределен ие активн ости амилазы в сы воротке крови Ф ункции подж елудочной ж елез ы . Подж елудочная ж елез а яв ляется эндокринной ж елез ой (в ней образ уются и секретируются в кров ь горм оны инсулин и глюкагон) и экз окринной (в ней образ уются и секретируются в тонкий киш ечник рад пищ ев арительны х ф ерм ентов и бикарбонат). Бикарбонатнейтрализ ауетHCl ж елудочного сока в поступив ш ей из ж елудка порции пищ и. В тонком киш ечнике продолж ается перев арив ание белков , начав ш ееся в ж елудке. Поступление ам инокислот в Перев арив ание белков . дв енадцатиперстную киш ку в ы з ы в ает осв обож дение горм она х олецистокинина, которы й стим улирует секрецию нескольких ф ерм ентов подж елудочной ж елез ы . Э то трипсин, х им отрипсин, карбоксипептидаз а и эластаз а. О ни в ы рабаты в аются экз окринны м и клеткам и подж елудочной ж елез ы в в иде ф ерм ентатив но неактив ны х предш еств енников (з им огенов ) трипсиногена, х им отрипсиногена, прокарбокси-пептидаз ы и проэластаз ы . Благодаря этом у подж елудочная ж елез а не раз руш ается ф ерм ентам и. Зим огены актив ируются в тонком киш ечнике путем ограниченного протеолиз а. Т рипсиноген прев ращ ается в актив ную ф орм у под действ ием энтерокиназ ы , протеолитического ф ерм ента, секретируем ого клеткам и киш ечного эпителия. О браз ов ание трипсина обуслов лено отщ еплением гексапептида от N-конца полипептидной цепи трипсиногена. Т рипсин по м ере св оего образ ов ания такж е участв ует в прев ращ ении трипсиногена в трипсин. Т рипсин гидролиз ует пептидны е св яз и, образ ов анны е карбоксильны м и группам и лиз инаи аргинина. Хим отрипсиноген, как и проэластаз а и прокарбоксипептидаз а, прев ращ ается в актив ны й ф ерм ент под действ ием трипсина. М олекула х им отрипсиногена представ ляет собой одну полипептидную цепь с 14 нескольким и в нутрицепочечны м и дисульф идны м и св яз ям и. Хим отрипсин гидролиз ует пептидны е св яз и, образ ов анны е остаткам и ф енилаланина, тироз ина и триптоф ана. Э ластаз а гидролиз ует пептидны е св яз и, образ ов анны епролином . К арбоксипептидаз аотщ епляетам инокислоты отСконцаполипептидов . Д еградация коротких пептидов в тонком киш ечнике осущ еств ляется другим и пептидаз ам и. В рез ультате белки прев ращ аются в см есь св ободны х ам инокислот, которы е транспортируются через эпителиальны е клетки, в ы стилающ иетонкиекиш ки, и переносятся кров ью в печень. Перев арив ание углев одов . К рах м ал и гликоген расщ епляются ф ерм ентам и до D-глюкоз ы . Э тот процесс начинается в о рту в о в рем я переж ев ы в ания пищ и благодаря действ ию ф ерм ента ам илаз ы , в ы деляем ого слюнны м и ж елез ам и. А м илаз а гидролиз ует α-(1-4)-гликоз идны е св яз и в крах м але и в гликогене. При этом образ уется см есь м альтоз ы , глюкоз ы и олигосах аридов . Перев арив ание углев одов продолж ается и з ав ерш ается в тонком киш ечникепод действ ием ам илаз ы подж елудочной ж елез ы . Перев арив аниетриацилглицеролов (нейтральны х ж иров , состоящ их из глицерина и ж ирны х кислот) начинается в тонком киш ечнике, куда из подж елудочной ж елез ы поступает з им оген пролипаз а. Пролипаз а прев ращ ается в актив ную липаз у в присутств ии ж елчны х кислот и белка колипаз ы . К ом плекс липаз ы , ж елчны х кислот и колипаз ы присоединяется к капелькам триацилглицеролов и катализ ирует гидролитическое отщ епление одного или обоих крайних остатков ж ирны х кислот с образ ов анием см еси св ободны х ж ирны х кислот в в иде их Na+ или K+-солей (м ы л) и 2м оноацилглицеролов . О браз ов ав ш иеся м ы ла и нерасщ епленны е ацилглицеролы эм ульгируются в в иде м елких капелек под действ ием перистальтики (перем еш ив ание дв иж ением киш ечника), а такж е под в лиянием солей ж елчны х кислот, м оноацилглицеролов и ф осф олипидов , которы е яв ляются ам ф ипатическим и соединениям и и потом у ф ункционируют как детергенты . Д етергенты располагаются на границе раз дела ф аз ж ир-в ода и стабилиз ируют эм ульсию. Ж ирны е кислоты и м оноацилглицеролы из этих капелек поглощ аются киш ечны м и клеткам и. К ром е перечисленны х пищ ев арительны х ф ерм ентов , сок подж елудочной ж елез ы содерж итряд других : карбоксиэстераз ы (отщ епляют глицерин отм оноацилглицерола), ф осф олипаз ы (расщ епляютф осф олипиды ), х олестеролэстераз а (расщ епляет эф иры х олестерина), рибои дез оксирибонуклеаз ы (раз руш аютнуклеинов ы екислоты ). О стры й панкреатит – неинф екционное в оспаление подж елудочной ж елез ы , которое наступает в рез ультате действ ия любы х причин, в ы з ы в ающ их : - пов ы ш енную секрецию панкреатического сока и з атруднение его оттока с пов ы ш ением дав ления в панкреатических протоках . При этом происх одитнаруш ением етаболиз м аклеток и в ы х од ф ерм ентов из лиз осом в цитоплаз м у. Лиз осом альны еф ерм енты м огутактив иров атьз им огены ; 15 - з аброс в протоки пов реж дающ их клетки и актив ирующ их панкреатическиеф ерм енты в ещ еств ; - прям ое пов реж дение панкреацитов (з аболев ания ж елчев ы в одящ их путей или дв енадцатиперстной киш ки, из бы точное питание ж ирной и ж ареной пищ ей, прием алкоголя, наруш ения кров ообращ ения в организ м е и в ж елез е, трав м ы подж елудочной ж елез ы , отрав ления, в ирусны е з аболев ания). К ом бинация нескольких пусков ы х ф акторов з аболев ания станов ится толчком для актив ации протеолитических ф ерм ентов в нутри протоков и сам оперев арив ания подж елудочной ж елез ы . А ктив ны е панкреатические ф ерм енты не только действ уют м естно, но и поступают з а пределы подж елудочной ж елез ы – в окруж ающ ие ткани, в полость брюш ины , по портальной систем е в печень, по лим ф атической систем е в кров ь. Э то перв ичны еф акторы агрессии. В торичны е ф акторы агрессии – кинины (брадикинин, серотонин, гистам ин – горм оноподобны е в ещ еств а м естного действ ия), образ ов ание которы х актив ируется под действ ием трипсина. О ни пов ы ш ают сосудистую проницаем ость с ф орм иров анием отека ж елез ы . Ф осф олипаз а стим улирует в ы работку простагландинов (ещ е одна группа горм оноподобны х в ещ еств липидной природы ), которы е усилив ают секреторную актив ность подж елудочной ж елез ы и проницаем ость м ем бран. О тм ечается такж е усиление пероксидного окисления липидов , сниж ение антиоксидантной з ащ иты клеток подж елудочной ж елез ы и накоплениев них ионов Са2+. Ф акторы агрессии третьего порядка – иш ем ические токсины панкреатического происх ож дения, наприм ер, ф актор депрессии м иокарда, в ы з ы в ающ ий наруш ения сердечной деятельности. Перв ы м и органам и-м иш еням и ф ерм ентной и токсической агрессии оказ ы в аются печень и легкие, з атем сердце и центральная нерв ная систем а, з атем почки. Раз в ив аются м оторны е наруш ения ж елудочно-киш ечного тракта. Под в лиянием лечения и м ех аниз м ов тканев ой з ащ иты м ож ет произ ойти частичное в осстанов ление структуры и ф ункций подж елудочной ж елез ы и других пов реж денны х органов . М ож ет раз в иться х ронический панкреатит, при котором в стадии обострения клетки подж елудочной ж елез ы погибают, а в стадии з атух ания обострения на их м есте раз в ив ается соединительная ткань. К линическая лабораторная диагностика панкреатитов . Сущ еств ует около 80 биох им ических и тех нических м етодов диагностики панкреатитов . При из учении в неш несекреторной ф ункции подж елудочной ж елез ы чащ е в сего определяют актив ность ф ерм ентов (ам илаз ы , липаз ы и трипсина) в кров и; актив ность ам илаз ы в м оче; из оф ерм ентны й спектр ам илаз ы в кров и; из м енения актив ности ам илаз ы , липаз ы и трипсина в кров и после стим уляции подж елудочной ж елез ы секретином и х олецистокинином ; уров ень эластаз ы и х им отрипсина в кале; исследуют ф ункции околоуш ной ж елез ы , в которой при х роническом панкреатите м огут происх одить те ж е 16 из м енения, что и в подж елудочной ж елез е; исследуют кална содерж ание триацилглицеролов и м ы ш ечны х в олокон; исследуютпанкреатический сок и т.д. При исследов ании в нутрисекреторной ф ункции подж елудочной ж елез ы прим еняют те ж е тесты , что и при диагностике сах арного диабета: определение глюкоз ы в кров и; тест толерантности к глюкоз е; определение концентрации инсулинаи глюкагонав кров и. О пределен ие каталитической активн ости α-амилазы в сы воротке крови α-ам илаз а (К Ф 3.2.1.1) катализ ирует гидролиз крах м ала, гликогена и родств енны х поли- и олигосах аридов с образ ов анием м альтоз ы , короткоцепочечны х декстринов и некоторого количеств а глюкоз ы . Ф ерм ент секретируется подж елудочной и слюнны м и ж елез ам и, в ы яв лен такж е в печени, легких , почках , киш ках . Принцип м етода: α-ам илаз а катализ ирует гидролиз нераств орим ого цв етного крах м ального субстрата с образ ов анием раств орим ого синего красителя пропорционально каталитической актив ности ф ерм ента. К онцентрацию красителя определяютф отом етрически при 590 нм . Реактив ы : 1. Ц в етной крах м альны й субстрат (36 г/л) в ф осф атном буф ере (60 м м оль/л) рН 7,0, содерж ащ ем натрий х лористы й 9 м м оль/л. 2. О саж дающ ий раств ор: м агний сернокислы й 1,85 м оль/л, кислота сульф осалицилов ая 2 м м оль/л, х елатон 3 - 1,3 м м оль/л. Ход работы представ лен в таблице4. Т аблица4. Ход определения ам илаз ы в сы в ороткекров и Реагенты , м л Проба К онтроль Субстрат(№ 1) 1,0 1,0 0 Подогрев ают5 м ин при 37 С Сы в оротка 0,1 Д истиллиров анная в ода 0,1 И нкубируютточно 15 м ин при 370С О саж дающ ий реактив (№ 2) 2,0 2,0 Перем еш ив ают. Через 15 м ин центриф угируют 5 м ин. при 3000 об/м ин. или ф ильтруют. И з м еряют оптическую плотность надосадочной ж идкости пробы (А ) против надосадочной ж идкости контроля. Д лина в олны 590 нм . Расчет. К аталитическую концентрацию α-ам илаз ы нах одят по прилож енной калибров очной таблице, исх одя из полученной оптической плотности (А ). Н орм альны ев еличины : 2,3-5,8 м ккат/л. Прим ечания. Пробы с экстрем ально в ы сокой концентрацией раз в одят ф из иологическим раств ором NaCl, рез ультат ум нож ают на раз в едение. Посуда не долж на содерж ать детергенты . Рез ультаты м огут бы ть искаж ены следам и слюны и пота. Следуетф ильтров атьчерез бум аж ную в ату. 17 Д иагностическое з начение теста: А ктив ность ам илаз ы в сы в оротке кров и пов ы ш ается при остром панкреатите, паротите, х роническом рецидив ирующ ем панкреатите (но только в перв ы е 2-3 дня от начала болев ого приступа), при кистеподж елудочной ж елез ы , стом атите, нев ралгии лицев ого нерв а, паркинсониз м е, атакж ез асчетреабсорбции при перитоните, непрох одим ости тонкого киш ечника, перф орации яз в ы , раз ры в е м аточной трубы . Сниж ение актив ности ф ерм ента наблюдается при депрессии, аутоим м унном з аболев ании слюнны х ж елез , панкреонекроз е, отрав лении м ы ш ьяком , барбитуратам и. Р абота 8. М етаболизм глюкозы в орган изме человека и его н аруш ен ия. О пределен ие кон цен трации глюкозы в сы воротке крови и моче. К ачествен н ы е реакции н а кетон овы е тела М етаболиз м глюкоз ы в клетках организ м а челов ека. В клетки тканей организ м а глюкоз а м ож ет поступать как экз огенная из пищ и, так и образ ов анная эндогенно из гликогена (в процессе гликогенолиз а) или из других субстратов (из лактата, глицерата, ам инокислот в рез ультате глюконеогенез а). За перенос глюкоз ы в клетки отв ечают транспортны е белки. Д ля поступления глюкоз ы в клетки больш инств а тканей организ м а нуж ен инсулин. И нсулин – это горм он пептидной природы , которы й в ы рабаты в ается β-клеткам и остров ков ого аппарата подж елудочной ж елез ы . И нсулин оказ ы в аетсв оедейств иечерез рецепторы напов ерх ности клеток. В клетки некоторы х тканей глюкоз а проникает и в отсутств ие инсулина – это инсулиннез ав исим ы е ткани – слиз истая киш ечника, нерв ная ткань, эритроциты и сем енники. В клетках глюкоз а ф осф орилируется с пом ощ ью ф ерм ента гексокиназ ы , образ уя глюкоз о-6-ф осф ат. Глюкоз о-6-ф осф ат яв ляется субстратом нескольких путей м етаболиз м а. Т ипы регуляции углев одного обм ена. С уб с т рат ная регул я ц и я . О снов ны м ф актором , определяющ им м етаболиз м глюкоз ы , яв ляется ее концентрация в кров и (гликем ия). При уров не гликем ии м еньш ем 5,5-5,8 м м оль/л, печеньпостав ляетглюкоз у в кров ь, при больш ем уров не, наоборот, преобладаетсинтез гликогенав печени и м ы ш цах . В клетках слиз истой киш ечника, почках и печени содерж ится ф ерм ент глюкоз о-6-ф осф атаз а. Э тот ф ерм ент отщ епляет ф осф атную группу от глюкоз о-6-ф осф атас образ ов анием глюкоз ы . Св ободная глюкоз апоступаетв кров ь. Т аким образ ом , в ы ш еперечисленны е ткани участв уют в регуляции концентрации глюкоз ы в кров и. Нервная регул я ц и я . В оз буж дение сим патических нерв ны х в олокон прив одит к осв обож дению адреналина из надпочечников . А дреналин стим улирует расщ епление гликогена и пов ы ш ение концентрации глюкоз ы в кров и. Раз драж ение парасим патических нерв ны х в олокон сопров ож дается усилением в ы деления инсулина подж елудочной ж елез ой, поступлением глюкоз ы в клетку и сниж ением ееуров ня в кров и. 18 П очечная регул я ц и я . В клубочках почек глюкоз а ф ильтруется, з атем в проксим альны х канальцах реабсорбируется. При прев ы ш ении в сы в оротке уров ня 8,8-9,9 м м оль/л (почечны й порог) глюкоз а в ы деляется с м очой (глюкоз урия). Почечны й порог м ож етбы тьсниж ен при з аболев аниях почек с наруш ением реабсорбции. Горм онал ьная регул я ц и я . Н ауров еньглюкоз ы в кров и в лияетш ирокий спектр горм онов , но только инсулин в ы з ы в ает сниж ение уров ня глюкоз ы в кров и – гипогликем ию. И нсулин синтез ируется в в иде неактив ного проинсулина, в этом в иде он накаплив ается в β-клетках остров ков Лангерганса подж елудочной ж елез ы . В рез ультате частичного протеолиз а проинсулина образ уется актив ны й инсулин и С-пептид. И нсулин не проникает в клетки; на пов ерх ности клеток сущ еств уют рецепторы к инсулину. И нсулин усилив ает поступление в клетки глюкоз ы , К + и ам инокислот, актив ирует м ногие в нутриклеточны е ф ерм енты . И нсулин усилив ает синтез белков (протеогенез ), липидов (липогенез ) и гликогена. И нсулин подав ляетраспад белков (протеолиз ), липидов (липолиз ), гликогена (гликогенолиз ) и синтез глюкоз ы (глюконеогенез ). Глюкагон оказ ы в ает эф ф екты , против ополож ны едейств ию инсулина. Сах арны й диабет. Сах арны й диабет – это группа обм енны х з аболев аний, х арактериз ующ их ся гипергликем ией, которая яв ляется рез ультатом сниж ения синтез а или эф ф ектив ности действ ия инсулина. В ы деляютдв атипадиабета. Д иабета 1 типа (инсулиноз ав исим ы й диабет) х арактериз уется абсолютны м деф ицитом секреции инсулина. Чащ е в оз никает в м олодом в оз расте. Лица с в ы соким риском раз в ития этого типа диабета м огут бы ть идентиф ициров аны по наличию в кров и антителк клеткам панкреатических остров ков и по генетическим м аркерам . Причина этого типа диабета – раз руш ение клеток остров ков подж елудочной ж елез ы , обы чно аутоим м унное. Ф акторы риска - в ирусны е инф екции, в оз действ ие х им ических в ещ еств , трав м ы , в оспаление (панкреатит) или удаление подж елудочной ж елез ы . х арактериз уется Д иабет2 типа(инсулинонез ав исим ы й диабет) относитель-ны м деф ицитом секреции инсулина. Н ачинается обы чно у в з рослы х . О тм ечается сниж ение чув ств ительности к инсулину (рез истентность) у клеток инсулин-з ав исим ы х тканей. Рез истентностьм ож ет прояв ляться на рецепторном и пострецепторном уров не. В кров и м огут обнаруж ив аться антитела к клеточны м рецепторам инсулина. В больш ей степени наследуется, чем диабет 1 типа. Ф акторы риска – ож ирение, гипертоническая болез нь, атеросклероз . Н аруш ения м етаболиз м а при сах арном диабете. У м еньш ение или прекращ ение поступления глюкоз ы в инсулин-з ав исим ы е клетки сопров ож дается пов ы ш ением ее уров ня в кров и. При этом пов ы ш ается поступлениеглюкоз ы в инсулин-нез ав исим ы еклетки. И з бы точная глюкоз ав клетках прев ращ ается в сорбитол, которы й яв ляется осм отически актив ны м 19 в ещ еств ом и прив одит к поступлению в оды в клетки. В частности, с накоплением сорбитола св яз ано в оз никнов ение катаракты у больны х диабетом . Гипергликем ия прив одит к пов ы ш енном у гликоз илиров анию белков – образ ов анию ком плексов м еж ду глюкоз ой или ф руктоз ой и ам иногруппам и белков и других аз отсодерж ащ их м олекул. О браз ующ иеся ком плексы наз ы в аются ф руктоз ам ины . Ф ункции гликоз илиров анны х белков наруш аются; так, гликоз илиров анны й гем оглобин прочнее св яз ы в ает кислород и х уж е отдает его тканям . В оз никают иш ем ия тканей, неф ропатия (патология почек), ретинопатия (патология сетчатки глаз а), ангиопатия (пов реж дениесосудов ) и другиепатологическиесостояния. Гипергликем ия прив одитк глюкоз урии – в ы делению глюкоз ы с м очой. Т ак как глюкоз а осм отически актив на, происх одит ув еличение объ ем а в ы деляем ой м очи (пов ы ш ениедиурез а) и усилениеж аж ды . У силение распада липидов прив одит к образ ов анию больш ого количеств аацетил-коф ерм ентаА . И з бы ток ацетил-К оА , которы й неуспев ает окисляться в цикле трикарбонов ы х кислот, в печени прев ращ ается в кетонов ы е тела – ацетоуксусную, β-гидроксим асляную кислоты и в ацетон. К етонов ы е тела поступают в кров ь и достав ляются в другие органы , где м огут бы ть окислены с в ы делением энергии. Пов ы ш ение концентрации кетонов ы х телв кров и м ож ет прив ести к кетоацидоз у, опасном у состоянию, при котором сниж ен рН кров и. У силенны й распад белков прив одитк сниж ению в есаи им м унитета. И з ам инокислот путем глюконеогенез а образ уется глюкоз а, при этом пов ы ш ается уров ень м очев ины в кров и, которая образ уется из ам иногрупп ам инокислот. Биох им ическиеанализ ы при сах арном диабете. Ди агнос т и ка с ахарного ди аб ет а. В диагностике сах арного диабета использ уют определение концентрации глюкоз ы в кров и (норм а – 3,33-5,55 м м оль/л) и глюкоз ы в м оче (в норм е нет). Т ест толерантности к глюкоз е в ключает определение скорости в оз в рата концентрации глюкоз ы в кров и к норм альном у уров ню послеприем аили в нутрив енного в в едения глюкоз ы . У з доров ы х людей через дв а часа после в в едения глюкоз ы ее уров ень в кров и в оз в ращ ается к норм е. Ди агнос т и ка ком пенс ац и и с ахарного ди аб ет а. О пределяют концентрации кетонов ы х тел в кров и и в м оче, лактата в кров и (для установ ления степени иш ем ии), ф руктоз ам инов и гликоз илиров анного гем оглобина в кров и (прогноз раз в ития ослож нений), инсулина и глюкагона в кров и. О пределен ие глюкозы в сы воротке крови. Г люкозооксидазн ы й метод Принцип м етода. При окислении β-D-глюкоз ы кислородом в оз дух апри каталитическом действ ии глюкоз ооксидаз ы образ уется экв им олярное количеств о пероксида в одорода. Под действ ием пероксидаз ы H2O2 окисляет 4-ам ино-антипирин в присутств ии ф енолов в окраш енное соединение. 20 И нтенсив ность окраски пропорциональна концентрации глюкоз ы в анализ ируем ом образ цеи из м еряется ф отом етрически при длинев олны 490540 нм . Реактив ы . 1. Рабочий реагент, содерж ащ ий калий-ф осф атны й буф ер 0,1 м м оль/л, рН 7,4; 12,5 ед/м л глюкоз ооксидаз ы , 2,5 ед/м л пероксидаз ы , 8оксих инолин 0,75 м м оль/л, 4-ам иноантипирин 50 м м оль/л. 2. Стандартны й раств ор глюкоз ы 10,0 м м оль/лв 0,15% раств оребенз ойной кислоты . Ход работы . В нести в пробирки сы в оротку кров и и образ цы согласно таблице 5. Пробы тщ ательно перем еш ать и инкубиров ать в течение 15 м ин. при тем пературе 37°С. После окончания инкубации из м ерить в еличину оптической плотности опы тной и калибров очной проб против контрольной пробы при длине в олны 490-540 нм . О краска проб стабильна в течение 2 ч. после инкубации при услов ии предох ранения от прям ого в оз действ ия солнечны х лучей. Т аблица5. Ход определения глюкоз ы Реактив ы О пы тная К алибров очная К онтрольная проба, м л проба, м л проба, м л Рабочий реагент 2,0 2,0 2,0 Сы в ороткакров и 0,02 Стандартны й раств ор 0,02 H2O 0,02 Расчет. Расчет концентрации глюкоз ы в анализ ируем ы х пробах пров ести по ф орм уле: С= Е Е опы т ⋅ 10 , станд где С - концентрация глюкоз ы , м м оль/л; Е опы т – оптическая плотность опы тной пробы ; Е станд – оптическая плотность калибров очной пробы ; 10 – концентрация глюкоз ы в стандартном раств оре, м м оль/л Д иагностическое з начение теста. Глюкоз а - основ ной ком понент энергетического обм ена в организ м е. Н орм альное содерж ание в кров и состав ляет3,33 – 5,55 м м оль/л, в сы в ороткеи плаз м е- 3,8 – 6,2 м м оль/л. Гипергликем ия (пов ы ш ение концентрации глюкоз ы в кров и) м ож ет наблюдаться в ф из иологических услов иях : послеобильной углев одной пищ и, ф из ических нагруз ок, сильны х эм оций. Гипергликем ия м ож ет наблюдаться при м ногих патологических состояниях : сах арном диабете, остром панкреатите, трав м ах , сотрясениях и з аболев аниях голов ного м оз га, токсикоз ах и отрав лениях , псих ическом в оз буж дении, пов ы ш енной горм ональной актив ности коры надпочечников и передней доли гипоф из аи некоторы х других патологиях . Гипогликем ия (сниж ение концентрации глюкоз ы в сы в оротке кров и) бы в ает при передоз иров ке инсулина, з аболев аниях подж елудочной ж елез ы , 21 з локачеств енны х опух олях , некоторы х пораж ениях печени, эндокринны х з аболев аниях , в рож денной недостаточности ф ерм ентов (галактоз ем ия). О пределен ие глюкозы мочи качествен н ы м методом Принцип м етода. Глюкоз а в осстанав лив ает соли м еди (II), им еющ ие голубую окраску, в соли м еди (I), в ы падающ ие из раств ора в в иде красного осадка. Реактив ы . Реактив Гайнеса, содерж ащ ий 13,3 г CuSO4·5H2O, 50 г NaOH и 15 г глицеринав 1 лH2O. Ход определения. К 4 м л реактив а Гайнеса прилив ают 1 м л м очи. Став ятв кипящ ую баню на2 - 3 м инуты . В присутств ии глюкоз ы появ ляется ж елтая или красная окраска ж идкости и осадок. При отсутств ии глюкоз ы цв етж идкости нем еняется (остается синим ). О ценка качеств а: полож ительная; слабо полож ительная; слабо отрицательная; отрицательная. К оличествен н ы й метод (А льтгаузен а) определен ия глюкозы мочи Принцип м етода. Глюкоз а при нагрев ании с NaOH образ ует окраш енноесоединение. Реактив ы : 10%-й раств ор NaOH. Ход определения: К 4 м л исследуем ой м очи прилить 1 м л 10%-го NaOH и кипятить 1 - 3 м ин. в кипящ ей в одяной бане. О х ладить. Через 10 м ин. срав нитьсо ш калой контрольны х раств оров . Приготов ление контрольны х раств оров . В з ять 1 г сух ой глюкоз ы и раств орить в 25 м л без белков ой, без глюкоз ной м очи. И з этого 4%-го раств ораготов ятраз в едения: 1. 3 м лраств ора+ 1 м лм очи = 3%-й раств ор 2. 2 м лраств ора+ 2 м лм очи = 2%-й раств ор 3. 1 м лраств ора+ 3 м лм очи = 1%-й раств ор 4. 0,5 м лраств ора+ 3,5 м лм очи = 0,5%-й раств ор. К онтрольны е раств оры обрабаты в ают так ж е, как опы тную пробу. Хранятоколо 2 недель. Д иагностическоез начение. Глюкоз ав м очепояв ляется при пов ы ш ении ее концентрации в кров и в ы ш е почечного порога реабсорбции (около 9 м м оль/л). Н аличиеглюкоз ы в м очем ож етбы тьприз наком сах арного диабета или з аболев ания почек со сниж ением порогареабсорбции для глюкоз ы К ачествен н ы е реакции н а кетон овы е тела в моче. П роба Л ибен а Реакция основ ана на св ойств е ацетона прев ращ аться в йодоф орм в присутств ии йода в щ елочной среде. К 1 м лисследуем ой м очи добав ляют несколько капель раств ора люголя (йод в раств оре йодистого калия) и несколько капель 10%-го раств ора гидроксида натрия. При наличии ацетона в м оче появ ляется пом утнение з а счет образ ов ания йодоф орм а, им еющ его х арактерны й з апах : 22 CH3 C=O + 3I2 + 4NAOH CH3 ацетон CHI 3 + CH3COONA + 3NAI + 3H2O О садок йодоф орм а (ж елты й, кристаллический) П роба Л егаля Реакция основ ана на том , что ацетон и ацетоуксусная кислота в щ елочной среде образ уют с нитропруссидом натрия ком плексны е анионы оранж ев о-красного цв ета, перех одящ его в в иш нев о-красны й при подкислении концентриров анной уксусной кислотой. К 1 м лм очи добав ляют несколько кристаллов нитропруссида натрия и 3-4 капли 10%-го раств ора гидроксида натрия. При кетонурии появ ляется оранж ев ое окраш ив ание, которое прев ращ ается в в иш нев ое при добав лении 5-8 капель концентриров анной уксусной кислоты . П роба Г ерхардта Е нольная ф орм а ацетоуксусной кислоты , в з аим одейств уя с х лорны м ж елез ом , образ ует ком плексное соединениев иш нев о-красного цв ета. К 1 м л м очи добав ляют несколько капель х лорного ж елез а. При наличии в м оче ацетоацетатапояв ляется в иш нев о-красноеокраш ив ание. CH3 CH3 C=O C-OH CH2 CH COOH ацетоуксусная кислота(кетоф орм а) COOH ацетоуксусная кислота (енольная ф орм а) Р абота 9. О бмен холестерин а в орган изме человека и его н аруш ен ия. О пределен ие кон цен трации холестерин а в сы воротке крови Холестерин (х олестерол) яв ляется соединением , типичны м для м етаболиз м а ж ив отны х , и содерж ится в з начительны х количеств ах в продуктах ж ив отного происх ож дения - в яичном ж елтке, м ясе, печени и м оз ге. Холестерин представ ляет собой ам ф ипатический липид и яв ляется нез ам еним ы м структурны м ком понентом м ем бран. Холестерин содерж ится в состав е липопротеинов либо в св ободной ф орм е, либо в в иде эф иров с длинноцепочечны м и ж ирны м и кислотам и. Липопротеины транспортируют х олестерин в кров отоке, где легко устанав лив ается рав нов есие с х олестерином , в х одящ им в состав других липопротеинов и м ем бран. 23 Липопротеины плаз м ы кров и. Н ераств орим ость ж иров в в оде обуслов лив ает необх одим ость сущ еств ов ания специальны х транспортны х ф орм для переноса их кров ью. О снов ны е из этих ф орм : х илом икроны , липопротеины очень низ кой плотности (ЛПО Н П, пре-β-липопротеины ), липопротеины низ кой плотности (ЛПН П, β-липопротеины ), липопротеины в ы сокой плотности (ЛПВ П, α-липопротеины ). Липопротеины представ ляют собой м елкие (до 1 м км диам етром ) глобулярны е образ ов ания, в которы х м олекулы ф осф олипидов , х олестерина и белков располож ены радиально гидроф ильной частью к пов ерх ности, гидроф обной частью к центру. Ц ентральная часть глобулы з анята триацилглицеролам и и эф ирам и х олестерина. Плотностьлипопротеинов прям о пропорциональнасодерж анию белкаи обратно пропорциональнасодерж анию триацилглицеролов . О бм ен х олестерина. Холестерин синтез ируется в о м ногих тканях из ацетил-К оА . Приблиз ительно полов ина х олестерина, им еющ егося в организ м е, образ уется путем биосинтез а (около 500 м г/сутки), а другая полов ина поступает с пищ ей. Холестерин синтез ируется глав ны м образ ом в печени (до 80%), киш ечникеи кож е. Холестерин яв ляется предш еств енником других стероидов , а им енно кортикостероидов (горм онов надпочечников ), полов ы х горм онов , ж елчны х кислот и в итам ина Д . И з организ м а челов ека еж еднев но в ы в одится около 1 г х олестерина. Прим ерно полов ина этого количеств а экскретируется с ф екалиям и после прев ращ ения в ж елчны е кислоты . О став ш аяся часть в ы в одится в в иде нейтральны х стероидов . Ж елчны е кислоты образ уются из х олестерина в печени. О ни способств уют эм ульгиров анию ж иров в процессе пищ ев арения и в сасы в анию ж иров в киш ечнике. Значительная доля солей ж елчны х кислот, поступающ их с ж елчью в киш ечник, в сасы в ается в киш ечнике и через в оротную в ену в оз в ращ ается в печень (киш ечно-печеночная циркуляция ж елчны х кислот). Д ля в осполнения потерьж елчны х кислотв печени постоянно осущ еств ляется синтез ж елчны х кислот из х олестерина в количеств ах , экв ив алентны х в ы в одим ом у. Н аруш ения обм ена х олестерина. В се состояния и з аболев ания, при которы х из м еняется содерж ание х олестерина в организ м е, кров и или отдельны х тканях , м ож но раз бить на три группы : перв ая х арактериз уется из м енением содерж ания х олестерина в плаз м е и тканях ; в торая объ единяет в се в иды гипер- и гипох олестеринем ий; к третьей относятся болез ни локального накопления в раз личны х клетках и тканях х олестерина и его произ в одны х . Холестерин яв ляется основ ны м ком понентом ж елчны х кам ней, однако его глав ная роль в патологии состоит в том , что он служ ит ф актором , в ы з ы в ающ им атеросклероз ж из ненно в аж ны х артерий голов ного м оз га, сердечной м ы ш цы и других органов . А теросклероз – патология, х арактериз ующ аяся отлож ением х олестерина в стенках сосудов . Глав ная причина отлож ений – гиперх олестеринем ия на ф оне пов реж дений эндотелия, в ы з в анны х 24 гипертонией, в оспалительны м и процессам и, пов ы ш енной св ерты в аем остью кров и, в оз действ ием токсических в ещ еств (наприм ер, ком понентов табачного ды м а). В пов реж денны х участках сосудистой стенки эндотелий оказ ы в ается проницаем ы м для ряда в ещ еств . В стенку сосуда м огут проникать в се липопротеины , кром е х илом икронов . О днако атерогенны м и яв ляются ЛПО Н П и ЛПН П, содерж ащ ием ного х олестерина. Липопротеины , проникш ие в сосудистую стенку, поглощ аются ф агоцитам и и в се их состав ны е части, кром е х олестерина, раз руш аются ф ерм ентам и. Холестерин этериф ицируется, эф иры х олестеринанакаплив аются в клетках и раз руш ают их . В округ образ ующ их ся липидны х бляш ек раз в ив ается соединительная ткань, наступает кальциф икация пораж енного участка сосуда. Сосуды станов ятся плотны м и, неэластичны м и, ух удш ается кров оснабж ение тканей, нам естебляш ек м огутв оз никатьтром бы . Гиперх олестеринем ия – рез ультат наруш ения в одном из з в еньев слож ной биох им ической систем ы , в ключающ ей синтез х олестерола, его обм ен, транспорт и в ы в едение, ф орм иров ание липопротеинов , их катаболиз м , рецепцию липопротеинов клеткам и. Т ак, з начительны й из бы ток х олестерина в питании, х отя и в едет к з ам едлению его биосинтез а, м ож ет яв иться причиной гиперх олестеринем ии. При сниж ении количеств а клеточны х рецепторов к х олестерину клетки теряютспособность поглощ ать х олестерин из кров и, что такж ев едетк раз в итию гиперх олестеринем ии. В настоящ ее в рем я м етоды предупреж дения и лечения атеросклероз а направ лены на то, чтобы ум еньш ить его поступление в организ м (диеты ), усилить обратны й отток из тканей путем сниж ения х олестеринем ии з а счет подав ления синтез а, прям ого удаления из организ м а (гем осорбции), путем ограничения в сасы в ания или ув еличения экскреции (преры в ание киш ечнопеченочной циркуляции ж елчны х кислот). О тм ечено, что содерж аниев пищ е полиненасы щ енны х ж ирны х кислот яв ляется ф актором , сниж ающ им содерж аниех олестеринав кров и. Лабораторная диагностика наруш ений обм ена х олестерина. О пределяютконцентрацию общ его х олестеринав сы в оротке(плаз м е) кров и. Пов ы ш ение показ ателя в ы ш е 6,5 м м оль/л - указ ание на в оз м ож ность раз в ития атеросклероз а. Т акж е определяют концентрацию х олестерина в о ф ракции ЛПВ П: сниж ение этого показ ателя ниж е 0,9 м м оль/луказ ы в ает на в оз м ож ность раз в ития атеросклероз а. В ероятность раз в ития атеросклероз а прогноз ируется оптим ально так наз ы в аем ы м индексом атерогенности – отнош ением сум м арного содерж ания х олестерина в ЛПН П и ЛПО Н П к его содерж анию в ЛПВ П. Э то отнош ениев 20-30 летот2 до 2,8; старш е30 – до 3,5, ау больны х атеросклероз ом – в ы ш е4,0. Д иагностическоез начениеим еет и содерж аниесум м арного содерж ания х олестеринак сум м еф осф олипидов : в норм еоколо 1,0, при атеросклероз е1,5 и в ы ш е. О пределен ие кон цен трации общ его холестерин а в сы воротке крови Принцип м етода. При гидролиз е эф иров х олестерина ф ерм ентом х олестеролэстераз ой образ уется св ободны й х олестерин. О браз ов ав ш ийся и 25 им еющ ийся в пробе х олестерин окисляется кислородом в оз дух а под действ ием х олестеролоксидаз ы с образ ов анием экв им олярного количеств а перекиси в одорода. Под действ ием пероксидаз ы перекисьв одородаокисляет х ром огенны е субстраты с образ ов анием окраш енного продукта. И нтенсив ность окраски пропорциональна концентрации х олестерина в пробе. Реактив ы . 1. Рабочий реагент: 0,1 м оль/л ф осф атны й буф ер, содерж ащ ий 20 м м оль/л ф енол, детергенты , актив аторы и стабилиз аторы ф ерм ентов , х ром огены , 200 U/л х олестеролэстераз ы , 250 U/л х олестеролоксидаз ы , 500 U/л пероксидаз ы . 2. Стандартны й раств ор х олестеринасодерж ит5,17 м м оль/лх олестерина. Ход работы . В трех пробирках – опы тной, калибров очной и контрольной – см еш ив аютреактив ы согласно таблице6. Содерж им ое пробирок тщ ательно перем еш ив ают и инкубируют не м енее 5 м ин. при тем пературе 37°С. И з м еряют оптическую плотность опы тной и калибров очной проб против контрольной пробы при длинев олны 490-500 нм . О краска стабильна в течение 2 часов при предох ранении от прям ого солнечного св ета. Т аблица6. Ход определения х олестерина Реактив ы , м л О пы тная проба К алибров очная К онтрольная проба проба Сы в оротка 0,02 В ода 0,02 дистиллиров анная Рабочий реагент 2,0 2,0 2,0 Стандартны й раств ор 0,02 х олестерина Расчет. Расчетконцентрации х олестеринапров одятпо ф орм уле: С = (Е 0/Eст)х 5,17 м м оль/л, гдеЕ 0 – оптическая плотностьопы тной пробы ; Eст – оптическая плотностькалибров очной пробы , из м еренны еотносительно контрольной пробы . Содерж аниех олестерина: идеальноесодерж ание < 5,2 м м оль/л; допустим оесодерж ание– 5,2 – 6,5 м м оль/л; патологическоесодерж ание> 6,5 м м оль/л. Д иагностическое з начение теста. У в еличение концентрации х олестерина в кров и – гиперх олестеринем ия – яв ляется достов ерны м ф актором рискараз в ития атеросклероз а. 26 Р абота 10. М етоды определен ия и классификация витамин ов. К олориметрический метод определен ия аскорбин овой кислоты в плазме М етоды определения в итам инов в биологических объ ектах делят на ф из ико-х им ические и биологические. Н екоторы е в итам ины обладают способностью поглощ атьоптическоеиз лучениеопределенной части спектра. В частности, в итам ин А им еетспециф ичную полосу поглощ ения при 328-330 нм . Е го концентрацию определяют спектроф отом етрически. При в з аим одейств ии в итам инов с рядом х им ических соединений наблюдаются х арактерны е цв етны е реакции. Поэтом у в итам ины м ож но определить ф отоколорим етрически, наприм ер, в итам ин B1 - при пом ощ и диаз ореактив аи т.д. Д ля определения в итам инов B1, В 2 и других прим еняют ф люором етрические м етоды . И спольз уют и титрим етрические м етоды , наприм ер, при определении в итам ина С прим еняют титров ание pacтв ором 2,6-дих лорф енолиндоф енола. Э ти м етоды поз в оляют судить о количеств енном содерж ании в итам инов в исследуем ом пищ ев ом продукте или органах и тканях ж ив отны х и челов ека. Д ля в ы яснения обеспеченности организ м а челов ека каким -либо в итам ином часто количеств енно определяют соотв етств ующ ий в итам ин или продукт его обм ена в сы в оротке кров и, м оче или биопсийном м атериале. Э кскрецию в итам инов рассчиты в ают на 1 г креатинина. О бъ ектив ную инф орм ацию об обеспеченности организ м а в итам ином такж е дает определение актив ности ф ерм ентов , использ ующ их в х оде катализ а коф ерм ентную ф орм у данного в итам ина. Н априм ер, определение степени актив ации транскетолаз ы эритроцитов последобав ления тиам инпироф осф ата яв ляется чув ств ительны м тестом оценки обеспеченности организ м а в итам ином B1. Биологические м етоды основ аны на определении того м иним ального количеств а в итам ина, которое при добав лении к искусств енной диете, лиш енной данного в итам ина, предох раняет ж ив отное от раз в ития ав итам иноз аили из лечив аетего отуж ераз в ив ш ейся болез ни. Э то количеств о в итам ина приним ают з а единицу (в литературе из в естны « голубины е», « кры сины е» единицы ). Больш ое м есто в количеств енном определении ряда в итам инов : ф олиев ой кислоты , в итам ина В 12 и др. в биологических ж идкостях , в частности, в кров и, з аним ают м икробиологические м етоды , основ анны е на из м ерении скорости роста бактерий; последняя пропорциональна концентрации в итам ина в исследуем ом объ екте. К оличеств о в итам инов принято в ы раж ать, кром е того, в м иллиграм м ах , м икрограм м ах , м еж дународны х единицах (ME или IU). К лассификация витамин ов Сов рем енная классиф икация в итам инов неяв ляется сов ерш енной. О на основ ананаф из ико-х им ических св ойств ах (в частности, раств орим ости) или на х им ической природе, но до сих пор сох раняются и букв енны е обоз начения. В з ав исим ости от раств орим ости в неполярны х органических раств орителях или в в одной среде раз личают ж ирораств орим ы е и 27 в одораств орим ы е в итам ины . В прив одим ой классиф икации в итам инов , пом им о букв енного обоз начения, в скобках указ ан основ ной биологический эф ф ект, иногда с пристав кой « анти», указ ы в ающ ей на способность данного в итам ина предотв ращ ать или устранять раз в итие соотв етств ующ его з аболев ания; далее прив одится ном енклатурное х им ическое наз в ание каж дого в итам ина. В итам ины , раств орим ы ев ж ирах : 1. В итам ин А (антиксероф тальм ический); ретинол; 2. В итам ин D (антирах итический); кальциф еролы ; 3. В итам ин Е (антистерильны й, в итам ин раз м нож ения); токоф еролы ; 4. В итам ин К (антигем оррагический); наф тох иноны . В итам ины , раств орим ы ев в оде: 1. В итам ин B1 (антинев ритны й); тиам ин; 2. В итам ин В 2 (в итам ин роста); рибоф лав ин; 3. В итам ин В 6 (антидерм атитны й, адерм ин); пиридоксин; 4. В итам ин В 12 (антианем ический); цианкобалам ин; кобалам ин; 5. В итам ин РР (антипеллагрический, ниацин); никотинам ид; 6. В итам ин В с (антианем ический); ф олиев ая кислота; 7. В итам ин В 3 (антидерм атитны й); пантотенов ая кислота; 8. В итам ин Н (антисеборейны й, ф актор ростабактерий, дрож ж ей и грибков ); биотин; 9. В итам ин С (антискорбутны й); аскорбинов ая кислота; 10. В итам ин Р (капилляроукрепляющ ий, в итам ин проницаем ости); биоф лав оноиды . Пом им о этих дв ух глав ны х групп в итам инов , в ы деляют группу раз нообраз ны х х им ических в ещ еств , из которы х часть синтез ируется в организ м е, но обладает в итам инны м и св ойств ам и. Д ля челов ека и ряда ж ив отны х эти в ещ еств апринято объ единятьв группу в итам иноподобны х . К олориметрический метод определен ия аскорбин овой кислоты в плазме крови Принцип м етода. М етод основ ан на учете интенсив ности окраски продукта, образ ов анного в рез ультатев з аим одейств ия аскорбинов ой кислоты и ф осф орно-в ольф рам ов ой кислоты . Реактив ы . 1. Раств ор ф осф орно-в ольф рам ов ой кислоты (в 30 м лв оды при нагрев ании на в одяной бане раств оряют 20 г NaWО 4•2Н 20 и 10 г Nа2HPО 4•2Н 2О ; в 15 м лв оды раств оряют 5 м лконцентриров анной H2SO4, з атем в торой раств ор м едленно в лив ают в теплы й раств ор в ольф рам ата и см есь кипятят с обратны м х олодильником в течение 2 ч.). 2. Стандартны й раств ор аскорбинов ой кислоты (2 м г/м л) в 0,5%-м раств оре щ ав елев ой кислоты . Ход работы . В центриф уж ную пробирку в носят 2 м лплаз м ы , з атем м едленно прибав ляют 2 м л раств ора ф осф орно-в ольф рам ов ой кислоты , перем еш ив ают, остав ляют на 30 м ин. и центриф угируют 15 м ин. при 3000 28 об/м ин. О птическую плотностьсупернатантаиз м еряютпротив контроля при 700 нм . Расчет. К онцентрацию аскорбинов ой кислоты рассчиты в ают по калибров очном у граф ику, построенном у с использ ов анием св еж еприготов ленного стандартного раств ора аскорбинов ой кислоты согласно таблице7. Граф ик линеен в интерв алеконцентраций аскорбинов ой кислоты от0,5 до 2 м г в 100 м л. Т аблица7. Приготов лениекалибров очны х раств оров аскорбинов ой кислоты Н ом ера Содерж аниеаскорбинов ой Реактив ы , м л пробирок Э талонны й раств ор кислоты , м г/м л Н 2О 1 1 4 0,4 2 2 3 0,8 3 3 2 1,2 4 4 1 1,6 5 5 0 2,0 Задачи по теме «В итамин ы » В ариан т № 1 1. Суточная потребность в з рослого челов ека в никотинов ой кислоте ум еньш ается, если в пищ е содерж ится больш ое количеств о ам инокислоты триптоф ана. Что м ож но сказ ать о в з аим осв яз и м еж ду никотинов ой кислотой и триптоф аном наоснов еэтого наблюдения? 2. В лев ой части страницы перепиш ите столбиком обоз начения в итам инов (см . ниж е). Против каж дого справ а укаж ите его биологическую роль. В итам ины : B2 (пантотенов ая кислота), B5 (PP), B6, B12, Bс (ф олиев ая кислота), А , E, К . Биологическая роль: а – участв уетв реакции образ ов ания ф орм ильной группы из серина; б – в х одит в состав дегидрогеназ ; в – стим улирует обм ен ам инокислот; г – участв ует в синтез е 2-го ф актора св ерты в ания кров и; д – в состав м олекулы в х одит ам идная группа; е – ослабляет цепны е св ободнорадикальны е процессы ; ж – при ав итам иноз е раз в ив ается анем ия; з – при ав итам иноз ев оз никаетусиленноеорогов ениеэпителия. 3. О бъ ясните, почем у работа в горячих цех ах з начительно пов ы ш ает потребностьв в итам инах . В ариан т № 2 1. П ол и неври т у гол уб ей. В став ш их классическим и эксперим ентах голуби, содерж ащ иеся на эксперим ентальной диете, утрачив али координацию дв иж ений и способность удерж ив ать тело в рав нов есии. У ров ень пирув ата в кров и и м оз гу этих птиц з начительно прев ы ш ал норм альны й. Т акое состояние прох одило, если голубям дав али м ясо. О бъ яснитеэти наблюдения. 29 2. В лев ой части страницы перепиш ите столбиком обоз начения в итам инов (см . ниж е). Против каж дого справ а укаж ите его биологическую роль. В итам ины : B2, B3 (пантотенов ая кислота), B5 (PP), Bс (ф олиев ая кислота), С, А , Д , К . Биологическая роль: а – участв ует в переносе ацильны х групп; б – в х одит в состав ф лав опротеинов ; в – необх одим для образ ов ания гидроксилиз ина и гидроксипролина в состав е коллагена; г – в состав м олекулы в х одятглутам инов ая и параам инобенз ойная кислоты ; д – в х одитв состав ф оточув ств ительны х элем ентов глаз а; е – образ уется в кож е под в лиянием ультраф иолетов ы х лучей; ж – участв ует в образ ов ании γкарбоксиглутам инов ой кислоты ; з – в х одитв состав Н А Д + и Н А Д Ф +. 3. О бъ ясните, почем у в детском в оз расте потребность в в итам инах в ы ш е, чем у в з рослы х . В ариан т № 3 1. Lactobacillus casei – представ ители сем ейств а бактерий, использ уем ы х для получения таких продуктов брож ения, как йогурт, кв аш еная капуста, соленья, не способны синтез иров ать рибоф лав ин. Характерное св ойств о этих бактерий з аключается в том , что они получают энергию з асчетрасщ епления глюкоз ы до м олочной кислоты (рК 3,5). К акой м етод количеств енного определения рибоф лав инав ы предлож или бы , исх одя из этой инф орм ации? 2. В лев ой части страницы перепиш ите столбиком обоз начения в итам инов (см . ниж е). Против каж дого справ а укаж ите его биологическую роль. В итам ины : Bс (ф олиев ая кислота), С, B5 (PP), B12, H (биотин), А , Д , Е . Биологическая роль: а– ав итам иноз м ож етв оз никнутьпри наруш ении секреторной ф ункции добав очны х клеток ж елудка; б – яв ляется антиоксидантом ; в – при гипов итам иноз е наруш ается структура соединительной ткани; г – св яз ы в аетСО 2; д – в х одитв состав родопсина; еучаств ует в переносе одноуглеродны х ф рагм ентов (м етильной группы ); ж стим улирует отлож ение кальция и ф осф ора в костях ; з – в х одит в состав НАД Ф Н. 3. При перех оде на рацион с в ы соким содерж анием белка организ м начинает испы ты в ать пов ы ш енную потребность в в итам ине B6. О бъ ясните м ех аниз м этого яв ления. В ариан т № 4 1. Бактерии Lactobacillus casei растутнапростой культуральной среде, содерж ащ ей рибоф лав ин, пиридоксин и четы ре ам инокислоты . Е сли в культуральную среду добав итьполны й набор ам инокислоти рибоф лав ин, то количеств о пиридоксина, необх одим ого для оптим ального роста бактерий, сократиться на90%. О бъ ясните, почем у так происх одит. 30 2. В лев ой части страницы перепиш ите столбиком обоз начения в итам инов (см . ниж е). Против каж дого справ а укаж ите его биологическую роль. В итам ины : B1, B2, B3 (пантотенов ая кислота), B5 (PP), H (биотин), Д , E, К. Биологическая роль: а – им еет стероидную структуру; б – в х одит в состав коф ерм ента А ; в – участв ует в окислении сукцината; г – участв ует в окислительном декарбоксилиров ании пиров иноградной и 2-оксоглутаров ой кислот; д – стим улятор биосинтез а протром бина; е – ослабляет цепны е св ободнорадикальны е процессы ; ж – участв ует в реакциях карбоксилиров ания; з – в х одитв состав Н А Д Ф Н . 3. При расследов ании дорож но-транспортного происш еств ия бы ло установ лено, что в одитель страдает гипов итам иноз ом . Э то послуж ило причиной столкнов ения дв ух ав том обилей в ночное в рем я. Н едостаток какого в итам инаприв елк трагедии? В ариан т № 5 1. Бактерии Streptococcus faecalis, обитающ ие в толстом киш ечнике, нуж даются в в итам ине ф олиев ой кислоте. Е сли в питательной среде содерж атся аденин и тим ин, то бактерии м огутх орош о расти и в отсутств ии ф олиев ой кислоты . Почем у бактерии нуж даются в ф олиев ой кислоте? Почем у потребность в ф олиев ой кислоте исчез ает при добав лении в культуральную среду аденинаи тим ина? 2. В лев ой части страницы перепиш ите столбиком обоз начения в итам инов (см . ниж е). Против каж дого справ а укаж ите его биологическую роль. В итам ины : B1, B2, B3 (пантотенов ая кислота), B6, С, А , Д , К . Биологическая роль: a - стим улирует синтез коллагена в соединительной ткани; б – переноситостаток уксусной кислоты ; в – яв ляется коф ерм ентом сукцинатдегидрогеназ ы ; г - при гиперв итам иноз енаблюдается кальциф икация тканей организ м а; д – в х одит в состав слож ного белка родопсина; е- участв уетв прев ращ ении одних ам инокислотв другие; ж - при недостатке в итам ина ув еличив ается в рем я св ерты в ания кров и; з - при гипов итам иноз еув еличив ается содерж аниепиров иноградной кислоты . 3. О бъ ясните целесообраз ность прием а в итам ина Е и его аналогов специалистам и, работающ им и в з онепов ы ш енной радиации. В ариан т № 6 1. В итам ины А и D м ож но прим енять сраз у з а один прием в количеств е, которое достаточно для поддерж ания их норм ального уров ня в течение нескольких недель; в итам ины ж е группы В необх одим о приним ать з начительно чащ е. Почем у? 31 2. В лев ой части страницы перепиш ите столбиком обоз начения в итам инов (см . ниж е). Против каж дого справ а укаж ите его биологическую роль. В итам ины : B1, B3 (пантотенов ая кислота), B5 (PP), B6, С, Bс (ф олиев ая кислота), Д , К . Биологическая роль: а– пов ы ш аетэластичностьсосудов и капилляров ; б – источником в итам инаяв ляется х олестерин; в – в состав в итам инав х одит 2,4-диокси-3,3-дим етилм асляная кислота и β-аланин; г – участв ует в окислении спиртов , альдегидов , ам инокислот, органических кислот; д – участв уетв переносеодноуглеродны х остатков ; е– необх одим для окисления пиров иноградной кислоты до уксусной; ж – участв ует в образ ов ании γкарбоксиглутам инов ой кислоты в состав е протром бина; з – в х одит в состав ам инотрансф ераз . 3. И з в естно, что ж елчны е кислоты актив но в лияют на в сасы в ание ж иров в киш ечнике. О пиш ите картину гипов итам иноз а у больны х людей с наруш ением поступления ж елчи в киш ечник. Р абота 11. К оличествен н ое определен ие пировин оградн ой кислоты в крови колориметрическим методом (по У мбрайту) Пиров иноградная кислота (пирув ат) яв ляется одним из центральны х м етаболитов углев одного обм ена. О на образ уется в процессе распада глюкоз ы и гликогена в тканях , при окислении м олочной кислоты , а такж е в рез ультате прев ращ ений ряда ам инокислот. При окислительном декарбоксилиров ании пирув ата образ уется ацетил-К оА , которы й в ступает в цикл К ребса. Пиров иноградная кислота - один из основ ны х субстратов глюконеогенез а. Принцип м етода. Пирув ат при в з аим одейств ии с 2,4-динитроф енилгидраз ином в кислой среде образ ует 2,4-динитроф енилгидраз он пиров иноградной кислоты . Э то соединение в щ елочной среде приобретает коричнев о-красную окраску, интенсив ностькоторой прям о пропорциональна содерж анию пирув ата. Реактив ы . 1. 10 %-й раств ор трих лоруксусной кислоты (Т ХУ ). 2. 3%-й раств ор NaOH. 3. 0,1 %-й раств ор 2,4-динитроф енилгидраз ина(2,4-Д Н Ф Г). 4. Э талонны й раств ор, содерж ащ ий 2 м г пирув атанатрия в 100 м лH2O. Ход работы . В центриф уж ную пробирку отм еряют 2 м л Т ХУ , добав ляют 0,5 м л кров и, в з балты в ают и остав ляют стоять 10 м ин. для осаж дения белков ; з атем центриф угируют 5 м ин. при 3000 g. Д алее берут 2 пробирки — в перв ую в носят 0,5 м л центриф угата (опы тная проба), в о в торую 0,5 м л H2O. В обе пробирки добав ляют по 0,5 м л 3%-го NaOH, в ы держ ив ают5 м ин. при ком натной тем пературе, добав ляют0,15 м л0,1%-го 2,4-Д Н Ф Г, перем еш ив ают и пом ещ ают в терм остат при 37˚С на 15 м ин. Затем добав ляют 3,5 м л 3%-го NaOH и через 5 м ин. опы тную пробу ф отоколорим етрируютпри 440 нм в кюв етах с толщ иной слоя 0,5 см , против контроля. 32 Расчет. Содерж ание пирув ата в пробе определяют по калибров очном у граф ику, построенном у по стандартны м раств орам пирув ата. Построениекалибров очного граф ика. И з эталонного раств орапирув ата приготав лив аюткалибров очны ераств оры согласно таблице8. Т аблица8. Приготов лениекалибров очны х раств оров пирув ата Н ом ера Реактив ы , м л Содерж аниепирув ата пробирок Э талонны й раств ор Н 2О м г% м км оль/л 1 1 4 0,4 36 2 2 3 0,8 72 3 3 2 1,2 109 4 4 1 1,8 163 5 5 0 2 181 И з каж дой пробирки отбирают по 0,5 м лкалибров очны х раств оров и обрабаты в ают так ж е, как опы тную пробу. По рез ультатам из м ерений построить граф ик з ав исим ости оптической плотности раств оров от концентрации пирув ата. К линическое з начение определения пирув ата. Содерж ание пирув ата в кров и з доров ого челов екаколеблется от0,4 до 1,2 м г в децилитрекров и (34102 м км оль/л), ав м оче- от10 до 25 м г в суточном диурез е. Н аиболее рез кое пов ы ш ение концентрации пирув ата отм ечается при м ы ш ечной работе и В 1-в итам инной недостаточности. При больш их ф из ических нагруз ках концентрация пирув атам ож етпов ы ш аться до 5 м г/100 м л. К ром е того, пов ы ш ение содерж ания пирув ата в кров и отм ечается при парех им атоз ны х з аболев аниях печени, сах арном диабете, сердечной деком пенсации, токсикоз ах . В спинном оз гов ой ж идкости концентрация пирув атаз начительно пов ы ш ается послетрав м ы черепа, при в оспалительны х процессах - м енингите, абсцессе м оз га. Пов ы ш енное содерж ание пирув ата токсично для организ м а. Р абота 12. Б иологическое окислен ие. К оличествен н ое определен ие А Т Ф и креатин фосфата мы ш ц Роль кислорода в м етаболиз м е. О рганиз м челов ека ф ункционирует в аэробны х услов иях : 90% энергии он получает при участии кислорода. К ислород в ы полняет дв е в аж нейш ие ф ункции в м етаболиз м е в процессе ж из недеятельности: 1) яв ляется конечны м акцептором электронов и протонов при биологическом окислении (оксидаз ны й путьиспольз ов ания кислорода); 2) в ы полняет пластическую ф ункцию: кислород в страив ается в процессе м икросом ального окисления в гидроф обны е соединения, перев одя их в гидроф ильны е(оксигеназ ны й путьиспольз ов ания кислорода). И з в естно около 200 ф ерм ентов , использ ующ их м олекулярны й кислород в качеств е одного из субстратов . В се они делятся на дв а класса в 33 з ав исим ости от того, в ключается кислород или нетв другой субстратв х оде такой реакции: 1) оксидаз ы : кислород не в ключается в субстрат, а использ уется как акцептор электронов . Сущ еств ует дв а типа оксидаз , одни образ уют в качеств еодного из продуктов в оду, адругие— перекисьв одорода: SH2 + 1/2 O2 → S + H2O SH2 + O2 → S + H2O2 2) оксигеназ ы — кислород в ключается в субстрат. Сущ еств ует такж е дв атипаоксигеназ : а) м онооксигеназ ы (или гидроксилаз ы ) — в ключаюттолько один атом кислорода: SH2 + 1/2 O2 → H-S-OH б) диоксигеназ а— в ключаютдв акислородав субстрат: SH2 + O2 → HO-S-OH кислорода м огут Т оксичность кислорода. А ктив ны е ф орм ы образ ов ы в аться при переносе электронов от окисляем ы х субстратов на кислород или неф ерм ентатив но. К актив ны м ф орм ам кислорода относятся: супероксид-ион, гидроксильны й радикал, пероксид-ион, синглетны й кислород. Д анны ечастицы представ ляютсобой опасность для ж из ни клеток в следств ие пов реж дений, которы е они способны причинять в сем классам биом олекул, особенно белкам и липидам , в ы з ы в ая пероксидное окисление ненасы щ енны х ж ирны х кислот. В ж ив ой клетке происх одит детоксикация пероксида в одорода и супероксид-иона при участии природны х антиоксидантов (аскорбинов ой кислоты , в итам ина Е , глутатиона) и ф ерм ентов (супероксиддисм утаз ы , каталаз ы , глутатионпероксидаз ы ). М акроэргические м олекулы . А Т Ф . К м акроэргическим относятся соединения, при гидролиз е которы х в ы деляется энергия не м енее 7 ккал/м оль. Н аиболее распространенны м и м акроэргическим и соединениям и яв ляются нуклеоз идтриф осф аты , которы е м огут передав ать св ою концев ую в ы сокоэнергетическую ф осф атную группу любой из м ногочисленны х органических м олекул-акцепторов . В ы сокоэнергетические нуклеотиды в ы ступают в качеств е унив ерсального источника энергии для больш ого числа энергоз ав исим ы х реакций. Ц ентральную роль в энергетике клетки играетА Т Ф . А Д Ф м ож етбы ть реф осф орилиров ан в А Т Ф в рез ультатеды х ательной актив ности или з а счет другого в ы сокоэнергетического соединения, наприм ер, креатинф осф ата, присутств ующ его в м ы ш ечны х клетках . Е сли в есь А Д Ф м ы ш ечной ткани прев ращ ается в А Т Ф , то ф осф ат от А Т Ф переносится на креатин с образ ов анием креатинф осф ата. При этом в нов ь появ ляется некоторое количеств о А Д Ф , которы й м ож ет, присоединив ф осф ат, образ ов атьА Т Ф . При пониж ении уров ня А Т Ф происх одитобратны й процесс: ф осф ат переносится от креатинф осф ата на А Д Ф , и з апасы А Т Ф в осстанав лив аются. 34 Т аким образ ом , А Т Ф действ уеткак св яз ующ ее клеточное з в ено м еж ду ды х анием и процессам и, требующ им и з атраты энергии. При этом его в ы сокоэнергетические ф осф атны е группы непреры в но отщ епляются и з ам ещ аются нов ы м и. Д ругием акроэргическиесоединения. А ргининф осф ати креатинф осф ат в ы полняют рольсв оеобраз ны х аккум уляторов х им ической энергии, которы е использ уются для бы строго ф осф орилиров ания А Т Ф в о в рем я энергичного м ы ш ечного сокращ ения. И х наз ы в аютф осф агенам и. А цилф осф аты — м акроэргическиесоединения с ангидридной св яз ью, в которы х карбонильны й атом углерода ацильной группы особенно легко участв уетв реакции с нуклеоф илам и. Значение∆G = — 12,8 ккал/м оль. Н априм ер, глицерол-1,3-бисф осф ат+ Н О Н → глицерол-3-ф осф ат+ Н 3РО 4. Т иоэф иры играют очень в аж ную роль в м етаболиз м е в качеств е м етаболически актив ной ф орм ы ацильной группы . В природе основ ны м и тиолсодерж ащ им и соединениям и яв ляются: коф ерм ентА , липоев ая кислота, белки с – SН -группой: ацетил-К оА + Н О Н → ацетат+ HS-KoA; ∆G = — 7,37 ккал/м оль. К оличествен н ое определен ие макроэргических соедин ен ий мы ш ц (А Т Ф и креатин фосфата) В м ы ш ечной ткани содерж ится дв а м акроэргических соединения – А Т Ф и креатинф осф ат, которы е обеспечив ают по м ере надобности м ы ш цу больш им количеств ом энергии. К реатинф осф ат образ уется в м ы ш це при участии А Т Ф в состоянии покоя и служ ит рез ерв ом в ы сокоэнергетического ф осф атадля синтез аА Т Ф из А Д Ф при актив ной м ы ш ечной работе. Принцип м етода. М етод основ ан на том , что дв а последних остатка ф осф орной кислоты в А Т Ф , так ж е как и ф осф атны й остаток в креатинф осф ате, легко отщ епляются при непродолж ительном гидролиз е в кислой среде. Э то так наз ы в аем ы й лабильно св яз анны й ф осф ор. Срав нение содерж ания неорганического ф осф ора в пробах до гидролиз а и после дает представ ление о количеств е лабильно св яз анного ф осф ора, которое прих одится на долю м акроэргических соединений м ы ш ечной ткани. К оличеств о ф осф ораопределяютпо цв етной реакции с м олибдатом ам м ония в присутств ии аскорбинов ой кислоты . Реактив ы . 1. 10%-й раств ор трих лоруксусной кислоты (Т ХУ ). 2. 1 м оль/лHCl. 3. 1 м оль/лNaOH. 4. 2,5%-й раств ор м олибдатаам м ония. 5. 1%-й раств ор аскорбинов ой кислоты . 6. Э талонны й раств ор, содерж ащ ий 5 м м оль/лф осф ора. Ход работы 1. 0,5 г м ы ш ечной каш ицы пом ещ ают в пробирку, стоящ ую в ледяной бане, и добав ляют в нее 5 м л ох лаж денного 10%-го раств ора Т ХУ . Содерж им ое пробирки перем еш ив ают стеклянной палочкой для экстрагиров ания А Т Ф и креатинф осф ата в течение 5 м ин. Э кстракт 35 ф ильтруютв м ерную пробирку, стоящ ую в ледяной бане. О статок м ы ш ечной каш ицы в пробиркез алив ают5 м лH2O и продолж аютэкстракцию 5 м ин. на х олоде. Полученны й экстракт ф ильтруют в ту ж е м ерную пробирку и дов одятобщ ий объ ем до 10 м лдистиллиров анной в одой. 2. В дв епробирки отбираютпо 0,5 м лбез белков ого ф ильтрата. Перв ая пробирка — контрольная, в торая — опы тная. В опы тную пробирку добав ляют 1 м л1 м оль/лHCl, з акры в ают ф ольгой, пом ещ ают в кипящ ую в одяную баню на 10 м ин. для гидролиз а ф осф орны х св яз ей. Затем раств ор ох лаж дают и добав ляют 1 м л1 м оль/лNaOH. В контрольную пробирку (без предв арительного кипячения) добав ляют 1 м л1 м оль/лHCl и 1 м л1 м оль/л NaOH. В опы тную и контрольную пробирки добав ляютиз бюретки по 7,5 м л H2O до получения объ ем а10 м л. 3. И з обеих пробирок отбирают по 5 м лж идкости, переносят в дв е другиепробирки и добав ляютв каж дую из них по 0,5 м л2,5%-го м олибдата ам м ония, 0,5 м л 1%-го раств ора аскорбинов ой кислоты и по 2 м л H2O. Перем еш ив аюти остав ляютстоятьпри ком натной тем пературе10 м ин. 4. К онтрольную и опы тную пробы ф отоколорим етрируют с красны м св етоф ильтром (длина в олны 670 нм ) против в оды . В опы тной пробе (после гидролиз а) определяем ы й неорганический ф осф ор представ ляетсобой сум м у лабильно св яз анного ф осф ораи ф осф атны х солей, присутств ующ их в тканях . В контрольной пробе— только ф осф атны есоли. 5. В ы читаютиз оптической плотности, найденной для опы тной пробы , оптическую плотность, полученную для контрольной пробы . К онцентрацию лабильно св яз анного неорганического ф осф ора в пробе нах одят по калибров очном у граф ику. Расчет. Рассчиты в ают количеств о лабильно св яз анного ф осф ора в м г на100 г сы рой ткани, учиты в ая раз в едениепо ф орм уле: х = А 3,3400 100; где х — содерж ание м акроэргических соединений в пересчете на 1 м г А Т Ф в 100 г сы рой ткани (м г/100 г); А — содерж ание А Т Ф в пробе, м г; 3,3400 — коэф ф ициент пересчета на 1 г ткани с учетом раз в едения раств оров . Построениекалибров очного граф ика. И з эталонного раств ора ф осф ора приготав лив ают калибров очны е раств оры согласно таблице9. Т аблица9. Приготов лениекалибров очны х раств оров ф осф ора Н ом ера Реактив ы , м л Содерж аниеф осф ора пробирок м м оль/л Э талонны й раств ор Н 2О 1 1 4 1 2 2 3 2 3 3 2 3 4 4 1 4 5 5 0 5 36 В каж дую пробирку добав ляютпо 0,5 м л2,5%-го м олибдата ам м ония, 0,5 м л 1%-го раств ора аскорбинов ой кислоты и по 2 м л H2O. Бы стро перем еш ив аюти остав ляютстоятьпри ком натной тем пературеточно 10 м ин. К алибров очны е раств оры колорим етрируют на Ф Э К е с красны м св етоф ильтром (длина в олны 670 нм ) против в оды . По рез ультатам из м ерений строят граф ик з ав исим ости оптической плотности раств оров от концентрации ф осф ора. Задачи по теме «М етаболизм» В ариан т № 1 1. У каж ите реакцию цикла К ребса, в которой происх одит в осстанов ление Ф А Д . К аков в ы х од А Т Ф при окислении 1 м олекулы Ф А Д Н 2 через ды х ательную цепь? 2. В цикле лим онной кислоты для расщ епления ацетил-К оА использ уется в осем ь ф ерм ентов . У каж ите для каж дого из них тип катализ ируем ой реакции: конденсация (образ ов аниеуглерод-углеродной св яз и); дегидратация (отщ еплениев оды ); гидратация (присоединениев оды ); декарбоксилиров ание(отщ еплениеСО 2); окисление-в осстанов ление; ф осф орилиров аниенауров несубстрата; из ом ериз ация. К акой коф актор или коф акторы необх одим ы для каж дой из этих реакций? 3. Препарат ф торцитрата прим еняется как средств о борьбы с гры з унам и. Проникнув в клетку, он прев ращ ается в о ф торацетил-К оА . Д ля из учения токсического действ ия ф торацетата бы лпров еден эксперим ент на интактном из олиров анном сердце кры сы . После перф уз ии сердца 0,22 м м оль/л ф торацетатом ум еньш алось поглощ ение глюкоз ы и сниж алась скорость гликолиз а, а глюкоз о-6-ф осф ат и ф руктоз о-6-ф осф ат накаплив ались. К онцентрации в сех пром еж уточны х продуктов цикла лим онной кислоты бы ли при этом ниж е норм ы , и только концентрация цитрата прев ы ш ала норм у в 10 раз . В какой точке блокируется цикл лим онной кислоты ? Почем у цитрат накаплив ается, а з апас других пром еж уточны х продуктов цикла истощ ается? Ф торацетил-К оА подв ергается ф ерм ентатив ны м прев ращ ениям в цикле лим онной кислоты . К аков а структура конечного продукта обм ена ф торацетата? Почем у он блокирует цикллим онной кислоты ? К ак м ож но снять это ингибиров ание? Почем у после перф уз ии сердца ф торацетатом ум еньш ается поглощ ение глюкоз ы и сниж ается скорость гликолиз а? В чем причина накопления м оноф осф атов ? Почем у отрав лениеф торцитратом см ертельно? 37 В ариан т № 2 1. У каж ите реакции гликолиз а и цикла К ребса, в которы х происх одит в осстанов ление Н А Д +. К аков в ы х од А Т Ф при окислении 1 в осстанов ленной м олекулы Н А Д Н через ды х ательную цепь? 2. В структурном и х им ическом отнош ении арсенатсх оден с ф осф атом , поэтом у м ногие ф ерм енты , нуж дающ иеся в ф осф ате, использ уют и арсенат. О днако органические произ в одны е м ы ш ьяков ой кислоты м енее стабильны , чем соотв етств ующ ие произ в одны е ф осф орной кислоты . Н априм ер, ациларсенаты легко раз лагаются без участия катализ аторов . К аков ы последств ия з ам ены ф осф ата арсенатом ? Д ля больш инств а организ м ов арсенаттоксичен. Чем это объ ясняется? 3. Е сли в суспенз ию анаэробны х клеток, потребляющ их глюкоз у с больш ой скоростью, в нести кислород, то клетки начнут его поглощ ать и уров ень потребления глюкоз ы рез ко пониз иться. О днов рем енно с этим прекратится накопление лактата. Э тот эф ф ект, х арактерны й для клеток, способны х и к аэробном у, и к анаэробном у потреблению глюкоз ы , в перв ы е наблюдал Луи Пастер в 60-гг. XIX в ., поэтом у он бы л наз в ан эф ф ектом Пастера. Почем у при в в едении в клеточную суспенз ию кислорода прекращ ается накопление лактата? Почем у в присутств ии кислорода сниж ается скоростьпотребления глюкоз ы ? В ариан т № 3 1. Сколько м олекул А Т Ф образ уется при полном распаде одной м олекулы глюкоз ы ? Зав иситли в ы х од А Т Ф в электронтранспортной цепи от использ ов ания раз личны х челночны х м ех аниз м ов переносаН А Д Н ? 2. При напряж енной работе м ы ш ечная ткань потребляет гораз до больш еА Т Ф , чем в состоянии покоя. В белы х скелетны х м ы ш цах , наприм ер в м ы ш цах ног у кролика или м ы ш цах кры ла индейки, почти в есь этот А Т Ф образ уется в процессе анаэробного гликолиз а. Представ им себе, что в скелетной м ы ш цеотсутств уетлактатдегидрогеназ а. М оглабы м ы ш цав этом случае напряж енно работать, то есть с больш ой скоростью генериров ать А Т Ф путем гликолиз а? 3. Гликогенф осф орилаз аиз скелетны х м ы ш ц х арактериз уется гораз до более в ы сокой в еличиной К м , чем тот ж е ф ерм ент из ткани печени. К акую ф из иологическую ф ункцию в ы полняетгликогенф осф орилаз ав скелетны х м ы ш ах и в ткани печени? Почем у в еличинаК м для м ы ш ечного ф ерм ента долж набы тьбольш е, чем для ф ерм ентаиз печени? 4. В ариан т № 4 1. Сколько м олекул А Т Ф образ уется при полном распаде 1 м олекулы пирув ата? Зав иситли в ы х од А Т Ф в электронтранспортной цепи от использ ов ания раз личны х челночны х м ех аниз м ов переносаН А Д Н ? 2. В начале 30-х годов А льберт Сент-Д ьердьи сообщ ил об интересном наблюдении. О н добав лялк ды ш ащ им суспенз иям из м ельченной 38 грудной м ы ш цы голубя оксалоацетат или м алат и обнаруж ил, что потребление кислорода при этом усилив ается. О бъ ясните, почем у это происх одит? 3. 2,4-динитроф енол – раз общ итель ды х ания и окислительного ф осф орилиров ания – пы тались одно в рем я использ ов ать как средств о для борьбы с ож ирением . Н ачем в принципем ож етбы тьоснов ано подобноеего действ ие? Т акого рода раз общ ающ ие агенты не прим еняются в качеств е лекарств енны х средств , поскольку из в естны случаи, когда их прим енение прив одило к летальном у исх оду. Почем у прием раз общ ающ их агентов м ож ет в ы з в атьсм ерть? В ариан т № 5. 1. В о в нутренней м итох ондриальной м ем бране им еется дикарбоксилатная транспортная систем а, которая обеспечив аетперенос через м ем брану м алатаи 2-оксоглутарата. Э татранспортная систем аингибируется n-бутилм алонатом . Предполож им , что n-бутилм алонатдобав лен к суспенз ии аэробны х почечны х клеток, использ ующ их в качеств е топлив а одну только глюкоз у. К ак долж ен подейств ов ать n-бутилм алонат на а) гликолиз ; б) потреблениекислорода; в ) образ ов аниелактата; в ) синтез А Т Ф ? 2. Срав ните сум м арны е в ы х оды А Т Ф (число м олей А Т Ф , образ ов ав ш их ся на1 м оль субстрата) при полном окислении (до СО 2 и Н 2О ) лактата и аланина, учтя в этом расчете расх од А Т Ф на в ы в едение аз ота в ф орм ем очев ины (реакция, катализ ируем ая лактатдегидрогеназ ой, обратим а). 3. В оз м ож ен ли реальны й синтез глюкоз ы из пирув ата в услов иях , когда цикл трикарбонов ы х кислот и окислительное ф осф орилиров ание полностью ингибиров аны ? В ариан т № 6. 1. Ротенон (токсин из растения) ингибируетм итох ондриальную Н А Д Н дегидрогеназ у. А нтим ицин А (токсичны й антибиотик) ингибируетокисление убих инона. Почем у ротенон оказ ы в ается см ертельны м ядом для некоторы х насеком ы х и ры б? Почем у антим ицин А действ ует как яд в ж ив отны х тканях ? 3. Д опустим , что эти в ещ еств аблокируютсоотв етств ующ иеучастки ды х ательной цепи с рав ной эф ф ектив ностью. К акое из них будет более сильны м ядом ? Почем у? 2. К ош кам , не получав ш им пищ и накануне в ечером , дали утром натощ ак ам инокислотную см есь, содерж ащ ую в есь набор ам инокислот, з а исключением аргинина. Через 2 часасодерж аниеам м иакав кров и ж ив отны х в оз росло до 140 м кг/л (при норм е 18 м кг/л) и появ ились клинические сим птом ы ам м иачного отрав ления. О дна кош ка погибла через 4,5 часа. В группе, получав ш ей см есь, в которой аргинин бы л з ам енен орнитином , никаких необы чны х сим птом ов обнаруж ено не бы ло. К акую роль играло в этом эксперим енте предв арительное голодание? В чем причина пов ы ш ения уров ня ам м иака в кров и? Почем у отсутств ие аргинина в рационе прив одило к ам м иачном у отрав лению? Я в ляется ли аргинин для кош ек нез ам еним ой ам инокислотой? Почем у аргинин м ож етбы тьз ам енен орнитином ? 39 3. Н апиш ите ряд последов ательны х реакций и сум м арную реакцию, которы е поз в олят определить число м олекул А Т Ф , расх одуем ы х на прев ращ ение цитоплаз м атического глюкоз о-6-ф осф ата в гликоген и гликогена обратно в глюкоз о-6-ф осф ат. К акую часть это число состав ит от м аксим ального числа м олекул А Т Ф , образ ующ егося при полном расщ еплении глюкоз о-6-ф осф ата? Р абота 13. М ин еральн ы й обмен в орган изме человека. О пределен ие кон цен трации кальция и хлоридов в сы воротке крови М инеральны й обм ен — сов окупность процессов в сасы в ания, распределения, усв оения и в ы деления м инеральны х в ещ еств , нах одящ их ся в организ м е преим ущ еств енно в в иде неорганических соединений. М инеральны е в ещ еств а играют в аж ную роль в поддерж ании кислотнооснов ного рав нов есия, осм отического дав ления, систем есв ерты в ания кров и, регуляции м ногочисленны х ф ерм ентны х систем и др., т.е. им еютреш ающ ее з начение в соз дании и поддерж ании постоянств а в нутренней среды организ м а. По количеств енном у содерж анию в организ м е элем енты делятся на м акро- (калий, кальций, натрий, м агний, ф осф ор, х лор) и м икроэлем енты (цинк, х ром , м едь, ж елез о, кобальт). О снов ную часть м инеральны х в ещ еств организ м а состав ляют х лористы е, ф осф орнокислы е и углекислы е соли натрия, кальция, калия, м агния. Соли в ж идкостях организ м а челов ека нах одятся в частично или полностью диссоцииров анном в иде. В состав м инерального ком понента кости и х рящ ев ой ткани м инеральны ев ещ еств ав х одятв в иденераств орим ы х соединений. В кости и х рящ ев ой ткани (сум м арно) содерж ится более 95% в сего кальция, 87% ф осф ора, 50% м агния. М инеральны е в ещ еств а присутств уют в организ м е такж е в в иде соединений с белкам и, нуклеинов ы м и кислотам и и др. М инеральны ев ещ еств аиз ж елудочно-киш ечного трактав сасы в аются в кров ь и лим ф у, где св яз ы в аются со специф ическим и транспортны м и белкам и. Н екоторы е м инеральны е в ещ еств а соединяются с таким и белкам и уж е в эпителии слиз истой оболочки киш ечника (кальций). О снов ное количеств о в ы в одим ы х из организ м а м инеральны х в ещ еств обнаруж ив аютв м оче, кале, поте. Через почки в ы в одятся ионы натрия, калия, х лора, йода, кальция (30%) и м агния (30%); через киш ечник — ионы кальция (70%), ж елез а, м агния (70%) и др. Н атрий — основ ной в неклеточны й катион. У челов ека до 55% натрия нах одится в костях , до 43% — в о в неклеточной ж идкости, около 2% — в клетках . К онцентрация ионов натрия в плаз м есостав ляет135-150 м м оль/л; в эритроцитах — 16-36 м м оль/л. Падениеконцентрации ионов натрия в плаз м е кров и ниж е135 м м оль/лгипонатриплаз м ия (в сы в оротке— гипонатрием ия), пов ы ш ение более 150 м м оль/л — гипернатриплаз м ия (в сы в оротке — гипернатрием ия). 40 В течение суток с пищ ев ы м и продуктам и в организ м поступает 4-6 г натрия, суточная потребность состав ляет 1 г. Ф из иологическая роль: 1) участв ует в в оз никнов ении и поддерж ании электрох им ического потенциала на плаз м атических м ем бранах клеток; 2) регулирует состояние в односолев ого обм ена; 3) регулирует кислотно-основ ное состояние: натрий обм енив ается на ионы в одорода. При недостатке ионов натрия в организ м е в ы в едение кислы х продуктов из организ м а наруш ается и в оз никает в оз м ож ностьраз в ития ацидоз а. О снов ной путь в ы деления натрия — почечны й: с м очой з а сутки в ы деляется 160 - 260 м м оль, с потом - 0,8, с калом - 7 - 8 м м оль. К алий — в нутриклеточны й катион (98%). Глав ны й рез ерв уар калия — м ы ш цы и печень. Содерж ание K+ в плаз м е кров и — от 3,8 до 5,1 м м оль/л, сниж ение концентрации K+ в плаз м е кров и ниж е 3,8 — гипокалиплаз м ия, пов ы ш ение в ы ш е 5,1 м м оль/л — гиперкалиплаз м ия. В течение суток поступает с пищ ей до 6 г K+. Суточная потребность — 2,5 - 5,0 г. Ф из иологическое з начение: необх одим для синтез а протеинов (на 1 г синтез иров анного протеинатребуется 20 м г K+), А Т Ф , гликогена; приним ает участие в ф орм иров ании потенциала покоя, действ ия, в ы з ы в ает конф орм ационны е перестройки протеинов , способств уя актив ации ф ерм ентов . И оны калия участв уют в регуляции ф ункции сердца, нерв ной систем ы , скелетной и гладкой м ускулатуры . И оны калия пов ы ш ают тонус и силу сокращ ений скелетны х и гладких м ы ш ц. В в ы соких концентрациях угнетают нерв но-м ы ш ечную пров одим ость. Препараты калия обладают диуретическим действ ием . В регуляции обм ена ионов калия приним ает участие альдостерон, усилив ающ ий их в ы деление с м очой, инсулин способств уетперех оду K+ в клетки. Содерж аниев организ м ев з рослого м агния состав ляет20 г. Содерж ится в костях (50%), м ягких тканях , м ы ш цах (49%) и в о в неклеточной ж идкости (1%). В торой по з начим ости послеK+ в нутриклеточны й катион, в плаз м еего концентрация колеблется от0,8 до 1,5 м м оль/л. О браз уетком плексы с А Т Ф , цитратом , протеинам и. Среднесуточное поступление с пищ ей состав ляет 300-400 м г. Д о 30% в ы деляется с м очой. В х одит в состав почти 300 ф ерм ентны х ком плексов , образ ует х елаты с нуклеинов ы м и кислотам и, способств ует синтез у протеинов , ком плексы м агния с ф осф олипидам и в клеточны х м ем бранах ф иксируют их , сним ают текучесть, ум еньш ая их проницаем ость. Глав ны м органом регуляции концентрации м агния яв ляются почки. М едь в х одит в состав м ногих ф ерм ентов и биологически актив ны х м еталлопротеинов . В кров и содерж ание м еди - 15,7-16 м км оль/л(98% в сей м еди нах одится в состав е церулоплаз м ина). При деф иците м еди в пищ е у челов ека наруш аются антиоксидантная з ащ ита, окислительнов осстанов ительны е процессы , пигм ентны й обм ен, обм ен ж елез а(сниж аются его в сасы в ание и утилиз ация), ф осф олипидов (происх одит дем иелиниз ация нерв ны х ств олов ), актив ность остеобластов , образ ов ание эластичной ткани 41 кров еносны х сосудов , так как м едь необх одим а для синтез а коллагена и эластина. М арганец актив ирует м ногие ф ерм ентатив ны е систем ы , он необх одим для биосинтез а антител, для эритропоэз а и образ ов ания гем оглобина. Стим улирует синтез х олестерина и ж ирны х кислот, прояв ляя липотропное действ ие. Ц инк в качеств е простетической группы в х одитв состав м олекулряда ф ерм ентов , он обнаруж ен в инсулине. О бладает липотропны м действ ием , норм ализ ует ж иров ой обм ен, предотв ращ ает ж иров ую инф ильтрацию печени. Н аибольш ееколичеств о цинкасодерж ится в печени, подж елудочной ж елез е, полов ы х ж елез ах . Хлор. Д о 65% в сего х лора нах одится в о в неклеточной ж идкости, глав ны м анионом которой яв ляется Сl-. Д о 17% св яз ано соединительной тканью и х рящ ам и; 12,4% нах одится в нутри клеток. О бм ен х лора тесно св яз ан с обм еном натрия, но в канальцах почек они м огут в ы деляться и реабсорбиров аться нез ав исим о друг отдруга. Ф осф аты . В цельной кров и больш ая часть ф осф ора нах одится в эритроцитах в в иде органического ф осф ата, в плаз м е кров и присутств уют липидны й ф осф ор, следы эф иров ф осф орной кислоты и неорганический ф осф ат. 50% общ его ф осф оранах одится в костях , до 20% - в о в неклеточной ж идкости. Ф осф аты играют в аж ную роль в обм енны х процессах : в х одят в состав коф ерм ентов , нуклеинов ы х кислот, ф осф опротеинов , ф осф олипидов . И з них образ уются: 2,3-бисф осф оглицерат, играющ ий в аж ную роль в регуляции транспорта кислорода, ф осф аты — обяз ательны й ком понент клеточны х м ем бран, состав ная часть А Т Ф , креатинф осф ата, в ы полняющ их в аж ную роль в переносе и сох ранении энергии. В м есте с кальцием ф осф аты образ уют апатиты — основ у костной ткани. Регуляция обм ена ф осф ора аналогичнаобм ену кальция с тем раз личием , что паратгорм он, пов ы ш ающ ий содерж аниекальция в плаз м екров и, сниж аетсодерж аниеф осф атов , пов ы ш ая их экскрецию почкам и. К альций. В организ м есодерж ится 1-1,5 кг кальция. В неклеточны й ион. Содерж ание в плаз м е - 2,29 - 2,99 м м оль/л, в эритроцитах - следы . 90% нах одится в костях , 1% - в о в неклеточной ж идкости. М еньш е полов ины кальция в плаз м е кров и нах одится в иониз иров анном в иде и яв ляется ф из иологически актив ны м , больш ая часть — св яз ана с белкам и или представ ленасолям и: ф осф атом , цитратом , сульф атом кальция. Н аибольш ей кальцийсв яз ы в ающ ей способностью обладаютальбум ины и β-глобулины . И оны кальция, участв уя в о м ногих процессах ж из недеятельности, работают на уров не клетки и на уров не в неклеточны х систем . Е го биологическая роль: - необх одим для секреторной актив ности практически в сех эндо- и экз окринны х ж елез исты х клеток; - участв уетв св ерты в ании кров и; 42 - яв ляется в торичны м посредником при м ем бранной передаче сигнала, актив ируя 40 ф ерм ентов ; - в ы полняет опорную ф ункцию, яв ляясь основ ны м ком понентом костного скелета; - обеспечив ает целостность м ем бран (в лияет на проницаем ость), так как способств ует плотной упаков ке белков , стабилиз ируя клеточны е м ем браны ; - участв ует в нерв но-м ы ш ечном в оз буж дении и сокращ ении. К альций приним ает участие в соз дании потенциала покоя (70 - 90 м В ), ум еньш ая скорость проникнов ения полож ительно з аряж енны х ионов в клетку; - стим улирует в ы работку гастрина, обуслов лив ая в ы работку пищ ев арительны х соков ; - в м есте с инсулином облегчает поступление глюкоз ы в клетки. М ногообраз ны е ф ункции ионов кальция на пов ерх ности и в нутри клетки обуслов лены его способностью соединяться с нем ем бранны м и ком плексам и — А Т Ф , ф осф атам и, белкам и. О снов ны е биологические процессы : раз м нож ение, пролиф ерация, гибельклетки, — осущ еств ляются при участии кальция. Содерж ание ионов кальция в плаз м е кров и определяют следующ ие ф акторы . 1. Состояниекостной ткани — в сеф акторы , ускоряющ иерассасы в ание костей, ув еличив ают содерж ание кальция и ф осф атов в кров и з а счет дем инерализ ации скелета (рез орбции, м обилиз ации из кости). В се ф акторы , способств ующ ие образ ов анию костной ткани, ум еньш ают его з а счет м инерализ ации. 2. В итам ин D3 и его аналоги способств уют в сасы в анию кальция и ф осф атов в киш ечникеи препятств уютих в ы в едению с м очой. 3. Паратгорм он стим улирует м обилиз ацию кальция и ф осф атов из костей, на уров не почек усилив ает реабсорбцию кальция и ум еньш ает реабсорбцию ф осф атов , пов ы ш аетсодерж аниеионов кальция в плаз м е. 4. К альцитонин способств ует м инерализ ации костей, ув еличив ает экскрецию ф осф атов с м очой, сниж аетсодерж аниеионов кальция в плаз м е. 5. А цидоз прив одит к рассасы в анию костей (содерж ание кальция в оз растает), а алкалоз — к их м инерализ ации (ум еньш ается концентрация ионов кальция в плаз м е). Регуляцию обм енов ф осф ора и кальция осущ еств ляют паращ итов идны е, щ итов идны е ж елез ы через секретируем ы е им и горм оны : кальцитонин, паратгорм он, атакж ев итам ин D3 и кальцитриол. Паратгорм он. Горм он-полипептид, состоящ ий из 84 ам инокислотны х остатков . Секретируется клеткам и паращ итов идной ж елез ы в отв ет на ум еньш ение концентрации ионов кальция в кров и. О снов ны м и клеткам им иш еням и для паратгорм она яв ляются клетки костей, почек, тонкой киш ки (действ ует опосредов анно через усиление биосинтез а кальцитриола). Паратгорм он действ уетнаклетки-м иш ени через ц-А М Ф и протеинкиназ ы . 43 Паратгорм он стим улирует рез орбцию костной ткани с осв обож дением кальция з а счет актив ации ф ерм ентов остеокластов , раз руш ающ их пром еж уточное в ещ еств о кости. В почках , в клетках дистальны х канальцев , паратгорм он стим улирует реабсорбцию ионов кальция из перв ичной м очи, но ингибируетреабсорбцию ф осф атов , и они в ы в одятся из организ м а. Т аким образ ом паратгорм он ув еличив ает концентрацию кальция (это актив ирует секрецию кальцитонина) и ум еньш аетуров еньф осф атов в кров и. К альцитриол. Хим ическая природа произ в одное циклопентанпергидро-ф енантрена. К леткам и-м иш еням и яв ляются клетки почек, костей, киш ечника. В ы рабаты в ается при ум еньш ении концентрации кальция в кров и и усилении секреции паратгорм она. Е го предш еств енником яв ляется в итам ин D3, которы й гидроксилируется в печени (ф ерм ент 25гидроксилаз а), з атем в почках (l-гидроксилаз а). С м естасинтез а(в почках ) он транспортируется кров ью в киш ечник, где в клетках слиз истой стим улирует синтез кальций-св яз ы в ающ его белка, которы й располагается напов ерх ности клеток слиз исты х и, благодаря св оей в ы сокой способности св яз ы в ать кальций, облегчает его в сасы в ание. И з клетки кальций попадает в кров оток пoсредств ом Са2+/Na+-А Т Ф -аз ы . Н а костную ткань кальцитриол действ ует аналогично паратгом ону: актив ируя ф ерм ентную систем у остеокластов , в ы з ы в ает дем инерализ ацию кости и ув еличив ает концентрацию кальция и ф осф атов в кров и. В клетках почек он усилив аетреабсорбцию кальция и ф осф атов . Рез ультатом действ ия кальцитриола яв ляется: ув еличение концентрации кальция и ф осф атов в кров и, ингибиров аниесекреции паратгорм она. К альцитонин - антагонистпаратгорм онаи кальпептид, состоящ ий из 32 остатков ам инокислот. В ы рабаты в ается С-клеткам и щ итов идной и паращ итов идной ж елез . Синтез ируется сраз у в актив ной ф орм е. К оличеств о кальцитонина в кров отоке регулируется концентрацией ионов кальция в кроyв еличениe стим улирует в ы брос кальцитонина в кров ь, а ум еньш ение подав ляет. К ром екальция, секрецию кальцитонинастим улируютадреналин, глюкагон, гастрин. О рганам и, содерж ащ им и клетки-м иш ени, яв ляются кости, почки, печень. М ех аниз м действ ия кальцитонина м ем браннов нутриклеточны й: актив ирует ф осф одиэстераз у, ум еньш ает содерж ание цАМ Ф . Д ейств уя на костную ткань, кальцитонин ингибирует ф ерм енты остеокластов , что способств ует сниж ению концентрации кальция в кров и. В клетках почечны х канальцев кальцитонин в ы з ы в ает пов ы ш енное в ы в едение кальция и ф осф атов с м очой. Т аким образ ом кальцитонин в ы з ы в ает ум еньш ение концентрации кальция и ф осф атов в кров и. Сов м естное действ ие паратгорм она, в итам ина D, кальцитонина и кальцитриола поддерж ив аетсодерж аниекальция и ф осф орав кров и напостоянном уров не. 44 О пределен ие кальция в сы воротке крови Принцип м етода. К альций образ ует с глиоксаль-бис-(2-оксианилом ) в щ елочной среде ком плекс красного цв ета. И нтенсив ность окраски из м еряется ф отом етрически при длинев олны 520-550 нм . Реактив ы . 1. Стандартны й раств ор CaCO3 2,5 м м оль/л. 2. Раств ор NaOH 0,4 м оль/л. 3. Раств ор глиоксаль-бис-(2-оксианила) 2,4 м м оль/л в м етаноле. Ход работы . См еш ать в пробирках реактив ы и сы в оротку кров и согласно таблице10. Прим ечание: лабораторная посудадолж наслуж итьисключительно для определения кальция и бы тьабсолютно чистой. Т аблица10. Ход определения кальция Реактив ы О пы тная К алибров очная К онтрольная проба, м л проба, м л проба, м л В одадистиллиров анная 1,00 1,00 1,00 Сы в ороткакров и 0,02 Раств ор 1 0,02 (стандартны й раств ор) Раств ор 2 (NaOH) 0,50 0,50 0,50 Перем еш ив аюти инкубируют10 м инут Раств ор 3 2,00 2,00 2,00 (раств ор глиоксаль-бис2-оксианила) Пробы тщ ательно перем еш ать и инкубиров ать в течение 5 м инут. Н е поз ж е чем через 10 м инут после окончания инкубации из м ерить в еличину оптической плотности опы тной и калибров очной проб против контрольной пробы при длинев олны 520-550 нм . Расчет. Расчет концентрации кальция в анализ ируем ы х пробах пров ести по ф орм уле: С= Е Е опы т ⋅ 2,5 станд гдеС - концентрация кальция, м м оль/л; Е опы т – оптическая плотностьопы тной пробы ; Е станд – оптическая плотностькалибров очной пробы ; 2,5 – концентрация кальция в стандартном раств оре, м м оль/л Д иагностическое з начение теста. К альций – основ ной ком понент костной ткани. О коло 40% кальция сы в оротки кров и св яз ано с белкам и, св ы ш е 50% нах одится в иониз иров анном (ф из иологически актив ном состоянии). В норм ев сы в ороткесодерж ится 2,25 - 2,75 м м оль/лкальция. Гиперкальцием ия наблюдается при гиперв итам иноз е Д , пов ы ш енной ф ункции паращ итов идны х ж елез , острой атроф ии костной ткани, м иелом ной 45 болез ни, некоторы х эндокринны х патологиях , сердечной недостаточности. У больны х бронх опнев м онией ув еличение концентрации кальция в кров и соотв етств ует тяж ести з аболев ания. Ф из иологическая гиперкальцием ия м ож етнаблюдаться при определенной диетеи у нов орож денны х детей. Гипокальцием ия наблюдается при недостаточности в итам ина Д , сниж енной ф ункции паращ итов идны х ж елез , при х ронических з аболев аниях почек, гипонатрием ии, остром панкреатите, цирроз е печени, алкоголиз м е, старческом остеопороз е. О пределен ие кон цен трации хлоридов в сы воротке и плазме крови титриметрическим методом Принцип м етода. И сследуем ая биологическая ж идкость титруется раств ором аз отнокислой ртути в присутств ии индикаторадиф енилкарбаз она. К огда в се х лорид-ионы св яз аны , из бы ток ионов х лора образ ует с индикатором ком плекс сине-лилов ого цв ета, что служ ит приз наком конца титров ания. Реактив ы . 1. Раств ор нитратартути. 2. 1 Н раств ор аз отной кислоты . 3. Раств ор диф енилкарбаз онав 96% этилов ом спирте. Ход работы . В м аленький стаканчик налить1,8 м лдистиллиров анной в оды , в нести 0,2 м лисследуем ой биологической ж идкости, добав ить0,1 м л раств орадиф енилкарбаз онаи 1 каплю аз отной кислоты и титров атьрабочим раств ором при постоянном перем еш ив ании до появ ления окраски. Расчет. [Хлориды ], м м оль/л= К х а, где К =93,3 (коэф ф ициент пересчета, полученны й при титров ании калибров очны х раств оров с из в естной концентрацией х лоридов ); а - количеств о м иллилитров раств ора нитрата ртути, уш едш ее на титров аниеисследуем ой биологической ж идкости. Н орм альны ев еличины . 95-100 м м оль/лх лоридов в сы в ороткеи плаз м е кров и. Д иагностическое з начение теста. Пов ы ш енное содерж ание х лоридов в кров и м ож ет наблюдаться при обез в ож ив ании организ м а, острой почечной недостаточности, несах арном диабете, некоторы х эндокринны х з аболев аниях . Пониж ение показ ателя м ож ет бы ть при потере солей в следств ие из бы точного потоотделения, рв оты и т.д.; ув еличении объ ем а в неклеточной ж идкости при в одной нагруз ке; и некоторы х других состояниях . Р абота 14. А зотисты й обмен . О пределен ие кон цен трации мочевин ы в сы воротке крови О бм ен ам м иака в организ м е. В рез ультате обм ена белков в организ м е в о в сех тканях постоянно образ уется ам м иак. И сточники ам м иака в организ м е: реакции окисления и дез ам иниров ания ам инокислот; распад пуринов ы х и пирим идинов ы х нуклеотидов ; распад биогенны х ам инов . 46 А м м иак яв ляется токсичны м в ещ еств ом для организ м а, особенно для центральной нерв ной систем ы . О снов ной путь обез в реж ив ания ам м иака в организ м е– биосинтез м очев ины в печени (орнитинов ы й цикл). Ц икл м очев ины . В печень ам м иак достав ляется из тканей в в иде глутам ина; из м ы ш ц и киш ечника – в состав е аланина. Глутам ин расщ епляется глутам иназ ой на ам м иак и глутам инов ую кислоту. Биосинтез м очев ины осущ еств ляется в 5 этапов : перв ы й и в торой прох одят в м итох ондриях печени, третий, четв ерты й и пяты й – в цитоз оле печени. Ф ерм енты биосинтез а м очев ины : карбам оилф осф атсинтетаз а 1; орнитинкарбам оилтрансф ераз а; аргининосукцинат-синтетаз а; аргининосукцинатлиаз а; аргиназ а. Биологическое з начение орнитинов ого цикла: 1) обез в реж ив ание ам м иака; 2) регуляция аз отистого баланса в организ м е – при поступлении в организ м больш ого количеств абелкаскоростьциклав оз растает; 3) постав ка ф ум арата в цикл трикарбонов ы х кислот, оксалоацетата для биосинтез а глюкоз ы и ам инокислот. И сточники аз ота, углерода и кислорода в м очев ине. Перв ая ам иногруппа – из ам м иака, образ ов ав ш егося при окислительном дез ам иниров ании глутам ата. В торая ам иногруппа постав ляется аспартатом , образ ов ав ш ем ся при трансам иниров ании оксалоацетата с ам инокислотам и. У глерод – из СО 2, образ ов ав ш егося в м итох ондриях при ды х ании. К ислород – из м олекулы в оды . Д иагностическое з начение определения ам м иака. В норм е в кров и содерж ится м енее 65 м км оль/л ам м иака. Гиперам м онием ия – пов ы ш ение концентрации ам м иака в кров и – наблюдается при 1) в рож денной недостаточности х отя бы одного их пяти ф ерм ентов биосинтез ам очев ины ; 2) печеночной недостаточности; 3) из бы точном потреблении белков ; 4) киш ечны х кров отечениях . С м очой в сутки в ы деляется 0,5 г ам м иака. К оличеств о ам м иакав м оче пов ы ш ается при респираторном и м етаболическом ацидоз е, гиперф ункции коры надпочечников , лих орадочны х состояниях , бактериальном раз лож ении м очи и некоторы х других з аболев аниях . О статочны й аз откров и – это аз отнебелков ы х ком понентов сы в оротки кров и. Глав ны м образ ом это аз от м очев ины – 85%, креатинина, м очев ой кислоты , индикана, ам инокислот, солей ам м ония – 15%. Т ак как преобладает аз от м очев ины , при из учении аз отистого обм ена определяют количеств о м очев ины в кров и. О пределен ие мочевин ы Принцип м етода: м очев инаобраз уетс диацетилм онооксим ом в сильно кислой среде в присутств ии тиосем икарбаз ида и ионов трех в алентного ж елез акрасны й ком плекс. Реактив ы . 1. Стандартны й раств ор м очев ины 16,65 м м оль/л. 2. Раств ор, содерж ащ ий диацетилм онооксим 5 м м оль/л, тиосем икарбаз ид 0,9 м м оль/л, сольж елез атрех в алентного 25 м км оль/л, серную кислоту 0,9 м оль/л. 47 Ход работы . В трех тонкостенны х пробирках см еш ив ают реактив ы согласно таблице11. Т аблица11. Ход определения м очев ины с тиосем икарбаз идом Реактив ы (м л) Проба Стандарт К онтроль Сы в оротка, раз в еденная м оча 0,01 Реактив 1 0,01 Д ист. в ода 0,01 Раств ор 2 2,00 2,00 2,00 О тв ерстие пробирок з акры в ают алюм иниев ой ф ольгой и пробирку пом ещ ают точно на 10 м ин. на кипящ ую в одяную баню. Потом содерж им ое пробирок бы стро ох лаж дают проточной в одой и из м еряют оптическую плотность пробы (А 1) и стандарта (А 2) против контрольного раств ора. И з м ерение следует пров ести до 15 м инут после ох лаж дения. М очу перед анализ ом раз в одят дистиллиров анной в одой от 1÷50 до 1÷100 (рез ультат ум нож аютнараз в едение). Расчет: М очев ина(м м оль/л)=16,65·А 1/А 2 О пределен ие мочевин ы в сы воротке крови уреазн ы м методом по реакции сфен ол-гипохлоритом Принцип м етода. М очев ина под действ ием ф ерм ента уреаз ы раз лагается на углекислы й газ и ам м иак. А м м иак определяют колорим етрически по образ ов анию продуктов синего цв ета (индоф енолов ) с гипох лоритом натрия и ф енолом . Реакция катализ ируется нитропруссидом натрия. И нтенсив ностьокраски пропорциональнасодерж анию м очев ины . Реактив ы . 1. Раств ор уреаз ы в Э Д Т А -буф ере. 2. Ц в етной реактив – ф енол0,11 м оль/л, нитропруссид натрия 0,18 м оль/л. 3. 0,011 м оль/лраств ор гипох лорита натрия в 0,13 м оль/лраств оре NaOH. 4. Стандартны й раств ор м очев ины 0,5 м м оль/л. 5. И з отонический 154 м м оль/лраств ор NaCl. Ход определения. В пробирку в носят0,1 м лрабочего раств ора уреаз ы и добав ляют 0,02 м л сы в оротки кров и, раз в еденной из отоническим раств ором NaCl в соотнош ении 1:9. Закры в ают пробирку пробкой, перем еш ив ают, инкубируют 15 м ин. при 37° С. Затем добав ляют 0,3 м л цв етного реактив а и 0,3 м л рабочего раств ора гипох лорита Na. Пробы перем еш ив ают, инкубируют при 37° С и ф отом етрируют при длине в олны 500-560 нм (з елены й св етоф ильтр) в кюв етес длиной оптического пути 1 см против контрольной пробы . К онтрольную и стандартную пробы обрабаты в аютаналогично опы тной, но в м есто исследуем ой сы в оротки кров и в носят соотв етств енно 0,02 м лиз отонического раств ора NaCl (контрольная проба) или 0,02 м лстандартного раств орам очев ины . Расчетпров одятпо ф орм уле: 48 C м очев ины = Е Е оп. ⋅ 0,5 ⋅ 10 , ст. где См очев ины – концентрация м очев ины в пробе, м м оль/л; Е оп. – экстинкция опы тной пробы ; Е ст. – экстинкция стандартной пробы ; 0,5 – концентрация м очев ины в стандартном раств оре, м м оль/л; 10 – коэф ф ициентраз в едения. Н орм альны е в еличины – 2,50 – 8,33 м м оль/л. У лиц старш е 60 лет уров еньм очев ины м ож етслегкапрев ы ш атьнорм у. Д иагностическое з начение теста. М очев ина синтез ируется в печени при обез в реж ив ании ам м иака, которы й интенсив но образ уется в реакциях окисления и дез ам иниров ания ам инокислот, пуринов ы х и пирим идинов ы х нуклеотидов , и в ы в одится с м очой. Т аким образ ом , содерж ание м очев ины в кров и з ав иситотсоотнош ения процессов м очев инообраз ов ания в печени и ее в ы в едения почкам и. При ух удш ении ф ункции почек им енно пов ы ш ение м очев ины в кров и яв ляется наиболее ранним диагностическим тестом . И з ф ракций остаточного аз ота в наибольш ей степени в кров и пов ы ш ается м очев ина, которая м ож етсостав лять до 90% ф ракции остаточного аз отапри патологии (в норм е– 50%). Раз личаюттри группы причин, прив одящ их к ув еличению содерж ания м очев ины в кров и: надпочечную аз отем ию, почечную и подпочечную. Н адпочечная аз отем ия обуслов лена пов ы ш ением уров ня м очев ины в кров и, наступающ им в следств ие сниж енного поступления кров и к почкам (циркулярная недостаточность в клубочках , ш ок, кров опотеря, дегидратация). А з отем ия почечного происх ож дения бы в аетсв яз анас острой или х ронической почечной недостаточностью в следств иеглом ерулонеф рита, пиелонеф рита, артериосклероз а, некроз а кортикального слоя почек. Подпочечная аз отем ия бы в аетсв яз анас облитерацией м очев ы в одящ их путей (м очекам енная болез нь, опух оли м очев ы в одящ их путей, предстательной ж елез ы и т. д.). При почечной гипертонии уров ень м очев ины в кров и пов ы ш ен, а при эссенциальной гипертонии содерж анием очев ины бы в аетв пределах норм ы . Пов ы ш ение уров ня м очев ины в кров и м ож ет бы ть и при усиленном распаде белков (синдром сдав лив ания, ож оги, лих орадка, перитонит), при обез в ож ив ании организ м а. Сниж ениеуров ня м очев ины бы в аетсв яз ано с отрицательны м балансом аз ота в рез ультате плох ого питания, с печеночной недостаточностью или с гипергидратацией организ м а. Сниж ение концентрации м очев ины в сы в оротке кров и наблюдается такж е при берем енности, в ирусном гепатите, острой дистроф ии печени, отрав лении ф осф ором , м ы ш ьяком и др. ядам и. Р абота 15. О пределен ие кон цен трации креатин ин а в сы воротке крови и в моче. Р асчет клирен са креатин ин а. К реатинин – продукт неф ерм ентатив ного гидролиз а креатинф осф ата – в ещ еств а, которое в м ы ш цах служ ит источником в ы сокоэнергетических 49 ф осф атны х групп для А Т Ф . О пределен ие креатин ин а в сы воротке крови Принцип м етода: в щ елочной среде пикринов ая кислота в з аим одейств ует с креатинином с образ ов анием оранж ев о-красной окраски, которую из м еряют ф отом етрически при длине в олны 500-510 нм (м етод Я ф ф ера). О пределение пров одят после депротеиниров ания (удаления белков ). О пределение не сов сем специф ично – интерф ерируют в ещ еств а с актив ной м етиленов ой группой и некоторы е в осстанав лив ающ ие в ещ еств а, наприм ер, глюкоз а. Реактив ы . 1. Стандартны й раств ор креатинина177 м км оль/лв раств оре альбум ина 12 г/л. 2. Д епротеинирующ ий раств ор – кислотатрих лоруксусная 1,22 м оль/л(Т ХУ ). 3. Пикринов ая кислота 0,04 м оль/л. 4. Н атрий гидроксид 0,75 м оль/л. Ход работы . В трех центриф уж ны х пробирках см еш ив ают реактив ы согласно таблице12. Т аблица12. Ход определения креатининав сы в ороткекров и Реагенты , м л Проба К онтроль Стандарт Сы в ороткакров и 0,5 Н 2О 1,0 1,5 1,0 Стандартны й раств ор 0,5 креатинина Т ХУ 0,5 0,5 0,5 Перем еш ив аюти центриф угируют5 м ин. при 3000 g. Затем из каж дой пробирки отбирают 0,5 м л надосадочной ж идкости и переносят в другие пробирки. В каж дую пробирку добав ляют по 0,5 м лпикринов ой кислоты и по 0,5 м л NaOH. Перем еш ив ают и через 20 м ин. из м еряют оптическую плотность пробы (А 1) и стандартного раств ора (А 2) против контрольного раств орапри длинев олны 500-510 нм . Расчет: [креатинин] = 177 А 1/А 2 Н орм а: м уж чины 61-715 м км оль/л ж енщ ины 53-97 м км оль/л. О пределен ие креатин ин а в моче При определении концентрации креатинина в м оче предв арительно раз бав ляютм очу в 100 раз , рез ультатум нож аютна50. См еш ив аютреактив ы согласно таблице 13. Перем еш ив ают и через 20 м ин. из м еряют оптическую плотность пробы (Е оп.) и стандартного раств ора (Е ст.) против контроля при длинев олны 500-510 нм . Т аблица13. Ход определения креатининав м оче Реагенты , м л Проба К онтроль Стандарт М оча 0,50 - 50 0,25 - Н 2О 0,75 Стандартны й раств ор креатинина Т ХУ 0,25 0,25 Пикринов ая кислота 0,50 0,50 NaOH 0,50 0,50 Расчетсуточной экскреции креатининапроиз в одятпо ф орм K= 0,50 0,25 0,25 0,50 0,50 уле: E оп. ⋅ С с т . ⋅ V ⋅ 50 , где Ес т . ⋅ v К – содерж ание креатинина в суточной м оче, м км оль/л; Е оп.– экстинкция опы тной пробы , Е ст. – экстинкция стандартной пробы ; Сст. – содерж ание креатинина в стандартной пробе, 177 м км оль/л; V – суточное количеств о м очи, м л; v – количеств о м очи, в з ятоедля анализ а, м л. Засутки с м очой в ы в одится 4,4 – 17,7 м м ольили 0,5-2,0 г креатинина. Прим ечание. При сборе суточной м очи в качеств е консерв анта реком ендуется использ ов атьтим ол. Пробы х ранитьдо 7 дней при 2-8ºС. Д иагностическое з начение теста. Пов ы ш ение уров ня креатинина в сы в оротке кров и яв ляется инф орм атив ны м показ ателем почечной недостаточности или м ы ш ечной дистроф ии. У стойчив ое пов ы ш ение уров ня креатинина в кров и указ ы в ает на наруш ение работы почечного ф ильтра при далеко з аш едш их патологических процессах , однако для ранней диагностики з аболев аний почек тест на пов ы ш енное содерж ание креатинина в кров и не дает полож ительного рез ультата. Пов ы ш ение уров ня креатинина в кров и отм ечается такж е при обструкции м очев ы в одящ их путей, киш ечной непрох одим ости, тяж елом диабете, некроз е м ы ш ц, синдром е длительного сдав лив ания, ож огах . Р асчет клирен са креатин ин а Н а основ е определения креатинина в м оче и в плаз м е (сы в оротке) кров и рассчиты в ается клиренс креатинина, которы й яв ляется х арактеристикой клубочков ой ф ильтрации. К лиренс креатинина (коэф ф ициенточищ ения) показ ы в ает, какой объ ем плаз м ы кров и полностью очищ ается отданного в ещ еств аз а1 м ин., и рассчиты в ается по ф орм уле: С= К И ⋅ V ⋅ 1,73 , S где К И – концентрационны й индекс; V – м инутны й диурез ; 1,73 – стандартная пов ерх ностьтела; S – истинная пов ерх ностьтела К онцентрационны й индекс показ ы в ает, во сколько раз концентрируется данноев ещ еств о почкам и. К И = [креатинин] в м оче [креатинин] в кров и V = Д /t, гдеД – объ ем м очи з ав рем я t, м л; t – в рем я в м ин. S – 0,0167 рост, см ⋅ в ес, к г . 51 Н орм апоказ ателя клиренса- 90-130 м л/м ин. К лиренс определяют, когдакреатинин в норм е, в следующ их случаях : - у потенциальны х доноров почек; - при м иним альны х пораж ениях почек (клиренс сниж ается раньш е, чем пов ы ш ается количеств о креатинина и м очев ины в кров и, т.е. яв ляется сам ы м ранним диагностическим приз наком пораж ения почек); - при определении доз иров ки токсического соединения; - оценке ф ункции каж дой почки (рез ультат срав нив ают с полов иной клиренса) Реабсорбцию рассчиты в аютпо ф орм уле: K −1 R= ⋅ 100% . K В еличинареабсорбции в норм есостав ляет97-99%. Р абота 16. М ехан изм действия адрен алин а. О пределен ие адрен алин а в сы воротке крови А дреналин – горм он м оз гов ого слоя надпочечников , синтез ируется в отв ет на состояние ф из ического или нерв ного стресса. Секреция его не з ав исит от концентрации глюкоз ы в кров и. Биосинтез адреналина идет по сх ем е: тироз ин → диоксиф енилаланин (Д О Ф А ) → доф ам ин → норадреналин → адреналин. А дреналин и норадреналин наз ы в ают катех олам инам и, но горм ональной актив ностью обладает адреналин, а норадреналин яв ляется нейром едиатором . К леткам и-м иш еням и для адреналина яв ляются клетки скелетны х м ы ш ц, печени, сердца, сердечно-сосудистой систем ы и ж иров ой ткани. Ф ункционирует адреналин в течение 1 м ин. М ех аниз м действ ия м ем бранно-в нутриклеточны й. Биологическоедейств иеадреналина. I. Вл и я ни е на угл еводный об м ен (преж де вс его в с кел ет ныхм ышц ах, а зат ем впечени ): - усилив ает распад глюкоз ы в процессе гликолиз а, актив ируя ф осф оф руктокиназ у; - усилив ает глюконеогенез в печени з а счет актив ации 4 ф ерм ентов ; пирув аткарбоксилаз ы , ф осф оенолпирув аткарбоксикиназ ы , ф руктов о-1,6бисф осф атаз ы и глюкоз о-6-ф осф атаз ы ; - усилив аетраспад гликогена, актив ируя каскадны м м ех аниз м ом , через аденилатциклаз ную систем у, гликогенф осф орилаз у; - ингибирует биосинтез гликогена, так как через аденилатциклаз ную систем у инактив ируетгликогенсинтаз у; В рез ультатеадреналин пов ы ш аег содерж аниеглюкоз ы в кров и. П . В лиян ие н а о б м е н липидо в: - усилив ает распад триацилглицеролов , актив ируя каскадны м м ех аниз м ом триацилглицерол-липаз у. - усилив аетраспад ж ирны х кислотв процессеβ-окисления. 52 - пов ы ш ает содерж ание ж ирны х кислот, х олестерина и ф осф оглицеридов в кров и. А дреналин подав ляет секрецию инсулина, пов ы ш ает секрецию глюкагона. К атаболиз м адреналина протекаетв гепатоцитах печени под в лиянием ф ерм ентов м оноам инооксидаз ы и катех ол-0-м етилтрансф ераз ы с образ ов анием 80% в анилил-м индальной кислоты , 15% - м етадреналина, которы е в ы деляются почкам и с м очой, лиш ь 5% адреналина в ы деляются с м очой неиз м ененны м и. Горм ональны ем ех аниз м ы реализ ации стресса. Состояниеф из ического и эм оционального стрессов в осприним ают клетки центральной нерв ной систем ы и посы лаютнерв ны еим пульсы в м оз гов ой слой надпочечников и в гипоталам ус. В м оз гов ом слоенадпочечников идетсекреция адреналина, ав гипоталам усе синтез ируется кортиколиберин (кортикотропин-рилиз инггорм он), под в лиянием которого в гипоф из е происх одит в ы работка адренокортикотропного горм она (А К Т Г), в оз действ ующ его на корков ы й слой надпочечников . Д лительное в ы деление адреналина прив одит к раз растанию (утолщ ению) корков ого слоя надпочечников и з начительном у ув еличению в ы деления кортикостероидны х горм онов . Следов ательно, горм ональны еиз м енения м етаболиз м апри стрессеобуслов лены в ы делением больш ого количеств а адреналина и кортикостероидны х горм онов . Патология: ф еох ром оцитом а(опух ольм оз гов ого слоя надпочечников ). К оличествен н ое определен ие адрен алин а колориметрическим методом Принцип м етода. М етод основ ан на колорим етрическом определении интенсив ности синего окраш ив ания, в оз никающ его при в з аим одейств ии адреналина с реактив ом Ф олина. Реактив Ф олина содерж итсоли ф осф орнов ольф рам ов ой и ф осф орно-м олибденов ой кислот, которы е в осстанав лив аются адреналином с образ ов анием более низ ких оксидов м еталлов , ком плексы которы х окраш ены в синий цв ет. Реактив ы : 0,01%-й раств ор адреналина в ам пулах ; реактив Ф олина; 10%-й раств ор углекислого натрия. Ход работы . В дв екалибров анны ена10 м лпробирки в носят: в перв ую — 1 м лстандартного раств ора адреналина, в о в торую — 1 м лисследуем ого раств ора. Д алее в каж дую пробирку добав ляют по 4 м л 10 %-го св еж еприготов ленного раств ора карбоната натрия и по 0,5 м л реактив а Ф олина, в стрях ив ают. Ж идкость постепенно окраш ив ается в синий цв ет, достигающ ий наибольш ей интенсив ности через 5 м ин. Д алее объ ем ж идкости дов одят до м етки 10%-м раств ором карбоната натрия, перем еш ив ают и окраску исследуем ого раств ора срав нив ают с окраской стандартного раств ора адреналина на ф отоколорим етре, св етоф ильтр красны й, кюв етас толщ иной слоя 5 м м . Расчет: К онцентрация адреналина, м г =(Cст·Е оп)/Е ст, 53 где Cст - концентрация адреналина в стандартном раств оре в м г, Е ст экстинкция стандартного раств ора, Eоп - экстинкция испы туем ого раств ора. Задан ие по теме «П ерен осген етической ин формации» 1. Н апиш ите нуклеотидную последов ательность участка Д Н К , синтез ируем ого Д Н К -полим ераз ой, если м атрицей для него бы ла последов ательность а) (5′) - AТ GА А ATTAСGТ GСACGACGCТ GA - (3′) б) (5′) - AТ GТ Т AGСATATСGТ GGGCCGТ AG - (3′) в ) (5′) - А TGAТ TА А AСGТ GСATTTAATTAA- (3′) г) (5′) - AТ GТ TTСGТ GСAAAAGCGCTTTGA - (3′). 2. Н апиш ите нуклеотидную последов ательность РН К , синтез ируем ой Д Н К -з ав исим ой РН К -полим ераз ой, если м атрицей для нее яв ляется синтез иров анны й участок, полученны й в п. 1. 3. Н апиш ите ам инокислотную последов ательность пептида, если в качеств ем атрицы для его синтез абудетРН К , полученная в п.2 (см . табл. 13). 4. М олекулаД Н К содерж ит15 ты с. пар основ аний. Рассчитайте длину м олекулы . (Расстояние м еж ду центрам и основ аний, леж ащ их друг над другом , рав но 0,34 нм . Н а каж ды й полны й в иток дв ойной спирали прих одится 10 нуклеотидны х пар.) 5. Согласно данны м электронной м икроскопии длина х ром осом ы E. coli рав на1,2 м км . Сколько пар ком плем ентарны х основ аний присутств уетв х ром осом е? 54 Т аблица13. Генетический код (последов ательностьоснов аний в триплетах м РН К , кодирующ их ам инокислоты ). Перв ое В тороеполож ение Т ретье полож ение полож ение U C A G (5’-конец) (3’-конец) ↓ ↓ Phe Ser Tyr Cys U U Phe Ser Tyr Cys C Leu Ser Стоп Стоп A Leu Ser Стоп Trp G C Leu Pro His Arg U Leu Pro His Arg C Leu Pro Gln Arg A Leu Pro Gln Arg G A Ile Thr Asn Ser U Ile Thr Asn Ser C Ile Thr Lys Arg A Met Thr Lys Arg G G Val Ala Asp Gly U Val Ala Asp Gly C Val Ala Glu Gly A Val Ala Glu Gly G О С Н О В Н А Я Л И Т ЕР А Т У Р А Биологическая х им ия. Руков одств о к лабораторны м з анятиям . - СПб., 1998. – 68 с. М едицинскиелабораторны етех нологии: Справ очник: В 2 т. / Под ред. А .И .К арпищ енко. - СПб: И нтерм едика, 1999. - Т .2. - 115 с. Пустов алов а Л.М . Практикум по биох им ии / Л.М . Пустов алов а. – Ростов -н/Д : Ф еникс, 1999. – 544 с. Д О П О Л Н И Т ЕЛ Ь Н А Я Л И Т ЕР А Т У Р А А лабов ский В .В . Задания к практическим з анятиям по биох им ии / В .В . А лабов ский. – В оронеж , 1994. – 116 с. Лиф ш иц В .М . Биох им ическиеанализ ы в клинике. / В .М . Лиф ш иц, В .И . Сидельников а. - В оронеж : И з д-в о В оронеж . ун-та, 1995. - 222 с. Э нциклопедия клинических лабораторны х тестов / Под ред. Н . Т ица. М .: Лабинф орм , 1997. - 942 с. Лениндж ер А . О снов ы биох им ии: В 3 т. / А . Лениндж ер. - М .: М ир, 1985. – Т . 1-3. 55 Состав ители: Попов аТ атьянаН иколаев на, М атасов аЛарисаВ ладим иров на, Т екунов аН инаА лексеев на Сем ених инаА настасия В ладим иров на Редактор Т их ом иров аО .А .