Азотистые гетероциклы в медицине и сельском
advertisement
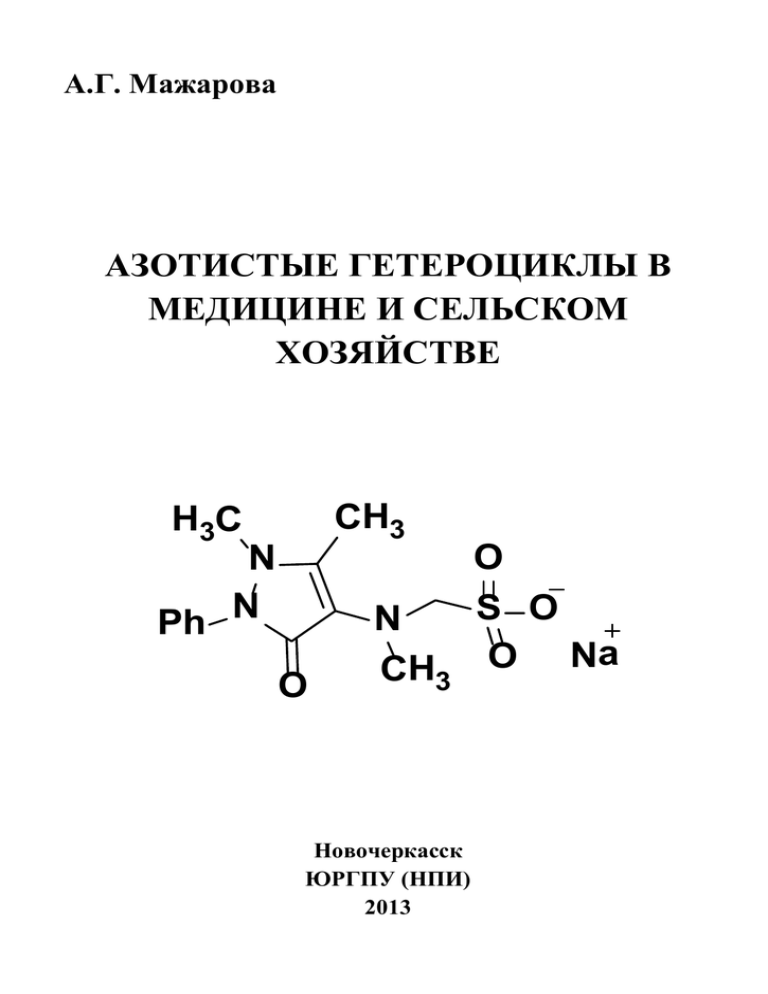
А.Г. Мажарова АЗОТИСТЫЕ ГЕТЕРОЦИКЛЫ В МЕДИЦИНЕ И СЕЛЬСКОМ ХОЗЯЙСТВЕ CH3 H3C N N Ph O O S O N a N O CH3 Новочеркасск ЮРГПУ (НПИ) 2013 Министерство образования и науки Российской Федерации Южно-Российский государственный политехнический университет (Новочеркасский политехнический институт) имени М.И. Платова А.Г. Мажарова АЗОТИСТЫЕ ГЕТЕРОЦИКЛЫ В МЕДИЦИНЕ И СЕЛЬСКОМ ХОЗЯЙСТВЕ Новочеркасск ЮРГПУ (НПИ) 2013 УДК 547.791.3.021:001.891 ББК 24.23 Рецензент – доктор технических наук И.Ю. Жукова Мажарова А.Г. Азотистые гетероциклы в медицине и сельском хозяйстве : учебное пособие / Юж.-Рос. гос. политехн. ун-т (НПИ). – Новочеркасск: ЮРГПУ (НПИ), 2013. – 79 с. В учебном пособии систематизированы современные требования к лекарственным средствам и пестицидам, стадии биологического изучения и стратегии создания новых синтетических препаратов. Описаны важнейшие представители азотистых гетероциклов, находящих применение в медицине и сельском хозяйстве. Учебное пособие предназначено для магистров ВУЗов, обучающихся в рамках направления 240100 «Химическая технология» по профилю «Химическая технология органических веществ». Также оно может быть полезным для аспирантов, преподавателей и научных работников, специализирующихся в области химии гетероциклических соединений. Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках ФЦП «Научные и научно-педагогические кадры инновационной России», грант 14.B37.21.0827, а также частично в рамках государственного задания на проведение НИОКР, шифр заявки 3.2107.2011. УДК 547.791.3.021:001.891 ББК 24.23 ©Южно-Российский государственный политехнический университет (НПИ) © Мажарова А.Г., 2013 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ ......................................................................................................................5 1. СОВРЕМЕННЫЕ ТРЕБОВАНИЯ К ЛЕКАРСТВЕННЫМ СРЕДСТВАМ И ПЕСТИЦИДАМ ..............................................................................................................7 2. СТАДИИ БИОЛОГИЧЕСКОГО ИЗУЧЕНИЯ ЛЕКАРСТВЕННЫХ И ПЕСТИЦИДНЫХ ВЕЩЕСТВ ...................................................................................11 3. ОСНОВЫ СТРАТЕГИИ СОЗДАНИЯ НОВЫХ СИНТЕТИЧЕСКИХ ЛЕКАРСТВ И СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ ................................................15 3.1. Принцип химического модифицирования структуры ......................................17 3.2. Принцип введения фармакофорной (токсофорной) группы ............................20 3.3. Принцип молекулярного моделирования. .........................................................21 3.4. Стратегия пролекарств и пропестицидов...........................................................23 3.5. Концепция антиметаболитов...............................................................................25 3.6. Методология комбинаторной химии ..................................................................28 4. СВЯЗЬ СТРУКТУРА - БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ........................30 5. ПРИНЦИПИАЛЬНАЯ СХЕМА РАЗРАБОТКИ НОВОГО ЛЕКАРСТВЕННОГО ИЛИ ПЕСТИЦИДНОГО ВЕЩЕСТВА ...........................38 6. КЛАССИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ ...............................................................................................42 7. ОСНОВНЫЕ КЛАССЫ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛОВ И ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ ............48 7.1. Препараты, содержащие трех- и четырехчленные циклы................................48 7.1.1. Вещества, содержащие трехчленные циклы: группа азиридина .... 48 7.1.2. Вещества, содержащие трехчленные циклы: группа азетидина ..... 49 7. 2. Препараты на основе пятичленных гетероциклов. ..........................................50 7.2.1. Производные пирролидина, пиррола и индола .................................... 50 7.2.2. Произодные имидазола ............................................................................... 53 7.2.3. Произодные пиразола .................................................................................. 54 7.2.4. Произодные триазола................................................................................... 56 7.3. Препараты, содержащие шестичленные гетероциклы .....................................62 7.3.1. Шестичленные гетероциклы с одним атомом азота:производные пиридина .................................................................................................................... 62 7.3.2. Шестичленные гетероциклы с двумя или тремя атомами азота .... 69 3 8. ГЕТЕРОЦИКЛЫ, СОДЕРЖАЩИЕ СЕМИЧЛЕННЫЙ ЦИКЛ .....................76 СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ ......................................................78 4 ВВЕДЕНИЕ Лекарственными веществами называют биологически активные вещества, применение которых для профилактики и лечения заболеваний человека разрешено законодательно [1]. В книге «Справочник Видаль. Лекарственные препараты России» (2012 г.) насчитывается более 2000 лекарственных средств. Подобное многообразие уже существующих лекарственных веществ, постоянный ежегодный прирост их арсенала (30-40 новых структур), сложность строения новых лекарственных, многостадийность их синтеза учебной информации по химии лекарств, не может претендовать на полное отражение в методическом пособии небольшого объема [1]. Химическими средствами защиты и регуляции жизнедеятельности животных и растений называют биологически активные вещества, применение которых в сельскохозяйственной, производственной и домашней практике разрешено законодательно [3]. Понятие «биологической активности вещества» отражает его взаимодействие с живыми организмами, которое вызывает в них определенный отклик. Например успокоительный эффект, снижение температуры, снятие болевого ощущения и др. для лекарственных средств. При попадании биологически активного вещества в организм вредителя культивируемых растений это вещество должно остановить рост, развитие, размножение вредных организмов или вызвать их гибель. Такие вещества называют пестицидами (от лат. pestis – зараза и caedere – убивать). Определенные биологически активные вещества используются для регуляции роста и развития самих культивируемых организмов, например, для стимулирования или, наоборот, замедления роста и развития растений, придания им устойчивости к неблагоприятным погодным условиям или к воздействию патогенных организмов и т.д. Такие вещества называют регуляторными [3]. 5 К настоящему времени создан большой арсенал лекарственных, пестицидных и регуляторных веществ как природного, так и синтетического происхождения, поскольку современная прогрессивная технология возделывания растительных культур и выращивания скота и птицы обязательно включает в себя применение химических средств защиты, лечения и рострегуляции. Число используемых в промышленных масштабах веществ перевалило далеко за тысячу, а число производимых препаратов составляет несколько тысяч. Многообразие созданных веществ с рассматриваемым полезным действием, их постоянное ежегодное обновление и прирост совокупного арсенала, сложность строения новых физиологически активных пестицидов и рострегуляторов, многостадийность их синтеза – все это составляет огромный массив как научной, так и учебной информации по химии пестицидных и регуляторных веществ. 6 1. СОВРЕМЕННЫЕ ТРЕБОВАНИЯ К ЛЕКАРСТВЕННЫМ СРЕДСТВАМ И ПЕСТИЦИДАМ К лекарственным веществам предъявляют многочисленные жесткие требования. Прежде всего лекарственное вещество должно обладать высокой активностью, избирательностью и продолжительностью лечебного действия. Оно должно быть нетоксичным и не должно вызывать нежелательных побочных эффектов. Кроме того, лекарственное вещество должно быть высокочистым и иметь высокую стабильность при хранении. Себестоимость его производства не должна быть слишком высокой. Наконец, оно должно быть доступным, а доходность при его реализации на фармацевтическом рынке – достаточно высокой. Все эти факторы определяют время жизни данного препарата среди применяемых в медицинской и международной практике аналогично действующих лекарственных веществ. Изучению токсических свойств потенциального лекарственного вещества уделяют в настоящее время самое серьезное влияние. Это в значительной мере удлиняет сроки от создания препарата в лаборатории до его массового производства и начала применения (до 7-10 лет). К необходимости резкого ужесточения требований по детальному исследованию побочных эффектов потенциальных лекарственных веществ пришли в конце 1960-х годов, когда обнаружилось, что использование снотворного под названием «талидомид» беременными женщинами стало приводить к рождению детей с уродливыми органами. Это лекарственное вещество сразу попало под запрет, а его дополнительное изучение показало, что талиломид применяли в виде рацемата, т.е. смеси двух оптически активных энантиомеров, из которых (+)-Rэнантиомер обладает снотворным действием, а его (–)-S-форма вызывает тератогенность (врожденные уродства): 7 Следует иметь ввиду, что опасное побочное действие лекарственных веществ может проявляться не только от недоизученности свойств, но и при неправильном применении «обычных» лекарственных средств, их передозировке и самолечении [1]. Химические средства защиты сельскохозяйственных растений и животных создаются и распространяются человеком в биосфере для уничтожения или контроля над численностью вредных для животноводства и растениеводства живых организмов. Поскольку большая часть подобных средств по определению (пестициды или биоциды) должна обладать высокой токсичностью в отношении вредных организмов, то вряд ли следует надеяться, что при этом все пестицидные вещества не окажутся в той или иной мере вредными и для человека. В связи с этим к современным ядохимикатам и рострегуляторным веществам предъявляют многочисленные очень жесткие требования. Перечислим прежде всего общие требования к химическим средствам защиты сельско-хозяйственных растений и животных. Первое требование заключается в том, что все пестициды должны обладать высокой активностью (эффективностью) полезного физиологического действия, например, быстрое уничтожение патогенных грибов. Во-вторых, требуется, чтобы препарат имел высокую селективность (избирательность, направленность) биодействия. Например, прекращение роста и развития определенного возбудителя заболевания растения. Следует отметить, что в химии и биологии часто действует правило, согласно которому высокая активность уменьшает избирательность действия. Так, среди гербицидов встречается довольно много высокоактивных веществ, но многие из них обладают сплошным, т.е. угнетающим одновременно многие растения, 8 гербицидным действием. Следующим очень важным требованием является нетоксичность используемых на практике веществ в отношении человека и животных. Пестициды должны иметь низкую острую и субхроническую (отдаленную) токсичность. Следует подчеркнуть, что самая высокая доля отравлений приходится на очень ядовитые пестициды (с ЛД50<50 мг/кг). Поэтому, не смотря на их высокую эффективность, их редко используют в сельском хозяйстве. Сказанное относится, прежде всего, к фосфорорганическим веществам. Пестициды должны также обладать малой способностью (или полным ее отсутствием) аккумулироваться в живых организмах, т.к. это может привести к проявлению субхронической токсичности. Высоким коэффициентом кумуляции (способностью накапливаться в организме) обладает, например, инсектицид ДДТ. Он имеет среднюю острую токсичность (ЛД50 0,2-0,5 г/кг), но его длительное воздействие, как и любого другого пестицида, вызывает изменение физиологических функций у большинства теплокровных. Пестициды не должны вызывать таких субхронических патологий, как аллергия, повреждения нервной системы, мутагенез, канцерогенез, отравления зародыша, тератогенез и др. У них также должна отсутствовать токсичность в отношении защищаемых растений (низкая фитотоксичность), миклофлоры и микрофауны, почвы (например, в отношении полезных почвенных бактерий, червей и т.п.), а также в отношении организмов, обитающих в воде (гидробионтов). Изучению токсических свойств потенциального пестицида и рострегулятора уделяют в настоящее время самое серьезное внимание. Это в значительной мере удлиняет сроки между созданием препарата в лаборатории и его массовым производством и началом применения (до 10 лет). Еще одно современное требование к промышленным ядохимикатам заключается в том, что они должны обладать малой стойкостью после их применения и достижения желаемого биоэффекта. Под действием внешней среды (атмосферы, гидросферы, почвы и бионтов – живых организмов, пестицидные и рострегуляторные вещества должны быстро разлагаться в 9 процессе химических, фотохимических и биохимических реакций гидролиза, деструкции, окисления и т.п. При этом должны образовываться продукты, не токсичные для человека хлорорганические и полезных инсектициды как бионтов. ДДТ и Например, такие гексахлорциклогексан высокоустойчивы (высокоперсистентны) и разрушаются в почве на 50% лишь за 1-2 года, а исчезают полностью лишь в течение 5-10 лет. В то же время фосфорорганические инсектоакарициды, например, тиофос разлагаются достаточно быстро. Их период полураспада (Т50) в почве и в растениях составляет 4-20 дней, а полная деструкция (Т100) наблюдается за 20-40 дней. Инсектицид севин быстро разлагается в растениях за 1-4 недели, но сохраняется в почве до 1,5 лет. В то же время такие инсектициды, как пиретроиды в считанные часы подвергаются фоторазложению в почве, а в растениях сохраняются несколько дней. Малое время ожидания полного распада ядохимиката (его низкая персистентность) после применения обеспечивает максимальную безопасность для человека и окружающей среды. Подобные быстро разлагающиеся химикаты не успевают попадать в пищу человека и животных, не загрязняют наземные и подземные водоемы и не отравляют природные и сельско-хозяйственные экосистемы в целом. Кроме рассмотренных требований пестициды должны иметь достаточно высокую стабильность при хранении. Их производство должно отличаться простотой и малыми трудоемкостью и энергозатратами. Пестицидные и регуляторные вещества должны иметь возможно низкую себестоимость, быть доступными, а экономическая эффективность их применения (доходность, рентабельность) должна быть достаточно высокой [3]. 10 2. СТАДИИ БИОЛОГИЧЕСКОГО ИЗУЧЕНИЯ ЛЕКАРСТВЕННЫХ И ПЕСТИЦИДНЫХ ВЕЩЕСТВ В настоящее время каждое потенциальное лекарственное вещество проходит три стадии изучения: фармацевтическую, фармокинетическую и фармодинамическую. На первой стадии устанавливают наличие полезного действия лекарственного вещества, после чего оно подвергается доклиническому изучению других показателей. Прежде всего определяется острая токсичность, т.е. смертельная доза для 50% опытных животных (LD50, выражаемая в мг лекарственного вещества на кг живого веса). Затем выясняется субхроническая токсичность в условиях длительного (несколько месяцев) введения лекарственного вещества в терапевтических дозах (которые обычно в 20 и более раз должны быть ниже LD50). При этом наблюдают возможные побочные эффекты и патологические изменения всех систем организма: тератогенность, влияние на репродуктивность (способность воспроизводить потомство) и иммунную систему, эмбриотоксичность (отравление плода), мутагенность (изменение наследственных функций), канцерогенность, аллергенность и другие вредные побочные действия. После этого этапа лекарственное средство может быть допущено к клиническим испытаниям, т.е. к установлению эффективности его лечебного действия и возможных побочных эффектов на больных людях в условиях клиники. На второй стадии – фармокинетической (фармокинетика как часть науки фармокологии зародилась в 1960-х годах) – изучают судьбу лекарственного вещества в организме: пути его введения и всасывания, распределение в биожидкостях, проникновение через защитные барьеры, доступ к органумишени, пути и скорость биотрансформации (расщепление лекарственного вещества на метаболиты происходит в основном в печени), пути выведения из организма ( с мочой, калом, потом и дыханием). Методы введения лекарственного вещества в организм разделяют на: 11 1) энтеральные (от греч. «энтерон» - желудочно-кишечный тракт, ЖКТ) – через нос (интраназально), через рот (перорально) или через прямую 12-перстную кишку; 2) парэнтеральные (минуя ЖКТ) – подкожные, внутримышечные, внутривенные инъекции, всасывание лекарства через поверхность кожи. На третьей - фармодинамической – стадии изучаются проблемы распознавания лекарственного вещества (или его метаболитов) мишенями и их последующего взаимодействия. Мишенями могут служить органы, ткани, клетки, клеточные мембраны, ферменты, нуклеиновые кислоты, регуляторные молекулы (гормоны, витамины, нейромедиаторы и т.д.), а также биорецепторы. Рассматриваются вопросы структурной комплементарности взаимодействующих и структур, стереоспецифичной функционального и химического соответствия лекарственного вещества или метаболита (например, фармакофорной группировки) его рецептору. Взаимодействие между лекарственным веществом и рецептором или акцептором, приводящее к активации (стимулированию) или дезактивации (ингибированию) биомишени и сопровождающееся ответом организма в целом, в основном обеспечивается за счет слабых связей – водородных, электростатических, ванн-дер-ваальсовых, гиброфобных [1]. Совсем недавно возникла наука фармогенетика – часть фармокологии, изучающая зависимость лечебных и токсических эффектов одного и того же лекарственного вещества не только от пола и возраста больных, но и от их генетических особенностей и, в часности, от их этнической принадлежности. В настоящее время каждое потенциальное пестицидное вещество проходит следующие стадии изучения. Большая часть биологически активных веществ, полученных в ходе эмпирического синтеза, проходит первичные испытания на выявление той или иной биологической активности. Этот этап поиска и создания средства химической защиты растений и животных называют биологическим скринингом (англ. просеивание). Его принцип был впервые разработан при поиске 12 противосифилитических препаратов среди органических соединений мышьяка. Скрининг проводят в биологических лабораториях в стандартных условиях на живых клетках, микроорганизмах (in vitro), на семенах и зеленых растениях, на животных (in vivo): на насекомых, жуках, тараканах, мышах, крысах и т.д. Напряженность отбора на каждом этапе биотестирования очень высока - из сотен веществ отбираются лишь несколько наиболее активных препаратов, которые затем передаются на углубленные испытания. Если высокая активность вещества подтверждается, то его всесторонне изучают для определения острой и субхронической токсичности и побочных эффектов, при отсутствии или незначительности которых проводятся широкие производственные испытания (в теплицах, на полях, птицефермах и т.д.). После подтверждения высокой эффективности препарата в производственных условиях его начинают производить в промышленных масштабах и применять в качестве коммерческого химического средства защиты, лечения и рострегулирования растений или животных в сельско-хозяйственной практике. Например, скрининг при поиске гербицидов и регуляторов роста может включать несколько этапов отбора. На стадии первичного отбора биологи изучают действие химических веществ на жизнедеятельность клеток некоторых высших растений (на культурах табака, сахарной свеклы и др.). Вещества, показавшие на этом этапе высокую активность, затем исследуются с целью определения характера их действия – стимулирования или ингибирования роста растений. В биотестах этого этапа наблюдают за влиянием тестируемого вещества на скорость прорастания семян, прироста колеоптилей (верхней части проростка пшеницы и других злаков, которым растение пробуравливает почву), гипокотелей (части стебелька, из которого затем формируется первичный корень) и т.д. Уровень биоактивности вещества оценивается в сравнении с действием в контроле природных фитогормонов – этилена (для его генерации используют этрел), абсцизовой кислоты, гетероауксина, кинетина, гиббереллина, а также некоторых синтетических эталонных гербицидов и рострегуляторов. 13 Затем выявляют направление практического использования отобранных на предыдущем этапе веществ. Оно определяется серией испытаний на семенах, на черенках растений, на всходах и молодых растениях различных видов. Подобные биотесты позволяют дифференцировать направленность использования потенциального препарата, например, для изменения сроков прорастания семян с целью достижения дружных всходов или задержки прорастания при хранении плодов; для стимулирования корнеобразования с целью размножения плодовых культур черенкованием; для задержки роста растения при борьбе с полеганием злаков; для дефолиации растений, что помогает, например, при уборке хлопка; для уничтожения сорных растений и ряда других целей. Вещества, успешно прошедшие подобные испытания, т.е. показавшие на всех этапах физиологическую активность на уровне или выше уровня активности эталонов, передаются на углубленные исследования. Определяется их воздействие на определенные виды культивируемых растений, а затем в случае успеха проводятся теплично-полевые испытания. Накопленные к настоящему времени данные о результатах биологического скрининга большого массива веществ используются в последние двадцать лет для обеспечения большей целенаправленности синтезов новых структур с высоким потенциальным уровнем ожидаемой биоактивности [1-3]. 14 3. ОСНОВЫ СТРАТЕГИИ СОЗДАНИЯ НОВЫХ СИНТЕТИЧЕСКИХ ЛЕКАРСТВ И СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ Ежегодно химики синтезируют, выделяют и характеризуют от 100 до 200 тысяч новых веществ. Большая часть этих веществ, полученных в ходе эмпирического синтеза проходит первичные испытания на выявление той или иной биологической активности. Этот этап поиска лекарственного вещества или средства (отсеиванием). защиты Его растения принцип называют был впервые биологическим разработан скринингом при поиске противосифилитических средств среди органических соединений мышьяка. Скрининг проводят в биологических лабораториях на живых клетках, микроорганизмах или кусочки живых тканей (in vitro), на здоровых или специально зараженных животных (in vivo): на мышах, крысах, морских свинках, собаках, обезьянах. При этом из сотен веществ отбираются несколько наиболее активных препаратов, которые затем передаются на углубленные испытания. Если высокая активность вещества подтверждается, то его всесторонне изучают для определения острой и субхронической токсичности и побочных эффектов, при отсутствии или незначительности которых проводятся клинические испытания на людях или широкие производственные испытания (в теплицах, на полях, птицефермах и т.д.). После подтверждения высокой эффективности препарат начинают производить в промышленных масштабах и применять в лечебной практике, а также в качестве коммерческого химического средства защиты, лечения и рострегулирования растений или животных в сельско-хозяйственной практике. Например, скрининг при поиске гербицидов и регуляторов роста может включать несколько этапов отбора. На стадии первичного отбора биологи изучают действие химических веществ на жизнедеятельность клеток некоторых высших растений (на культурах табака, сахарной свеклы и др.). Вещества, показавшие на этом этапе высокую активность, затем исследуются с целью 15 определения характера их действия – стимулирования или ингибирования роста растений. В биотестах этого этапа наблюдают за влиянием тестируемого вещества на скорость прорастания семян, прироста колеоптилей (верхней части проростка пшеницы и других злаков, которым растение пробуравливает почву), гипокотелей (части стебелька, из которого затем формируется первичный корень) и т.д. Уровень биоактивности вещества оценивается в сравнении с действием в контроле природных фитогормонов – этилена (для его генерации используют этрел), абсцизовой кислоты, гетероауксина, кинетина, гиббереллина, а также некоторых синтетических эталонных гербицидов и рострегуляторов. Считается необходимым, чтобы все новые синтезируемые вещества были подвергнуты первичным испытаниям. Однако к настоящему времени синтезировано уже более 10 миллионов веществ (правда, бо/льшая часть их существует только на бумаге, а не «в руках» синтетика), и следует указать, что видов биологической активности и болезней насчитывают многие тысячи. Очевидно, что возможность испытать все новые соединения на все нужные (полезные) виды активности пока остается малореальной. На помощь химиками биологам приходит компьютерная техника, которая позволяет сегодня вместо испытания в эксперименте синтезированных веществ провести определение потенциала их биоактивности путем машинного анализа. Такой подход может быть основан на кластерном анализе большого массива уже известных лекарственных, сгруппированных биоактивности. по их Другим пестицидных структуре типом или и по машинного регуляторных веществ, видам проявляемой анализа может ими служить моделирование на ЭВМ механизма взаимодействия лекарственного вещества или пестицида с биорецептором или иных эмпирических связей известных препаратов с биомишенями. Биологу необязательно в этом случае иметь вещество в руках, а достаточно лишь ввести в компьютер сведения о его строении. По окончании машинного анализа оператор получает рекомендации о целесообразности или нецелесообразности испытаний данного вещества на тот 16 или иной вид активности. Подобное машинное «сито» (скрининг) экономит время, материалы и силы при аналоговом поиске лекарственных веществ и потенциальных химических средств защиты растений и животных. Однако выявление принципиально новых видов активности или новых видов фармокофорных группировок будет еще долгое время основываться на эксперименте и интуиции исследователя. Для получения потенциально биологически активных веществ химики задолго до появления машинного анализа старались руководствоваться принципами целенаправленного синтеза, которые могли быть выработаны лишь при тщательном и глубоком изучении зависимости биологической активности от химического и стереохимического строения органического соединения. Сегодня стратегия и тактика создания новейших лекарственных веществ опираются на следующие принципы [1-4]. 3.1. Принцип химического модифицирования структуры известных синтетических и природных лекарственных веществ, а также физиологически активных соединений остается пока одним из главных принципов для получения большого числа новых веществ, предназначенных для поиска новых препаратов всех классов. Этот прием является интуитивным, умозрительным. С его помощью исходя из аналогии двух структур биоактивность известного вещества как бы переносят на новое соединение. Ожидают при этом, что биоактивность последнего окажется большей. Для лекарственных веществ типичным примером может служить модификация структуры пенициллинов и цефалоспоринов по указанным стрелками радикалам (R), что позволило получить многочисленные новые препараты с улучшенными антибиотическими свойствами. Другим ярким примером стала возможность химической модификации сульфаниламидов, которые кроме основного антибактериального действия имели побочный мочегонный эффект. В результате был создан новый класс сульфаниламидных диуретиков: 17 R2 HN пенициллины цефалоспорины SO2 R1 NH сульфаниламиды Указанный прием широко и с успехом используется и в настоящее время в синтезе многочисленных произвлдных практически всех классов лекарственных веществ. Типичным примером может служить модификация структуры природного пиретрина I (1). Систематический подход в постепенном изменении его структуры позволил получить несколько поколений синтетических пиретроидных инсектицидов. Первое поколение появилось после замены в спиртовой компоненте природного пиретрина I пентадиенильного фрагмента сначала на химически более устойчивый пропенильный (аллетрин, 2). Позднее была осуществлена более принципиальная «хирургическая» операция: вместо вырезанной циклопентеноновой части молекулы инсектицида провели химическую имплантацию 2-бензилфурилметильного блока (ресметрин, 3), а затем и его заменили на фенилоксбензильную группировку (фенотрин, 4). В результате появилось второе поколение синтетических пиретроидов с повышенной фотоустойчивостью. Следующим успешным этапом на пути химической модификации оказалось варьирование заместителей в циклопропильном кольце, наряду с введением цианогруппы в спиртовую компоненту. Это привело к появлению препаратов третьего (соединения 5) и четвертого (соединения 6 и 7) поколения. Появление следующего поколения инсектицидов, имеющих большую активность, более широкий спектр действия и повышенную устойчивость, также обязано аналоговому синтезу. Новизна их строения связана, во-первых, с раскрытием циклопропанового кольца (флуцитринат, 8), во-вторых, с переходом от сложных эфиров к простым (препараты 9). Затем упразднили диалкилоксидный спейсер, связывающий две арильные группировки, заменив его на алкен (вещество 10), и, наконец, ввели 18 атом кремния в диарилалкильную цепочку (силафлуофен 11): Me Me O C O O O Me Me C O Me O O CH2 C C (3) ресметрин R O CH Me O Hal Me (5) O Hal C CN O CH Me Me Me Me O C O CH CN 4-EtOC6H4 F2HC O O O C O CH CN Me O (6) фенпропатрин R = H, Hal = Cl, перметрин (амбуш); R = СN, Hal = Cl, циперметрин (цимбуш); R = СN, Hal = Br, дельтаметрин Me Me Me Me (4) фенотрин O CH2 O Me Me Me Me (2) синтетический инсектицид (+ _ ) аллетрин O CH2 Me O Me Me (1) природный инсектицид пиретрин-I O O Me Me Me C (7) циклопротрин F O C CH CH Me (10) OEt (8) флуцитринат Me EtO C CH2 O CH2 R1 R2 (9) O 1 2 3 R = R = Me, R = H, этофенпрокс; R1=СF3, R2= H, R 3= Cl, флуфенпрокс O R3 Me Si Me F O (11) силафлуофен Последние новые группы высокоэффективных пестицидов (8-11) имеют лишь отдаленное структурное сходство (соединения 8,9) или не имеют его вовсе (соединения 10,11) со своим природным родоначальником (1). Тем не 19 менее, все инсектициды обладают (1-11) близким механизмом физиологического контактного действия на насекомых, которое проявляется в блокировании передачи нервных импульсов. На этом примере синтезов пиретроидов принцип структурного сходства-разнообразия получил блестящее воплощение. 3.2. Принцип введения фармакофорной (токсофорной) группы известного физиологически активного вещества в молекулу нового вещества. Фармакофорным называют такой структурный элемент или фрагмент молекулы, который обеспечивает фармокологическую активность. Так, на основе азотистого иприта было получено семейство противораковых препаратов путем введения в различные вещества N,N-дихлордиэтиламинного или азиридинового фрагмента (например, сарколизин). В ряду пестицидов токсофорным называют такой структурный элемент, группировку или фрагмент молекулы, который обеспечивает токсическое действие данного вещества. К настоящему времени выявлен целый ряд токсофорных групп, введение которых в молекулу потенциального пестицида «прививает» ему нужную биоактивность. Например, наличие нитрофурильного фрагмента может обеспечить антибактериальне свойства молекулам (1). Введение фосфатной или тиофосфатной производного группировки (2) в молекулу инсектицидной способствует активности, а проявлению присутствие у остатка алкилкарбоновой кислоты может сообщить молекулам (3) ростстимулирующее действие. Разнообразные производные, содержащие мочевинную группу (4), ответственную за токсичность, используют в качестве гербицидов: O2N R O (1) бактерициды S R1 S P OR2 OR3 (2) инсектициды Ar (CH2)nCOOH (3) рострегуляторы O Ar N C NH R R (4) гербициды Объектами химического распознавания и последующего взаимодействия токсофорной группировки пестицида с живыми организмами на молекулярном уровне могут быть клеточные мембраны, биорецепторы, ферменты, 20 нуклеиновые кислоты, эндогенные регуляторные молекулы (нейромедиаторы, гормоны и т.п.). По-видимому, такие группировки-токсофоры имеют химическую структурную и стереоспецифичную комплементарность со структурными элементами биомишени. Вызывающее биоэффект взаимодействие между пестицидным веществом и его биорецептором или биоакцептором обеспечивается, как правило, за счет слабых связей – водородных (-О…H-N, -N…H-O, -S…H-N и т.д.), электростатических, ван-дерваальсовых (диполь-дипольных, стэкинговых), гидрофобных. 3.3. Принцип молекулярного моделирования Химическое моделирование новых молекул производится на основе знаний о структуре природных веществ, активных метаболитов, а также на основе данных о механизмах физиологического действия комплементарных им активных центрах биомишенией. Молекулярный дизайн (или графика) в сочетании с рентгеноструктурным анализом позволяет опознать структурные элементы и стереохимические особенности в проектируемой молекуле потенциального препарата, которые ответственны за проявление физиологической активности. Таковыми элементами могут оказаться участки с геометрической цис-, транс- (Z-, E-)изомерией, абсолютная конфигурация (R, S) хиральных атомов активного центра, степень конформационной подвижности скелетной части молекулы или же распределение зарядов и расстояние между ними в сильно поляризованных или цвиттер-ионных частях молекулы препарата и биорецепторного участка его захвата. Владение этими данными позволяет более целенаправленно проводить синтезы биоактивных молекул с заданными на молекулярном уровне параметрами. Основное достоинство рассматриваемого подхода по синтезу новых лекарственных средств и пестицидов заключается в возможности их конструирования из фрагментов, близких по структуре к биогенным. Такой подход приводит к значительному снижению риска образования опасных для человека и окружающей среды токсических веществ на различных этапах получения и применения 21 пестицидной молекулы. Этот метод был успешно использован в синтезе высокоэффективных анальгетиков – аналогов морфина, а также для получения ряда лекарственных веществ, действующих на центральную нервную систему подобно природному нейромедиатору γ–аминомасляной кислоте (фенигама и др.). В качестве примера наиболее успешного использования принципа молекулярного моделирования можно привести ранее рассмотренные синтезы пиретроидов (см. раздел 1, принцип химмодифицирования). Другим примером может служить так называемое биоизостерическое преобразование малодоступных природных инсектицидов (например, 1-3) в доступные синтетические инсектициды (4, 5): H OH 5 3' 2' 4 1 5' N 1' Me 3 S S 4' 2 (1) 3-(R), 4-(R), 2'-(R) гвианезин А; (2) 3-(R), 4-(R), 2'-(S) гвианезин В; (3) 3-(R), 4-(S), 2'-(R) гвианезин С (1-3) природные инсектициды 54 R 3 NMe2 (4) R = H, 3-(S)-изомер; (5) R = NMe2, 3-(S)-, 5-(R)-изомер S S 2 1 (4,5) синтетические инсектициды Биоизостерами называют вещества, имеющие одинаковые или очень близкие топологические (одно-, двух- и трехмерные) характеристики и обладающие одинаковым или очень близким типом, уровнем и механизмом биологического действия. Например, к биоизостерам можно отнести три гвианезиновых алкалоида (1-3), выделенных 15 лет назад из бразильского дерева Cassiopourea guianensis. Все они обладают сильным инсектицидным действием и по строению эти 3-пирролидил-1,2-дитиоланы имеют лишь отличие в абсолютной конфигурации трех асимметрических центров. Моделированием строения алкалоидов (1-3) были синтезированы биоизостеры, обладающие мощной инсектицидной полученные синтетические вещества активностью. (4 и 5) В по данном случае химическому и 22 стереохимическому строению дитиоланового кольца полностью отвечали требованиям биорецепторного распознавания и взаимодействия. Абсолютная конфигурация атома С-3, как оказалось, не играет роли в проявлении инсектицидной активности. 3.4. Стратегия пролекарств и пропестицидов Лекарственный или пестицидный препарат после введения растительный или животный организм сразу же подвергается в атаке ферментными системами, защищающими организм от чужеродных веществ (ксенобиотиков). Лекарственное вещество таким образом биодеградируется с образованием различных производных, называемых метаболитами, средства защиты растений – до ксенометаболитов. В ряде случаев, установлено, что не само введенное лекарственное (пестицидное) вещество (его в этом случае называют пролекарством или пропестицидом), а его метаболит оказывает лечебный эффект. Поэтому тщательное изучение метаболизма лекарственных и пестицидных веществ, синтез и биотестирование его метаболитов (ксенометаболитов) могут привести к созданию новых препаратов. На этой основе возникла идея заведомого синтеза пролекарства (пропестицида), которое само по себе не обладает лечебным (пестицидным) действием, но имеет такие структурные группировки, которые позволяют ему легко преодолевать в организме защитные барьеры и точно доставляться в больной орган или биомишень, где препарат метаболизируется и превращается в истинное лекарство (пестицид). Считается, что почти четвертая часть всех новых лекарственных веществ вводится в настоящее время в виде пролекарств. 23 O Me HN O R O CH2 O N3 1 R=CH3, кодеин 2 R=H, морфин 3 R=PO3Р, фосфатидил 4 R=H, азидотимидин Например, кодеин (1) оказывает обезболивающее действие благодаря превращению в организме в морфин. Азидомитидин (или AZT) – лекарство против СПИДа – вводится как пролекарство в виде фосфатидилпроизводного, фосфолипидная форма которого лучше проникает через липидные оболочки макрофагов и накапливается там же, где обычно концентрируются и вирусы иммунодефицита человека (ВИЧ). Это лекарство, гидролизуясь в макрофаге до довольно токсичного для организма человека азидотимидина (4), действует, таким образом, только на зараженные иммунные клетки. Так, при исследовании метаболизма нового инсектицида диафентиурона (5), эффективного против сосущих насекомых – клещей, белокрылок и тлей (вредителей хлопчатника и овощей), - было установлено, что одним из его метаболитов является карбодиимидное производное (6): Изучение его физиологической активности показало, что именно он, а не диафентиурон (5) является истинным инсектицидом, действующим как блокатор окислительного фосфорилирования и как ингибитор аденозинтрифосфатазы. Еще одним примером плодотворности принципа пропестицидов вкупе с принципом химической модификации является создание группы производных имидазола и триазола, которые применяются против глистных инфекций, вызываемых нематодами. Начало исследованию положило предположение о 24 том, что родоначальник будущей группы пестицидов синтетический препарат (7) тиазолидинового ряда является пропестицидом, т.к. он высокоактивен на овцах и домашних птицах, но не активен на крысах и мышах. В последнем случае, следовательно, не образуется метаболит с соответствующим биодействием. Вскоре удалось выделить из организмов овец и птиц, установить строение и синтезировать метаболит (8). Действительно это вещество оказалось высокоэффективным против гельминтов как у овец и птиц, так и при введении в организм мышей. Затем был получен тетрамизол (9), ставший промышленным антигельминтиком. При переходе от конденсированной системы тиазолидиноимидазолина (9) к тиазолилзамещенным бензимидазолам был выявлен высокоактивный препарат промышленного значения тиабендазол (10), обладающий двойным биодействием – противоглистным и фунгицидным, что позволяет использовать его в ветеринарии и для протравливания семян. Дальнейшие модификации строения позволили получить как антигельминтики например, фуродазол (11), так и фунгициды: фуберидазол (12) и трициклазол (13): 3.5. Концепция антиметаболитов Этот подход базируется на создании синтетического лекарственного или пестицидного вещества, структурно близкого к какому-либо естественному (эндогенному) метаболиту организма человека или растительного (животного) организма. Задача такого синтетического вещества, называемого антиметаболитом, состоит в подмене истинного метаболита в естественных биореакциях. Антиметаболиты должны быть способны лишь частично 25 выполнять в организме функции метаболитов. Являясь химическими имитаторами метаболитов, лекарственные вещества такого рода «обманывают» контролирующие ферментные системы, встраиваются в метаболическую схему и заменяют собой настоящий метаболит, например, в растущей цепочке ДНК и РНК. Подобный прием был успешно использован в синтезе противораковых веществ, а также для торможения роста и развития патогенных вирусов при создании ацикловира – высокоэффективного антигерпесного препарата. Создание препарата (1) вполне укладывается в рамки концепции антиметаболитов. Диниконазол (1) является системным фунгицидом широкого спектра действия. Из четырех возможных изомеров (геометрических E- и Z- по отношению к двойной связи и энантиомеров с абсолютной R- и Sконфигурацией) наибольшей активностью обладает дихлорфенил)-4,4-диметил-2-(1,2,4-триазол-1-ил)-1-пентен-3-ол. (R)-(E)-1-(2,4Он взаимодействует стехиометрически с цитохромными ферментами и нарушает биосинтез стероидов в патогенных грибах, конформационно имитируя фрагмент естественного метаболита – ланостерола. Последний является промежуточным продуктом синтеза эргостерола. В координации фунгицида с ферментами участвует неподеленная электронная пара атома азота в положении 4 имидазольного ядра фунгицида. Синтез фунгицида (1) основан на бромировании метилизобутилкетона (2) и последующем алкилировании бромкетоном (3) 1Н-1,2,4-триазола (4). Полученный кетон (5) затем обрабатывают 2,4-дихлорбензальдегидом и в образовавшемся промежуточном арилзамещенном олефине восстанавливают кетогруппу в спиртовую. Спирты (6) содержат четыре изомера, из которых кристаллизацией легко выделяют смесь (R,S)-E-изомеров (1). Из этой смеси (R)-E-энантиомер можно выделить, используя жидкостную хроматографию на иммобилизованной оптически активной фазе: 26 N O Me C CMe3 (2) 1. Cl O BrCH2 C CMe3 (3) Br2 Cl CHO N H K2CO3 (5) N OH Me3С С H Ar CMe3 HO CH C CHAr N N N N кристаллизация 2. NaBH4 N O (4) CH2 C CMe3 N N N HO C N N H H Ar H разделение энантиомеров N (1) фунгицид (R,S)-E (6) Me3C N (1) фунгицид (R)-E диниконазол Целевой синтез подобного типа можно осуществить только на основе детального знания микроорганизмах метаболических определенного путей вида. При и функций создании ферментов гербицида в или рострегулятора растения необходимо синтезировать вещества со специфичным для растительного обмена действием с высокой избирательностью по отдельным стадиям метаболизма. То же самое требование заложено и для веществ, активных в отношении насекомых и других животных организмов. Важной характеристикой антиметаболитов-инсектицидов должна быть нейтральность в отношении растений, для гербицидов антиметаболитного действия – их малая токсичность для теплокровных животных и т.д. Таким образом, знание путей транспорта в целых организмах, изучение распределения и судьбы пестицида в растительных и животных тканях и органах, анализ данных о его прохождении через мембраны внутрь клеточных структур, установление строения метаболитов, локализация участков взаимодействия пестицида и его активных метаболитов с рецепторами и другими активными местами их захвата – все это позволяет более целенаправленно проводить синтез и поиск новых эффективных пестицидов и рострегуляторов. Важной характеристикой синтетических антиметаболитов является то, что они обладают малой токсичностью и не оказывают нежелательных побочных эффектов благодаря высокой степени их узнаваемости системами 27 организмов, для которых эти лекарственные или пестицидные вещества структурно «выглядят» почти нечужеродными, биогенными. 3.6. Методология комбинаторной химии Этот принцип совмещения химии и биологии возник и стал быстро развиваться в 1990-х годах как часть общей стратегии открытия новых лекарственных и пестицидных веществ. Стратегия комбинаторной химии основана на недавней разработке нескольких революционных химических и биологических методов параллельного синтеза и испытания большого числа соединений. Была создана техника миниатюризации синтезов и биоиспытаний, позволяющая синтезировать в растворе или на твердых подложках от сотен до нескольких тысяч новых соединений в день и быстро их тестировать в виде смесей или после выделения индивидуальных веществ. В совокупности с автоматизацией синтез целых семейств (или «библиотек») веществ требует значительно меньших затрат реагентов при огромном росте производительности. В рамках комбинаторной химии сначала создается тематическая библиотека веществ с выявлением блока «хитов» - соединений с высоким уровнем биоактивности. Из нее затем формируют так называемую фокусированную библиотеку, позволяющую соединений. следующей стадии На сделать определяются выборку целевых соединения-лидеры, обладающие максимальной полезной биоактивностью. Лидерная группа в последствии дает соединения кандидаты в пестициды, а из кандидатов определяется вещество, внедряемое в производство и применяемое на практике. Типичным примером для лекарственных средств может служить синтез библиотеки антибактериальных 1,3-оксазолидин-2-онов (6), основанный на принципе защитных групп. Твердофазный синтез осуществляют одновременно в многочисленных миниатюрных реакционных ячейках, в которые помещают полимерные бусы или порошки (принцип «тысячи чайных мешочков») из ионообменной полистирольной смолы (1), имеющей активную группу (2), с которой могут взаимодействовать 1,2-диолы (3): 28 R=полистирол В каждую из таких реакционных ячеек добавляется свой изомерный диол и затем изомерный изоцианат (4). По окончании образования карбаматов (5) реакционную смесь в каждой ячейке обрабатывают основанием, регенерируя активную группу полимерной подложки (7) и смывая растворителем образовавшиеся при этом целевые оксазолидины (6). В результате параллельного выполнения многочисленных синтезов получают многие сотни производных 1,3-оксазолидинона, которые затем испытывают параллельно на подложке, содержащей соответствующее количество ячеек для тестов с бактериальным штаммом. 29 4. СВЯЗЬ СТРУКТУРА - БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ Химическое и пространственное строение вещества определяет наличие у него биоактивности. Однако ее уровень (эффективность действия) может в значительной степени зависеть от разнообразных факторов. Большинство лекарственных веществ должно обладать хорошей водорастворимостью, т.к.они переносятся в организме главным образом кровяным током, что благоприятствует созданию концентрации, достаточной для проявления фармакологического действия. Многие лекарственные вещества должны иметь хорошую липофильность и обладать способностью проникать через клеточные полупроницаемые мембраны, чтобы влиять на биохимические процессы метаболизма. Препараты, действующие на центральную нервную систему должны свободно переходить из крови в спинномозговую жидкость и мозг, т.е. преодолевать гемато-энцефалический барьер, который защищает мозговые функции от чужеродных веществ. Другим барьером для проникновения лекарственных веществ из крови к тканям органа-мишени является стенка капилляров. Для большинства лекарственных веществ не очень высокой молекулярной массы этот барьер преодолим. Существует еще один барьер плацентарный, отделяющий организм матери от плода. Он обычно легко проницаем для лекарственных веществ, поэтому отбор препаратов, предназначаемых беременным женщинам чрезвычайно строг. В целом лекарственная молекула кроме основной фармакофорной группировки, непосредственно отвечающей за терапевтический эффект, должна содержать гидрофильные и/или липофильные фрагменты (быть сбалансирована по ним), чтобы осуществлялся ее нормальный перенос к соответствующей системе организма. Для создания концентрации пестицида, достаточной для проявления необходимого уровня физиологического действия, его молекула кроме основной токсофорной группировки, непосредственно отвечающей за пестицидный 30 эффект, должна содержать гидрофильные и/или липофильные фрагменты (быть сбалансирована по ним), чтобы осуществлялся ее нормальный перенос к соответствующей системе организма. В случае растений пестицидное вещество должно обладать хорошим прохождением (за счет хорошей водорастворимости) по их сосудистым системам и проникновением через защитные барьеры тканей, в том числе и стенки капилляров и клеточные мембраны. В случае насекомых препараты, действующие на их нервную систему (нейротоксины), должны преодолевать барьеры, защищающие нервные ткани от чужеродных веществ. При дизайне пестицидных и регуляторных веществ стараются учитывать приведенные выше факторы, вводя соответствующие химические группировки в потенциально активные вещества. Так, введение в структуру фенольных группировок, карбоксильных, фосфатных или сульфогрупп, основного или аммонийного атома азота (четвертичная соль) улучшает водорастворимость органической молекулы пестицида, изменяет ее основность или кислотность, усиливает, как правило, ее биодействие. Наличие н-алкильных цепей, их удлинение, а также введение галогенов, наоборот, повышает липофильность пестицида (растворимость в жировых тканях), облегчает его прохождение через биомембраны. Разветвленные алкильные заместители и присутствие атомов галогенов затрудняет метаболизм (в частности биоокисление) пестицида. Циклоалкильные группировки могут улучшить связываемость с биорецептором за счет ван-дер-ваальсовых сил. Использование пестицидов с биоактивной спиртовой или карбоксильной группами в виде их сложных или простых эфиров изменяет полярность молекулы биологической активности и пестицида, улучшает профиль замедляет биодекарбоксилирование. Биологические системы при действии на них синтетических пестицидов часто не делают различия между веществами, в которых вместо, например, бензольного кольца присутствует пиридиновое, вместо фуранового - пиррольное или тиофеновое, т.е. замена одного плоского ядра на другое не сказывается существенным образом на полезном биодействии. Поэтому подобные замены могут составлять часть стратегии при дизайне синтетических 31 пестицидов для изменения полярности молекулы, введения различных заместителей в ароматическое кольцо (эта задача облегчается в случае замены бензольного ядра взаимодействия на π-избыточный гетероцикл), в целях усиления пестицида со специфическим рецептором и улучшения полезного действия препарата. Однако следует иметь в виду возможность изменения при этом и стабильности вещества. Следует отметить, что рассмотренные приемы генерирования и модификации биологической активности потенциального пестицида и регуляторного вещества не являются абсолютными и не всегда могут обеспечить желаемый уровень ожидаемого эффекта. При конструировании лекарственного препарата стараются учитывать приведенные выше факторы, вводя соответствующие химические группировки в потенциальное лекарственное вещество. Так, введение в структуру фенольных группировок, карбоксильных или сульфогрупп, основного или аммонийного атома азота (четвертичная соль) улучшает водорастворимость органической молекулы лекарственного вещества, изменяет ее основность или кислотность, усиливает, как правило, ее биодействие. Наличие н-алкильных цепей, их удлинение, а также введение галогенов, наоборот, повышает липофильность лекарственных веществ (растворимость в жировых тканях, которые могут служит лекарственным депо) и облегчает их прохождение через биомембраны. Разветвленные алкильные заместители и присутствие атомов галогенов затрудняет метаболизм (в частности, биоокисление) лекарственных веществ. Циклоалкильные группировки улучшают связываемость с биорецептором за счет ван-дер-ваальсовых сил. Использование лекарственных веществ с биоактивной спиртовой или карбоксильной группами в виде их сложных или простых эфиров изменяет полярность молекулы лекарственного вещества, улучшает профиль фармакологической активности и замедляет биодекарбоксилирование. Биологические системы при действии на них синтетических лекарственных веществ часто не делают различия между веществами, в которых вместо, например, бензольного кольца присутствует 32 пиридиновое, вместо фуранового - пиррольное или тиофеновое, т.е. замена одного плоского ядра на другое не сказывается существенным образом на полезном биодействии. Поэтому подобные замены могут составлять часть стратегии при дизайне синтетических лекарственных веществ для изменения полярности молекулы, введения различных заместителей в ароматическое кольцо (эта задача облегчается в случае замены бензольного ядра на πизбыточный гетероцикл), в целях усиления взаимодействия лекарственного вещества со специфическим рецептором и улучшения фармакологической картины действия препарата. Однако следует иметь в виду возможность изменения и стабильности лекарственного вещества. К настоящему времени выявлен целый ряд фармакофорных групп, введение которых в молекулу потенциального лекарственного вещества "прививает" ему нужную биоактивность. Например, наличие фенольной группировки может обеспечивать антисептические свойства веществу. Введение карбамидной функции способствует проявлению снотворного эффекта. Диарил(аминоалкил)метановая группировка ответственна за антигистаминное действие. Следует отметить, что рассмотренные приемы генерирования и модификации физиологической активности потенциального лекарственного вещества не являются абсолютными и часто не могут обеспечить ожидаемого эффекта. При конструировании нового физиологически активного соединения учитываются знания о зависимости структура-биоактивность у полученных ранее близких по строению рядах веществ с заданным видом биоактивности. Например, в ряду симметричных 1,3,5-триазинов (1), имеющих при С-2 и С-4 замещенные аминогруппы, прослеживается следующая зависимость биологической активности от природы заместителя R при С-2. Если R = Сl, то эти триазины обладают выраженными гербицидными свойствами. Если R = OH, то все триазины, независимо от строения заместителей Х и У, полностью теряют свойства гербицидов. 33 H X N N 6 1 H N H N Y 5 N 4 N 2 N3 R (12) гербициды 1 Сl N N R (13) фунгицид анилазин 2 Переход к R = OАlk вновь генерирует у триазинов гербицидную активность, но иной избирательности, чем в случае R = Сl. Группа R = SАlk имеет влияние аналогичное влиянию О-алкильной группы. Причем наибольшей активностью обладают триазины с -О- и –S-метильными заместителями. В случае –О- и –S-бензильных группировок гербицидное действие триазинов резко снижается, но при этом появляется выраженная фунгицидная активность. Триазины с Х = алкил при замене NH-Y- группы при С-4 на атом хлора сохраняют умеренный уровень гербицидных свойств, однако стабильность этих веществ резко падает. Если же Х = 2-хлорфенил, то гербицидная активность у такого вещества становится незначительной и уступает место фунгицидным свойствам. Причем уровень новой активности таков, что препарат (анилазин, 2) уже применяется в сельском хозяйстве против патогенов на картофеле и томатах. При создании новых лекарственных веществ или пестицидов, имеющих хиральные центры, следует иметь в виду, что различные энантиомеры могут обладать различным, и даже противоположным, биодействием. Выше уже приводился пример лекарственного вещества талидомида, (+)-R-изомер которого является хорошим транквилизатором и снотворным, а (-)-Sэнантиомер - оказался тератогеном (см. раздел 2.). В случаях хиральной зависимости биоактивности ассиметричесий центр в молекулах лекарственного вещества или пестицида должен ориентироваться тремя точками на хиральном участке биорецептора, чувствительном к ассиметрии препарата. При их «нормальном взаимодействии», т.е. комплементарном трехточечном контакте (W...W’, Y...Y’, Z...Z’, рис.1), проявляется ожидаемый полезный эффект. Второй же антипод оказывается 34 некомплементарен активному участку рецептора (правая часть рисунка, W...W’, Y...Y’, а Z не взаимодействует с Z’) и может иметь менее выраженный (или совсем не проявить) необходимый эффект или даже оказаться токсичным веществом. Так, установлено, что левовращающий энантиомер кокаина почти в два раза более активен в качестве местного анестетика и в четыре раза менее токсичен, чем его правовращающий оптический антипод. Очевидно, что требование двухточечного контакта физиологически активного вещества с рецептором снимает различия в биодействии оптических изомеров. В настоящее время среди поставляемых на фармацевтический рынок хиральных лекарственных веществ лишь 15% производится в виде индивидуальных стереоизомеров (остальные - в виде рацематов или диастереомеров). X X X (+) R (-) S Z Y W Y Y Z Z W W Y' Y' W' Z' рецептор Z' W' рецептор Рис.1. Трехконтактное взаимодействие энантиомеров с биорецептором: а) комплементарное; б) аномальное. В заключение этого раздела отметим некоторые современные приемы по пролонгированию действия лекарств. Обычно лекарственное средство состоит из собственно лекарственного вещества (активное начало) и компонентов лекарственной формы, используемых для удобства введения препарата в организм. Применяемые лекарственные формы включают порошки, таблетки, капсулы, мази, растворы. Поскольку большинство лекарственных веществ быстро подвергается метаболизму и до биомишени порой достигает лишь десятая доля введенного препарата, постоянно ведутся работы по созданию таких лекарственных форм, которые обеспечивали бы длительную и равномерную подачу лекарственного вещества в кровоток и к больному органу. 35 В одном из новых эффективных направлений используются биосовместимые полимерные материалы, к которым привито (присоединено) лекарственное вещество. Введение лекарственного вещества на полимере-носителе улучшает фармакокинетические и фармакодинамические свойства препарата, значительно пролонгируя его действие и позволяя контролировать его подачу в организм благодаря замедленной диффузии лекарства из места введения. Так, за счет комплексообразования поли-N-винилпирролидона с некоторыми антибиотиками созданы пролонгированные формы последних. В накожных терапевтических системах используют замедленную диффузию лекарственного вещества из раствора, расположенного между наружной непроницаемой мембраной и внутренней, медленно проницаемой микропористой мембраной, изготовленной из эфиров целлюлозы или полипропилена. Такая система, например, применяется успокаивающего средства для длительной при морской подачи или противорвотного воздушной болезни и - противоукачивающего средства скополамина: H H H HH O скополамин тринитроглицерин 5 прогестерон На основе растворов тринитроглицерина в сополимере 2-гидроксиэтановой и 2-гидроксипропановой кислот получено новое средство от стенокардии "тринитролонг", прикрепляемое к десне и действующее в течение четырех часов. Подобные макромолекулярные системы с растворенными в них (или суспендированными) лекарственными веществами начинают широко применяться и в гинекологической и стоматологической практике. Например, стероидный контрацептив прогестерон (природный гормон) в твердом биосовместимом полимере полидиметилсилоксановом каучуке помещают в полости организма (прикрепляется к матке), что обеспечивает в течение года 36 предупреждение нежелательной беременности. Поскольку этот гормон очень быстро разлагается при приеме внутрь, ранее использовались его более стабильные, но и более токсичные гидроксипроизводные. 37 5. ПРИНЦИПИАЛЬНАЯ СХЕМА РАЗРАБОТКИ НОВОГО ЛЕКАРСТВЕННОГО ИЛИ ПЕСТИЦИДНОГО ВЕЩЕСТВА Путь лекарственного средства или пестицидного вещества от замысла синтетика до выпуска готовой формы препарата и его сложен, трудоемок и долог. Причем суммарные затраты при этом могут достигать многих десятков и даже сотен миллионов долларов. Схема разработки нового пестицидного или регуляторного препарата, необходимость в котором диктуется потребностями рынка пестицидов, включает следующие стадии (см. рис. 2). На первой стадии проводится умозрительный или машинный перебор химических структур и выбор базового потенциально активного оригинального препарата или генерика – вещества, ранее защищенного патентом, действие которого узаконено. На этой стадии создается замысел, что синтезировать, зачем и как. Производится анализ информации о наличии разнородных элементов, групп атомов, функциональных группировок, типах связей между ними, электронном строении, пространственном расположении. Совокупность этих данных может сообщить строению целевого вещества ожидаемый потенциал свойств, включая, прежде всего биологическую активность, подобно тому, как фраза, составленная из букв, слов и связок слов, получает смысловое звучание. Уже на этой стадии делается предварительная оценка доступности и стоимости исходных реагентов, их токсичности. В разработке целевых структур участвуют специалисты по органическому синтезу, химии природных и синтетических биологически активных соединений. Они же осуществляют и вторую стадию, которая заключается в выборе и лабораторной разработке методов и путей синтеза промежуточных веществ и целевого соединения, его близких структурных аналогов, их отборе по надлежащей устойчивости, простоте получения, выходу, растворимости и т.п. Делается предварительная оценка технико-экономических показателей, которая и диктует выбор пути синтеза с наименьшим числом стадий, наименьшими затратами труда, времени, энергии и наибольшей безопасностью всех операций. 38 Биотестирование на третьей ступени схемы - главное сито, на котором отбраковывается основная масса неактивных и малоактивных синтезированных соединений, и остаются для продолжения углубленных испытаний наиболее перспективные вещества, обладающие высокой целевой биологической активностью и не проявляющие при этом высокой острой токсичности и других побочных эффектов в отношении человека и полезных животных. Наиболее ответственной является четвертая стадия – клинические испытания на людях, на которой подтверждается высокая лечебная эффективность лекарственного вещества и выясняется наличие или отсутствие неблагоприятных побочных эффектов при лечении больных или тепличные, полевые и другие производственные испытания, в ходе которых подтверждается высокая пестицидная или рострегуляторная эффективность разрабатываемого вещества и выясняется наличие или отсутствие неблагоприятных воздействий на окружающую среду – на теплокровных животных, рыб и других полезных растительных, почвенных и водно-обитающих организмов. Изучается метаболизм выделившихся препаратов, выясняется строение и биоактивность их метаболитов. Определяется субхроническая токсичность – мутагенность, канцерогенность, тератогенность, аллергенность и другие свойства пестицида и его метаболитов. Изучается персистентость пестицида в растениях, почве, воде, его кумулятивные свойства (накопление остатков пестицида в продуктах питания: молоке, мясе, рыбе и т.п.). Только на крысах токсичность препарата изучается не менее, чем на трех поколениях и в течение двух лет. Третий и четвертый этапы наиболее длительны и занимают 2-3 года, а всего новый препарат проходит около 100 испытаний. Из 10-15 тысяч исследованных соединений на регистрацию и патентование поступает одно-два вещества. Основными действующими лицами на третьем и четвертом этапах являются биологи, токсикологи и агрохимики. 39 Скриниг, др. биотесты 3 Клинические/полевые испытания. Регистрация препарата 4 Лабораторный синтез 2 Масштабирование, промышленная технология 5 Замысел 1 Новый замысел 9 Реклама и продажа препарата на рынке 8 Производство готовых форм 7 Валидация и сертификация субстанций 6 Рис. 2. Общая схема разработки лекарственного или пестицидного препарата. В случае положительных государственных испытаний пестицидное вещество получает официальный статус (регистрируется) и передается на разработку технологии его синтеза – масштабирования лабораторной установки, создания пилотной установки и, наконец, промышленной установки. В разработке промышленного синтеза заключается пятая стадия, которая является самой материалоемкой, трудоемкой и энергоемкой. Осуществлением этой стадии занимаются технологи, инженеры, химики, физико-химики и экономисты. Получаемая на производстве субстанция поступает на шестую стадию – стадию государственной валидации и сертификации, где ей придается статус полного соответствия современным требованиям, и таким образом, данный препарат получает разрешение на его широкое использование в сельском хозяйстве и быту. На седьмой стадии изучаются и создаются наиболее приемлемые формы применения препарата. 40 С заводского производства лекарственное или пестицидное вещество поступает в продажу (стадия 8). В заключение раздела следует подчеркнуть, что по некоторым оценкам на научные разработки тратится 15-20% от общих затрат, на скрининг, углубленные и полевые испытания – около 20%, на изучение метаболизма, токсичности и экологичности от 20 до 30%, на отработку технологии и производства примерно 20-25%. Остальные затраты идут на регистрацию и маркетинг. Приведенное соотношение затрат остается достаточно выгодным, несмотря на то, что прибыль начинают получать только на десятыйдвенадцатый год от начала исследований. Считается, что на каждый доллар инвестиций в производство препарата получают несколько долларов прибыли. 41 6. КЛАССИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ Существует три основных типа классификации лекарственных веществ: 1) по медицинскому назначению; 2) по источникам получения; 3) по химическому строению. По лечебному действию лекарственные вещества подразделяют на три группы - химиотерапевтическую, нейрофармакологическую и регуляторную. К химиотерапевтическим относят противоинфекционные лекарственные вещества, действующие на паразитические антимикробные (антибиотики, антималярийные, фунгицидные, организмы: антисептики), антивирусные, антитуберкулезные, противоопухолевые, антигельминтные препараты. В нейрофармакологической группе различают лекарственные вещества, действующие на центральную нервную систему (наркотические обезболивающие средства, снотворные и другие психотропные препараты); и действующие на периферийную нервную систему (например, местные анестетики). Отметим, классифицировала что всемирная психотропные организация лекарственные здравоохранения вещества центрального действия по специфичности их воздействия на различные психозы следующим образом: нейролептики (или большие транквилизаторы) - вещества, которые успокаивают, напряженность, уменьшая реакции чувство страха, на внешнее агрессивность, возбуждение, бред, снимают галлюцинации; седативные средства (или малые транквилизаторы) - препараты, которые также уменьшают напряженность, страх и тревогу, но в отличие от нейролептиков не проявляют антипсихотического эффекта; антидепрессанты - вещества, которые снимают угнетенные состояния (депрессии); психостимуляторы - вещества, которые стимулируют функции головного мозга, психическую и физическую деятельность. 42 Группа регуляторных лекарственных веществ включает витамины, гормоны, метаболиты и антиметаболиты (вещества, регулирующие активность ферментных, гормональных, иммунных и генных систем). По источникам синтетические получения лекарственные вещества делят (составляют около 70% на от всех лекарственных веществ), полусинтетические (получают из природных веществ путем их химической модификации, например, антибиотики цефалоспоринового и пенициллинового ряда) и природные (например, алкалоиды, витамины, гормональные вещества и др.). По химическому строению лекарственные вещества разделяют на неорганические (соли, оксиды, комплексные соединения), органические синтетические производные алифатического, алициклического, ароматического и гетероциклического ряда (внутри каждого ряда лекарственные вещества подразделяют на группы, основываясь на наличии тех или иных функциональных групп и заместителей), органические природные соединения (алкалоиды, антибиотики, гормоны, витамины, гликозиды и др.). [1] Существует три основных типа классификации пестицидных, лечебных и регуляторных веществ: 1) по назначению (объектам действия); 2) по источникам получения; 3) по химическому строению. По объектам действия пестицидные вещества подразделяют на 4 группы: 1.1) вещества, действующие на растения; 1.2) вещества, воздействующие на насекомых; 1.3) препараты, действующие на микроорганизмы; 1.4) соединения, активные против вредных теплокровных животных.[1-3] К ВЕЩЕСТВАМ, ДЕЙСТВУЮЩИМ НА РАСТЕНИЯ ОТНОСЯТСЯ: • гербициды (лат. герба – трава, цедере – убивать) – препараты, уничтожающие наземные сорняки; • альгициды (лат. альга – водоросль) – препараты для борьбы с вредной водной растительностью; • арборициды (лат. арбор – дерево) – соединения для уничтожения вредных кустарников и деревьев; 43 • регуляторы роста и развития растений – вещества, стимулирующие рост, ускоряющие и синхронизирующие цветение и созревание плодов, увеличивающие морозостойкость и урожайность культурных растений; • ретарданты (лат. ретардацио – задержка) – вещества, замедляющие рост растений в высоту, используемые в борьбе с их полеганием; • дефолианты (лат. фолиум –лист) – вещества, под действием которых растение сбрасывает листву; • десиканты (лат. десиккаре – высушивать) – вещества, приводящие к подсушиванию растений; как и в случае дефолиантов эти вещества используют для облегчения механического сбора хлопка и плодов различных культур; • гербицидные антидоты (греч. антидотон – противоядие) – вещества, обезвреживающие токсическое для культурных растений действие гербицидов; • гаметоциды (греч. гаметес – супруг) – вещества, стерилизующие главным образом мужскую пыльцу растений (применяют при гибридизации растений). К ВЕЩЕСТВАМ, ВОЗДЕЙСТВУЮЩИМ НА НАСЕКОМЫХ ОТНОСЯТСЯ: • инсектициды (лат. инсектум – насекомое) – вещества для уничтожения насекомых; • акарициды (греч. акари – клещ, жук) – вещества против вредных жуков и клещей; • афициды (лат. афис – тля) – вещества для борьбы с тлей; • овициды (лат. овум – яйцо) – вещества для борьбы с насекомыми на стадии яиц; • ларвициды (лат. ларва – личинка) – вещества, убивающие насекомых на стадии личинок; • антигельминтики (греч. гельминтос – глисты, черви) – вещества для борьбы с паразитирующими на растениях и животных червями; • нематоциды (греч. нема – нить; лат. нематодес – круглые черви) – вещества, используемые против нематод – круглых почвенных червей; 44 • моллюскоциды (лат. моллюскус – мягкотелый) или лимациды (лат. лимакс – слизень, улитка) – вещества для борьбы с моллюсками и улитками; • антифоулинги (англ. фоул – обросший водорослями и ракушками) – препараты, используемые для защиты изделий, корпусов кораблей от обрастания их поверхностей гидробионтами (слизнями, ракушками, водорослями); • репелленты (лат. репелленс – отталкивающий) – вещества для отпугивания вредных насекомых от растений, животных, человека; • аттрактанты (лат. аттрахере – привлекать) – вещества для привлечения насекомых в ловушку; • феромоны (греч. феромао – возбуждаю) вещества экстрагормонального типа, выделяемые в атмосферу насекомыми одного вида в качестве сигналов следа, пищи, агрегации, спаривания и т.п.; используют в сельском хозяйстве для привлечения вредных насекомых в ловушки и их последующей обработки инсектицидами; • афиданты (антифиданты, антифидинги) (англ. фид – питать) – вещества, уменьшающие аппетит у вредных насекомых или совсем отпугивающие их от пищи; • стерилизаторы (лат. стерилис – бесплодный) – вещества, действующие на половую систему вредных насекомых и предотвращающие таким образом их размножение, что сокращает численность популяции. К ПЕСТИЦИДНЫМ ВЕЩЕСТВАМ, ДЕЙСТВУЮЩИМ НА ВРЕДНЫЕ МИКРООРГАНИЗМЫ ОТНОСЯТСЯ: • гермициды (лат. гермен – зародыш) - вещества, уничтожающие все виды микроорганизмов; • фунгициды и фунгистатики (лат. фунгус – гриб) – вещества для борьбы с болезнетворными грибами и плесенью (уничтожают грибы или подавляют развитие спор и мицелия); 45 • бактерициды и бактериостатики – вещества для уничтожения или прекращения размножения патогенных бактерий; • антисептики (греч. сепсис – гниение) – вещества, используемые для защиты • неметаллических материалов (изделий из древесины, ткани и т.п.); • протравители семян – вещества, применяемые для защиты семенного фонда от грибковых и бактериальных заболеваний, а также от вредителей растений. К ВЕЩЕСТВАМ, ДЕЙСТВУЮЩИМ НА ВРЕДНЫХ ЖИВОТНЫХ ОТНОСЯТСЯ: • ратициды (фр. рат – крыса) – вещества против крыс и мышей; • родентициды (лат. роденс – грызущий) – вещества для борьбы с вредными грызунами; • ихтиоциды (греч. ихтиос – рыба) – вещества, применяемые против сорной рыбы; • авициды (лат. авис – птица) – вещества для борьбы с дикими птицами (например, для их отпугивания с аэродромов, скоростных дорог и т.п.); • зооциды (греч. зоон – животное) – вещества для борьбы с теплокровными и позвоночными животными; • антикоагулянты (лат. коагуляцио – свертывание, сгущение) – вещества, снижающие нормальную свертываемость крови (при ранении теплокровные погибают от кровотечения). Вещества пестицидного действия подразделяются также по уровню их острой токсичности (сильные яды - вещества с ЛД50< 50 мг/кг, с ЛД50 от 50 до 200 мг/кг – высокоопасные, с ЛД50 от 200 до 1000 мг/кг – умеренноопасные и с ЛД50>1000 мг/кг – малоопасные), по персистентости (устойчивости в почве, на земле, в воде и атмосфере – до трех, шести, девяти месяцев, до года, до полутора и более лет), по способам и характеру действия (сплошного или избирательного действия, семянного, контактного, корневого или системного 46 действия, кишечного, кожно-покровного действия или действия через дыхательные пути, убивающего, защитного или лечащего действия). По источникам получения пестицидные и регуляторные вещества делят на синтетические, полусинтетические, которые получают из природных веществ путем их химической модификации (например, некоторые пиретроидные инсектициды), и природные, например, феромоны, витамины, фитогормоны. По химическому строению пестицидные вещества разделяют на неорганические (сера, соли, кислоты), органические природные соединения (пиретрины, фитогормоны, синтетические феромоны, производные витамины алифатического, и др.), органические ароматического и гетероциклического рядов. Внутри каждого ряда органических веществ пестициды подразделяют на группы, основываясь на наличии тех или иных функциональных групп и заместителей [3]. 47 7. ОСНОВНЫЕ КЛАССЫ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛОВ И ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ И СРЕДСТВ ЗАЩИТЫ РАСТЕНИЙ Вещества, содержащие гетероциклические фрагменты, занимают ведущее положение в общем арсенале лекарственных препаратов, пестицидных и регуляторных веществ., используемых для защиты, лечения и регуляции роста и развития растений и животных. Структура биологически активных гетероциклических веществ выглядит обычно намного сложнее, чем у негетероциклических [1,3]. 7.1. Препараты, содержащие трех- и четырехчленные циклы 7.1.1. Вещества, содержащие трехчленные циклы: группа азиридина Незамещенный азиридин обладает мутагенным и канцерогенным действием и используется для моделирования раковых заболеваний на опытных животных при изучении метаболизма лекарственных веществ и поиске новых препаратов. Два противоопухолевых препарата, соответственно, этоксен (1) и третамин (ТЭМ, триэтиленмеламин, 2). На основе азиридина и производных фосфорной кислоты был получен большой ряд амидов, нашедших клиническое применение при лечении различных форм рака. Так, тиофосфамид (3) используют для лечения опухоли яичника, рака молочной железы и шейки матки. Препарат дипин (4) рекомендуется при лимфолейкозах и раке гортани. 48 7.1.2. Вещества, содержащие трехчленные циклы: группа азетидина Многие виды микроорганизмов выделяют вещества, которые ограничивают рост или убивают микроорганизмы других видов. Эти вещества, названные антибиотиками, могут быть также и продуктами жизнедеятельности высших растений и животных, и являются как бы химическими средствами защиты. Их история начинается с первого наблюдения гибели стафилококковых бактерий при контакте с зеленой плесенью Penicillium и последующего выделения из нее "действующего начала" - пенициллина. Оказалось, однако, что именно азетидиновый цикл является ответственным за антибиотическое действие не только пенициллина, но и целого ряда других, открытых много позднее групп природных и полусинтетических антибиотиков: Нокардицины монобактамы карбапанемы Эра пенициллиновых антибиотиков началась с открытия в 1929 году антимикробных свойств у плесневого почвенного гриба Penicillium notatum, который предотвращал рост микроорганизмов Staphylococus, и выделения из него действующего "начала" - индивидуального соединения, названного пенициллином (8). Из нескольких известных в настоящее время природных пенициллинов наиболее широкое применение получил самый дешевый и низкотоксичный бензилпенициллин. Отличаются пенициллины строением радикалов при 6-аминогруппе. Все они проявляют бактерицидную активность главным образом на грамположительных бактериях: стрептококках, стафилококках, пневмококках и др., ингибируя в них биосинтез белков клеточных стенок, особенно на последней стадии - поперечной сшивки белков. 49 COOH C NH O HO O N S O COOH N N N N Me 10 Применяют пенициллины для лечения пневмоний, ангины, туберкулеза, дизентерии, раневых и гнойных инфекций и других заболеваний. Не так давно был создан антибиотик мециллинам (9), который оказался активным против грамотрицательных бактерий и эффективно используется для подавления инфекций мочевыводящих путей, особенно вызванных Escherichia coli. На основе природного соединения – клавуроновой кислоты – посредством ее модификации был синтезирован сильный антибиотик третьего поколения моксалактам (10). Он обладает длительным антибиотическим действием, устойчив к лактамазам и низкотоксичен. 7. 2. Препараты на основе пятичленных гетероциклов 7.2.1. Производные пирролидина, пиррола и индола Производные пиррола занимают особое место в ряду биологически важных соединений. Достаточно сказать, что основу витамина В12, а также пигментов жизни" - гемоглобина, хлорофилла, цитохрома - составляют порфириновые тетрапиррольные макроциклы. Среди синтетических производных пирролидина выделяются две группы биологически лекарственные активных веществ: средства. В психотропные настоящее время и антигипертензивные пользуются большой популярностью ноотропные препараты (noos - мышление, tropos - сродство). Некоторые из них являются безрецептурными и широко используются для улучшения интегративных функций мозга, памяти, внимания и обучаемости. Первым из этой группы психотропных препаратов стал пирацетам (ноотропил, 1). Пирацетам применяют и при лечении больных, перенесших черепно-мозговую травму, инсульт, атеросклеротическое поражение сосудов мозга у старых людей, при умственной отсталости у детей. При острой 50 почечной недостаточности и беременности он противопоказан. Для препаратов группы пирацетама характерна краткость действия из-за быстрого метаболизма ферментами и кислотами в крови и желудке пирацетам оксирацетам O N CH CH2 (OH при С-4) этирацетам n 2 анирацетам Поли-N-винилпирролидон (2) поли-N-винилпирролидон нашел применение в качестве плазмозаменителя крови, для выведения токсичных веществ из организма и пролонгирования действия лекарств (за счет образования комплексов с биологически активными веществами). Из производных пирролидина выделяются два лекарственных вещества, вошедшие в практику в качестве антигипертензивных (сердечно-сосудистых) средств в 1980-х годах - это каптоприл (3) и эналаприл (4). каптоприл эналаприл Среди индолов имеются многочисленные биологически активные производные - природная аминокислота триптофан (5), биогенные амины (медиатор ЦНС серотонин (6), гормон мелатонин (7), синтетическое лекарственное вещество (мексамин, 8). Серотонин применяют для лечения геморрагических синдромов (от тромбозов), так как он укорачивает время кровотечения, являясь гемостатиком. Индометацин (9), является активным противовоспалительным средством 51 (применяют против ревматизма, подагрического артрита и др. воспалительных заболеваниях). Оно также обладает ненаркотическим анальгетическим действием и ингибирует биосинтез простагландинов. В качестве примера лекарственного вещества индольного ряда с более сложным строением бензоиндолизиновый и относится атипрозин пиперазиновый (10), содержащий фрагменты. Считают, что этот антигипертензивный агент является антагонистом адренэргических рецепторов (он блокирует их активность). Среди производных пиррола и индола известно небольшое число соединений по сравнению с лекарствами, которые проявляют промышленно значимый уровень пестицидной активности. Дигидропроизводное пиррола – флуромид (11) – обладает высокой фунгицидной активностью, его применяют на цитрусовых и других плодовых культурах. Фталофос (фосмет, 12) является кишечным и контактным ядом для широкого круга насекомых, включая колорадского жука. Еще одним представителем изоиндолинов является фунгицид плондрел (13). Главным природным ростовым гормоном считается 3-индолилуксусная кислота (гетероауксин, ИУК, 14). На практике ИУК (14) широко используют для укоренения черенков при вегетативном размножении плодово-ягодных культур, декоративных, древесных и кустарниковых растений, а также для ускорения созревания плодов и получения бескосточковых плодов. 52 Синтетическим путем получен его гомолог, устойчивый к действию света – ризопон (15). Он оказывает аналогичное ИУК действие на корнеобразование различных культур. Кроме того он увеличивает выход семян кормовых трав. Среди лекарственных средств есть примеры соединений с тетрапиррольной основой, макроциклы - фототоксичные сенсибилизаторы, с помощью которых были успешно вылечены многие тысячи раковых больных. Гематопорфирины (16) –сенсибилизаторы первого поколения, ко второму поколению относятся индивидуальные вещества - бензопорфирины, фталоцианианы и нафталоцианины (17). 7.2.2. Произодные имидазола Среди полностью и частично восстановленных производных имидазола имидазолидинов или имидазолинов, найдены как фунгициды, так и гербицидные препараты. В то же время производные ароматического имидазола и бензимидазола обладают, главным образом, фунгицидным действием. Фунгицид ровраль (18) используют на плантациях виноградника и плодовых культур, а также для защиты овощей, картофеля, зерновых и цветочных культур. 53 гербицид имазаметабенз (ассерт, смесь изомеров с R=4-Me и гербицид имазапир R=5-Me) Высокая гербицидная активность против сорняков типа овсюга в посевах злаков обнаружена у группы производных имидазолин-5-она, в частности, у препаратов имаза-метабенза (ассерт, 19) и имазапира (20) (последний используют в основном для очистных работ). Производные бензимидазола также нашли применение в качестве рострегуляторов и фунгицидов. Так, фарбизол (21) повышает урожайность картофеля, а бензимидазол (дифосет, 22) увеличивает устойчивость к стрессам и урожайность моркови, свеклы, огурцов, улучшая к тому же их пищевые качества. рострегулятор фарбизол рострегулятор дифосет препарат циметидин В ряду лекарственных средств на основе имидазола важное по значимости место занимает такой препарат, как циметидин (23), который успешно используется при лечении язвенной болезни желудка и 12-перстной кишки. 7.2.3. Произодные пиразола К производным пиразола относятся широко известные препараты, в основном анальгетического действия: антипирин (24), амидопирин (25), анальгин (26), бутадион (27). 54 Антипирин (24) оказывает болеутоляющее, жаропонижающее и в той или иной степени противовоспалительное действие. Небольшое изменение в молекуле 1 (замена метильного радикала на диметиламиногруппу) дала более сильное средство, обезболивающим, амидопирин Анальгин (25). жаропонижающим и слабым (26) также обладает противовоспалительным действием. Бутадион (27) - средство, применяемое местно при суставных и мышечных болях, относится к нестероидным противовоспалительным препаратам. В сельском хозяйстве применяют такие производные пиразола как, например, гербицид авенж (дифензокват, 28), который применяют для борьбы с сорняками, препарат релиз (29) , используемый для более эффективного сбора плодов цитрусовых. Производное 5-гидроксипиразола (30) используется в качестве гербицида, препятствует биосинтезу хлорофилла. Фенпироксимат (31) применяется в качестве инсектицида против клещей, он подавляет у личинок процесс линьки, а у взрослых особей приводит к нокдаун-эффекту. авенж релиз пайсер фенпироксимат Среди пиразолкарбоновых кислот в последнее время обнаружены инсектоакарициды. Тебуфенпирад (32) обладает системной токсичностью против ряда растительноядных клещей, аналог пиразолкарбоновых кислот финпронил (33) – препарат нового поколения, используемый как протравитель семян и почвенный инсектицид. 55 O S CF3 NC N NH2 N Cl Cl 33 CF3 7.2.4. Произодные триазола Замещенные 1,2,3-триазолы до сих пор не нашли практического применения. Однако в этом ряду ведутся интенсивные поиски пестицидов и недавно установлено, что 1,2,3-триазолы (34а) обладают сильной афицидной (противомольной) активностью. Обнаруженоно, что они являются проафицидами, так как на свету и в организме тлей эти вещества превращаются в истинные инсектициды-диарилазиридины (34b). Большую группу промышленных пестицидов сосотавляют производные 1,2,4-триазолов. Во второй половине прошлого века аминотриазол (35) под торговым названием «амитрол» широко применялся в качестве неселективного гербицида [21,22]. В связи с канцерогенностью амитрол в настоящее время используется для обработки плантаций непищевых растений и борьбы с сорняками после уборки урожая. По меньшей мере три представителя 1,2,4-триазоло[1,5а]пиримидинов – Flumetsulam (36a), Metosulam (36b) и Pyroxsulam (36c) являются ингибиторами ацетолацетатсинтазы и применяются в сельском хозяйстве в качестве гербицидов нового поколения для защиты посевов пшеницы, соевых бобов, риса, табака и кукурузы. 56 В 2009 г. компанией BASF зарегистрирован новый фунгицид под названием Initium® (синоним Ametocradin, 37), который в настоящее время получил разрешение к применению в ряде европейских стран и может использоваться для защиты винограда, картофеля, томатов и других сельскохозяйственных культур от заболеваний, вызываемых оомицетами, например Plasmopara viticola, Phytophthora infestans . Исследования в области поиска новых пестицидов на основе 1,2,4-триазоло[1,5-a]пиримидина в последние годы ведутся очень интенсивно. Триазоло[1,5-a]-1,3,5-триазины также неоднократно предлагались к использованию в качестве гербицидов. Паклобутразол (38) используют в качестве ретарданта для уменьшения полегания льна и риса, он также способствует увеличению урожайности, регуляции роста декоративных культур и газонных трав. Кроме того, этот триазол обладает фунгицидной активностью. Аналогичную бинарную активность имеют препараты (39-41), отличающиеся от предшественника наличием двойной связи в алкильном заместителе. Униконазол 3 – ретардант в борьбе против полегания риса, а также используется для увелечения цветения горшечных растений и выведения декоративных форм. 38 паклобутразол 39-41 ретарданты и фунгициды 39 R= C6H4Cl-4, униконазол 40 R= C6H3Cl2-2,5, диниконазол 41 R= , баронет (триапентенол) Близкую структурную аналогию с пестицидом 35 имеет ряд производных 57 (например, байлетон 42 и байтан 43). Подобная вариация структуры привела к тому, что препараты 42 и 43 обладают большей фунгицидной активностью широкого спектра, они занимают ведущее место среди системных фунгицидов. Байлетон (42) применяют для защиты злаковых, овощных и плодовых культур от ржавчины и мучнистой росы. Его восстановленный аналог байтан (43) является протравителем семян различных культур. Аминопроизводное 1,2,4-триазола 44 – фунгицид вепсин – используют для борьбы с мучнистой росой. Трициклическое соединение, имеющее в своей структуре фрагмент триазольного кольца (трициклазол 45) задействовано в сельском хозяйстве в качестве системного фунгицида против грибкового заболевания риса. Возможности применения С-амино-1,2,4-триазолов и их производных в медицине очень разнообразны. Например, действующим веществом популярного кардиотоника и вазодилатора «трапидил» (синоним «рокорнал»), является триазолопиримидин 46 , получаемый в три стадии из аминотриазола 35. Не так давно было установлено, что «трапидил» обладает антипролиферационным действием. Это послужило толчком для исследования противораковых свойств других производных 1,2,4-триазоло[1,5-а]пиримидина, среди которых большой интерес вызывали комплексы триазоло[1,5- a]пиримидинов с платиной и серебром. Платиновые и рутениевые комплексы 1,2,4-триазоло[1,5-а]пиримидинов обладают также выраженными противопротозойными свойствами [379-380]. 7-Ариламино-1,2,4-триазоло[1,558 а]пиримидины проявляют высокую противомалярийную активность, а 6-нитро1,2,4-триазоло[1,5-а]пиримидины - высокую антимикробную активность в отношении Staphylococcus противогрибковую в aureus, отношении Bacillus Candida cereus, Proteus albicans. vulgaris Кроме и того, триазолопиримидины оказывают противовирусное действие (Herpess implex I, вирусы классической чумы птиц и везикулярного стоматита), а соединения 47 находятся в стадии клинических испытаний лечения вируса гепатита С. Соединение 48 является перспективным препаратом для лечения болезни Альцгеймера, а 7-феноксиметил-1,2,4-триазоло[1,5-а]пиримидин 49 предлагается в качестве антиконвульсанта и препарата для лечения мигрени. Некоторые 1,2,4-триазоло[1,5-а]пиримидины также проявляют выраженную иммуносупрессивную и противодиабетическую активности. Соединение 50 – Essramycin, первый представитель 1,2,4-триазола, обнаруженный в природе – первоначально считалось сильным антибиотиком. Однако позже выяснилось, что его антибактериальная активность, по-видимому, была вызвана примесями в природном препарате. Некоторые 1,2,4-триазоло[1,5-a]триазины, получаемые на основе АТ, являются селективными ингибиторами А2а аденозиновых рецепторов и могут найти применение для лечения болезней Альцгеймера и Паркинсона. В настоящее время неаннелированные АТ также интенсивно исследуются в качестве потенциальных лекарственных препаратов. Например, соединение 51 (ингибитор HMG-CoA редуктазы) прошло клинические испытания и предложено в качестве нового эффективного препарата (BMS-644950) для лечения гиперхолестеринемии. Высокую активность по отношению к сердечнососудистой системе также проявляют триазолы 52 и 53. 59 Некоторые 5-алкиламино- и 5-ариламино-1-(2,3-дихлорфенил)-1,2,4- триазолы (например 54) являются антагонистами Р2Х7 рецепторов и потенциальными Алкиламино- препаратами и для лечения ревматоидного диалкиламино-1,2,4-триазолы артрита. рассматриваются как перспективные кандидаты для создания препаратов терапии астмы. В результате биологического скрининга in vitro обнаружено, что соединение 55 является нетоксичным и высокоэффективным ингибитором ATM киназы и может использоваться для увеличения чувствительности раковых клеток к радиационной запатентованы например терапии. В качестве разнообразные соединения общей эффективных ингибиторов киназ производные 3,5-диамино-1,2,4-триазола, формулы Высокой 56. противораковой активностью также обладают рибонуклеозиды 57. Многие производные АТ предлагаются в качестве средств для лечения инфекционных заболеваний, вызванных Micobacteria tuberculosis , Helicobacter pylori, Staphylococcus aureus, Candida albicans. 5-Амино-1,2,4-триазол-3-карбоновая кислота (58) применяется в производстве «рибавирина» (59) , одного из наиболее эффективных препаратов для лечения гепатита С. 60 Производное 3,5-диамино-1,2,4-триазола 60, известное как препарат «ламтидин», является эффективным антагонистом Н2-рецепторов гистамина и может использоваться для лечения язвы желудка [23]. 61 7.3. Препараты, содержащие шестичленные гетероциклы 7.3.1. Шестичленные гетероциклы с одним атомом азота:производные пиридина Эра пиридиновых лекарственных веществ началась после открытия витамина В5 и установления его структуры. Это стимулировало синтетические исследования производных пиридина для поиска искусственных лекарственных веществ: был получен кордиамин, препарат для лечения нарушений кровообращения, синтезированы модификации пиридинкарбоновых кислот, обладавшие антидоты, противотуберкулезными а также созданы свойствами, серии пиридинальдоксимные нейролептиков, спазмолитиков, антигипертензивных и антигистаминных препаратов на основе производных пиридина. Первое применение природных производных пиридина в качестве пестицидов связано с алкалоидами никотином и анабазином, содержащимися в табачном порошке, который издавна использовали для уничтожения вредных насекомых. В настоящее время ведутся непрерывные поиски препаратов с пиридиновой основой практически для всех областей медицины и сельского хозяйства. 7.3.1.1. Производные пиперидинового ряда Группа важнейших анальгетиков пиперидинового ряда берет свое начало с 1940-х годов, после создания меперидина (петидин, лидол, 1). Это обезболивающее лекарственное вещество, обладающее кроме того выраженным спазмолитическим действием, остается до сих пор широко применяемым препаратом. Ph OCOEt Me N Me 4 Обнаружение анальгетической активности у большой серии производных 4-фенилпиперидина, синтезированных на основе идеи упрощения структуры 62 известного природного анальгетика морфина, привело к выводу правила Бекетта-Кейзи, оказавшегося, несмотря на свою упрощенность, полезным на определенном этапе создания фармакологического блока морфиноподобных анальгетиков. Так, расширение шестичленного пиперидинового кольца до семичленного (см. пирролидинового этогептазин (см. пролидин, 2) или сужение гетероцикла не снижает анальгетическую 4) до эффективность. В середине 1950-х годов был разработан синтез промедола (5), который остается ведущим анальгетиком в России. Введение в положение С-4 пиперидинового кольца амидной группы [N(Ph)COEt] привело к открытию фентанила (6),самого сильного из известных анальгетиков пиперидинового ряда (его действие в 50 раз сильнее обезболивающего действия морфина). Все рассмотренные пиперидиновые анальгетики действуют на опиоидные рецепторы мозга, и аналогично морфину вызывают привыкание и болезненное пристрастие. Исследования по синтезу их аналогов с малой степенью привыкания (малых наркотиков, но сильных анальгетиков) привели к получению пиценадола (7). Введение в β-положение 4-арилпиперидола-4 ароильного радикала (вместо метильного) приводит к потере анальгетической активности. Но при этом могут проявиться другие виды биодействия, как оказалось в случае флазолона (8), который обладает противовоспалительным действием. Промышленно важным производным пиперидина является рострегулятор пикс (9), который предотвращает полегание зерновых культур и увеличивает урожайность лука и чеснока и стимулирует созревание хлопчатника. Ретардант 63 алден (амиб, 10) повышает декоративность и предотвращает перерастание вплоть до получения карликовых форм. Ряд гидрокси- и оксопроизводных пиперидина также используют в качестве ретардантов и стимуляторов. Фоспинол (11) увеличивает урожайность картофеля, а также улучшает декоративность тюльпанов, гвоздик и других цветов. Акпинол (12) ускоряет как прорастание, так и начало цветения гладиолусов. Рострегулятор ЖУФ-1 (13) повышает всхожесть и урожайность овощных культур. 7.3.1.2. Производные на основе пиридинкарбоновых кислот Витамин В5 (ниацин, 14) предотвращает развитие пеллагры (его старое название - витамин РР - Pellagra preventing), болезни кожи, которая сопровождается нервными расстройствами, потерей памяти, а в тяжелых случаях приводит к смерти. Ниацин участвует в регуляции деятельности нервной системы и желудочно-кишечного тракта, поддерживает нормальный метаболизм, ингибирует выброс свободных жирных кислот, уменьшает уровень холестерина в плазме крови. Его применяют в клинике не только для лечения пеллагры, но и рекомендуют также при инфекционной желтухе, бронхиальной астме, гипертонии, сердечно-сосудистых заболеваниях. В последние десятилетия показано, что комплекс никотинамида с хлоридом железа можно использовать для эффективного восполнения потерь железа в организме. В виде комплекса с хлоридом кобальта он рекомендован при лечении переломов костей. Никотиновая кислота тормозит рост саркомы, а ее соль с алюминием (III) оказывает антиспастическое и сосудорасширяющее действие. 64 ниацин ниацинамид Ниацин используют для синтеза кордиамина (16) - аналептика и стимулятора ЦНС. Его эфир (17) - никотафурил (трафурил), используемый для лечения ревматизма. Также ниацин используется в сеотском хозяйстве, поскольку он стимулирует корнеобразование у рассады риса, а также у ряда древесных и декоративных растений. В больших количествах никотиновую кислоту добавляют в корма животным, так как этот витамин значительно увеличивает продуктивность благодаря его участию в биорегуляции деятельности желудочно-кишечного тракта и улучшению метаболизма в целом. Высокую способность подавлять развитие микобактерий имеют также тиоамиды - этионамид (18) и протионамид (19). Эти производные имеют строение амидов тиоизоникотиновой кислоты и широко применяются при лечении туберкулеза. этиоамид протионамид К производным 2-пиридинкарбоновой кислоты относится фузариновая кислота (20). Она обладает антибактериальным действием. Группа аминопиридинов включает значительное число биологически активных производных. В качестве примера можно привести супрастин (21), обладающий антигистаминным действием и применяемый при аллергических дерматозах. Другим примером служит триаминопроизводное феназопиридин (22), который используется в качестве анальгетика при болезненном мочеиспускании. Класс пиридинкарбоновых кисот представлен в ассортименте средст защиты растений, в основном хлорпроизводными. Так, лонтрел (23) является гербицидом широкого спектра действия, пиклорам (24) широко используют для 65 уничтожения кустарниковых сорняков. Как и лонтрел, пиклорам нарушает пропорциональность роста растений. Среди 7.3.1.3 Хлор, амино- и оксипроизводные пиридинов хлорпроизводных можно выделить нитрапирин (25). Он эффективно ингибирует рост азотпоглощающих бактерий и тем самым сохраняет в почве азотные удобрения. Нитроимин имидахлорид (26) является системным инсектицидом, его активно используют в сельском хозяйстве для протравления семян, обработки почвы и растений в борьбе против тли (афицид), капустной моли, совок, мух и других насекомых, для защиты злаков, кукурузы, картофеля и сахарной свеклы. Среди аминопроизводных препарат авитрол (27) используется для отпугивания птиц (например, на аэродромах). Число препаратов на основе оксизамещенных пиридина значительно. Приведем несколько примеров – соединения 28-32 регуляторы роста и развития. Замачивание семян моркови, огурцов и томатов водным раствором ивина 28 повышает их урожайность. Ивин-Х (29) нашел применение для увеличения урожая сладкого перца, а комплесы 30 и 31 повышают урожайность соответственно моркови и огурцов (30) и раннего картофеля (31). Смесь 32 повышает у люцерны ее семенную продуктивность. 28 X нет, ивин 29 Х=HCl, ивин-Х (капанин) 30 X= , ивин П 66 31 X= (CH2COOH)2, ивин-ЯН 32 Х= (NH4)2MoO4+27, люцис Важных пиридин-альдоксимы, например, (33-34) используются в качестве антидотов (противоядий) при отравлении фосфорорганическими пестицидами. Гидрокси- и гидроксиметилпроизводные пиридина также используются в качестве лекарственных веществ. Например, к этому ряду принадлежат антиатеросклеротический препарат пармидин (35), витамин В6 (36). К витамину В6 относятся три соединения, отличающиеся строением заместителя при С-4: это пиридоксин (36), пиридоксаль (37) и пиридоксамин (38), которые легко взаимно превращаются в организме. В медицине используют пиридоксин и пиридоксальфосфат при заболеваниях нервной системы (невралгия, радикулит и др.) и кожи (экзема, псориаз, нейродермит). Дисульфидное производное пиридоксина - пиридитол (39а), является антидепрессантом с седативным компонентом. Он проявляет ноотропный эффект и уменьшает головные боли. Уместно отметить, что ноотропным и анксиолитическим (снимающим беспокойство) эффектом обладает мексидол (39b). В основном он используется в виде сукцината как антиоксидант и антигипоксант. Интересно, что в виде гидрохлорида этот гидроксипиридин (эмоксипин, 39c) применяют в качестве ретинопротектора для защиты глазной сетчатки от действия света высокой интенсивности. Он также способствует рассасыванию внутриглазных кровоизлияний. 67 Витамин В6 используют в животноводстве, добавляя его к кормам для повышения продуктивности сельскохозяйственных животных. 7.3.1.4. Производные тетрагидропиридинов С конца 1960-х годов в лечении болезней, связанных с высоким кровяным давлением и нарушениями в сердечно-сосудистой системы, наметились серьезные сдвиги, так как в это время на фармацевтическом рынке появились первые представители блокаторов кальциевых каналов. Самыми интересными из них оказались производные 1,4-дигидропиридинов, причем наиболее эффективные препараты были синтезированы в 1980-1990-х годах. К настоящему времени они составляют большой фармацевтический блок вазодилататоров и антигипертензивных средств (несколько десятков препаратов этого типа, например, никардипин, нифедипин, фелодипин и др.). Нифедипин в 1990-м году по сумме мировых продаж всех лекарственных веществ находился на четвертом месте никардипин Me 42 нифедипин 43 риопидин F3 CO2Et MeO2C 44 фелопидин N Me CH2 CH2 N O 45 флуордипин Недавно при поиске более эффективных антигипертензивных средств в ряду производных 1,4-дигидропиридина неожиданно было открыто новое нейропротекторное лекарственное вещество цереброкраст (46), основной эффект которого - усиление функций головного мозга. Он проявляет ноотропное действие, улучшая познавательные способности и память, а также нейропротекторную активность (корректируя возрастные, антигипоксические и антиалкогольные нарушения в нейронах). 68 O CHF2 R 46 R Me Биологически N H цеброкраст Me активные тетрагидропиридины представлены в современном лекарственном арсенале в основном 1,2,3,6-гидропроизводными. Хорошо известна группа гипотензивных веществ, содержащих гуанидиновую функцию, и среди них выделяется гуанциклин (50), объединяющий в своей структуре тетрагидропиридиновый скелет с гуанидилалкильным заместителем. 7.3.2. Шестичленные гетероциклы с двумя или тремя атомами азота 7.3.2.1. Производные пиперазина и пиридазина Сам пиперазин (в виде четвертичных солей) и некоторые его производные применяют при гельминтозах (как противоглистные средства). Интересную группу нейролептиков формируют соединения, включающие сразу три азотистых гетероцикла: пиримидин, пиразин и пиперидин. Базовым препаратом в этом ряду является баспирон (51). Его структура послужила основой для создания серии аналогов, в том числе джепирона (52). Оба препарата относятся к фармакологическому классу анксиолитиков, снимают беспокойство и страх. 69 R N N N N R проспидин Cl Cl 53 спиробромин баспирон Важное джепирон место среди противораковых препаратов алкилирующего действия (цитостатиков) занимают производные пиперазина. Проспидин (53а) и спиробромин (53б) назначают при лечении лейкозов, лимфом, раке гортани, яичников, легких и кожи. Пиридазиновое ядро также входит в состав некоторых лекарственных веществ. Так, производные фталазина - гидралазин (апрессин, 54) и дигидралазин(55), нашли применение для лечения гипертонии, ограниченное, однако из-за их токсичности и ряда побочных эффектов. Ar NHR N N Cl O гидралазин 57-58 57 Ar=Ph, R=H, хлоридазон (пиразон, пирамин) 58 Ar=C6H4CF-3, R=Me, норфлуразон дигидралазин Производные 3,6-диоксопиразидина (гидразид малеиновой кислоты, МГ, ГМК, 56) широко применяются в овощехранилищах для предотвращения прорастания картофеля, моркови, лука, чеснока. МГ также повышает декоративность цветов и газонных трав. В ряду пиразидинов также выделены мощные гербициды. Так, пирамин (57) проявляет гербицидную активность, нарушая в растении фенольный и азотный обмен, уменьшая уровень хлорофилла и ингибируя фотосинтез на стадии разложения воды до кислорода. Норфлуразон (58) – специфический 70 ингибитор биосинтеза каротиноидов. Пирамин применяют для уничтожения сорняков в посевах сахарной свеклы, а норфлуразон – в посевах хлопчатника и свеклы. 7.3.2.2. Производные пиримидинов Многие соединения, содержащие пиримидиновый цикл проявляют разнообразную активность. Среди средств защиты растений применение нашли в основном производные с гербицидными и инсектоакарицидными свойствами. Анцимидол (59) применяют для стимулирования раннего зацветания комнатных цветов и повышения декоративности георгинов, тюльпанов, хризантем и пионов. Он также повышает цветоносность помидор. Тербацил (60)используют против однолетних сорняков на посадках плодовых деревьев, а его аналог – бромацил (61) является гербицидом сплошного действия. Ar= -C6H4OMe-4, R=циклопропил регулятор анцимидол 60 Hal=Cl, тербацил 61 Hal=Br, бромацил Пиримидиновый гетероцикл входит составной частью в витамин В1 (тиамин). Тиамин используют в больших количествах в качестве добавки в корм сельскохозяйственных животных для увеличения их продуктивности. Базудин – контактный инсектицид системного действия, применяемый для уничтожения личинок насекомых, тлей и гусениц. Бупиримат (64) используется как системный фунгицид и полезен против мучнистой росы различных сельскохозяйственных культур. 71 Производные пиримидина находят широкое применение и в медицине. Барбитуровая кислота (65) лежит в основе большого класса широко используемых снотворных веществ, например, барбитураты (66-72). Механизм их действия пока не раскрыт в деталях. Некоторые из барбитуратов оказывают антиконвульсивное действие (фенобарбитал, 69), другие - анестезирующее (гексенал 66 и тиопентал-натрий 67 используют в неингаляционном наркозе для общего обезболивания организма). Ранее их применяли также как седативные средства, но к настоящему времени они вытеснены в этом плане бензодиазепинами - более эффективными успокаивающими средствами. Отмечены случаи физического привыкания к некоторым снотворным этой группы циклических уреидов. ONa N O Me N O Me 66 веронал (барбитал) барбамин фенобарбитал нембутал циклобарбитал Первым противоопухолевым препаратом диоксопирилидинового ряда был 5-фторурацил (73). Модификацией структуры фторурацила в середине 1970-х годов был создан широко используемый сейчас другой антиметаболический противоопухолевый агент фторафур (тегафур, 74). Оба лекарственных вещества 73 и 74 применяют при злокачественных опухолях желудка и других отделов желудочно-кишечного тракта. Попадая в 72 раковые клетки, эти соединения превращаются в 5-фтордезоксиуридин монофосфаты и в качестве таковых ингибируют тимидилатсинтетазу. При этом тормозится биосинтез одного из оснований ДНК - тимидина, и, тем самым, подавляется синтез ДНК раковой клетки. Фторурацил и фторафур имеют определенную токсичность и для здоровых клеток, что диктует необходимость создания новых лекарственных веществ, на плодотворной идее антиметаболитов. Производные пиримидинов, являющиеся синтетическими лекарственными веществами против СПИДа (75-77) имеют нуклеозидную природу и считаются антиметаболитами. Действие этих лекарств сводится к остановке размножения ВИЧ. азидотимидин (AZT, азидовудин) 2’,3’ –дидезоксицитидин 2’,3’ –дидезокси-2’,3’ дидегидротимидин Примером веществ, изучающихся в качестве потенциальных соединений против СПИДа, является группа соединений типа 78с пиримидиновой основой и ряд пиридонов-2 (79). Et Me X CH2R N H O 79 X= NH, CH2; R= Ar, HetAr нуклеозидные препараты (в разработке) Аминозамещенные пиримидины (80-82) обладают антимикробным действием. Хлоридин (80) – противомалярийный препарат, триметоприм (81) используют для профилактики и лечения мочевыделительной системы, а миноксидил (82) является сосудорасширяющим антигипертензивным 73 средством, а при местном применении замедляет или останавливает потерю волос. хлоридин триметоприм миноксидил 7.3.2.3. Производные триазина Триазинон считается перспективным пестицидом, эффективен для защиты овощных культур. Он подавляет у насекомых их поведенческие и пищевые инстинкты. Дигидропроизводные 1,2,4-триазина метаметрон (84) и метрибузин (85) применяют для защиты от сорняков сахарной свеклы, томатов и сои. Соединения 84-86 являются антифотосинтетиками, их используют для борьбы с сорняками в посевах озимой пшеницы и ряда других культур и отличаются весьма низкими нормами расхода. 84 R1= Me, R2=Ph, метаметрон 85 R1= SMe, R2=CMe, метрибузин 86 R1= SEt, R2= CMe3, этиозин Группа гербицидов имеет исключительно широкий диапазон действия при высокой избирательности отдельных препаратов. Их применяют для борьбы с сорняками хлопчатника, сахарной и кормовой свеклы, сои, гороха, подсолнечника, виноградников, ягодников и плодовых садов. Они относятся к почвенным гербицидам, проникающим в растения через корни. сим-Триазины сравнительно медленно разрушаются почвенными микроорганизмами. Их гербицидное действие длится от нескольких дней до нескольких месяцев. Для теплокровных организмов они малотоксичны. Симазин (87) применяют для защиты кукурузы, озимой пшеницы и ржи, 74 картофеля и чайных плантаций. Пропазин (88) используют для очистки от сорняков в посевах моркови и проса. Семерон (90) эффективно уничтожает такие сорняки, как марь белая, горец развесистый, пикульник на посевах капусты. 1 2 87 R = R =Et, симазин 88 R1= R2= CHMe2, пропазин 89 R1 =Et, R2= CHMe2, атразин 90 R1= R2=Me, семерон 91 R1= R2= CHMe2, прометрин 92 R1 =Et, R2= CHMe2, десметрин 75 8. ГЕТЕРОЦИКЛЫ, СОДЕРЖАЩИЕ СЕМИЧЛЕННЫЙ ЦИКЛ Семичленные циклы с одним или двумя циклическими гетероатомами являются составной частью фармакологически ценных соединений. Так, производные азепина (семичленного гетероцикла, содержащего один циклический атом азота) известны как антидепрессанты. Соединения 1,4диазепинового ряда (включающих два циклических атома азота) обладают свойствами транквилизаторов. Ряд дигидропроизводных дибензо[b,f]-азепинов вошел в медицинскую практику благодаря сильновыраженным свойствам снимать у больных с психическими расстройствами депрессивные состояния. Типичными представителями этого класса антидепрессантов являются дезипрамин (1), имипрамин (имизин, 2) и другие препараты (3,4). дезипрамин имипрамин лофепрамин ипсидон Препараты, содержащие 1,4-бензодиазепиновое ядро, сначала были введены в клинику психотерапии человека, а затем и в животноводство. Они формируют фармакологическую группу транквилизаторов (например, нитразепам 5, феназепам 6, диазепам 7 и др.) - веществ, устраняющих чувство страха, напряженности, тревоги, и являются одной из самых распространенных в мире лекарственных групп. Данные препараты находят применение и в сельском хозяйстве. Так, у животных они снимают стрессовые состояния, неизбежные при их массовом содержании и транспортных перевозках. 76 5 R1=H, R2=NO2, Ar= Ph нитразепам (неозепам) 6 R1=H, R2=Br, Ar= C6H4Cl-2 феназепам 7 R1=H, R2=Cl, Ar= Ph диазепам (валиум, седуксен) элениум (либриум, осказепам (нозепам) альпразопам хлордиазепоксид) Некоторые транквилизаторы обладают побочными эффектами. Так, нитразепам (5) оказывает сильное снотворное действие. Кроме того он усиливает действие других снотворных, а также анальгетиков. Он нашел применение для купирования эпилептических припадков (как противосудорожное средство). Феназепам (6) полезен для купирования синдрома алкогольной абстиненции. Он также оказывает противосудорожное и снотворное действие. Элениум (7) и осказепам (8) также применяют в анастезиологической практике, при экземе и в психиатрической практике. Альпразолам (ксанаксом, 10) - один из самых популярных транквилизаторов, поскольку у него менее выражен снотворный эффект. 77 СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ 1. Солдатенков А. Т. Основы органической химии лекарственных веществ / Солдатенков А. Т. ; Колядина Н. М., Шендрик И. В.; 3-е изд.. - М. : Бином.Лаборатория знанийМир, 2007. - 191 с. - ISBN 978-5-94774-640-2, 5-03-003794-2: 156-65 2. Основы органической химии пищевых, кормовых и биологически активных добавок : учеб. пособие для вузов / Солдатенков А. Т. , Колядина Н. М. ,А. Ле Туан, Буянов В. Н. ; . - М. : Академия, 2006. - 278 с. - ISBN 5-94628-238-7: 199-00, 243-58 3. Солдатенков А. Т. Пестициды и регуляторы роста : прикладная органическая химия/ Солдатенков А. Т. ; Колядина Н. М.,А. Ле Туан . – М.: БИНОМ. Лаборатория знаний, 2010. – 223 с. : ил. – (Библиотека классического университета). - ISBN 978-5-9963-0202-4 4. Джилкрист Т. Химия гетероциклических соединений: Пер с англ. / Под ред. М.А. Юровской . – М.:Мир, 1996. – 464 с. 5. Мельников Н.Н., Новожилов К.В., Белан С.Р. Пестициды и регуляторы роста растений: Справочник. – М.: Химия, 1995. – 576 с. 6. Биоорганическая химия : учебник / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. - 2010. - 416 с. 7. Барлоу Р., Введение в химическую фармакологию, пер. с англ., М., 1959; 8. Альберт Э., Избирательная токсичность, пер. с англ., М., 1971; 9. Справочник фармацевта, под ред. А. И. Тенцовой, 2 изд., М., 1981; 10.Лакин К. М., Крылов Ю. Ф., Биотрансформация лекарственных веществ, М., 1981; 11.Побочные действия лекарственных средств, под ред. М. Н. Г. Дюкса. пер. с англ., М., 1983; Машковский М. Д., "Химико-фармацевтический журнал", 1983, № 10, с. 1222-30; 12.Холодов Л. Е., Яковлев В. П., Клиническая фармакокинетика, М., 1986; 78 13.Машковский М. Д., Лекарственные средства, т. 1-2, 10 изд.. М., 1985; Goodman and Oilman's the pharmacological basis of therapeutics, ed. by A. Goodman, L. Gilman, Th. Rail, F. Murad, 17 ed., N.Y., 1985; 14.Negwer М., Organic chemical drugs and their synonyms, 6 ed., v. 1-3, В., 1987. 15.Андреева Е.И., Зинченко В.А. Биологическая активность и механизм действия системных фунгицидов. М.: МСХА, 1995.- 60 с. 16.Ассортимент средств защиты растений, включающий новое поколение биопестицидов, БАВ, экологически безопасные пестициды и аналоги природных соединений. Часть 1. Инсектициды, акарициды, фунгициды. С-Пб, ВИЗР, 2001 -76с. 17.Ассортимент средств защиты растений, включающий новое поколение биопестицидов, БАВ, экологически безопасные пестициды и аналоги природных соединений. Часть 2.. Гербициды. С-Пб, ВИЗР, 2001.-100 с. 18.Белан С.Р., Трапов А.Ф. Мельникова Г.М. Новые пестициды. Справочник. М., 2001. - 196 с. 19.Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность. – М.: КолосС, 2005. – 232 с. 20.Попов С.Я., Дорожкина Л.А., Калинин В.А. Основы химической защиты растений. Учебное пособие. М: Арт-Лион, 2003. – 208 с. 21.Potts K.T. The chemistry of 1,2,4-triazoles // Chem. Rev. 1961. V. 61, N 2. P. 87-127. 22.Curtis A.D.M., Jennings N. 1,2,4-Triazoles. In Comprehensive Heterocyclic Chemistry III / Katritzky A.R., Ramsden C.A., Scriven E.F.V., Taylor R.J.K. Eds.; Elsevier: Oxford, 2008. V. 5. P. 159-209. 23.Чернышев В.М. С-амино-1,2,4-триазолы и конденсированные гетероциклические системы на их основе: синтез, особенности строения и реакционная способность. Дис…докт.хим.наук. – Р-н-Д., 2012. -351 с 79


