Использование метана для получения синтез-газа
реклама

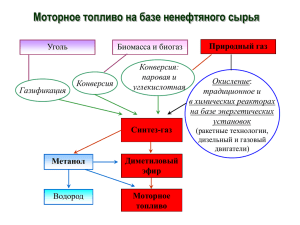
Использование метана для получения органических продуктов Научно-исследовательский инженерный центр "СИНТЕЗ" Юрий Анисимович Трегер Генеральный директор д.х.н., профессор НИИЦ СИНТЕЗ Природный газ – сырье для тяжелого органического синтеза CH3COOH (CH3CO)2O HCOOH HCOH Диметилкарбонат Простые и сложные эфиры H2 NH3 С2H2, CS2, CH4-xClx C (сажа, тех. углерод) C2H6 C3H8 He СН3ОН Топливо Низшие алкены Арены СН2=СНОАс С2Н5ОН Синтез-газ Топливо Масла Алканы Алкены ДМЭ и другие СН4 Природный газ (ПГ) С2H4 НСN Сжатый и сжиженный ПГ H2S Относительная эффективность переработки природного газа в Относительная стоиомсть продукции из природного газа различные продукты (по данным фирмы "Sasol") 1,5 1,2 0,9 1,5 0,6 1,3 1 0,3 0 Топливо Олефины Оксигенаты Блок-схема переработки природного газа в синтез-газ и далее в метанол Н2О Природный газ рецикл О2 I II сдувка инертов IV III СН3ОН I – получение синтез-газа II – синтез метанола III – конденсация метанола IV – ректификация метанола Товарный СН3ОН Реакции паровой (III), углекислотной (IV) и кислородной (V) конверсии природного газа СН4 + Н2О СО + 3Н2 – 206 кДж/моль () СН4 + СО2 2СО + 2Н2 – 247 кДж/моль (V) СН4 + ½ О2 СО + 2Н2 + 36 кДж/моль (V) Побочные реакции СН4 + 2О2 СО2 + 2Н2О Н2 + ½ О2 Н2О Температурная зависимость констант равновесия для процесса получения синтез-газа с помощью паровой (реакция III) и углекислотной (реакция IV) конверсии метана 10 8 6 log10 K 4 2 0 -2 -4 -6 -8 -10 0 200 400 600 800 1000 1200 1400 1600 о Температура, К Максимальный выход синтез-газа на моль исходного метана как функция температуры при разных давлениях для кислородной конверсии метана (реакция V) Моли СО + Н 2 /моль СН 4 3,2 1 атм 2,4 10 атм 1,6 20 атм 0,8 750 850 950 1050 о Температура, С 1150 Рекомендуемый тип риформинга природного газа в зависимости от мощности производства метанола № п/п Мощность производства метанола т/день Рекомендуемый тип риформинга природного газа 1 Более 5000 Одностадийный, автотермический 2 1500-7000 Двухстадийный, паровой и кислородный 3 Менее 1500 Одностадийный, паровой Перспективные разработки получения синтез-газа • Мембранная технология • Процесс при ультрамалых временах контакта на монолитных катализаторах • Многоканальный реактор с диаметром труб менее 1 мм • Получение синтез-газа в реакторе – дизельном двигателе • Получение синтез-газа в ракетном двигателе Реакции получения метанола из оксидов углерода и водорода • СО + 2Н2 СН3ОН + 90,8 кДж/моль () • CO2 + 3H2 CH3OH + H2O + 49,6 кДж/моль () f = (Н2 – СО2) : (СО + СО2) Условия процесса получения метанола Температура – 200-300оС Давление – 4-15 МПа Конверсия СО + СО2 за один проход – 15-50% Общая конверсия СО + СО2 в метанол – 97-99% Содержание метанола в реакционном газе – 3-5% Основные типы реакторов для синтеза метанола Пар Вода Утилизация тепла Адиабатический реактор фирмы "ICI" Адиабатический реактор фирмы "Haldor Topsoe" Трубчатый реактор фирмы "Lurgi" Экономические показатели трех различных схем для производства метанола Паровой риформинг Комбинированный риформинг Мега-метанол 2500 2500 5000 Потребность в природном газе, ММТИ/т 30 28,5 28,5 Общая фиксированная стоимость, млн.долларов 225 215 300 Себестоимость продукта, долл./т 113 108 79 Мощность , т/сут Другие перспективные разработки синтеза метанола • Синтез в двухступенчатом реакторе без циркуляции (фирма "Haldor Topsoe", Дания) • Многоканальный реактор с диаметром труб ~ 1,5 мм (фирма "Velocys", США) • Прямое окисление метана до метанола (Россия) Капитальные затраты (млн. долл.) Капитальные затраты на строительство установок по производству метанола (данные фирмы "ICI") 400 300 200 100 10 100 500 1000 3000 Производительность установки (т/сутки) 10 000 Удельные капзатраты, долл./т продукции в год Зависимость удельных капзатрат при производстве cинтетических жидких углеводородов от производительности предприятия 6000 5000 4000 3000 2000 1000 0 0 500 1000 1500 2000 2500 3000 3500 Производительность, тыс. т/год Отпускная стоимость метанола как функция мощности для различной стоимости природного газа. 150 140 0.5 $ / MMBtu 130 1.0 $ / MMBtu $/T 120 110 Олефин 100 90 80 Транспортабельное 70 Энергетика 60 0 5000 10000 Производительность т/день 15000 Переход :химикаты в топливо / химикаты для бизнеса Сегодня Отпускная цена топлива в $/MMBTU 7.00 4.65 Завтра 2.30 0.00 0 0 50 70 100 140 Отпускная цена MeOH/DME в $/т MeOH – CH3OH, DME – (CH3)2O 150 210 MeOH DME Реакции, протекающие при синтезе диметилового эфира из синтез-газа • 3СО + 3Н2 СН3ОСН3 + СО2 + 245,7 кДж/моль (V) • 2СО + 4Н2 СН3ОСН3 + Н2О + 204,8 кДж/моль (V) • СО + 2Н2 СН3ОН + 90,8 кДж/моль () • 2CH3OH (CH3)2O + H2O + 23,4 кДж/моль (V) • CO + H2O CO2 + H2 + 40,9 кДж/моль (X) Параметры процессов синтеза метанола, метанола + ДМЭ и ДМЭ (Японская корпорация NKK и Токийский университет) Параметр Метанол Метанол + ДМЭ ДМЭ Соотношение рециркуляции 5 5 2 Доля газов выброса, % 23 15 5 Конверсия за один проход, % 14 18 50 Общая конверсия, % 77 85 95 ДМЭ – диметиловый эфир Различные варианты получения этилена и других олефинов из природного газа Парциальное окисление метана Окислительная димеризация метана Cl2 О2 О2 Природный газ 1 млрд. м3 О2 Н2О С2Н 4 метанол Получение синтез-газа Получение метанола CO Каталитический крекинг С2 Н 4 С3Н 6 C4H 8 С2Н 4 Получение хлорметила О2 CH3C HCl синтез-газ Синтез олефинов С 2Н 4 С 3Н 6 C 4H 8 С2 Н 4 С2Н 2 C2H3Cl О2 Получение бензина Гомологизация до этанола Дегидратация этанола Cl2 Хлоропиролиз Термический пиролиз бензина С2Н 4 С3Н 6 C4H 8 Термоокислительный пиролиз С2Н 4 С2Н 2 Пиролиз хлористого метила С 2Н 4 С 2Н 2 C2H3Cl Показатели процесса окислительной димеризации метана 2СН4 + ½ О2 С2Н6 + 2Н2О 2СН4 + О2 С2Н4 + 2Н2О • Выход углеводородов С2 – до 25% • Селективность по углеводородам С2 – до 80% • Селективность по этилену – до 55% Другие рассмотренные способы получения этилена • Переработка природного газа и/или хлористого метила в присутствии хлора CH4 + Cl2 (HCl + O2) (CH3Cl) C2H4 + C2H2 + C2H3Cl • Переработка природного газа термоокислительным пиролизом СН4 + О2 С2Н2 + С2Н4 + СО + СО2 + Н2 + Н2О • Получение олефинов пиролизом топлива, синтезированного методом Фишера-Тропша n CO + (2n + 1) H2 CnH2n+2 + n H2O CnH2n+2 (бензиновая фракция) С2Н4 + С3Н6 + С4Н8 • Синтез этилена гомологизацией метанола с последующей дегидратацией полученного этанола CH3OH + CO + 2H2 CH3CH2OH + H2O CH3CH2OH CH2=CH2 + H2O • Синтез олефинов методом Фишера-Тропша n CO + 2n H2 CnH2n + n H2O • Синтез олефинов из метанола 2 СН3ОН СН3ОСН3 олефины С2-С5 Сравнительный анализ катализаторов SAPO-34 и ZSM-5 в процессах превращения метанола % масс. в реакционном газе 50 45 Mobil ZSM-5 MTG 40 UOP/HYDRO SAPO-34 MTO 35 30 25 20 15 10 5 0 C1-C4 парафины этилен пропилен бутены С5+ и пр. Технология превращения метанола в олефины (MTO) UOP/Hydro • Конверсия метанола ~ 100% • Выход С2Н4 и С3Н6 ~ 80% • То же с рециклом С4-С6 – 85-89% • Производительность опытной установки – 500 кг/сутки Переработка природного газа в олефины через метанол Природный газ 1 млрд. нм3 О2 Н2О Синтез-газ Метанол 1 100 000 т Этилен 220 000 т Пропилен 150 000 т Бутилен 45 000 т Выводы • Природный производства газ является универсальным многочисленных продуктов сырьем для органического синтеза. Разработаны высокоэффективные технологии для их получения. • Ведутся интенсивные исследования для переработки метана в этилен и другие непредельные углеводороды, являющиеся сырьем для получения ряда важных промышленных продуктов. • При определенных условиях переработка природного газа в химическую продукцию целесообразной и выгодной. становится экономически