УДК 661.733.31 Исследование термодинамических свойств
advertisement
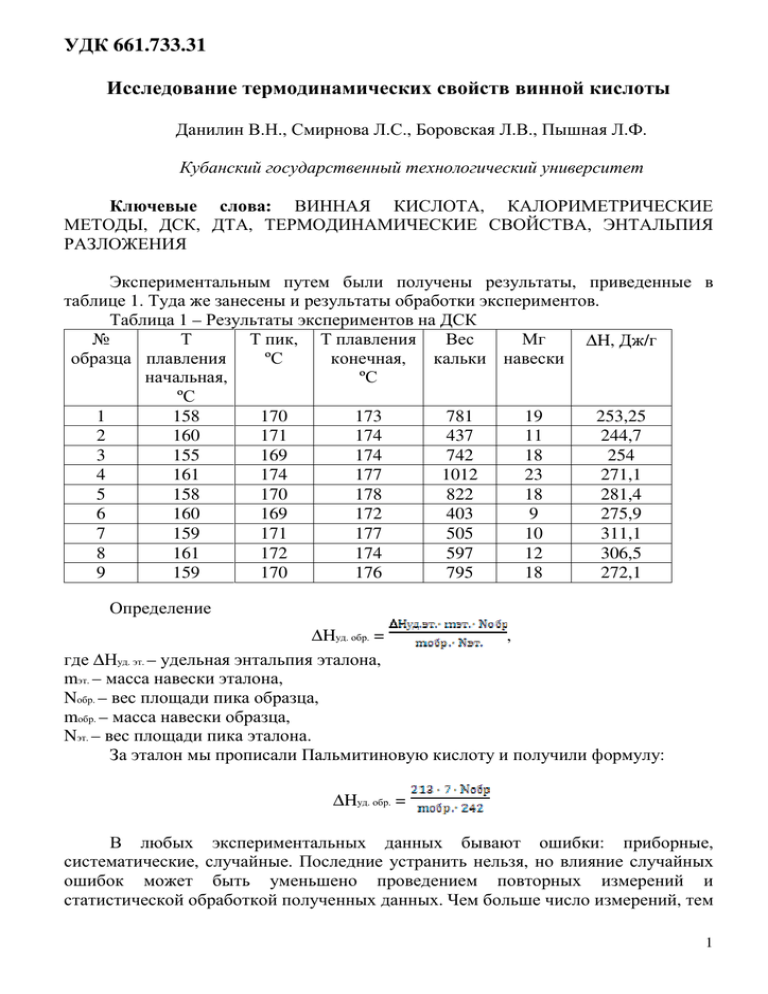
УДК 661.733.31 Исследование термодинамических свойств винной кислоты Данилин В.Н., Смирнова Л.С., Боровская Л.В., Пышная Л.Ф. Кубанский государственный технологический университет Ключевые слова: ВИННАЯ КИСЛОТА, КАЛОРИМЕТРИЧЕСКИЕ МЕТОДЫ, ДСК, ДТА, ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА, ЭНТАЛЬПИЯ РАЗЛОЖЕНИЯ Экспериментальным путем были получены результаты, приведенные в таблице 1. Туда же занесены и результаты обработки экспериментов. Таблица 1 – Результаты экспериментов на ДСК № Т Т пик, Т плавления Вес Мг ∆H, Дж/г образца плавления кальки навески ºС конечная, начальная, ºС ºС 1 158 170 173 781 19 253,25 2 160 171 174 437 11 244,7 3 155 169 174 742 18 254 4 161 174 177 1012 23 271,1 5 158 170 178 822 18 281,4 6 160 169 172 403 9 275,9 7 159 171 177 505 10 311,1 8 161 172 174 597 12 306,5 9 159 170 176 795 18 272,1 Определение ∆Hуд. обр. = , где ∆Нуд. эт. – удельная энтальпия эталона, mэт. – масса навески эталона, Nобр. – вес площади пика образца, mобр. – масса навески образца, Nэт. – вес площади пика эталона. За эталон мы прописали Пальмитиновую кислоту и получили формулу: ∆Hуд. обр. = В любых экспериментальных данных бывают ошибки: приборные, систематические, случайные. Последние устранить нельзя, но влияние случайных ошибок может быть уменьшено проведением повторных измерений и статистической обработкой полученных данных. Чем больше число измерений, тем 1 меньше коэффициент и доверительный интервал для данного уровня надежности. Имеет смысл ставить не менее трех параллельных опытов, проводить не менее трех измерений. Истинное значение искомой величины (а0) можно выразить, как среднее арифметическое (ā) из m ее измерений (при первом приближении): а0 = ā = мерой случайной ошибки, т.е. погрешности, с которой определено истинное значение а0, может служить среднее арифметическое отклонение ∆= но более строгим и надежным способом определения случайной ошибки является расчет, проведенный вероятностным методом на основе той или иной функции распределения непрерывных случайных величин. В исследовательской практике число повторных измерений редко превышает 10 – 15, в нашем случае m = 9. Когда m < 30, для определения случайной ошибки используют функцию распределения Стьюдента = f (t), где t – коэффициент Стьюдента, характеризующий зависимость абсолютной погрешности ∆ от числа измерений m при заданной доверительной вероятности P. Величину абсолютной погрешности вычисляют по формуле ∆ = ā – а0 = ± t · S(ā) где S(ā) = есть среднее квадратическое отклонение среднего арифметического, характеризующее степень разбросанности результатов измерений относительно истинного значения. Число степеней свободы f = m – 1. Расчет случайной ошибки обычно проводят задаваясь доверительной вероятностью Р = 0,95. Так же мы поступим и в нашем случае. Используя таблицу Стьюдента, имеем, что значение t при доверительной вероятности 0,95 = 2,31. Окончательный результат можно записать как а0 = ā ± ∆ Можем так же определить относительную ошибку измерения искомой величины ∆= · 100% Рассчитаем по температурному пику: а0 = ā = 1536/9=170,7 ∆ (сред. арифм. отколон.) =1,26 2 S(ā) = 1,77 ∆ (абсол. погреш.) = 2,31 · 1,77 = 4, 097 f=8 а0 = ā ± ∆ = 170,7 ± 1,26 δ = 2,4 А так же проведем расчеты по ∆Н: а0 = ā = 2470,05/9 = 274,45 ∆ (сред. арифм. отколон.) = 0,05/9= 0,0055 S(ā) = 3,472 ∆ (абсол. погреш.) = 2,31 · 3,472 = 8,02 f=8 а0 = ā ± ∆ = 274,45 ± 0,0055 δ = 2,9 Молярная масса = 150, 09 = 54,4 ± 12,6 Дж/моль·градус = 13 ± 3 кал/моль·град γпл = (54,4 · (170,7+273)) : 150,09 = 160,82 γпл max = ((54,4+12,6) ·(170,7+273)) : 150,09 = 186,24 274,45Дж/г · 150,09 = 41192,2 : 170,7 = 241,3 Далее был проведен эксперимент винной кислоты на дериватографе. Полученные результаты занесены в Таблицу 2. Таблица 2 - Результаты экспериментов на дериватографе Т плавления Т плавления № S ∆H, Дж/г образца начальная, ºС конечная, ºС 1 112 195 521,2 23 2 124 198 611,8 27 3 122 200 634,5 28 Обработав результаты имеем, что ∆Hсред = 589,2 Дж/г Исследуя пики мы получили: ∆Hплав = 54,5% = 321,1 Дж/г ∆H разл = 45,5% =268,1 Дж/г Рассмотрим и проанализируем энтальпию разложения по закону Гесса. При нагревании винная кислота подвергается дегидратации декарбоксилированию с образованием пировиноградной кислоты: С4Н6О6 и СО2 + Н2О + С3Н4О3 3 Закон Гесса позволяет теоретически рассчитать энтальпию разложения. Проведя вычисления, получаем ∆H = 261,4 Дж/г. 4



















