коллоидная химия
реклама

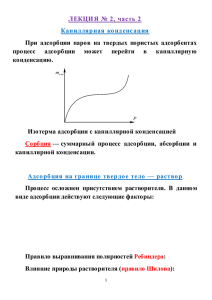
КОЛЛОИДНАЯ ХИМИЯ Значение коллоидной химии Коллоидная химия –– это раздел физической химии, изучающий поверхностные явления и дисперсные системы. Коллоидная химия практически завершает изучаемые общеобразовательные химические дисциплины, т. к. ориентируется на рассмотрение сложных реальных физико-химических систем. Вследствие малых размеров частиц дисперсной фазы типичные коллоидные системы являются наносистемами –– объектами современных нанотехнологий. Именно в них наиболее ярко проявляется влияние поверхности на свойства, и поэтому поверхностные явления имеют определяющее значение для процессов, протекающих в коллоидных дисперсных системах. Фактически нет ни одной области деятельности человечества, которая в той или иной степени не имела бы дела с коллоидными системами. Это производство пластмасс, синтетических волокон, клеев, резины, лакокрасочных и строительных материалов, продуктов питания, лекарств и т. п. Наконец, любая физико-химическая система приобретает свойства коллоидных систем, если хотя бы одно из трех измерений вещества дисперсной фазы находится в области 10–2 – 10–7 см. Это расширяет круг систем, в том числе и биологических, обладающих коллоидными свойствами. К ним относятся: бислойные липидные мембраны, мышечные и нервные волокна, вирусы, протоплазма, кровь, мозговое вещество, стекловидное тело глаза и т. д. ЛЕКЦИЯ № 1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ Те рмо д ина мика по ве рхно с тных явл е ний Поверхностные явления протекают на границах раздела фаз и обусловлены особыми свойствами поверхностных слоев. Состояние молекул или атомов, находящихся в поверхностном слое, иное, чем у молекул или атомов, находящихся в объеме фазы. 1 Из-за нескомпенсированности сил межмолекулярного взаимодействия со стороны воздуха энергия у молекул поверхностного слоя выше, чем у молекул в объеме фазы. Фаза I - водяной пар в воздухе Граница раздела фаз F=0 Фаза II - вода F≠0 Суммарный избыток энергии молекул поверхности —свободная поверхностная энергия Гиббса Gs. Общая энергия системы G — сумма поверхностной энергии Гиббса Gs и энергии Гиббса объемной фазы Gv: G = Gs + Gv Пусть имеется гомогенная фаза с площадью поверхности А, тогда: Gs = A hσ – TAsσ, где hσ и sσ — энтальпия и энтропия единицы поверхности, а Ahσ и Asσ — энтальпия (Hs) и энтропия (Ss) поверхности. Общая энергия Гиббса системы: G = Hv – TSv + Hs – TSs, где Hs и Ss — избыточные значения термодинамических величин, обусловленные наличием поверхностных слоев. Поверхностная энтальпия Hs = G s + TSs. фактор незначителен, то Hs = Gs. 2 Если энтропийный По ве рхно с тно е на тяже ние Поверхностное натяжение (σ) — это работа, которую требуется затратить для образования единицы поверхности (размерность Дж/м2). Поверхностное натяжение (σ) — это мера избытка энергии поверхностной энергии, приходящегося на единицу площади поверхности, который возникает за счет нескомпенсированности сил межмолекулярных взаимодействий у молекул поверхностного слоя. Зависимость поверхностного натяжения от различных факторов От природы жидкости От температуры При повышении температуры силы межмолекулярных взаимодействий ослабевают и поверхностное натяжение уменьшается. При критической температуре исчезает поверхность раздела фаз жидкость—пар, поверхностное натяжение становится равным 0. От давления При повышении давления увеличивается взаимодействие поверхностных слоев жидкостей с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности (сила F становится меньше) –– поверхностное натяжение уменьшается. Зависимость поверхностного натяжения водных растворов различных веществ от их природы и концентрации ПАВ (поверхностно-активные вещества) — вещества, понижающие поверхностное натяжение водных растворов. σПАВ < σН2О Неионогенные ПАВ — спирты, альдегиды, кетоны, сложные эфиры. 3 Ионогенные ПАВ — органические кислоты, амины и их соли. СН3 СОО- СН3 NH3+ σ σH2O σПАВ I σПАВ II σПАВ III C ПАВ Изотермы ПАВ, отличающихся разной длиной углеродной цепи ПИВ (поверхностно-инактивные вещества) — вещества, повышающие поверхностное натяжение водных растворов. Сильные неорганические электролиты — соли, кислоты, щелочи. σПИВ > σН2О ПНВ (поверхностно-неактивные вещества) — вещества, не изменяющие поверхностное натяжение водных растворов. Многоатомные спирты, углеводы. σПИВ ≈ σН2О σ ПИВ ПНВ C Изотермы ПИВ и ПНВ 4 Ме то д ы изме ре ния по ве рхно с тно г о на тяже ния Сталагмометрический метод Метод основан на зависимости между числом капель, получаемых из определенного объема жидкости , и поверхностным натяжением. Определив число капель (n) и зная плотность жидкости (ρ), находят поверхностное натяжение: ρ n0 σ = σ0 ρ0 n , где σ — поверхностное натяжение исследуемой жидкости; σ0 — поверхностное натяжение стандартной жидкости с известным значением σ, например, воды; ρ0 и ρ — плотности воды и исследуемой жидкости; n0 и n —число капель воды и исследуемой жидкости. Если концентрации веществ малы, то ρ и ρ0 примерно равны и тогда: n σ = σ0 0 n 5 ЛЕКЦИЯ № 2 АДСОРБЦИЯ Адсорбция –– Десорбция –– Адсорбент — Адсорбат или адсорбтив –– Абсорбция –– Фундаментальное уравнение адсорбции Гиббса. ࢊ࣌ Г =– ࢉ ∙ ࢊࢉ ࢀ܀ Поверхностная активность (только для ПАВ) g = − dσ dc c→0 Изотерма гиббсовской адсорбции и графическое определение поверхностной активности 6 Правило Дюкло—Траубе — Ад с о рб ция на тве рд о м те л е Адсорбция на границе твердое тело—газ Основная характеристика — теплота адсорбции Химическая (хемосорбция) Физическая Те о рия мо но мо л е кул ярно й а д с о рб ции Л е нг мюра . Допущения Ленгмюра 1) 2) 3) 4) В таких условиях образуется 7 Уравнение изотермы Ленгмюра a = a∞ c K +c при адсорбции из раствора P a = a∞ K +P при адсорбции газа Изотерма адсорбции Ленгмюра Константы уравнения Ленгмюра находят построенной в логарифмических координатах. 8 по изотерме, Полимолекул ярна я адсорбция. Теории Поляни и БЭТ Часто процесс адсорбции заканчивается образованием на поверхности адсорбента не одного слоя молекул адсорбата, а полимолекулярного адсорбционного слоя Изотерма полимолекулярной адсорбции Основные положения теории Поляни: ● на поверхности твердых адсорбентов существуют адсорбционные силы, действующие на расстояниях, превышающих размеры молекул адсорбата, в результате чего образуется полимолекулярный слой; ● плотность слоя убывает по мере удаления от поверхности адсорбента. Основные положения теории Брунауэра, Эммета и Теллера (БЭТ) ● на поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров; ● каждая молекула предыдущего слоя представляет собой активный центр для адсорбции молекул следующего адсорбционного слоя; ● взаимодействие соседних адсорбированных молекул в первом и последнем слоях отсутствует; ● предполагается, что все молекулы во втором и более дальних слоях ведут себя подобно молекулам жидкости. 9 Адсорбированная фаза — цепи молекул, первая из которых связана с поверхностью адсорбента. Цепи энергетически не взаимодействуют между собой Строение адсорбционного слоя по теории БЭТ Адсорбция на границе твердое тело — раствор Процесс осложнен присутствием растворителя. В данном виде адсорбции действуют следующие факторы: • ●молекулы растворителя могут конкурировать с молекулами адсорбата за адсорбционные центры; • молекулы адсобрата взаимодействуют с растворителем; • возможно электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если последний является электролитом. Правило выравнивания полярностей Ребиндера: Влияние природы растворителя (правило Шилова): 10 Виды адсорбции на границе твердое тело—раствор Молекулярная адсорбция Ионная адсорбция — – эквивалентная –– – обменная адсорбция — – избирательная адсорбция — Правило избирательной адсорбции (Фаянса—Панета) Адсорбционная способность ионов зависит от их заряда и радиуса в гидратированном состоянии: Li+ > Na+ > K+ > Rb+ > Cs+ уменьшение радиуса гидратированного иона Лиотропный ряд адсорбции однозарядных катионов: катион Cs+ Rb+ NH4+ K+ Na+ Li+ радиус, Å 1,68 1,48 1,43 1,33 0,95 0,6 увеличение радиуса гидратированных катионов уменьшение адсорбции Лиотропный ряд адсорбции однозарядных анионов: анион радиус, Å NO3– 2,5 I– 2,16 Br– Cl– F– 1,36 1,81 1,36 увеличение радиуса гидратированных анионов уменьшение адсорбции 11 Ионообменная адсорбция Адсорбенты, способные к обмену ионами, называются ионитами. Иониты — Иониты имеют сетчатую структуру. С сеткой ковалентно связаны группы атомов R±, несущие положительный или отрицательный заряд (фиксированные ионы). Этот заряд компенсируется противоионами (М+ или А–). Фиксированные ионы вместе с противоионами (R–M+ или R+А–) называют ионогенными группировками. По типу ионогенных групп иониты делят на катиониты R– M+ (кислотные иониты, обменивающие катионы) и аниониты R+А– (основные иониты, обменивающие анионы). Ионообменные реакции: для катионита: R–H+ + Na+ для анионита: R+OH– + Cl– R–Na+ + H+ R+Cl– + OH– Активность ионитов — поглощающая характеризуется обменной емкостью (ОЕ) — способность Применение в фармации: умягчение жесткой, опреснение засоленной воды, для извлечения из анализируемых смесей различных компонентов. 12 Смач ивание Смачивание — это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другим жидким телом при наличии одновременного контакта этих двух несмешивающихся фаз с третьей фазой — газом (чаще всего воздухом). В системе имеются три поверхности раздела фаз: твердое тело—газ, жидкость—газ, жидкость—твердое тело с соответствующими поверхностными натяжениями: σтг, σтж, σгж. Линия пересечения всех трех поверхностей раздела –– линия смачивания; замкнутая линия смачивания образует периметр смачивания. Угол θ между поверхностями жидкость—газ и твердое тело—жидкость –– краевой угол смачивания. Смачивание Несмачивание 13 Уравнение Юнга: σтг = σтж + σжг cosθ или cosθ = σтг - σтж σ жг • если cosθ > 0 –– «ограниченное смачивание»; • если cosθ < 0 –– «плохое смачивание»; • если равновесный краевой угол устанавливается, — «полное смачивание» растекание. Характеристика явления — энтальпия смачивания: не или ∆Н = Hтг –Нтж Отношение энтальпий смачивания твердых поверхностей водой (Нв) и углеводородом (Hу) — характеристика гидрофильности поверхности —коэффициент гидрофильности. Для гидрофильных поверхностей β = Нв > 1, Hу для гидрофобных — β < 1. Для активированного угля β ≈ 0,4 (гидрофобная поверхность), для кварца β ≈ 2 (гидрофильная поверхность), для крахмала β ≈ 20 (сильно гидрофильная поверхность). В фармацевтической практике изменение смачивания применяется для регулирования гигроскопичности фармацевтических порошков. Б ио л о г ич е с ко е зна ч е ние про це с с о в а д с о рб ции 14 Приложение к лекциям № 1 и 2 Величины, характеризующие поверхностные явления Величина Поверхностная энергия Поверхностное натяжение Поверхностная активность Адсорбция на твердой поверхности Адсорбция на жидкой границе Символ или формула GS g Дж Дж/м2 = Н/м Дж⋅⋅ м⋅⋅ моль–1 a моль/м2*; моль/кг** Γ моль/м2*** безразмерная величина (доли единицы) σ H в**** β= Hy Коэффициент гидрофильности Размерность в СИ Примечания: * Если известна поверхность адсорбента, количество адсорбированного вещества относится к единице поверхности адсорбента. ** Если не известна поверхность адсорбента, количество адсорбированного вещества относится к единице массы адсорбента. *** Количество адсорбированного вещества относится к единице поверхности раздела фаз. **** Hв и Hу — энтальпии смачивания твердой поверхности водой и углеводородом, соответственно. 15