определение постоянной адиабаты по клеману
реклама

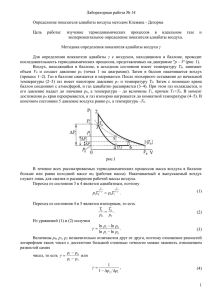
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ Кафедра физики Самсонова Н.П., Михеева О.Б. ОПРЕДЕНИЕ ПОСТОЯННОЙ АДИАБАТЫ ПО КЛЕМАНУ-ДЕЗОРМУ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ ПО КУРСУ «ФИЗИКА» для студентов специальности:140104 “Промышленная теплоэнергетика” очной формы обучения Тюмень, 2010 УДК 531 С-17 Самсонова Н.П., Михеева О.Б.Определение постоянной адиабаты по Клеману – Дезорму: методические указания к лабораторной работе по курсу «Физика» для студентов специальности 140104 “Промышленная теплоэнергетика” очной формы обучения. - Тюмень: РИЦ ГОУ ВПО ТюмГАСУ, 2010. – 13 с. Методические указания предназначены для выполнения лабораторной работы по курсу общей физики, раздел «Молекулярная физика и термодинамика». Методические указания содержат краткую теоретическую часть, описания установки и метода измерений, контрольные вопросы. В пособии даны методические рекомендации по порядку выполнения работы, математической обработке результатов измерений и оформлению таблиц. Рецензент: Михеев В.А. Тираж 50 экз. © ГОУ ВПО «Тюменский государственный архитектурно-строительный университет » © Самсонова Н.П., Михеева О.Б. Редакционно-издательский центр ГОУ ВПО «Тюменский государственный архитектурностроительный университет » 2 Содержание 1 2 3 4 5 Краткая теория . . . . . . . . . . . . . . . Описание установки и метода измерений Порядок выполнения работы . . . . . . . Контрольные вопросы . . . . . . . . . . . Литература. . . . . . . . . . . . . . . . . . 3 . . . . . . . . . . . . . . . . . . . . . . 4 . . . .. . . . . . . . . 7 . . .. . .. . . . . . . 9 . . . . . . . . . . . . . 11 . . . . . . . . . . . . . 11 УДК 531 С-17 Самсонова Н.П., Михеева О.Б.Определение постоянной адиабаты по Клеману – Дезорму: методические указания к лабораторной работе по курсу «Физика» для студентов специальности 140104 “Промышленная теплоэнергетика” очной формы обучения. - Тюмень: РИО ГОУ ВПО ТюмГАСУ, 2010. – 11 с. Методические указания предназначены для выполнения лабораторной работы по курсу общей физики, раздел «Молекулярная физика и термодинамика». Методические указания содержат краткую теоретическую часть, описания установки и метода измерений, контрольные вопросы. В пособии даны методические рекомендации по порядку выполнения работы, математической обработке результатов измерений и оформлению таблиц. Рецензент: Михеев В.А. Тираж 50 экз. © ГОУ ВПО «Тюменский государственный архитектурно-строительный университет » © Юрова Е. С. Редакционно-издательский центр ГОУ ВПО «Тюменский государственный архитектурностроительный университет » 4 ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ АДИАБАТЫ ПО КЛЕМАНУ-ДЕЗОРМУ ЦЕЛЬ РАБОТЫ: изучить термодинамические процессы и определить отношение теплоѐмкостей воздуха Cp/Cv. ОБОРУДОВАНИЕ: лабораторный комплекс ЛКТ-5 «Процессы в газах». 1 КРАТКАЯ ТЕОРИЯ Состояние газа характеризуется тремя макропараметрами: давлением p, Па; объѐмом V, м³; температурой Т, К. Уравнение, связывающее эти три величины, называется уравнением состояния газа. Уравнением состояния идеального газа является уравнение МенделееваКлапейрона: pV m RT , M (1) где m – масса газа, кг; M – молярная масса, кг/моль; R=8,31 Дж/(моль·К) – универсальная газовая постоянная. Для одного моля газа уравнение (1) имеет вид: pVм=RT, (2) где Vм – молярный объѐм, м3/моль. Теплоѐмкость газов зависит от условий нагревания. Выясним эту зависимость, воспользовавшись уравнением состояния идеального газа (1) и первым началом термодинамики, которое формулируется так: количество теплоты δQ, Дж, переданное системе, затрачивается на изменение еѐ внутренней энергии dU, Дж, и на работу δА, Дж, совершаемую системой против внешних сил: δQ=dU+δA 5 (3) Внутренняя энергия идеального газа равна: i m RT , 2M U (4) где i – число степеней свободы – число независимых координат, определяющих положение молекулы в пространстве. Элементарная работа δА, совершаемая газом при расширении, равна δА=p·dV (5) Молярной теплоѐмкостью См, Дж/(моль·К), называется отношение сообщѐнного количества теплоты δQ одному молю вещества к достигнутой разности температур dT: CM M Q m dT M dU m dT M A m dT (6) Из уравнения (6) видно, что теплоѐмкость идеального газа может иметь различные значения в зависимости от способа нагревания газа, т.к. одному и тому же значению dT могут соответствовать различные значения δА. Рассмотрим процессы, протекающие в идеальном газе при изменении температуры, когда масса газа остается неизменной. Процесс называется изохорным, если объѐм газа остается постоянным, т.е. V=const, dV=0, следовательно, δА=0.При этом вся теплота идет на изменение внутренней энергии: δQ=dU (7) Из уравнений (6) и (7) следует, что молярная теплоѐмкость газа при постоянном объѐме (изохорная теплоѐмкость) равна Сv: CM M dU m dT CV (8) Используя уравнение (4), можно получить CV i R 2 6 (9) Процесс, протекающий при постоянном давлении p=const, называется изобарным. В этом случае теплоѐмкость газа при постоянном давлении (изобарная теплоемкость) обозначается Cp. Из уравнений (6) и (5) имеем: M dU m dT Cp M pdV m dT (10) Из уравнения (1) для изобарного процесса следует: M pdV m RdT (11) Подставляя формулы (8) и (11) в уравнение (10), получим: Cp=Cv+R или i Cp 2 2 R (12) (13) Уравнение (12) называется уравнением Майера. При изобарном нагревании газа подводимая теплота идет не только на изменение внутренней энергии (изменение температуры), но и на совершение работы газом (изменение объѐма). Поэтому молярная теплоѐмкость Ср больше молярной теплоемкости Сv. Изотермическим называется процесс, протекающий при постоянной температуре Т=const. В этом случае dT=0, dU=0, тогда δQ=dА, (14) т.е. вся подводимая теплота расходуется на работу. Такой процесс практически не осуществим, т.к. для его реализации изменения давления p и объѐма V должны происходить бесконечно медленно. Кроме того, газ должен находиться в среде с очень большой теплоѐмкостью. Адиабатический процесс протекает без теплообмена с окружающей средой, т.е. при полной теплоизоляции, δQ=0. В этом случае первое начало термодинамики будет иметь вид: dU+δA=0 (15) или A m CV dT M dU 7 (16) Используя уравнения (1), (5), (12), после математических преобразований получим уравнение адиабатического процесса – уравнение Пуассона: pV const , (17) где γ = Cр/Сv – показатель адиабаты, или i 2 i (18) Условие δQ=0 на практике не осуществимо. Только для очень быстрых процессов это условие приближенно выполняется. 2 ОПИСАНИЕ УСТАНОВКИ И МЕТОДА ИЗМЕРЕНИЙ Все элементы комплекса размещены в каркасе, состоящем из передней панели и двух боковин. Органы управления вынесены на переднюю панель, на которой нанесена мнемосхема соединений элементов комплекса (рисунок 1). Рисунок 1 – Схема пневмосистемы 8 Основной элемент комплекса – баллон объемом 3,25 л, который в соответствии с рисунком 1 на панели обозначен знаком Б. Кран К3 с окном большого сечения (около 1 см²) соединяет баллон с атмосферой и позволяет быстро сбрасывать давление газа в баллоне. Рукоятка края баллона выведена на переднюю панель. При повороте рукоятки из положения «ОТКРЫТ» в положение «ЗАКРЫТ» или обратно срабатывает микропереключатель, подключенный параллельно кнопке «ADVANCE» секундомера. Результатом является измерение времени открытого или закрытого состояния крана. Часы-таймер предназначены для измерения интервалов времени с разрешением 0,01 с. Управление секундомером осуществляется тремя кнопками. Кнопка «MODE» - выбор режима работы. В режиме «СЕКУНДОМЕР» мигает надпись в верхней части дисплея. Кнопка «ADVANCE» в режиме «СЕКУНДОМЕР» поочерѐдно запускает и останавливает отсчѐт времени. Если не сбрасывать отсчѐты, то происходит суммирование измеряемых интервалов времени. Кнопка «SET», нажатая в процессе отсчѐта времени, фиксирует показания дисплея, но не останавливает отсчѐт времени. При повторном нажатии этой кнопки показания дисплея будут соответствовать продолжающемуся отсчѐту времени. Кнопка «SET», нажатая при остановленном отсчѐте времени, сбрасывает (обнуляет) отсчѐт и показания дисплея. Осушитель обозначен на панели знаком «О» и представляет собой стеклянный баллончик с силикагелем. Цвет работоспособного силикагеля – темно-коричневый. Израсходованный (влажный) силикагель светло-желтый или белый. Для восстановления его нужно прокалить в духовке в течение 20 минут при температуре 130-170ºС. Элементы комплекса соединены шлангами из синтетического материала. Краны К1 и К2 пережимают соответствующие шланги. Воздух подается в баллон через штуцер Ш1, при этом происходит удаление влаги. Штуцер Ш3 позволяет соединить баллон с внешним манометром на 40 кПа (300 мм рт. ст.). К штуцеру Ш1 подключѐн шланг груши-помпы. Метод Клемана-Дезорма по определению отношения теплоѐмкостей Cр/Сv довольно прост. В баллоне создаѐтся давление воздуха р1, превышающее атмосферное давление р0. Затем на короткое время открывают кран в атмосферу. Давление в баллоне упадѐт до атмосферного, а оставшийся в баллоне воздух вследствие адиабатического расширения охладится от начальной температуры Т1 (комнатной) до температуры Т0, определяемой уравнением адиабаты (Пуассона): p11 T1 p 01 T 9 (19) После закрывания крана температура воздуха в баллоне постепенно вернѐтся к комнатной Т2=Т1, а давление возрастѐт до значения р2, определяемого уравнением изохорного процесса: p0 T0 p2 T1 (20) Из этих отношений находим Cp CV ln( p1 p 0 ) ln( p1 p 2 ) (21) 3 ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ 1. Закрыть кран К2 по часовой стрелке до упора. 2. Открыть кран К3, обнулив показания манометра. Затем кран К3 закрыть 3. Кран К1 приоткрыть. Накачать в баллон воздух до избыточного давления Δр1 (200-250 мм рт.ст.), после чего кран К1 закрыть. 4. Подождать 1-2 минуты, пока установится температура воздуха, и давление перестанет меняться. Если необходимо - аккуратно довести давление Δр1 до заданного значения, слегка приоткрывая кран К2 или накачивая воздух грушей. 5. Записать в таблицу 2 давления: р0=750 мм рт.ст.; Δр1 – из показаний манометра и р1=р0+ Δр1. 6. Включить часы в режим «СЕКУНДОМЕР». Обнулить их показания. На короткое время t от 0,3 до 1 секунды открыть кран К3 баллона (повернуть рукоятку крана по часовой стрелке до упора) и снова закрыть его. Время открытого состояния крана автоматически измерит таймер. Записать это время t в таблицу 1. 7. Подождать 1-2 минуты до установления температуры и давления в баллоне. Записать установившееся избыточное давление Δр2 из показаний манометра в таблицу 1. 8. Для фиксированного значения Δр1 повторить измерения 5-6 раз для различных значений t , увеличивая постепенно время открытого состояния крана К3 до 4 секунд. Заполнить таблицу 1. 9. Построить график зависимости ln (Δр2) = f(t) в соответствии с рисунком 2. Этот график покажет, какие значения t слишком малы (воздух не успевает выйти из баллона), а какие слишком велики (воздух успевает частично прогреться, пока кран еще открыт). Экстраполируя график из области больших t к значению t=0, найти «идеальные» значения ln(Δр2), избыточного давления Δр2 и полного давления р2=( р0+ Δр2 ). Полученные данные занести в таблицу 2. 10 О - «идеальное» значение Δр2, полученное экстраполяцией графика к значению t=0 Рисунок 2 – График зависимости ln (Δр2) от времени t 10. Рассчитать экспериментальное значение γ = Cр/Сv по формуле (21).Полученный результат для γ сравнить с теоретическим значением γт, которое вычисляют по формуле (18), при этом воздух считать двухатомным газом (i=5)/ 11. Указать причины расхождения полученных результатов. Таблица 1 – Контрольные измерения t, c Δр2, мм рт.ст. ln(Δр2) Таблица 2 – Результаты измерений р0, мм рт.ст. Δр1, мм рт.ст. р1, мм рт.ст. Δр2, мм рт.ст. ln(Δр2) 11 р2, мм рт.ст. γ = Cр/Сv γт 4 КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Что такое идеальный газ? Записать уравнение МенделееваКлапейрона. 2. Сформулировать первое начало термодинамики. Дать определение внутренней энергии тела. Записать формулы работы газа в термодинамике и внутренней энергии идеального газа. 3. Что называется молярной и удельной теплоемкостью вещества? Единицы их измерения. 4. Применить первое начало термодинамики к изохорному и изобарному процессам. Получить уравнение Майера. 5. Применить первое начало термодинамики к изотермическому и адиабатическому процессам. Получить уравнение Пуассона. Сравнить изотерму с адиабатой. 6. Объяснить метод Клемана-Дезорма, вывести расчетную формулу (21). 5 ЛИТЕРАТУРА 1. Трофимова Т.И. Курс физики.-М.:Академия,2007.-560с. 2. Детлаф А.А., Яворский Б.М. Курс физики.-М.:Высшая школа,2001.-718с. 3. Кухлинг Х. Справочник по физике.-М.:Мир,1998.-519с. 12