тест по теме галогены
реклама
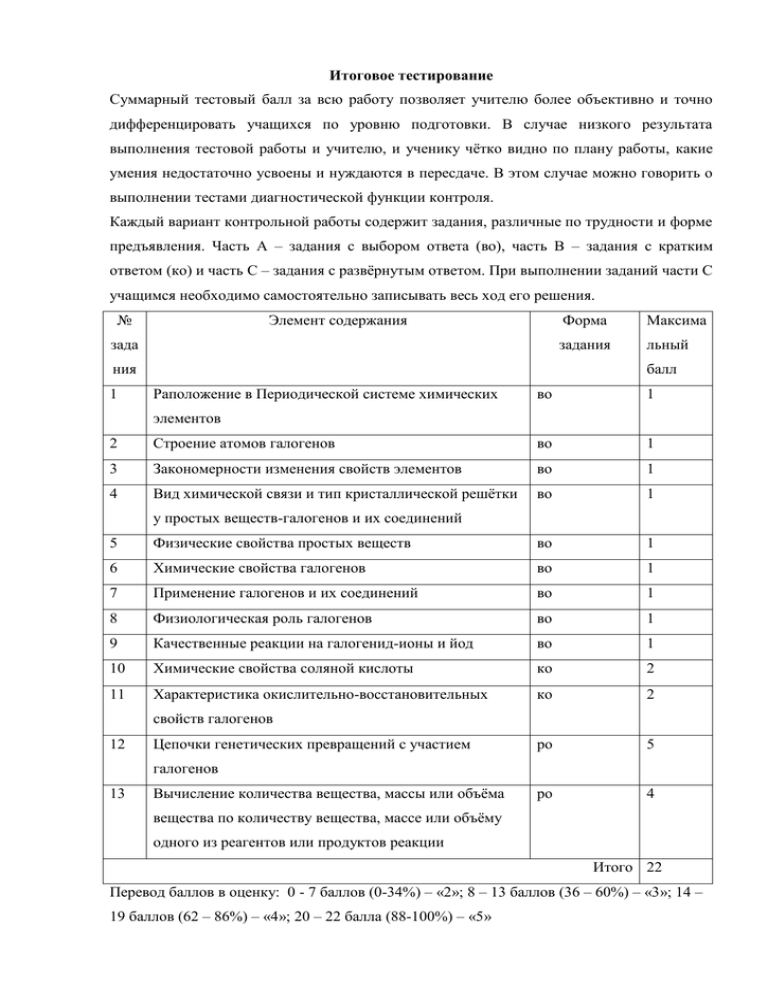
Итоговое тестирование Суммарный тестовый балл за всю работу позволяет учителю более объективно и точно дифференцировать учащихся по уровню подготовки. В случае низкого результата выполнения тестовой работы и учителю, и ученику чётко видно по плану работы, какие умения недостаточно усвоены и нуждаются в пересдаче. В этом случае можно говорить о выполнении тестами диагностической функции контроля. Каждый вариант контрольной работы содержит задания, различные по трудности и форме предъявления. Часть А – задания с выбором ответа (во), часть В – задания с кратким ответом (ко) и часть С – задания с развёрнутым ответом. При выполнении заданий части С учащимся необходимо самостоятельно записывать весь ход его решения. № Элемент содержания зада ния 1 Форма Максима задания льный балл Раположение в Периодической системе химических во 1 элементов 2 Строение атомов галогенов во 1 3 Закономерности изменения свойств элементов во 1 4 Вид химической связи и тип кристаллической решётки во 1 у простых веществ-галогенов и их соединений 5 Физические свойства простых веществ во 1 6 Химические свойства галогенов во 1 7 Применение галогенов и их соединений во 1 8 Физиологическая роль галогенов во 1 9 Качественные реакции на галогенид-ионы и йод во 1 10 Химические свойства соляной кислоты ко 2 11 Характеристика окислительно-восстановительных ко 2 ро 5 ро 4 свойств галогенов 12 Цепочки генетических превращений с участием галогенов 13 Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции Итого 22 Перевод баллов в оценку: 0 - 7 баллов (0-34%) – «2»; 8 – 13 баллов (36 – 60%) – «3»; 14 – 19 баллов (62 – 86%) – «4»; 20 – 22 балла (88-100%) – «5» Вариант 1 Часть 1 А1. Положение элемента йода в Периодической системе химических элементов: а) 2-й период, главная подгруппа VII группы; б) 3-й период, главная подгруппа VII группы; в) 4-й период, главная подгруппа VII группы; г) 5-й период, главная подгруппа VII группы. А2. Электронная формула атома хлора: а) 1s22s22p63s23p1 б) 1s22s22p63s23p6 в) 1s22s22p63s23p5 г) 1s22s22p5 А3. Неметаллические свойства галогенов в подгруппе с увеличением порядкового номера: а) возрастают; б) не изменяются; в) уменьшаются; г) изменяются периодически. А4. Химическая связь и тип кристаллической решётки у фтора: а) ковалентная неполярная, ионная; б) ковалентная неполярная, молекулярная; в) ковалентная полярная, молекулярная; г) ковалентная полярная, атомная. А5. Агрегатное состояние брома и хлора при обычных условиях: а) жидкое и газообразное; б) газообразное и газообразное; в) газообразное и твёрдое; г) газообразное и жидкое. А6. Хлор взаимодействует с каждым из перечисленных веществ: а) железо, водород, бромид калия; б) фосфор, соляная кислота, гидроксид натрия; в) водород, фторид кальция, медь; г) хлорид натрия, гидроксид натрия, магний. А7. Спиртовой раствор этого галогена применяют для обработки ран: а) фтор; б) хлор; в) бром; г) йод. А8. Соединения какого галогена успокаивающе действуют на нервную систему: а) фтор; б) хлор; в) бром; г) йод. А9. В двух пробирках находятся растворы соляной кислоты и бромида калия. После добавления в каждую из них раствора нитрата серебра будет наблюдаться соответственно: а) образование белого осадка, выделение газа; б) отсутствие изменений, образование желтого осадка; в) образование желтого осадка, образование белого осадка; г) образование белого осадка, образование светло-жёлтого осадка. Часть 2 Ответами к заданиям В1 и В2 является последовательность цифр, которая соответствует номерам правильных ответов. В1. Из предложенного перечня веществ с раствором соляной кислоты вступают в реакцию: 1) медь; 2) гидроксид калия; 3) магний; 4) карбонат кальция; 5) оксид железа(III); 6) углекислый газ. В2. Выберите схемы превращений, в которых хлор является окислителем: 1) 2Cl-1 → Cl20 2) Cl20 → 2Cl+1 3) Cl+5 → Cl-1 4) Cl20 → 2Cl-1 5) Cl+7 → Cl+5 Часть 3 При выполнении заданий подробно запишите ход решения и полученный результат С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: KBr → Br2 → HBr → AgBr Реакцию 1 рассмотрите с точки зрения ОВР, а для реакции 3 составьте полное и сокращённое ионное уравнение химической реакции. С2. Рассчитайте объём хлороводорода (н.у.) , полученного при взаимодействии 117 г хлорида натрия с концентрированной серной кислотой. Вариант 2 Часть 1 А1. Положение элемента фтора в Периодической системе химических элементов: а) 2-й период, главная подгруппа VII группы; б) 3-й период, главная подгруппа VII группы; в) 4-й период, главная подгруппа VII группы; а) 5-й период, главная подгруппа VII группы. А2. Электронная формула внешнего энергетического уровня атома йода: а) …3s23p5 б) …4s24p5 в) …5s25p5 г) …5s25p3 А3. Радиусы атомов галогенов в подгруппе с увеличением порядкового номера: а) возрастают; б) не изменяются; в) уменьшаются; г) изменяются периодически. А4. Химическая связь и тип кристаллической решётки у хлороводорода: а) ковалентная неполярная, ионная; б) ковалентная неполярная, молекулярная; в) ковалентная полярная, молекулярная; г) ковалентная полярная, атомная. А5. Простые вещества фтор и йод при обычных условиях: а) красно-бурая жидкость и жёлто-зелёный газ; б) бесцветный газ с резким запахом и темно-фиолетовое кристаллическое вещество ; в) светло-жёлтый газ и темно-фиолетовое кристаллическое вещество; г) светло-желтый ядовитый газ и белое кристаллическое вещество. А6. Хлор взаимодействует с каждым из перечисленных веществ: а) магний, водород, йодид калия; б) углекислый газ, соляная кислота, гидроксид натрия; в) оксид алюминия, вода, медь; г) хлорид натрия, гидроксид натрия, магний. А7. Вещество, которое используют для обеззараживания воды, отбеливания бумаги и ткани: а) фтор; б) хлор; в) бром; г) йод. А8. Соединения какого галогена добавляют в поваренную соль для предотвращения заболеваний щитовидной железы: а) фтор; б) хлор; в) бром; г) йод. А9. В двух пробирках находятся растворы йодида и хлорида калия. После добавления в каждую из них раствора нитрата серебра будет наблюдаться соответственно: а) образование белого осадка, выделение газа; б) отсутствие изменений, образование желтого осадка; в) образование желтого осадка, образование белого осадка; г) образование белого осадка, образование светло-жёлтого осадка. Часть 2 Ответами к заданиям В1 является последовательность цифр, которая соответствует номерам правильных ответов. В1. Из предложенного перечня веществ с раствором соляной кислоты вступают в реакцию: 1) алюминий; 2) сера; 3) гидроксид кальция; 4) оксид углерода(II); 5) оксид бария; 6) нитрат серебра. В задании В2 на установление соответствия внесите в таблицу цифры выбранных вами ответов. Получившуюся последовательность цифр запишите в строку ответа. В2. Установите соответствие между схемой реакции и изменением степени восстановителя: СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ А) HCl(конц.) + MnO2 → MnCl2 + Cl2 + H2O 1) Cl20 → 2Cl-1 Б) 2KClO3 → 2KCl + 3O2 2) 2Cl-1 → Cl20 В) 2NaOH + Cl2 → NaClO + NaCl + H2O 3) Cl0 → Cl+1 4) Cl+5 → Cl-1 5) Mn+4 → Mn+2 6) 2O-2 → O20 А Б В Часть 3 При выполнении заданий подробно запишите ход решения и полученный результат С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Cl2 → HCl → NaCl → AgCl Реакцию 1 рассмотрите с точки зрения ОВР, а для реакции 3 составьте полное и сокращённое ионное уравнение химической реакции. С2. Какой объём хлора (н.у.) необходим для получения 8г брома из бромида калия? Вариант 3 Часть 1 А1. Положение элемента брома в Периодической системе химических элементов: а) 2-й период, VIIА группа; б) 3-й период, VIIА группа; в) 4-й период, VIIА группа; а) 4-й период, VIIБ группа. А2. Электронная формула внешнего энергетического уровня атома фтора: а) …3s23p5 б) …4s24p5 в) …2s22p3 г) …2s22p5 А3. Окислительная способность атомов галогенов в подгруппе с увеличением порядкового номера: а) возрастают; б) не изменяются; в) уменьшаются; г) изменяются периодически. А4. В паре формул у веществ связь ионная и ковалентная неполярная: а) NaCl и HCl; б) F2 и CaF2; в) AlI3 и I2; г) HBr и HCl. А5. Простые вещества бром и хлор при обычных условиях: а) красно-бурая жидкость и жёлто-зелёный газ; б) бесцветный газ с резким запахом и темно-фиолетовое кристаллическое вещество ; в) светло-жёлтый газ и темно-фиолетовое кристаллическое вещество; г) светло-желтый ядовитый газ и белое кристаллическое вещество. А6. Йод взаимодействует с каждым из перечисленных веществ: а) магний, водород, бромид калия; б) хлорид натрия, соляная кислота, гидроксид натрия; в) оксид углерода (II), вода, медь; г) алюминий, калий, водород. А7. Нашел применение в военном деле в качестве боевого отравляющего вещества, соединения этого элемента являются причиной разрушения озонового слоя Земли: а) фтор; б) хлор; в) бром; г) йод. А8. Соединения какого галогена добавляют в зубную пасту для предотвращения кариеса: а) фтор; б) хлор; в) бром; г) йод. А9. Доказательством наличия крахмала в продуктах питания является: а) выпадение белого осадка при растворении в воде; б) появление синего окрашивания при добавлении йода; в) образование желтого осадка при добавлении нитрата серебра; г) появление резкого запаха при нагревании. Часть 2 Ответами к заданиям В1 является последовательность цифр, которая соответствует номерам правильных ответов. В1. Из предложенного перечня веществ с раствором соляной кислоты вступают в реакцию: 1) карбонат натрия; 2) углерод; 3) оксид кремния (IV); 4) нитрат серебра; 5) гидроксид натрия; 6) оксид меди(II). В задании В2 на установление соответствия внесите в таблицу цифры выбранных вами ответов. Получившуюся последовательность цифр запишите в строку ответа. В2. Установите соответствие между схемой реакции и изменением степени окислителя: СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ А) Cl2 + 2NaBr → 2NaCl + Br2 1) 2Br-1 → Br20 Б) 2F2 + 2H2O → 4HF + O2 2) 2Cl-1 → Cl20 В) H2 + Cl2 → 2HCl 3) Cl20 → 2Cl-1 4) F0 → F-1 5) H20 → 2H+1 6) 2O-2 → O20 А Б В Часть 3 При выполнении заданий подробно запишите ход решения и полученный результат С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: HI → KI → I2 → AlI3 Реакцию 2 рассмотрите с точки зрения ОВР, а для реакции 1 составьте полное и сокращённое ионное уравнение химической реакции. С2. Какой объём водорода (н.у.) выделится при взаимодействии 13г цинка с соляной кислотой? Вариант 4 Часть 1 А1. Положение элемента хлора в Периодической системе химических элементов: а) 2-й период, VIIА группа; б) 3-й период, VIIА группа; в) 4-й период, VIIА группа; а) 4-й период, VIIБ группа. А2. Химический знак элемента, электронная формула которого 1s22s22p63s23p5: а) Cl б) O в) F г) I А3. Восстановительная способность атомов галогенов в подгруппе с увеличением порядкового номера: а) возрастают; б) не изменяются; в) уменьшаются; г) изменяются периодически. А4. В паре формул у веществ связь ковалентная полярная и ковалентная неполярная: а) NaCl и HCl; б) F2 и CaF2; в) HI и I2; г) HBr и HCl. А5. Какое утверждение не относится к характеристике физических свойств галогенов: а) Температуры кипения и плавления галогенов находятся в зависимости от значений молекулярных масс; б) от фтора к йоду усиливается интенсивность окраски галогенов; в) являются безопасными в обращении веществами; г) йод способен возгонятся. А6. Бром взаимодействует с каждым из перечисленных веществ: а) натрий, водород, фторид калия; б) хлорид натрия, соляная кислота, гидроксид калия; в) хлорид меди (II), вода, медь; г) йодид калия, калий, водород. А7. Эту реакцию используют для изготовления надписей и рисунков на стекле: а) SiO2 + 4HF → SiF4 + 2H2O; б) Cl2 + H2O → HCl + HClO; в) 2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O; г) 2KClO3 → 2KCl + 3O2. А8. Стимулирует обмен веществ, рост волос, придаёт бодрость и силу: а) фтор; б) хлор; в) бром; г) йод. А9. В двух пробирках находятся растворы фторида и хлорида калия. После добавления в каждую из них раствора нитрата серебра будет наблюдаться соответственно: а) образование белого осадка, выделение газа; б) отсутствие изменений, образование белого осадка; в) образование желтого осадка, образование белого осадка; г) образование светло-жёлтого осадка, образование белого осадка. Часть 2 Ответами к заданиям В1 и В2 является последовательность цифр, которая соответствует номерам правильных ответов. В1. Из предложенного перечня веществ с раствором соляной кислоты вступают в реакцию: 1) оксид азота(II); 2) кислород; 3) цинк; 4) нитрат серебра; 5) оксид кальция; 6) гидроксид меди(II). В2. Выберите схемы превращений, в которых хлор проявляет свойства восстановителя: 1) Cl+3 → Cl+1 2) Cl-1 → Cl20 3) Cl+7 → Cl+5 4) Cl+5 → Cl+7 5) Cl-1 → Cl+3 Часть 3 При выполнении заданий подробно запишите ход решения и полученный результат С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: HBr → KBr → Br2 → CaBr2 Реакцию 2 рассмотрите с точки зрения ОВР, а для реакции 1 составьте полное и сокращённое ионное уравнение химической реакции. С2. Какой объём бромоводорода израсходуется для нейтрализации раствора, содержащего 28г гидроксида калия? Ответы на задания с выбором ответа Вариант А1 А2 А3 А4 А5 А6 1 г в в б а а 2 а г а в в а 3 в г в в а г 4 б а а в в г Ответы на задания с развёрнутым ответом А7 г б б а А8 в г а б А9 г в б б В1 2345 1356 1456 3456 В2 345 263 343 245 Вариант1 С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: KBr → Br2 → HBr → AgBr Реакцию 1 рассмотрите с точки зрения ОВР, а для реакции 3 составьте полное и сокращённое ионное уравнение химической реакции. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Приведены уравнения реакций, соответствующие схеме превращений: 1) 2KBr + Cl2 → 2KCl + Br2 2) Br2 + H2 → 2HBr 3) HBr + AgNO3 → AgBr + HNO3 4) Составлен электронный баланс для реакции 1, указан процесс окисления и восстановления, окислитель и восстановитель 2Br-1 -2e → Br20 процесс окисления, восстановитель 0 -1 Cl2 + 2e → 2Cl процесс восстановления, окислитель 5) Для реакции 3 составлено полное и сокращённое ионное уравнение реакции H+ + Br- + Ag+ + NO3- → AgBr + H+ + NO3Ag+ + Br- → AgBr Ответ правильный и полный, включает все названные выше элементы Правильно записано 4 элемента ответа Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Баллы 5 4 3 2 1 0 5 С2. Рассчитайте объём хлороводорода (н.у.) , полученного при взаимодействии 11,7 г кристаллического хлорида натрия с концентрированной серной кислотой при нагревании. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: 1) Записано уравнение реакции: NaCl + H2SO4 → NaHSO4 + HCl 2) Определено количество вещества хлорида натрия ν(NaCl) = 11,7/58,5 = 0,2 моль 3) Найдено количество вещества хлороводорода ν(HCl) = 0,2 моль 4) Найден объём выделившегося хлороводорода V(HCl) = 0,2моль • 22,4 л/моль = 4,48л Ответ правильный и полный, включает все названные выше элементы Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Вариант 2 Баллы 4 3 2 1 0 4 С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Cl2 → HCl → NaCl → AgCl Реакцию 1 рассмотрите с точки зрения ОВР, а для реакции 3 составьте полное и сокращённое ионное уравнение химической реакции. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Приведены уравнения реакций, соответствующие схеме превращений: 1) Сl2 + H2 → 2HCl 2) HCl + NaOH → NaCl + H2O 3) NaCl + AgNO3 → AgCl + NaNO3 4) Составлен электронный баланс для реакции 1, указан процесс окисления и восстановления, окислитель и восстановитель H20-2e → 2H+ процесс окисления, восстановитель 0 -1 Cl2 + 2e → 2Cl процесс восстановления, окислитель 5) Для реакции 3 составлено полное и сокращённое ионное уравнение реакции Na+ + Cl- + Ag+ + NO3- → AgCl + Na+ + NO3Ag+ + Cl- → AgCl Ответ правильный и полный, включает все названные выше элементы Правильно записано 4 элемента ответа Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Баллы 5 4 3 2 1 0 5 С2. Какой объём хлора (н.у.) необходим для получения 8г брома из бромида калия? Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: 1) Записано уравнение реакции: 2KBr + Cl2 → 2KCl + Br2 2) Определено количество вещества брома ν(Br2) = 8/160 = 0,05 моль 3) Найдено количество вещества хлора ν(Cl2) = 0,05 моль 4) Найден объём выделившегося хлора V(Cl2) = 0,05моль • 22,4 л/моль = 1,12 л Ответ правильный и полный, включает все названные выше элементы Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Вариант 3 Баллы 4 3 2 1 0 4 С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: HI → KI → I2 → AlI3 Реакцию 2 рассмотрите с точки зрения ОВР, а для реакции 1 составьте полное и сокращённое ионное уравнение химической реакции. Содержание верного ответа и указания по оцениванию Баллы (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Приведены уравнения реакций, соответствующие схеме превращений: 1) HI + KOH → KI + H2O 2) 2KI + Br2 → 2KBr + I2 3) 3I2 + 2Al → 2AlI3 4) Составлен электронный баланс для реакции 2, указан процесс окисления и восстановления, окислитель и восстановитель 2I--2e → I20 процесс окисления, восстановитель 0 -1 Br2 + 2e → 2Br процесс восстановления, окислитель 5) Для реакции 1 составлено полное и сокращённое ионное уравнение реакции H+ + I- + K+ + OH- → K+ + I- + H2O H+ + OH- → H2O Ответ правильный и полный, включает все названные выше элементы 5 Правильно записано 4 элемента ответа 4 Правильно записано 3 элемента ответа 3 Правильно записано 2 элемента ответа 2 Правильно записано 1 элемента ответа 1 Все элементы записаны неверно 0 Максимальный балл 5 С2. Какой объём водорода (н.у.) выделится при взаимодействии 13г цинка с соляной кислотой? Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: 1) Записано уравнение реакции: 2HCl + Zn → ZnCl2 + H2 2) Определено количество вещества цинка ν(Zn) = 13/65 = 0,2 моль 3) Найдено количество вещества водорода ν(H2) = 0,2 моль 4) Найден объём выделившегося водорода V(H2) = 0,2моль • 22,4 л/моль = 4,48 л Ответ правильный и полный, включает все названные выше элементы Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Вариант 4 Баллы 4 3 2 1 0 4 С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: HBr → KBr → Br2 → CaBr2 Реакцию 2 рассмотрите с точки зрения ОВР, а для реакции 1 составьте полное и сокращённое ионное уравнение химической реакции. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: Приведены уравнения реакций, соответствующие схеме превращений: 1) HBr + KOH → KBr + H2O 2) 2KBr + Cl2 → 2KCl + Br2 3) Br2 + Ca → CaBr2 4) Составлен электронный баланс для реакции 2, указан процесс окисления и восстановления, окислитель и восстановитель 2Br--2e → Br20 процесс окисления, восстановитель 0 -1 Cl2 + 2e → 2Cl процесс восстановления, окислитель 5) Для реакции 1 составлено полное и сокращённое ионное уравнение реакции H+ + Br- + K+ + OH- → K+ + Br- + H2O H+ + OH- → H2O Ответ правильный и полный, включает все названные выше элементы Правильно записано 4 элемента ответа Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Баллы 5 4 3 2 1 0 5 С2. Какой объём бромоводорода израсходуется для нейтрализации раствора, содержащего 28г гидроксида калия? Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: 1) Записано уравнение реакции: HBr + KOH → KBr + H2O 2) Определено количество вещества гидроксида калия ν(KOH) = 28/56 = 0,5 моль 3) Найдено количество вещества водорода ν(HBr) = 0,5 моль 4) Найден объём выделившегося бромоводорода V(HBr) = 0,5моль • 22,4 л/моль = 11,2 л Ответ правильный и полный, включает все названные выше элементы Правильно записано 3 элемента ответа Правильно записано 2 элемента ответа Правильно записано 1 элемента ответа Все элементы записаны неверно Максимальный балл Баллы 4 3 2 1 0 4