Реакции электролитов в водных растворах
реклама
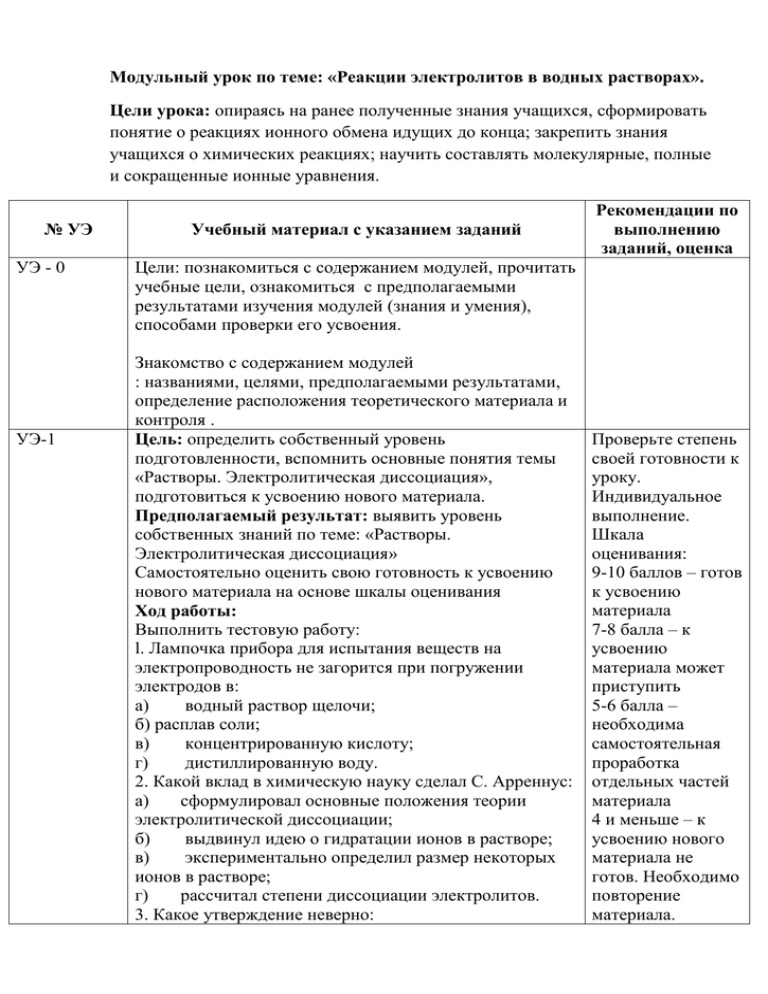
Модульный урок по теме: «Реакции электролитов в водных растворах». Цели урока: опираясь на ранее полученные знания учащихся, сформировать понятие о реакциях ионного обмена идущих до конца; закрепить знания учащихся о химических реакциях; научить составлять молекулярные, полные и сокращенные ионные уравнения. № УЭ УЭ - 0 УЭ-1 Учебный материал с указанием заданий Рекомендации по выполнению заданий, оценка Цели: познакомиться с содержанием модулей, прочитать учебные цели, ознакомиться с предполагаемыми результатами изучения модулей (знания и умения), способами проверки его усвоения. Знакомство с содержанием модулей : названиями, целями, предполагаемыми результатами, определение расположения теоретического материала и контроля . Цель: определить собственный уровень подготовленности, вспомнить основные понятия темы «Растворы. Электролитическая диссоциация», подготовиться к усвоению нового материала. Предполагаемый результат: выявить уровень собственных знаний по теме: «Растворы. Электролитическая диссоциация» Самостоятельно оценить свою готовность к усвоению нового материала на основе шкалы оценивания Ход работы: Выполнить тестовую работу: l. Лампочка прибора для испытания веществ на электропроводность не загорится при погружении электродов в: а) водный раствор щелочи; б) расплав соли; в) концентрированную кислоту; г) дистиллированную воду. 2. Какой вклад в химическую науку сделал С. Арреннус: а) сформулировал основные положения теории электролитической диссоциации; б) выдвинул идею о гидратации ионов в растворе; в) экспериментально определил размер некоторых ионов в растворе; г) рассчитал степени диссоциации электролитов. 3. Какое утверждение неверно: Проверьте степень своей готовности к уроку. Индивидуальное выполнение. Шкала оценивания: 9-10 баллов – готов к усвоению материала 7-8 балла – к усвоению материала может приступить 5-6 балла – необходима самостоятельная проработка отдельных частей материала 4 и меньше – к усвоению нового материала не готов. Необходимо повторение материала. а) катионы движутся в растворе упорядоченно; б) катионы заряжены положительно; в) некоторые катионы окрашены; г) некоторые катионы ядовиты. 4. Степень диссоциации электролитов зависит: а) от температуры; б) от давления; в) от гидратации; г) от концентрации. 5. Атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов превращаются в ионы. Какой заряд могут иметь эти ионы: а) положительный или отрицательный; б) только отрицательный; в) только положительный; г) не имеют заряда. 6. Какие ионы определяют общие свойства кислот: а) анионы кислорода; б) катионы водорода; в) анионы кислотного остатка; г) ионы не влияют на общие свойства кислот. 7. Как называется электролит NH4NO3(NH4+ + NO3-): а) кислота; б) основание; г) оксид; в) соль. . 8. Процесс диссоциации сульфата магния можно выразить уравнением: а) MgSO4 Mg+2 + SO4 -2; б)MgSO4 Mg2+ + SO4 2-; в) MgSО4 Mg+2 + 4SO2-; г) MgSO4 Mg+2 + SO4 -1. 9. При диссоциации какого вещества образуется больше всего ионов: а) хлорид кальция; б) соляная кислота; в) сульфат алюминия; г) угольная кислота. 10.При комнатной температуре из 150 молекул электролита на ионы распались 90. Степень электролитической диссоциации равна ... %. УЭ – 2 Составление уравнений реакций электро литической диссоциации оснований, кислот и солей Цель: Научиться составлять уравнения электролитической диссоциации оснований, кислот и солей. Предполагаемый результат: Уметь составлять уравнения диссоциации кислот, оснований, солей, знать отличительные особенности диссоциации этих групп веществ Ход работы: 1. Ознакомиться с понятиями кислот, солей и оснований в свете теории электролитической диссоциации 2. Определите отличительные черты диссоциации солей, кислот, оснований, заполнив пробелы в тексте: При диссоциации кислот в качестве катиона отрываются……….. При диссоциации соли образуют катионы ….. и анионы…….. При диссоциации основания в качестве аниона образуются только ………… 3. Рассмотреть примеры диссоциации этих групп веществ. Обратить внимание на многоступенчатую диссоциацию 4. Запишите формулу Ва(ОН)2 —> Ва2+ + ОНрастворимого Н2SO4 —> Н+ + SO42гидроксида (кислоты Al(NO3)3 —> Al3+ + NO3или соли) в левой части уравнения, а формулы катионов и анионов в правой Расставьте Ва(ОН)2 = Ва2+ + 2ОН коэффициенты (если катион металла гидроксид они нужны), поставьте анион вместо стрелки знак Н2SO4 = 2Н+ + SO42равно катион водорода анион кислотного остатка Al(NO3)3 —> Al3+ + 3NO3катион металла анион кислотного остатка 1.См. учебник стр. 38, 40,44 3.Стр. 39,40,44 учебника Контроль усвоения материала: Запишите уравнения диссоциации следующих электролитов: сульфата натрия (Na2SO4), хлорида бария (BaCl2), гидроксида калия (KOH), соляной кислоты (HCl). УЭ-3. Ионные уравнения реакций Шкала самооценивания: Сверьте свои результаты с правильными ответами Правильное выполнение задания – 5 баллов 1 ошибка – 4 балла 2 ошибки - 3 балла Более 3 ошибок – 2 балла Цели: сформировать понятие о реакциях ионного обмена, повторить и закрепить знания о химических реакциях. Предполагаемый результат: уметь отличать реакции ионного обмена. Ход работы: Прочитать текст учебника и написать Стр. учебника 35 определение ионных реакций: Ионные реакции – это реакции__________________________________________ ________________________________________________ Контроль усвоения материала: Определите, к какой группе относятся перечисленные ниже реакции, если у вас возникнут трудности, обратитесь к учебнику, учителю, товарищу, который может дать консультацию. 1.Реакция, которая является реакцией ионного обмена 2. Не относится к реакцям ионного обмена а) С + О2=СО2 б) Na2SO4 + BaCl2= BaSO4 + 2NaCl в) KOH + HCl = KCl + H2O г) 2H2 + O2 = 2H2O д) 2H2S+ 3O2 = 2H2O + 2SO2 е) FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl УЭ-5. Реакции ионного обмена, идущие до конца. Реакции, которые не доходят до конца). Цель: Изучить реакции ионного обмена. Сформировать навык написания реакций ионного обмена, умение предполагать продукты реакции. Предполагаемый результат: уметь писать реакции ионного обмена, идущие до конца Ход работы: 1. Изучить алгоритм составления ионных уравнений. Ответьте на вопросы. А) В каких случаях реакция не идет до конца? Б) В каких случаях реакция идет до конца? Г) Что в ионном уравнении записывается в ионной форме? Д) Что в ионных уравнениях записывается в молекулярной форме Если вам проблемно ответить на данные вопросы прочитайте текс учебника Контроль знаний: Выполните предложенные реакции. Пользуясь алгоритмом составления ионных уравнений реакций запиши молекулярное, полное и сокращенное ионное уравнение реакций между: а) гидроксидом калия и азотной кислотой; б) сульфатом меди и гидроксидом лития; в) карбонатом калия и серной кислотой; г) между нитратом бария и хлоридом кальция. УЭ -5 Лабораторный практикум В каком случае реакция не идет до конца? Цели: применить полученные знания об ионных реакциях, предсказав исход реакции, и сравнить теоретические выводы с практическим результатом Предполагаемый результат: совпадение результатов теоретических выводов с результатами экспериментальной работы Ход работы: 1. Допишите реакции, установив, идут ли они до конца См. страница 36 учебника Стр. 37, заголовок проблема Шкала самооценивания: Проверьте результаты по слайду. 1 ошибка – 5 баллов 2 ошибки – 4 балла 3 ошибки – 3 балла 4 ошибки и более – 2 балла А. CaCO3+H2SO4= Б. Na2SO4 + BaCl2= 2. Проведите реакции между этими веществами 3. Проверьте совпал теоретический и практический результат УЭ - 6. Итоговый контроль Цели: определить собственный уровень полученных знаний Предполагаемый результат: усвоение основных понятий и терминов темы, умение составлять ионные уравнения. Ход работы: Выполните задания(1 балл): 1. Не записывая ионные уравнения, определите какие реакции не идут до конца: а) между хлоридом калия и нитратом серебра; б) между хлоридом натрия и гидроксидом калия; 2. Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакций между(2балла): Первый вариант Второй вариант а) гидроксидом лития и азотной кислотой а) сульфатом железа (II) и гидроксидом калия 3. Установите соответствие(4 балла). Молекулярное уравнение Сокращенное ионное уравнение LiOH + HCl = LiCl + H2O Ag++Cl- = AgCl Cu(OH)2+ 2HNO3 = Cu(NO3)2 + 2H2O OH- + H+ = H2O SrCl2 + 2 AgNO3 = Sr(NO3)2 + 2AgClv CO3 2-+ 2H+ = СО2 +H2O K2CO3 + H2SO4 = K2SO4 + СО2 +H2O Cu(OH)2+ 2H+ = Cu2+ + 2H2O Лист самоконтроля: Суммарное количество баллов за работу Уровень усвоения знаний 15 и больше Хорошее усвоение материала От 9 до 14 Материал усвоен, требуется повторение От 5 до 8 Материал усвоен частично Менее 5 Требуется проработка всех модулей еще раз Домашнее задание (в зависимости от уровня усвоения материала) «Хорошее усвоение материала» - 2-18, 2-19, 2-20 – задачник «Материал усвоен» - 2-18, 2-24,2-25 – задачник «Материал усвоен частично» - стр. 18 – стр. 19 задачника, упр. 2-18,2-23 «Требуется проработка всех моделей» - см. все модули урока, стр. 18. стр.19 задачника, упр. 2-18,2.19 задачника Ответы к тесту : 1. г; 2. а; 3. г; 4. г; 5. а; 6. б; 7. г; 8. б; 9. в; 10. При комнатной температуре из 150 молекул электролита на ионы распалось 90. Степень электролитической диссоциации равна 60%. Решение: α = 90/150 = 0,6 (или 60%);