Презентация Николаевой Александры.
advertisement

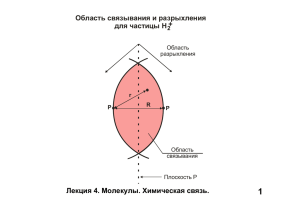
Презентация Николаевой Александры. Цель образования химической связи в том, что атомы завершают внешний энергетический уровень до 8 электронов и приобретают устойчивое состояние. 1) Химическая связь возникает между двумя атомами за счёт обращения электронов с антипараллельными спинами. 2) При образовании молекулы электронная структура взаимодействующих атомов в основном сохраняется. 3) Химическая связь располагается в направлении, обеспечивающем максимальное перекрытие электронных орбиталей. 4) Прочность химической связи зависит от степени перекрывания взаимодействующих орбиталей. Это такая химическая связь, которая образована за счёт общих электронных пар, в одинаковой мере принадлежащих обоим атомам. 1) Неполярная связь – образуется между атомами с одинаковым значением электроотрицательности (н , Cl , Br , O , N ) 2) Ковалентная полярная – образуется между атомами неметаллов с разным значением электроотрицательности (H ,S,H2O,NH3,HHal) 3) Донорно-акцепторная связь - образуется за счёт передачи электронной пары донора на свободную орбиталь акцептора. 2 2 2 2 2 2’ 1) Изображение электронов в виде символов (точек, крестиков и т. п.)поставленных у химического знака элемента. Н.+.Н = Н:Н 2) Часто ковалентную связь изображают чёрточкой, которая символизирует пару электронов. Запись, которая получается при таком изображении связи называется структурная формула. Н-Н, Н-О-Н, О=С=О. 1) Длина связи - расстояние между центрами ядер, связанных в молекулы атомов. 2) Прочность судят по её энергии. Энергия – выделяющееся при образовании связи из атомов , энергия необходима для разрыва связи по гомолитическому типу. Чем больше энергия связи, тем прочнее связь. 3) Полярность. 4) Направленность. 5) Насыщенность. Это такая химическая связь, которая образуется в соединениях типичных металлов с типичными неметаллами: 1А, 2А, 6А, 7А гр.; разность электроотрицательности должна быть более 1,6. Это связь между положительными ионами в кристаллах металлов, осуществляемая за счёт притяжения электронов, свободно перемещающихся по кристаллу. С увеличением порядкового номера в периоде металлические свойства ослабевают, а с увеличением порядкового номера в группе металлические свойства усиливаются. Это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. 1. Кузьменко Н.Е., Чуранов С. С. Общая и неорганическая химия: Пособие для поступающих в ВУЗы. 2. Хомченко Г. П. Химия для поступающих в ВУЗы. 3. Глинка Н. Л. Общая химия. 4. Бровко М. И., Волович П. М. Домашний репетитор.